Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.62 no.2 Medellín July/Dec. 2009
INFLUENCIA DE LAS CONDICIONES DE INCUBACIÓN SOBRE LA ACTIVACIÓN DE ZOOSPORAS DE Spongospora subterranea, EN BUSCA DE UN INÓCULO PARA EL ESTUDIO DE LA SARNA POLVOSA
INFLUENCE OF INCUBATION CONDITIONS ON THE ACTIVATION OF ZOOSPORES OF Spongospora subterranea, SEARCHING FOR AN INOCULUM TO THE STUDY OF THE POWDERY SCAB
Edgar Beltrán Sánchez1; Elizabeth Gilchrist Ramelli2; Sonia del Carmen Jaramillo Villegas3 y Sebastián Reynaldi4
1 Biólogo. Universidad de Antioquia. Calle 67 No. 53-108. Medellín, Colombia. <titar23@yahoo.com>
2 Ingeniera Agrónoma. D.Sc. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779, Medellín, Colombia. <egilchristr@unal.edu.co>
3 Profesora Asociada. Universidad Nacional de Colombia, Sede Medellín. Departamento de Ciencias Agronómicas. A.A. 1779, Medellín, Colombia. <sjaramal@unal.edu.co>
4 Profesor Asistente. Universidad Nacional de Colombia, Sede Medellín. Departamento de Ciencias Agronómicas. A.A. 1779, Medellín, Colombia. <sreynaldi@unal.edu.co>
Recibido: Mayo 7 de 2008; Aceptado: Septiembre 14 de 2009
Resumen. La sarna polvosa es una enfermedad que decrece la producción de papa. Es causada por el parásito obligado Spongospora subterranea f. sp. subterranea, el cual produce grupos de zoosporas enquistadas llamados quistosoros. Cuando las zoosporas están activas pueden infectar raíces y tubérculos iniciando un nuevo ciclo reproductivo. Para estudiar la influencia de las condiciones de incubación sobre la activación de las zoosporas, suspensiones acuosas de quistosoros fueron incubadas bajo diferentes condiciones. Los quistosoros y las zoosporas activas fueron diariamente contados utilizando microscopio óptico. El mayor número de zoosporas activas se encontró al cuarto día de incubación, mientras que el menor número de quistosoros se registró al quinto día de incubación. Esto sugiere que las zoosporas permanecen activas por un corto periodo. El número de zoosporas activas por quistosoro fue significativamente (P<0,05) más alto en agua de red que en agua destilada, y en presencia de luz que en oscuridad. Un mayor número de zoosporas por quistosoro se activó a 19 °C que a 5 °C, pero la presencia de raíz de papa no tubo efecto significativo (P<0,05) en la activación. Estos resultados muestran que las condiciones de incubación pueden aumentar las zoosporas liberadas; sin embargo, el número de zoosporas activas por quistosoro observado no fue mayor de cinco. Más zoosporas por quistosoro eran esperadas, porque un quistosoro es entre 10 y 40 veces mayor que una zoospora. En consecuencia, se necesita un gran número de quistosoros para asegurar la presencia de zoosporas activas en un inóculo.
Palabras claves: Sarna polvosa, Spongospora subterranea f. sp. subterranea, quistosoros, zoosporas, papa.
Abstract. The powdery scab is a disease that decreases potato production. It is caused by Spongospora subterranea f. sp. subterranea. This obligate parasite produces cystosori, which are groups of encysted zoospores. When these zoospores are active, they can infect roots and tubers initiating a new replication cycle. To investigate the influence of the incubation conditions on the zoospore activation, suspensions of cystosori in water were incubated under different conditions. The cystosori and the active zoospores were daily counted under microscope. The higher number of active zoospores was found after four days of incubation, meanwhile the lower number of cystosori was found after five days of incubation. This suggests that zoospores are active for a short period. The number of active zoospores per cystosorus was significantly (P<0.05) higher in tap water than in distillated water, and in presence of light than in dark. More zoospores per cystosorus were activated at 19 °C than at 5 °C, but potato roots did not have a significant (P<0.05) effect on zoospores activation. These results indicate that the incubation conditions may increase the zoospores activation. However, the number of active zoospores per cystosori was not higher than five. More active zoospores were expected, because a cystosorus is between 10 and 40 times bigger than a zoospore. This shows that a large number of cystosori are needed to ensure the presence of active zoospores in an inoculum.
Key words: Powdery scab, Spongospora subterranea f. sp. subterranea, cystosori, zoospores, potato.
La sarna polvosa diminuye la producción de tubérculos de papa y puede afectar el aspecto cosmético de los tubérculos producidos (Harrison et al., 1997). Las pérdidas en la producción de tubérculos pueden llegar al 40% de la cosecha (Gilchrist et al., 2009). En la actualidad, la sarna polvosa afecta las principales zonas productoras de papa del mundo (Harrison et al., 1997; Merz, 2008). Esta enfermedad se expandió por el mundo debido al uso de tubérculos infectados como semilla, y se consolidó por la falta de tratamientos efectivos (Harrison et al., 1997; Merz, 2008).
La sarna polvosa es causada por el Spongospora subterranea (Wallr) Lagerh. forma especial subterranea Tomlinson (Harrison et al., 1997), que en adelante se denominará como S. subterranea. El análisis filogenético brindó evidencia para clasificar a S. subterranea dentro del filo Cercozoa, conjunto de amebas y zooflagelados (Qu and Christ, 2004), que forman parte del grupo Rhizaria perteneciente al reino protista (Adl et al., 2005). S. subterranea se caracteriza por presentar una división nuclear cruciforme, originando un plasmodio multinucleado que resulta en conjuntos de zoosporas enquistadas llamados quistosoros (Harrison et al., 1997). Los quistosoros pueden permanecer latentes durante años hasta que las zoosporas se activan (Merz, 2008). Las zoosporas activas presentan dos flagelos de diferente tamaño con los que nadan en el agua del suelo para encontrar raíces y tubérculos para infectar, comenzando un nuevo ciclo reproductivo (Harrison et al., 1997; Merz, 2008).
S. subterranea es un parásito obligado (Harrison et al., 1997), esto determina que se deba infectar plantas hospedadoras para poder estudiar la sarna polvosa. Trabajos previos utilizaron quistosoros como inóculo para infectar plantas de papa o tomate (Merz, 1989; Van de Graaf et al., 2005; Jaramillo y Botero, 2007; Gilchrist et al., 2009). Sin embargo, la incidencia de infección utilizando quistosoros mostró ser varias veces menor a la incidencia de infección utilizando zoosporas activas (Mäkäräinen et al., 1994), sugiriendo que la activación de las zoosporas es un limitante en la investigación del a sarna polvosa.
No se conoce como se activan las zoosporas de S. subterranea (Harrison et al., 1997; Merz, 2008). Sin embargo, se han encontrado condiciones de incubación que pueden estimular este proceso como es la inmersión de los quistosoros en medio líquido (Merz, 1989; Harrison et al., 1997). Con la intención de obtener un inóculo replicable y homogéneo para estudiar la sarna polvosa, el presente trabajo tuvo como objetivos confirmar y dimensionar la influencia de las condiciones de incubación sobre la activación de las zoosporas en suspensiones acuosas de quistosoros. Para esto se determinó el número de zoosporas activas por quistosoros como una estimación de la eficiencia del proceso de activación. Además, se buscó investigar la dinámica del proceso de activación, determinando el tiempo de incubación necesario para observar el pico de zoosporas activas y la desaparición de la mayor parte de los quistosoros.
MATERIALES Y MÉTODOS
Identificación de quistosoros por microscopía electrónica de barrido. Tubérculos con pústulas fueron colectados en el municipio de la Unión, Antioquia, Colombia y lavados para quitar el exceso de suelo. Luego de dejarlos secar a temperatura ambiente, la superficie de los mismos fue raspada y macerada suavemente, para pasarla sucesivamente por tamices de poro de 250, 100 y 53 µm.
Una muestra de quistosoros fue fijada sumergiéndola por 12 horas en una solución de glutaraldehído al 3% en tampón de cacodilatos 0,1 M, pH 7,4. Luego, la muestra fue deshidratada embebiéndola por 5 minutos en soluciones crecientes de etanol (30, 50, 70, 90, 99 % v/v) y en acetona al 100% v/v (Iftikhar et al., 2002). Finalmente, se revistió con oro-paladio (8 nm) y se examinó con microscopio electrónico de barrido Jeol JSM-5910LV, realizando registros fotográficos a diferentes aumentos.
Suspensiones de quistosoros. Las suspensiones de quistosoros fueron realizadas con 50 mg del tamizado de pústulas de tubérculo y 25 mL de agua de red o destilada. Estas suspensiones fueron agitadas fuertemente antes de tomar 2 mL y diluirlos en 10 mL de agua de red o destilada, las suspensiones finales se incubaron en tubos de polietileno con tapa de 15 mL. La abundancia de quistosoros fue determinada utilizando una cámara de Neubauer y expresada como quistosoros por mililitro. Los quistosoros fueron reconocidos por su forma ovoide o esférica irregular, por su estructura porosa de apariencia esponjosa y por su color ocre oscuro. Sólo fueron considerados los quistosoros que tuviesen completo un 75% de su forma ovoide o esférica irregular.
Zoosporas activas. Las zoosporas activas fueron identificadas por la presencia de los dos flagelos de tamaño diferente insertados lateralmente formando un ángulo de 180°. Estas zoosporas presentan movimientos rápidos en líneas rectas, con cambios bruscos de dirección o giros sobre su propio eje, como los observados por Merz (1992). La abundancia de zoosporas activas fue determinada utilizando una cámara de Neubauer, contando sólo las zoosporas que presentaban los movimientos arriba descritos.
Dinámica de activación de zoosporas. La aparición de zoosporas activas y la desaparición de quistosoros fueron monitoreadas diariamente en cuatro suspensiones de quistosoros como las descritas anteriormente, las cuales fueron incubadas a 19 °C durante 7 días en agua de red.
Influencia del tipo de agua y de la presencia de luz. Para establecer la influencia del tipo de agua, suspensiones de quistosoros fueron preparadas en agua destilada y de red, e incubadas en presencia de luz. Para determinar la influencia de la presencia de luz, suspensiones de quistosoros preparadas en agua de red fueron incubadas en presencia de luz natural o en oscuridad. En ambos casos, se dispusieron seis repeticiones por nivel de tratamiento que fueron incubadas a una temperatura de 19 °C durante cuatro días y la aparición de zoosporas activas fue monitoreada diariamente.
Influencia de la temperatura y de la presencia de raíz de papa. Las suspensiones de quistosoros fueron incubadas en presencia y ausencia de raíces de papa durante 4 días en presencia de luz natural. Se utilizaron doce suspensiones de quistosoros por nivel de tratamiento, seis de ellas se incubaron a una temperatura de 5 °C y las restantes seis a una temperatura de 19 °C. La aparición de zoosporas activas fue registrada diariamente. Se escogieron estas temperaturas porque son fácilmente alcanzables en el laboratorio con un refrigerador y un equipo de aire acondicionado.
Para obtener raíces de papa libres de patógeno, se enraizaron esquejes de papa Solanum tuberosum variedad Diacol Capiro con ácido naftalenacético (ANA) en turba de coco fuertemente lavada. A cada suspensión se le agregaron 200 mg de raíces.
Análisis estadístico. La unidad experimental fue la suspensión de quistosoros en agua, la variable dependiente fue el número de zoosporas activas por quistosoro, que se determinó dividiendo el número de zoosporas activadas por el número original de quistosoros. La homocedasticidad y normalidad de los valores que tomó esta variable se analizó utilizando los ensayos de Levene y Kolmogorov-Smirnov, respectivamente (Zar, 1999). La transformación de ranking fue utilizada, cuando estos requerimientos no fueron alcanzados (Potvin y Roff, 1993). Como las zoosporas y los quistosoros fueron observados durante varios días en las mismas unidades experimentales, los tratamientos fueron comparados utilizando análisis de Medidas Repetidas seguido del ensayo de Tukey para unidades experimentales no independientes (P<0,05) utilizando el programa de distribución libre R versión 2.10 y el paquete multcomp (CRAN, 2009).
RESULTADOS
Identificación de quistosoros por microscopía electrónica de barrido. Las Figuras 1 y 2 muestran que los quistosoros presentaron una forma poliédrica o ligeramente elipsoidal y un tamaño entre 35 a 45 µm de diámetro. El resultado del tamizado fue en su mayoría quistosoros, aunque no todos lograron mantener la integridad (Figura 2).
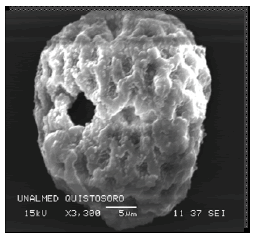
Figura 1. Quistosoro de Spongospora subterranea extraído de pústulas desarrolladas en tubérculos de papa y observado al microscopio electrónico de barrido.

Figura 2. Quistosoros de Spongospora subterranea extraídos de pústulas desarrolladas en tubérculos de papa y observados con microscopio electrónico de barrido.
Dinámica de activación de zoosporas. El número de zoosporas liberadas se incrementó significativamente (P<0,05) a partir del tercer día de incubación, observándose el pico de abundancia, 85 zoosporas/mL, al cuarto día de incubación (Figura 3A). A partir del día quinto, el número de zoosporas/ml comienza a disminuir.
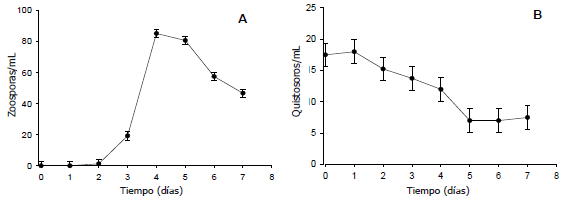
Figura 3. Número de zoosporas (A) y quistosoros (B) por ml de Spongospora subterranea en función del tiempo de incubación, observados en pústulas desarrolladas en tubérculos de papa. Las barras indican intervalos de confianza del 95%.
El número de quistosoros/mL disminuyó significativamente (P<0,05) a partir del tercer día de incubación y se detuvo luego del quinto día de incubación, alcanzando un 63% de los quistosoros originales (Figura 3B).
Influencia del tipo de agua y de la presencia de luz. Las zoosporas comenzaron a activarse luego del primer día de incubación de los quistosoros en agua de red y luego de dos días de incubación en agua destilada (Figura 4). La interacción entre el tipo de agua y el tiempo de incubación fue significativa (P<0,05), la diferencia en las pendientes de las curvas muestra que la activación de las zoosporas fue más veloz cuando los quistosoros fueron incubados en agua de red (Figura 4). Al cuarto día de incubación, las zoosporas activas en el tratamiento con agua de red duplicaron el número de zoosporas activas en el tratamiento con agua destilada, esta diferencia fue altamente significativa (P<0,001) (Figura 4).
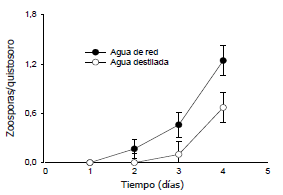
Figura 4. Número de zoosporas por quistosoro de Spongospora subterranea en pústulas desarrolladas en tubérculos de papa en función del tiempo de incubación, en agua de red y en agua destilada. Las barras indican intervalos de confianza del 95%.
En presencia de luz, las activación de las zoosporas fue significativamente más veloz (P<0,05). El número de zoosporas activas comenzó a aumentar luego del primer día de incubación en presencia de luz, mientras que esto sucedió después del segundo día de incubación en oscuridad. (Figura 5). Al cuarto día de incubación, el número de zoosporas activas por quistosoro en presencia de luz fue 1 y en oscuridad fue 0,4 (Figura 5), esta diferencia fue altamente significativa (P<0,001).
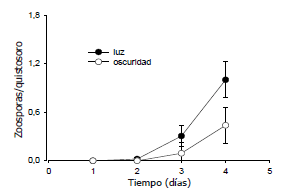
Figura 5. Número de zoosporas por quistosoro de Spongospora subterranea en pústulas desarrolladas en tubérculos de papa en función del tiempo (días) de incubación en presencia de de luz y en oscuridad. Las barras indican intervalos de confianza del 95%.
Influencia de la temperatura y de la presencia de raíz de papa. El número de zoosporas activas por quistosoro fue significativamente mayor (P<0,05) a 19 °C que a 5 °C al tercer día de incubación (Figura 6). Esta diferencia fue altamente significativa (P<0,001) al cuarto día de incubación (Figura 6). Cuando se incubaron los quistosoros a 5 °C, muy pocas zoosporas se activaron (Figura 6), independientemente de la presencia o ausencia de raíz de papa. La presencia de raíz de papa incrementó el número de zoosporas por quistosoro. Sin embargo, este incremento no fue significativo (P<0,05), como lo muestra la superposición de los intervalos de confianza del 95% (Figura 6).
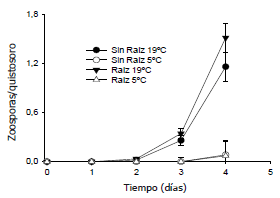
Figura 6. Número de zoosporas por quistosoro de Spongospora subterranea en función del tiempo de incubación a 5 ºC y a 19 °C en presencia y ausencia de raíz de papa. Las barras indican intervalos de confianza del 95%.
DISCUSIÓN
Identificación de quistosoros de Spongospora subterranea. La Figura 2 valida el método utilizado para obtener los quistosoros, porque muestra que ellos constituyen la mayor parte del material resultante del último paso de tamizado. En la fotografía también se pueden observar quistosoros dañados o incompletos. Esto, muy probablemente, se deba al raspado de las pústulas y al macerado que se realizó al inició del proceso de obtención de los quistosoros. El diámetro de los quistosoros de S. subterranea observados estuvo entre 30 y 45 µm, menores a los quistosoros encontrados en Pakistán (Iftikhar et al., 2002). Sin embargo, en el presente trabajo se utilizó un tamiz 53 μm para facilitar la remoción de partículas de suelo durante el aislamiento de los quistosoros. La forma de los quistosoros fue similar a la descrita por otros autores, se observaron formas similares a un panal de abejas o a una pelota de golf (Harrison et al., 1997; Iftikhar et al., 2002), confirmando que se trataba de S. subterranea (Figuras 1 y 2).
Dinámica de activación de zoosporas. Los quistosoros son grupos de zoosporas enquistadas (Harrison et al., 1997). En coincidencia con esto, en el presente trabajo, el aumento del número de zoosporas activas se incrementó con la disminución del número de quistosoros (Figura 3). Sin embargo, el número de zoosporas activas alcanzó su máximo al cuarto día de incubación (Figura 3A), los quistosoros alcanzaron su mínimo al quinto día de incubación. (Figura 3B). Esto último, justo cuando las zoosporas activas comenzaron a disminuir (Figura 3A). Este desacople de un día entre la desaparición de quistosoros y la activación de zoosporas, sugiere que las zoosporas pierden movilidad, se enquistan nuevamente o posiblemente mueren dentro de las siguientes 24h luego de su activación.
La mayoría de las zoosporas se activaron entre el tercero y cuarto día de incubación como muestra la pendiente de la curva que describe el número de zoosporas activas en función del tiempo (Figura 3A). Esto ya había sido encontrado por Merz (1989), y nuevamente observado por Alzate et al. (2008). Más aún, los pequeños intervalos de confianza observados en la Figura 3A indican que hay una similitud entre las repeticiones dispuestas. Esto muestra que parece existir una constancia en el tiempo de activación.
Influencia del tipo de agua y de la presencia de luz. Las zoosporas activadas se redujeron sustancialmente en agua destilada (Figura 4), probablemente sufrieron estrés osmótico. En agua destilada, el contenido de iones en el interior de las zoosporas es mucho mayor al del medio circundante generando un gradiente. Siguiendo este gradiente, el agua circundante muy posiblemente pudo ingresar a las zoosporas haciéndolas colapsar. Para evitar esto, en el resto de los experimentos se realizaron utilizando agua de red.
En los protocolos para los bioensayos con S. subterranea, los quistosoros se incuban en oscuridad para simular las condiciones naturales del patógeno en el suelo (Merz, 1989). En este trabajo, el número de zoosporas por quistosoro en presencia de luz fue más que el doble que el observado en oscuridad (Figura 5). Esto coincide con los registros copilados por Harrison et al. (1997), que describen una mayor severidad de infección de S. subterranea luego de intensas lluvias, seguidas de días soleados. Sin embargo, los resultados de esta investigación podrían no describir lo que ocurre en la naturaleza, pero advierten sobre la posibilidad de subestimar el potencial infectivo de una muestra cuando la incubación de los quistosoros se realiza en oscuridad.
Influencia de la temperatura y de la presencia de raíz de papa. Más y más rápidamente se activaron las zoosporas cuando los quistosoros fueron incubados a 19 ºC que cuando lo fueron a 5 ºC (Figura 6). A esta última temperatura las zoosporas casi no se activaron (Figura 6). Entre las condiciones de incubación que parecen influenciar la activación de las zoosporas, la temperatura ha sido una de las más estudiadas (Harrison et al., 1997). En concordancia con lo obtenido en este trabajo, Harrison et al. (1997) mencionaron que a temperaturas entre 0 y 5 ºC las zoosporas se activan más lentamente que a una temperaturas de 14 ºC. Esto indica que las temperaturas frías parecen no estimular una rápida activación de las zoosporas, sugiriendo que la sarna polvosa en climas fríos podría estar presente por períodos más largos debido a una liberación lenta de las zoosporas.
A una temperatura de incubación de 19 ºC, más zoosporas se activaron en presencia de raíz de papa que en ausencia de esta (Figura 6). Sin embargo, esta diferencia no fue significativa (P<0,05), posiblemente esto se deba a que las raíces utilizadas estaban muertas. Un estimulo significativo se observó cuando los quistosoros fueron incubados con extractos de raíz de papa (Alzate et al., 2008). Esto sugiere que alguna sustancia producida y liberada por las raíces estimula la activación de las zoosporas, y que la concentración de esa sustancia va disminuyendo con la muerte de la raíz. Futuras investigaciones deberán centrarse en este aspecto, porque podría significar la posibilidad de construir trampas que protejan los cultivos.
Número de zoosporas activas por quistosoro. El número de zoosporas por quistosoro se obtuvo al dividir el número de zoosporas activas contadas diariamente por el número inicial de quistosoros en la suspensión. Este número fue menor que cinco en el primer experimento (Figuras 3), y aun menor en los restantes (Figuras 4-6). Un número menor del esperado, si se considera que una zoospora tiene un diámetro de entre 2 y 3 μm (Merz, 1992; Merz, 1997) y un quistosoro entre 35 y 80 μm (Harrison et al., 1997). De esta forma, un quistosoros puede ser entre casi 12 y 40 veces mayor a una zoospora. Alzate et al. (2008) observaron un número de 14 a 16 zoosporas, pero luego de incubar 50 mL de suspensiones de 2,4 x 104 quistosoros/mL. Este ínfimo número de zoosporas por quistosoro, más allá de evidenciar una posible sobrestimación de los quistosoros iniciales, confirma lo observado en el presente trabajo. Al respecto, un litro de suspensión de 30 quistosoros/mL, 30.000 quistosoros en total, se necesitaron para poder detectar infección en plántulas de tomate (Merz, 1989). La activación de las zoosporas parece no ser un fenómeno masivo, ocurre en una minoritaria fracción de ellas. Eso sugiere que se necesita un gran número de quistosoros para obtener un inóculo infectivo eficiente.
CONCLUSIONES
Una pequeña fracción de las zoosporas enquistadas parece poder activarse en una escala temporal menor a una semana, observándose la mayor activacion entre el tercer y cuarto día de incubación. Sin embargo, esta pequeña fracción puede reducirse más de la mitad, si se incuban las suspensiones de quistosoros a una temperatura de 5 ºC y en oscuridad. Además, la activación ocurre durante un breve periodo de tiempo, probablemente menor a 24 h. Esto sugiere que solo un alto número de quistosoros puede asegurar la presencia de zoosporas activas en un inóculo infectivo de S. subterranea.
AGRADECIMIENTOS
Se agradece a los alumnos del grupo BIODES por su colaboración durante los experimentos y al señor Medardo Pérez Guisao por su asesoramiento profesional en microscopía electrónica. Este trabajo fue financiado por el Ministerio de Agricultura y Desarrollo Rural, el Fondo Nacional Hortifrutícola, y la Dirección de Investigaciones de la Universidad Nacional de Colombia, Sede Medellín (DIME).
BIBLIOGRAFÍA
Adl, S.M., A.G.B. Simpson, M.A. Farmer, R.A. Andersen, O.R. Anderson, J.R. Barta, S.S. Bowser, G. Brugerolle, R.A. Fensome, S. Fredericq, T.Y. James, S. Karpov, P. Kugrens, J. Krug, Ch. E. Lane, L.A. Lewis, J. Lodge, D.H. Lynn, D.G. Mann, R.M. McCourt, L. Mendoza, O. Moestrup., S.E. Mozley-Standridge, T.A. Nerad, C.A. Shearer, A.V. Smirnov, F.W. Speigel and M.F. Taylor. 2005. The new higher level classification of eukaryotes with emphasis on the taxonomy of protists. Journal of Eukaryotic Microbiology 52(5): 399–451.
Alzate, D.E., L.M. Hoyos y E.P. González. 2008. Factores que inciden en la liberación de zoosporas de Spongospora subterranea (Wallroth) Lagerheim f. sp. subterranea Tomlinson. Revista Facultad Nacional de Agronomía, Medellín 61(2): 4503-4510. [ Links ]
CRAN. 2009. The Comprehensive R Archive Network. http://cran.r-project.org/; consulta: julio 2009. [ Links ]
Gilchrist, E., S. Jaramillo y S. Reynaldi. 2009. Efecto sobre la sarna polvosa de cuatro aislamientos del hongo Trichoderma asperellum en tres tipos de suelo. Revista Facultad Nacional de Agronomía, Medellín 62(1): 4783-4792. [ Links ]
Harrison, J.G., R.J. Searle and N.A. Williams. 1997. Powdery scab disease of potato: a review. Plant Pathology 46(1): 1-25. [ Links ]
Iftikhar, S., F. Fahmeed, A. Iftikhar and A. Hameed. 2002. Characterization of Spongospora subterranea f. sp. subterranea, the cause of powdery scab of potato in Pakistan. Journal of Biological Sciences 2(7):441-443. [ Links ]
Jaramillo, S. y J.M. Botero. 2007. Respuesta de diferentes poblaciones de Spongospora subterranea f. sp. subterranea a la rotación entre dos variedades de papa (Solanum tuberosum spp. andigena). Revista Facultad Nacional de Agronomía, Medellín 60(2):3859-3876. [ Links ]
Mäkäräinen, E., H. Rita, E. Teperi and J.P.T. Valkonen. 1994. Resistance to Spongospora subterranea in tuber-bearing and non tuber-bearing Solanum spp. American Journal of Potato Research 37(2): 123-127. [ Links ]
Merz, U. 1989. Infectivity, inoculum density and germination of Spongospora subterranea resting spores: a solution-culture test system. European Plant Protection Organisation Bulletin 19(3): 585-592. [ Links ]
Merz, U. 1992. Observations on swimming pattern and morphology of secondary zoospores of Spongospora subterranea. Plant Pathology 41(4): 490-494. [ Links ]
Merz, U. 1997. Microscopical observations of the primary zoospores of Spongospora subterranea f.sp. subterranea. Plant Pathology 46(5): 670-674. [ Links ]
Merz, U. 2008. Powdery scab of potato-occurrence, life cycle and epidemiology. Symposium paper. American Journal of Potato Research 85(4): 241–246.
Potvin, C. and D. Roff. 1993. Distribution-free and robust statistical methods: viable alternatives to parametric statistics. Ecology 74(6): 1617-1628. [ Links ]
Qu, X. and B.J. Christ. 2004. Genetic variation and phylogeny of Spongospora subterranea f.sp. subterranea based on ribosomal DNA sequence analysis. American Journal of Potato Research 81(6): 385–394.
Van de Graaf, P., A.K. Lees, S.J. Wale and J.M. Duncan. 2005. Effect of soil inoculum level and environmental factors on potato powdery scab caused by Spongospora subterranea. Plant Pathology 54(1): 812-819. [ Links ]
Zar, J. 1999. Bioestadistical análisis. Fourth Edition. Prentice Hall. 663 p. [ Links ]














