Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.62 no.2 Medellín July/Dec. 2009
DIVERSIDAD DE LIBÉLULAS (INSECTA-ODONATA) PARA DOS USOS DE SUELO, EN UN BOSQUE SECO TROPICAL
DRAGONFLY (INSECTA: ODONATA) DIVERSITY IN TWO USE OF SOILS IN A TROPICAL DRY FOREST
Mariano Altamiranda Saavedra1
1 Estudiante de Maestría en Ciencias-Entomología. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. A.A. 3840, Medellín, Colombia. <marianoaltamirandas@hotmail.com>
Recibido: Septiembre 9 de 2008; Aceptado: Octubre 13 de 2009.
Resumen. Se estimo la diversidad de la fauna de odonatos en el Centro Agropecuario Cotové en Santafé de Antioquia-Colombia. Se utilizó la captura activa con red entomológica. Cada transecto fue orientado de manera perpendicular al cuerpo de agua, con una extensión de 200 m y un ancho de 8 m, aproximadamente. Fueron registradas en total 20 especies de odonatos, distribuidas en 5 familias y 15 géneros. La familia Libellulidae mostró la mayor abundancia y riqueza, con un total de 65 individuos que representan el 53,7% de la abundancia total, y de esta familia se identificaron 12 especies que constituyen el 60% de la comunidad registrada. La diversidad α fue mayor en el bosque en referencia al cultivo; sin embargo, las bajas abundancias registradas destacan la necesidad de un mayor esfuerzo de muestreo en el cultivo, para una mejor estimación de la diversidad γ. La diversidad β fue de 12 especies y el índice de complementariedad registrado fue de 0,6; lo cual indica que la fauna de odonatos es característica y distintiva para cada uso de suelo.
Palabras claves: Abundancia, riqueza, bosque tropical, cultivo, Odonata.
Abstract. Dragonfly diversity was estimated in the Agricultural Center Cotové (Santafé de Antioquia-Colombia). Active capture using an entomological net was used. Each transect was located perpendicular to the water body, for a length of approximately 200 m and a lateral extension of 8 m. Twenty Odonata species were registered, from 5 families and 15 genus. Libellulidae showed the biggest abundance and richness, with 65 specimens that represent 53.7% of the total abundance, and 12 species that represent 60% of the registered community. The α diversity was high in the forest in reference at crop; however, the low abundances register highlight the need for greater sampling effort in cultivating, for a better estimate of γ diversity; the β diversity was of 12 species and the complementary index was of 0.6, it indicates that the Odonata’s fauna is characteristic and distinctive for each use of soil.
Key words: Abundance, richness, tropical forest, crop, Odonata.
Los odonatos son componentes conspicuos de los ecosistemas tropicales, son activos durante el día, especialmente se les encuentra en áreas abiertas dentro del bosque o cerca a cuerpos de agua (Louton et al., 1996). Tanto sus estados larvales como los adultos son depredadores primarios y secundarios con una amplia gama de estrategias (Corbet, 1999).
Los odonatos juegan un papel importante en el control biológico de otros organismos, siendo depredadores de otros insectos que pueden ser plagas en cultivos o vectores de enfermedades (Corbet, 1999). Además, son importantes en la red trófica de los ecosistemas y el hábitat, debido a que hacen parte de la dieta de aves, reptiles, peces y anfibios (Santos, 1981). Pese a su papel fundamental en los ecosistemas donde habitan, los odonatos constituyen uno de los grupos en los cuales el conocimiento de su composición, función e importancia en los ecosistemas acuáticos a nivel tropical ha avanzado poco. Esto se debe a la escasa y dispersa información y al limitado número de especialistas.
El orden Odonata es considerado un agente útil en el monitoreo ambiental, debido principalmente a que muchas especies muestran respuestas especificas a alteraciones ambientales (Carle, 1979). Algunos de los atributos que determinan esta capacidad son: aprovechan el espectro completo de los hábitats acuáticos en un sitio particular, las larvas de cada especie son específicas en su habilidad para tolerar disturbios ambientales, son relativamente sedentarias, los machos maduros son generalmente conspicuos ya que patrullan cerca de su hábitat larval (Schmidt, 1985).
Uno de los dos mayores obstáculos para la conservación de la biodiversidad tropical, es la falta de información que permita el establecimiento de prioridades y concentración de esfuerzos (Pelli et al., 1998). Esa falta de documentación se debe a la ausencia de inventarios de fauna en muchas áreas, o el conocimiento de la distribución y abundancia de especies. Es importante resaltar que, para la definición de listas de especies amenazadas de extinción, son usados como criterios el grado de endemismo de cada especie, su abundancia en poblaciones naturales y la frecuencia con que cada especie ha sido observada o colectada (Ferreira y De Marco, 2002).
Los estudios en Odonata se iniciaron con las formas adultas (imagos), tal como ha sucedido con la mayoría de los otros grupos de insectos. Los estadios preimaginales han sido muy poco estudiados. Arango y Roldán (1983) realizaron el que hasta el momento es el único trabajo con trascendencia en taxonomia de Odonata (náyades) en Colombia. En esta ocasión, se hizo una sinopsis de los estadios preimaginales de algunas especies de Odonata del Departamento de Antioquia.
En Colombia, los estudios de mayor importancia relacionados con el Orden están enfocados en descripciones taxonómicas. Tales como las realizadas por: Ris (1918); Williamson (1918); Navas (1935); Paulson (1968); Cruz (1986); Zloty y Pritchard (2001), Bermúdez (2005) e inventarios propuestos por Suárez (1987); Urrutia (2005). Sin embargo, se ha dejado a un lado el conocimiento de los requerimientos ecológicos de las distintas especies, lo cual toma una enorme importancia en el momento de proponer prioridades para el manejo y conservación de los ecosistemas acuáticos.
Para la costa Caribe se destacan los inventarios realizados por Altamiranda et al. (2006) acerca de la riqueza de imagos de Odonatos en siete municipios del Atlántico; igualmente presenta una propuesta de metodología para estimar distribución y posibles desplazamientos de enjambres de las especies Miathyria simplex y Miathyria marcella en dos ciénagas de diferentes localidades.
Mediante los inventarios es posible evaluar por ejemplo, si la riqueza de especies es alta, o si la presencia de especies con rangos de distribución restringida, señala la presencia de endemismos, o si la disminución de la diversidad se debe al efecto de disturbios humanos. El uso de grupos indicadores como estrategia para evaluar la biodiversidad y los procesos que la afectan, ha generado una serie de debates y criticas que han permitido delimitar el concepto, precisar el tipo de información que se desea obtener y establecer criterios y su evaluación para la postulación como indicadores. (Favila 1997).
MATERIALES Y MÉTODOS
El trabajo se desarrolló en el Centro Agropecuario Cotové de la Universidad Nacional de Colombia, Sede Medellín, ubicado en el Municipio de Santafé de Antioquia, a 74 km al noroccidente de Medellín (6° 30´ 22-59”N y 75°14´34-79” W). El lugar se encuentra en una zona de vida de Bosque Seco Tropical según (Holdridge, 1978), a 540 msnm, posee una temperatura promedio anual de 27 ºC y una precipitación anual de 1.100 mm
Selección y ubicación de los transectos. Cada transecto se estableció con base en los siguientes criterios:
- presencia de un sistema acuático lótico.
- uso del suelo (Cultivo de mango y bosque secundario).
Cada transecto se ubicó de manera perpendicular al cuerpo de agua en cada una de las zonas seleccionadas, y tuvo una extensión de 200 m y un ancho de 8 m, aproximadamente.
Colecta de especímenes. Para la colecta de los adultos se utilizó la captura activa con red entomológica, dicha red (jama) tenía un diámetro de 40 cm, una extensión del cono de 60 cm y un mango de 1,5 m.
Se seleccionaron dos usos de suelo, cultivo de mango (Mangifera indica L.) y bosque secundario, las capturas se realizaron durante un día por uso de suelo y el esfuerzo de muestreo fue de 16 horas en total. Las recolectas se llevaron a cabo en períodos fijos entre las 08:30 y las 18:30 horas, con intervalos de 4 horas en la mañana y 4 horas en la tarde, cuando se observó la mayor actividad de los adultos (Pérez, 2003).
A cada ejemplar colectado se le asignó un código de campo y se anotaron en una planilla las observaciones correspondientes (ubicación en el transecto, hora de colecta, No. del transecto, sexo, tipo de vegetación).
Preservación de los ejemplares. Los imagos colectados se depositaron en sobres entomológicos (triángulos de papel pergamino), posteriormente se sumergieron en un recipiente con acetona, durante 16 a 24 horas, luego de las cuales se extrajeron y se dejaron al aire libre para su secado.
Identificación taxonómica. Para la identificación de las especies colectadas, se utilizaron las claves taxonómicas de Borror (1945), McCafferty (1981), De Marmels (1993, 2001); Westfall y Tennessen (1996) y Förster (1999).
Para la diferenciación de las morfoespecies se emplearon diferentes criterios morfológicos entre ellos: morfología alar, forma y tamaño de la genitalia masculina, forma y tamaño de los cercos entre otros. Para la separación de los machos y hembras de mismo morfo, estos fueron colectados en campo en tándem y se introdujeron en el mismo sobre, para su posterior identificación en el laboratorio.
Colección de referencia. Los imagos identificados fueron montados en seco, y rotulados con papel opalina (libre de acido) con los datos básicos de campo. Cada ejemplar se introdujo en un sobre de celofán con las alas plegadas y el abdomen extendido perpendicularmente. Luego se incluyó dentro de la colección de odonatos del Museo Entomológico Francisco Luís Gallego (MEFLG) de la Universidad Nacional de Colombia, Sede Medellín.
Análisis de datos. Para el análisis de la información se construyó una matriz estratificada en una hoja de calculo (Excel) con toda la información de campo asociada a cada uno de los ejemplares. Con dicha información se estimo la riqueza específica (S), la abundancia absoluta (número total de individuos colectados) por cada transecto y se construyeron clusters mediante el uso del programa PRIMER 5 (Robert, 2006). Con los valores de presencia–ausencia se calculó el índice de similitud de Jaccard, para evaluar el patrón de distribución espacial de la comunidad de libélulas en el área de estudio.
Mediante el programa ESTIMATE SWin800, se diseñó una curva de acumulación de especies, para estimar el eficiencia de captura y el recambio de especies por uso de suelo, usando el modelo de la división aditiva de la diversidad, para ello se utilizaron estimadores noparamétricos de Chao 1 y Chao 2 con un intervalo de confianza del 95%. El índice de complementariedad también fue considerado.
RESULTADOS Y DISCUSIÓN
En total se colectaron 20 especies de odonatos, distribuidos en 5 familias y 15 géneros (Tabla 1). Para el suborden Zygoptera se registraron 6 especies, agrupadas en 4 géneros y 3 familias, mientras que para el suborden Anisoptera se registraron 14 especies agrupadas en 11 géneros y 2 familias, en este suborden los géneros Dythemis y Erytrodiplax tuvieron la mayor representación con 2 especies cada uno.
Tabla 1. Lista de especies de odonatos recolectados en el Centro Agropecuario Cotové. Santafé de Antioquia, Colombia.
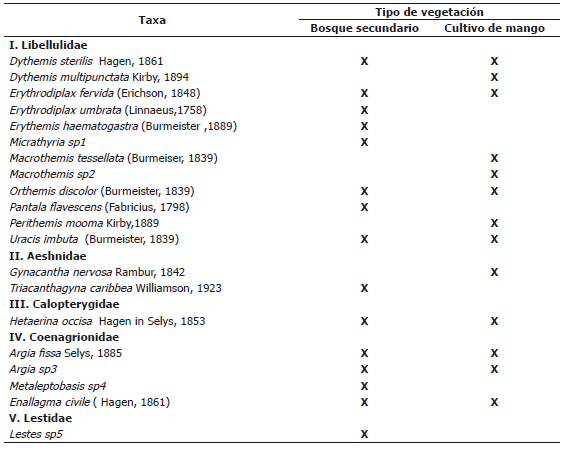
Con respecto al total colectado los Anisopteros contribuyeron con el 70% de las especies. Este valor relativamente alto, se debe posiblemente a la presencia de un gran número de especies termófilas (Vega et al. 2004), concentrándose la mayor cantidad de individuos en las zona litoral del sistema lótico.
En cuanto a las familias, la Libellulidae mostró la mayor abundancia y riqueza (Figura 1) con un total de 65 individuos que representaban el 53,7% de la población total, y de esta familia, se identificaron 12 especies que constituyen el 60% de la comunidad registrada. Las familias que mostraron la menor representación tanto en abundancia como riqueza fueron Calopterygidae con un total de 23 individuos de solo una especie y Lestidae con un solo individuo. La dominancia de la familia Libellulidae es un resultado consistente con su afinidad y adaptabilidad a áreas con un alto grado de intervención antrópica (Carle, 1979), debido a que los ecosistemas muestreados en el Centro Agropecuario Cotové, se encuentran al interior de una matriz boscosa, rodeada en su mayor parte por potreros. De igual forma hay que tener en cuenta que los diversos requerimientos termorregulatorios de las libélulas, son una variable determinante en la presencia de algunos ensamblajes particulares (Samways y Steytler, 1996).
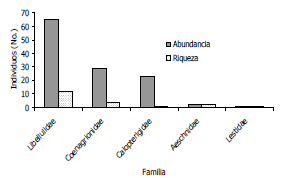
Figura 1. Abundancia y riqueza de odonatos por familia recolectados en el Centro Agropecuario Cotové. Santafé de Antioquia, Colombia.
Del total de 121 individuos colectados, Hetaerina occisa fue la mas abundante (23 individuos), seguida de Uracis imbuta con (18 individuos) y Enallagma civile (14 individuos) (Figura 2), todas ellas representando el 45,4% de la abundancia total, lo cual es además un indicativo de una marcada dominancia de estas tres especies, en la comunidad de odonatos en el área de estudio.
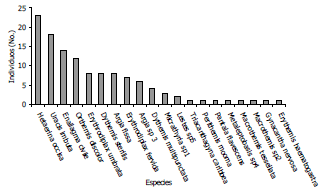
Figura 2. Abundancia general de odonatos en el Centro Agropecuario Cotové. Santafe de Antioquia, Colombia.
Uso de suelo. El bosque secundario presentó la mayor riqueza específica y la mayor abundancia en el Centro Agropecuario Cotové, con 15 especies (75%) y 69 individuos (57%), mientras que en el cultivo de mango, se colectaron 13 (65%) especies y 50 (41,3%) individuos. La variación en riqueza de especies entre las áreas de estudio, posiblemente se explica por las diferencias en composición edáfica, florística y faunística de los usos de suelo; además, este resultado puede estar asociado con los impactos antrópicos producto de la fragmentación, en este caso los monocultivos interrumpen el régimen de perturbación natural; eliminando los gradientes ambientales, estas alteraciones reducen la riqueza local por que homogenizan los ambientes, disminuyendo la disponibilidad de recursos (Ward, 1998). Sin embargo, cabe resaltar que estudios en otros países contradicen las observaciones aquí plateadas, entre ellos se pueden mencionar los trabajos de Samways y Stewart (1998); Ferreira y Fonseca (2003). Estos autores, afirman que la complejidad de los ecosistemas puede trasformar el efecto de las perturbaciones en nuevos ambientes, y que estos agentes perturbadores posiblemente favorecen a muchas especies de odonatos. En Brasil, Ometo et al. (2000) no encontraron relaciones entre el uso del suelo (áreas urbanizadas, pastizales y caña de azúcar) y la riqueza de macroinvertebrados, sugiriendo que solamente alteraciones bruscas del uso del suelo, pueden determinar las condiciones locales de los sistemas acuáticos. No obstante, la modificación del hábitat también puede cambiar la densidad de predadores, las larvas de Odonata y algunos peces, además, el uso que hagan del medio ambiente que ocupan, modificando así los tipos de alimentación y desarrollo de las larvas (Crowley y Johnson, 1992). De este modo, estos cambios alteran la riqueza de especies de depredadores, incluyendo Odonata, que puede ser un factor determinante en algunos casos, como el flujo de la energía, que afectaría a la estructura de las redes troficas de los ecosistemas acuáticos (Ferreira y De Marco. 2002).
Se realizó una prueba de comparación de medias a través de un análisis de varianza de una vía, para la abundancia de cada especie entre los dos usos de suelo, esta permitió apreciar que no existen diferencias estadísticamente significativas entre el número de individuos recolectados en el cultivo de mango y el bosque secundario (F=0,58; P=0,44).
Por su parte, el índice de similitud de Jaccard (Figura 3) (basado en la presencia o ausencia de especies), reveló que a pesar de tener los diferentes tipos de vegetación una abundancia similar, no comparte las mismas especies. Esto se debe posiblemente a que existen especies que están adaptadas a las condiciones de degradación del ambiente como es el caso de los monocultivos, entre estas se encontraron a los Aesnidos Gynacantha nervosa, Triacanthagyna caribbea y los Libélulidos Dythemis multipunctata, Perithemis mooma y Macrothemis tesellata, las cuales se registraron de manera exclusiva en el cultivo de mango. Además, hay que recordar que las libélulas son un grupo de insectos que no dependen de las plantas desde el punto de vista trófico; por lo tanto, el tipo de comunidad vegetal parece no afectar la distribución de muchas especies como ocurre con insectos herbívoros (González et al., 2009).
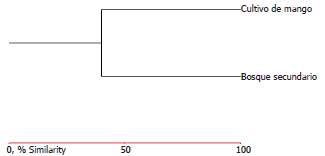
Figura 3. Análisis de similaridad (Jaccard) entre los dos tipos de vegetación evaluados en el Centro Agropecuario Cotové. Santafé de Antioquia, Colombia.
Mediante la curva de acumulación de especies, utilizando una rarefacción (Figura 4) se pudo observar que la diversidad α es mayor en el bosque que en el cultivo; sin embargo, el estimador de Chao 1 permite concluir que las bajas abundancias registradas no son apropiadas para estimar la diversidad γ del Centro Agropecuario Cotové, la diversidad β fue de 12 especies y el índice de complementariedad medido fue de 0,6; lo cual indica, que los dos tipos de suelo presentan una fauna de odonatos característica y distintiva. Estas notables diferencias en cuanto al número de especies exclusivas en los dos tipos de uso de suelo, ponen de manifiesto la importancia que tienen los fragmentos de bosque seco tropical y principalmente la vegetación riparia en la conservación de libélulas ya que éstos sirven como áreas de dispersión y reproducción de muchas especies (Samways y Steytler, 1996).
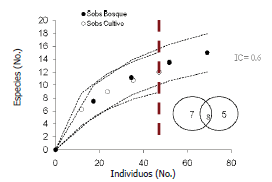
Figura 4. Curva de acumulación de especies, (±IC 95%, líneas punteadas) utilizando el número de individuos como sustitutos para estimar el esfuerzo de muestreo. Centro Agropecuario Cotové. Santafé de Antioquia, Colombia.
Proporción sexual. En cuanto a la proporción de sexos, se observó un mayor número de especies representadas por machos colectándose 78 individuos y 17 especies, mientras que solo fueron registrados 48 individuos y 13 especies como hembras (Figura 5). Este resultado puede ser explicado si se tiene en cuenta que los muestreos, tanto en el bosque como en el cultivo, se realizaron en cercanías a un sistema lótico y las hembras de los odonatos maduran los huevos lejos del agua; y sólo se acercan a ella, para aparearse y realizar la puesta. En general, se asume que la mayoría de las hembras consigue aparearse, ya que la proporción de sexos en las cercanías de las masas de agua, esta muy sesgada hacia los machos (Cordero, 1994). Algunos autores han señalado que este sesgo debe ser considerado un artefacto debido al comportamiento más críptico, la coloración de las hembras y el uso diferencial del hábitat; por lo tanto, la probabilidad de capturar a una hembra es típicamente menor a la de un macho (Garrison y Hafernik, 1981). Sin embargo, existen diversas hipótesis que tratan de esclarecer el comportamiento de la proporción sexual en odonatos, entre las que se destacan, que puede haber un sesgo hacia los machos en la proporción de sexos durante la emergencia; además, que los machos y las hembras pueden no emerger de manera sincrónica, las hembras tiene un periodo mas largo de maduración, las hembras inmaduras tienen mayores tasas de mortalidad y por último, que las hembras maduras tienen menores probabilidades de supervivencia (Cordero y Stoks, 2008).
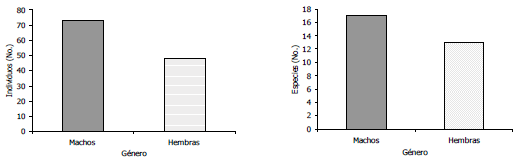
Figura 5. Abundancia y riqueza de machos y hembras de odonatos, recolectados en el Centro Agropecuario Cotové. Santafé de Antioquia, Colombia.
Distribución/Distancia al cuerpo de agua. Los resultados de este trabajo también mostraron que la distribución de las especies estuvo altamente influenciada por la distancia al cuerpo de agua (Figura 6) independientemente del tipo de vegetación, debido a que la abundancia disminuyó conforme se incrementó la distancia hacia el sistema lótico. Esto demuestra la marcada relación entre el recurso hídrico y la actividad de los adultos del orden Odonata.
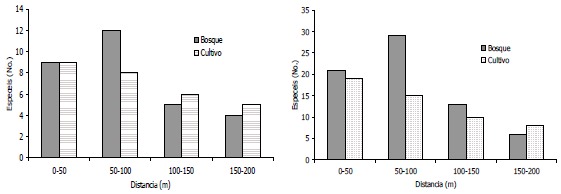
Figura 6. Abundancia y riqueza por sexos según la distancia al sistema lótico. Centro Agropecuario Cotové. Santafé de Antioquia, Colombia.
La distribución de la abundancia de cada sexo también se vió afectada por la distancia al cuerpo de agua, debido a que en ambos usos de suelo, los machos fueron más abundantes entre los 0-100 m del transecto. Este resultado puede estar asociado a que la mayoría de especies de Libelúlidos y Calopterígidos y de estos últimos principalmente la especie Hetaerina occisa la cual fue la más abundante durante todo el estudio, presentan comportamientos territoriales bastante marcados; en donde los machos, cuidan un espacio determinado cerca del sistema acuático el cual utilizan fundamentalmente para capturar a las hembras para la copula, mientras éstas sólo llegan allí para copular u ovipositar (Assis et al., 2004).
CONCLUSIONES
La diversidad α es mayor en el bosque en relación al cultivo; sin embargo, las bajas abundancias registradas destacan la necesidad de un mayor esfuerzo de muestreo en el cultivo, para una mejor estimación de la diversidad γ; la diversidad β fue de 12 especies y el índice de complementariedad registrado fue de 0,6, lo cual indica que la fauna de odonatos es característica y distintiva para cada uso de suelo.
La distribución de la abundancia y riqueza de cada sexo, también se vio afectada por la distancia al cuerpo de agua, Esto puede estar asociado a que la mayoría de especies de odonatos presentan comportamientos territoriales bastante marcados.
AGRADECIMIENTOS
Al Museo Entomológico Francisco Luis Gallego de la Universidad Nacional de Colombia, Sede Medellín, al profesor Allan Smith Pardo, y los evaluadores anónimos los cuales ayudaron a mejorar la calidad del documento.
BIBLIOGRAFÍA
Altamiranda, M., M. Lobo, M. Moreno, L. Gutiérrez. 2006. Variación de la riqueza y abundancia de imagos de odonatos durante los eventos climáticos (lluvia–sequía) en relictos de bosque seco tropical (Bs-T) en las zonas bajas del departamento del Atlántico. pp. 255. En: Memorias. Segundo Congreso Colombiano de Zoología. Universidad Nacional de Colombia. Santa Marta.
Assis, J., A.Carvalho e J. Nessimian. 2004. Composição e preferência por microhábitat de imaturos de Odonata (Insecta) em um trecho de baixada do Rio Ubatiba, Maricá-RJ, Brasil. Revista Brasilera de Entomologia 48(2): 273-282. [ Links ]
Arango, M. y G. Roldán. 1983. Odonatos inmaduros del departamento de Antioquia en diferentes pisos altitudinales. Actualidades Biológicas 12(46): 91-105. [ Links ]
Bermúdez, C. 2005. Estudio taxonómico de los adultos del suborden Anisoptera (Odonata), del Valle del Cauca, Colombia. Tesis de grado de Biología. Universidad del Valle. 117 p. [ Links ]
Borror, D.J. 1945. A key to the world genera of Libellulidae (Odonata). Annals of the Entomological Society of America 38(2): 168-194. [ Links ]
Carle; F.L. 1979. Environmental monitoring potential of the Odonata, with a list of rare and endangered Anisoptera of Virginia, United States. Odonatologica 8(4): 319-323. [ Links ]
Corbet, P.S. 1999. Dragonflies: Behaviour and ecology of Odonata. Harley Books. New York. 829 p. [ Links ]
Cordero, A. 1994. Reproductive allocation in different-sized adults Ischnura graellsii (Rambur) (Zygoptera: Coenagrionidae) Odonatologica 23(3): 271-276. [ Links ]
Cordero, A. and R. Stoks. 2008. Chapter 2. Mark–recapture studies and demography. pp. 7-20. In: Córdoba, A. (ed.). Dragonflies and Damselflies model organisms for ecological and evolutionary research. Oxford University Press US. 289 p.
Crowley, P.H. and D.M. Johnson. 1992. Variability and stability of a dragonfly assemblage. Oecologia 90(2): 260-269. [ Links ]
Cruz, L. 1986. Contribución a los estudios taxonómicos de Odonata (Zigoptera) de Colombia: descripción de una nueva especie de Cianallagma (Odonata: Coenagrionidae). Caldasia 14(68/70): 743-747. [ Links ]
De Marmels, J.C. 1993. Los géneros venezolanos de la familia Aeshnidae (Insecta: Odonata) Trabajo de ascenso. Facultad de Agronomía. Universidad Central de Venezuela. Maracay. 67 p. [ Links ]
De Marmels, J. 2001. Revision of megapodagrion (Selys, 1886) (Insecta: Odonata: Megapodagrionidae). Tesis doctoral. Mathematisch Naturwissenschaftliche Fakultaet. Universitaet Zuerich, Zuerich Suiza. 220 p. [ Links ]
Favila, M.E. and G. Halffter. 1997. The use of indicator groups for measuring biodiversity as related to community structure and function. Acta Zoológica Mexicana 72:1-25. [ Links ]
Ferreira, P.S e G.A. Fonseca. 2003. Comunidade de Odonata (Insecta) em áreas naturais de cerrado e monocultura no nordeste do Estado de São Paulo, Brasil: relação entre o uso do solo e a riqueza faunística. Revista Brasileira de Zoología 20(2): 219-224. [ Links ]
Ferreira, P. e P.J. De Marco. 2002. Efeito da alteração ambiental sobre comunidades de Odonata em riachos de Mata Atlântica de Minas Gerais, Brasil. Revista Brasileira de Zoología 19(2): 317-327. [ Links ]
Förster, S. 1999. The dragonflies of Central America exclusive of Mexico and the West Indies: A guide to their identification. Second edition. G. Rehfeldt., Braunschweig 141 p. [ Links ]
Garrison, R.W. and J.E. Hafernik. 1981. Population structure of the rare damselfly, Ischnura gemina (Kennedy)(Odonata: Coenagrionidae). Oecologia 48(3): 377–384
González, E., F.A. Noguera, S. Zaragoza y E. Ramírez. 2009. Odonata de un bosque tropical caducifolio: sierra de San Javier, Sonora, México. Revista Mexicana de Biodiversidad 80: 341-348. [ Links ]
Holdridge, L. 1978. Ecología basada en zonas de vida. Instituto Interamericano de Ciencias Agrícolas, San José. Costa Rica. 216 p. [ Links ]
Louton, J.A., R.W. Garrison and O.S. Flint. 1996. The Odonata of Parque Nacional Manu, Madre de Dios, Perú; natural history, species richness and comparisons with other peruvian sites. pp. 431-449. In: Wilson D. and A. Sandoval (eds.). Manu. The biodiversity of southeastern Peru. Smithsonian Institution Press. Washington, D.C. 679 p. [ Links ]
Navas, L. 1935. Odonatos de Colombia. Boletín de la Sociedad Entomológica de España 17: 33-38. [ Links ]
McCafferty, P.W. 1981. Aquatic Entomology. Science Books International. 448 p. [ Links ]
Ometo, J.P., L.A. Martinelli; M.V. Ballester, A.F. Gessner; A.V. Krusche;R.L. Victoria and M. Williams. 2000. Effects of land use on water chemistry and macroinvertebrates in two streams of the Piracicaba river basin, south-east Brazil. Freshwater Biology 44:327-337. [ Links ]
Pérez, L.A. 2003. Estudio biotaxonómico de los odonatos (Insecta: Odonata Fabricius 1973) del Distrito de Santa Marta (Magdalena- Colombia) Tesis de pregrado. Universidad del Magdalena-Santa Marta, Colombia. 176 p. [ Links ]
Paulson, D.R. 1968. Odonata from isla San Andres, western Caribbean sea. Entomological News 79: 229-231. [ Links ]
Pelli, A. e F.A.R. Barbosa. 1998. Insetos coletados em Salvinia molesta Mitchell (Salviniaceae), incidindo sobre as espécies que causam danos às plantas, lago de água Olhos, Minas Gerais, Brasil. Revista Brasilera de Entomología 42: 9-12. [ Links ]
Ris, F. 1918. Libellen (Odonata) aus der region der amerikanischen kordilleren von Costarica bis Catamarca. Archiv für Naturgeschichte 89(2): 1-192. [ Links ]
Robert, C. 2006. Departamento de Ecología y Biología Evolutiva de la Universidad de Connecticut, CT 06869-3043, EE.UU. http://viceroy.eeb.uconn.edu/EstimateS, consulta: Junio 2008. [ Links ]
Santos, N. D. 1981. Odonata. pp 64-85. In: Hurlbert, S.H., G. Rodríguez and N.D. Dos Santos (eds.). Aquatic Biota of Tropical South América. Part 1 Arthropoda. San Diego State University. California. [ Links ]
Samways, M.J and N.S. Steytler. 1996. Dragonfly (Odonata) distribution patterns in urban and forest landscapes, and recommendations for riparian management. Biological Conservation 78(3): 279-288. [ Links ]
Samways, M.J. and Stewart, D.A.B. 1998. Conserving dragonfly (Odonata) assemblages relative to river dynamics in an African savanna game reserve. Conservation Biology 12(3): 683-692 [ Links ]
Schmidt, E. 1985. Habitat inventarization, characterization and bioindication by a “representative spectrum of Odonata species (RSO). Odonatologica”. 14(2): 127-33.
Suárez, M. 1987. Contribución al estudio de los Odonatos del Valle del Cauca. Trabajo de grado de Biología. Facultad de Ciencias. Universidad del Valle. Cali. 32 p. [ Links ]
Urrutia, M.X. 2005. Riqueza de especies de Odonata Zygoptera por unidades fisiográficas en el departamento del Valle del Cauca. Boletín del Museo de Entomología de la Universidad del Valle 6(2): 30-36. [ Links ]
Ward, J.V. 1998. Riverine landscapes: biodiversity patterns disturbance regimes, and aquatic conservation. Biological Conservation 83(3): 269-278. [ Links ]
Westfall, M.J and K.J. Tennessen. 1996. Odonata. pp. 164-211. En: Merritt, R. and K. Cummins (eds.). An Introduction to the Aquatic Insects of North America. Third edition. Kendall/Hunt Publishing Company. 862 p. [ Links ]
Williamson, E.B. 1918. Results of the University of Michigan-Williamson Expedition to Colombia, 1916-1917. I. Two interesting new Colombian gomphines (Odonata). University of Michigan Museum of Zoology 52: 1-14. [ Links ]
Zloty, J. and Pritchard, G. 2001. Cora chiribiquete spec, nov. a new damselfly species from Colombia (Zygoptera: Polythoriade). Odonatologica 30 (2): 227-232. [ Links ]














