Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.62 no.2 Medellín July/Dec. 2009
DETERMINACIÓN DEL NIVEL DE NUTRICIÓN FOLIAR EN BANANO POR ESPECTROMETRÍA DE REFLECTANCIA
FOLIAR NUTRITION DETERMINATION LEVEL ON BANANAS BY REFLECTANCE SPECTROMETRY
Juan Manuel Botero Herrera1; Luis Norberto Parra Sánchez2 y Kenneth Roy Cabrera Torres3
1 Ingeniero Agrónomo. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779, Medellín, Colombia. <juanmanuel.botero@gmail.com>
2 Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín. A.A. 1779, Medellín, Colombia. <lnparra@unalmed.edu.co>
3 Instructor Asociado. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. A.A. 3840, Medellín, Colombia. <krcabrer@unalmed.edu.co>
Recibido: Junio 8 de 2009; Aceptado: Octubre 26 de 2009
Resumen. Con el objetivo de generar conocimiento básico para el desarrollo de la agricultura de precisión y para mejorar la respuesta a las necesidades de disponer de más información a nivel espacial y temporal, se utilizó el espectro de reflectancia de muestras foliares de banano molidas y tamizadas. Se realizó calibración quimiométrica mediante PLSR (Partial Least Square Regresion), con diferentes pre-tratamientos espectrales (espectro crudo, transformaciones MSC (Multiplicative Scatter Correction), SNV (Standard Normal Variate), Savitzky y Golay con primera y segunda derivada, transformación Log 1/R, y DOSC (Direct Orthogonal Signal Correction). Para la calibración se empleó la concentración en tejido foliar de 11 nutrientes contrastada con la reflectancia de la misma muestra, encontrando que para todos los casos el mejor pre tratamiento fue DOSC, que permitió construir modelos de calibración con errores similares a los de los métodos de referencia, con un número bajo de variables latentes y ajustes superiores al 80%, lo cual es suficiente para sugerir esta metodología como una alternativa práctica, económicamente viable, precisa y rápida, a los análisis químicos tradicionales de tejido foliar.
Palabras claves: Espectroscopía, análisis foliar, PLSR, calibración, concentración de nutrientes.
Abstract. In order to generate basic knowledge for development of precision agriculture and to improve response to the needs of generate more information spatial and temporal level, was used the reflectance spectrum of banana leaf samples ground and sieved. The chemometric calibration was performed by PLSR (Partial Least Square Regression), with different pre-treatments spectrum (spectrum crude transformations MSC (Multiplicative Scatter Correction), SNV (Standard Normal Variate), Savitzky and Golay with first and second derivative transformation Log 1 / R, and DOSC (Direct Orthogonal Signal Correction). The calibration was between the leaf tissue concentration of 11 nutrients and the reflectance of the same sample, finding that in all cases the best DOSC pre-treatment was that allowed to build calibration models with errors similar to the reference methods with a low number of latent variables and settings above 80% which is sufficient to suggest this methodology as a practical alternative, economically viable, accurate and quick, the traditional chemical leaf tissue analysis.
Key words: Spectroscopy, foliar analysis, PLSR, calibration, nutrient concentration.
Dada la necesidad de conocer más detalladamente el estado nutricional del cultivo de banano y debido a que los análisis químicos tradicionales resultan costosos cuando se quiere tener mucha información de este tipo, se adoptó como alternativa, la espectrometría de reflectancia por sus múltiples ventajas, entre ellas el no ser destructiva, ni invasiva, por ser precisa, rápida y no requerir preparación de muestras ni reactivos, además, se pueden determinar varios parámetros simultáneamente y es fácilmente automatizable cuando se apoya en la calibración PLSR y algunas transformaciones espectrales (Huang et al., 2004; Veselá et al., 2007; He et al., 2007; Dou et al., 2007; Roggo et al., 2007; Xie et al., 2007; Azzouz y Tauler, 2008; Min et al., 2008). El principio fundamental de la espectroscopía es que la radiación sufre modificaciones observables y medibles al interactuar con las sustancias, lo cual depende de la composición química del objeto y/o de sus atributos físicos y estructurales (Nicolai et al., 2007; Ayala y Beyl, 2005; Armenta et al., 2007). Tradicionalmente los cambios visuales en las hojas han servido para detectar deficiencias nutricionales en las plantas, de allí que una métrica más precisa del espectro de reflectancia de las hojas sirva como indicador de tales deficiencias nutricionales (Adams et al., 2000a).
Es así que muchos autores han desarrollado investigaciones exitosas para determinar la concentración de nutrientes en tejido foliar. En maíz, (Noh et al., 2006; Osborne et al., 2002) y algunas pasturas, Cho y Skidmore (2006) y Mutanga y Skidmore (2007); en hojas de sorgo, Zhao et al. (2005c); en algodón, Zhao et al. (2005a) y Zhao et al. (2005b); en soya, Adams et al. (2000b); en trigo Feng et al. (2008). Christensen (2004) y Jorgensen y Christensen (2004) encontraron en plantas de avena y maíz, que al incluir la respuesta espectral de toda la hoja y la información espacial de la misma, tomada en la base, parte media y punta de la hoja, se incrementa de forma significativa la predicción en los modelos o la discriminación de las deficiencias de nitrógeno, fósforo y potasio.
En Colombia la investigación agrícola en este tema es incipiente, un grupo de investigación de CENICAÑA desarrolló una metodología para la determinación de nitrógeno en tejido foliar de caña, por medio de espectroscopía de infrarrojo cercano (1.100 a 2.500 nm) por medio de calibración quimiométrica MLR y PLS, obteniendo resultados similares en ambos casos, con una buena aproximación a los obtenidos en la determinación por medio de la metodología de laboratorio Kjeldhal (Larrahondo et al., 2001).
Por otro lado Bastidas y Carbonell (2008) utilizaron la espectroscopia NIR con análisis clúster para clasificar los diferentes grupos taxonómicos de suelos presentes en el valle geográfico del río Cauca, encontrando algunas diferencias en la homogeneidad interna dentro de cada grupo analizado. Aparte de estas dos referencias, no se han encontrado otras investigaciones que utilicen la espectrometría en la investigación agrícola.
En este trabajo, se desarrolló un modelo matemático útil para determinar la concentración de algunos nutrientes en tejido foliar, de una forma sencilla, rápida y con la precisión suficiente para ser utilizada en planes de fertilización, permitiendo no solo tener información puntual a nivel espacial, sino que además por la naturaleza de las mediciones, facilita hacer un seguimiento con la resolución temporal que se desee (incluso día a día) para conocer verdaderamente la efectividad de las labores realizadas en los planes de fertilización, obteniendo registros de manera casi instantánea y sin un costo muy elevado comparado con el volumen de datos disponibles, es también importante tener en cuenta que los sensores para estas labores pueden ser de tamaño portátil de campo, sensores montados en maquinaria agrícola acoplados con sistemas de respuesta automáticos de dosis variable, hasta sensores instalados en aeroplanos que logren obtener información muy detallada de áreas grandes que sirvan como insumo para el desarrollo de metodologías de agricultura de precisión.
MATERIALES Y MÉTODOS
Se tomaron 60 muestras foliares de plantas de banano, provenientes de Urabá (Colombia), secadas al horno, molidas y tamizadas a 2 mm, que fueron analizadas en el laboratorio de suelos de la Universidad Nacional de Colombia, Sede Medellín, para determinar el contenido de nutrientes foliares. Las muestras fueron seleccionadas de tejido vegetal que ingresó al laboratorio en un periodo de tiempo dado, con el fin de incorporar en el modelo de predicción una amplia área geográfica y una buena variación en los niveles foliares de nutrientes, como base para una buena calibración. Por la confidencialidad de la información no se presenta información específica de las fincas o lotes de donde proviene el material.
Los nutrientes a los cuales se les determinó su concentración fueron: nitrógeno (N) por el método de Kjeldhal; fósforo (P), por el método colorimétrico complejo fosfo – molíbdico; calcio (Ca), magnesio (Mg), potasio (K), hierro (Fe), manganeso (Mn), cobre (Cu) y Zinc (Zn) por el método de absorción atómica; azufre (S), por el método de turbidimetría BaCl2 bactogelatina, y por último boro (B), por el método colorimétrico (Azometin h) la descomposición de la muestra se hizo vía seca 550 ºC. Estos parámetros constituyen una base de datos que se emplea como las variables respuesta para la calibración del modelo.
Para las determinaciones espectrométricas, las muestras foliares fueron llevadas al horno nuevamente a 60 °C por 48 horas, tiempo después del cual fueron puestas individualmente en un mortero de porcelana para triturarlas hasta llevarlas al menor tamaño posible de partícula y apariencia homogénea, posteriormente el polvo se colocó sobre un porta objetos de vidrio donde se le adicionó agua destilada suficiente para formar una pasta, la cual se esparció de forma homogénea hasta formar una capa opaca de 1 milimetro y fué secada lentamente al horno a 60 °C por 48 horas para evitar agrietamientos u otros defectos en la superficie a analizar. La microcapa fue colocada en posición inclinada a 90 grados y analizada en el espectrómetro Perkin Elmer Lambda 25, equipado con la esfera para mediciones por reflectancia, donde se les obtuvo la reflectancia espectral cada 2 nanometros y en el rango entre 400 y 1.050 nm. De cada muestra se obtuvieron 3 mediciones espectrales para obtener un espectro promedio, el cual se utilizó como grupo de variables explicativas de la concentración foliar de nutriente de dichas muestras, en la calibración PLSR con diferentes pre-tratamientos.
Análisis de datos. Todos los análisis gráficos y estadísticos fueron realizados con el software R versión 2.7.2. (CRAN, 2008)
Se analizó cada variable con gráficos box plot, los cuales fueron utilizados para la detección de valores extremos, considerados como los valores que estuvieran más allá de dos veces la distancia intercuantílica.
Pre-tratamientos espectrales. Para la calibración o regresión PLS (Partial Least Squares) se utilizó el espectro de reflectancia tratado de diferentes formas, así:
a. Espectro Crudo, tal cual lo arroja el equipo.
b. Espectro con transformación MSC (Multiplicative Scatter Correction); esta transformación se realizó con librería PLS, por medio de la función msc.
c. Transformación SNV(Standard Normal Variate), aplicada mediante de la función msNormalizeSNV presente en la libreria msProcess.
d. Transformación Log 1/R, cada valor de reflectancia en cada longitud de onda se le aplicó la formula:
Rt=log (1 /R).
Donde R es la reflectancia en cada longitud de onda, medida por el espectrómetro y Rt es el valor transformado.
e. Filtro de Savitsky y Golay de primera y segunda derivada, presente en la librería Signal donde la función sgolayfilt aplica un filtro que utiliza un suavizado ajustado a una función polinomial, a un cierto número de segmentos (longitudes de onda consecutivas), el cual reemplaza en el segmento del centro, el valor de la primera o segunda derivada según se desee, utilizándose así:
sgolayfilt (X,a,b,c )
Donde X es el espectro de reflectancia, a es un número que corresponde al orden de la curva polinomial con el que se suaviza el espectro, b es el número de segmentos utilizados para hacer el suavizamiento y c es el orden de la derivada que se utilizará (ej: 1 para la primera derivada, o 2 para la segunda derivada). En este trabajo se utilizó la primera (SG1) y segunda derivada (SG2).
f. Corrección directa ortogonal de la señal (DOSC, Direct Orthogonal Signal Correction), la cual fue necesaria programar o construir la función en R versión 2.7.2, con ayuda de la librería corpcor indispensable para el cálculo de la pseudo inversa de Moore Penrose, utilizada en este pretratamiento del espectro. A continuación se muestra el guión utilizado en R para esta función:
X<-NIRS
Y <-qrab
X y Y son respectivamente, la matriz de datos espectrales y la matriz o vector de datos respuesta.
yhat<-X %*% pseudoinverse((X)) %*% Y
%*% es la multiplicación matricial en R, la pseudoinverse((X)) calcula la pseudo inversa también conocida como inversa de Moore-Penrose de la matriz de datos espectrales, donde yhat es la proyección de la respuesta sobre la matriz de datos espectrales X.
A continuación se realiza esto:
AyX <- X - yhat %*% pseudoinverse (yhat) %*% X
Deflacta a X con respecto a yhat, es decir expresa el primero en términos de la magnitud del segundo, y se continúa con el cálculo de los componentes principales mayores del producto matricial entre AyX y su transpuesta, así:
eig<-eigen (AyX %*% t(AyX))
Donde eig contiene los valores y vectores propios del objeto. A continuación se calcula la pseudo inversa de la matriz de espectros de reflectancia X.
pinvX = pseudoinverse(X)
Con esta última y los vectores propios de eig se calcula W, que son los pesos utilizados para calcular los componentes DOSC , de la siguiente forma:
Ta<-eig$vectors
W<-pinvX %*% Ta
Se sigue con el cálculo de los componentes DOSC (T).
T<- X %*% W
Posteriormente se calculan los loadings (P) para remover los componentes DOSC de X, donde los loadings se encuentran como sigue:
P <- t(X)%*%T%*%solve(t(T)%*%T)
Donde t(X) calcula la traspuesta de X y la función solve(), calcula la inversa de la matriz argumento de la función.
Por último, se deflactan los datos espectrales X con respecto a los componentes DOSC, generando un espectro corregido ortogonalmente de manera directa, así:
newX = X - X%*%W%*%t(P)
De esta misma forma, se corrigen datos espectrales posteriores que se capten y no sean utilizados en la calibración, de tal manera que W y P, son los correspondientes a los datos iniciales y X, correspondería a los datos espectrales nuevos, donde newX, sería al final, el nuevo espectro corregido con DOSC, con base en los pesos (W) y los loadings (P) de los datos iniciales. Este procedimiento fue hecho fundamentado en el código programado para MATLAB.
Calibración PLS. La calibración o regresión PLS se realizó con la librería PLS y la función plsr, esta calibración se hizo para cada uno de los tratamientos del espectro y para cada una de las variables analizadas. Se utilizó el análisis de validación cruzada del tipo LOO (Leave One Out, o dejando uno por fuera) para analizar la precisión del modelo construido y se seleccionó el número de variables latentes por medio de la construcción de diferentes modelos, escogiendo el que presentó el menor error cuadrado medio en la predicción RMSEP (Root Mean Square Error of Prediction).
La selección del mejor modelo para cada variable se realizó teniendo en cuenta la construcción de un modelo robusto, el cual debe ser sencillo y con buena habilidad en la predicción, esto se logra mediante un modelo con un número bajo de componentes o variables latentes (LV), un error bajo en la predicción de la validación cruzada, un pequeño error ajustado en la validación cruzada y un coeficiente R² lo más cercano a uno posible.
Se llevó a cabo la selección de las longitudes de onda más significativas para cada modelo, tomando los cuatro coeficientes mayores de cada modelo en valor absoluto y a partir de esta información se seleccionaron las longitudes de onda.
RESULTADOS
Según los indicadores que se utilizaron en esta investigación, para la selección de los mejores modelos de predicción para la concentración de los diferentes nutrientes, el mejor pretratamiento de los datos espectrales fue siempre DOSC, permitiendo construir modelos confiables, con pocas variables latentes, un error bajo y un alto nivel de ajuste.
A continuación en las Tablas 1 y 2, se describen algunas características de parámetros de los modelos de predicción obtenidos y se mencionan las longitudes de onda que para dichos modelos tienen un mayor peso en la predicción, pero se debe tener en cuenta que la mejora en las técnicas matemáticas y estadísticas busca sacar la mayor información posible de todas las variables utilizadas (todas las longitudes de onda) por lo cual no se hace mucho énfasis en buscar algunas longitudes de onda especificas.
Tabla 1. Características de los modelos de predicción para macro nutrientes, obtenidos por espectrometría de reflectancia.
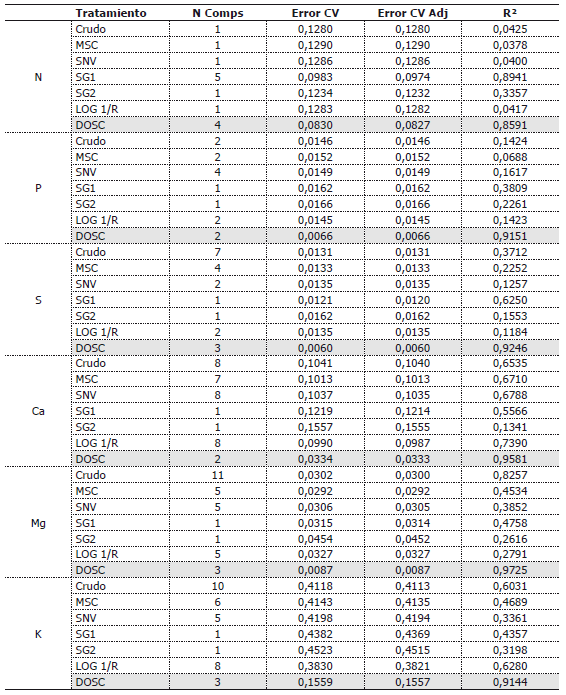
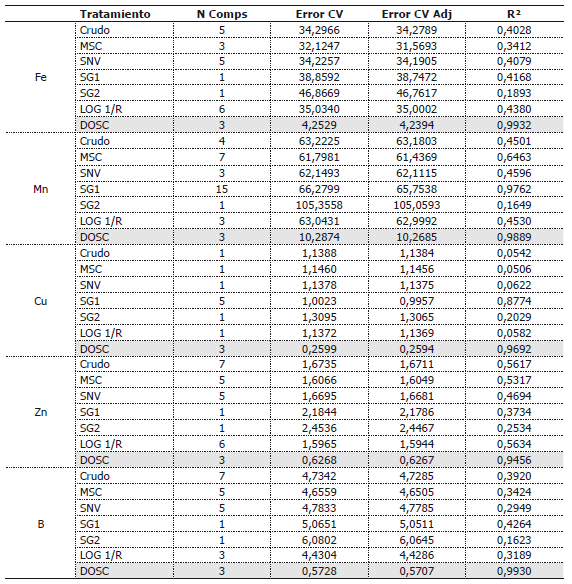
Tabla 2. Características de los modelos de predicción para micro nutrientes, obtenidos por espectrometría de reflectancia.
El caso del nitrógeno muestra un error en la predicción de 0,08%, con un ajuste del 85% y mostrando a 1.042, 1.025, 888 y 909 nm como las longitudes de onda más importantes, de igual forma que en el primer experimento organizadas de menor a mayor, según su grado de importancia dentro del modelo de predicción.
En la determinación de fósforo se obtiene un modelo cuyas longitudes de onda más influyentes son 1.001, 980, 859 y 902 nm, alcanzando un error de predicción de 0,006%, con un excelente ajuste del 91%.
Para determinar el contenido de azufre, se obtiene un modelo que permite predecir la concentración de este nutriente con un error de 0,006%, de 92%, señalando la reflectancia en 1.045, 1.041, 938 y 988 nm como las más influyentes en la predicción de esta característica.
La reflectancia en 886, 856, 920 y 981 nm, es la que más influye sobre el modelo para la determinación del contenido de calcio, con un ajuste de 95% y un error de 0,03%.
El magnesio, se logra estimar a través de reflectancia espectral, con un error de 0,008%, un ajuste del 97%, y muestra la reflectancia en 963, 831, 958 y 1.043 nm como las más importantes para este efecto.
De igual forma para la estimación del porcentaje de potasio a partir de la reflectancia, se obtiene que las longitudes de onda más influyentes son 1.050, 784, 918 y 888 nm y que el modelo construido logra predecir con un error de 0,15% y un ajuste del 91%.
Para la determinación de Fe, se construye un modelo que predice con un error de 4,2 ppm y un ajuste de 99%, mostrando además que las longitudes de onda más significativas para este fin son 1.012, 866, 1.045 y 1.024 nm.
El modelo construido para la determinación de manganeso, muestra la reflectancia en 901, 1.017, 947 y 1.039 nm como las longitudes de onda más influyentes para determinar la concentración de este nutriente, este permite estimar dicha concentración con un error de 10,2 ppm con un ajuste del 98%.
La reflectancia en 1046, 907, 948 y 997 nm, son las longitudes de onda que presentan mayor efecto sobre el modelo desarrollado para la determinación de cobre, el cual lo hace con un error de 0,25 ppm y un ajuste del 96%.
El caso del zinc, se comporta de igual forma con un muy buen ajuste del 94% y un error de predicción de 0,62 ppm, y muestra que las longitudes más importantes en dicha predicción son 1.015, 991, 1.046 y 882 nm.
Por último el modelo para la predicción del contenido de boro, a partir de reflectancia espectral, presenta un error de 0,57 ppm y un ajuste de 99%, mostrando que las longitudes de onda 877, 976, 879 y 963 nm, son las más influyentes en la predicción de la concentración de este nutriente.
DISCUSIÓN
En primer lugar es necesario resaltar que en esta técnica, hay tres partes fundamentales para desarrollar un buen modelo de calibración, de un lado está el conjunto de muestras de calibración que debe ser un conjunto amplio y que incluya todas las posibilidades en la escala de medición de las variables o características de importancia, que para este caso son los nutrientes a nivel foliar, además se debe tener en cuenta que si se trata de materiales biológicos y se trabajan con varias variables, no solo se deben incluir todas las posibilidades en la escala de medición de cada una de ellas, sino también considerar las diferentes posibilidades de interacciones o combinaciones entre todas las variables, por lo cual es fundamental tener un método de referencia (laboratorio) muy preciso y confiable, que permita medir las variables de interés de forma detallada y sin temor a errores; de otro lado, se debe tener un muy buen sensor en la parte espectroscópica que posea muy buena resolución espectral y que sea de una confiabilidad alta, y por último, y de igual importancia es la herramienta matemática o estadística que permite lograr la conexión entre los datos de referencia y la información espectral de manera adecuada, y con la capacidad de omitir información adicional que no sea de interés; así como, el ruido o errores incorporados por diferentes factores, dentro de las cuales están los métodos de regresión y muchos tratamientos de los datos espectrales para refinar la información de interés. Se debe tener en cuenta que el poder predictivo del modelo construido está en función de las tres partes mencionadas arriba, siendo todas de igual importancia, y la disminución en la calidad de cualquiera de ellas tres, conllevara a la disminución del poder predictivo del modelo.
En las Tablas 1 y 2 y la Figura 1, se observa claramente la calidad de los modelos construidos para determinar el contenido de los nutrientes a partir de muestras foliares por medio de espectroscopia de reflectancia, destacando los errores para la predicción y los ajustes que se obtienen en el proceso de calibración de los modelos, que permiten fácilmente pensar en la sustitución de los análisis tradicionales por esta nueva metodología.
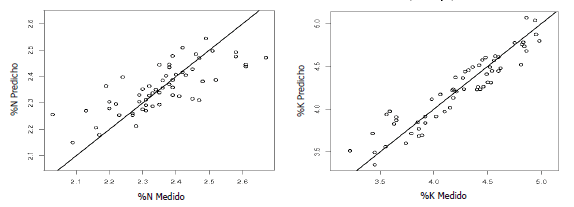
Figura 1. Validación cruzada de los modelos de predicción para nitrógeno (superior izquierda), potasio (superior derecha).
Sin embargo para la construcción de tal modelo, es indispensable disponer de una base de datos robusta y confiable y que cubra todo el rango de nutrientes para un cultivo dado, basada en las determinaciones tradicionales como análisis de referencia para poder calibrar adecuadamente los modelos de predicción.
Acerca de lo que muchos autores afirman sobre la existencia de varias características explicadas por una misma región o longitud de onda, se puede ver que en la construcción de los mejores modelos se encontraron algunas coincidencias en este respecto, que pueden llegar a causar incertidumbre en la determinación de alguna de las variables, ya que dos o más variables, comparten la reflectancia en una longitud de onda que explica gran parte del comportamiento, este es el caso de la reflectancia en 888 nm que explica la concentración de K y N, 963 nm para B y Mg, 1.045 nm para Fe y S y por último 1.046 nm para Cu y Zn. Sin embargo, se debe tener en cuenta la posibilidad de que la afinación en la lectura (aumentar la resolución espectral) pueda eliminar este problema, y simplemente encontrar que esta incertidumbre es causada por una deficiencia en precisión de los equipos que se han utilizado en estas investigaciones. Además, se debe tener en cuenta que al emplear estas técnicas multivariadas el objetivo principal deja de ser encontrar dos o tres longitudes de onda para la explicación de una variable; sino por el contrario, lograr utilizar la mejor información de todo el espectro, para poder afinar la determinación de la característica estudiada.
Se recomienda continuar realizando investigaciones con la espectrometría de reflectancia en diferentes campos como el manejo de plagas y enfermedades en los cultivos de banano, lo que podría conducir a un manejo racional de agroquímicos, optimizando dichas aplicaciones, y llevando los costos de producción a un punto más bajo conservando ó incluso mejorando la calidad de los productos, no solo en la parte sanitaria y alimenticia, sino en la ingesta de menos agroquímicos en la dieta del consumidor.
Es muy importante continuar el estudio de las metodologías estadísticas para la realización de las calibraciones así como de los pre-tratamientos espectrales que en este caso han sido exitosas; no obstante, aun son susceptibles de mejoramiento especialmente para datos no lineales.
Como recomendación final se sugiere realizar recalibración constante de cada modelo de este tipo, lo que consiste en incluir cada cierto tiempo un número determinado de muestras analizadas de la forma clásica a la base de datos con el fin de enriquecer el rango de los valores posibles y mantener actualizado los modelos con los posibles cambios que se presenten a nivel global que puedan afectar la respuesta espectral de las muestras.
CONCLUSIONES
Se ha demostrado a través de modelos de predicción, la factibilidad de determinar por espectrometría de reflectancia, la concentración de nutrientes en banano a nivel foliar a partir de muestras secas, con muy buena precisión.
Este tipo de modelos constituyen una base científica práctica y con la ayuda de dotaciones instrumentales similares al que se utilizó en esta investigación, se pueden construir laboratorios nutricionales accesibles a nivel de finca o de empresa, por lo menos para los sectores más industrializados de la producción agropecuaria, y realizar una mayor cantidad de análisis foliares de nutrientes ya sea, para investigación y experimentación o como apoyo fundamental en la toma de decisiones.
Este tipo de paquete tecnológico, agiliza el manejo cotidiano de la producción, permitiendo generar una mayor cantidad de información a nivel de lotes, así como un mejor seguimiento en el tiempo y un mejor control del estado nutricional de las plantaciones, evaluar la efectividad de los correctivos y de las aplicaciones de fertilizantes en el tiempo.
BIBLIOGRAFÍA
Adams, M.L., W.A. Norvell, W.D. Philpot and J.H. Peverly. 2000a. Spectral detection of micronutrient deficiency in ‘Bragg’ soybean. Agronomy Journal 92: 261-268.
Adams, M.L., W.A. Norvell, W.D. Philpot and J.H. Peverly. 2000b. Toward the discrimination of manganese, zinc, copper, and iron deficiency in ‘Bragg’ soybean using spectral detection methods. Agronomy Journal 92: 268-274.
Armenta, S., S. Garrigues and M. de la Guardia. 2007. Partial least squares-near infrared determination of pesticides in commercial formulations. Vibrational Spectroscopy 44(2): 273–278
Ayala, T. and C.A. Beyl. 2005. Changes in spectral reflectance of wheat leaves in response to specific macronutrient deficiency. Advances in Space Research 35(2): 305–317
Azzouz, T. and R. Tauler. 2008. Application of multivariate curve resolution alternating least squares (MCR-ALS) to the quantitative analysis of pharmaceutical and agricultural samples. Talanta 74(5): 1201–1210.
Bastidas, E. y J.A. Carbonell. 2008. La espectroscopia en el infrarrojo cercano (NIR) para caracterizar el patrón espectral en los suelos. En: Memorias del XIV Congreso Colombiano de la Ciencia del Suelo. “Manejo del Suelo para la Mitigación del Cambio Climático”. Sociedad Colombiana de la Ciencia del Suelo. Villavicencio, Colombia.
Cho, M.A. and A.K. Skidmore. 2006. A new technique for extracting the red edge position from hyperspectral data:The linear extrapolation method. Remote Sensing of Environment 101(2): 181–193.
Christensen, L.K. 2004. NPK deficiencies discrimination by use of spectral and spatial response. Ph.D. Thesis. Department of Agricultural Sciences. AgroTechnology. The Royal Veterinary and Agricultural University. Denmark. 102 p. [ Links ]
Dou, Y., N. Qu, B. Wang, Y.Z. Chi and Y.L. Ren. 2007. Simultaneous determination of two active components in compound aspirin tablets using principal component artificial neural networks (PC-ANNs) on NIR spectroscopy. European Journal of Pharmaceutical Sciences 32(3) 193–199.
The R Foundation for Statistical Computing-CRAN. 2008. R Development Core Team. R: A language and environment for statistical computing. Vienna, Austria. In: http://cran.r-project.org/bin/windows/base/. [ Links ]
Feng, W., X. Yao, Y. Zhu, Y.C. Tian and W.X. Cao. 2008. Monitoring leaf nitrogen status with hyperspectral reflectance in wheat. European Journal of Agronomy 28 (3): 394–404.
He, Y., M. Huang, A. García, A. Hernández and H. Song. 2007. Prediction of soil macronutrients content using near-infrared spectroscopy. Computers and Electronics in Agriculture 58(2): 144–153.
Huang, Z., B.J. Turner, S.J. Dury, I.R. Wallis and W.J. Foley. 2004. Estimating foliage nitrogen concentration from HYMAP data using continuum removal analysis. Remote Sensing of Environment 93(1-2): 18–29.
Jorgensen, N.R. and L.K.Christensen, 2004. Nutrient stress discrimination of N, P, and K deficiencies in barley utilising multi-band reflection at sub-leaf scale. 2004´CIGR International Conference, Beijing, China. [ Links ]
Larrahondo, J.E., F.J. Palau y C. Ramírez. 2001. Espectroscopia de infrarrojo cercano NIR. Principios generales. Determinacion de nitrógeno en tejido foliar de caña de azúcar: calibración y validación del equipo Bran&Luebbe, modelo InfrAlyzer 500. Serie Procesos Industriales No. 1. Centro de Investigación de la Caña de Azúcar de Colombia. Cali, Colombia. [ Links ]
Min, M., W.S. Lee, T.F. Burks, J.D. Jordan, A.W. Schumann, J.K. Schueller and H. Xie. 2008. Design of a hyperspectral nitrogen sensing system for orange leaves. Computers and Electronics in Agriculture 63(2): 215–226.
Mutanga, O. and A.K. Skidmore. 2007. Red edge shift and biochemical content in grass canopies. ISPRS Journal of Photogrammetry and Remote Sensing 62(1): 34–42
Nicolai, B.M., K. Beullens, E. Bobelyn, A. Peirs, W. Saeys, K.I. Theron, J. Lammertyn. 2007. Nondestructive measurement of fruit and vegetable quality by means of NIR spectroscopy: A review. Postharvest Biology and Technology 46(2): 99–118.
Noh, H., Q. Zhang, B. Shin, S. Han and L. Feng. 2006. A neural network model of maize crop nitrogen stress assessment for a multi-spectral imaging sensor. Biosystems Engineering 94(4): 477–485
Osborne, S.L., J.S. Schepers, D.D. Francis and M.R. Schlemmer. 2002. Detection of phosphorus and nitrogen deficiencies in corn using spectral radiance measurements. Agronomy Journal 94(6): 1215-1221. [ Links ]
Roggo, Y., P. Chalus, L. Maurer, C. Lema-Martínez, A. Edmond and N. Jent. 2007. A review of near infrared spectroscopy and chemometrics in pharmaceutical technologies. Journal of Pharmaceutical and Biomedical Analysis 44(3): 683–700.
Veselá, A., A.S. Barros, A. Synytsya, I. Delgadillo, J. Čopíková and M.A. Coimbra. 2007. Infrared spectroscopy and outer product analysis for quantification of fat, nitrogen, and moisture of cocoa powder. Analytica Chimica Acta 601(1): 77–86.
Xie, L., Y. Ying and T. Ying. 2007. Combination and comparison of chemometrics methods for identification of transgenic tomatoes using visible and near-infrared diffuse transmittance technique. Journal of Food Engineering 82(3): 395–401.
Zhao, C., L. Liu, J. Wang, W. Huang, X. Song and C. Li. 2005a. Predicting grain protein content of winter wheat using remote sensing data based on nitrogen status and water stress. International Journal of Applied Earth Observation and Geoinformation 7(1): 1–9.
Zhao, D.H., J.L. Li and J.G. Qi. 2005b. Identification of red and NIR spectral regions and vegetative indices for discrimination of cotton nitrogen stress and growth stage. Computers and Electronics in Agriculture 48(2): 155–169.
Zhao, D., K.R. Reddy, V.G. Kakani and V.R. Reddy. 2005c. Nitrogen deficiency effects on plant growth, leaf photosynthesis, and hyperspectral reflectance properties of sorghum. European Journal of Agronomy 22(4): 391–403.














