Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.62 no.2 Medellín July/Dec. 2009
CARACTERIZACIÓN DE LA MORFOLOGÍA FLORAL DE DOS CULTIVARES DE BERENJENA (Solanum melongena L.) (Solanaceae)
FLORAL MORPHOLOGY CHARACTERIZATION OF TWO CULTIVARS OF EGGPLANT (Solanum melongena L.) (Solanaceae)
Hermes Araméndiz Tatis1; Carlos Cardona Ayala2 y Miguel Espitia Camacho3
1 Profesor Titular. Universidad de Córdoba. Departamento de Ingeniería Agronómica y Desarrollo Rural. Carrera 6 No. 76-103. Montería, Colombia. <haramendiz@hotmail.com>
2 Profesor Titular. Universidad de Córdoba. Departamento de Ingeniería Agronómica y Desarrollo Rural. Carrera 6 No. 76-103. Montería, Colombia. <cardona@unicordoba.edu.co>
3 Profesor Titular. Universidad de Córdoba. Departamento de Ingeniería Agronómica y Desarrollo Rural. Carrera 6 No. 76-103. Montería, Colombia. <mespitia@unicordoba.edu.co>
Recibido: Septiembre 5 de 2008; Aceptado: Octubre 13 de 2009
Resumen. La berenjena es una especie perteneciente al género Solanum, de gran importancia en la horticultura del Caribe colombiano. El estudio tuvo como objetivo describir la morfología floral de dos cultivares de berenjena “Long Purple” y “Criolla Lila”, que tienen origen geográfico diferente, utilizando para ello, una muestra aleatoria de 100 cojines florales por cultivar. Se estimaron la media, rango, varianza, desviación estándar, coeficiente de variación y se aplicó la prueba t, para determinar diferencias entre los dos cultivares. Los resultados indicaron que el cultivar “Long Purple”, presenta flores distílicas, en tanto que en el “Criollo Lila” se observó la presencia de tristilia. El potencial de producción de frutos, fue del 76,5% y 57,52%, para el “Criollo Lila” y “Long Purple”, respectivamente. Las flores brevistílicas en ambos cultivares, incrementan la aptitud masculina y por ende un desbalance entre las flores con funcionamiento masculino y hermafrodita.
Palabras claves: Heterostília, estructura floral, comportamiento sexual.
Abstract. The eggplant is a specie of genus Solanum, of great importance in horticulture of colombian Caribbean region. The objective of study was to describe the floral morphology of two cultivars of eggplant “Long Purple” and “Lilac land race”, which have different geographic origin. We used a random sample of 100 floral cushions for cultivar. The mean, range, variance, standard deviation, variation coefficient were estimated. The t-test was applied to determine differences between two cultivars. The results indicated that genotype ‘Long Purple’, showed distylics flowers, while in the “Lilac land race” was observed the presence of tristylics flowers. The potential for production of fruit was 76.50% and 57.52% for the “Lilac land race” and “Long Purple”, respectively. Brevistylics flowers in the two cultivars, increased male fitness and thus produced a nonbalance on functioning between male and hermaphrodite flowers.
Key words: Heterostyle, floral structure, sexual behavior.
La berenjena (Solanum melongena L.) es la Solanácea hortícola de mayor importancia en el Caribe colombiano, después del ají y el tomate; originaria de las áreas tropicales del oriente, cultivada desde hace más de 4.000 años por los chinos y árabes (Prohens et al., 2005); siendo su centro de diversidad genética India e Indochina (Sękara et al., 2007). Posee importancia económica y social en la cultura Sinuana, ya que fue introducida por los árabes en el siglo XIX; que con sus costumbres, tradiciones y diversidad cultural, contribuyeron al enriquecimiento de la base alimentaria de ésta región del país (Araméndiz et al., 2006).
La mayoría de las plantas que florecen son hermafroditas, pero un 6% son dioicas, es decir tienen la parte masculina separada de la femenina (Renner y Ricklefs, 1995). Factores ecológicos como precipitación, suelos, polinizadores, densidad de población, etc. (Norman et al., 1997; Elle, 1999) y genéticos basados en la diferencia de las características florales, inciden en el porcentaje de polinización cruzada (Vrieling et al., 1997; Elle, 1999). El porcentaje de polinización cruzada en la Solanácea Datura stramonium L., está influenciado por la separación de las anteras de los estigmas, que es una característica hereditaria (Motten y Stone, 2000). Diferencias morfológicas asociadas a estas características, pueden conducir al desarrollo de genotipos que difieren en su endogamia, con potenciales implicaciones evolutivas en los sistemas de apareamiento (Lloyd, 1975; Charlesworth y Charlesworth, 1978; Uyenoyama et al., 1993).
En especies autógamas, la polinización por insectos puede conducir a un mayor porcentaje de polinización cruzada con respecto a la polinización por el viento, especialmente en plantas individuales cuando están bastante dispersas (Regal, 1982). Cuando la polinización es por el viento, la concentración de polen disminuye rápidamente con la distancia de separación, reduciendo la autogamia; en contraste, los insectos polinizadores pueden volar grandes distancias y llevar en su cuerpo grandes cantidades de polen directamente al estigma (Lemen, 1980; Regal, 1982).
El conocimiento de la estructura floral y de la biología reproductiva de una especie, es básico para el mejorador de plantas, con el fin de desarrollar las técnicas de emasculación e hibridación como estrategia de control de la polinización. De acuerdo a Gomes et al. (2001), el rápido progreso logrado en el mejoramiento genético de plantas, obedece al estudio de los procesos reproductivos que ocurren en las flores.
La heterostilia es un polimorfismo floral controlado genéticamente, caracterizado por la presencia de dos o tres morfologías florales: distilia y tristilia, en las cuales se presentan variaciones en la longitud del estilo y filamentos, tamaño y producción de granos de polen y tamaño de las papilas estigmáticas; lo cual es típico de las Solanaceas y Rubiaceas (Kohn y Barret, 1992; Motten y Stone, 2000; Teixeira y Machado, 2004).
El control genético de la tristilia esta asociado a dos genes ligados o no ligados, cada uno con dos alelos (Lewis y Jones, 1992), lo que conduce a tres tipos de morfos en las poblaciones (Charlesworth y Charlesworth, 1978). En las especies distílicas dos morfos se presentan en las poblaciones y se presenta en 25 familias que florecen (Barrett, 1992) y la tristilia en menos de seis familias que florecen (Barrett, 1993; Thompson et al., 1996). Sin embargo, el modelo de mayor peso en la explicación de la heterostilia, se fundamenta en lo expuesto por LLoyd y Webb (1992a, 1992b), quienes proponen que el estado inicial es autocompatible y con separación de anteras y estigma en hercogamia de aproximación (estigma a mayor altura que anteras). La fuerza selectiva causó un aumento de eficacia en la transferencia de polen y el siguiente paso fue la aparición de dimorfismo estilar: hay dos longitudes de estilo, pero la altura de las anteras virtualmente no varía. Este estadio debe ser inestable y, por tanto, raro en la naturaleza, debiendo conducir a la hercogamia recíproca o heterostilia por el incremento y disminución de la altura de los estambres.
En razón al alto porcentaje de polinización cruzada natural de la berenjena en el Caribe colombiano, se planteó conocer la morfología floral de dos cultivares de berenjena de origen geográfico diferente, para usar este conocimiento en futuras investigaciones sobre esta especie.
MATERIALES Y MÉTODOS
El estudio se realizó en el área experimental de la Universidad de Córdoba (Montería-Colombia), ubicada a una altura de 13 msnm. Sus coordenadas geográficas corresponden a los 8° 44’ de latitud norte y 75° 53’ latitud oeste, respecto al meridiano de Greenwich. La zona de vida a la cual corresponde la ciudad de Montería, se denomina bosque seco tropical (bs-T), según la clasificación de Holdridge (1967), con precipitación anual de 1.346,1 mm, temperatura media del aire de 27,4 °C, humedad relativa de 84% y brillo solar anual de 2.108,2 horas (Palencia et al., 2006).
Para el conocimiento de la morfología y biología floral, se utilizaron los cultivares “Long Purple” y “Criollo Lila”, de origen americano y nacional, respectivamente, que son los de mayor demanda en los sistemas de producción del Caribe colombiano y se tomaron como base los conceptos de Hill et al. (1967) así como los de Arias y Guzmán (1995).
En la fase de floración se colectaron al azar durante todo el ciclo de los cultivares, 100 cojines florales de cada uno de ellos. Con la ayuda del estereoscopio, se contó el número de flores por cojín floral y su respectivo sexo en cada genotipo. En el laboratorio, con la ayuda de un vernier cuando fue necesario, se registraron los siguientes parámetros florales: homostília; heterostília; número y estado libre de pétalos y sépalos; diámetro de la corola; longitud externa (desde la inserción del pedúnculo al tallo hasta el ápice de un pétalo); longitud interna de la flor (desde la base de la corola hasta el punto de separación de los sépalos); estambres (número, inserción, color, longitud, forma de las anteras, clasificación según su número y disposición en comparación con el periantio, y estado libre o soldado de las anteras); pistilo (longitud, color y forma del estigma; color y longitud del estilo; número de lóculos (a partir de cortes transversales); placentación y tamaño del ovario (diámetro y longitud).
Las observaciones realizadas sobre la morfología floral se describieron por la media, rango, varianza, desviación estándar, coeficiente de variación y aplicación de la prueba t, para la estimación de la diferencia de dos medias y así, establecer criterios básicos en la identificación de los dos cultivares.
RESULTADOS Y DISCUSIÓN
Los cultivares de berenjena presentaron flores solitarias o en cojines florales con un número variable de flores, perfectas, actinomorfas o ligeramente zigomorfas, hermafroditas con variación heteromórfica, en cuanto a la posición del estigma y anteras, presentándose flores distílicas y tristílicas, que facilitan la alogamia, por ser un polimorfismo floral controlado genéticamente (Pailler y Thompson, 1997; Motten y Stone, 2000; Teixeira y Machado, 2004) y típico en 25 familias, entre ellas la Solanácea (Barrett, 1993; Thompson et al., 1996), lo que repercute en el valor adaptativo de los genotipos dentro de una población. Las flores brevistílicas son pequeñas, de comportamiento masculino, presentes ante todo en los cojines florales, lo cual es usual en las especies andromonoicas (Elle, 1998 ,1999) y representa un mecanismo para maximizar los recursos asignados a las funciones reproductivas (Diggle, 1993).
El cultivar “Long Purple” presenta distília es decir, flores con estilos largos y estambres cortos, llamadas longistílicas y flores con estilo corto y estambres, largos, llamados brevistílicas. El porcentaje de flores con longistília y brevistília es de 57,52 y 42,48%, respectivamente (Tabla 1). Estos valores se aproximan a lo encontrado por Bezerra y Machado (2003), en otra especie del mismo género, la Solanum stramonifolium Jacq; con un 62% del tipo longistílica. De otra parte, el cultivar “Criollo Lila” presentó tristília, es decir población de flores de tipo longistília, homostília (flores de estilos con estigmas a igual nivel de los poros de los estambres) y brevistília, con 37,87%, 38,63% y 23,50%, respectivamente (Tabla 1). Estas morfologías diferentes conducen a un conflicto reproductivo dentro de la población, por diferencia de fecundidad entre dichos morfos (Contreras y Ornelas, 1999; Coelho y Barbosa, 2004) y ocurre en plantas donde el número óptimo de flores funcionalmente estaminadas, es mayor que el número de flores que puede producir frutos y el costo de madurar un fruto es alto (Hokche y Ramírez, 2006).
Tabla 1. Porcentaje de tipos florales y frutos potenciales en los cultivares de berenjena “Long Purple” y “Criollo Lila”.
Como un aporte de estos resultados al mejoramiento genético de la especie, el énfasis o presión de selección sobre morfos de tipo longistílico, favorecería el incremento en la producción de frutos y por ende en el avance del mejoramiento genético hacia cultivares más eficientes fisiológicamente.
Motten y Stone (2000), señalaron que la posición del estigma incide en el porcentaje de polinización cruzada y este valor se incrementa en la medida que la diferencia es mucho más notoria, destacando que existe una correlación positiva entre la separación de las anteras–estigma y el porcentaje de polinización cruzada. Resultados similares han sido encontrados en otras Solánaceas como Nicotiana tabacum L. (Breese, 1959); Lycopersicon pimpinellifolium L. (Rick et al., 1978) y Datura stramonium L. (Motten y Stone, 2000) y en la familia Amarilladaceae en el genero Narcissus (Arroyo y Barrett, 2000).
El potencial de frutos formados por el cultivar “Criollo Lila” corresponde a un 76,5% y es mayor al del genotipo “Long Purple” que registró 57,52%, ya que los ovarios de flores longistílicas son fértiles; mientras que las flores brevistílicas son estériles (Tabla 1) como lo sostienen Rylski et al. (1984) y corroboran Hokche y Ramírez (2006), quienes anotan que las flores de estilo corto son masculinas y las de estilo largo, hermafroditas. De igual manera, acusan presencia de papilas estigmáticas poco desarrolladas y de bajo contenido de azúcar (Rylski et al., 1984), de tamaño reducido, con pistilos no funcionales e incapaces de formar frutos (Solomon, 1986). Esta diferencia de fecundidad, además de ser observada en berenjena (Rylski et al., 1984), también ha sido encontrada en otras especies del género Villarsia (Ornduff, 1986) y en Primula sieboldii E. Morren (Washitani et al., 1994).
En la Tabla 2, se aprecia que existen diferencias significativas entre las medias de los cultivares para el número de flores por cojín floral, siendo superior este valor en cultivar mejorado. Los cojines florales del cultivar “Long Purple” están constituidos por 2 ó 3 flores, con un promedio de 2,10 ± 0,10 y un coeficiente de variación muy bajo, de 5%; estos cojines presentan longistília en la primera flor y brevistília en las siguientes, que hace a estas últimas funcionalmente masculinas, según lo mencionan Forni–Martins et al. (1998) así como Bezerra y Machado (2003). Esta situación permite incrementar la aptitud masculina por medio de la donación de polen y por ende, la asignación de recursos para la producción de flores masculinas y hermafroditas no es igual.
Tabla 2. Valores medios, medidas de dispersión y prueba de t en componentes de la estructura floral de los cultivares de berenjena “Long Purple” y “Criollo Lila”.
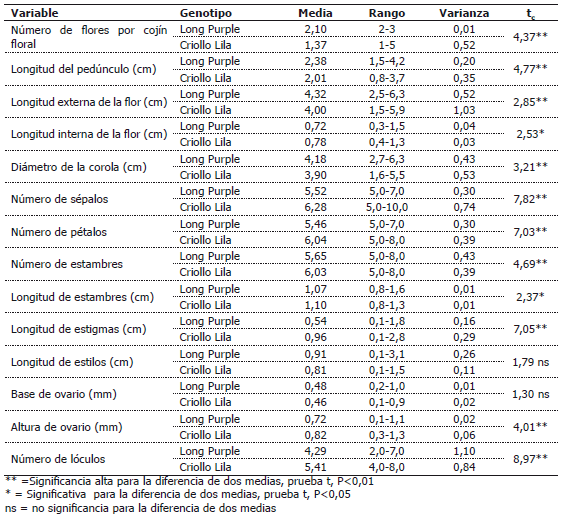
En los cojines florales del cultivar “Criollo Lila” las flores fluctúan de 1 a 5, con valores medios de 1,37 ± 0,72 y un coeficiente de variación de 52,86% (Tabla 2), característica muy variable en este cultivar. En cuanto a amplitud de variación, estos resultados concuerdan con Jaramillo y Lobo (1977) quienes indican que la berenjena, sin hacer referencia al cultivar, presenta flores solitarias y cojines florales que poseen de 2 a 5 flores. Elle (1999) observó para Solanum carolinense L. que el número de flores tiene heredabilidad entre el 15 y 20% y la proporción de flores masculinas entre el 28 y 42%, por lo que la selección por menor cantidad de flores brevistílicas, permite disponer de una mayor cantidad de recursos para la producción de semillas y frutos.
Las flores del cultivar “Long Purple” poseen un pedúnculo de longitud media de 2,38 ± 0,44 cm, con rango de 1,53 a 4,2 cm, mientras que en el cultivar “Criollo Lila” el pedúnculo tiene longitud media de 2,01 ± 0,59 cm y oscila de 0,81 a 6,65 cm. La prueba de t entre las medias de los cultivares acuso diferencias altamente significativas, siendo superior en el mejorado, lo que representa una ventaja agronómica al momento de la cosecha (Tabla 2). Las variaciones en la longitud del pedúnculo oscilan entre 18,84% a 29,58% en las dos poblaciones, respectivamente, con la presencia de flores brevistílicas con pedúnculos de menor longitud que en flores longistílicas y homostílicas. El pedúnculo a medida que avanza el desarrollo del botón floral, tiende a disponerse en forma pendular.
Las longitudes externa e interna medias de las flores del cultivar “Long Purple” son de 4,32 ± 0,72 cm y 0,72 ± 0,20 mm, respectivamente. Así mismo, en el cultivar “Criollo Lila” la longitud externa e interna media de las flores es de 4,00 ± 1,00 y 0,78 ± 0,18 cm, respectivamente. La comparación de medias a través de la prueba t, arrojó diferencias significativas al 1% y 5%, respectivamente. La variación es mayor de 16% en las dos poblaciones debido a que las flores brevistílicas poseen menor longitud externa e interna que las flores longistílicas y homostílicas.
El perianto es actinomorfo, es decir, presenta varios planos de simetría. Los sépalos son de color verde, unidos y soldados; en el cultivar “Long Purple” varían de 5 a 7 en número, con valores medios de 5,52±0,55 y con un coeficiente de variación bajo, de 9,98%, mientras en el cultivar “Criollo Lila” oscilan de 5 a 10, con valores medios de 6,28 ± 0,86 y coeficiente de variación de 13,68%. La prueba de t para la diferencia entre las dos medias, acusó diferencias altamente significativas entre los dos cultivares (Tabla 2). Al respecto, Jaramillo y Lobo (1977) anotan que el número de éstos es muy variable, con un papel importante de protección (Diggle y Millar, 2004), atrayente de polinizadores (Bell, 1985), y para optimizar la distribución de la función masculina y femenina (Miller y Venable, 2003).
La corola es gamopétala, de color violáceo en ambos cultivares; en el cultivar “Long Purple” los pétalos oscilan de 5 a 7 en número, en promedio 5,46 ± 0,55 y coeficiente de variación de 10,09%, mientras que en el cultivar “Criollo Lila” fluctúan de 5 a 8, con valores medios de 6,04 ± 0,62 y coeficiente de variación de 10,29%. Diferencia altamente significativa, fue encontrada entre los cultivares, con una media superior en “Criollo Lila”, lo que habilita para el cumplimiento de la función vexilar mas efectiva (Tabla 2). Jaramillo y Lobo (1977), afirman que las flores de berenjena poseen 5 pétalos, lo que difiere de la fluctuación encontrada en esta investigación.
Morgan y Schoen (1997), expresan que la variación en los pétalos, tiene influencia en el éxito reproductivo, ya que sirven para atraer polinizadores, conllevando a un incremento en la remoción y transporte del polen y benefician la función femenina, por incremento en la cantidad y diversidad genética del polen recibido (Zimmermanand y Pyke, 1988), lo que torna al cultivar “Criollo Lila”, mucho más vulnerable a la polinización cruzada, por poseer pétalos vistosos, que asociados con el color amarillo intenso de las anteras, son llamativos a insectos polinizadores, especialmente del género Trigona y Apis (Araméndiz et al., 2006).
La corola tiene forma rotácea, el diámetro medio en el cultivar “Long Purple” es de 4,18 ± 0,65 cm, con valores mínimos y máximos que oscilan de 2,71 a 6,31 cm y un coeficiente de variación de 15,74%. En el cultivar “Criollo Lila” el diámetro medio es de 3,93 ± 0,72 cm, con valores máximos y mínimos que fluctúan de 1,6 a 5,5 cm y un coeficiente de variación de 18,48%. Las medias de los cultivares para este carácter, resultaron diferentes estadísticamente, siendo superior en el genotipo mejorado (Tabla 2). El coeficiente de variación en las dos poblaciones es mayor del 15%, explicado en parte, por la presencia de flores brevistílicas cuyas corolas presentan diámetro medio menor que el de los otros tipos de flores (Tablas 3 y 4). No obstante, los valores del diámetro de la corola se encuentran cercanos a los manifestados por Jaramillo y Lobo (1977), quienes observaron de 4 a 5 cm. Esta variación, obedece a que se consideraron conjuntamente las flores hermafroditas con las estaminadas, ya que las primeras poseen mayor tamaño de la corola (Diggle y Miller, 2004) y ello, afecta la polinización cruzada (Anderson y Symon, 1989).
Tabla 3. Valores medios de diámetro de la corola, longitud de estambres, longitud de estilos, longitud de estigmas, base y altura del ovario de flores del cultivar de berenjena “Long Purple”, en dos diferentes tipos de flor.
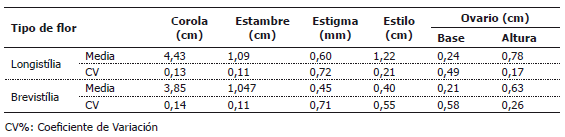
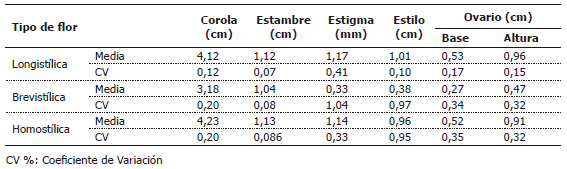
Tabla 4. Valores medios de diámetro de la corola, longitud de estambres, longitud de estilo, longitud de estigma, base y altura del ovario de flores del cultivar de berenjena “Criollo Lila”, en tres diferentes tipos de flor.
El androceo está constituido por estambres libres e insertados en la corola, de color amarillo intenso y vistosos, las anteras son de forma basifija con dehiscencia poricida, que según Bezerra y Machado (2003), es característica de varias especies de la familia Solanácea, en especial del género Solanum que restringe la liberación vibrátil de polen a algunos insectos polinizadores. Las anteras se encuentran dispuestas alrededor del gineceo, formando un cono en una sola serie y alternas entre los pétalos, como lo establecen Forni–Martins et al. (1998) y Bezerra y Machado (2003).
En los dos cultivares el número de estambres fluctúa de 5 a 8; el cultivar “Long Purple”, presenta una media de 5,65 ± 0,65 y un coeficiente de variación de 11,63%; la longitud media de estambres, es de 1,07 ± 0,11 cm, oscila de 0,78 a 1,6 cm y presenta un coeficiente de variación de 11,08%; mientras que en el cultivar “Criollo Lila” el número de estambres es de 6,03 ± 0,62, y un coeficiente de variación de 10,43%; la longitud media de los estambres es de 1,10 ± 0,10 cm, con una fluctuación de 0,8 a 1,34 cm y un coeficiente de variación de 9,06%; la prueba de t registró diferencias significativas entre las medias para los dos caracteres (Tabla 2).
La fluctuación del número de estambres en las dos poblaciones, es menor que la encontrada por Jaramillo y Lobo (1977), que anotan 5 a 10 estambres. Buchmann (1983), mencionó que en especies con anteras porícidas, la polinización es realizada por abejas durante la colecta de polen, lo cual es conocido como polinización por vibración y ello explica, el comportamiento prevalentemente alógama de esta especie, en el valle del Sinú. De igual manera, el color amarillo de los estambres, contribuye a incrementar la visita de polinizadores, ya que mayor cantidad de polen, puede ser depositada en plantas vecinas (Jones y Cruzan, 1999).
El gineceo está constituido por un estigma capitado, de color verde; en el cultivar “Long Purple” su longitud oscila de 0,1 a 1,8 mm con 0,54 ± 0,40 mm, en promedio, y un coeficiente de variación de 74,84%, mientras que en el cultivar “Criollo Lila” la longitud fluctúa de 0,1 a 2,8 mm con un valor medio de 0,96 ± 0,54 mm y un coeficiente de variación de 56,93%. La prueba de medias entre los dos cultivares mostró diferencia altamente significativa, con superioridad del material no mejorado, lo cual posibilita la selección de flores con mayor ventaja para la polinización y fecundación (Tabla 2). La variación es mayor en el cultivar Long Purple por la presencia de un mayor porcentaje de flores brevistílicas.
El estilo es soldado, de color verde y varía proporcionalmente con el número de lóculos del ovario; en el genotipo “Long Purple” la longitud media es de 0,91 ± 0,51 cm con valores que oscilan de 0,14 a 3,1 cm y un coeficiente de variación de 55,93%; así mismo, en el genotipo “Criollo Lila”, la longitud media es de 0,84 ± 0,34 cm con valores medios que fluctúan de 0,06 a 1,5 cm y un coeficiente de variación de 40,35%. No se encontró diferencia significativa entre las dos medias, como resultado de la prueba de t, para esta característica (Tabla 2). La variación es mayor en el “Long Purple” por la presencia de flores con brevistília en mayor porcentaje.
El ovario es súpero, de color blanco, con numerosos óvulos, dispuestos en placentación axial. En el cultivar “Long Purple” posee de 2 a 7 lóculos, promedio de 4,29 ± 1,05 y un coeficiente de variación de 24,5%, la base y altura media de 0,48 ± 0,12 y 0,72 ± 0,16 cm, respectivamente. El número de lóculos, altura y base del ovario, presentan coeficientes de variación alrededor del 20%. El cultivar “Criollo Lila” presenta una fluctuación, en el número de lóculos, de 4 a 8, en promedio 5,41 ± 0,91, con base y altura media de 0,46 ± 0,15 y 0,82 ± 0,24 cm, respectivamente; la base y altura del ovario varían similarmente (Tabla 2). Con excepción de la base del ovario, la altura del ovario y número de lóculos fue estadísticamente diferente en ambos cultivares (P<0,01). Miller y Diggle (2007), señalan que este comportamiento esta asociado a cambios en la expresión sexual de las especies andromonóicas.
En los cultivares “Criollo Lila” y “Long Purple” (Tablas 3 y 4), las flores longistílicas poseen corolas de mayor diámetro, con pistilos más grandes que las flores brevistílicas. En el cultivar “Long Purple” las flores brevistílicas y longistílicas poseen estambres con longitudes similares, mientras que en el cultivar “Criollo Lila”, los estambres de flores homostílicas y longistílicas poseen longitudes similares, pero mayores que en flores brevistílicas. Lo encontrado en esta investigación, difiere en parte con lo hallado por Forni-Martins et al. (1998), en Solanum paniculatum L., en la que las flores longistílicas y brevistílicas de dos poblaciones presentaban longitudes similares. No obstante, en concordancia con lo encontrado en el presente estudio, Bezerra y Machado (2003), mencionaron que la producción de flores pequeñas puede ser una estrategia del género Solanum para atraer pequeñas abejas vibradoras que polinizan otras especies simpátricas del género y de distinta configuración, por ser las abejas más eficientes en estas flores, debido a la reducción de la distancia entre el estigma y la antera, abrazando directamente todo el cono estaminal con su corto tórax. Sin embargo, en este trabajo, las flores brevistílicas al no presentar fertilidad femenina, funcionan como masculinas, aportando polen que es transportado por las abejas hacia flores longistílicas y homostílicas. Weller et al. (2007) indican que en este tipo de poblaciones, es posible la selección contra el alelo que controla la expresión de este tipo de morfo.
CONCLUSIONES
Existe variación en la morfología floral de los cultivares “Long Purple” y “Criollo Lila” que afecta, de manera diferencial, el proceso de polinización-fecundación y, potencialmente la formación de frutos.
La heterostília se expresa, en el cultivar “Long Purple”, con la presencia de flores longistílicas y brevistílicas, mientras que en el cultivar “Criollo Lila”, el polimorfismo floral está representado por flores longistílicas, homostílicas y brevistílicas.
La mayor variación en los caracteres morfológicos, se encontró en el cultivar “Criollo Lila”, lo cual abre las posibilidades de selección de plantas con atributos morfológicos asociados con productividad.
Las flores brevistílicas son de menor tamaño que las longistílicas y homostílicas y actúan sólo como fuente proveedora de polen.
BIBLIOGRAFÍA
Anderson, G.J. and D.E. Symon. 1989. Functional dioecy and andromonoecy in Solanum. Evolution 43(1): 204–219.
Araméndiz, H., C. Cardona, J. Robles, C. Fernández y H. Hernández. 2006. Polinización cruzada natural en berenjena (Solanum melongena L.). Fitotecnia Colombiana 6 (1): 59-66. [ Links ]
Arias, J. y E. Guzmán. 1995. Morfología externa de los órganos vegetativos y reproductivos de las plantas superiores. Serie de Módulos de Botánica General. Universidad de Córdoba. 101 p. [ Links ]
Arroyo, J. and S.C. Barrett. 2000. Discovery of distyly in Narcissus (Amaryllidaceae). American Journal of Botany 87 (5):748-751. [ Links ]
Barrett, S.C.H. 1992. Evolution and function of heterostyly. Springer-Verlag, Berlin, Germany. 279 p. [ Links ]
Barrett, S.C.H. 1993. The evolutionary biology of tristyly. pp. 283–326. In: Futuyama, D. and J. Antonovics (eds.). Oxford Surveys in Evolutionary Biology. Volume 9.
Bell, G. 1985. On the function of flowers. Proceedings of the Royal Society of London. Series B, Biological Sciences 224: 223–265.
Bezerra, E. and I. Machado. 2003. Floral biology and pollination system of Solanum stramonifolium Jacq. (Solanaceae) in Atlantic forest renmant remnot in Pernambuco. Revista Botánica Brasileira 17(2): 247-257. [ Links ]
Breese, E.L. 1959. Selection for differing degrees of out-breeding in Nicotiana rustica. Annals of Botany 23 (2): 331–344
Buchmann, S.L. 1983. Buzz pollination in Angiosperms. pp. 73-113. In: C.E. Jones and R.J. Little (eds.). Handbook of Experimental Pollination Biology. Van Nostrand and Reinhold, New York. 275 p. [ Links ]
Charlesworth, B. and D. Charlesworth. 1978. A model for the evolution of dioecy and gynodioecy. American Naturalist 112(988): 975–997.
Coelho, C.P. e A.A. Barbosa. 2004. Biología reprodutiva de Psychotria poeppigiana Mull. Arg. (Rubiaceae) em mata de galeria. Acta Botanica Brasileira 18(3): 481-489. [ Links ]
Contreras, P.S. and J.F. Ornelas. 1999. Reproductive conflicts of Palicourea padifolia (Rubiaceae) a distylous shrub of a tropical cloud forest in Mexico. Plant Systematics and Evolution 219(3-4): 225-241. [ Links ]
Diggle, P.K. and J.S. Miller. 2004. Architectural effects mimic floral sexual dimorphism in Solanum (Solanaceae). Amercian Journal of Botany 91(12): 2030-2040. [ Links ]
Diggle, P.K. 1993. Developmental plasticity, genetic variation, and the evolution of andromonoecy in Solanum hirtum (Solanaceae). Amercian Journal of Botany 80(8): 967-973. [ Links ]
Elle, E. 1999. Sex allocation and reproductive success in the andromonoecious perennial Solanum carolinense (Solanaceae). I. Female success. American Journal of Botany 86(2): 278-286. [ Links ]
Elle, E. 1998. The quantitative genetics of sex allocation in the andromonoecious perennial, Solanum carolinense L. Heredity 80(4): 481–488.
Forni–Martins, E.R., M.C. Marques e M. Lemes. 1998. Biología floral e reprodução de Solanum paniculatum L. (Solanaceae) no estado de São Paulo, Brasil. Revista Brasileira de Botánica 21(2): 117-124.
Gomes, J.E., M.C. Pavani, D. Perecin e A.B. Martins. 2001. Morfologia floral e biologia reprodutiva de genótipos de aceroleira. Scientia Agrícola
58(3): 519-523.
Hill, J.B., L.O. Overholts, H. Pop and J.A. Grove. 1967. Tratado de botánica. Segunda edición. Ediciones Omega S.A., Barcelona. 747 p. [ Links ]
Hokche, D.O. y N. Ramírez. 2006. Biología reproductiva y asignación de biomasa en Solanum gardneri Sendth (Solanaceae): una especie andromonoica. Acta Botánica Venezolana 29(1):69-88. [ Links ]
Holdridge, L.R. 1967. Ecología basada en zonas de vida. Primera edición. Instituto Interamericano de Ciencias Agrícolas, San José, Costa Rica. 216 p. [ Links ]
Jaramillo, J. y M. Lobo. 1977. Hortalizas: Manual de Asistencia Técnica No. 28. pp. 145-163. Primera edición. Ministerio de Agricultura, ICA. [ Links ]
Jones, E. and M. Cruzan. 1999. Floral morphological changes and reproductive success in deer weed (Lotus scoparius) Fabaceae. American Journal of Botany 86(2): 273-277. [ Links ]
Kohn, J.R. and S.C. Barret. 1992. Experimental studies on the functional significance of heterostyly. Evolution 46(1):43-55. [ Links ]
Lloyd, D.G. 1975. The maintenance of gynodioecy and androdioecy in angiosperms. Genetica 45 (3): 325–339.
Lloyd, D.G. and C.J. Webb. 1992a. The evolution of heterostyly. pp. 151-178. In: Barrett, S.C.H. (ed.). Evolution and function of heterostyly. Springer-Verlag, Berlin, Germany. [ Links ]
Lloyd, D.G. and. C.J. Webb. 1992b. The selection of heterostyly. pp. 179-207. In: Barrett, S.C.H. (ed.). Evolution and function of heterostyly. Springer-Verlag, Berlin, Germany. [ Links ]
Lemen, C. 1980. Allocation of reproductive effort to the male and female strategies in wind-pollinated plants. Oecologia 45 (2): 156–159.
Lewis, D. and D.A. Jones. 1992. The genetics of heterostyly. pp. 129–150. In: Barrett, S.C.H. (ed.). Evolution and function of heterostyly. Springer-Verlag, Berlin, Germany.
Miller, J.S. and D.L. Venable. 2003. Floral morphometrics and the evolution of sexual dimorphism in Lycium (Solanaceae). Evolution 57(1): 74–86.
Miller, J.S. and P.K. Diggle. 2007. Correlated evolution of fruit size and sexual expression in andromonoecious Solanum sections, Acanthophora and Lasiocarpa (Solanaceae). American Journal of Botany 94(10): 1706-1715. [ Links ]
Morgan, M.T. and D.J. Schoen. 1997. Selection on reproductive characters: floral morphology in Asclepias syriaca. Heredity 79(4): 433–441.
Motten, A.F. and J.L. Stone. 2000. Heritability of stigma position and the effect of stigma-anther separation on outcrossing in a predominantly self-fertilizing weed, Datura stramonium (Solanaceae). American Journal of Botany 87(3): 339-347. [ Links ]
Norman, J.K., S.G. Weller and A.K. Sakai. 1997. Pollination biology and outcrossing rates in hermaphroditic Schiedea lydgatei (caryophyllaceae). American Journal of Botany 84(5): 641–648.
Ornduff, R. 1986. Comparative fecundity and population composition of heterostylous and non-heterostylous species of Villarsia (Menyanthaceae) in western Australia. American Journal of Botany 73(2): 282-286. [ Links ]
Pailler, T. and J.D. Thompson. 1997. Distyly and variation in heteromorphic incompatibility in Gaertnera vaginata (rubiaceae) endemic to La Reunion island. American Journal of Botany 84(3): 315–327.
Palencia, G., T. Mercado y E. Combatt. 2006. Estudio agrometeorológico del departamento de Córdoba. Facultad de Ciencias Agrícolas. Universidad de Córdoba. Gráficas del Caribe. 126 p. [ Links ]
Prohens, J., J.M. Blanca and F. Nuez. 2005. Morphological and molecular variation in a collection of eggplants from a secondary center of diversity: Implications for conservation and breeding. Journal of the American Society for Horticultural Science 130(1): 54-63. [ Links ]
Regal, P.J. 1982. Pollination by wind and animals: ecology of geographic patterns. Annual Review of Ecology and Systematics 13: 497–524.
Renner, S.S. and R.E. Ricklefs. 1995. Dioecy and its correlates in the flowering plants. American Journal of Botany 82(5): 596–606.
Rick, C.M., M. Holle and R.W. Thorp. 1978. Rates of cross-pollination in Lycopersicon pimpinellifolium: impact of genetic variation in floral characters. Plant Systematics and Evolution 129(1-2): 31–44.
Rylski, I., J. Nothmann and L. Arcan.1984. Differential fertility in short-styled eggplant flowers. Scientia Horticulturae 22(1-2): 39-46. [ Links ]
Sękara, A., S. Cebula and E. Kunicki. 2007. Cultivated eggplants–origin, breeding, objectives and genetic resources, a review. Folia Horticulturae 19(1): 97-114.
Solomon, B.P. 1986 Sexual allocation and andromonoecy: resource investment in male and hermaphrodite flowers of Solanum carolinense (Solanaceae). American Journal of Botany 73(8): 1215–1221.
Teixeira L. e I.C. Machado. 2004. Sabicea cinerea Aubl. (Rubiaceae): distilia e polinização em um frasgmento de floresta Atlântica em Pernambuco, Nordeste do Brasil. Revista Brasileira de Botánica 27(1): 193-204. [ Links ]
Thompson, J.D., T. Pailler, D. Strasberg and D. Manicacci. 1996. Tristyly in the endangered Mascarene island endemic Hugonia serrata (Linaceae). American Journal of Botany 83(9): 1160–1167.
Uyenoyama, M.K., K.E. Holsinger and D.M. Waller. 1993. Ecological and genetic factors directing the evolution of self-fertilization. pp. 327–381. In: Futuyma, D.J. and J. Antonovics (eds.). Oxford Surveys in Evolutionary Biology. Oxford University Press. Oxford, UK. 442 p.
Vrieling, K., P. Saumitou-Laprade, E. Meelis and J.T. Epplen. 1997. Multilocus DNA fingerprints in the plant Cynoglossum officinale L. and their use in the estimation of selfing. Molecular Ecology 6(6): 587–593.
Washitani, I., R. Osawa, H. Namai and M. Niwa. 1994. Paterns of female fertility in heterostylous Primula sieboldii under severe pollinator limitation. Journal of Ecology 82(3): 571-579. [ Links ]
Weller, S.G., C.A. Domínguez, F.E. Molina-Freaner, J. Fornoni and G. Lebuhn. 2007. The evolution of distyly from tristyly in populations of Oxalis alpina (Oxalidaceae) in the Sky islands of the Sonoran Desert. American Journal of Botany 94(6): 972-985. [ Links ]
Zimmermanand, M. and G.H. Pyke. 1988. Reproduction in Polemonium: assessing the factors limiting seed set. American Naturalist 131(5): 723–738.














