Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.63 no.1 Medellín Jan./June 2010
ASPECTOS ANATÓMICOS DEL DESARROLLO DEL FRUTO DE FEIJOA [ACCA SELLOWIANA (O.BERG) BURRET]
ANATOMICAL ASPECTS OF DEVELOPMENT OF PINEAPPLE GUAVA FRUIT [ACCA SELLOWIANA (O.BERG) BURRET]
Mariela Rodríguez1; Harvey Arjona2; Gerhard Fischer3; Hector Campos4 y Martha Chaparro de Valencia5
1 Profesora Ocasional. Universidad Nacional de Colombia, Sede Bogotá. Facultad de Agronomía. Carrera 45 No. 26-85, Edificio 500. Bogotá, Colombia. <mrodriguezs@unal.edu.co>
2 Profesor Asociado. Universidad Nacional de Colombia, Sede Bogotá. Facultad de Agronomía. Carrera 45 No. 26-85, Edificio 500. Bogotá, Colombia. <hearjonad@unal.edu.co>
3 Profesor Asociado. Universidad Nacional de Colombia, Sede Bogotá. Facultad de Agronomía. Carrera 45 No. 26-85, Edificio 500. Bogotá, Colombia. <gerfischer@gmail.com>
4 Candidato Doctoral. Universidad Nacional de Colombia, Sede Bogotá. Facultad de Ciencias. Departamento de Biología. <hacamposm@unal.edu.co>
5 Profesora Jubilada. Universidad Nacional de Colombia, Sede Bogotá. Facultad de Ciencias. Departamento de Biología.
Recibido: Marzo 16 de 2010; Aceptado: Mayo 6 de 2010
Resumen: Se realizó un estudio anatómico de los frutos de feijoa con el propósito de describir los cambios anatómicos desde capullo floral hasta la madurez fisiológica. Para realizar la descripción, se tomaron muestras de los frutos de diferentes tamaños de los clones 41 (Quimba) y 8-4 las cuales se trataron con técnicas histológicas. Las muestras se fijaron en FAA, después de lo cual se realizó el proceso de inclusión que tiene las etapas de deshidratación, infiltración e inclusión, finalmente, se realizó el corte y montaje con safranina fast-green. Las observaciones mostraron que las células del exocarpio y el endocarpio presentaron multiplicación celular hasta avanzadas etapas del desarrollo. El mesocarpio tuvo un incremento importante en el volumen, debido principalmente a la multiplicación celular en la primera y segunda etapa del desarrollo y, a la expansión celular en la última etapa del desarrollo. Se concluyó que el fruto de feijoa es estable anatómicamente porque los tejidos observados en el capullo floral mantienen su identidad hasta cuando el fruto alcanza la madurez fisiológica. Desde el punto de vista anatómico, el tamaño final del fruto depende de las continuas divisiones celulares que sufren estos tejidos y a la expansión celular en la etapa de llenado del fruto. Con las observaciones microscópicas se concluyó que el exocarpio del fruto está conformado por la epidermis externa y la hipodermis; el mesocarpio está constituido por numerosas capas de parénquima; el endocarpio está constituido por la epidermis interna y tres o cuatro capas de células subepidérmicas en ambos clones.
Palabras claves: Madurez fisiológica, exocarpio, mesocarpio, endocarpio, Myrtaceae.
Abstract. An anatomical study of feijoa fruits was carried out with the purpose to describe the anatomical changes in the fruit starting from floral bud until the physiological maturity. In order to realize the description, fruit samples of different sizes from clones 41 (Quimba) and 8-4 were taken and histological techniques were applied. The samples were fixed in FAA, after which it was made the inclusion process, it has stages of dehydration, infiltration and inclusion, finally, was made the cut and assembly of the samples with fast- green and safranin. The observations showed that cells of the exocarp and endocarp presented cellular multiplication until advanced stages of development. The mesocarp had an important increment in volume, mainly due to the cellular multiplication at the first and second stages of development and cellular expansion at the last stage of development. One important conclusion was that feijoa fruit is stable anatomically because the tissues observed in the floral bud maintain its identity until when the fruit reaches the physiologic maturity. From the anatomical point of view, the final size of the fruit depends on the continuous cellular multiplications that suffer these tissues and to the cellular expansion in the stage of fruit filling. By microscopic observations it was concluded that the exocarp of the fruit is composed of the outer epidermis and hypodermis, the mesocarp is composed of many layers of parenchyma, the endocarp is formed by the inner epidermis and three or four layers of subepidermal cells in both clones .
Key words: Physiological maturity, exocarp, mesocarp, endocarp, Myrtaceae.
La feijoa [Acca sellowiana (O. Berg) Burret] pertenece a la familia de las Myrtaceae y es originaria del sur del Brasil, Uruguay y las partes altas del lado occidental del Paraguay (Hoffmann et al., 1994). La feijoa es un frutal cultivado en la región andina, con grandes posibilidades de exportación ya que la producción en países como Israel, Italia, Francia, Alemania, España, Estados Unidos y Nueva Zelanda no es constante durante todo el año debido a la presencia de estaciones. Este aspecto le permite a Colombia entrar al mercado europeo en cualquier época del año. Desde el punto de vista nutricional, el fruto se caracteriza por su alto contenido de yodo y vitamina C (Hoffmann et al., 1994). Igualmente, la feijoa se presenta como un fruto rico en flavonoides, los cuales poseen actividades inmunológicas y antioxidantes (Ielpo et al., 2000). Adicionalmente, el fruto tiene actividad antimicrobiana y antioxidante, por lo tanto, se considera que tiene potencial como materia prima para producción de nuevos medicamentos (Vuotto et al., 2000). Debido a las expectativas comerciales del cultivo y a la importancia nutricional y medicinal de este fruto es importante optimizar el manejo agronómico del mismo. Sin embargo, en Colombia, no hay publicaciones científicas de estudios anatómicos del crecimiento y desarrollo del fruto que permitan implementar prácticas de manejo con el propósito de mejorar su calidad.
El fruto proviene de un ovario ínfero y resulta del desarrollo conjunto de las paredes del receptáculo y las paredes del ovario (León, 1987). El fruto es una baya, cuya pulpa es de color marfil, con aroma penetrante y de sabor agradable que se asemeja al de la fresa, al de la piña y al del kiwi. El mesocarpio se caracteriza por la presencia de esclereidas (células pétreas) que dan al fruto una textura arenosa (Tocornal, 1988), similar al de la guayaba (Garcés, 1987). En varios huertos comerciales de Cundinamarca (Colombia) se cultivan los clones 41 y 8-4 por las características organolépticas del fruto. En el municipio de La Vega, Rodríguez et al. (2006) observaron que ambos clones presentaron una curva de crecimiento sigmoidal simple, el clon 41 alcanzó su madurez fisiológica a los 154 días, mientras que el clon 8-4 la alcanzó a los 147 días. Así mismo, Rodríguez et al. (2006) determinaron que en la etapa tres del desarrollo el volumen se incrementó significativamente en ambos clones. En el clon 41, la primera etapa fue de crecimiento lento hasta los 70 días después de antesis y la etapa dos va desde los 70 días hasta los 126 días después de la antesis; la etapa tres abarcó el periodo comprendido entre los 126 y 154 días. En el clon 8-4 la primera etapa fue hasta los 56 días después de la antesis y la etapa dos desde los 56 días hasta los 117 días después de la antesis; la etapa tres se presentó entre los 117 y 147 días. La caracterización físico-química de los frutos reveló que el clon 41 tiene mejor comportamiento en la poscosecha en cuanto a las características organolépticas; por otra parte, las observaciones de campo mostraron que hay un porcentaje importante de aborto de frutos en este clon durante la primera etapa del crecimiento. De acuerdo con lo anterior, se decidió realizar una descripción anatómica de los clones 41 y 8-4, desde capullo floral hasta la madurez fisiológica, con el objetivo de establecer hasta que momento del desarrollo se presenta división celular, lo cual facilitaría el manejo eficiente de reguladores de crecimiento dirigidos a mejorar el cuajado y tamaño de los frutos.
METODOLOGÍA
Para el estudio anatómico, se tomaron muestras de fruto en los clones 41 y 8-4 en diferentes estadios de desarrollo, desde botón floral hasta la madurez fisiológica en árboles de huertos comerciales localizados en el municipio de La Vega, Cundinamarca, coordenadas 04º 54' LN y 74º 18' LO; altitud promedio de los huertos 1.900 msnm, precipitación promedio anual 1.800 mm y temperatura promedio anual 17 oC. Estos clones fueron seleccionados por el fitomejorador Over Quintero (1951-2003), quién fue el pionero en el mejoramiento genético de la feijoa en Colombia. El clon 41 presenta mejores rendimientos entre los 1.800 y 2.300 msnm, el fruto es ovalado y de pulpa más astringente que el clon 8-4, con calidad organoléptica excelente. El clon 8-4 ha registrado mejor producción a 2.600 msnm siendo de calificación sensorial normal. En cuanto al tamaño, los frutos más grandes del clon 8-4 pueden llegar a pesar 200 g, mientras que los frutos más grandes del clon 41 alcanzan un peso de 160 g. Sin embargo, para el estudio se tomaron los frutos de tamaño promedio entre 60 y 80 g de ambos clones. Con el propósito de asegurar la homogeneidad de los datos, los frutos tomados en cada muestreo fueron muy similares en peso y diámetros. El peso final del fruto en promedio en el clon 41 fue 64,3 g y en el clon 8-4 fue 70,1 g.
Se tomaron seis muestras para cada estadío fenológico así: botón floral en preantesis, fruto 15 días después de antesis, 30 días, 90 días, 128 días, 135 días, 142 días y madurez fisiológica, la cual se caracteriza porque al ejercer presión suave sobre el diámetro ecuatorial, este se hunde sutilmente y se aprecia cambio de color en la piel del fruto. Para cada muestreo se realizó el siguiente procedimiento: el material vegetal se cortó en pequeñas secciones, después de lo cual se fijo en FAA, mezcla de formaldehído, ácido acético, alcohol y agua, utilizando 50 mL de etanol (96%), 5 mL de ácido acético glacial, 10 mL formaldehido (37-40%) y 35 mL de agua. Debido a que en ensayos previos, los cortes en micrótomo no fueron posibles por la dureza de los tejidos, fue necesario hervirlos por dos horas en glicerina después de lo cual se procedió con la deshidratación y posterior inmersión en parafina. Una vez listos los tejidos en bloques de parafina se hicieron cortes transversónales entre 12 y 15 m con un microtomo de rotación, los cuales se colorearon con Fast-green y safranina (Johansen, 1968; Garcés, 1987). Se utilizó un microscopio Nikon Eclipse E600, cámara Nikon Coolpix 995. Las observaciones al microscopio se contrastaron con observaciones visuales en las diferentes etapas del desarrollo fenológico.
RESULTADOS Y DISCUSIÓN
Estudio del botón floral. Es importante resaltar que en esta etapa, el botón floral no es considerado como fruto, por lo tanto los términos de exocarpio, mesocarpio y endocarpio, solo se consideran después del cuajado del fruto. La epidermis externa y la hipodermis del botón floral corresponden al exocarpio del fruto; el mesófilo al mesocarpio y la epidermis interna más tres o cuatro capas de células debajo de la epidermis en constante división corresponden al endocarpio.
El corte transversal de ovario, mostró cuatro lóculos y septos sinuosos. El mesófilo está limitado hacia fuera por una epidermis uniestratificada de células más altas que largas, con tricomas epidérmicos intercalados entre las células, los cuales explican la textura aterciopelada del ovario. Interiormente, el mesófilo está delimitado por una epidermis interna uniestratificada, la cual tiene células más largas que altas con tendencia a alargarse tangencialmente. Debajo de la epidermis interna hay dos capas de células con abundantes divisiones anticlinales, las cuales dan origen a células parenquimáticas de formas isodiamétricas. En el mesófilo y en los septos se observaron drusas y esclereidas como en el fruto de guayaba (Garcés, 1987); igualmente, en la región subepidérmica de la epidermis externa se observaron canales oleíferos de origen esquizolisigénico (Garcés, 1987) (Figura 1).
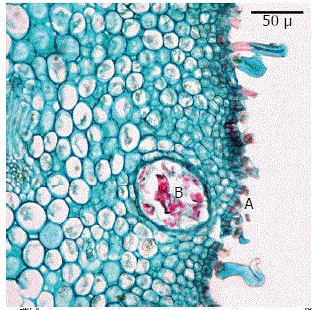
Figura 1. Corte transversal en capullo floral de feijoa en preantesis. A. Epidermis externa. B. Canal oleífero. Aumento 40X.
La mitad interior del mesófilo, está formado por tejido parenquimático, el cual es interrumpido por los haces conductores. En esta etapa se observan 46 capas de células desde la epidermis interna hasta la epidermis externa en el clon 8-4, mientras que en el clon 41 se observan 45 capas.
Corte transversal 15 días después de antesis. En este estadío fenológico hay multiplicación celular de tipo anticlinal (Figura 2) en el endocarpio y exocarpio del fruto. Debajo de la epidermis externa se observan procesos de lisigénesis. En los septos y en el mesocarpio hubo incremento en el número de capas celulares; en el clon 8-4 se contaron 58 capas de células en el mesocarpio, mientras que en el clon 41 fueron 54 capas. Adicionalmente, en el mesocarpio las células teñidas de rojo, indican la presencia de taninos. En cuanto al número de capas, estos resultados indican que la tasa de división celular es mayor en el clon 8-4 con respecto al clon 41 en frutos de la misma edad.
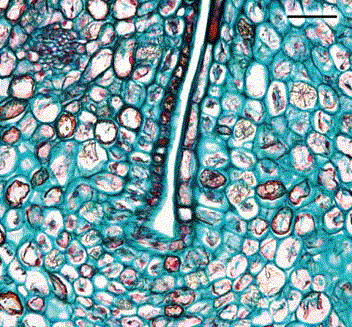
Figura 2. Corte transversal 15 días después de antesis en frutos de feijoa. A. Epidermis interna; B. División anticlinal. Aumento 40 X.
Corte transversal en frutos de 30 días. En el mesocarpio de ambos clones hay grupos de esclereidas rodeando las cavidades loculares. Adicionalmente, se aprecian los septos teñidos de rojo, lo cual indica la presencia de taninos (Figura 3). Las divisiones de tipo anticlinal continúan tanto en el endocarpio como en el exocarpio. El total de capas en el mesocarpio en el clon 8-4 fueron 70, mientras que en el clon 41 fueron 64; igualmente, se presentó aumento en el número de capas celulares en los septos de ambos clones, los cuales están constituidos por tejido parenquimatoso que invade la cavidad locular. Como en la descripción anterior, en este período se conserva la diferencia en la tasa de división celular a favor del clon 8-4.
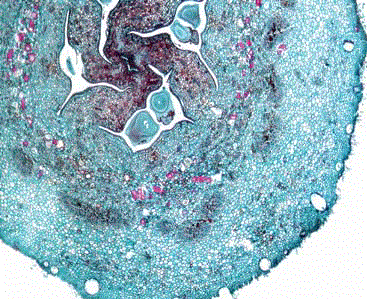
Figura 3. Corte transversal del fruto de feijoa de 30 días. A. Haz vascular; B. Esclereidas; C. Endocarpio (Epidermis interna); D. Lóculo; E. Exocarpio; F. Canal oleífero; G. Rudimento seminal; H. Septo. Aumento 4X.
Corte transversal en frutos de 90 días. En esta etapa, el espacio de los lóculos ha disminuido en los frutos de los dos clones, porque ha sido invadido progresivamente por los septos y la placenta. Se presentó división celular en las células parenquimáticas del mesocarpio ubicadas debajo de la epidermis interna. El total de capas celulares en el clon 8-4 fue de 142 y en el clon 41 fue de 122 capas. Adicionalmente, desde la antesis hasta este punto del crecimiento y desarrollo, se visualiza que es una etapa de crecimiento ralentizado en los dos clones porque no hay aumento considerable en el peso seco y en el diámetro de los frutos (Rodríguez et al. 2006), lo cual sugiere que puede ser una etapa programada genéticamente (Grange, 1993). En cuanto a diferenciación de tejidos, en ambos clones se aprecian algunas capas de células entre la exodermis y el mesófilo, éstas son más pequeñas y de paredes celulares engrosadas comparadas con las células del mesófilo, este grupo de células en particular constituyen la hipodermis que junto con la exodermis forman el exocarpio del fruto de feijoa.
Corte transversal en frutos de 128 días. En las células ubicadas entre la epidermis interna y el mesocarpio, las divisiones celulares son pocas. Sin embargo, hay división celular en la hipodermis. El número de capas en este estadío aumentó considerablemente en el mesocarpio; en el clon 8-4 se contaron 215 capas, mientras que en el clon 41 fueron 160 capas, aproximadamente. En este estadío la cavidad locular ha sido invadida completamente por los septos y la placenta con presencia de semillas bien formadas. En el mesocarpio se presentó expansión de las células del parénquima en los dos cultivares, a los 90 días el tamaño de las células osciló entre 10 y 17,5 m mientras que a los 128 días osciló entre 37,5 y 85 m, lo cual indica que el fruto se halla en la última etapa de crecimiento y desarrollo (Salisbury y Ross, 2000).
Corte transversal en frutos de 135 días. En este estadío, continua el proceso de expansión de las células del parénquima que conforman el mesocarpio, el tamaño de las células oscila entre 75 y 137,5 m, lo cual concuerda con la etapa de expansión celular en la última etapa del crecimiento y desarrollo a la que hacen referencia varios autores (Grange, 1993; Barceló et al., 2001; Salisbury y Ross, 2000). En éste punto, no se evidencia división celular en el endocarpio; sin embargo, hay división celular en el exocarpio (epidermis e hipodermis). Esto indica, que el endocarpio termina su desarrollo antes que el exocarpio, como sucede en Prunus persica (Esau, 1985).
Corte transversal en frutos de 142 días. En el clon 8-4 las esclereidas están rodeadas por células radiadas, como resultado del aumento en las tensiones debido al crecimiento del fruto, mientras que en clon 41 las células que rodean las esclereidas son redondeadas. En ambos clones las células de la hipodermis se han alargado tangencialmente, indicando que el fruto ha terminado su desarrollo transversal.
Madurez fisiológica. En los dos clones se observan idioblastos conformados hasta por 18 esclereidas. No hay división celular en la hipodermis. La epidermis está protegida por una cutícula gruesa, lo cual índica que la feijoa tiene protección natural contra la deshidratación. El endocarpio se observa ligeramente desordenado debido al cambio en la consistencia que sufren los septos y el parénquima placentario, el cual es de consistencia blanda, jugosa y azucarada.
Generalidades de la anatomía del fruto de feijoa. El fruto de feijoa proviene de un ovario ínfero, por lo tanto, los tejidos del fruto maduro provienen del hipantio y del ovario, como sucede en guayaba y agraz, en el fruto maduro se observan restos del cáliz, estos aspectos anatómicos concuerdan con las observaciones de Esemann et al. (2008).
Anatómicamente, el exocarpio del fruto está conformado por la epidermis externa y la hipodermis. En este caso, la epidermis y la hipodermis conforman lo que se conoce como piel, cáscara u hollejo. En el fruto maduro la epidermis está protegida por una cutícula, la cual contribuye a retardar la deshidratación del fruto. La hipodermis presenta 3 a 4 capas de células, que se han alargado en sentido tangencial.
Desde botón floral hasta madurez fisiológica se observan los canales de aceite en la región subepidérmica, los cuales aumentan a medida que el fruto crece y se desarrolla. Estos canales son de origen esquizolisigénico como en el caso de la guayaba. Tanto la epidermis externa como la hipodermis deben su desarrollo a divisiones de tipo anticlinal principalmente, aunque se observan algunas divisiones periclinales. Estas divisiones estuvieron presentes desde botón floral hasta bien avanzada la etapa tres, en la cual se presentó elongación celular y por lo tanto hubo expansión del fruto. La curva de crecimiento de los diámetros longitudinal y ecuatorial de ambos clones descrita por Rodríguez et al. (2005) corresponde a una curva tipo sigmoide simple, en la cual hay tres etapas de crecimiento. Siendo la etapa tres la última y la de crecimiento más rápido.
El mesocarpio. Se halla constituido por numerosas capas de parénquima. En los primeros estadíos de desarrollo se observaron drusas que disminuyen en las etapas avanzadas de desarrollo. Las esclereidas están presentes desde capullo floral y van aumentando en número durante el desarrollo del fruto. Estas pueden estar solas o en grupo. Alrededor de las esclereidas hay células de gran tamaño que sufren alargamientos radiales debido a la tensión que se genera en las células del parénquima; la mayor elongación se presenta en frutos que están en la última etapa de crecimiento. En frutos inmaduros hay presencia de taninos, tal como sucede en frutos inmaduros de guayaba y de Vaccinium floribundum (Garcés, 1987; Chaparro y Becerra, 1999).
El endocarpio. Está constituido por la epidermis interna y las tres o cuatro capas de células que están debajo de la epidermis. En el ovario esta epidermis es uniestratificada con células pequeñas más anchas que altas. Después de la fecundación y hasta madurez fisiológica las células de la epidermis sufren divisiones anticlinales y se observan más alargadas en sentido tangencial. Igualmente, las tres o cuatro capas debajo de la epidermis sufren divisiones anticlinales y periclinales. Al momento de la madurez fisiológica, la epidermis interna se observa ligeramente desordenada, lo cual sugiere que al madurar el fruto, estas células se separan fácilmente, mezclándose con los tejidos placentarios y las semillas.
El fruto de feijoa conserva una buena consistencia cuando madura. Esto se debe posiblemente a que no se presenta lisis celular abundante, por lo tanto no hay liberación del contenido celular a los espacios intercelulares del mesocarpio lo mismo que en otros frutos de ovario ínfero (Chaparro y de Carrillo, 1991). Por otra parte, las esclereidas le confieren a los tejidos resistencia mecánica (Strasburger et al., 1990).
Los septos y el parénquima placentario son estructuras que provienen del ovario y durante el desarrollo del fruto el parénquima placentario rodea las semillas y llena los espacios de los lóculos junto con los septos, los cuales sufren abundantes divisiones anticlinales. El parénquima placentario y los septos se tornan de aspecto pulposo y exhiben consistencia blanda y jugosa cuando el fruto está maduro y, cuando el fruto está sobremaduro éstos tejidos sufren pardeamiento. Adicionalmente, el aspecto y el sabor de la pulpa influyen en el consumidor de fruta fresca, debido a que es la parte más dulce. Así mismo, el cambio de la textura en los frutos carnosos es muy importante en los procesos de comercialización (Hernández, 2001). La consistencia y el sabor de los septos son diferentes a la consistencia del mesocarpio y el exocarpio. Mientras que los septos tienen consistencia suave y dulce, el mesocarpio y exocarpio son de consistencia dura y sabor astringente. En cuanto al desarrollo de los septos, estos están conformados por capas de células parenquimáticas dispuestas en arreglo lineal, que inicialmente pueden tener 12 capas de células y en la fase de elongación celular, este tejido alcanzó en las partes más anchas alrededor de 35 capas. De otro lado, se presentaron eventos de lisis celular en las paredes de los septos en el estadío de madurez fisiológica.
El aumento del tamaño del fruto en ambos clones, depende de varios factores, entre los que se cuentan el incremento en las capas celulares en el mesocarpio, los septos y la placenta. En la última etapa de crecimiento, el aumento en el tamaño se debe a la expansión de las células del mesocarpio, cuando el fruto se aproxima a la madurez fisiológica, por lo tanto, aumenta significativamente el peso fresco. Lo anterior indica que el peso y tamaño final del fruto dependen entre otros, de factores intrínsicos como el número y tamaño de las células (Chariello et al., 1989; Henton et al., 1999).
CONCLUSIONES
Desde el punto de vista anatómico, el aumento del tamaño del fruto en ambos clones depende del incremento en las capas celulares en el mesocarpio, los septos y la placenta.
El exocarpio en ambos clones está constituido por la epidermis y la hipodermis; el mesocarpio está constituido por tejido parenquimático y el endocarpio por la epidermis interna y tres o cuatro capas subepidérmicas.
La presencia de esclereidas, la escasa lisis celular en el mesocarpio y la presencia de cutícula en el momento de la cosecha le confieren resistencia mecánica al fruto lo que permite una mayor vida poscosecha.
Los frutos de feijoa de ambos clones presentaron cuatro lóculos, cada uno con tejido placentario al que se adhieren las semillas.
BIBLIOGRAFÍA
Barceló, J., G. Nicolas, B. Sabater y R. Sanchez. 2001. Fisiología vegetal. pp. 275-306. Ediciones Pirámide, Madrid. 566 p. [ Links ]
Chaparro, M.L. y N.M. de Carrillo. 1991. Anatomía del fruto de Macleania rupestris (H:B:K) A.C. Smith (Uva camarona). Agronomía Colombiana 8(2): 286-305. [ Links ]
Chaparro, M.L. y N. Becerra. 1995. Anatomía del fruto del “Agraz” (Vaccinium meridionale Swartz). Acta Biológica Colombiana 9: 159-172.
Chaparro, M.L. y N. Becerra. 1999. Anatomía del fruto de Vaccinium floribundum (Ericaceae). Acta Biológica Colombiana 4(1): 47-60. [ Links ]
Chariello, N.R., H.A. Mooney and K. Williams. 1989. Growth, carbon allocation and cost of plant tissues. pp. 327-367. In: Plant physiological ecology: Field methods and instrumentation. Chapman and Hall,
Esau, K. 1985. Anatomía vegetal. pp. 621-641. Ediciones Omega, Barcelona. 779 p. [ Links ]
Esemann, K., A.P. Mota, G.B. Kerbauy, M.P. Guerra, J.P. Ducroquet, R. Pescador. 2008. Estudo anatômico do crescimento do fruto em Acca sellowiana Berg. Revista Brasileira de Fruticultura. Jaboticabal 30(2): 296-302. [ Links ]
Garcés, E. 1987. Estudio anatómico y de los procesos de crecimiento y desarrollo del fruto de guayabo (Psidium guajava L). Agronomía Colombiana 4: 31-38. [ Links ]
Grange, R. 1993. Crecimiento del fruto. pp. 449- 462. En: Azcón-Bieto, J. y M. Talón (eds.). Fisiología y bioquímica vegetal. Interamericana-McGraw-Hill, Madrid. 581 p. [ Links ]
Henton, S.M., G.J. Piller and P.W. Gandar. 1999. A fruit growth model dependent of both carbon supply and inherent fruit characteristics. Annals of Botany 83(5): 509-514. [ Links ]
Hernández, M. 2001. Conservación del fruto de arazá (Eugenia stipitata Mc Vaugh) durante la poscosecha mediante la aplicación de diferentes técnicas. Tesis doctoral en Ciencias Agrarias. Facultad de Agronomía. Universidad Nacional de Colombia. Bogotá. 219 p. [ Links ]
Hoffmann, A., J.C. Nachtigal, R.A. Kluge e A.B. Bihalva. 1994. Influência da temperatura e do polietileno no armazenamento de frutos de goiabeira serrana (Feijoa sollowiana Berg). Scientia Agrícola 51(3): 563-568. [ Links ]
Ielpo, M.T.L., A. Basile, R. Miranda, V. Moscatiello, C. Nappo, S. Sorbo, E. Laghi, M.M. Ricciardi, L. Riciardi and M.L. Vuott. 2000. Immunopharmacological properties of flavonoids. Fitoterapia 71: S101-S109. [ Links ]
Johansen, D.A. 1968. Plant microtecnique. pp. 19-135. McGraw-Hill Book Company,
León, J. 1987. Botánica de los cultivos tropicales. pp. 357-365. Segunda edición. Instituto Interamericano de Cooperación para la Agricultura, San José, Costa Rica. 445 p. [ Links ]
Rodríguez, M., H. Arjona y H.A. Campos. 2006. Caracterización físico-química del crecimiento y desarrollo de los frutos de feijoa (Acca sellowiana Berg) en los clones 41 (Quimba) y 8-4. Agronomía Colombiana 24(1): 54-61. [ Links ]
Salisbury, F.B. y C.W. Ross. 2000. Fisiología de las plantas 3: Desarrollo de las plantas y fisiología ambiental. pp. 529-562. Thompson Editores, Madrid. [ Links ]
Strasburger, E., F. Noll, H. Schenk y A.F.W. Schimper. 1990. Tratado de botánica. pp. 107-139. Ediciones Omega S.A., España. [ Links ]
Tocornal, G. 1988. Frutos no tradicionales: kaki, feijoa, níspero y zarzaparrilla. pp. 125-154. Facultad de Ciencias Agrarias y Forestales, Universidad de Chile. Santiago de Chile. [ Links ]
Vuotto, M.L., A. Basile, V. Moscatiello, P. de Sole, R. Castaldo, E. Laghi and M.T.L. Ielpo. 2000. Antimicrobial and antioxidant activities of Feijoa sellowiana fruit. International Journal of Antimicrobial Agents 13(3): 197-201. [ Links ]














