Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.63 no.1 Medellín Jan./June 2010
EVALUACIÓN DE PRÁCTICAS DE MANEJO DE LA POLILLA DE LAS FLORES DE LULO SYMMETRISCHEMA INSERTUM POVOLNY (LEPIDOPTERA: GELECHIIDAE)
EVALUATION OF MANAGEMENT PRACTICES OF THE MOTH OF LULO FLOWER SYMMETRISCHEMA INSERTUM POVOLNY (LEPIDOPTERA: GELECHIIDAE)
Harol Enrique Martínez Córdoba1; José Mauricio Montes Rodríguez2 y Francisco Cristóbal Yepes Rodríguez3
1 Ingeniero Agrónomo. Universidad Nacional de Colombia. Facultad de Ciencias. Medellín. Colombia. <harolmartinez@hotmail.com>
2 Ingeniero Agrónomo. Universidad Nacional de Colombia. Facultad de Ciencias. Medellín. Colombia. <jmpamplonman@gmail.com>
3 Profesor Asociado. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia, Sede Medellín. A.A. 1779, Medellín, Colombia. <fcyepes@unalmed.edu.co>
Recibido: Noviembre 9 de 2009; Aceptado: Abril 22 de 2010
Resumen. Las larvas de Symmetrischema insertum ocasiona la caída del botón floral en cultivos de lulo pero los métodos tradicionales de control con insecticidas no han sido suficientes para bajar las poblaciones de este insecto; sin embargo, las prácticas culturales y de control biológico podrían reducir las pérdidas a niveles aceptables. Con el objetivo de buscar alternativas para su manejo, se plantearon tres tratamientos en campo: recolección de brotes afectados del suelo en combinación con la aplicación de un insecticida, recolección de brotes del suelo y la aplicación de un producto con base en Bacillus thuringiensis var. kurstaki (Btk) y solo recolección. Además, se evaluó la susceptibilidad de la larva de S. insertum a Btk en condiciones de laboratorio, comparando tres dosis: 0,3, 0,5 y 1,0 kg ha-1 y un insecticida en dosis comercial. En campo, la aplicación del insecticida más la recolección de brotes obtuvo los porcentajes más altos de control, mientras que en la recolección y la recolección más la aplicación de Btk, el control fue irregular a través del tiempo, posiblemente debido al efecto negativo de los factores ambientales en la acción y persistencia del Btk. Se reconocieron nueve especies de parasitoides de los cuales el bracónido Chelonus sp. fue el más abundante; estos controlan naturalmente gran parte de la población de S. insertum. En laboratorio las concentraciones más bajas de Btk alcanzaron igual porcentaje de mortalidad de S. insertum que las altas y que el insecticida, pero con un efecto tardío.
Palabras claves: Solanum quitoense, Solanaceae, Bacillus thuringiensis var. kurstaki, Fentoato.
Abstract. The larvae of Symmetrischema insertum causes the flower drop in lulo crops. Traditional control methods with insecticides have not been enough to decrease the populations of this insect; however, cultural practices and biological control can reduce the losses at acceptable levels. With the aim of finding alternatives for its management, three treatments in field conditions were tested: gathering of affected flowers in combination with the application of an insecticide; gathering of affected flowers and aspersion of a product based on Bacillus thuringiensis var. kurstaki (Btk) and gathering alone. Also was assessed the susceptibility of the larva of S. insertum to Btk under laboratory conditions by comparing three doses: 0.3, 0.5 and 1.0 kg/ha and an insecticide. Field application of insecticide and gathering had the highest percentages of control, while with gathering and application of Btk and only gathering, the control was erratic over time, possibly due to the negative impact of environmental factors in action and persistence of Btk. Were recognized nine species of parasitoids of which Chelonus sp. was the most abundant, this control naturally great part of the population of S. insertum. In the laboratory conditions, lower concentrations of Btk reached the same percentage of mortality of S. insertum that high concentrations and that the insecticide, but with a late effect.
Key words: Solanum quitoense, Solanaceae, Bacillus thuringiensis var. kurstaki, Fentoato.
El lulo es una de las frutas con mayor potencial de demanda debido a su amplia aceptación en los mercados nacionales, por su calidad, valor nutritivo y múltiples usos en la agroindustria. El cultivo del lulo participa con el 1,7% de la producción frutícola nacional, con aproximadamente 5.000 hectáreas sembradas. La producción promedio nacional fue de 7,8 ton/ha en el año 2000 (Franco et al., 2002).
La polilla de los brotes florales del lulo Symmetrischema insertum Povolny (Lepidoptera: Gelechiidae) llega a ser una plaga importante en los agroecosistemas de lulo en Antioquia, en su estado inicial ataca los brotes y hojas terminales (Vélez, 1988). Cuando crece ataca las flores donde se alimenta de estambres y otras estructuras, las cuales pega con un hilo sedoso que ella misma produce, quedando la flor en forma de bombillo alargado, que posteriormente se seca y cae al suelo, donde la larva continúa su ciclo (Franco et al., 2002). Actualmente se conoce que su ciclo de vida dura en promedio 26,1 días con una temperatura de 26,2 oC y 63,1% de humedad relativa, y que la longevidad del adulto es 5,4 días en promedio (Vélez, 1988); sin embargo, no existe información a cerca de los demás aspectos de su biología y ecología. Esta polilla y el picudo Anthonomus sp. son los principales insectos que habitan dentro de los botones florales.
Los métodos tradicionales de control con insecticida no se han evaluado; no obstante, los mercados de exportación de esta fruta exigen el uso mínimo de productos químicos, razón por la cual se hace necesaria la utilización y evaluación de otras prácticas de manejo cultural y de control biológico de acuerdo con el esquema del manejo integrado de plagas (MIP).
En cuanto a los enemigos naturales se han reconocido cuatro especies de parasitoides, una especie de Braconidae y tres especies de Ichneumonidae en el departamento de Antioquia (Vélez, 1988), de los cuales no se conoce su biología ni su potencialidad como agentes de control natural de S. insertum.
La bacteria entomopatógena Bacillus thuringiensis var. Kurstaki (Berliner) (Btk) ha sido probada con éxito en el control de otros lepidópteros (Carmona, 2002); sin embargo, su uso en el control de S. insertum aun no ha sido evaluado ni su compatibilidad con otros agentes de control biológico como depredadores y parasitoides. La baja persistencia y selectividad de Btk sobre lepidópteros, son ventajas importantes teniendo en cuenta que la producción de frutos en cultivos de lulo es continua durante todo el año.
Este estudio tuvo como propósito evaluar la eficacia y compatibilidad de prácticas de manejo en el control de la polilla de las flores y brotes del lulo S. insertum, y el reconocimiento de sus enemigos naturales, en el municipio de Girardota, Antioquia (Colombia).
MATERIALES Y MÉTODOS
La investigación se desarrolló en el municipio de Girardota (Antioquia, Colombia), vereda “La Mata”, en un cultivo de lulo de la variedad “La Selva”, de cuatro años de edad, a 1.894 msnm., con una distancia de siembra de tres metros entre plantas y tres metros entre surcos. La zona presenta una pendiente del 50%. El estudio se realizó en los meses de abril y mayo del 2010.
Ensayos en campo. Se delimitaron cuatro bloques con tres tratamientos en cada uno. Cada tratamiento correspondió a una parcela de nueve plantas. Las lecturas en campo se realizaron en cuatro semanas y los tratamientos fueron:
Tratamiento 1. Recolección de botones florales en el árbol y en el suelo semanalmente + aplicación de insecticida Fentopen® (i.a. Fentoato), quincenalmente.
Tratamiento 2. Recolección de botones florales en el árbol y en el suelo semanalmente + aplicación de Bacillus Agrogen WP® Bacillus Agrogen WP® (Btk) quincenalmente.
Tratamiento 3. Recolección de botones florales en el árbol y en el suelo semanalmente.
Para la recolección de los botones florales se tomó un tiempo de cinco min en cada parcela de nueve plantas. Se recolectaron los frutos caídos en el suelo y en el árbol. También se realizaron otras prácticas de cultivo para los tres tratamientos como la aplicación de fungicidas (Antracol® i.a. Propineb y Oxicloruro de Cobre) quincenalmente y recolección de frutos enfermos. Las aplicaciones de Btk se acompañaron del coadyuvante Cosmoaguas®, el cual acidifica la solución, maximizando el efecto de los cristales que entran en el intestino de la larva que es altamente alcalino. Para todas las aplicaciones se utilizó el coadyuvante antiespumante, adherente, INEX-A®. Las aplicaciones se hicieron de manera localizada en las inflorescencias del lulo con lo cual se disminuía la cantidad de producto a aplicar y el riesgo de afectar la fauna benéfica.
En la planta central de cada parcela se instaló un dispositivo con acetato y mallas plásticas en dos ramas productivas, el cual impedía que las flores que se desprendían por el daño de S. insertum y el picudo Anthonomus sp. (Coleoptera: Curculionidae), o por caída natural (esterilidad femenina y falta de polinización) cayeran al suelo; estas flores, se recolectaron semanalmente y se calculó el porcentaje de incidencia de S. insertum.
Para cada parcela se estimó el porcentaje de control de S. insertum durante las semanas del ensayo (Ecuación 1). En el caso de valores negativos se asumió como 0% de control.

En la cuarta semana se recolectó además de las flores caídas, todas las que permanecían en las ramas productivas, a las que también se les midió la incidencia y porcentaje de control de S. insertum, esta última recolección se le denominó “barrido”.
Se realizaron análisis de varianza con un diseño en bloques al azar para evaluar la hipótesis nula de igualdad en los tratamientos, tomando como variable el porcentaje de control de S. insertum, este análisis se realizó para cada semana. En el caso de diferencias significativas en los tratamientos se utilizo como prueba de comparación de medias la prueba de Tukey con un nivel de confianza del 95%; para ello se utilizó el programa estadístico Statgraphics Centurión versión XV 15.1.02. (Statpoint, 2006).
Para evaluar el efecto de cada tratamiento en el control de S. insertum se probó la hipótesis de que el porcentaje de control fuera estadísticamente diferente de cero, para cada semana, con un nivel de significancia de 5%.
Porcentaje de parasitoidismo y reconocimiento de parasitoides. Los botones recolectados del suelo y de la planta se llevaron al laboratorio de la Universidad Nacional de Colombia Sede-Medellín, en donde se disecaron con el objetivo de buscar larvas y parasitoides de la polilla de los brotes del lulo S. insertum; las larvas y pupas tanto de la polilla como de los parasitoides se guardaron en frascos de plástico con algodón humedecido en donde se llevó el seguimiento hasta imago. Los parasitoides que emergieron se montaron e identificaron según claves especializadas, (Fernández y Sharkey, 2006; Hanson y Gauld, 1995).
Se midió el porcentaje de parasitoidismo (Ecuación 2) y se evaluó si existían diferencias entre los tres tratamientos con una prueba de independencia al 5%. Los especímenes se depositaron en la colección entomológica del museo “Francisco Luis Gallego”, en la Universidad Nacional de Colombia, Sede Medellín.
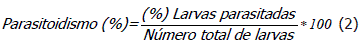
Bioensayo en laboratorio. Para comprobar la patogenicidad de la presentación comercial de Btk utilizada en campo, se realizó un ensayo en el laboratorio de entomología de la Universidad Nacional de Colombia-Sede Medellín, el cual posee una temperatura promedio de 22,02 ºC y una humedad relativa de 56,25 %. Se tomaron cajas Petri de 100 mm de diámetro y 15 mm de alto y se modificaron haciendo una abertura en la parte superior, forrándola con tul, en estas cajas se introdujeron botones florales de lulo afectados por S. insertum, previamente sumergidos e impregnados en soluciones con Btk, insecticida mas coadyudante (Tabla 1).
Tabla 1. Tratamientos del bioensayo en laboratorio con larvas de Symmetrischema insertum.

Se utilizó el coadyuvante INEX-A® en dosificación de 1 cm3/L de agua, Cosmoaguas® con 1 g/L de agua y el insecticida Fentopen® con 2 L/ha. Se hicieron lecturas cada 12 h hasta las 60 h, midiendo el porcentaje de mortalidad.
RESULTADOS Y DISCUSIÓN
Ensayos en campo. En la primera y segunda semana no se detectaron diferencias en el control de S. insertum entre los tratamientos; en la tercera, el tratamiento con insecticida fue mayor (P=0,018); y en la última semana o “barrido”, no existieron diferencias entre el tratamiento con Btk y el tratamiento con insecticida, y estos dos se diferenciaron de la sola recolección (P=0,038).
El insecticida en combinación con la recolección manual de brotes afectados, controló significativamente (P<0,001), en la tercera y la última lectura o “barrido”. El efecto retardado del insecticida es debido a que algunas larvas en el momento de la primera aplicación estaban dentro de botones florales y no entraron en contacto con el insecticida, con la segunda aplicación se mantuvo el efecto protector, impidiendo que la larva pudiera entrar en los botones florales, con lo cual se obtuvo un porcentaje de control alto en las últimas lecturas (Figura 1).
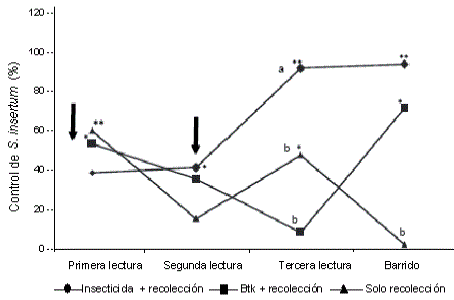
Figura 1. Porcentaje de control de tres tratamientos sobre Symmetrischema insertum. Las flechas verticales indican el momento de las aplicaciones de Btk y el Fentoato (i.a.), los asteriscos indican porcentajes de control estadísticamente diferentes de cero con 95 (*) y 99 (**) de confianza. Letras diferentes indican diferencias significativas con la prueba de comparación de Tukey con un nivel de confianza del 95 %.
En cuanto a la recolección y la aplicación del producto biológico Btk, se encontró un control significativo en la primera y segunda lectura (P<0,02 y P= 0,04) y en el barrido (P<0,01). Sin embargo, en la tercera semana el control no fue significativo. Esto probablemente debido a la alta influencia de factores ambientales en el control de S. insertum con Btk. Según Ibarra y Del Rincón (2001), los rayos UV del sol desnaturalizan las proteínas tóxicas, y Sánchez y Peña (2000) encontraron que las esporas de Btk persistían en hojas de maíz y fríjol entre 48 y 72 h después de su aspersión, debido a la sensibilidad de sus esporas a la desecación y la radiación solar. Además, aunque no se midió la precipitación en campo, la época en la que se desarrolló el estudio coincide con la temporada de lluvias que pudieron lavar las esporas y cristales de las hojas, impidiendo la ingestión y la acción en S. insertum.
Con sólo recolección se alcanzó un control significativo en la primera y tercera lectura (P<0,001 y P<0,04); sin embargo, en la última lectura o “barrido”, en el que se colectaron todos los botones florales de las inflorescencias, el control fue casi nulo (Figura 1). La recolección tuvo un efecto en la disminución de las poblaciones de S. insertum, con la recolección de flores afectadas que presentan el síntoma “bombillo”, se recolectan larvas que están en los últimos instares, antes de empupar, con lo cual se frena la producción de adultos y por ende, de nuevas posturas. Varios factores posiblemente influyen para que el control con esta práctica no sea mejor que el observado:
-
Tiempo de recolección insuficiente. Teniendo en cuenta el potencial productivo de la variedad La Selva de 17,5 ton/ha y el porcentaje de cuajamiento de 20% (Franco et al., 2002), se podría estimar una producción de 20 flores/ planta/ semana de las cuales solo el 20%, es decir, cuatro se convertirán en frutos; de esta manera se tendrían que recolectar 16 flores por planta en cada semana, el tiempo estimado para cada planta en el presente ensayo fue de 30 segundos, lo cual parece insuficiente para capturar todas las flores presentes en el suelo y con efecto bombillo en las ramas, esto sumado a que muchas quedan ocultas por las arvenses presentes entre los surcos.
-
Reinfestación de lotes externos de S. insertum. En la zona de estudio los experimentos estaban rodeados de parcelas sin tratamiento contra S. insertum, por lo cual a pesar de recoger total o parcialmente las flores afectadas, hubo la posibilidad de reinfestación de lotes cercanos. Sería importante evaluar la recolección de flores afectadas sin la influencia de lotes externos.
-
Altos niveles de infestación. La incidencia de S. insertum al comienzo del presente ensayo fue del 12% de flores afectadas, con esta práctica posiblemente no se recogen todas las flores afectadas y se alcanzan a escapar larvas y adultos que reinfestan y no permiten que esta práctica sea más efectiva. Es probable que con niveles de infestación menor esta práctica pueda ser utilizada como única práctica de control de S. insertum.
Después de dos aplicaciones de insecticida y la recolección manual semanalmente, se alcanzó un control del 96%, por lo cual este tratamiento es la mejor alternativa para bajar rápidamente las poblaciones en lotes con alta incidencia de S. insertum. La recolección manual y la combinación de recolección manual y aplicación de Btk podrían funcionar con baja incidencia de S. insertum (menos del 5%), y cuando se encuentran en los primeros estadios de desarrollo, tal como lo recomienda Ibarra y Del Rincón (2001). La aplicación de Btk. podría ser más conveniente a mediano plazo debido a que es selectivo, con lo cual no se afecta la fauna benéfica como enemigos naturales de S. insertum y los artrópodos polinizadores; además, es 30% menos costoso que el insecticida y su toxicidad es muy baja, lo cual permite inclusive, cosechar un producto agrícola inmediatamente después de una aplicación con Btk (Ibarra y Del Rincón, 2001).
Los beneficios de la recolección de flores afectadas se evidencian en que anteriormente el agricultor aplicaba insecticidas sin un control adecuado de la plaga; sin embargo, con la combinación de recolección de flores afectadas y aplicación del insecticida se consigue un efecto sinérgico que alcanza los mejores niveles de control, debido a que las larvas que sobreviven al insecticida por estar dentro de los botones florales, son recolectados manualmente, con lo cual estas dos prácticas son complementarias.
Otra ventaja de la recolección manual es que disminuye la población del picudo de los botones florales del lulo, Anthonomus sp. (Coleoptera: Curculionidae) el cual se alimenta de los estambres y causa la caída de la flor. La incidencia de este insecto pasó de 7,5% en la primera lectura, a 5% en la segunda y a 3 % en la tercera y cuarta. En el barrido a los brotes no se encontró ningún picudo.
Porcentaje de parasitoidismo y reconocimiento de parasitoides. Las especies de parasitoides encontradas en brotes de lulo atacando larvas de S. insertum se presentan en la Tabla 2. El parasitoide Chelonus sp. (Figura 2B), fue el más abundante en este estudio, y se presento en el 60% de las larvas parasitadas; esta avispa posee una larva apoda de color anaranjado intenso (Figura 2E) que emerge del cuerpo del hospedante en el último instar, construyendo un capullo de seda blanco dentro del que previamente construyó el hospedante (Figura 2F) (Campos y Sharkey, 2006). Su eficiencia en campo, lo hace candidato promisorio para un estudio de selección de parasitoides en programas de control biológico de S. insertum.
Tabla 2. Parasitoides de Symmetrischema insertum en el cultivo de lulo de Girardota, Antioquia-Colombia.

Figura 2. Depredadores y parasitoides de Symmetrischema insertum. A. Larva de Chrysopidae atacando larva de Symmetrischema insertum dentro del botón floral. B. Adulto de Chelonus sp. en campo. C. Perilampus sp. D. parasitoide de la familia Bethylidae. E. Larva de Chelonus sp. F. Adulto y pupario de Chelonus sp.
La presencia de Apanteles gelechidivoris Marsh (Hymenoptera: Braconidae) fue baja (menos del 5%). A. gelechidivoris y Chelonus sp. (Hymenoptera: Braconidae) comparten el mismo hábitat y estrategias de parasitoidismo (endoparasitoide, koinobionte); Chelonus sp. parasita un estado de desarrollo más temprano lo cual le da cierta ventaja sobre los otros parasitoides y podría explicar su mayor parasitoidismo.
El género Perilampus sp. (Himenoptera: Perilampidae) según Darling (2006), tiene un rango amplio de hospederos (Figura 2C); sin embargo, es conocido que también puede ser hiperparasitoide de Hymenopteros de la familia Ichneumonidae, por lo cual es incierto su papel como controlador biológico de S. insertum.
Los parasitoides de la familia Ichneumonidae emergieron de la larva de último instar de S. insertum (Figura 3B y 3F). La larva de estos parasitoides es de color blanco con manchas rojizas tenues y rosadas, la cual es más grande que la que presenta los parasitoides Bracónidos y al igual que estas, construye un capullo dentro del capullo del hospedante. Según Palacio y Wahl (2006), un aspecto importante que limita el uso de Ichneumónidos como control biológico es que una considerable proporción en zonas tropicales es idiobionte y en consecuencia su rango de hospedantes generalmente es amplio; sin embargo las tres especies de Icneumónidos encontradas en este estudio son koinobiontes.

Figura 3. Depredadores y parasitoides de Symmetrsichema insertum. A. Araña cerca de las flores de lulo. B. Parasitoide adulto de S. insertum. C. Ichneumonidae en campo. D. Larva de Ichneumonidae alimentándose de larva de S. insertum. E. Larva de Ichneumonidae emergiendo de la larva de S. insertum. F. Parasitoide adulto de S. insertum.
Otros enemigos naturales son las larvas de la familia Chrysopidae, las cuales entran a los botones florales y consumen los estados inmaduros de S. insertum (Figura 2A); chinches de la familia Anthocoridae, que han sido observados como depredadores de huevos y larvas de otros Gelechiidos, como Tecia solanivora (Osorio et al., 2001); además de las arañas que cazan cerca de los botones florales (Figura 3A).
El porcentaje de parasitoidismo no mostró diferencias entre los tratamientos y no se vio afectado con la aplicación de insecticidas (Tabla 3). La aplicación localizada del insecticida podría evitar que toda la fauna de parasitoides se viera afectada con las aplicaciones, debido a que ellos se vieron buscando hospedantes además de las flores, en los tallos de la planta y en el suelo (Figura 2B y 3C).
Tabla 3. Porcentaje de parasitoidismo de Symmetrischema insertum bajo tres prácticas de manejo.
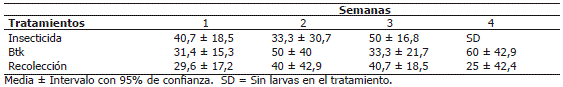
Es necesario evaluar el efecto de estas aplicaciones sobre la fauna de polinizadores como las abejas del género Bombus observadas frecuentemente en el lote y las cuales han demostrado, que aumentan la productividad en cultivos de otras solanáceas como tomate (Aldana et al., 2007).
Bioensayo en laboratorio. El ensayo de laboratorio mostró diferencias altamente significativas (Tabla 4) en todas las lecturas (P<0,0001). Los resultados del bioensayo indicaron que 24 h después de la aplicación, se encontraron larvas muertas y otras con signos y síntomas de intoxicación en las tres dosificaciones de Btk. Las larvas muertas presentaban coloración oscura; las intoxicadas con Btk se reconocían por la lentitud en su movimiento, su decoloración, movimientos involuntarios, la presencia de manchas oscuras en su cuerpo. También se observó cambio de ubicación de las larvas enfermas con respecto al sitio inicial del daño donde habían sido detectadas.
Tabla 4. Porcentaje de mortalidad de Symmetrischema insertum expuestas a tres dosis de Btk y el insecticida Fentoato (i.a.).

A las 36 h después de la aplicación (Tabla 4), los porcentajes de mortalidad en los tratamientos de 0,3, 0,5 y 1,0 kg/ha de Btk no presentaron diferencias significativas, con valores de 66%, 56% y 60%, respectivamente. Mientras que el insecticida Fentopen® mostró un control del 100%.
A las 48 h después de la aplicación (Tabla 4), el tratamiento 1,0 kg/ha de Btk mantuvo un mayor control que las dosificaciones de 0,3 y 0,5 kg/ha, con un porcentaje de mortalidad del 87%, y no presentó diferencias significativas con respecto al insecticida Fentopen® (2 L/ha). A las 60 h las tres dosificaciones de Btk no presentaron diferencias significativas con respecto al insecticida con porcentajes de mortalidad que fluctuaron entre el 64 y el 87%, lo cual evidencia la susceptibilidad de S. insertum a los cristales tóxicos de Btk.
En todas las lecturas las dosificaciones de Btk no presentaron diferencias en mortalidad de S. insertum.
Estos resultados podrían ser explicados porque las larvas de S. insertum se alimentaron principalmente del material vegetal de la parte interna de los estambres, los cuales no tienen los cristales tóxicos de Btk, con lo cual se espera poca diferencia en la ingestión de cristales tóxicos entre concentraciones. Resultados similares obtuvieron Niedmann y Meza (2006), al evaluar la susceptibilidad a Btk, de Tuta absoluta Meyrick (Lepidoptera: Gelechiidae) el cual es un minador de hojas.
CONCLUSIONES
En condiciones de campo el tratamiento con aplicación localizada de insecticida más la recolección de botones florales afectados, controló mejor la polilla Symmetrischema insertum en comparación con la aplicación de Bacillus thuringiensis var. Kurstaki más la recolección de botones florales afectados y solo recolección.
El tratamiento con insecticida no disminuyó el porcentaje de parasitoidismo después de 3 semanas.
Chelonus sp. fue el parasitoide más abundante y parasitó el 60% de las larvas encontradas.
El ensayo en laboratorio mostró que 24 h después de la aplicación de Btk, se encontraron larvas muertas y otras con síntomas de intoxicación en las dosificaciones de 0,3, 0,5 y 1,0 kg/ha de Btk.
A las 60 h en condiciones de laboratorio, las tres dosificaciones de Btk, no presentaron diferencias significativas con respecto al insecticida con porcentajes de mortalidad que fluctuaron entre el 64 al 87%.
AGRADECIMIENTOS
Agradecemos al Señor Luis Builes, propietario de la finca en Girardota, Antioquia y al Museo Entomológico Francisco Luis Gallego de la Universidad Nacional de Colombia Sede Medellín.
BIBLIOGRAFÍA
Aldana, J., J. Cure, M.T. Almanza, D. Vecil, D. Rodríguez. 2007. Efecto de Bombus atratus (Hymenoptera: Apidae) sobre la productividad del tomate (Lycopersicum sculentum Mill.) bajo invernadero en la Sabana de Bogotá, Colombia. Agronomía Colombiana 25(1): 62-72. [ Links ]
Campos, D.F., M.J. Sharkey. 2006. Familia Braconidae. pp. 331-384. En: Fernández, F. y M. Sharkey (eds.). Introducción a los Hymenoptera de la Región Neotropical. Sociedad Colombiana de Entomología y Universidad Nacional de Colombia, Bogotá D.C. 894 p. [ Links ]
Carmona, A. 2002. Aislamiento y caracterización parcial de una cepa de Bacillus thuringiensis tóxica a Spodoptera frugiperda (Lepidoptera: Noctuidae). Bioagro 14(1): 3-10. [ Links ]
Darling, D.C. 2006. Familia Perilampidae. pp. 705-708. En: Fernández, F. y M. Sharkey (eds.). Introducción a los Hymenoptera de la Región Neotropical. Sociedad Colombiana de Entomología y Universidad Nacional de Colombia, Bogotá D.C. 894 p. [ Links ]
Fernández, F. y M.J. Sharkey. 2006. Introducción a los Hymenopteros de la Región Neotropical. Sociedad Colombiana de Entomología y Universidad Nacional de Colombia. Bogota D.C. 894 p. [ Links ]
Franco, G., E.J. Bernal, C.M.J. Giraldo, M.P.J. Tamayo, P.O. Castaño, V.A. Tamayo. 2002. El cultivo del lulo. Corporación Colombiana de Investigación Agropecuaria-Corpoica. Regional Nueve. Manizales, Caldas. 103 p. [ Links ]
Hanson, P.E. and I.D. Gauld. 1995. The Hymenoptera of Costa Rica. The Natural History Museum. Oxford University Press, London. 893 p. [ Links ]
Ibarra, M.J.E. y C.M.C. Del Rincón 2001. Cuantificación toxicólogica de Bacillus thurigiensis. p. 133-151. En: Primitivo, J.F. (ed.). Bioinsecticidas: Fundamentos y Aplicaciones de Bacillus thurigiensis en el Control Integrado de Plagas. 318 p. [ Links ]
Niedmann, L. y L. Meza. 2006. Evaluación de cepas nativas de Bacillus thuringiensis como una alternativa de manejo integrado de la polilla del tomate (Tuta absoluta Meyrick; Lepidoptera: Gelechiidae) en Chile. Agricultura Técnica-Chile 66(3): 235-246. [ Links ]
Osorio, M.P.A., E.M.E. Espitia, Z.E. Luque. 2001. Reconocimiento de enemigos naturales de Tecia solanivora (Lepidoptera: Gelechiidae) en localidades productoras de papa en Colombia. Revista Colombiana de Entomología 27(3-4): 177-185. [ Links ]
Palacio, E.E. y D.B. Wahl. 2006. Familia Ichneumonidae. pp. 293-329. En: Fernández, F. y M. Sharkey (eds.). Introducción a los Hymenoptera de la Región Neotropical. Sociedad Colombiana de Entomología y Universidad Nacional de Colombia, Bogotá D.C. 894 p. [ Links ]
Sánchez, J.M. y J.J. Peña. 2000. Persistencia de esporas de Bacillus thurigiensis en hojas de maíz, de frijol y en el suelo. TERRA Latinoamericana 18(4): 325-331. [ Links ]
Statpoint. 2006. Statgraphics® Centurion XV. Statistical Exploration and Modeling Software. En: http:// www.statgraphics.com; consulta: Julio 2008. [ Links ]
Vélez, A.R. 1988. Reconocimiento, identificación y biología de especies de Gelechiidae (Lepidoptera) asociadas con plantas Solanáceas del Departamento de Antioquia. Trabajo de investigación presentado como requisito parcial para optar a Profesor Titular. Universidad Nacional Medellín. 123 p. [ Links ]




![ANATOMICAL ASPECTS OF DEVELOPMENT OF PINEAPPLE GUAVA FRUIT [ACCA SELLOWIANA (O.BERG) BURRET]](/img/en/prev.gif)









