Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.63 no.1 Medellín Jan./June 2010
EFECTO DE LA RELACIÓN AGITACIÓN-AIREACIÓN SOBRE EL CRECIMIENTO CELULAR Y LA PRODUCCIÓN DE AZADIRACTINA EN CULTIVOS CELULARES DE AZADIRACHTA INDICA A. JUSS
AGITATION-AERATION RELATION EFFECTS ON CELL CULTURE OF AZADIRACHTA INDICA A. JUSS NEEM ON AZADIRACHTIN PRODUCTION IN A STIRRED TANK BIOREACTOR
Juan Carlos Bedoya Pérez1 y Rodrigo Alberto Hoyos Sánchez2
1 Ingeniero Químico. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779, Medellín, Colombia. <jcbedoy1@unal.edu.co>
2 Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779, Medellín, Colombia. <rhoyos@unal.edu.co>
Recibido: Noviembre 10 de 2008; Aceptado: Febrero 8 de 2010
Resumen. Se evaluó la producción de azadiractina a partir de células de Azadirachta indica A. Juss, establecidas en un biorreactor sometido a variaciones en la velocidad de agitación y el caudal del aire suministrado al medio de cultivo. Además, se determinó el efecto del oxigeno disuelto en el medio de cultivo, sobre el crecimiento celular y la producción del metabolito, mediante la estimación del coeficiente de transferencia de oxígeno (kLa), la velocidad de transferencia de oxígeno (OTR), la velocidad de consumo de oxígeno (OUR) y el consumo celular específico de oxígeno (SOUR). Los resultados mostraron que el crecimiento celular y la producción de azadiractina, están fuertemente influenciados por las condiciones de mezclado presentes en el biorreactor, indicando un alto grado de sensibilidad de las células al estrés hidrodinámico. Por otra parte, se evidenció que los valores de kLa y OTR aumentaron al incrementar la velocidad de agitación y aireación, lo que favoreció la transferencia de masa, mientras que ocurrió lo contrario con la OUR y la SOUR, posiblemente debido a la pérdida de la viabilidad celular, al incrementar los esfuerzos cortantes dentro del biorreactor.
Palabras claves: Biorreactor de tanque agitado, cultivo de células vegetales, coeficiente de transferencia de oxígeno (kLa), velocidad de transferencia de oxígeno (OTR), velocidad de consumo de oxígeno (OUR), consumo específico de oxígeno (SOUR).
Abstract. It was evaluated the production of azadiractin from cells of Azadirachta indica A. Juss, established in a biorreactor submitted to variations in the speed of agitation and the air flow provided to the culture medium. Besides, it was determined the effect of the oxygen dissolved in the culture medium, on cellular growth and production of the metabolite, by means of estimating the oxygen transfer coefficient (kLa ), oxygen transfer rate (OTR), oxygen uptake rate (OUR), and the cellular specific oxygen uptake rate (SOUR). The results showed that the cellular growth and azadiractin production, are strongly influenced by the mixed conditions in the biorreactor, indicating a high degree of sensitivity of cells to the hydrodinamic stress. On the other hand, it was evident that kLa and OTR values, increased to promote the agitation speed and air supply, which favoured the mass transfer, whereas it was opposite with the OUR and the SOUR, possibly because of the loss of the cellular feasibility, to put up the cut effects inside the biorreactor.
Key words: Bioreactor stirred tank, plant cell culture, oxygen transfer coefficient (kLa), oxygen transfer rate (OTR), Oxygen uptake rate (OUR), specific oxygen uptake rate (SOUR).
Las células vegetales son capaces de sintetizar una amplia variedad de sustancias que se han vuelto indispensables en la vida del hombre. Proteínas, grasas, carbohidratos, cosméticos, analgésicos, cardiotónicos, colorantes naturales, aditivos para alimentos, pesticidas naturales y enzimas, son ejemplos de ellas. Entre éstas, aquéllas que no son formadas por las células durante el metabolismo primario son denominadas metabolitos secundarios. Muchas de estas sustancias son de alto valor comercial y están siendo demandadas en cantidades que no han podido ser satisfechas a nivel mundial, por lo que la industria química ha hecho grandes esfuerzos para fabricarlas pero con resultados muy limitados (Vasconsuelo y Boland, 2007).
Debido a la dificultad de su síntesis química y a que no son producidos por microorganismos, muchos de los metabolitos secundarios que son elaborados por las plantas, continúan obteniéndose por métodos tradicionales (cultivos en campo). Además de ser dependientes, entre otros factores, de cambios climáticos, estacionales, problemas geopolíticos y tenencia de la tierra; la producción de metabolitos secundarios de interés comercial mediante cultivos en campo presenta muchos problemas asociados, principalmente a variaciones en la calidad y la cantidad del producto. Todos los inconvenientes mencionados, sumados al intento de lograr satisfacer la creciente demanda mundial de sustancias que son sintetizadas por las plantas, han incentivado la búsqueda de métodos de producción alternativos, entre los cuales, las técnicas biotecnológicas de cultivo in vitro de células vegetales en condiciones estáticas o de movimiento en medios de cultivo líquido han recibido especial atención porque permiten obtenerlos en cantidades significativas y en términos económicamente viables (Gerth et al., 2007).
Los procesos biotecnológicos que utilizan células vegetales en medios de cultivo líquido, son una importante alternativa de producción, ya que bajo condiciones controladas no presentan los problemas del cultivo en campo; sin embargo, la producción a nivel comercial y competitivo de sustancias con un alto valor comercial, sólo es posible cuando se utilizan biorreactores que permitan obtener cantidades significativas de éstos de una manera rentable (Murthy et al., 2008). Existen algunas publicaciones sobre estudios de crecimiento de células vegetales orientados a la producción de metabolitos secundarios en biorreactores (Huang et al., 2002; Jeong et al., 2006; Pakrash y Srivastrava, 2008). Varias especies han centrado la atención de los investigadores por el potencial de comercialización de las sustancias que producen; entre ellas la especie Azadirachta indica A. Juss, sobresale como una fuente confiable de compuestos que son altamente eficientes en el control de plagas que afectan las cosechas de vegetales, granos y cítricos (Orozco y Rodríguez, 2007).
Entre los más de 300 metabolitos secundarios que produce A. indica (Orozco y Rodríguez, 2007), los triterpenoides (limonoides) están considerados como los principales, de los cuales la azadiractina es el más importante en el control de insectos. La azadiractina es un potente bioinsecticida que no afecta los insectos benéficos, animales o al hombre y su producción actual, no satisface los requerimientos del mercado en términos de calidad y cantidad (Capataz, 2005; Orozco y Rodríguez, 2007); razón por la cual, hace algunos años se vienen realizando estudios sobre el cultivo de células de A. indica en biorreactores que permitan obtener cantidades significativas de azadiractina de una manera rentable, pero aún existen muchos problemas que impiden su escalado y producción a nivel industrial (Raval et al., 2003; Pakrash y Srivastra, 2005a, 2007, 2008).
Se han desarrollado medios de cultivo y propuesto algunas condiciones adecuadas de operación en el establecimiento de cultivos celulares de A. indica en biorreactores (Capataz, 2005; Pakrash y Srivastra, 2005a, 2007, 2008), pero aún no se encuentran publicados estudios en los que se determinen condiciones apropiadas de mezclado (Orozco y Rodríguez, 2007), lo cual se requiere si se tiene en cuenta que en la producción a gran escala de estos compuestos, es necesario establecer condiciones adecuadas de agitación-aireación, que garanticen la transferencia continua de nutrientes desde el medio de cultivo hasta las células sin generar problemas de estrés hidrodinámico que afecten el crecimiento celular, la producción del metabolito de interés y que no permitan la caída de la concentración de oxígeno disuelto en el medio de cultivo, hasta valores críticos que puedan generar limitaciones en el proceso (Jeong et al., 2006).
En el caso de procesos microbianos el mezclado del fluido afecta la fisiología celular y la producción de metabolitos (Enfors et al., 2001), pero existe la necesidad de investigar el efecto del proceso de mezclado sobre la fisiología y metabolismo en cultivos de células vegetales en biorreactores. En el aumento de escala, la eficiencia del mezclado tiende a disminuir debido a la necesidad de aumentar las velocidades de agitación-aireación, que mantengan las condiciones de mezclado de pequeña escala, pero la sensibilidad de las células vegetales a los esfuerzos cortantes impiden este incremento lo que puede generar la sedimentación celular, disminuir el crecimiento celular y al mismo tiempo la productividad del proceso (Huang et al., 2002).
En la presente investigación se utilizaron las técnicas in vitro de cultivo de tejido vegetal, para el estudio del comportamiento de las suspensiones celulares de A. indica en un biorreactor de tanque agitado.
MATERIALES Y MÉTODOS
Establecimiento del cultivo de tejido in vitro de A. indica. Para esta fase se realizó el procedimiento recomendado por Capataz (2005).
Establecimiento del cultivo en biorreactor.
Preparación de inóculos. Se seleccionaron aquellas suspensiones que contenían entre 60-80 % (P/V) de biomasa fresca (entre 12 y 15 g L-1 de biomasa seca) a las cuales se les realizó control microbiológico, mediante cultivos en medio sólido (AGAR). En matraces de 500 mL con un volumen de 40 mL de medio de cultivo, fueron adicionados 200 mL de las suspensiones anteriores, las cuales se mantuvieron en un agitador orbital sin aireación forzada a una velocidad de agitación de 120 rpm. Este material se utilizó a los siete (7) días para inocular el biorreactor de 7 L.
Modo de operación y características del biorreactor de tanque agitado con suspensiones celulares de A. indica. Las características del biorreactor en el cual se estudió la cinética de crecimiento de A. indica se especifican en la Tabla 1. Las células de A. indica se cultivaron en el biorreactor de 7 L con un volumen efectivo de trabajo aproximado de 3,0 L. El biorreactor junto con 2,5 L de medio de cultivo fresco (Capataz, 2005) fue esterilizado a 121 ºC y 20 lb/pulg2 durante 20 minutos. La inoculación se realizó en cámara de flujo laminar y se operó a diferentes combinaciones de agitación (120, 180, 250 rpm) – aireación (0,1; 0,3 vvm) a 27 °C y luz permanente.
Tabla 1. Características del biorreactor para el estudio de las suspensiones de Azadirachta indica A. Juss.

Bajo las condiciones anteriores se realizaron las fermentaciones batch con células de A. indica. Se evaluó el crecimiento celular, la variación en la concentración de azúcares reductores, la producción de azadiractina, el coeficiente volumétrico de transferencia de oxígeno y el consumo específico de oxígeno. Cada fermentación tuvo una duración de 30 días.
Métodos analíticos
Determinación de la curva de crecimiento en el biorreactor. Para la determinación de la curva de crecimiento se empleó el peso fresco y peso seco celular. Cada tres (3) días se colectaron muestras de 25 mL de medio de cultivo, de las cuales se tomaron dos (2) alícuotas de 5 mL cada una. De cada alícuota se separó el sobrenadante de la biomasa mediante filtración al vacío utilizando cómo filtro papel Whatman Nº 1 previamente secado (60 ºC durante 24 horas) y pesado. La biomasa retenida, junto con el filtro fue secada a 60 ºC durante 24 horas, para luego ser pesada nuevamente; en tanto que, el medio libre de células (sobrenadante), fue utilizado para realizar la determinación de azúcares reductores en el medio y de azadiractina extracelular (Orozco, 2002).
Determinación de azúcares reductores. Se empleó el método del ácido dinitrosalicílico (DNS) (Miller, 1959). De cada alícuota (numeral 2.3.1) se tomaron 0,5 mL del sobrenadante al 10% (se mezclaron 50 mL de sobrenadante con 450 mL de agua destilada) y se agregaron 0,5 mL de reactivo DNS. Todas las muestras fueron agitadas vórtex durante 30 seg y colocadas a ebullir en baño María por cinco min. A continuación, fueron enfriadas con agua-hielo, posteriormente se les adicionaron 14 mL de H2O destilada. Se dejaron reposar durante quince (15) min para luego leer la absorbancia en un espectrofotómetro a 540 nm. La curva de calibración se realizó a partir de un stock de glucosa (4 mg mL-1) haciendo diluciones para obtener concentraciones desde 0,02 hasta 0,1 g L-1.
Extracción y cuantificación de azadiractina por cromatografía líquida (HPLC). La determinación del contenido intracelular de azadiractina se realizó a muestras celulares provenientes de callos friables y suspensiones celulares en matraces agitados, y a aquellas muestras tomadas cada tres días del biorreactor. En los dos primeros casos (callos y suspensiones) se eligieron al azar 3 muestras; de cada uno de los callos, se tomaron 2 g (peso fresco) y de cada una de las suspensiones se tomaron 20 mL de solución homogenizada mediante agitación magnética; el resto de la biomasa fue utilizada para determinar la relación peso seco/peso fresco. En el caso de las muestras tomadas del biorreactor, se realizó la extracción de azadiractina a partir de 15 mL de muestra de cultivo.
Cada muestra fue centrifugada a 3.000 rpm durante 10 min, la biomasa se lavó con suficiente agua destilada y fué macerada, para posteriormente hacer la extracción con metanol, CH3OH (3 x 10 mL). En seguida los extractos metanólicos se mezclaron y concentraron al vacío en un rotoevaporador R-3000 Büchi por debajo de 45 °C hasta sequedad; después se adicionaron 10 mL de agua destilada más 1 mL de cloruro de sodio (NaCl 5% p/v) y se extrajeron nuevamente con diclorometano, CH2Cl2 (3 x 10 mL). Las fases acuosas fueron descartadas y las capas de diclorometano se combinaron y se secaron con 2 g de sulfato de magnesio (MgSO4) para retirar el exceso de agua. Los extractos se rotoevaporaron nuevamente hasta sequedad y fueron re-disueltos en 2 mL de metanol HPLC y almacenados a -4 °C (Balaji et al., 2003; Capataz, 2005; Dai et al., 1999; Giraldo et al., 2002; Mordue et al., 1995; Schaaf, 2000).
En el caso de metabolitos extracelulares, 10 mL de muestra libre de células del biorreactor fueron mezclados con 5 mL de diclorometano en un embudo de separación y agitados por 1 min. Posteriormente, la fase de diclorometano fue removida. Este procedimiento se realizó 3 veces y todas las fracciones de diclorometano fueron combinadas retirando el exceso de agua con sulfato de magnesio (MgSO4) el cual fue removido por filtración. Los extractos extracelulares fueron rotoevaporados al vacío hasta sequedad por debajo de 45 ºC, re-disueltos en 2 mL de metanol HPLC y almacenados a -4 °C.
Los extractos se analizaron mediante HPLC utilizando alícuotas de 10 mL en una columna LiChroCART 125-4 LiChrospher 100 RP-18 (125 mm x 4,6 mm D.I, diámetro de poro 5 mm) (Merck, Alemania). Se utilizó como fase móvil acetonitrilo: agua (30:70), empleando una velocidad de flujo de 0,7 mL min-1 durante 8 min; los picos fueron detectados a 218 nm. La cantidad de azadiractina presente fue calculada por comparación de las áreas bajo la curva o picos de absorción obtenidos para cada muestra y una muestra de referencia de azadiractina al 95% de pureza (Sigma A 7430), para lo cual se utilizó una curva estándar generada por la inyección directa de diluciones sucesivas (0,5; 2,5; 5; 10; 30; 60; 80; 100; 150 y 200 ppm) (Capataz, 2005; Schaaf, 2000). Cada inyección (10 mL) fue repetida tres veces utilizando un automuestreador.
Evaluación del consumo y el coeficiente volumétrico de transferencia de oxígeno (kLa). La tensión de oxígeno disuelto, TOD (porcentaje de la concentración de saturación de oxígeno en el medio), fue monitoreada continuamente utilizando un sensor de oxígeno disuelto (D100 Series OxyProbe, Broadley and James Corp.); el consumo de oxígeno y el coeficiente volumétrico de transferencia de oxígeno, kLa, se estimaron cada 3 días mediante el método dinámico sin control de oxígeno disuelto (Trejo et al., 2007).
Diseño experimental. Los efectos de la variación en la velocidad de agitación, aireación y de su interacción sobre la cinética de crecimiento de A . indica y la producción de azadiractina en un biorreactor agitado de 7 L fueron estudiados mediante un diseño factorial 3x2 (Tabla 2). Todos los tratamientos se hicieron por duplicado con dos repeticiones para cada análisis realizado. Las muestras se tomaron cada tres días durante los 30 días de cultivo correspondientes a cada tratamiento, para la estimación de cambios en el tiempo de la concentración de biomasa, concentración de glucosa y producción de azadiractina. Igualmente, cada 3 días se evaluó el coeficiente volumétrico de transferencia de oxígeno (kLa), el consumo de oxígeno (OUR) y la velocidad de transferencia de oxígeno al medio de cultivo (OTR).
Tabla 2. Factores y niveles del diseño experimental empleados en el estudio de las suspensiones de Azadirachta indica A. Juss.

Los valores obtenidos para cada una de las variables-respuesta mencionadas, se utilizaron para establecer estadísticamente, con un nivel de significancia del 5%, la influencia de cada factor y su interacción sobre el desempeño del proceso. Otras variables como: concentración máxima de biomasa, concentración máxima de azadiractina y los valores promedios de contenido intracelular de azadiractina, kLa, OTR y OUR, fueron también consideradas como variables-respuesta para establecer diferencias entre las medias de cada tratamiento y la influencia de los factores, así como su interacción sobre las variaciones consideradas significativas. Se utilizó la prueba de Fisher con un nivel de confianza del 95%. Todos los datos fueron analizados con el paquete estadístico SAS System para Windows, versión 6.12., utilizando como apoyo para digitación de datos, la realización de tablas y gráficas del programa Microsoft Office Excel 2003.
RESULTADOS
Las condiciones de trabajo (agitación, aireación) correspondientes a los tratamientos realizados, los parámetros cinéticos (productividad de biomasa, productividad volumétrica, velocidad específica de crecimiento, tiempo de duplicación) y las máximas concentraciones de biomasa y producto obtenidas se encuentran en la Tabla 3.
Tabla 3. Parámetros cinéticos promedios obtenidos para cultivos celulares de Azadirachta indica A. Juss bajo diferentes combinaciones de agitación-aireación en un biorreactor agitado.
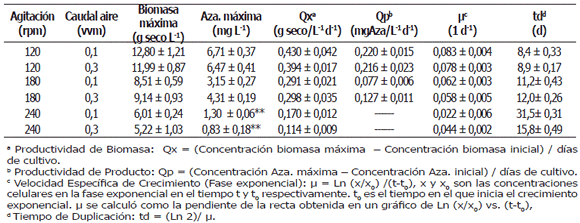
a Productividad de Biomasa: Qx = (Concentración biomasa máxima – Concentración biomasa inicial) / días de cultivo.
b Productividad de Producto: Qp = (Concentración Aza. máxima – Concentración Aza. inicial) / días de cultivo.
c Velocidad Específica de Crecimiento (Fase exponencial): m = Ln (x/x0) /(t-t0), x y x0 son las concentraciones celulares en la fase exponencial en el tiempo t y t0 respectivamente. t0 es el tiempo en el que inicia el crecimiento exponencial. m se calculó como la pendiente de la recta obtenida en un gráfico de Ln (x/x0) vs. (t-t0),
d Tiempo de Duplicación: td = (Ln 2)/ m.
Crecimiento celular de A. indica en el biorreactor. En la Figura 1 se presentan las concentraciones de biomasa obtenidas en cada uno de los tratamientos. Las concentraciones (g/l) promedio de biomasa obtenidas durante la fase estacionaria fueron 11,97 ± 0,72 (120 rpm, 0,1 vvm), 11,09 ± 0,79 (120 rpm, 0,3 vvm), 8,96 ± 0,30 (180 rpm, 0,1 vvm), 8,05 ± 0,17 (180 rpm, 0,3 vvm), 5,92 ± 0,19 (240 rpm, 0,1 vvm) y 5,10 ± 0,25 (240 rpm, 0,3 vvm).
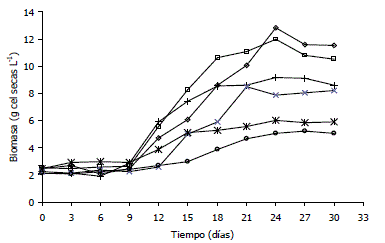
Figura 1. Concentraciones celulares de Azadirachta indica A. Juss en el biorreactor para diferentes combinaciones de agitación-aireación. (◊) 120 rpm-0.1 vvm, (□) 120 rpm-0,3 vvm, (+) 180 rpm-0,1 vvm, (x) 180 rpm-0,3 vvm, (*) 240 rpm-0,1 vvm, (○) 240 rpm-0,3 vvm.
Mediante el análisis estadístico se determinó que la velocidad de agitación y el caudal de aire suministrado al medio de cultivo tuvieron un efecto significativo sobre la concentración máxima celular obtenida.
Concentración de azúcares reductores en el medio de cultivo. Las concentraciones de azúcares reductores en el medio se incrementaron significativamente durante los 12 primeros días del cultivo (Figura 2). En el caso de las fermentaciones realizadas a 120 y 180 rpm el crecimiento celular llegó a una fase estacionaria correspondiente al agotamiento de la fuente de carbono en el medio de cultivo. En las corridas realizadas a 240 rpm, el crecimiento celular se detuvo aún con la presencia de azúcares reductores en concentraciones superiores a 5 g L-1.
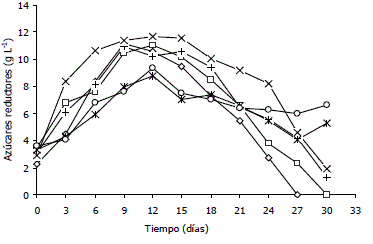
Figura 2. Concentración de azúcares reductores en las suspensiones celulares de Azadirachta indica A. Juss en el biorreactor para diferentes combinaciones de agitación-aireación. (◊) 120 rpm-0,1 vvm, (□) 120 rpm-0,3 vvm, (+) 180 rpm-0,1 vvm, (x) 180 rpm-0.3 vvm, (*) 240 rpm-0,1 vvm, (○) 240 rpm-0,3 vvm.
Producción de azadiractina. Los resultados obtenidos para la concentración intracelular de azadiractina en las muestras tomadas a partir de callos y suspensiones se presentan como promedios en la Tabla 4 y para cada uno de los tratamientos realizados en la Figura 3. Se registró una disminución del 57,1% en la concentración de este metabolito al pasar de medio sólido (callo) a medio líquido (suspensión). No se encontró la presencia de azadiractina extracelular en ninguna de las muestras analizadas.
Tabla 4. Concentración intracelular de azadiractina y relación peso/seco peso fresco en callos y suspensiones celulares de Azadirachta indica A. Juss.
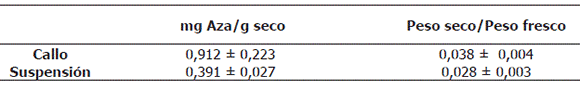
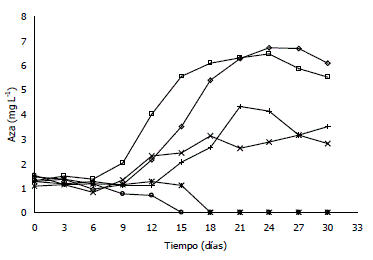
Figura 3. Concentración de azadiractina en suspensiones celulares de Azadirachta indica A. Juss para diferentes combinaciones de agitación-aireación en el biorreactor. (◊) 120 rpm-0.1 vvm, (□) 120 rpm-0,3 vvm, (+) 180 rpm-0,1 vvm, (x) 180 rpm-0,3 vvm, (*) 240 rpm-0,1 vvm, (○) 240 rpm-0,3 vvm.
En términos de la concentración, la velocidad de agitación fue un factor influyente sobre la producción de azadiractina, pero no se encontró efecto sobre esta variable respuesta del caudal de aire suministrado ni de la interacción entre los factores analizados. La concentración promedio de azadiractina en mg azadiractina/ g seco fue de 0,54 ± 0,07 (120 rpm, 0,1 vvm), 0,60 ± 0,08 (120 rpm, 0,3 vvm), 0,38 ± 0,07 (180 rpm, 0,1 vvm), 0,48 ± 0,06 (180 rpm, 0,3 vvm), 0,21 ± 0,21 (240 rpm, 0,1 vvm) y 0,21 ± 0,26 (240 rpm, 0,3 vvm).
kLa, OTR, OUR y SOUR. En la Figura 4 se muestran los valores promedios obtenidos para el kLa. Puede notarse un mayor impacto de la velocidad de agitación sobre este parámetro, aunque a medida que aumenta la velocidad del agitador, es más significativa la influencia del caudal de aire suministrado. En general no se registraron grandes variaciones en el valor de kLa durante los 30 días de cultivo para cada una de las corridas realizadas. Las variaciones más notables se presentaron en las corridas realizadas a 120 rpm con una disminución máxima del 23,3% a 0,1 vvm y de 13,2% a 0,3 vvm, con respecto a los valores máximos obtenidos para el tratamiento respectivo.
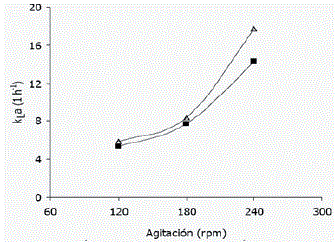
Figura 4. Coeficiente volumétrico de transferencia de oxígeno (kLa) para cada combinación agitación-aireación en suspensiones celulares de Azadirachta indica A. Juss. (D) 0,3 vvm, (♦) 0,1 vvm.
En la Figura 5 se muestra la velocidad específica de consumo de oxígeno (SOUR) en el transcurso del tiempo para cada uno de los tratamientos. La actividad metabólica de las células representada por el consumo específico de oxígeno mostró grandes variaciones durante las diferentes fases de crecimiento. Se aprecia que en cada uno de los tratamientos aumentó en forma significativa, al inicio de la fase exponencial y luego disminuyó con el paso del tiempo, pasando por sus valores iniciales al finalizar esta etapa. Para la fase estacionaria el consumo de oxígeno cayó drásticamente, indicando una disminución del metabolismo aerobio celular, lo cual puede estar asociado a la falta de nutrientes en el medio, o a la pérdida de viabilidad celular en el caso de las corridas realizadas a 240 rpm. Respuestas similares se han obtenido para cultivos de Panax ginseng (Thanh et al., 2006) y Stizolobium hassjoo (Huang et al., 2002).
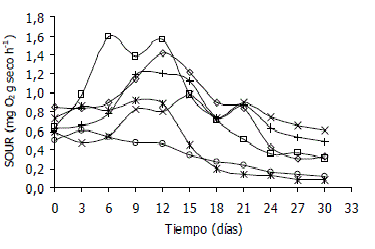
Figura 5. Velocidad específica de consumo de oxígeno (SOUR) para cada uno de los tratamientos realizados en el biorreactor para la producción de azadiractina a partir de cultivos celulares de Azadirachta indica A. Juss. (◊) 120 rpm-0,1 vvm, (□) 120 rpm-0,3 vvm, (+) 180 rpm-0,1 vvm, (x) 180 rpm-0,3 vvm, (*) 240 rpm-0,1 vvm, (○) 240 rpm-0,3 vvm.
Se realizó una gráfica en la cual se especifican simultáneamente la velocidad de consumo (OUR) y la velocidad de transferencia de oxígeno (OTR). Los resultados obtenidos para las corridas realizadas a 120 rpm se muestran en la Figura 6. La OTR tuvo un aumento continuo durante todo el proceso de crecimiento celular y sufrió una leve disminución durante la fase estacionaria. La OUR por su parte, incrementó rápidamente al inicio y durante la fase de crecimiento exponencial, finalmente disminuyó en la fase de declive y estacionaria indicando una fuerte reducción en la actividad metabólica celular, relacionada con las bajas o nulas velocidades de crecimiento celular y el agotamiento de la fuente de carbono en el medio de cultivo. Los máximos valores de la OTR corresponden a las mínimas concentraciones de oxígeno registradas en el medio a 120 rpm (61,8 ± 3,7% y 58,9 ± 2,6% de la concentración de saturación a 0,1 y 0,3 vvm, respectivamente). En todas las corridas realizadas la concentración de oxígeno disuelto decreció levemente durante la fase lag (donde la concentración de biomasa es pequeña) y disminuyó rápidamente hasta un nivel mínimo en la fase exponencial.
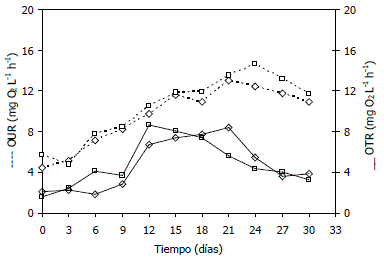
Figura 6. Comparación entre valores experimentales máximos obtenidos para la velocidad de consumo de oxígeno (OUR) y la velocidad de transferencia de oxígeno (OTR) en la producción de azadiractina a partir de cultivos celulares de Azadirachta indica A. Juss. . (◊) 120 rpm-0,1 vvm, (□) 120 rpm-0,3 vvm. La línea punteada corresponde a la OTR y la línea continua a la OUR.
En el caso de la velocidad específica de consumo de oxígeno (SOUR) se encontró un efecto significativo de la velocidad de agitación y de aireación, mientras que para la OUR hubo un efecto significativo de la interacción entre estos factores.
DISCUSIÓN
Crecimiento celular de A. indica en el biorreactor. Para cada combinación agitación-aireación (Figura 1) las curvas de crecimiento de cultivos celulares de A. indica en el biorreactor mostraron un incremento gradual en la acumulación de biomasa respecto al tiempo, alcanzando las máximas concentraciones celulares después del día 21 del cultivo. Patrones de crecimiento similares han sido observados previamente para cultivos celulares de A. indica en matraces agitados y biorreactores (Capataz, 2005; Raval et al., 2003; Pakrash y Srivastra, 2008) e igualmente para otros cultivos de células vegetales como Panax ginseng (Thanh et al., 2006; Han y Zhong, 2003) Panax notoginseng (Zhong et al., 1999), Taxus chinensis (Zhong et al., 2002) y Catharantus roseus (Tate y Payne, 1991).
La concentración y la productividad de biomasa máximas obtenidas en esta investigación (12,8 g seco L-1, 0,43 g seco L-1 d-1 a 120 rpm y 0,1 vvm) superan los valores obtenidos en investigaciones previas realizadas con A. indica en la Universidad Nacional de Colombia sede Medellín, en las que se utilizó el mismo equipo y montaje experimental de esta investigación a velocidades de agitación de 200 rpm y caudales de aire de 0,2 vvm. Muñoz et al. (2006), observaron concentraciones y productividades máximas de biomasa de 9,2 g seco L-1 y 0,27 g seco L-1 d-1 respectivamente.
El estrés hidrodinámico creado por velocidades de agitación superiores a 180 rpm tuvo un efecto significativo sobre la acumulación de biomasa dentro del biorreactor. Al comienzo del cultivo (fase lag) no hubo crecimiento celular como respuesta a la intensidad de mezclado. Al aumentar la velocidad de agitación se presentaron fases de acoplamiento más largas (9, 12 y 15 días a 120, 180 y 240 rpm, respectivamente) indicando aumentos en los tiempos de adaptación celular a las nuevas condiciones del cultivo. Los resultados obtenidos a velocidades de agitación de 120 rpm, condición de operación bajo la cual se generó el menor estrés hidrodinámico en esta investigación, presentaron los mejores rendimientos en términos de máxima concentración de biomasa (12,80 ± 1,21 g seco L-1), velocidad de crecimiento (0,083 ± 0,004 d-1), productividad de biomasa (0,430 ± 0,042 g seco L-1 d-1) y productividad de producto (0,220 ± 0,015 mg azadiractina L-1 día-1).
Para una velocidad de flujo de aire de 0,1 vvm, se presentó una disminución en la concentración máxima de biomasa del 28,59% (180 rpm) y 53,05% (240 rpm) respecto a la máxima concentración de biomasa alcanzada (12,8 g seco L-1 a 120 rpm), mientras que para un caudal de 0,3 vvm las disminuciones fueron del 33,52% y 59,22%, respectivamente. Las mejores productividades de biomasa se lograron con una velocidad de agitación de 120 rpm (Tabla 3), valores que representan un aumento en el rendimiento del 190,5% y 194,8% con respecto a los valores obtenidos a 240 rpm y del 43,1% y 27,4% con respecto a los valores obtenidos a 180 rpm a velocidades de aireación de 0,1 y 0,3 vvm, respectivamente. Estas variaciones significativas muestran la importancia del proceso de mezclado sobre el crecimiento de células de A. indica en biorreactores agitados mecánicamente.
En cuanto al caudal de aire suministrado al medio de cultivo, no se encontró un efecto significativo de esta variable operacional sobre el crecimiento celular dentro del rango ensayado. Aunque, en general, existió una disminución en la velocidad de crecimiento al aumentar el caudal de aire manteniendo constante la velocidad de agitación (Tabla 3); además, para todos los tratamientos evaluados, durante la fase estacionaria las corridas realizadas a 0,1 vvm superaron la concentración de biomasa obtenida a 0,3 vvm. La razón de estas diferencias no es clara, pero la disminución en concentraciones a 0,3 vvm podría deberse a un mayor grado de arrastre de compuestos gaseosos del medio (CO2, C2H4 y otros compuestos volátiles), que están implicados en el crecimiento celular y la producción de metabolitos secundarios (Smart y Fowler, 1981; Jeong et al., 2006). Igualmente el aumento en el caudal de aire de 0,1 a 0,3 vvm incrementó considerablemente la generación de espuma dentro del biorreactor y su acumulación sobre la superficie del líquido, lo que favoreció la separación de las células del medio de cultivo, su adhesión a las paredes del recipiente y probablemente afectó la toma de nutrientes por parte de las células reduciendo las velocidades de crecimiento y los rendimientos del proceso, efecto que fue más fuertemente percibido a 180 rpm, condición en la que se alcanzaron altos niveles de biomasa y pequeños agregados celulares.
Concentración de azúcares reductores en el medio de cultivo. La cinética de crecimiento de las células de A. indica en el biorreactor mostró una dependencia directa de la concentración de azúcares reductores en el medio de cultivo. En la Figura 2 se observa cómo durante la fase de latencia (los primeros 12 días) las células se encargan de desdoblar la sacarosa para su posterior aprovechamiento. Esto probablemente indica la presencia de enzimas secretadas al medio o presentes en la superficie celular que permitieron la hidrólisis extracelular de sacarosa y por tanto la formación de glucosa y fructosa, fenómeno que ha sido observado en diferentes cultivos de células vegetales (Shin et al., 2003). En el caso de las fermentaciones realizadas a 120 y 180 rpm el crecimiento celular llegó a una fase estacionaria correspondiente al agotamiento de la fuente de carbono en el medio de cultivo y posiblemente limitando el proceso de crecimiento por la falta de nutrientes. En las corridas realizadas a 240 rpm, el crecimiento celular se detuvo aún con la presencia de azúcares reductores en el medio de cultivo con concentraciones superiores a 5 g L-1, lo que demuestra que el factor limitante del crecimiento no estuvo asociado con la fuente de carbono en el medio y que probablemente el crecimiento fue afectado por la pérdida de viabilidad celular creada por la intensidad de mezclado.
Producción de azadiractina. La velocidad de agitación afectó considerablemente la producción de azadiractina. Al aumentar la velocidad de agitación hubo una disminución continua en el contenido intracelular de azadiractina hasta el punto de no detectarse la presencia de este compuesto a nivel intracelular después del día 15 para una velocidad de agitación de 240 rpm (Tabla 3, Figura 3). A 120 rpm la curva de producción de azadiractina muestra un patrón similar al de crecimiento celular y, a pesar de ser un metabolito secundario, su producción se presenta durante toda la fase de crecimiento, alcanzando su máximo valor al finalizar esta etapa (0,66 mg azadiractina/g célula seca a 0,1 vvm y 0,59 mg azadiractina/g célula seca a 0,3 vvm).
En las fases estacionarias correspondientes a las fermentaciones realizadas a 120 rpm hubo una disminución en el tiempo, de la concentración intracelular de azadiractina, lo cual puede estar directamente relacionado con la formación de agregados celulares más grandes al finalizar la etapa de crecimiento exponencial a esta misma velocidad de agitación. A 120 rpm y a mediados de la fase exponencial se generó la precipitación de biomasa al fondo del biorreactor; esta deficiencia en el mezclado pudo alterar la producción de azadiractina por limitaciones de oxígeno disuelto. Un aumento en el tamaño de agregados celulares disminuye los procesos difusionales y limita la toma de nutrientes por parte de las células, especialmente aquellas que se encuentran en el centro de los mismos, alterando los procesos metabólicos celulares y la producción de metabolitos secundarios (Zhong et al., 2002).
En la Figura 3 se notan algunas diferencias sobre la producción de azadiractina generadas por la velocidad de aireación. En general las concentraciones promedios de este metabolito en la fase estacionaria fueron superiores a 0,1 vvm (6,48 y 4,02 mg azadiractina L-1 a 120 y 180 rpm, respectivamente) respecto a los valores obtenidos a 0,3 vvm (5,95 y 2,79 mg azadiractina L-1 a 120 y 180 rpm, respectivamente) indicando que la sobre-aireación puede inhibir considerablemente la producción de azadiractina, efecto que es más evidente a 180 rpm (disminuciones del 30,6% al variar la aireación de 0,1 a 0,3 vvm) mostrando que la interacción entre las variables operacionales es significativa. La explicación a estas disminuciones puede radicar en los cambios en la composición gaseosa del medio por el arrastre de moléculas volátiles a mayores velocidades de aireación (Schlatman et al., 1993).
La concentración más alta de azadiractina obtenida durante el cultivo fue de 6,71 mg L-1 (120 rpm, 0,1 vvm), valor que supera la concentración obtenida en matraces agitados en estudios previos realizados (4,4 mg L-1, 120 rpm, luz permanente, 35 ºC) (Capataz, 2005) y da un visto bueno a la posibilidad de realizar procesos de escalado con esta línea celular. Al comparar estos resultados con los disponibles en la literatura en los cuales se observaron productividades de azadiractina entre 10 y 72,81 mg L-1 en matraces agitados (Balaji et al., 2003; Capataz 2005; Kuruvilla et al., 1999; Prakash y Srivastava, 2005a; Raval et al., 2003) y entre 45 y 81,3 mg L-1 en diferentes tipos de biorreactores (Prakash y Srivastava, 2005a, 2005b, 2008; Prakash et al.,2005), se hace evidente la necesidad de realizar estudios sobre otros factores que afecten el crecimiento celular y la producción de azadiractina, que permitan obtener mayores velocidades de crecimiento, concentraciones más altas de biomasa y de producto que hagan más atractiva la propuesta de implementar y escalar la producción in vitro de células de A. indica.
kLa, OUR Y OTR. La velocidad de agitación y el caudal de aire suministrado al medio de cultivo afectaron considerablemente los contenidos de oxígeno disuelto en el medio de cultivo y los valores de kLa, OTR y SOUR. En cada uno de los tratamientos y para el mismo día de cultivo los contenidos de oxígeno, la kLLa, OTR y SOUR generalmente incrementaron con el aumento de la velocidad de agitación y aireación, mientras, ocurrió lo contrario con los valores de la SOUR, indicando consecuencias directas de las variaciones de estos parámetros operacionales sobre las características del medio de cultivo y las células de A. indica. Las disminuciones registradas a 240 rpm en la SOUR durante la fase de crecimiento exponencial y la fase estacionaria respecto a aquellos obtenidos a velocidades de agitación de 120 y 180 rpm indican la posible pérdida de viabilidad celular bajo estas condiciones de operación.
En suspensiones celulares de A. indica la mínima velocidad de transferencia de oxígeno (OTR) fue de 41,6 mg O2 L-1 h-1 a nivel de erlenmeyer con aireación forzada y a este escala no se encontraron condiciones limitantes de oxígeno (Raval et al., 2003). En todas las fermentaciones realizadas en esta investigación, la mínima OTR obtenida fue de 4,38 mg O2 L-1 h-1 (180 rpm, 0,3 vvm, día 0) mientras que la máxima SOUR fue de 8,39 mg O2 L-1 h-1 (120 rpm, 0,1 vvm, día 18) a los que correspondieron valores de 1,45 y 14,02 mg O2 L-1 h-1 para la SOUR y OTR respectivamente. La mínima diferencia entre los valores de estos dos parámetros (SOTR-OUR) se calculó en 0,33 mg O2 L-1 h-1 (180 rpm, 0,1 vvm, día 12). Como lo indican los resultados anteriores, los valores de la OTR siempre superaron los de la SOUR indicando que no existieron limitaciones del proceso en términos de oxígeno disuelto (Figura 6).
De otro lado, la variación en el tiempo de la SOUR en cultivos celulares de A. indica mostró un patrón de comportamiento similar al de la concentración de biomasa y estuvo influenciada por la fase de crecimiento. Hubo un incremento del valor de este parámetro durante la fase lag y especialmente durante la fase de crecimiento exponencial, mientras que sus valores decrecieron lentamente al finalizar esta última fase para mantenerse prácticamente constantes durante la fase estacionaria. Por su parte, la SOUR incrementó rápidamente durante la fase lag e inicios de la fase exponencial hasta alcanzar valores máximos para luego disminuir a medida que se incrementaba el tiempo de fermentación. Resultados similares se han obtenido en cultivos celulares de Stizolobium hassjo (Huang et al., 2002), Panax notoginseng (Thanh et al., 2006) y de A. indica en matraces agitados (Raval et al., 2003).
Los máximos valores de SOUR correspondieron al inicio de las fases exponenciales del crecimiento celular (Figura 5) en las que es de esperarse que ocurra un incremento en la actividad celular asociada con el inicio de la división celular. A 120 rpm se registraron las mayores caídas en el valor de este parámetro respecto a sus valores máximos para cada tratamiento. Hay que recordar que para esta misma velocidad de agitación se formaron agregados celulares más grandes los cuales probablemente afectaron la transferencia de oxígeno entre el medio de cultivo y las células disminuyendo la SOUR. A velocidades de 180 rpm los valores de SOUR superaron los obtenidos a 120 rpm durante la fase estacionaria lo cual es debido, probablemente, a que el aumento en la velocidad de agitación disminuye el tamaño promedio de los agregados celulares y mejora la velocidad de transferencia de oxígeno entre el medio de cultivo y las células (Huang, et al, 2002).
CONCLUSIONES
La velocidad de agitación fue un factor influyente en el rendimiento de cultivos celulares de A. indica en el biorreactor. A 120 rpm se generó la mejor condición de operación en esta investigación, aunque favoreció la formación de agregados celulares más grandes lo que pudo provocar la disminución en el contenido intracelular de azadiractina al final del cultivo. A 180 y 240 rpm se obtuvo un mezclado uniforme pero existieron disminuciones considerables en los rendimientos de biomasa y producto que indicaron un alto grado de sensibilidad de las células de A. indica ante los esfuerzos cortantes generados bajo estas condiciones de operación.
La relación agitación-aireación tuvo un efecto significativo sobre el coeficiente volumétrico de transferencia y el consumo celular de oxígeno. En general, al aumentar los niveles de agitación y aireación se presentaron aumentos considerables en la velocidad de transferencia de oxígeno al medio de cultivo y disminuciones en los consumos específicos de oxígeno, indicando respectivamente, mejoras en la velocidad de difusión molecular y la posible pérdida de viabilidad celular ante el incremento en la intensidad del mezclado.
Bajo las condiciones de operación establecidas en esta investigación no se presentaron limitaciones del proceso de crecimiento celular y síntesis de azadiractina asociadas con bajas concentraciones de oxígeno disuelto en el medio de cultivo.
BIBLIOGRAFÍA
Balaji, K., C. Veeresham, K. Srisilam and C. Kokate. 2003. Azadirachtin, a novel biopesticide from cell cultures of Azadirachta indica. Journal of Plant Biotechnology 5(2): 121-129. [ Links ]
Capataz, T.J. 2005. Efecto de elicitores abióticos sobre la producción de metabolitos secundarios de suspensiones celulares de Azadirachta indica y su efecto sobre Spodoptera sp. Medellín. Tesis de Maestría en Biotecnología. Facultad de Ciencias. Universidad Nacional de Colombia. 68 p. [ Links ]
Dai, J., V.A. Yaylayan, G.S. Raghavan and J.R. Parè. 1999. Extraction and colorimetric determination of azadirachtin-related limonoids in neem seed kernel. Journal of Agricultural and Food Chemistry 47(9): 3738-3742. [ Links ]
Enfors, S.O., M. Jahic, A. Rozkov, B. Xu, M. Hecker, B. Jürgen, E. Krüger, T. Schweder, G. Hamer, D. O’Beirne, N. Noisommit-Rizzi, M. Reuss, L. Boone, C. Hewitt, C. McFarlane, A. Nienow, T. Kovacs, C. Trägardh, L. Fuchs, J. Revstedt, P.C. Friberg, B. Hjertager, G. Blomsten, H. Skogman, S. Hjort, F. Hoeks, H.Y. Lin, P. Neubauer, R. van der Lans, K. Luyben, P. Vrabel and A. Manelius. 2001. Physiological responses to mixing in large scale bioreactors. Journal of Biotechnology 85: 175-185.
Gerth, A., D. Schmidt and D. Wilken. 2007. The production of plant secondary metabolites using bioreactors. ISHS Acta Horticulturae 764: 95-104. [ Links ]
Giraldo, F., C. Cataño, G. Morales, C. López y D. Galeano. 2002. Determinación de azadiractina por cromatografía líquida de alta eficiencia (HPLC) en semillas de árbol de neem (A. indica) cultivados en Colombia. Vitae 9(1): 59-63. [ Links ]
Han, J. and J.J. Zhong. 2003. Effects of oxygen partial pressure on cell growth and ginsenoside and polysaccharide production in high density cell cultures of Panax notoginseng. Enzyme and Microbial Technology 32(3-4): 498-503. [ Links ]
Murthy, H.N., E.J. Hahn and K.Y. Paek. 2008. Adventitious roots and secondary metabolism. Chinese Journal of Biotechnology 24(5): 711-716. [ Links ]
Huang, S.Y., Y.W. Shen and H.S. Chan. 2002. Development of a bioreactor operation strategy for L-Dopa production using Stizolobium hassjoo suspension culture. Enzyme and Microbial Technology 30(6): 779-791. [ Links ]
Jeong, C., D. Chakrabarty, E.J. Hahn, H.L. Lee and K.Y. Paek. 2006. Effects of oxygen, carbon dioxide and ethylene on growth and bioactive compound production in bioreactor culture of ginseng adventitius roots. Biochemical Engineering Journal 27(3): 252-263. [ Links ]
Kuruvilla, T., P. Komaraiah and S. Ramakrishna. 1999. Enhanced secretion of azadirachtin by permeabilized margosa (Azadirachta indica) cells. Indian Journal for Experimental Biology 37: 89-91. [ Links ]
Miller, G.L. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry 31(3): 426-428. [ Links ]
Mordue, A.J., A. Zounos, I.R. Wickramananda and E.J. Allan. 1995. Neem tissue culture and the production of insect antifeedant and growth regulatory compounds. In: Integrated Crop Protection: Towards Sustainability?. BCPC Symp. Proceedings 63: 187-194. [ Links ]
Muñoz, W., O. Vanegas, A. Guzmán, J. Capataz, R. Hoyos y F. Orozco. 2006. Estimación de variables de operación de un bioreactor con células de Azadirachta Indica A. Juss. Revista Facultad Nacional de Agronomía, Medellín 59(2): 3467-3478. [ Links ]
Orozco, F. 2002. Establecimiento de un cultivo de células de suspensión de Eucaliptos cinerea y evaluación de la producción de 1,8 cineol y otros terpenoides por CG-EM. Tesis de Maestría en Biotecnología. Facultad de Ciencias. Universidad Nacional de Colombioa. Medellín. 77 h. [ Links ]
Orozco, F. y M. Rodríguez. 2007. Cultivos de células en suspensión de Azadirachta indica para la producción de un bioinsecticida. Revista Mexicana de Ingeniería Química 6(3): 251-258. [ Links ]
Prakash, G. and A. Srivastava. 2005a. Modeling of azadirachtin production by Azadirachta indica and its use for feed forward optimization studies. Biochemical Engineering Journal 29(1-2): 62-68. [ Links ]
Prakash, G. and A. Srivastava. 2005b. Statistical media optimization for cell growth and azadirachtin production in Azadirachta indica (A. Juss) suspension cultures. Process Biochemistry 40(12): 3795-3800. [ Links ]
Prakash, G., C. Emmannuel and A. Srivastava. 2005. Variability of azadirachtin in Azadirachta indica (Neem) and batch kinetics studies of cell suspension culture. Biotechniology and Bioprocess Engineering 10: 198-204. [ Links ]
Prakash, G. and A. Srivastava. 2007. Azadirachtin production in stirred tank reactors by Azadirachta indica suspension culture. Process Biochemistry 42(1): 93-97. [ Links ]
Prakash, G and A. Srivastava. 2008. Statistical elicitor optimization studies for the enhancement of azadirachtin production in bioreactor Azadirachta indica cell cultivation. Biochemical Engineering Journal 40(1): 218-226. [ Links ]
Raval, K. S. Hellwig, G. Prakash, A. Ramos, A. Srivastava and J. Buchs. 2003. Necessity of a two-stage process for the production of azadirachtin-related limonoids in suspension cultures of Azadirachta indica. Journal of Bioscience and Bioengineering 96(1): 16-22. [ Links ]
Schaaf, O. 2000. Rapid and sensitive analysis of azadirachtin and related triterpenoids from neem (Azadirachta indica) by high performance liquid cromatography atmospheric pressure chemical ionization mass spectrometry. Journal of Chromatography. 886(1-2): 89-97. [ Links ]
Schlatman, J., A. Nuutila, W. Van Gulik, H.J. Ten Hoopen, R. Verpoorte and J. Heijnen. 1993. Scaleup of ajmalicine production by plant cell cultures of Catharanthus roseus. Biotechnology and Bioengineering 41(2): 253-262. [ Links ]
Shin, K., D. Chakrabarty, J. Ko, S. Han and K. Paek. 2003. Sucrose utilization and mineral nutrient uptake during hairy root growth of red beet (Beta vulgaris L.) in liquid culture. Plant Growth Regulation 39(2): 187-193. [ Links ]
Smart, N. and M. Fowler. 1981. Effect of aeration on large-scale cultures of plant cells. Biotechnology Letters 3(4):171-176. [ Links ]
Tate, J. and G. Payne. 1991. Plant cell growth under different levels of oxygen and carbon dioxide. Plant Cell Reports 10(1): 22-25. [ Links ]
Trejo, G. K. Bermúdez, G. Sepúlveda, G. Trejo, G. Jiménez, A. Jiménez y M. Rodríguez. 2007. Aspectos teórico-prácticos del cultivo de células vegetales en bioreactores. Manual de prácticas de laboratorio. Centro de Desarrollo de Productos Bióticos del Instituto Politécnico Nacional y Sociedad Mexicana de Biotecnología y Bioingeniería A.C. Delegación Morelos.
Thanh, N.T., H.N. Murthy, K.W. Yu, C. Seung Jeong, E.J. Hahn and K.Y. Paek. 2006. Effect of oxygen supply on cell growth and saponin production in bioreactor cultures of Panax ginseng. Journal of Plant Physiology 163(12): 1337-1341. [ Links ]
Vasconsuelo, A. and R. Boland. 2007. Molecular aspects of the early stages of elicitation of secondary metabolites in plants. Plant Science 172(5): 861-875. [ Links ]
Zhong, J., F. Chen and W. Hu. 1999. High density cultivation of Panax notoginseng cells in stirred bioreactors for the production of ginseng biomass and ginseng saponin. Process Biochemistry 35(5): 491-496. [ Links ]
Zhong, J., Z. Pan, Z. Wang, J. Wu, F. Chen, M. Takagi and T. Yoshida. 2002. Effect of mixing time on taxoid production using suspension cultures of Taxus chinenesis in a centrifugal impeller bioreactor. Journal of Bioscience and Bioengineenering 94(3): 244-250. [ Links ]














