Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.63 no.1 Medellín Jan./June 2010
CARACTERIZACIÓN FISICOQUÍMICA Y ACTIVIDAD ANTIMICROBIANA DEL PROPÓLEOS EN EL MUNICIPIO DE LA UNIÓN (ANTIOQUIA, COLOMBIA)
PHYSICOCHEMICAL CHARACTERIZATION AND ANTIMICROBIAL ACTIVITY OF PROPOLIS FROM MUNICIPALITY OF LA UNION (ANTIOQUIA, COLOMBIA)
Lady Rossana Palomino García1; Julián Paúl Martínez Galán2; Carlos Mario García Pajón3; Jesús Humberto Gil González4 y Diego Luis Durango Restrepo5
1 Ingeniera Química. Estudiante Maestría en Ciencias-Química. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. Escuela de Química. A.A. 3840. Medellín, Colombia. <lrpalomi@unal.edu.co>
2 Químico de Alimentos. Estudiante Maestría en Ciencia y Tecnología de los Alimentos. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. Departamento de Ingeniería Agrícola y de Alimentos. A.A.1779. Medellín, Colombia.<jpaulmg1@gmail.com>
3 Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. Escuela de Química. A.A. 3840. Medellín, Colombia: <cmgarcia@unal.edu.co>
4 Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. Departamento de Ingeniería Agrícola y fr Alimentos. A.A. 1779. Medellín, Colombia. <jhgilg@unal.edu.co>
5 Profesor Asistente. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. Escuela de Química. A.A. 3840. Medellín, Colombia. <dldurango@unal.edu.co>
Recibido: Marzo 24 de 2009; Aceptado: Febrero 23 de 2010.
Resumen. El propóleo un producto natural elaborado por las abejas melíferas (Apis mellifera) a partir de los brotes y exudados de diferentes plantas, se ha empleado en la medicina tradicional desde tiempos ancestrales, debido a sus propiedades biológicas. La composición química de este producto de la colmena es altamente compleja y dependiente de la vegetación circundante al sitio de recolección. En este trabajo, se evaluaron las características fisicoquímicas, y la actividad antifúngica y antibacteriana del propóleo colectado en el municipio de La Unión (Antioquia, Colombia). Los resultados del análisis fisicoquímico del propóleo fueron: punto de fusión, 67-68 °C; sustancias extractables con hexano, 74,32 ± 0,90%; resinas solubles en etanol, 14,08 ± 2,24%; residuos insolubles, 10,47 ± 0,84%; pérdidas por calentamiento, 1,82 ± 0,32%; cenizas, 0,16 ± 0,01%, y el índice de oxidación, 8,0 ± 3,0 s. Las evaluaciones de actividad antifúngica, contra los hongos Colletotrichum gloeosporioides, C. acutatum, Aspergillus sp. y Penicillium sp., y de actividad antibacteriana, contra Bacillus subtilis (esporulada), Escherichia coli, Staphylococcus aureus y Salmonella tiphy, demuestran un efecto moderado del propóleo en la inhibición del crecimiento del microorganismo. El análisis mediante cromatografía de gases-espectrometría de masas (CG-EM), permitió la detección de ácidos grasos y sus ésteres, esteroides, triterpenos y diterpenos.
Palabras claves: Propóleo, actividad antimicrobiana, Colletotrichum, Bacillus subtilis, composición química.
Abstract. Propolis, a natural product collected by honeybees (Apis mellifera) from certain plant resins, has been used in folk medicine since ancient times, due to its many biological properties. The chemical composition of this hive product is very complex and depends upon the vegetation of the area from where it was collected. In this work, physicochemical characteristics, and antifungal and antibacterial activity of propolis collected in the municipality of La Unión (Antioquia, Colombia) were evaluated. Results of the physicochemical analysis of propolis were: melting point 67-68°C; hexane extractable substances 74.32 ± 0.90%; resins soluble in ethanol 14.08 ± 2.24%; insoluble residues 10.47 ± 0.84%; loss by heating 1.82 ± 0.32%; ash 0.16 ± 0.01%, and oxidation index 8.0 ± 3.0 s. Evaluations of antifungal activity, against the fungi Colletotrichum gloeosporioides, C. acutatum, Aspergillus sp., and Penicillium sp., and antibacterial activity, against Bacillus subtilis (sporulated), Escherichia coli, Staphylococcus aureus and Salmonella tiphy, demonstrated an moderated effect of propolis in the growth of the different microorganisms. The analysis using gas chromatography-mass spectrometry (GC-MS) allows the detection mainly of fatty acids and their esters, steroids, triterpenes, and diterpenes.
Key words: Propolis, antimicrobial activity, Colletotrichum, Bacillus subtilis, chemical composition.
El propóleo es una sustancia resinosa elaborada por las abejas melíferas (Apis mellifera) a partir de los brotes y exudados de ciertas plantas. Una vez colectado, el material es enriquecido con secreciones salivares y enzimáticas (Gómez et al., 2006), y usado para construir y reparar la colmena. Sin embargo, el propóleo no sólo es un material de construcción, sino que también es el “arma química” de las abejas contra los microorganismos patógenos; la presencia de esta sustancia al interior de la colmena proporciona un ambiente inadecuado para el crecimiento de bacterias y otros microorganismos (Kartal et al., 2003).
El propóleo contiene una amplia variedad de compuestos químicos; se han identificado más de 300 (De Castro, 2001), tales como polifenoles (flavonoides, ácidos fenólicos y sus ésteres, aldehídos, alcoholes y cetonas fenólicas), terpenoides, esteroides, aminoácidos, y compuestos inorgánicos (Aga et al., 1994; Bankova, De Castro y Marcucci, 2000). Sin embargo, la composición de este producto de la colmena es altamente variable y dependiente de la flora local en el sitio de recolección (Marcucci 1995; Bankova, de Castro y Marcucci, 2000). Así, algunos estudios han demostrado que los propóleos de regiones templadas (Europa, Norte América, Oeste de Asia) poseen como principales constituyentes compuestos fenólicos (flavonoides, ácidos cinámicos, y derivados), los cuales son colectados a partir de los exudados de diferentes brotes de álamo (Populus spp.), abedul (Betula alba), castaño de Indias (Aesculus hippocastanum) y otros árboles. No obstante, en las regiones tropicales dónde está ausente esta vegetación, las abejas visitan otras plantas como fuente para la producción de propóleos, lo que conduce a diferencias en la composición química. En Brasil, por ejemplo, se han encontrado como constituyentes principales de este producto apícola, terpenoides y derivados prenilados de ácidos p-cumáricos (Marcucci, 1995), mientras que en Chile se encontraron predominantemente lignanos (Valcic, Montenegro y Timmermann, 1998), y en Venezuela, Brasil y Cuba se hallaron benzofenonas preniladas (Tomas et al., 1993; Porto et al., 2000; Trusheva et al., 2004; Hernández et al., 2005). Las resinas de Clusia spp., Araucaria heterophylla, y Baccharis spp. se observaron como las fuentes dominantes del propóleo tropical (Banskota et al., 1998; Bankova, de Castro y Marcucci, 2000; Park, Alencar y Aguiar, 2002; Kumazawa et al., 2003).
Numerosas propiedades biológicas se han asociado con el propóleo, incluyendo antibacteriana, antifúngica, antiviral, antiinflamatoria, antitumoral, antioxidante, entre otras (Dobrowolski et al., 1991; Burdock, 1998; Kujumgiev et al., 1999; Koo et al., 2000; Kumazawa, Hamasaka y Nakayama, 2004). Se pueden distinguir innumerables usos para el propóleo en diferentes industrias: farmacéutica (tanto en medicina humana como medicina veterinaria), agrícola, cosmética, y alimentaría (Matsuka, 2000). En esta última, se ha empleado para múltiples propósitos, tales como la elaboración de bebidas y alimentos funcionales (Banskota, Tezuka y Kadota, 2001), y como conservante de frutas en postcosecha (Sangalli, 1990) y alimentos congelados (Mizuno, 1989), debido a que permite aumentar la vida útil de éstos productos. La diversidad en la composición química de este producto apícola y su empleo generalizado en la industria, ha traído como consecuencia la necesidad de su control de calidad y normalización. Con este fin, se han desarrollado metodologías de trabajo establecidas por diferentes normas internacionales, entre las que se incluyen la norma IRAM-INTA del Instituto Argentino de Normalización-Subcomité de productos agroalimentarios del NOA (2004), la norma Ramal del Ministerio de Agricultura de Cuba (1994), y el reglamento técnico para la fijación de identidad y calidad de propóleos del Ministerio de Agricultura de Brasil (1999).
Actualmente, aunque en Colombia el propóleo es ampliamente utilizado como medicamento homeopático en el tratamiento de infecciones respiratorias, son escasos los estudios que permitan realizar su estandarización química afín de garantizar su calidad, seguridad y eficiencia, necesarios para ser admitido oficialmente entre los sistemas para el cuidado de la salud. En los propóleos colectados en Antioquia, la información sobre la composición, origen, y actividad biológica es aún limitada. El presente trabajo se realizó con el fin de obtener información sobre algunos parámetros fisicoquímicos, tales como punto de fusión, cenizas, material extractable con n-hexano y etanol, residuo insoluble e índice de oxidación, del propóleo colectado en el municipio de La Unión (Antioquia, Colombia), como parte del conjunto de estudios de control de calidad requeridos para la tipificación de este valioso producto de la colmena. Adicionalmente, se analizó el perfil químico mediante cromatografía de gases y se determinó la actividad antifúngica contra Colletotrichum gloeosporioides, C. acutatum, Aspergillus sp. y Penicillium sp. y antibacteriana contra Bacillus subtilis, Escherichia coli, Staphylococcus aureus and Salmonella tiphy.
MATERIALES Y MÉTODOS
Muestras de propóleo. La muestra de propóleo se colectó en un apiario de abejas melíferas africanizadas de la vereda San Juan del municipio de La Unión (Latitud: 5°59’N, Longitud: 75°22’O; 2.473 msnm), Antioquia. La recolección se realizó empleando trampas matrizadas durante los meses de marzo y abril de 2007 (época de lluvias). El muestreo se efectuó en forma aleatoria en las diferentes colmenas del apiario para formar una muestra compuesta representativa. En el área de recolección del propóleo, predominan las especies vegetales Eucalyptus globulus, Baccharis latifolia, Polylepis quadrijuga, Myconia notabilis y Weinmannia tomentosa. Una vez colectado, el material fue almacenado en frascos ámbar y conservado a -20 °C hasta su análisis.
Caracterización fisicoquímica. Se emplearon los métodos recomendados en la norma IRAM-INTA del Instituto Argentino de Normalización - Subcomité de productos agroalimentarios del NOA (2004) así como, la Norma del Ministerio de Agricultura de Brasil (1999). Los parámetros analizados, el procedimiento empleado y los contenidos máximos y mínimos establecidos por las normas fueron los siguientes: Punto de fusión: se determinó en un fusiómetro Fischer Scientific. Pérdidas por calentamiento (humedad): se determinó por termo gravimetría (contenido máximo del 10%). Cenizas: se llevó a cabo por gravimetría en mufla a 500 °C, hasta peso constante (contenido máximo del 5%). Sustancias extractables en n-hexano (ceras): se determinó por gravimetría del residuo obtenido mediante una extracción con n-hexano en un equipo Soxhlet, durante el tiempo necesario para extracción total, posterior destilación del hexano y secado del extracto en estufa a 105 °C hasta peso constante (contenido máximo del 40%). Resinas solubles en etanol: se determinó por gravimetría de las resinas obtenidas mediante una extracción con alcohol etílico del 96%, en un equipo Soxhlet, a partir del residuo sólido resultante de la extracción con n-hexano, posterior destilación del etanol a presión reducida y secado de la resina obtenida hasta peso constante (contenido mínimo del 30%). Residuo insoluble (cuerpos extraños): se realizó por gravimetría del residuo insoluble seco que resulta de las extracciones con n-hexano y alcohol etílico (máximo del 25%). Índice de oxidación: se determinó el tiempo de decoloración de 50 mL de una solución de permanganato de potasio 0,1 N con una solución hidroalcóholica de propóleos (Ministerio de Agricultura de Brasil 1999; Salamanca, Correa y Principal, 2007). Como referencia se suelen considerar valores hasta de 22 segundos como criterio comercial de calidad (Ministerio de Agricultura de Brasil 1999; Salamanca, 2002).
Actividad antifúngica. Para la evaluación de la actividad antifúngica in vitro, se utilizaron cepas de las especies de hongos Aspergillus sp., Penicillium sp., Colletotrichum acutatum y C. gloesporioides. Las dos primeras especies fueron donadas por el Laboratorio de Sanidad Vegetal, y las restantes por el Laboratorio de Fitopatología, de la Universidad Nacional de Colombia, Sede Medellín. La actividad antifúngica, de la resina soluble en etanol del propóleos, se determinó empleando el método de la placa perforada. Previamente se prepararon los inóculos del hongo extendiendo una solución de esporas sobre el medio de cultivo (PDA); luego de 48 h, la capa homogénea de micelio joven, se cortó en cilindros con un sacabocados de 5 mm de diámetro. Estos inóculos se incrustaron en el punto medio de cajas de Petri que contenían agar PDA adicionado de la resina a evaluar; utilizándose 5 niveles de concentración (50, 100, 250, 500, 1000 mg de resina L-1 de medio de cultivo). Para facilitar la incorporación homogénea de la resina en el agar PDA, se empleó 0,5 mL de etanol:tween 60, 1:1; este volumen de mezcla a su vez se incorporó en los respectivos controles. La actividad antifúngica del extracto etanólico del propóleo se determinó en función del diámetro de crecimiento micelial; medido con una regla milimetrada cada 24 h por un período de tiempo máximo de 10 días. Adicionalmente, se determinó el porcentaje de inhibición a las 96 horas de incubación mediante la siguiente ecuación:
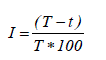
Donde I = % inhibición; T = crecimiento en mm de los testigos de referencia; t = crecimiento en mm de los tratamientos. En las evaluaciones se empleó un diseño completamente al azar, con análisis de medidas repetidas en el tiempo; cada ensayo, contenía tres repeticiones por tratamiento.
Actividad antibacteriana. Para el estudio de la actividad antibacteriana también se empleó la resina soluble en etanol del propóleo. Ésta se pesó bajo condiciones asépticas en viales estériles, y se disolvió con etanol estéril para obtener las concentraciones de estudio (0,1; 1,0 y 10 mg mL-1). La actividad se evaluó por el método de difusión en disco en agar Mueller-Hilton inoculado con la cepa indicadora correspondiente; dos bacterias Gram-positivas: Staphylococcus aureus y Bacillus subtilis (esporulada), y dos Gram-negativas: Escherichia coli y Salmonella tiphy, obtenidas del laboratorio de Microbiología Industrial de la Universidad Nacional de Colombia, Sede Medellín. Para cada experimento se empleo un testigo con etanol. En la superficie del agar se depositaron discos de papel de filtro de 6 mm de diámetro y tamaño de poro de 100 mm previamente esterilizados. Los discos fueron impregnados con 20 mL de las soluciones de propóleo y las cajas incubadas durante 18 h a 37 ºC. Luego de la incubación se realizaron las lecturas del diámetro promedio del halo, con un calibrador. La actividad se expresó como la diferencia, en milímetros, entre el radio del halo de inhibición y el radio del disco de papel filtro. Los experimentos se llevaron a cabo por triplicado y los resultados (diámetros de inhibición en mm) se expresaron como valores promedio. Todas las cepas fueron recuperadas en medio BHI a 37 °C por 24 h.
Análisis cromatográfico. El análisis de cromatografía de gases-espectrometría de masas (CG-EM) se realizó en un cromatógrafo de gases Varian 3800 acoplado a un detector de masas Saturn 2000 (tipo trampa de iones). La separación se llevó a cabo usando una columna HPS-MS (30 m x 0,25 mm x 0,25 mm, Agilent Technologies). Las muestras de propóleo y estándares se analizaron posterior a su derivatización (metilación) usando el método descrito por Markham et al. (1996); una alícuota de 400 mL (10 mg mL-1) del propóleo, o los estándares, disuelto en etanol, se combinó con una solución de CH2N2 (400 mL) en un vial de vidrio, y la mezcla resultante se refrigeró durante 4 horas para permitir la metilación completa. Un volumen de muestra de 1mL se inyectó y analizó mediante CG-EM. La temperatura inicial de la columna fue de 100 °C, la cual se elevó a 280 °C y se mantuvo por 15 min, siendo 45 min el tiempo total de análisis. La inyección se realizó en modo splitless a 250 °C. Se utilizó helio como gas de arrastre a un flujo de 1 mL min-1. Los picos fueron identificados por comparación con datos de la literatura y de la base de datos Nist 02 ó bien por comparación de los tiempos de retención y patrones de fragmentación con muestras auténticas (ácido isocuprésico, agatadiol y 13-epi-torulosol).
RESULTADOS Y DISCUSIÓN
Caracterización fisicoquímica. En Colombia, la producción de propóleo es un mercado cautivo y de manejo artesanal por lo que se requiere de una amplia difusión de las diferentes propiedades fisicoquímicas y biológicas de este material, que permitan proponer alternativas para el mejoramiento de la calidad del producto, y asimismo interesen a los productores y empresarios a incursionar en un rubro no tradicional dentro de la actividad apícola.
Los resultados de las determinaciones fisicoquímicas se presentan en la Tabla 1. A partir de la información referente a las pérdidas por calentamiento, se puede señalar que el propóleo de La Unión, Antioquia, presentó valores relativamente bajos, y cumplen con la normatividad vigente, ya que este parámetro no supera el 10% exigido como valor máximo. La humedad excesiva en el propóleo favorece el desarrollo de algunas especies de mohos y levaduras en la superficie del mismo, lo que se manifiesta por la presencia de capas blancas y verdosas; además de que se pueden producir fermentaciones que a su vez generan productos no deseados, se pueden generar toxinas perjudiciales para la salud (Jürgens, 2008). En cuanto al contenido de cenizas, el propóleo también cumple con la normatividad mencionada, ya que no supera el 5% exigido como valor mínimo para este parámetro.
Tabla 1. Determinaciones físico-químicas para el propóleo del municipio de La Unión, Antioquia - Colombia.
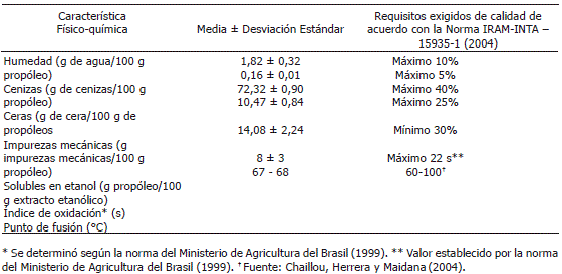
El análisis de sustancias extractables con n-hexano reveló que el propóleo analizado presenta un alto contenido de ceras, 72,32 ± 0,90%, superior al valor máximo permitido por la norma utilizada y al máximo del 40% para propóleo de buena calidad (Arrate, 2008). La presencia de ceras resta pureza al propóleo. El exceso de ceras probablemente, puede ser resultado de la época del año en que se recolectó el propóleo o de una mala manipulación del producto por parte del apicultor, quien eventualmente mezcla el propóleo con cera de la colmena durante la recolección. Además, del contenido de ceras, otro parámetro que influye notablemente en la calidad del propóleo es el contenido de resinas solubles en etanol. Cuanto mayor sea el valor de esta fracción, mejor será en términos de rendimiento, la calidad del producto final, puesto que es allí donde se encuentran los compuestos con actividad biológica (Arrate, 2008). En el estudio se determinó que el propóleo analizado presenta un contenido de resinas solubles en etanol menor al valor mínimo exigido, demostrándose la calidad inferior para éste.
Al igual que las ceras, las impurezas mecánicas no contienen principios activos y su elevada presencia deprecia el producto. El propóleo presentó un contenido de 10,47 ± 0,84 %, valor muy inferior al que establece la normatividad como máximo permitido, 25% y al fijado por Arrate (2008) para propóleos de baja pureza. El punto de fusión de la muestra fue bajo y se encuentra en el rango determinado frecuentemente para propóleo, 60-100 °C (Chaillou, Herrera y Maidana, 2004). El índice de oxidación (8,0 ± 3,0 s) fue inferior al valor máximo establecido en el reglamento técnico para la fijación de identidad y calidad de propóleos del Ministerio de Agricultura de Brasil (1999) de 22 s. Este valor es inferior al presentado en otros propóleos colombianos provenientes de los municipios de Cerinza, Santa Rosa y Belén (Boyacá), y de Tame (Arauca) (Salamanca, Correa y Principal, 2007). A partir de la información referente a éste parámetro, se puede deducir que el propóleo evaluado presenta una buena cantidad de compuestos oxidables. A mayor concentración de este tipo de compuestos menor tiempo de decoloración y por lo tanto mejor calidad del producto.
A pesar de que el propóleo tiene bajo porcentaje de sustancias extractables con etanol éste presenta una rápida decoloración de la solución de permanganato, indicando que posiblemente están presentes compuestos de naturaleza fenólica, o con grupos funcionales oxidables (hidroxilos, instauraciones entre otras), los cuales pueden exhibir actividad biológica.
Actividad antifúngica. En este trabajo, se evaluó la actividad antifúngica del propóleo contra hongos del género Colletotrichum sp., causantes de la enfermedad conocida como antracnosis, la cual afecta diversos frutos y causa pérdidas considerables en la producción tanto en cosecha como en postcosecha (Bailey y Jerger, 1992). Adicionalmente, se analizó el efecto del propóleo contra los hongos toxigénicos del género Aspergillus sp. y Penicillium sp., los cuales causan el deterioro de muchos productos alimenticios (por ejemplo, frutos) y son reconocidos por su capacidad para producir sustancias tóxicas y carcinogénicas en seres humanos y animales (micotoxinas) (Abarca et al., 2001).
En la Figura 1 se representa el crecimiento radial de las especies de hongos evaluadas en presencia de la fracción extractable con EtOH del propóleo. De acuerdo con estos resultados, se observó que durante todo el tiempo de análisis, la fracción del propóleo inhibió o retrasó el crecimiento de todos los hongos en comparación con los testigos. En general, la especie C. acutatum presentó la mayor sensibilidad al propóleo, lo cual se evidencia por la diferencia superior entre el crecimiento micelial de los tratamientos y los testigos durante todo el tiempo de observación, en comparación con las otras especies de hongos evaluadas. Esta mayor inhibición del hongo fitopatógeno C. acutatum, se observa también en la Figura 2, donde se aprecia un retraso del crecimiento micelial superior al 34 % para las concentraciones de 500 y 1000 mg L-1 del extracto de propóleo, luego de 4 días de incubación. En estas mismas condiciones, el crecimiento micelial fue reducido para las especies C. gloeosporioides y Penicillium sp. entre 20 y 30 %.
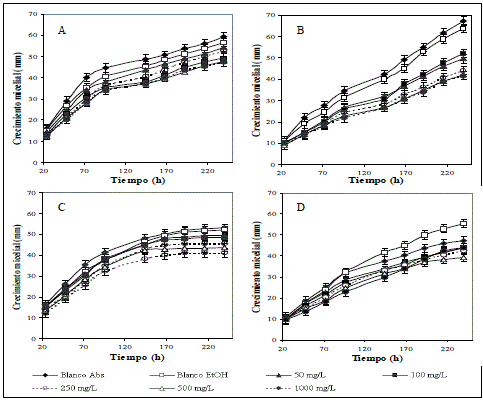
Figura 1. Crecimiento micelial de los hongos Colletotrichum gloeosporioides (A) y Colletotrichum acutatum (B), Aspergillus sp. (C) y Penicillium sp. (D) en presencia de la fracción extractable con EtOH del propóleo del municipio de La Unión, Antioquia-Colombia, a diferente concentración.
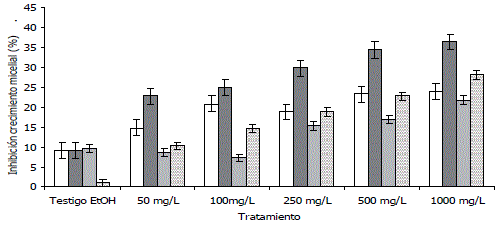
Figura 2. Inhibición del crecimiento micelial de los hongos Colletotrichum gloeosporioides, Colletotrichum acutatum, Aspergillus sp. y Penicillium sp. a las 96 h de incubación con la fracción extractable con EtOH del propóleos del municipio de La Unión, Antioquia-Colombia.
Actividad antibacteriana. La medida de las zonas de inhibición del crecimiento microbiano con la fracción extractable en EtOH del propóleo, se muestran en la Tabla 2. Las bacterias E. coli, S. aureus y S. tiphy, no presentaron reducción del crecimiento en presencia de la fracción del propóleos, mientras que la bacteria Gram positiva B. subtilis (esporulada) fue sensible a las concentraciones de 1,0 y 10,0 mg mL-1, observándose tanto un efecto bacteriostático (leve recrecimiento del cultivo a 1,0 mg mL-1) como bactericida (10,0 mg mL-1), con halos de inhibición de 8,0 ± 1,7 mm (Figura 3). Es importante mencionar que B. subtilis ha demostrado resistencia a algunos antibióticos en el pasado (Graham y Bott, 1975; Cohan, King y Zawadzki, 1994).
Tabla 2. Actividad antibacteriana del extracto etanólico del propóleo del municipio de La Unión, Antioquia - Colombia.
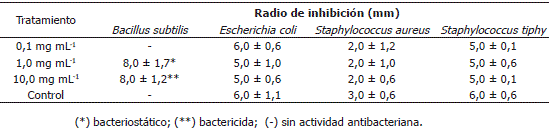
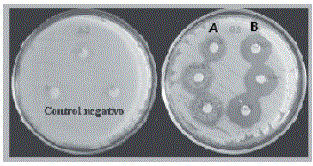
Figura 3. Efecto bacteriostático y bactericida del extracto etanólico del propóleo del municipio de La Unión, a concentraciones de 1 mg/mL (A) y 10 mg/mL (B).
Los resultados de la actividad antibacteriana concuerdan con aquellos encontrados por Grange y Davey (1990), quienes observaron una marcada acción de los propóleos contra bacterias Gram-positivas y una actividad limitada contra aquellas Gram-negativas. Dobrowolski et al. (1991), y Woisky, Giesbrecht y Salatino (1994) también obtuvieron resultados similares, soportando la hipótesis de que los propóleos son activos principalmente contra bacterias Gram-positivas. Además, es conocido que bacterias Gram-negativas como E. coli, poseen una membrana adicional denominada “Estructura OM” la cual les confiere un mayor grado de resistencia a los agentes antimicrobianos (Urzua et al., 1998; Brehm-Stecher y Jonson, 2003). Es necesario, sin embargo, probar el efecto del propóleo, en un número mayor de cepas bacterianas.
Composición química. La composición química del extracto etanólico del propóleo, se evaluó mediante análisis por CG/EM. La identificación de las sustancias se basó en la interpretación del espectro de masas, el tiempo de retención, y por comparación con los espectros de masas reportados en la base de datos Nist 02 y con muestras auténticas. En general, la identificación a partir del análisis de los espectros de masas solamente, y en una mezcla compleja como el propóleo, es una tarea ardua debido al número de isómeros y la presencia de diferencias mínimas en los espectros de los constituyentes (Pereira et al., 2000). La caracterización de los constituyentes se describe a continuación:
Ácidos grasos y sus ésteres: A valores de tiempo de retención entre 15,8 y 20,1 minutos se detectaron los ésteres metílicos o etílicos de los ácidos grasos saturados, palmítico y esteárico, e insaturados, linoléico, oleico y linolénico. Los ésteres metílicos de los ácidos grasos saturados y monoenóicos (ácido oleico) presentaron picos con buena abundancia a m/z 74 y m/z 87, los cuales corresponden a fragmentos de referencia que han sido empleados por otros autores (Vetter y Thurnhofer, 2007). Los ésteres etílicos de los ácidos grasos saturados y monoénoicos mostraron los fragmentos a m/z 73 y 88, mientras que los ésteres metílicos de los ácidos polienóicos (con más de un doble enlace), ácidos linoléico y linolénico, presentaron picos a m/z 79 y 81 (Vetter y Thurnhofer, 2007). Sesquiterpenos: se detectaron cinco sesquiterpenos a tiempos de retención entre 9,0 y 12,0 min, los cuales han sido previamente reportados en propóleos Europeos (Melliou, Stratis y Chinou, 2007; Silici y Kutluca, 2005). Los sesquiterpenos detectados presentaron una señal a m/z 204 (pico de ion molecular para el cadineno y muuroleno, y M-18, pérdida de H2O, para el cadinol y muurolol); adicionalmente la pérdida del grupo metilo genera el ion a m/z 189 y la del grupo isopropilo, resulta en un ión prominente a m/z 161. Triterpenos pentaciclicos: fueron observados seis triterpenos entre los que se encuentran acetato de cicloartenol, 7-Friedouren-3-ol, cuyas fragmentaciones características son m/z 177 (abundante, 84%), 191, 341, 205 (Budzikiewicz et al., 1963), y Acetato del 3-lupanol que presenta el ion característico a m/z 191; sin embargo, se debe tener en cuenta que los espectros de masas de derivados del lupano presentan pocas características en común y solo unos pocos fragmentos ofrecen información útil (Budzikiewicz et al., 1963). Diterpenos: en el propóleo analizado se encontraron dos clases de diterpenos, diterpenos bicíclicos tipo labdano y un ácido tricíclico (ácido abiético). El ácido abiético presentó un pico de ión molecular de 316 um; adicionalmente, señales en m/z 241 (M-75; M-CH3-HCO2CH3; pico prominente), 257 (M-CO2CH3), 256 (M-HCO2CH3), 91 (C7H7+), 213 (M-103; M-C3H7-HCO2CH3) y 273 (M-43; M-C3H7) (Holmbom, Avela y pécala, 1974). Asimismo, los diterpenos tipo labdano presentaron picos con buena abundancia a m/z 109, 107, y 95. Además, para la identificación se tuvieron en cuenta los fragmentos M-18 (pérdida de agua), debida a la presencia del grupo hidroxilo de la cadena α,β-insaturada (Cox et al., 2007); M-60 (perdida del grupo acetato), y las señales con m/z 189, 177 107 y 81, correspondientes a las fragmentaciones del sistema bicíclico, algunas de los cuales han sido previamente utilizados para la detección y cuantificación de diterpenos tipo labdano (Guedes de Pinho et al., 2009).
El cromatograma obtenido y los compuestos detectados se presentan en la Figura 4 y Tabla 3, respectivamente. El número de picos en la Tabla 3 está dado tomando en cuenta el tiempo de retención de los picos mayoritarios. Los resultados muestran que el extracto etanólico del propóleo posee una composición compleja, constituida principalmente por la presencia de ácidos grasos y sus ésteres, triterpenos pentacíclicos, y ácidos diterpénicos. La metodología empleada no permitió la detección de flavonoides ó ácidos fenólicos en la muestra.
De acuerdo con diferentes autores (Kujumgiev et al., 1999; Sforcin et al., 2000), la actividad antibacteriana de los propóleos es debida a la presencia de compuestos fenólicos, especialmente flavonoides, ácidos fenólicos y sus ésteres. No obstante, esta clase de metabolitos secundarios es más característica de los propóleos de zonas templadas. Debido a la relación existente entre la actividad biológica del propóleo y el contenido de diterpenos tipo labdano, de acuerdo con lo observado para propóleos de Brasil (Bankova et al., 1996; Bankova, de Castro y Marcucci, 2000), propóleos de Grecia (Melliou y Chinou, 2004) y propóleos colombianos (Meneses, Durango y García, 2009), se procedió a evaluar la presencia en la muestra de propóleo, de los compuestos de reconocida actividad antimicrobiana, ácido isocuprésico (como éster metílico), 13-epi-torulosol, y agatadiol, mediante comparación de sus propiedades cromatográficas y espectrométricas con estándares puros inyectados bajo las mismas condiciones. El análisis reveló que las señales en CG con tiempos de retención de 22,56, 24,52 y 25,75 min, corresponden con las de los compuestos 13-epi-torulosol, agatadiol y ácido isocuprésico (como éster metílico), respectivamente. Estos resultados indican que posiblemente la actividad biológica de este material se encuentra relacionada con la presencia de los diterpenos tipo labdano o al sinergismo de éstos con otros componentes.
CONCLUSIONES
La muestra de propóleo proveniente del municipio de La Unión, Antioquia presentó características fisicoquímicas que se encuentran dentro de los valores establecidos en normas internacionales; sin embargo, se exceptúan el contenido de ceras, el cual supera el 40%, y el porcentaje de extracto etanólico que fue inferior al valor mínimo exigido en la normatividad. Adicionalmente, la composición química del extracto etanólico fue compleja, destacándose la presencia de ácidos grasos y sus ésteres, sesquiterpenos, triterpenos pentacíclicos y diterpenos biciclicos tipo labdano, tales como: acido isocuprésico, agatadiol y 13-epi-turolosol. La actividad antifúngica del extracto etanólico a concentraciones entre 50 y 1.000 mg mL-1 fue moderada, teniendo mayor efecto de inhibición del crecimiento micelial sobre el hongo C. acutatum (> 34 %). Asimismo, se observó que el extracto posee actividad bacteriostática (a 1,0 mg mL-1) y bactericida (a 10,0 mg mL-1) contra la bacteria Gram positiva esporulada B. subtilis. Con estos resultados se hace un aporte importante a la cadena apícola regional, mediante la caracterización desde el punto de vista químico y de actividad biológica del propóleo proveniente del lugar mencionado; no obstante, es necesario emprender estudios más profundos que permitan relacionar el origen, la composición y la actividad biológica del propóleo aquí considerado y los de otros municipios de Antioquia.
AGRADECIMIENTOS
La presente investigación se realizó gracias a la financiación otorgada por la Universidad Nacional de Colombia sede Medellín a través del proyecto DIME-20101006710. Los autores agradecen al profesor Carlos López de la Universidad de Antioquia por su valiosa colaboración para la obtención de los cromatogramas (GC-MS) y al apicultor Luís Demetrio Rodríguez por la consecución de la muestra.
BIBLIOGRAFÍA
Abarca, M.L., F. Accensi, M.R. Bragulat and F.J. Cabañes. 2001. Current importance of ochratoxin A-producing Aspergillus spp. Journal of Food Protection 64(6): 903–906.
Aga, H., T. Shibuya, T. Sugimoto, M. Kurimoto and S. Nakajima. 1994. Isolation and identification of antimicrobial compounds in Brazilian propolis. Bioscience, Biotechnology and Biochemistry 58(5): 945-946. [ Links ]
Arrate, L. 2008. Propoleo, el “antibiótico” natural de la colmena. Sustrai: Revista Agropesquera 85: 56-61.
Bailey, J.A. and M.J. Jeger. 1992. Colletotrichum: biology, pathology and control. CAB International, Wallingford, UK. 388 p. [ Links ]
Bankova, V.S., S.L. de Castro and M.C. Marcucci. 2000. Propolis: recent advances in chemistry and plant origin. Apidologie 31(1): 3-15. [ Links ]
Bankova, V.S., M.C. Marcucci, S. Simova, N. Nikolova, A. Kujumgiev and S. Popov. 1996. Antibacterial diterpenic acids from Brazilian propolis. Zeitschrift für Naturforschung 51(5-6): 277-280. [ Links ]
Banskota, A.H., Y. Tezuka and S. Kadota. 2001. Recent progress in pharmacological research of propolis. Phytotherapy Research 15(7): 561-571. [ Links ]
Banskota, A.H., Y. Tezuka, J.K. Prasain, K. Matsushige, I. Saiki and S. Kadota. 1998. Chemical constituents of Brazilian propolis and their cytotoxic activities. Journal of Natural Products 61(7): 896-900. [ Links ]
Brehm-Stecher, B. and E. Johnson. 2003. Sensitization of Staphylococcus aureus and Escherichia coli to antibiotics by the sesquiterpenoids nerodiol, farnesol, bisabolol and apritone. Antimicrobial Agents and Chemotherapy 47(10): 3357–3360.
Budzikiewicz, H., J.M. Wilson and C. Djerassi. 1963. Mass spectrometry in structural and stereochemical problems. XXXII Pentacyclic Triterpenes. Journal of the American Chemical Society 85(22): 3688-3699. [ Links ]
Burdock, G.A. 1998. Review of the biological properties and toxicity of bee propolis (propolis). Food Chemical Toxicology 36(4): 347-363. [ Links ]
Chaillou, L.L., H.A. Herrera y J.F. Maidana. 2004. Estudio del propoleos de Santiago del Estero, Argentina. Ciencia e Tecnologia de Alimentos 24 (1): 11-15. [ Links ]
Cohan, F.M., E.C. King and P. Zawadzki. 1994. Amelioration of the deleterious pleiotropic effects of an adaptive mutation in Bacillus subtilis. Evolution 48(1): 81–95.
Cox, R.E., S. Yamamoto, A. Otto and B.T. Simoneit. 2007. Oxygenated di and tricyclic diterpenoids of southern hemisphere conifers. Biochemical Systematics and Ecology 35(6): 342-362. [ Links ]
De Castro, S.L. 2001. Propolis: biological and pharmacological activities. Therapeutic uses of this bee-product. Annual Review of Biomedical Science 3: 49-83. [ Links ]
Dobrowolski, J.W., S.B. Vohora, K. Sharma, S.A. Shah, S.A. Naqvi and P.C. Dandiya. 1991. Antibacterial, antifungal, antiamoebic, antiinflammatory and antipyretic studies on propolis bee products. Journal of Ethnopharmacology 35(1): 77-82. [ Links ]
Guedes de Pinho, P., R.F. Gonçalves, P. Valentão, D.M. Pereira, R.M. Seabra, P.B. Andrade and M. Sotomayor. 2009. Volatile composition of Catharanthus roseus (L.) G. Don using solid-phase microextraction and gas chromatography/mass spectrometry. Journal of Pharmaceutical and Biomedical Analysis 49(3): 674–685.
Gómez, A.M., G.M. Gómez, D. Arráez, A. Segura and A. Fernández. 2006. Advances of phenolic compounds in product derived from bees. Journal of Pharmaceutical and Biomedical Analysis 41(4): 1220-1234. [ Links ]
Graham, R.S. and K.F. Bott. 1975. Antibiotic-resistant mutants of Bacillus subtilis conditional for sporulation. Molecular and General Genetics 137(3): 227-237. [ Links ]
Grange, J.M. and R.W. Davey. 1990. Antibacterial properties of propolis (bee glue). Journal of the Royal Society of Medicine 83(3): 159-160. [ Links ]
Hernández, I., M.C. Fernández, O. Cuesta, A.L. Piccinelli and L. Rastrelli. 2005. Polyprenylated benzophenone derivatives from Cuban propolis. Journal of Natural Products 68(6): 931-934. [ Links ]
Holmbom, B., E. Avela and S. Pekkala. 1974. Capillary gas chromatography-mass spectrometry of resin acids in tall oil rosin. Journal of the American Oil Chemists’ Society 51(9): 397-400.
Instituto Argentino de Normalización-Subcomité de productos agroalimentarios del NOA. 2004. Norma IRAM-INTA 15935-1 Scheme 1. Buenos Aires, Argentina. [ Links ]
Jürgens, C. 2008. Factores que influyen en la producción y almacenado del propóleo. En: Vida Apícola, http://www.vidaapicola.com/tecnica/manejo/almacenado.html. 5 p.; consulta: noviembre 2008. [ Links ]
Kartal, M., S. Yildiz, S. Kaya, S. Kurucu and G. Topçu. 2003. Antimicrobial activity of propolis samples from two different regions of Anatolia. Journal of Ethnopharmacology 86(1): 69-73. [ Links ]
Koo, M.H., B.P. Gomes, P.L. Rosalen, G.M. Ambrosano, Y.K. Park and J.A. Cury. 2000. In vitro antimicrobial activity of propolis and Arnica montana against oral pathogens. Archives of Oral Biology 45(2): 141–148.
Kujumgiev, A., I. Tsvetkova, Y. Serkedjieva, V. Bankova, R. Christov and S. Popov. 1999. Antibacterial, antifungal and antiviral activity of propolis of different geographic origin. Journal of Ethnopharmacology 64(3): 235-240. [ Links ]
Kumazawa, S., M. Yoneda, I. Shibata, J. Kanaeda, T. Hamasaka and T. Nakayama. 2003. Direct evidence for the plant origin of Brazilian propolis by the observation of honeybee behavior and phytochemical analysis. Chemical and Pharmaceutical Bulletin. 51(6): 740–742.
Kumazawa, S., T. Hamasaka and T. Nakayama. 2004. Antioxidant activity of propolis of various geographic origins. Food Chemistry 84(3): 329–339.
Marcucci, M.C. 1995. Propolis: chemical composition, biological properties and therapeutic activity. Apidologie 26(2): 83-99. [ Links ]
Markham, K.R., K.A. Mitchell, A.L. Wilkins, J.A. Daldy and Y. Lu. 1996. HPLC and GC-MS identification of the major organic constituents in New Zealand propolis. Phytochemistry 42(1): 205-211. [ Links ]
Matsuka, M. 2000. Criteria of propolis in Japan. p. 4. In: Japan Propolis Conference. Japan Health Food and Nutrition Food Association. Tokio. [ Links ]
Melliou, E., E. Stratis and I. Chinou. 2007. Volatile constituents of propolis from various regions of Greece – Antimicrobial activity. Food Chemistry 103(2): 375–380.
Melliou, E. and I Chinou. 2004. Chemical analysis and antimicrobial activity of Greek propolis. Planta Medica 70(6): 515-519. [ Links ]
Meneses, E.A., D. Durango and C.M. García. 2009. Antifungal activity against postharvest fungi by extracts from Colombian propolis. Química Nova 32(8): 2011-2017. [ Links ]
Ministerio de Agricultura de Brasil-Apacame. 1999. Reglamento técnico para fijar la identidad y calidad de propóleos. Revista Mensagem Doce 52. [ Links ]
Ministerio de Agricultura de Cuba. 1994. Norma Ramal Cubana: Apicultura NRAG-1135-94 (Propóleos Materia Prima), Especificaciones. La Habana, Cuba. [ Links ]
Mizuno, M. 1989. Food packaging materials containing propolis as a preservative. Japanese Patent No. JP Ol 243 974 [89 243 974]. 5 p. [ Links ]
Park, Y.K., S.M. Alencar and C.L. Aguiar. 2002. Botanical origin and chemical composition of Brazilian propolis. Journal of Agricultural and Food Chemistry 50(9): 2502-2506. [ Links ]
Pereira, A.S., M. Norsell, J.N. Cardoso, F.R. Aquino and M.F. Ramos. 2000. Rapid screening of polar compounds in Brazilian propolis by high-temperature high-resolution gas chromatography-mass spectrometry. Journal of Agriculture and Food Chemistry 48(11): 5226-5230. [ Links ]
Porto, A.L., S.M. Machado, C.M. de Oliveira, V. Bittrich, M.C. Amaral and A.J. Marsaioli. 2000. Polyisoprenylated benzophenones from Clusia floral resins. Phytochemistry 55(7): 755-768. [ Links ]
Salamanca, G.G. 2002. Origen naturaleza y características de los propóleos. p. 101-110. En: Memorias XVI Seminario Americano de Apicultura. Secretaria de Agricultura Pesca y Alimentación. Tuxtla, Gutiérrez, México. [ Links ]
Salamanca, G., I.L. Correa y J. Principal. 2007. Perfil de flavonoides e índices de oxidación de algunos propóleos colombianos. Zootecnia Tropical 25(2): 95-102. [ Links ]
Sangalli, A. 1990. La propoli. L´Ape Nostra Amica 12(4): 16-25. [ Links ]
Sforcin, J.M., J.A. Fernandes, C.A.M. Lopes, V. Bankova, and S.R.C. Funari. 2000. Seasonal effect on Brazilian propolis antibacterial activity. Journal of Ethnopharmacology 73(1-2): 243-249. [ Links ]
Silici, S. and S. Kutluca. 2005. Chemical composition and antibacterial activity of propolis collected by three different races of honeybees in the same region. Journal of Ethnopharmacology 99(1): 69–73.
Tomas, F.A., C. García, P. Vit-Olivier, F. Ferreres and F. Tomas.1993. Phytochemical evidence for the botanical origin of tropical propolis from Venezuela. Phytochemistry 34(1): 191-196. [ Links ]
Trusheva, B., M. Popova, H. Naydenski, I. Tsvethkova, J.V. Rodríguez and V. Bankova. 2004. New polyisoprenylated benzophenones from Venezuelan propolis. Fitoterapia 75 (7-8): 683-689. [ Links ]
Urzua, A., M. Caroli, L. Vasquez, L. Mendoza, M. Wilkens and E. Tojo. 1998. Antimicrobial study of the resinous exudate and of diterpenoids isolated from Eupatorium salvia (Asteraceae). Journal of Ethnopharmacology 62(3): 251-254. [ Links ]
Valcic, S., G. Montenegro and B.N. Timmermann. 1998. Lignans from Chilean Propolis. Journal of Natural Products 61(6): 771-775. [ Links ]
Vetter, W. and S. Thurnhofer. 2007. Analysis of fatty acids by mass spectrometry in the selected ion monitoring mode. Lipid Technology 19(8): 184-186. [ Links ]
Woisky, R.G., A.M Giesbrecht e A. Salatino. 1994. Atividade antibacteriana de uma formulação preparada a partir de própolis de Apis mellifera L. Revista da Farmacia e Bioquimica da Universidade de Sao Paulo 30(1): 19-21. [ Links ]














