Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.63 no.1 Medellín Jan./June 2010
DIGESTIÓN ANAEROBIA DE LACTOSUERO: EFECTO DE ALTAS CARGAS PUNTUALES
ANAEROBIC DIGESTION OF WHEY: EFFECT OF HIGH POINT LOADS
Ricardo Adolfo Parra Huertas1
1 Profesor Titular. Universidad Pedagógica y Tecnológica de Colombia, UPTC. Escuela de Ciencias Químicas. Avenida Central de Norte. Tunja, Colombia. <rparrahuertas@hotmail.com>
Recibido: Octubre 14 de 2009; Aceptado: Febrero 24 de 2010
Resumen. La tecnología de tratamiento anaeróbico se ha desarrollado para el tratamiento de aguas residuales principalmente de origen alimentario. El trabajo tuvo como objetivo determinar el comportamiento del sistema de depuración anaerobio cuando se incorporaban altas cargas puntuales de lactosuero. Se utilizó lactosuero ácido el cual alimentaba un sistema de dos etapas, biofiltro anaerobio y reactor UASB. Se manejaron 3 cargas constantes de 5,200 mg DQO/L.día, 7,800 mg DQO/L.día y 10.500 mg DQO/L.día; en cada carga se aplicaron 3 cargas puntuales de lactosuero ácido: 5,700 mg DQO/L.día, 26,300 mg DQO/L.día y 34.200 mg DQO/L.día, cada una con una duración de 24 horas. El tiempo de retención hidráulico del sistema fue 2,9 días; el valor del pH para la influente de las cargas puntuales y constantes fue de 7,0 previamente añadiéndose bicarbonato de sodio, para la efluente, el pH en las cargas constantes fue 7,6 y 7,7 para las cargas puntuales. La temperatura de operación se mantuvo en un intervalo de 15-20 °C. En las cargas constantes (CC) la eliminación de DQO fue 57% y en las cargas puntuales (CP) 82%. En azúcares la eficiencia fue 99% en las CC y CP. En proteína la eliminación fue 64% para las CC y CP 89%. Los ácidos grasos volátiles en las CC tuvieron una concentración de 403 mg/L en el influente y en efluente una concentración de 3.156 mg/L, en las CP la influente presentó concentración de 572 mg/L y para el efluente 4.492 mg/L. El sistema de dos etapas soportó las cargas puntuales hasta 6,5 veces la carga constante sin disminuir sus eficiencias, por el contrario las eficiencias en las variable respuesta estuvieron por encima de las cargas orgánicas constantes, observándose que el sistema propuesto es una buena opción para el tratamiento de agua residual con lactosuero pudiendo soportar descargas de lactosuero puro, por lo que puede ser recomendado a los productores de queso.
Palabras clave: Reactores, digestión anaerobia, lactosuero, carga, eficiencia.
Abstract. Anaerobic treatment technology was developed for wastewater treatment mainly of dietary origin. The work was aimed at determining the behavior of the anaerobic treatment system when incorporating whey high point loads. Acid whey was used, which fed the two-stage system, and anaerobic biofilter reactor UASB. 3 charges were handled constant of 5,200 mg COD / L.day, 7,800 mg COD / L.day and 10.500 mg COD / L.day; on each charge is applied 3 point charges whey acid: 5,700 mg COD / L.day, 26,300 mg COD / L.day and 34,200 mg COD / L.day, each with a duration of 24 hours. The hydraulic retention time of the system was 2.9 days, the pH value for the influent of constant point charges was 7.0 and adding sodium bicarbonate prior to the effluent, the pH at constant loads was 7.6 and 7.7 for loads point. The operating temperature was in the range of 15-20 °C. In the constant loads (CC) elimination of COD was 57% and point charges (PC) 82%. Sugar efficiency was 99% in CA and PC. Protein removal was 64% for CC and CP 89%. Volatile fatty acids in the CC had a concentration of 403 mg/L in the influent and effluent concentration of 3,156 mg/L in the influent introduced the CP concentration of 572 mg/L and the effluent 4,492 mg/L. The two-stage system endured until the point charges 6.5 times the constant load without reducing their efficiency; however, the efficiencies in the response variable were above the constant organic loads, noting that the proposed scheme is a good option for treatment with whey wastewater discharges could bear pure whey, so it can be recommended for cheese producers.
Key words: Reactors, anaerobic digestion, whey, load, efficiency.
La industria láctea genera residuos líquidos, los cuales requieren disposición de una gran cantidad de inversión de capital (Donoso et al., 2009). La mayoría de plantas lácteas no tienen sistemas de tratamiento apropiados para la disposición de lactosuero y el vertimiento de los constituyentes de lactosuero generan una significante perdida potencial alimenticio y de energía; además, que se caracterizan por una alta concentración de (Demanda química de oxígeno) DQO y (Demanda biológica de oxígeno) DBO, representando alto contenido orgánico.
Composición y tipos de lactosuero. El lactosuero es definido como “la sustancia líquida obtenida por separación del coágulo de leche en la elaboración de queso”. Es un líquido translúcido verde obtenido de la leche después de la precipitación de la caseína. Existen varios tipos de lactosuero dependiendo principalmente de la eliminación de la caseína, el primero denominado dulce, está basado en la coagulación por la renina a pH 6,5. El segundo llamado ácido resulta del proceso de fermentación o adición de ácidos orgánicos o ácidos minerales para coagular la caseína como en la elaboración de quesos frescos (Parra, 2009). La diferencia entre los dos tipo de lactosuero son el contenido de mineral, la acidez y la composición de la fracción de proteína de lactosuero.
Aproximadamente, 9 kg de lactosuero resultan por cada kg de queso producido y el costo asociado con la disposición de este gran volumen de lactosuero es substancial. Ya que comprende el 80-90% del volumen de la leche durante el proceso de elaboración del queso y contiene cerca del 50% de los sólidos presentes en la leche original, incluyendo 20% de proteína y la mayor de lactosa, minerales y vitaminas hidrosolubles.
El lactosuero está compuesto de lactosa (5%), agua (93%), proteínas (0,85%), minerales (0,53) y una mínima cantidad de grasa (0,36%). El lactosuero causa contaminación ambiental debido a su alta DBO dentro de un rango de 30,000-50,000 mg/L, siendo su disposición difícil y costosa. La presencia de lactosa en el lactosuero es la principal responsable para este valor de DBO alta (Mukhopadhyay et al., 2005).
La producción de lactosuero a nivel mundial genera más de 145 millones de toneladas por año (Donoso et al., 2009), lo anterior justifica el desarrollo de varios métodos de tratamientos para este residuo, a pesar de las diferentes posibilidades de la utilización de lactosuero, aproximadamente la mitad del producido a nivel mundial es descartado sin tratamiento (Donoso et al., 2009).
Digestión anaerobia. Los procesos de digestión anaerobia han sido principalmente aplicados a residuos con alta carga orgánica y aguas residuales, por ejemplo efluentes de vinos, leche y sus derivados, cervezas o lodos de plantas de tratamiento de aguas residuales (Donoso et al., 2009; Montero et al.,2008); involucra la degradación y estabilización de materiales orgánicos bajo condiciones anaerobias por organismos microbianos (Chen et al., 2008); este proceso se basa en un consorcio de poblaciones de microorganismos simbióticos e interdependientes, los cuales son capaces de utilizar un diverso espectro de sustratos en la ausencia de oxígeno para la síntesis de productos finales (Ghaly, 1996); esta degradación anaerobia de materia orgánica puede ser llevada a cabo en un amplio rango de temperaturas incluyendo condiciones termofílicas, mesofílicas y psicrofílicas (Tartakovsky et al., 2007).
Este proceso ha tenido ventajas como la baja generación de lodos, consumo reducido de energía y alta producción de metano. La principal desventaja de la digestión anaerobia es su lentitud (Montero et al., 2008). Además, con esta tecnología dos efluentes residuales son producidos: biogás (principalmente metano (CH4) y dióxido de carbono (CO2)) los cuales empleados como una fuente de energía, y otra efluente que podría ser utilizada como un acondicionador de suelos debido a sus propiedades fisicoquímicas (Montero et al., 2008).
El proceso de digestión anaerobia consiste en la transformación de la materia orgánica a través de una serie de reacciones bioquímicas, en un biogás con un alto contenido de CH4, que puede ser aprovechado como fuente de energía y un efluente sólido, con excelentes características para ser utilizado como fertilizante para el suelo (Mascad y Zhang, 2010). Durante la primera etapa, participan las bacterias hidrolíticas, encargadas de romper los polímeros orgánicos (polisacáridos, proteínas, y lípidos) para convertirlos a monómeros tales como los ácidos grasos volátiles de cadena larga, los alcoholes, el hidrógeno (H2) y el CO2; posteriormente intervienen las bacterias fermentativas o acidogénicas que transforman los productos formados durante la hidrólisis en ácido acético y compuestos intermedios como el etanol, el ácido láctico, el ácido propiónico, el ácido fórmico y el ácido butírico, además de H2 y el CO2. Estos productos son convertidos en acetato, H2 y el CO2 por las bacterias acetogénicas. Finalmente, el CH4 es producido por las bacterias metanogénicas a partir del acetato, el H2 y el CO2 (Sandoval et al., 2007).
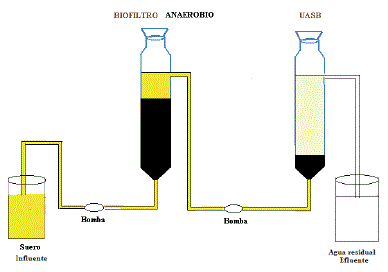
Reactores anaeróbicos. Los reactores anaeróbicos son una alternativa atractiva para el tratamiento de aguas residuales (Donoso et al., 2009), están incrementándose para el tratamiento de varios tipos de aguas residuales por sus costos operacionales bajos, requerimientos de espacio pequeño, alta eficiencia en la eliminación de carga orgánica y producción baja de lodos, combinada con un beneficio neto de energía a través de la producción de biogás. El reactor anaerobio de cama de lodos de flujo ascendente (UASB) y biofiltro anaeróbico son los reactores anaeróbicos más frecuentemente utilizados (Rajinikanth et al., 2008).
Reactor anaerobio de cama de lodos de flujo ascendente (UASB). Es un reactor anaerobio alimentado por la parte inferior, puede ser dividido en 4 compartimentos (de abajo hacia arriba): cama de lodos, zona fluidizada, separador de gas líquido y el compartimento de sedimentación (Kalogo y Verstraete, 1999). El funcionamiento se basa en la formación de un lecho de lodo biológico constituido por los microorganismos responsables de realizar la digestión anaerobia (Kalogo y Verstraete, 1999); La forma granular del lodo evita que los microorganismos sean evacuados del reactor por el flujo ascendente del agua.
El reactor UASB así como el de otros sistemas, ha encontrado buena aplicación en el tratamiento de aguas residuales basadas en la industria papelera, industria textilera, residuos de refinería petroquímica e industrias alimentarias que incluyen residuos de frutas y vegetales, refinería de aceites comestibles, derivados lácteos, industria cárnica, producción de azúcar y almidón, procesamiento de productos marinos, y fermentaciones (Chen et al., 2008; Monroy et al., 2000; Fuentes et al., 2007; Kamah et al., 2010).
El reactor UASB es uno de los procesos más comúnmente utilizado para la recuperación de aguas residuales con más de 500 instalaciones tratando un amplio rango de aguas residuales industriales (Nuntakumjorn et al., 2008). Este reactor fue primero introducido para optimizar el tratamiento anaerobio de aguas residuales agroindustriales (Kalogo y Verstraete, 1999) que contenían una concentración media-alta de materiales orgánicos (Chiu-Yue et al., 2001). La aplicación de tecnología UASB para el tratamiento de residuos está rápidamente creciendo en América Latina, con recientes experiencias en Argentina, Brasil, Colombia, Guatemala y México, donde el 45% de todos los reactores anaerobios están frecuentemente tratando residuos, incluyendo el reactor más grande (83.700 m3) (Seghezzo et al., 1998).
Los reactores del tipo UASB presentan una serie de ventajas: bajos requerimientos de nutrientes, ahorro eléctrico (no transferencia de O2), beneficios de productos como el metano utilizado, niveles de eficiencia altos en eliminación de materia orgánica (Bermúdez et al., 2003).
La mayoría de reactores a gran escala han sido diseñados para el tratamiento de aguas residuales donde los carbohidratos son los principales contaminantes. Sin embargo, algunas aguas residuales agroindustriales contienen también una fracción significante de proteínas, las cuales son los principales componentes responsables de la DQO en las efluentes de reactores anaeróbicos (Fuentes et al., 2007).
El objetivo de este trabajo consistió en determinar el comportamiento del sistema de depuración anaerobio, cuando se incorporaban altas cargas puntuales de lactosuero, teniendo en cuenta que se pretendía simular las condiciones verdaderas de temperatura ambiente.
MATERIALES Y MÉTODOS
Localización. Esta investigación se realizó en los laboratorios del Centro de Investigaciones en Ciencia y Tecnología de los Alimentos del Instituto de Ciencias Agropecuarias de la Universidad Autónoma del Estado de Hidalgo en México.
Materiales
Lactosuero. El lactosuero ácido en este estudio fue obtenido de la Empresa Prounilac. Las muestras fueron proporcionadas desde la empresa, colectadas en contenedores de 10 L y llevada diariamente al laboratorio, refrigerada y almacenada a 4 °C para evitar la acidificación y cambios en la composición química del lactosuero. Durante la fase de adaptación, lactosuero diluido a pH 6,5 fue alimentado al reactor. Basados en la necesidad del experimento, varias diluciones de lactosuero fueron preparadas utilizando agua destilada. El pH del lactosuero fue ajustado a 7, utilizando bicarbonato de sodio puro. En la Tabla 1 se observan las características fisicoquímicas y microbiológicas del lactosuero ácido proveniente de Prounilac, utilizado para este trabajo.
Lodos. Los lodos anaeróbicos granulados utilizados como base en el sistema fueron tomados de la planta de tratamiento de agua residual local. Los lodos anaeróbicos fueron aclimatados para la degración de lactosuero, durante el periodo de inicio del sistema a través de la continua operación del sistema alimentado con lactosuero durante 6 meses.
Operación de reactor. Se utilizó un sistema de dos etapas formado por dos reactores: biofiltro anaerobio y un reactor UASB; el biofiltro anaerobio de capacidad de volumen 2,5 L fue inoculado al 40% de su capacidad con lodos anaerobios previamente adaptados, y con un tiempo de retención hidráulico (TRH) de 1,9 días; el reactor UASB tuvo capacidad de volumen de 2,5 L inoculado con 25% de lodos anaerobios, y un tiempo de retención hidráulico de 2,9 días; el sistema trabajo a condiciones de temperatura ambiente de laboratorio (15-20 ºC) simulando condiciones verdaderas de trabajo a nivel de planta puesto que posteriormente el experimento se realizaría a escala real para el tratamiento de lactosuero de la ciudad.
Tabla 1. Características fisicoquímicas y microbiológicas del lactosuero ácido proveniente de Prounilac.

Tanto al influente como al efluente se les determinaron los siguientes análisis:
-
Demanda química de oxígeno: método espectrofotométrico pH.
-
Azúcares totales: método espectrofotométrico.
-
Proteína: método espectrofotométrico (Bradford, 1976).
-
Amonio: método electroforesis capilar (Cahours et al., 1998).
-
Ácidos grasos volátiles - AGV (acido acético, propiónico, butírico): método electroforesis capilar.
La cuantificación de AGVs y amonio se hizo mediante un equipo de electroforesis capilar marca Beckman-Coler. Las muestras se centrifugaron a 6000 rpm durante quince minutos y filtradas por medio de un filtro de 0,45 mm. Se preparó solución buffer para AGVs (ácido benzoico 10 mM, TTAB 1 mM e histidina 10 mM) ajustando el pH a 6 con una solución de hidróxido de sodio 4 N. El buffer utilizado para la determinación de amonio fue una solución de imidazol en una concentración 10 mM ajustando el pH con una solución de ácido acético 1 M.
RESULTADOS Y DISCUSIÓN
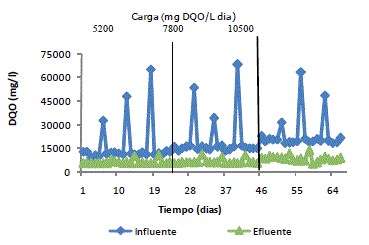
La Figura 3 muestra el comportamiento de los azúcares totales en el sistema biofiltro - reactor UASB durante su degradación. Se observa que se llevó a cabo una total degradación de los carbohidratos por parte del consorcio microbiano encapsulados en los lodos anaerobios; sin importar la carga constante manejada y ni la carga puntual tuvo una eficiencia de degradación mayor al 98% en el efluente; estos resultados son similares a los obtenidos por Vidal et al. (2000) que encontraron eficiencias en un rango de 92-100%, estos mismos autores mencionan además, que la biodegradación de carbohidratos (como lactosa) es más rápida y casi total en condiciones anaerobicas, de allí su alta degradación.
Najafpour et al., 2008 encontraron porcentajes degradación de azúcares de 80-85% a un TRH de 36 horas, además se estableció que a medida que aumentaba la DQO el porcentaje de degradación de azúcares disminuía gradualmente.
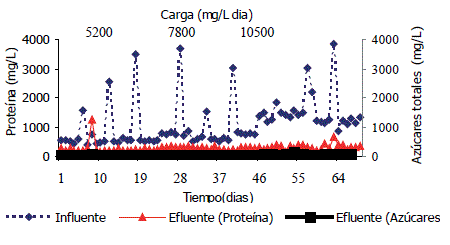
Figura 3. Comportamiento de la proteína y azúcares totales en un sistema anaerobio a diferentes cargas.
La Figura 3 muestra el comportamiento de la proteína, se observa que la eficiencia de degradación en la carga de 5.200 mg DQO/L·día y 7.800 mg DQO/L·día de lactosuero fue 61% aproximadamente, mientras que para la tercera carga (10.500 mg DQO/L·día) fue 73% en eficiencia; para las cargas puntuales 15.700, 26.300 y 34.200 mg/L·día DQO manteniendo en las carga de 5.200, 7.800 y 10.500 mg DQO/L·día, el promedio de eficiencia para proteína fue 89, 86 y 91% respectivamente; estos resultados son menores comparados con los hallados por Vidal et al. (2000), donde al manejar cargas de 5.400, 6.400, 10.900 y 16.400 mg DQO/L·dia las eficiencias fueron del 95, 95, 92 y 90% respectivamente, estas diferencia de eficiencias es quizás debido a lo que afirman Parkin y Owen (1986) quienes mencionan que el material proteico es degradado más completamente a temperaturas termofílicas, de acuerdo a Vidal et al. (2000) en condiciones anaerobias la hidrólisis de proteínas es más lenta que la hidrólisis de carbohidratos, la eficiencia de degradación en proteína es menor a la de carbohidratos en condiciones anaerobias debido a que la hidrólisis de proteínas es más lenta que la hidrólisis de carbohidratos.
Un compuesto relacionado con la degradación de proteínas es el amonio; Chen et al. (2008), mencionan que el amonio es producido por la degradación biológica de materia nitrogenada, principalmente proteína y urea. Un exceso de concentración de amonio puede atravesar difusamente dentro de la célula, causando un desbalance de protones y/o deficiencia de potasio; para las cargas de 5.200; 7.800 y 10.500 mg DQO/L·día se obtuvo una concentración de 208, 282 y 343 mg/L de amonio respectivamente; para las cargas puntuales de 15.700; 26.300 y 34.200 mg DQO/L·día el promedio de amonio fue 509, 468 y 549 mg/L respectivamente; lo anterior, puede ser observado en la Figura 4.
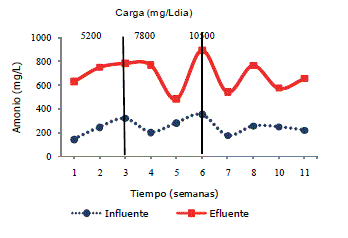
Figura 4. Efecto de las diferentes cargas en la producción de amonio.
Concentraciones de amonio entre 200-1.000 mg/L son satisfactorias en digestores anaerobios, mientras que concentraciones arriba de 3.000 mg/L han sido observadas como fuertemente inhibidores según Parkin y Owen (1986); además, que es considerado el amonio como estimulatorio debido a que el nitrógeno es un nutriente esencial; en otros trabajos como los de Vidal et al. (2000); Malaspina et al. (1996) se observaron valores máximos de amonio de 1.196 mg/L, lo anterior permite establecer que las concentraciones de amonio en este trabajo y en el nuestro estuvieron en un nivel normal.
Una vez los complejos orgánicos son hidrolizados, ellos son fermentados a cadenas largas, ácidos orgánicos, azúcares, aminoácidos, y eventualmente a pequeños ácidos orgánicos como propiónico, butírico y ácido valérico (Parkin y Owen, 1986). El comportamiento de ácidos grasos volátiles se detalla en la Figura 5, se observa que a mayor carga puntual hay una mayor concentración de AGVs en el efluente del sistema. En el sistema la influente tuvo en promedio 530 mg/L de AGVs y para el efluente el promedio fue 4.158 mg/L de AGVs, Se han encontrado concentraciones de AGVs cerca de 6.000 mg/L, estas son menores a las tres cargas puntuales, al respecto Malaspina et al. (1996) e Inanc et al. (1999) mencionan que las poblaciones metanogénicas pueden tolerar concentraciones de ácido acético, ácido propiónico y ácido butírico superior a 10.000 mg/L, además es un valor indicativo que permite suponer que la digestión anaerobia marcha bien; al respecto Parkin y Owen (1986), han mencionado que concentraciones de ácidos volátiles arriba de 6.000 mg/L pueden ser toleradas.
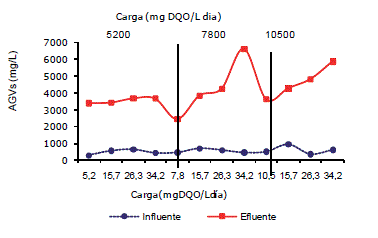
Figura 5. Comportamiento de AGV en un sistema anaerobio a diferentes cargas.
En la Figura 6 se muestra el comportamiento de pH durante el experimento, para la carga de 5.200, 7.800 y 10.500 mg DQO/L·día los valores de pH fueron 7,3; 7,7 y 7,9 respectivamente, para las cargas puntuales en las carga de 5.200, 7.800 y 10.500 mg DQO/L·día el promedio de los valores de pH fueron de 7,4; 7,9 y 7,8 respectivamente.
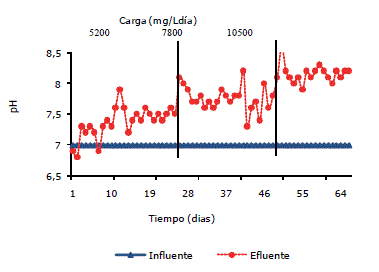
Figura 6. Comportamiento del pH en un sistema anaerobio a diferentes carga.
El pH es una de las variables más importantes, el mantenimiento en un rango apropiado es requerido para una digestión anaerobia eficiente, generalmente el rango aceptado para una eficiencia es pH en promedio 6,5-7,6 según Parkin y Owen (1986), y de 6,7-7,4 según Rajeshwari et al. (1998); estos datos son cercanos a los obtenidos en este trabajo en el efluente.
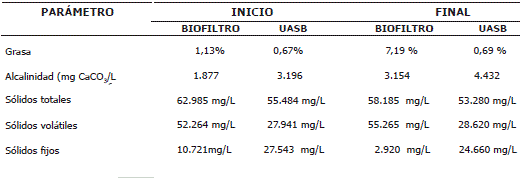
En la Tabla 3 se puede ver que aumentó en 6 veces el valor de grasa para el biofiltro, es decir retuvo en gran de la efluente, mientras que para el reactor UASB el aumento en la grasa fue mínimo cumpliendo el biofiltro la función de retener grasa como lo mencionan Saavedra et al. (2005), igualmente en la Tabla 3 se puede observar que los sólidos totales y fijos tanto en el biofiltro como reactor UASB disminuyeron al final del experimento, los sólidos volátiles aumentaron en ambos reactores; sin embargo, en el biofiltro fue mayor posiblemente debido al aumento notable de grasa que retenía durante el experimento como lo describe Saavedra et al. (2005).
CONCLUSIONES
Los resultados obtenidos muestran que el sistema formado por biofiltro-reactor UASB es una opción viable para el tratamiento de aguas residuales que contienen lactosuero, con eficiencias de degradación de DQO en promedio de 56% en las cargas orgánicas constantes y 78% en eficiencia de DQO en las cargas puntuales.
El sistema de dos etapas biofiltro reactor UASB mostró no ser afectado por cargas puntuales hasta 35.000 mg DQO/L·día con eficiencias de 80% en la DQO.
La degradación de carbohidratos fue del 99% en las cargas constantes orgánicas y cargas puntuales orgánicas, mientras que para proteínas, la eficiencia fue de 64% para las cargas constantes orgánicas y para las cargas puntuales la eficiencia en promedio fue 88%.
RECOMENDACIONES
Se sugiere llevar a cabo una digestión anaerobia de lactosuero utilizando temperaturas termofílicas con el fin de aumentar la eficiencia en la degradación de materia orgánica.
BIBLIOGRAFÍA
Álvarez, J., L. Otero and J. Lema. 2010. A methodology for optimising feed composition for anaerobic co-digestion of agro-industrial wastes. Bioresource Technology 101(4): 1153-1158. [ Links ]
Bermúdez, R., S. Rodríguez, M. Martínez y A. Terry. 2003. Ventajas del empleo de reactores UASB en el tratamiento de residuales líquidos para la obtención de biogas. Tecnología Química 23(2): 37-44. [ Links ]
Bradford, M.1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry 72(1-2): 248-254. [ Links ]
Cahours, X., P. Morin and M. Dreux. 1998. Quantitative determination of inorganic minor cations in sodium-calcium-magnesium-matrix simulated samples by capillary electrophoresis. Journal of Chromatography 810(1-2): 209-220. [ Links ]
Donoso, A., M. Carballa, G. Ruiz and R. Chamy. 2009.Treatment of low strength sewage with high suspended organic matter content in an anaerobic sequencing batch reactor and modeling application. Electronic Journal of Biotechnology 12(3):1-10. [ Links ]
Chen, Y., J. Cheng and K. Creamer. 2008. Inhibition of anaerobic digestion process: A review. Journal Bioresource Technology 99(10): 4044–4064.
Chiu-Yue, L., C. Feng-Yun and K. Creamer. 2001. Treatment of wastewaters using an upflow anaerobic sludge blanket reactor. Journal Water Environment Research 73: 194-201. [ Links ]
Fuentes, M., N. Scenna, P. Aguirre and M. Mussati. 2007. Anaerobic digestion of carbohydrate and proteinbased wastewaters in fluidized bed bioreactors. Latin American Applied Research 37:235-242. [ Links ]
Ghaly, A.E. 1996. A comparative study of anaerobic digestion of acid cheese whey and dairy manure in a two stage reactor. Journal Bioresource Technology 58(1): 61-72. [ Links ]
Ghaly, A., D. Ramkumar, S. Sadaka and J. Rochon. 2000. Effect of reseeding and pH control on the performance of a two-stage mesophilic anaerobic digester operating on acid cheese whey. Canadian Agricultural Engineering 42 (4):173-183. [ Links ]
Inanc, B., S. Matsui and S. Ide. 1999. Propionic acid accumulation in anaerobic digestion of carbohydrates: An investigation on the role of hydrogen gas. Water Science and Technology 40(1): 93-100. [ Links ]
Kalogo, Y. and W. Verstraete. 1999. Development of anaerobic sludge bed (ASB) reactor technologies for domestic wastewater treatment: motives and perspectives. World Journal of Microbiology and Biotechnology 15(5): 523-534. [ Links ]
Kamah, H., A. Tawfik, M. Mahmoud and H. Halim. 2010. Treatment of high strength wastewater from fruit juice industry using integrated anaerobic/aerobic system. Desalination 253(1-3): 158–163.
Malaspina, F., C. Cellamare, L. Stante and A. Tilche. 1996. Anaerobic treatment of cheese whey with a downflow-upflow hybrid reactor. Bioresource Technology 55(2): 131-140. [ Links ]
Mashad, H. and R. Zhang. 2010. Biogas production from co-digestion of dairy manure and food waste. Bioresource Technology 101(11): 421-428. [ Links ]
Monroy, O., G. Fama, M. Meraz, L. Montoya and H. Macarie. 2000. Anaerobic digestion for wastewater treatment in Mexico: state of the technology. Water Resources 34(6): 1803-1816. [ Links ]
Montero, B., J. Garcia, D. Sales and R. Solera. 2008. Evolution of microorganisms in thermophilic-dry anaerobic digestion. Bioresource Technology 99(8): 3233-3243. [ Links ]
Najafpour, G., B. Hashemiyeh, M. Asadi and M. Ghasemi. 2008. Biological treatment of dairy wastewater in an upflow anaerobic sludge-fixed film bioreactor. American-Eurasian Journal Agricultural and Environmental Science 4(2): 251-257. [ Links ]
Nuntakumjorn, B., W. Khumsalud, N. Vetsavas, T. Sujjaviriyasup and C. Phalakornkule. 2008. Comparison of sludge granule and UASB performance by adding chitosan in different forms. Journal Science 35(1): 95-102. [ Links ]
Parkin, G. and W. Owen. 1986. Fundamentals of anaerobic digestion of wastewater sludge. Journal of Environmental Engineering 112(5): 867-915. [ Links ]
Parra, R. 2009. Lactosuero: importancia en la industria de alimentos. Revista Facultad Nacional de Agronomía 62(1): 4967-4982. [ Links ]
Rajeshwari, K., A. Kansas and K. Lata. 1998. Anaerobic digestion technologies for energy recovery from industrial wastewater- a study in Indian context. TERI. Information Monitor on Environmental Science 3(2). [ Links ]
Rajinikanth, R., I. Ramírez, J. Steyer, I. Mehrotra, P. Kumar, R. Escudie and M. Torrijos. 2008. Experimental and modeling investigations of a hybrid upflow anaerobic sludge-filter bed (UASFB) reactor. Water Science & Technology 58(1): 109-117. [ Links ]
Rico, J., P. García and F. Polanco. 1991. Anaerobic treatment of cheese production wastewater using a UASB reactor. Bioresource Technology 37(3): 271-276. [ Links ]
Saavedra, P., R. Campos, M. Cisneros, O. Monroy, R. Rodríguez y J. Pimentel. 2005. Degradación de lactosuero ácido a diferentes concentraciones en un biofiltro hidrolítico. Memorias en extenso del XXVI Encuentro Nacional AMIDIQ. Acapulco, México. [ Links ]
Sandoval, C., M. Carreño, E. Castillo y M. Vergara. 2007. Caracterización microbiológica de lodos anaerobios utilizados en el tratamiento de la fracción orgánica de los residuos sólidos urbanos. Scientia et Technica 35: 509-514. [ Links ]
Seghezzo, L., G. Zeeman, J. Van Lier, V. Hamelers and G. Lettinga. 1998. A review: the anaerobic treatment of sewage in UASB and EGSB reactors. Bioresource Technology 65: 398-407. [ Links ]
Health Association (APHA)/American Water Works Association/Water Pollution Control Federation. 1992. Standard Methods for the Examination of Water and Wastewater. American Public, 18th edition. Washington DC, USA. [ Links ]
Tartakovsky, B., E. Morel, P. Dansereau, M. Perrier and S. Guiot. 2007. Control of an anaerobic mesophilic reactor using periodic temperature variations.10 International IFAC Symposium on Computer Applications in Biotechnology. México. [ Links ]
Vidal, G., A. Carvalho, R. Mendez and J. Lema. 2000. Influence of content in fats and proteins on the anaerobic biodegradability of dairy wastewaters. Bioresource Technology 74(3): 231-239. [ Links ]