Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.63 no.1 Medellín Jan./June 2010
EVALUACIÓN DEL USO DE ENZIMAS Y FILTRACIÓN POR GRAVEDAD PARA LA CLARIFICACIÓN DE UNA MEZCLA DILUIDA DE PULPA DE FRUTOS DE CACTUS (OPUNTIA BOLDINGHII BRITTON & ROSE), JUGOS DE NARANJA Y TORONJA
EVALUATION OF THE USE OF ENZYMES AND GRAVITY FILTRATION FOR CLARIFICATION OF DILUTED MIXTURE OF CACTUS (OPUNTIA BOLDINGHII BRITTON & ROSE) FRUITS PULP, ORANGE AND GRAPEFRUIT JUICES
Carlos Alberto Padrón Pereira1 y Mario José Moreno Álvarez2
1 Investigador. Universidad Simón Rodríguez. Laboratorio de Biomoléculas. Canoabo, Estado Carabobo, Venezuela. <carlospadron1@gmail.com>
2 Profesor Titular. Universidad Simón Rodríguez. Laboratorio de Biomoléculas. Canoabo, Estado Carabobo, Venezuela. <morenoalvarez@cantv.net>
Recibido: Abril 1 de 2009; Aceptado: Mayo de 2010
Resumen. En Venezuela los frutos de cactus (Opuntia boldinguii) son de escasa utilidad comercial. Para su aprovechamiento se evaluó el efecto del uso combinado de enzimas fibrolíticas y filtración por gravedad en la clarificación de una mezcla diluida de pulpa de frutos de cactus, jugos de naranja y toronja. Se compararon los valores de las curvas de flujo de filtrado de las mezclas hidrolizada y sin hidrolizar mediante la prueba t de Welch. La concentración óptima de enzimas fue 0,76% (v/v). La hidrólisis enzimática previa a la pasteurización no afectó el color de la mezcla. Durante los ensayos de pasteurización (62 ± 1 ºC por 30 min) hubo grandes cambios de coloración, solo en la mezcla hidrolizada, por degradación de las betalaínas y la adición de ácido ascórbico (0,5% p/v) permitió preservar el color. Hubo diferencias altamente significativas entre los valores de las curvas de flujo de filtrado (P<0,01). El flujo de filtrado de la mezcla hidrolizada, transcurridos 110 min (0,159 mL·min-1), fue mayor al flujo de la mezcla sin hidrolizar (control) a los 8 min (0,100 mL·min-1). El rendimiento en producción de jugo durante la filtración de la mezcla hidrolizada fue 38,3% mayor al obtenido con la mezcla control. La elaboración de bebidas cítricas pigmentadas con frutos de cactus representa una alternativa de aprovechamiento de estas especies y la hidrólisis enzimática previa a la elaboración constituye un tratamiento para mejorar la calidad.
Palabras claves: Betalaínas, cactus, filtración, hidrólisis enzimática, Opuntia boldinghii, pasteurización de bebidas cítricas.
Abstract. In Venezuela the fruits of cactus (Opuntia boldinguii) are of scarce commercial usefulness. For its utilization the effect of combined use of fibrolytic enzymes and gravity filtration for clarification of diluted mixture of cactus fruits pulp, orange and grapefruit juices was evaluated. The values of filtered-flow curves of hydrolyzed and not hydrolyzed mixtures were compared by means of Welch’s t-test. The optimal enzymes concentration was 0.76% (v/v). The prior enzymatic hydrolysis to the pasteurization does not affect the color of the mixture. During the pasteurization assays (62 ± 1 ºC for 30 min) there were large changes of coloring, only in the hydrolyzed mixture, by betalains degradation and the addition of ascorbic acid (0.5% w/v) permitted to preserve the color. There were highly significant differences between the filtered-flow curves values (P<0.01). The filtered-flow of the hydrolyzed mixture elapsed 110 min (0.159 mL·min-1) was greater to the not hydrolyzed mixture (control) flow to the 8 min (0.100 mL·min-1). The juice production yield during the filtration of hydrolyzed mixture was 38.3% greater than that obtained with the control mixture. The elaboration of citric beverages pigmented with fruits of cactus represents an alternative of utilization of these species and the prior enzymatic hydrolysis to the elaboration constitutes a treatment to improve the quality.
Key words: Betalains, cactus, citric beverages pasteurization, enzymatic hydrolysis, filtration, Opuntia boldinghii.
En Venezuela, los frutos del cactus Opuntia boldinghii Britton & Rose tienen escasa utilidad comercial, y su aprovechamiento está limitado al consumo fresco debido a dificultades en el manejo postcosecha y al desconocimiento de su potencial alimentario (Viloria et al., 2002; Moreno et al., 2003). La pulpa de frutos de cactus puede ser utilizada para la elaboración de jugos. Estos frutos se procesan porque son alimentos que proveen diversidad de pigmentos y promueven la salud (Moßhammer, Stintzing y Carle, 2006; Cassano, Conidi y Drioli, 2010). Kuti (2004) demostró que los frutos de Opuntia (Cactaceae) son una buena fuente de antioxidantes y su consumo puede contribuir sustancialmente con cantidades en la dieta. Entre los pigmentos de algunas especies, se encuentran las betalaínas, que poseen actividad antioxidante (Azeredo, 2009; Guzmán et al., 2010), la cual en sinergia con otros compuestos como los fenólicos, se incrementa (Georgiev et al., 2010). En un estudio llevado a cabo en ratas por Galati et al. (2005), se evidenció que un jugo elaborado a partir del fruto de la especie Opuntia ficus indica (L.) Mill. produjo un efecto hepaprotector el cual pudo estar relacionado con el contenido de flavonoides del jugo, los cuales actuando sinergísticamente con otros compuestos como la vitamina C y las betalaínas, contribuyeron a disminuir procesos degenerativos por medio de su actividad antioxidante. De otro lado, los frutos de toronja (Citrus paradisii M.) son cultivados principalmente para la obtención de jugos y reciben atención por sus propiedades nutricionales y antioxidantes asociadas al contenido de ácido ascórbico y flavonoides, los cuales se ha señalado son parte importante de sus ingredientes activos (Wu, Guan y Ye, 2007; Xu et al., 2008).
Entre los problemas que se presentan en la elaboración de jugos están la turbidez y la viscosidad (Ribeiro et al., 2010). Flores et al. (1995) señalan que el problema en la elaboración de jugos de cactus son los sedimentos. La adición de complejos enzimáticos puede mejorar el rendimiento en producción de jugos (Das et al. 2004; Ribeiro et al., 2010). El uso de enzimas para la clarificación de jugos de pulpa de cactus ha sido llevado a cabo exitosamente por Sáenz et al. (2006) probando una gran variedad de enzimas de diferente procedencia. El efecto de los procesos de microfiltración y ultrafiltración sobre la composición fisicoquímica de jugos de cactus, ha sido investigado para evaluar la influencia de los tratamientos de clarificación sobre el contenido de los principales parámetros (Cassano, Conidi y Drioli, 2010). También el efecto de la pasteurización de jugo de cactus sobre el color y la estabilidad de las betalaínas ha sido evaluado, determinándose que las pérdidas de betalaínas y las alteraciones de las características de color fueron mínimas mediante el sistema de alta temperatura con breves periodos de tiempo (HTST) (Moßhammer, Stintzing y Carle, 2006; Herbach et al., 2007). Moreno et al. (2003) en la pasteurización de bebidas formuladas con pulpa de tuna y jugos de naranja y toronja, empleó tratamientos térmicos de baja temperatura en largo tiempo (LTLT) (60 ± 0,1 ºC durante 30 min).
El objetivo de este trabajo fue clarificar una mezcla diluida de pulpa de frutos de cactus, jugos de naranja y toronja mediante tratamiento enzimático y filtración por gravedad para incrementar el rendimiento en producción de mezcla de jugos.
MATERIALES Y MÉTODOS
Selección y tratamiento de las materias primas. Mediante un muestreo de juicio se seleccionó un lote de 2 kg de frutos de cactus (O. boldinghii Britton & Rose), en plantas de 1,5 a 2,0 m de altura; en su ambiente natural, en la zona de Guama, sector Los Chucos (Estado Yaracuy, Venezuela), mediante los siguientes criterios: madurez de consumo, color rojo homogéneo y sin rastros de deterioro (Moreno et al., 2003). La cosecha se llevó a cabo en un mismo sitio y un mismo día en horas de la tarde.
Se seleccionaron 36 frutos de naranjas (Citrus sinensis L.) en la zona de Montalbán, sector El Charal y 24 frutos de toronjas amarillas (Citrus paradisii M.) en la zona de Canoabo, sector Los Naranjos (Estado Carabobo), de varias plantas, pertenecientes a la cosecha de Abril de 2007, utilizando como criterios de muestreo para ambos frutos: sin rastro aparente de clorofilas, madurez homogénea y ausencia de daños por oleocelosis o rameado. Los frutos fueron lavados con agua corriente, secados con papel absorbente, colocados en una cava-termo de poliestireno y trasladados al Laboratorio de Biomoléculas de la Universidad Nacional Experimental “Simón Rodríguez”, Núcleo Canoabo, Estado Carabobo, donde se almacenaron en una nevera a 6 ± 1 ºC.
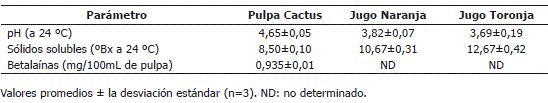
Análisis de materias primas. A la pulpa de cactus y los jugos de naranja y toronja se le realizaron análisis de pH (COVENIN, 1983) y grados Brix (COVENIN, 1977). El contenido de betalaínas en pulpa de cactus se determinó de la siguiente manera: 10 g de pulpa se mezclaron con agua destilada en un balón aforado de 100 mL, se agitó y filtró en embudo de placa porosa. Del filtrado se tomó una alícuota de 10 mL y se diluyó con agua hasta el aforo en un balón de 100 mL. La muestra diluida se colocó en celdas espectrofotométricas y se midió la absorbancia en un espectrofotómetro (Agilent, modelo 8453 UV-Visible, con software Spectroscopy System), a una longitud de onda (l) de 537 nm y pH 6,1. La concentración se calculó empleando la siguiente ecuación: Betalaínas(g·L-1)=(Absorbancia·ε-1)PM·FD, donde: g/L=Concentración (p/v); ε=Coeficiente de extinción molar de betacianina (E1cm1%:1120 L·mol-1·cm-1); PM=Peso molecular y FD=Factor de dilución (Viloria y Moreno, 2001; Viloria et al., 2002).
Preparación de la mezcla de jugos. Los frutos del cactus, fueron lavados con agua, cortados en trozos y despulpados en un extractor de jugos (Oster modelo 3169). Las naranjas y toronjas fueron cortadas ecuatorialmente por la mitad y fue extraído el jugo en un exprimidor de cítricos (Oster, modelo 4100-08A).
La pulpa de cactus y los jugos de naranja y toronja se mezclaron (MJ) en una relación de 1:3:3, respectivamente y se añadieron 65 mL de agua para completar un volumen de 100 mL. La proporción de esta mezcla de jugos diluida (MJD) está basada en una investigación previa llevada a cabo por Moreno et al. (2003) y dicha proporción representa un 53,85 mL de MJ/100mL de agua (%v/v). La MJD estuvo exenta de sacarosa comercial.
Enzimas utilizadas. Se empleó la combinación de dos preparaciones enzimáticas comerciales de la casa DSM (Países Bajos); Rapidase® TF y Rapidase® LIQ Plus. Ambas preparaciones son solubles en agua y con ligero olor a fermentación. Rapidase® TF está basada principalmente con actividades pectinasa y hemicelulasa. La actividad standard declarada de Rapidase® TF es de 100.000 AVJP/g (actividades pectinasas por gramo) y sus condiciones óptimas de trabajo son: pH de 3,0-5,5 y temperatura de 10-55 ºC. Rapidase® LIQ Plus, está basada en actividades pectinasa, hemicelulasa y celulasa, predominando esta última, y sus condiciones: pH 5,8 y temperatura 30-35 ºC (Interenzimas Ltda., 2006).
Determinación de la concentración óptima de enzimas. En un beaker de 500 mL, se colocaron 300 mL de la MJD. El beaker fue sumergido en agua contenida en un recipiente provisto de una camisa con resistencia eléctrica el cual posee regulador de temperatura que se controló a 35 ± 1 ºC y se ajustó el pH a 5,8 ± 0,1 con una solución de carbonato de sodio 2M, utilizando un potenciómetro marca HANNA, modelo pH211. Las muestras se dosificaron con una combinación enzimática de Rapidase® TF y Rapidase® LIQ Plus en una proporción 1:1 y una relación porcentual de concentración de enzimas/concentración de MJD ([E]/[MJD]) de 0,2; 0,4; 0,6; 0,8; 1,0; 1,2 y 1,4% (v/v). Se agitó a 150 rpm intermitentemente cada 5 min empleando un agitador de hélice marca IKA, modelo RW15, siendo el tiempo de hidrólisis de 30 min, posteriormente se colocó el beaker sobre una plancha previamente calentada y regulada a 85 ºC por 5 min para la desactivación enzimática. Luego de la desactivación se determinó el porcentaje de azúcares reductores (AR) mediante el método de Lane-Eynon (AOAC, 1990); seleccionándose como la concentración óptima de enzimas [E0], aquella que produjo mayor porcentaje de AR. Se empleó un control sin adición de enzimas. Los ensayos se realizaron por triplicado y se hizo una gráfica [AR] = ƒ [E]. En esta investigación todas las determinaciones de concentración de AR son expresadas o referidas como gramos de glucosa/100 mL de MJD.
Evaluación del tiempo de hidrólisis. Se colocaron 300 mL de la MJD en un beaker de 500 mL, como en el caso anterior. Se controló la temperatura a 35 ± 1 ºC y ajustó el pH a 5,8 ± 0,1 con solución de carbonato de sodio 2M. Se dosificó con la concentración de enzimas óptima [E0] determinada en el ensayo previo. La hidrólisis se llevó a cabo con agitación a 150 rpm (intermitente cada 5 min) durante 5, 15, 30, 45, 60, 75 y 90 min. La desactivación enzimática se llevó a cabo a 85 ºC por 5 min, determinándose posteriormente el porcentaje de AR (AOAC, 1990). Los ensayos se realizaron por triplicado y se elaboró una gráfica [AR] = ƒ (t). Este ensayo permitió definir el tiempo máximo de hidrólisis.
Hidrólisis enzimática de la MJD. 300 mL de la MJD se colocaron en un beaker de 500 mL (sumergido). Se controló la temperatura a 35 ± 1 ºC y se ajustó el pH a 5,8 ± 0,1. Se dosificó con la combinación enzimática de Rapidase® TF y Rapidase® LIQ Plus en una proporción 1:1 acorde a la concentración de enzimas óptima [E0] y se agitó a 150 rpm intermitentemente cada 5 min durante el tiempo máximo de hidrólisis determinado previamente. Se desactivaron las enzimas a 85 ºC por 5 min y se determinó finalmente el contenido de AR (AOAC, 1990) Este ensayo se realizó por duplicado y permitió obtener la mezcla de jugos diluida hidrolizada enzimáticamente (MJDHE), también exenta de sacarosa comercial.
No se realizaron ensayos de evaluación del efecto de la variación de la concentración de sustratos por considerarse que la concentración de sustrato óptima para la hidrólisis corresponde a 53,85 mL de MJ/100 mL de agua (%v/v) (5% de pulpa de cactus + 15% de jugo de naranja + 15% de jugo de toronja + 65% de agua) indicada por Moreno et al. (2003) en un estudio previo.
Pruebas de pasteurización y determinación de la actividad enzimática residual. Muestras de 300 mL de MJD se colocaron en un beaker de 500 mL (sumergido). Se controló la temperatura a 35 ± 1 ºC, el pH se ajustó a 5,8 ± 0,1 y se dosificó con la concentración de enzimas óptima [E0]. La hidrólisis se llevó a cabo con agitación intermitente a 150 rpm durante el tiempo máximo de hidrólisis determinado. Seguidamente las mezclas de jugos diluidas se pasteurizaron a baja temperatura en largo tiempo (LTLT) sobre una plancha previamente calentada y regulada a 62 ± 1 ºC durante 30 min con agitación constante, y culminado el tiempo de pasteurización se dejó en reposo. Este ensayo se realizó con el doble propósito de pasteurizar el producto hidrolizado y determinar la efectividad del tratamiento térmico para desactivar las enzimas. La actividad residual de las enzimas fue medida mediante un refractómetro marca Bausch & Lomb, modelo ABBE-3L de precisión ± 0,1 ºBx (COVENIN, 1983), a distintos intervalos de tiempo desde la preparación de la MJD (ºBx iniciales) hasta 5 horas después de la pasteurización (ºBx finales). Se pasteurizó un control sin adición de enzimas. Los ensayos se realizaron por triplicado.
Pruebas de filtración. Muestras de MJD y MJDHE se filtraron separadamente, por gravedad, en embudo de vidrio empleando papel Whatman Nº 4. Se midió el volumen del filtrado a diferentes intervalos de tiempo y se graficaron en función del tiempo de filtración (V = ƒ (t)). Se calcularon los flujos de filtrado mediante la ecuación: F = V·t-1 (donde: F = flujo de filtrado (mL·min-1); V = volumen de filtrado (mL) y t = tiempo de filtración (min)) y se graficaron. Estas experiencias permitieron definir el mejor rendimiento en producción de mezcla de jugos. Los ensayos se realizaron por triplicado.
Análisis estadísticos. Los valores promedios ± la desviación standard, se calcularon mediante el menú de estadística descriptiva del software Statistix for Windows versión 9.0 (Analytical Software, Tallahassee, Florida, USA). La comparación de los valores de las gráficas de los flujos de filtrado se llevó a cabo mediante una Prueba t de Welch para dos muestras independientes, utilizando el Software MedCalc® versión 11.3.1.0 (MedCalc Software bvba, Mariakerke, Belgium).
RESULTADOS Y DISCUSIÓN
Análisis de materias primas. En la Figura 1 se presenta el espectro de absorción de betalaínas en pulpa de cactus, donde se obtuvo un valor de absorbancia máxima de 0,27 unidades a una l de 537 nm. No se observó desplazamiento batocrómico que pudiese estar asociado a eventos de degradación de pigmentos y este valor coincide con los señalados por otros autores para la betacianina, pigmento mayoritario en pulpas de cactus de la especie en estudio (Viloria y Moreno, 2001; Viloria et al., 2002). Esta medida de absorbancia permitió calcular la concentración de betalaínas mediante la ecuación basada en el coeficiente de extinción molar (ε).
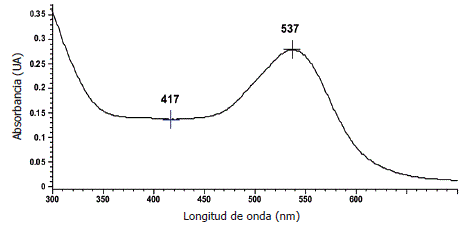
Figura 1. Espectro de absorción de betalaínas en pulpa de cactus.
Los análisis fisicoquímicos realizados a las muestras de materias primas se presentan en la Tabla 1. Los valores de pH y sólidos solubles (°Bx) determinados en la pulpa del fruto del cactus (O. boldinghii Britton & Rose), son similares a los indicados por Moreno et al. (2003) de 4,5 y 6,5; respectivamente, para muestras de la misma especie en estudio y difieren de los obtenidos por El-Samahy et al. (2008) en la especie O. ficus-indica, quienes determinaron un valor de pH 5,72 y sólidos solubles de 11,53 ºBx. El contenido de betalaínas fue mayor al señalado por Moreno et al. (2003) de 0,59 mg/100 mL de pulpa, y al indicado por Repo y Encina (2008) de 6,9 mg/100 mL para la especie O. ficus-indica. Estas diferencias se relacionan a factores tales como, la variedad y el medio ambiente (El-Samahy et al., 2008). En relación a los jugos de naranja y toronja, los resultados obtenidos en este estudio son similares a los descritos en otros trabajos (Padrón y Moreno, 1999; Isgro et al., 2001; Moreno et al., 2003; Karadeniz, 2004; Tariq et al., 2007) exceptuando el contenido de grados Brix del jugo de toronja que fue mayor.
Tabla 1. Análisis fisicoquímico de las materias primas utilizadas para la clarificación de una mezcla diluída de jugos de frutos.
Determinación de la concentración óptima de enzimas. En la Figura 2 se presenta la variación del contenido de AR por efecto de la variación de la concentración de enzimas en la hidrólisis de la MJD. Inicialmente, sin adición de enzimas, el contenido de AR en la muestra fue de 3,09 g glucosa/100 mL de MJD; luego, con la adición de la mezcla enzimática hubo un incremento progresivo de la concentración de azúcares hasta 3,79% (p/v) cuando la concentración de enzimas fue de 0,76 mL/100 mL de MJD, y a partir de este valor el aumento en la adición de enzimas no produjo efecto en el incremento de la concentración de azúcares, considerándose este como la concentración óptima de enzimas [E0] para ser utilizada en la hidrólisis de la MJD.
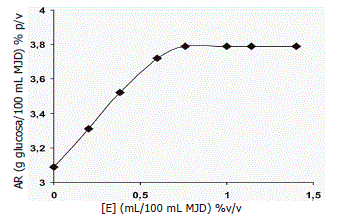
Figura 2. Efecto de la variación de la concentración de enzimas en la hidrólisis de una mezcla diluida de jugos de frutos.
Evaluación del tiempo de hidrólisis. La Figura 3, presenta el efecto de la variación del tiempo de hidrólisis en la degradación enzimática de la MJD bajo condiciones de concentración óptima de enzimas (0,76 mL/100 mL de MJD, %v/v) y sustrato (53,85 mL de MJ/100 mL de agua, %v/v). En ella se aprecia que al cabo de 90 min se obtuvo el mayor contenido de AR (4,19 g glucosa/100 mL de MJD), no obstante a los 60 min el valor fue 4,17% (p/v) por lo que se consideró este último tiempo como el mas idóneo para la obtención de hidrolizados a partir de la MJD, por no existir gran variación en relación a los 90 min y por razones de ahorro de energía y tiempo.
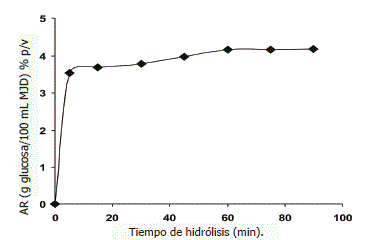
Figura 3. Efecto de la variación del tiempo de hidrólisis en la degradación enzimática de una mezcla diluida de jugos de frutos.
En condiciones establecidas de: concentración de enzimas, tiempo de hidrólisis, pH y temperatura, se determinó la actividad enzimática de la combinación Rapidase® TF y Rapidase® LIQ Plus sobre la MJD, obteniéndose un valor de 2,48 mg glucosa/mL enzimas TF+LIQ Plus·min·mL de MJD.
Análisis fisicoquímicos de las mezclas de jugos diluidas. En la Tabla 2 se presentan los análisis realizados a las mezclas de jugos diluidas antes y después de la hidrólisis enzimática. Los contenidos de sólidos solubles (°Bx) y AR se incrementaron luego del tratamiento enzimático. La combinación enzimática empleada para la hidrólisis está constituida por enzimas del sistema celulasa (endoglucanasas, exoglucanasas y celobiasas), hemicelulasas y pectinasas y es probable que las endoglucanasas actuaron sobre las cadenas largas en las regiones amorfas de las fibras de celulosa produciendo oligosacáridos y aumentando la disponibilidad de los extremos no reductores de la molécula sobre los cuales ejercieron su acción las exoglucanasas provocando la liberación de unidades de celobiosas. Las celobiasas degradaron la celobiosa formando monómeros de glucosa contribuyendo a aumentar los valores citados. Las hemicelulosas y pectinas se encuentran estrechamente asociadas a las fibras de celulosa y por la acción enzimática se produjeron conversiones a azúcares más simples, mediante diversos mecanismos, que también contribuyeron a elevar los contenidos de sólidos solubles y AR (Lemos et al., 2003; Ovando, Waliszewski y Pardio, 2005; Rai y De, 2009; Ribeiro et al., 2010).
Tabla 2. Análisis fisicoquímicos de las mezclas diluidas de jugos de frutos antes y después del tratamiento enzimático.

Pruebas de pasteurización y determinación de la actividad enzimática residual. Luego de la hidrólisis en las condiciones previamente establecidas de concentración de enzimas y tiempo, la desactivación enzimática a 85 ºC por 5 min generó ligeros cambios de coloración en la obtención de la MJDHE y durante los ensayos de pasteurización (62 ± 1 ºC por 30 min) se pudieron apreciar grandes cambios de coloración en la MJDHE y ningún cambio en la MJD no hidrolizada (control). Moreno et al. (2003) en la elaboración de una bebida formulada con pulpa de cactus y jugos de naranja y toronja (sin adición de ácido ascórbico y sin tratamiento enzimático) no apreciaron cambios de coloración luego de la pasteurización. Es conocido que las betalaínas son termolábiles; Farías (2003), señala que la degradación de la betanina (betacianina de las betalaínas), que suele ser el mayor responsable del color rojo (Fernández et al., 2002), comienza a ser significativa a partir de los 55 ºC. El gran cambio de coloración ocurrido en la MJDHE se atribuye a la acción de las enzimas fibrolíticas sobre los componentes estructurales que sirven de soporte a las betalaínas (pectinas, hemicelulosas y celulosas) modificando su estructura y haciéndolas mas susceptibles a la degradación por efecto del calor. También es conocido que en la elaboración de bebidas cítricas pigmentadas con fuentes naturales de betalaínas como frutos de cactus y raíces de remolacha, el ácido ascórbico ejerce un efecto protector sobre las mismas (Moreno et al., 2003; Moreno et al., 2007; Moßhammer et al., 2007; Azeredo, 2009) y en este sentido, luego de la hidrólisis, se adicionó previo a la pasteurización, ácido ascórbico en concentración de 0,5% (p/v), logrando preservarse el color en las mezclas de jugos diluidas (hidrolizadas y no hidrolizadas) hasta 15 días después del tratamiento térmico. Así mismo, es recomendable al inicio de la desactivación enzimática (85 ºC por 5 min), en los ensayos de determinación de la concentración de enzimas y evaluación del tiempo de hidrólisis, la adición de 0,5% de ácido ascórbico. Moßhammer et al. (2007) en la evaluación del impacto de la adición de ácido ascórbico, isoascórbico y cítrico en la estabilidad al calor de las betalaínas de frutos de pulpa de cactus a 85 ºC, pH 4 y 6 y durante un lapso de tiempo de 1 h a 24 h en condiciones de refrigeración; determinaron que la estabilidad de los pigmentos y las características de color dependen del tipo de concentración del aditivo añadido y de las condiciones de pH.
En relación a la actividad residual de las enzimas, en la Tabla 3 se presentan las mediciones (en ° Brix) realizadas a la mezcla de jugos diluida con enzimas, antes y después de la hidrólisis, al finalizar la pasteurización y en reposo (1 y 5 h después), en comparación con la mezcla de jugos diluida sin enzimas (control). Luego de la hidrólisis en condiciones previamente establecidas, hubo un incremento en los ° Brix de 4,0 a 4,6; esto fue debido a la acción enzimática de la mezcla Rapidase® TF y Rapidase® LIQ Plus sobre compuestos fibrosos insolubles transformándolos a fracciones solubles o azúcares mas simples. Das et al. (1994) evaluaron el efecto combinado de enzimas pectinasas, hemicelulasas y celulasas comerciales en la extracción del jugo de naranja, observando un incremento de 1,8 °Bx en el contenido de los sólidos solubles comparado con el tratamiento control. Esto pudo ser atribuido a el efecto sinergístico de las enzimas combinadas (Ribeiro et al., 2010)
Tabla 3. Actividad residual de las enzimas en las etapas de pasteurización y reposo de una mezcla diluida de jugos de frutos..
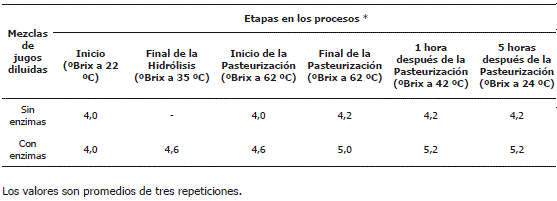
El valor de los °Brix por efecto del tratamiento térmico de pasteurización aumentó de 4,6 a 5,0 y una hora después en reposo alcanzó un valor de 5,2; esto se atribuyó en parte a la inestabilidad de polisacáridos estructurales por causa de la acción enzimática, a la temperatura que provocó la liberación de oligómeros y monómeros (Cabrera, Paz y Gutiérrez, 1997) y a la pérdida de agua por evaporación durante el tiempo de pasteurización, más que a la actividad residual de las enzimas, ya que a 5 h después del tratamiento térmico el valor se mantuvo en 5,2. Sorrivas, Genovese y Lozano (2006) señalan que a consecuencia del tratamiento enzimático el tamaño promedio de las partículas, inicialmente de 1000 a 1500 nm disminuye luego a aproximadamente 1100 nm y que la destrucción de la red de pectina por la acción enzimática causa agregación de partículas seguido del colapso de los agregados ocasionando tamaños de partículas menores a 500 nm. En el caso de la mezcla de jugos diluida sin enzimas, la pasteurización provocó, aunque en menor proporción que en la mezcla de jugos con enzimas, un ligero aumento de los °Brix de 4,0 a 4,2 que se atribuyó solo a la pérdida de agua por evaporación.
Los resultados confirman que en la hidrólisis enzimática de la MJD, la adición antes de la pasteurización de ácido ascórbico en concentración de 0,5% (p/v) ayuda a preservar el color y el tratamiento térmico a 62 ± 1 ºC por 30 min es efectivo para la desactivación enzimática.
Pruebas de filtración. En la Figura 4(a) se presentan las gráficas de los volúmenes de filtrado medidos en función del tiempo de filtración, V = ƒ (t) y en la Figura 4(b) los flujos de filtrado de la MJDHE y la MJD. Mediante la Prueba t de Welch se determinaron diferencias altamente significativas (P<0,01) en la comparación de los valores de las gráficas de los flujos de filtrado.
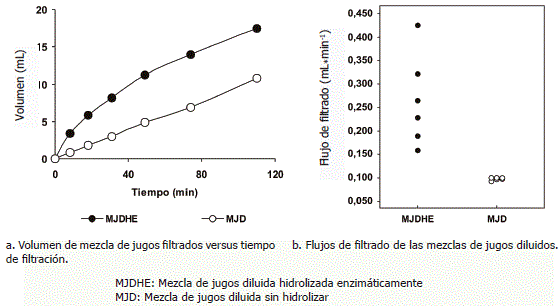
Figura 4. Pruebas de filtración de una mezcla diluida de jugos de frutos.
La MJDHE presentó un comportamiento logarítmico. Al cabo de 8 min el volumen de filtrado fue de 3,4 ± 0,06 mL equivalentes a un flujo de filtrado de 0,425 mL·min-1 que fue disminuyendo en el tiempo hasta alcanzar un valor de 0,159 mL·min-1 cuando el volumen de filtrado acumulado fue de 17,5 ± 0,75 mL a los 110 min. La disminución del flujo de filtrado se atribuyó a la acumulación de sedimentos no hidrolizados en el papel de filtro; macromoléculas y fracciones no polares de pequeños compuestos que fueron retenidas por el papel que actuó como membrana reteniendo sustancias que podían generar turbidez en el filtrado (Matta, Moretti y Cabral, 2004). La MJD sin hidrolizar presentó un comportamiento lineal. A los 8 min el volumen de filtrado fue de 0,8 ± 0,21 mL equivalentes a un flujo de filtrado de 0,1 mL·min-1. El flujo final fue de 0,098 mL·min-1 cuando el volumen de filtrado acumulado fue de 10,8 ± 0,2 mL a los 110 min. La variación entre los flujos inicial y final de la MJD fue de 0,002 mL·min-1; muy lenta en comparación con la de la MJDHE que fue de 0,266 mL·min-1. Junker (1994) evaluó la influencia del tratamiento enzimático con pectinasas en la clarificación de jugos de grosellas negras (Ribes nigrum L.) logrando la disminución del tiempo de filtración. Cabe destacar que el flujo de filtración de la MJDHE transcurridos 110 min (0,159 mL·min-1) fue mayor que el flujo de la MJD a los 8 min (0,100 mL·min-1) que fue el tiempo medido en el que ambas muestras alcanzaron el mayor flujo y el rendimiento en producción de jugo durante la filtración de la MJDHE fue 38,3% mayor al obtenido con la MJD. Ribeiro et al. (2010) sostienen que por efecto de las enzimas fibrolíticas sobre la pectina y otras estructuras de la pared de las células contenidas en un jugo, se produce un ablandamiento del tejido de la pulpa y un aumento de la producción de jugo. Lo antes señalado sugiere que la combinación enzimática de Rapidase® TF y Rapidase® LIQ Plus produjo un incremento en flujo de filtrado y mayor rendimiento en producción de jugo.
CONCLUSIONES
Mediante el presente estudio se evidenció que es viable la hidrólisis enzimática de una mezcla diluida de pulpa de frutos de cactus, jugos de naranja y toronja para incrementar el rendimiento en producción de mezcla de jugos mediante filtración por gravedad, por consecuencia de la degradación de componentes estructurales presentes en la mezcla a formas más simples de carbohidratos. La pasteurización de la MJD (no hidrolizada) no produjo cambio de coloración, no obstante, en la MJD sometida a la acción enzimática si se afectó el color luego del tratamiento térmico, pudiendo preservarse el mismo adicionando antes del proceso de pasteurización, ácido ascórbico en concentración de 0,5% (p/v). La elaboración de bebidas cítricas pigmentadas con frutos de O. boldinghii es una alternativa de aprovechamiento del cactus y la hidrólisis enzimática previa a la elaboración constituye un tratamiento para mejorar la calidad.
AGRADECIMIENTOS
Los autores agradecen al Consejo de Desarrollo Científico, Humanístico y Tecnológico (CDCHT) de la Universidad Simón Rodríguez por el financiamiento del Proyecto de Investigación UNESR–FONACIT Pem 2001002271, a la Ingeniera Ruby Jacqueline Alfonso Villamarín (División Técnica y Comercial - INTERENZIMAS LTDA, Colombia) por su colaboración con el envío de las muestras de enzimas y material de apoyo y al Ingeniero Carlos Alberto Medina Martínez (UNESR, Venezuela) por su apoyo logístico.
BIBLIOGRAFÍA
Azeredo, H.M.C. 2009. Betalains: properties, sources, applications, and stability-a review. International Journal of Food Science and Technology 44(12):2365-2376. [ Links ]
AOAC. 1990. Methods of Analysis of the Association of Official Analytical Chemist. 15th edition. Washington D.C., USA. [ Links ]
Cabrera, J.C., D. Paz y A. Gutiérrez. 1997. Estudio de preparados enzimáticos pectinolíticos industriales. I-Actividad poligalacturonasa del Pectinex Ultra SPL. Cultivos Tropicales 18(1): 20-23. [ Links ]
Cassano, A., C. Conidi and E. Drioli. 2010. Physico-chemical parameters of cactus pear (Opuntia ficus-indica) juice clarified by microfiltration and ultrafiltration processes. Desalination 250(3):1101-1104. [ Links ]
Comisión Venezolana de Normas Industriales (COVENIN). 1983. Determinación de sólidos solubles por refractometría. Norma 924. Caracas. Venezuela. 14 p. [ Links ]
Comisión Venezolana de Normas Industriales (COVENIN). 1977. Determinación de acidez titulable e iónica. Norma 1151. Caracas. Venezuela. 7 p. [ Links ]
Das, K., A. Solehah, V.T. Balaumani and M.A. Amiza. 1994. Enzymes for improved extraction and stabilization of colour and flavour of orange juice. Journal of Food Science and Technology 31(6): 508-510. [ Links ]
El-Samahy, S.K., H.A. El-Mansy, H.E. Bahlol, A.I. El-Desouky and A.E. Ahmed. 2008. Thermal process time and sensory evaluation for canned cactus pear nectar. Journal of the Professional Association for Cactus Development 10: 85-107. [ Links ]
Farías, C. 2003. Estabilidad de las betalaínas de tuna púrpura (Opuntia ficus-indica). Trabajo de grado. Facultad de Ciencias Agronómicas y Forestales. Universidad de Chile. Santiago. 56 p. [ Links ]
Guzmán, S.H., G. Herrera, D. Hernández, R. Reynoso, A Guzmán, F. Vaillant and P. Brat. 2010. Physicochemical, nutritional and functional characteristics of two underutilised fruit cactus species (Myrtillocactus) produced in central Mexico. Food Chemistry 121(2): 381-386. [ Links ]
Fernández, J.A., R. Castellar, J.M. Obón and L. Almela. 2002. Screening and mass-spectral confirmation of betalains in cactus pears. Chromatographia 56(9-10): 591-595. [ Links ]
Flores, C., J. de Luna, P. Ramírez, J. Corrales y P. Ponce. 1995. Procesamiento y transformación industrial de la tuna. En: Mercado mundial de la tuna. ASERCA-CIESTAAM, México. 87 p. [ Links ]
Galati, E.M., M.R. Mondello, E.R. Lauriano, M.F. Taviano, M. Galluzzo and N. Miceli. 2005. Opuntia ficus indica (L.) Mill. fruit juice protects liver from carbon tetrachloride-induced injury. Phytotherapy Research 19(9): 796-800. [ Links ]
Georgiev, V.G., J. Weber, E.M. Kneschke, P.N. Denev, T. Bley and A.I. Pavlov. 2010. Antioxidant activity and phenolic content of betalain extracts from intact plants and hairy root cultures of the red beetroot Beta vulgaris cv. Detroit Dark Red. Plant Foods for Human Nutrition 65(2): 105-111. [ Links ]
Herbach, K.M., C. Maier, F.C. Stintzing and R. Carle. 2007. Effects of processing and storage on juice colour and betacyanin stability of purple pitaya (Hylocereus polyrhizus) juice. European Food Research and Technology 224(5): 649-658. [ Links ]
Interenzimas Ltda. 2006. Rapidase® TF y Rapidase® LIQ Plus. Fichas técnicas. e-mail: ralfonso@interenzimas.com [ Links ]
Isgro, N., A. Nesbitt, D. King and I. Broad. 2001. The national red fleshed grapefruit trial. pp. 63-65. Horticulture Technical Annual Report 2000-2001. [ Links ]
Junker, R. 1994. Effect of enzymatic treatment and fining on colloid content and filterability of black currant juice. Flüss Obst 61(6-7): 262-265. [ Links ]
Karadeniz, F. 2004. Main organic acid distribution of authentic citrus juices in Turkey. Turkish Journal of Agriculture and Forestry 28: 267-271. [ Links ]
Kuti, J. 2004. Antioxidant compounds from four Opuntia cactus pear fruit varieties. Food Chemistry 85(4): 527-533. [ Links ]
Lemos, M.A., J.A. Teixeira, M.R.M. Domingues, M. Mota and F. Gama. 2003. The enhacement of the cellulolytic activity of cellobiohydrolase I and endoglucanase by the addition of cellulose binding domains derived from Trichoderma reesei. Enzyme and Microbial Technology 32(1): 35-40. [ Links ]
Matta, V.M., R.H. Moretti and L.M.C. Cabral. 2004. Microfiltration and reverse osmosis for clarification and concentration of acerola juice. Journal of Food Engineering 61(3): 477-482. [ Links ]
Moßhammer, M., M. Rohe, F. Stintzing and R. Carle. 2007. Stability of yellow-orange cactus pear (Opuntia ficus-indica [L.] Mill. cv. ‘Gialla’) betalains as affected by the juice matrix and selected food additives. European Food Research and Technology 225(1): 21-32.
Moßhammer, M., F. Stintzing and R. Carle. 2006. Cactus pear fruits (Opuntia spp.): A review of processing technologies and current uses. Journal of the Professional Association for Cactus Development 8: 1-25. [ Links ]
Moreno, M., M. Betancourt, A. Pitre, D. García, D. Belén y C. Medina. 2007. Evaluación de la estabilidad de bebidas cítricas acondicionadas con dos fuentes naturales de betalaínas: tuna y remolacha. Bioagro 19(3): 149-159. [ Links ]
Moreno, M., C. Medina, L. Antón, D. García y D.R. Belén. 2003. Uso de pulpa de tuna (Opuntia boldinghii) en la elaboración de bebidas cítricas pigmentadas. Interciencia 28(9): 539-543. [ Links ]
Ovando, S.L., K.N. Waliszewski and V.T. Pardio. 2005. The effect of hydration time and ethanol concentration on the rate of hydrolysis of extracted vanilla beans by commercial cellulose preparations. International Journal of Food Science and Technology 40(9): 1011-1018. [ Links ]
Padrón, C.A. y M.J. Moreno. 1999. Extracción de colorantes en cáscara de naranja (Citrus sinensis L.) por métodos no convencionales y su utilización para fortificar color en naranjadas. Revista UNELLEZ de Ciencia y Tecnología 17(1):125-140. [ Links ]
Rai, P. and S. De. 2009. Clarification of pectin-containing juice using ultrafiltration. Current Science 96(10): 1361-1371. [ Links ]
Repo, R. y C.R. Encina. 2008. Determinación de la capacidad antioxidante y compuestos bioactivos de frutas nativas peruanas. Revista de la Sociedad Química del Perú 74(2): 108-124. [ Links ]
Ribeiro, D.S., S.M.B. Henrique, L.S. Oliveira, G.A. Macedo and L.F. Fleuri. 2010. Enzymes in juice processing: a review. International Journal of Food Science and Technology 45(4): 635-641. [ Links ]
Sáenz, C., H. Berger, J. Corrales, L. Galletti, V. García, I. Higuera, C. Mondragón, A. Rodríguez-Félix, E. Sepúlveda y M. Varnero. 2006. Utilización agroindustrial del nopal. pp. 162-168. Boletín de Servicios Agrícolas de la FAO. 186 p. [ Links ]
Sorrivas, V., D.B. Genovese and J.E. Lozano. 2006. Effect of pectinolytic and amylolytic enzymes on apple juice turbidity. Journal of Food Processing and Preservation 30(2): 118-133. [ Links ]
Tariq, M., M. Sharif, Z. Shah and R. Khan. 2007. Effect of foliar application of micronutrients on the yield and quality of sweet orange (Citrus sinensis L.). Pakistan Journal of Biological Sciences 10(11): 1823-1828. [ Links ]
Vitoria, A.J. y M.J. Moreno. 2001. Betalaínas: Una síntesis de su proceso. BIOTAM 12(3): 7-18. [ Links ]
Vitoria, A., D. Corbelli, M.J. Moreno y C.D.R. Belén. 2002. Estabilidad de betalaínas en pulpa de tuna (Opuntia boldinghii Br. et R.) sometidas a un proceso de liofilización. Revista de la Facultad de Agronomía-LUZ 19(4): 324-331. [ Links ]
Wu, T., Y. Guan and J. Ye. 2007. Determination of flavonoids and ascorbic acid in grapefruit peel and juice by capillary electrophoresis with electrochemical detection. Food Chemistry 100(4): 1573-1579. [ Links ]
Xu, G., D. Liu, J. Chen, X. Ye, Y. Ma and J. Shi. 2008. Juice components and antioxidant capacity of citrus varieties cultivated in China. Food Chemistry 106(2): 545-551. [ Links ]














