Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.63 no.2 Medellín July/Dec. 2010
RENDIMIENTO Y REACCIÓN A COLLETOTRICHUM LINDEMUATHIANUM EN CULTIVARES DE FRÍJOL VOLUBLE (PHASEOLUS VULGARIS L.)
YIELD AND REACTION TO COLLETOTRICHUM LINDEMUATHIANUM IN CULTIVARS OF CLIMBING BEANS (PHASEOLUS VULGARIS L.)
Carolina Gallego G.1; Gustavo Adolfo Ligarreto Moreno2; Luz Nayibe Garzón Gutiérrez3; Óscar Arturo Oliveros Garay4 y Linda Jeimmy Rincón Rivera5
1 Ingeniera Agrónoma. Universidad Nacional de Colombia, Sede Bogotá. Facultad de Agronomía. Carrera 45 No. 26-85, Bogotá, Colombia. <cgallegog@unal.edu.co>
2 Profesor Asociado. Universidad Nacional de Colombia, Sede Bogotá. Facultad de Agronomía. Carrera 45 No. 26-85, Bogotá, Colombia. <galigarretom@unal.edu.co>
3 Estudiante de Doctorado en Ciencias Agropecuarias. Universidad Nacional de Colombia, Sede Bogotá. Facultad de Agronomía. Carrera 45 No. 26-85, Bogotá, Colombia. <lgarzong@unal.edu.co>
4 Profesor Asociado. Universidad Nacional de Colombia, Sede Bogotá. Facultad de Agronomía. Carrera 45 No. 26-85, Bogotá, Colombia. <oaoliverosg@unal.edu.co>
5 Estudiante Doctorado en Ciencias Agropecuarias. Universidad Nacional de Colombia, Sede Bogotá. Facultad de Agronomía. Carrera 45 No. 26-85, Bogotá, Colombia. <ljrinconr@unal.edu.co>
Recibido: Agosto 31 de 2009; Aceptado: Febrero 2 de 2011.
Resumen. Bajo condiciones de la sabana de Bogotá (Colombia), se evaluaron 32 cultivares de fríjol voluble por componentes del rendimiento y por su reacción a una mezcla de aislamientos de Colletotrichum lindemuthianum procedentes de Boyacá y Cundinamarca. Los genotipos que presentaron un buen comportamiento en rendimiento y una reacción en campo a la resistencia de la enfermedad fueron: D. Moreno y 3198. Los que expresaron una reacción de resistencia a la antracnosis fueron: 3180, 3182, 3177 y G-2333. Aquellos que mostraron un buen comportamiento en componentes de rendimiento fueron: 3164, 3159, 3176 y Radical. Estos genotipos podrían usarse como posibles candidatos parentales ó sobresalientes en el programa de mejoramiento de fríjol. También se realizó análisis de dos marcadores moleculares tipo SCAR ligados a los genes Co-4 y Co-5 que confieren resistencia a C. lindemuthianum, ninguno de los materiales de evaluación a excepción del testigo resistente G-2333, amplificó los marcadores SCAR, asociados a los genes de resistencia de interés.
Palabras clave: Antracnosis, reacción a enfermedad, rendimiento, SCAR.
Abstract. Under Bogotá plateau (Colombia) conditions, 32 cultivars of climbing bean were evaluated by components of yield and by reaction with a mixture of isolations of Colletotrichum lindemuthianum coming from Boyacá and Cundinamarca. The cultivars that presented a good behavior in yield and resistance reaction to the disease were: D. Moreno and 3198. Those that expressed a resistant reaction to the anthracnose were: 3180, 3182, 3177 and G-2333. Finally those that showed a good behavior in yield components were 3164, 3159, 3176 and Radical. These genotypes could be used as excellent candidates in the breeding program of common bean. It was also carried out a test for each cultivar, by means of two markers molecular type SCAR tried to resistance genes to anthracnose Co-4 and Co-5. Any of the evaluation materials amplified for the couple of genes, except for the resistant control G-2333.
Key words: Anthracnose, disease reaction, yield, SCAR.
El fríjol común es la leguminosa comestible más importante en la dieta alimenticia de la población colombiana. En el país se estima que participan 65.000 familias en la producción, con área de siembra cercana a 115.000 ha/año (Pachón, Gracia y Ligarreto, 2009), una producción alrededor de 130.000 t y un consumo por persona año de 3,5 kg (Ligarreto, 1997). El fríjol tipo voluble en sistema de monocultivo es el más predominante; con un aporte cercano al 65% en el total de la producción nacional (Santana y Mahuku, 2002).
La antracnosis cuyo agente causal es el hongo Colletotrichum lindemuthianum (Sacc & Mag.) es considerada como la enfermedad más limitante en el cultivo del fríjol (Pastor-Corrales et al., 1994; Molano, Otoya y Pastor-Corrales, 1996). Esta enfermedad ocasiona pérdidas en el rendimiento que oscilan entre 38 y 95%, según la susceptibilidad del cultivar (Guzmán, Donado y Gálvez, 1979; Tamayo, 1995) y afecta principalmente la calidad de las vainas y el grano (Santana y Mahuku, 2002).
Dentro de las técnicas de manejo de la enfermedad, la resistencia varietal es considerada la más deseable y práctica de emplear (Cobo y Pastor-Corrales, 1987). En este aspecto se han venido adelantado numerosos estudios encaminados a la búsqueda de fuentes de resistencia a partir de técnicas clásicas como inoculaciones en campo e invernadero (Schwartz, Pastor-Corrales y Sing, 1982; Singh, 1998; Santana y Mahuku, 2002; Santana et al., 2004), así como también con técnicas modernas como la selección asistida por medio de marcadores moleculares (Santana et al., 2004; Garzón, Blair y Ligarreto, 2007). Actualmente se han diseñado marcadores moleculares cada vez más específicos como los SCAR (Regiones Amplificadas Caracterizadas y Secuenciadas) utilizados para la selección por resistencia a antracnosis en fríjol (Garzón, Blair y Ligarreto, 2007).
La información obtenida sugiere que en el fríjol común, la resistencia a la antracnosis es controlada por un pequeño grupo de genes independientes (Melotto y Kelly, 1998). Se conocen once genes de resistencia al patógeno, la mayoría identificados en las variedades diferenciales (Co–1-Co-7, co-8, Co-9-Co-11) (Goncalves-Vidigal et al., 2007; Kelly y Vallejo, 2004). Todos los genes son de naturaleza dominante con la excepción del gen Co-8, el cual es recesivo; de ellos solo el Co-1 es de origen Andino, los demás son del acervo Mesoamericano (Kelly y Vallejo, 2004).
Los estudios relacionados con la diversidad y estructura genética de las poblaciones del patógeno, han mostrado una amplia variación patogénica del hongo en América Latina, siendo los aislamientos procedentes de esta región muy virulentos (Pastor-Corrales, Otoya y Maya, 1993). Sin embargo, muchos de los datos no son comparables por la variación en el uso de las variedades diferenciales (Pastor-Corrales, 1985). Sólo hasta el año de 1989, en la primera reunión de fríjol en América Latina, se estandarizó la caracterización de las razas, acordando emplear el sistema binario proveniente del juego de las 12 variedades diferenciales (Riascos, 2001).
Rincón (2007) evaluó 127 aislamientos monospóricos de C. lindemuthianum provenientes de diferentes departamentos de Colombia: Cundinamarca, Boyacá, Santander, Antioquia, Cauca y Valle. Este estudio permitió establecer 35 patotipos (razas) de las cuales la raza 3 fue la que se encontró con mas frecuencia (30,4%) y se identificó en todos los departamentos. Las razas 0, 1, 7, 13, 133, 137, 139, 521 y 645 se identificaron en dos o más departamentos. Antioquia, Cauca y Cundinamarca presentaron las valores más altos de variabilidad para este patógeno (índices de Shanon 2,62; 2,51 y 2,17 respectivamente). Las razas identificadas con mayor frecuencia varían en cada departamento, de esta manera por ejemplo para los departamentos de Antioquia, Boyacá y Cauca, las razas que se presentaron con mayor frecuencia fueron la 13, 1 y 521.
En el programa de mejoramiento de fríjol en Colombia, se han obtenido 4 cultivares tipo Cargamanto con reacción resistente ó intermedia a la antracnosis, los cuales son ICA Viboral, ICA–Llanogrande, Frijolica LS-3.3 y las 106 (Santana et al., 2004). Sin embargo, se ha observado que la reacción resistente de estas variedades no es estable; se considera que las variedades resistentes a una o varias razas no lo son necesariamente en otra localidad o año (Pastor-Corrales, Otoya y Maya 1993). No se conoce si los cambios ocurridos en la reacción de las variedades al patógeno, se deba a modificaciones en la frecuencia de las razas existentes o a la aparición de nuevas razas por mutación o por migración (Pastor-Corrales, Otoya y Maya, 1993). Esto implica la necesidad de obtener materiales con resistencia durable (Santana et al., 2004).
El objetivo de esta investigación fue evaluar 30 cultivares de fríjol voluble, tipos Bola Rojo y Crema-Rojo Moteado y dos controles, frente al rendimiento y a la reacción a antracnosis e identificar marcadores moleculares tipo SCAR (Sequence Characterised Amplified Region) ligados a los genes de resistencia a antracnosis Co-4 y Co-5.
MATERIALES Y MÉTODOS
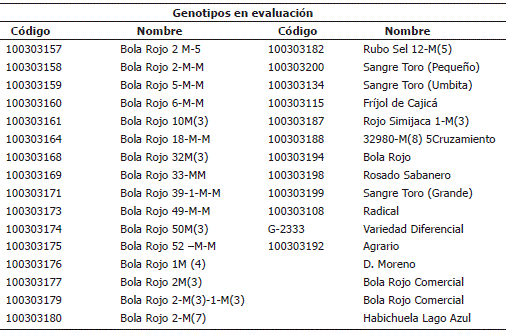
Material vegetal. Se utilizaron 30 cultivares de fríjol voluble procedentes del banco de germoplasma que administra la Corporación Colombiana de Investigación Agropecuaria – CORPOICA, Centro de Investigación (C.I.) Tibaitatá ubicado en el municipio de Mosquera, Cundinamarca y dos controles habichuela Lago Azul y G-2333. Estos cultivares fueron seleccionados previamente por su alto rendimiento, calidad del grano y por reacción de resistencia intermedia a la antracnosis presentada bajo condiciones de campo. Entre los materiales, 24 son líneas de mejoramiento (Tabla 1), constituidos por 21 genotipos de tipo Bola Rojo y 3 del tipo Crema-Rojo Moteado. Así mismo, se seleccionaron 6 cultivares comerciales, los cuales fueron: Cargamanto, Agrario, Radical, Bola Rojo Comercial, Bola Rojo Pesca y D. Moreno. La variedad de habichuela Lago Azul se empleó como testigo susceptible y la variedad diferencial de fríjol G-2333 como el testigo resistente.
Tabla 1. Cultivares de fríjol voluble evaluados por su reacción a la antracnosis, provenientes de CORPOICA, C.I Tibaitatá
Obtención del inóculo: Los aislamientos de C. lindemuthianum empleados en este estudio, fueron obtenidos de vainas de fríjol Bola Rojo que mostraron síntomas típicos de la enfermedad en condiciones naturales. Dos muestras fueron tomadas de cultivos ubicados en Simijaca, Cundinamarca y en Pasca, Boyacá. Este fue un estudio inicial y por esta razón se uso una mezcla de razas, más que evaluaciones con razas individuales.
Los aislamientos del patógeno, la obtención de cultivos monospóricos y el incremento del inóculo, se realizaron de acuerdo al protocolo elaborado por el Programa de Fitopatología del Centro Internacional de Agricultura Tropical (Araya, Pastor y Ramírez, 1991).
Ensayos de campo. La evaluación de los genotipos por días a cosecha, componentes de rendimiento y por su reacción al patógeno, se realizó bajo condiciones de la Sabana de Bogotá en los invernaderos de la Facultad de Agronomía, de la Universidad Nacional de Colombia. La temperatura media fue de 14,5 ºC, con un promedio de temperatura mínima de 4 ºC y máxima de 20,5 ºC y una humedad relativa media alrededor del 70%.
De cada uno de los cultivares y controles, se sembraron diez semillas en parcelas de 1 m de largo, con una distancia entre plantas de 0,1 m; entre parcelas de 0,5 m y entre surcos de 1 m. Se realizaron tres repeticiones por cultivar, con un total de 98 parcelas. El manejo del cultivo se realizó de acuerdo con las prácticas culturales propias para el monocultivo de fríjol en la Sabana de Bogotá.
Los cultivares se mantuvieron bajo condiciones de campo semicontroladas en términos de humedad. La humedad relativa se aumentó al 85%, mediante la construcción de una cámara húmeda, encerrando con plástico el área del ensayo e instalando en su interior un sistema de riego por aspersión, con una distancia entre aspersores de 1 m. Se realizaron dos riegos diarios, con una frecuencia de 15 min por riego.
Para la inoculación se utilizó una mezcla de los tres aislamientos descritos previamente. Se aplicó el inóculo a una concentración de 1,2x106 conidias/mL, por medio de aspersión homogénea en hojas y tallos utilizando una aspersora de espalda. Con el fin de contribuir a la diseminación de la enfermedad, quince días antes de la siembra de los genotipos, se sembró la habichuela alrededor del área del ensayo, formando un cuadrado. No se realizó control alguno para las enfermedades que se presentaron durante el estudio tales como antracnosis, roya y mildeo polvoso.
La primera inoculación se realizó cuando las plantas se encontraban en fase fisiológica V4 o de tercera hoja trifoliada. En total, se realizaron 4 inoculaciones, programadas con un intervalo de 10 días. A partir de la última inoculación, se evaluó la severidad de la enfermedad, utilizando el sistema estándar de evaluación de antracnosis (Schoonhoven y Pastor-Corrales, 1987). Este sistema utiliza un rango de calificación de 1 a 9, en el cual el máximo valor corresponde a las plantas altamente susceptibles (Riascos, 2001). La evaluación de la resistencia se realizó en la etapa de floración, para cada uno de los estratos de la planta: superior, medio y bajo.
Las variables cuantitativas evaluadas fueron: días a cosecha, longitud de las vainas, ancho de las vainas, número de vainas cosechadas por planta, número de granos por vaina, peso de 100 granos y rendimiento por planta.
Análisis de datos. El análisis realizado fue un método de ordenación por componentes principales y agrupamientos jerárquicos basados en distancias euclidianas, utilizando el sofware SPAD 4.5 (Pagès, 2004). Los valores de las escalas de reacción a antracnosis fueron pasados a porcentajes para ser manejados como variables cuantitativas en conjunto con las variables de rendimiento.
Identificación de los genes de resistencia Co-4 y Co-5 en los genotipos con marcadores moleculares tipo SCAR. De cada uno de los 32 genotipos, se colectaron 5 hojas trifoliadas jóvenes, y se realizó la extracción del ADN mediante la metodología de extracción alcalina, la cual no utiliza solventes orgánicos altamente tóxicos como fenol o cloroformo (Klimyuk et al., 1997). Se realizaron diluciones de ADN teniendo en cuenta una razón 1:20 (ADN:agua).
Los dos marcadores moleculares tipo SCAR utilizados fueron: SAS13 el cual hace parte del gen Co-4, y amplifica una banda de 950 pb (Vallejo y Kelly, 2001) y SAB3 ligado al gen Co-5 que amplifica una banda de 400 pb (Kelly y Miklas, 1998).
Para la amplificación de los SCARs, por reacción se usó un volumen final de 15 mL, que contenía 5 mL de ADN diluido, 1X de buffer PCR (500 mM de KCl, 10 mM de Tris HCl pH 8,8; 1% de Tritron X-100, 1 mg/mL bovine serum albumin); 0,10 mm de cada primer (Invitrogen Corp. San Diego, Calif.), 0,25 mM de cada dNTP, 2,5 mM de MgCl2, 1 unidad de Taq y agua de calidad HPLC para completar al volumen final. La reacción en cadena de la polimerasa para amplificar el marcador SAB3 y SAS 13, se basó en el procedimiento descrito por Garzón, Blair y Ligarreto (2007). La amplificación se llevó a cabo en un termociclador Icycler Biorad. Los productos de amplificación se separaron en geles de agarosa al 1,5%, estos se corrieron en cámaras de electroforesis con buffer TBE 0,5X y posteriormente se tiñeron con bromuro de etidio, para ser visualizados sobre un transiluminador con luz ultravioleta.
RESULTADOS Y DISCUSIÓN
Variables agronómicas. Mediante el análisis de componentes principales utilizando el criterio de Kaiser, se seleccionaron los primeros tres componentes por presentar valores propios >1 (Franco e Hidalgo, 2003; SAS Institute, 2004). El primer componente principal, representó el 33,19% de la variación total. El segundo componente principal contribuyó con el 26,66% de la variación total explicada, mientras el tercer componente principal, representó el 16,94% de la variación total (Tabla 2). Estos componentes en conjunto explican el 72,79% de la variación total.
Tabla 2. Vectores de variables para los primeros tres componentes principales (CP) de reacción a antracnosis, ciclo de vida y factores de rendimiento en fríjol voluble.
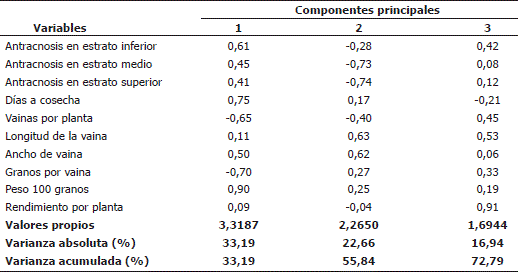
La distribución de los coeficientes del primer vector propio sugiere que la variable peso de 100 granos es la más discriminante, seguida en menor grado de la variable días a cosecha en sentido positivo. De otra parte, las variables número de vainas por planta y número de granos por vaina, fueron las que más contribuyeron en forma negativa al primer componente (Tabla 2). Esto indica que el primer componente, permitió distinguir los genotipos con semilla de tamaño grande, que a su vez, se diferencian por ser los más tardíos e igualmente registran valores bajos en componentes de rendimiento como número de vainas por planta y número de granos por vaina.
De manera secundaria influyen con sentido positivo, para este componente las variables ancho de vaina y antracnosis en estrato inferior. Lo cual indica que las accesiones con semilla más grande, suelen ser tardías y tienden a desarrollar un menor número de vainas por planta, siendo estas vainas mas anchas, como respuesta al tamaño de la semilla. Igualmente, estas accesiones fueron las que mayor severidad de la enfermedad presentaron para el estrato inferior del dosel. Posiblemente, debido que presentan mayor follaje y hojas más grandes que ocasionan un ambiente de alta humedad, favoreciendo la mayor incidencia del patógeno.
De acuerdo con la Tabla 2, para el segundo componente principal, existe mayor ponderación en sentido negativo, para las variables antracnosis en estrato medio y en estrato superior. Con menor contundencia, pero con gran valor en la interpretación biológica del segundo componente principal, influyen de manera positiva las variables longitud y ancho de vaina. Por tanto, en este segundo componente, fue posible distinguir los genotipos que presentaron una reacción de resistencia completa e intermedia a la enfermedad, para los estratos medio y superior del dosel. A su vez, se destacaron genotipos que presentan un tamaño de semilla medio y un mayor número de semillas por vaina.
Para el caso del tercer componente principal, la característica que más contribuyó con este componente en sentido positivo fue rendimiento por planta. Considerándose el componente tres como el componente del rendimiento. En menor grado, contribuyeron las variables longitud de la vaina en sentido positivo y días a cosecha en sentido negativo (Tabla 2). Por consiguiente, el tercer componente permitió distinguir las accesiones, que exhiben un alto rendimiento por planta, que se define por tener un tamaño pequeño de semilla y cuyo crecimiento y desarrollo se caracteriza por ser precoz.
En general lo resultados muestran que las variables de rendimiento son más discriminatorias en los genotipos de evaluación, que las variables relacionadas con la reacción de estos a la enfermedad. Igualmente las variables peso del grano y días a cosecha, resultan ser más discriminatorias que las otras variables relacionadas con los principales componentes de rendimiento. El grado de discriminación de la variable reacción a la antracnosis en los tres estratos de la planta, permite inferir que su comportamiento depende principalmente del tamaño de la semilla y de la precocidad del material.
El análisis de conglomerados agrupa a los genotipos evaluados en tres clases, con sus respectivos subgrupos discriminantes, como se observa en la Figura 1. Por lo cual, las selecciones se realizaron con base a este tipo de agrupación. Los coeficientes de variación oscilaron entre 3,35% en días a cosecha para la clase 2/3 (Figura 1) hasta 93,34% para antracnosis en estrato superior en la clase 3/3, presentándose los valores más altos para los descriptores relacionados con la severidad de la enfermedad en los estratos del dosel. Esto muestra un amplio rango de variación o de comportamiento de los individuos dentro de cada cultivar y entre los mismos para dichas variables. Las variables características de la clase 1, son las relacionadas con la severidad de la enfermedad en estrato medio y superior (Tabla 3). En la clase 1, se manifiestan los genotipos que presentaron una reacción de susceptibilidad al ataque del patógeno.
Tabla 3. Variables características de los tres agrupamientos presentados en el estudio de cultivares de fríjol voluble por su reacción a la antracnosis.
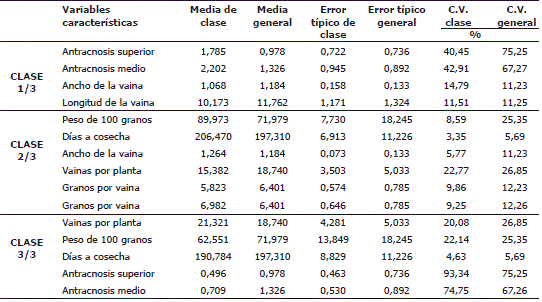
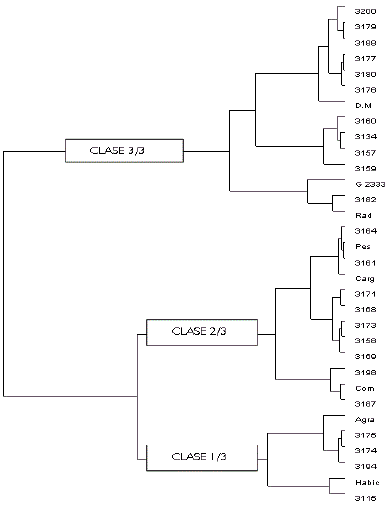
Figura 1. Agrupamiento de genotipos de fríjol voluble basado en la evaluación de caracteres de rendimiento, ciclo de vida y la reacción a la enfermedad antracnosis. Dendrograma construido con distancias Euclidianas.
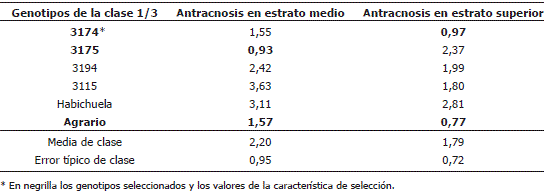
La pre-selección de los materiales, se realizó con base a las variables más discriminatorias en la clase y se elaboró un intervalo de clase para antracnosis en estrato superior (1,06 -2,507) y para antracnosis en estrato medio (1,57-3,147). Estos intervalos de confianza de clase son comparables con los valores promedios obtenidos por cada genotipo (Tabla 4). En este agrupamiento es posible seleccionar solo las accesiones que están por debajo del intervalo de confianza para cada una de las características, como lo son los materiales 3174 y 3175 y Agrario (Tabla 4). El testigo susceptible habichuela Lago Azul, se encuentra por encima del intervalo de confianza, lo cual ratifica su susceptibilidad.
Tabla 4. Valores promedios de antracnosis para los genotipos de fríjol voluble pertenecientes a la clase 1/3, según Figura 1.
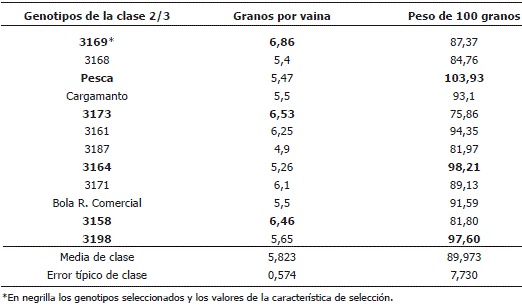
La Clase 2 (Figura 1) se caracteriza por los individuos que presentan un buen comportamiento en términos de componentes de rendimiento (Tabla 3). Destacándose las variables peso de 100 granos y granos por vaina. La Clase no se caracteriza por la reacción de los genotipos a la enfermedad. De igual manera, la pre-selección de los individuos de esta Clase, se realizó con base a las características más preponderantes en la Clase (Tabla 5). El intervalo de clase para la variable peso de 100 granos es (82,24 – 97,70) y para la variable granos por vaina es (5,4 – 6,39). Los genotipos preseleccionados por la variable característica peso de 100 granos son: Pesca, 3164 y 3198, y aquellos pre-seleccionados por la variable discriminante granos por vaina son: 3169, 3173 y 3158.
Tabla 5. Valores promedios de granos por vaina y peso de 100 granos para los genotipos de fríjol voluble de la clase 2/3, según Figura 1, evaluados por su reacción a la antracnosis
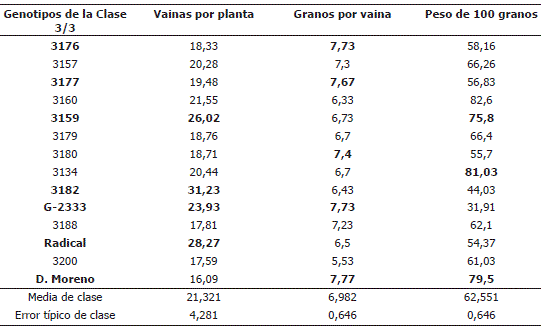
La Clase 3 (Figura 1) se caracteriza por tener en común el comportamiento de las variables vainas por planta, peso de 100 granos y granos por vaina, siendo esta ultima la que más se destaca entre todas las anteriores (Tabla 3); presentando una reacción negativa a la enfermedad, es decir, en esta Clase se agrupan los genotipos que exhiben una reacción de resistencia completa o intermedia. Acorde con esto, en esta Clase se encuentra el testigo resistente: la variedad diferencial G-2333; la cual se caracteriza por su inherente resistencia a C. lindemuthianum y por presentar un alto valor en el componente de rendimiento de granos por vaina. Los intervalos de clase para cada una de las variables son: granos por vaina (6,33-7,62); vainas por planta (17,04 – 25,602); peso de 100 granos (48,70 – 76,40).
Como se observa en la Tabla 6, las accesiones pre-seleccionadas por la variable característica vainas por planta son 3159, 3182, G-2333 y Radical. Los genotipos pre-seleccionados por la variable discriminante granos por vaina son: 3176, 3177, 3180, G-2333 y D. Moreno. Igualmente la variable característica peso de 100 granos discrimina para la pre-selección de los cultivares 3159, 3134 y D. Moreno. De esta manera, los genotipos G-2333, 3159 y D. Moreno, son los que cumplen con mayor número de variables características.
Tabla 6. Valores promedios de los componentes de rendimiento para los genotipos de fríjol voluble pertenecientes a la Clase 3/3, según Figura 1, evaluados por su reacción a la antracnosis.
Los intervalos de confianza generales para cada una de las variables características son: peso de 100 granos (53,734 – 90,224); granos por vaina (5,61 – 7,18); vainas por planta (13,70 – 23,77); antracnosis medio (0,434 – 2,218); antracnosis superior (0,242 – 2,218). Los materiales seleccionados, fueron aquellos que estuvieron por encima del valor máximo del intervalo, para el caso de componentes de rendimiento y aquellos que presentaron valores inferiores al valor mínimo del intervalo, para las variables relacionadas con la enfermedad (Tabla 7).
Tabla 7. Genotipos de fríjol voluble seleccionados por su comportamiento agronómico en componentes de rendimiento y reacción intermedia a resistente en escala de evaluación de antracnosis.
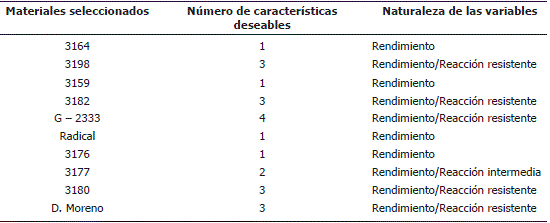
El material más sobresaliente fue el 3198, el cual presenta un peso de semilla alto, es decir un grano grande y a pesar de ello, registra una reacción resistente a la enfermedad. Por otra parte, el material D. Moreno aunque presentó un peso alto de 100 granos, tuvo una reacción resistente a intermedia a la enfermedad.
En el caso de Radical, este fue seleccionado por su comportamiento en rendimiento, aún cuando es muy susceptible a antracnosis. La variedad diferencial G-2333 es un material sobresaliente en casi todas las variables de evaluación; sin embargo, el peso de la semilla es muy bajo, lo que afecta su rendimiento y lo hace poco apetecido en los mercados locales de Colombia donde hay preferencia por los granos secos de tamaño grande (peso de 100 granos mayor a 45 g).
Presencia de genes de resistencia. En el gel de agarosa se encontró que los materiales evaluados no amplificaron la banda de 950 bp con el marcador SAS13, el cual hace parte del gen Co-4 (Melotto y Kelly, 1998; Balardín y Kelly, 1998). De igual manera, los cultivares no amplificaron la banda de 400 bp con el marcador SAB3 ligado al gen Co-5. Esto puede indicar la ausencia de ambos genes en los 31 genotipos evaluados, excepto para el genotipo G-2333, en el cual han sido identificados ambos genes (Young y Kelly, 1996; Alzate, Minarim y Barros, 2001).
Por lo anterior, se infiere que los materiales andinos en evaluación no se podrían considerar como potenciales fuentes para los genes de resistencia que pertenecen al acervo Mesoamericano, estos resultados son comparables con el comportamiento expresado de los genotipos en campo, los cuales en su mayoría manifestaron una reacción de susceptibilidad o resistencia intermedia a la presión del patógeno.
Según Geffroy et al. (1999), los análisis genéticos realizados en el complejo P. vulgaris – C. lindemuthianum, han sugerido que se presentan dos tipos independientes de procesos de domesticación: tanto en Sur América como en Mesoamérica; así mismo, se ha observado un proceso de coevolución, dentro de cada centro de diversificación. De igual manera, sugieren que C. lindemuthianum posee un bajo rango de diseminación, lo cual brinda la posibilidad de que se presente dentro de cada centro de domesticación un compacto proceso coevolutivo, resultado de una constante y reciproca selección de mecanismos de resistencia y patogenicidad dentro del complejo planta-patógeno.
Con base en los resultados obtenidos y en concordancia con los argumentos expuestos, se puede inferir el supuesto de que los genes Co-4 y Co-5 identificados en genotipos Mesomaericanos, rara vez se presentan en genotipos del acervo Andino (Pastor-Corrales, Otoya y Maya, 1993). De igual manera, Pastor-Corrales et al. (1995); sugieren que los fríjoles de origen Andino poseen una base genética de resistencia estrecha, la cual podría ser ampliada por la introgresión de los genes de resistencia del acervo Mesoamericano.
Teniendo en cuenta que el acervo genético presenta una base genética de resistencia estrecha hacia C. lindemuthianum, sería de gran importancia realizar pruebas para el gen Co-6, el cual presenta una amplia base de resistencia a un gran número de razas del patógeno, especialmente aquellas de origen Andino en cultivos de fríjol del departamento de Cauca.
CONCLUSIONES
Se exhibe una amplia variación en el comportamiento de la enfermedad dentro y entre genotipos. Esto se debe principalmente a las características genéticas de compatibilidad o incompatibilidad con el patógeno, que experimentan cada uno de los genotipos evaluados, sumado al factor ambiente. También los cultivares evaluados evidenciaron que el comportamiento de la enfermedad está asociado con el tamaño de la semilla y la precocidad del material.
El uso de marcadores moleculares tipo SCAR facilita la selección de genotipos que presentan genes de resistencia contra C. lindemuthianum o para complementar y acelerar procesos de piramidación de genes. De igual manera, complementa los resultados obtenidos en las técnicas tradicionales de selección de genotipos por resistencia. En los materiales de mejora genética en estudio no se encontró la presencia de genes asociados con la resistencia a antracnosis, posiblemente porque los genes evaluados pertenecen al acervo Mesoamericano y los genotipos son parte del acervo Andino.
BIBLIOGRAFÍA
Alzate, M., H. Minarim and G. Barros. 2001. Inheritance of anthracnose resistance in the common bean differential cultivar G-2333 and identification of a new molecular marker linked to the Co.4 gene. Phytopathology 149(5): 259-264. [ Links ]
Araya, C.M., M. Pastor y J.F. Ramírez. 1991. Variación patogénica de aislamiento de Colletotrichum lindemuthianum de fríjol procedentes de la zona noroeste y central de Costa Rica. Agronomía Costarricense 15(1-2): 63-66. [ Links ]
Balardin, R.S. and J.D. Kelly. 1998. Interaction among races of Colletotrichum lindemuthianum and diversity in Phaseolus vulgaris. Journal of the American Society for Horticultural Science 123(6): 1038-1047. [ Links ]
Cobo, F. y M.A. Pastor – Corrales. 1987. Variación patogénica y fuentes de resistencia a Colletotrichum lindemuthianum (Saac & Magn) patógeno de la antracnosis del fríjol en Colombia. Acta Agronómica 37(1): 36-47.
Franco, T., R. Hidalgo. 2003. Análisis estadístico de datos de caracterización morfológica de recursos fitogenéticos. Boletín Técnico 8, Instituto Internacional de Recursos Fitogenéticos (IPGRI), Cali, Colombia. 89 p. [ Links ]
Garzón, L.N., M.W. Blair y G.A. Ligarreto. 2007. Uso de selección asistida con marcadores para resistencia a antracnosis en fríjol común. Agronomía Colombiana 25(2): 207-214. [ Links ]
Geffroy, V., D. Sicard, J. Oliveira, J. M. Sévignac, S. Cohen, P. Gepts, C. Neema, T. Langin and M. Dron. 1999. Identification of an ancestral resistance gene cluster involved in the coevolution process between Phaseolus vulgaris and its fungal pathogen Colletotrichum lendemuthianum. The American Phytopathological Society 12(9): 774-784. [ Links ]
Gonçalves-Vidigal, M.C., C.R. Silva, F.P.S. Vidigal, A. Gonela, M.V. Kvitschal. 2007. Allelic relationships of anthracnose (Colletotrichum lindemuthianum) resistance in the common bean (Phaseolus vulgaris L.) cultivar Michelite and the proposal of a new anthracnose resistance gene, Co-11. Genetics and Molecular Biology 30(3): 589-593. [ Links ]
Guzmán, P., M.R. Donado y G.E. Gálvez. 1979. Pérdidas económicas causadas por la antracnosis del fríjol Phaseolus vulgaris en Colombia. Turrialba 29(1): 65-67. [ Links ]
Kelly, J.D. and P.N. Miklas. 1998. The role of RAPD markers in breeding for disease resistance in common bean. Molecular Breeding 4(1): 1-11. [ Links ]
Kelly, J.D. and V. Vallejo. 2004. A comprehensive review of the major genes conditions resistance to Antracnose in common bean. HortScience 39(6): 1196-1207. [ Links ]
Klimyuk, V.I., B.J. Carroll, C.M. Thomas and J.D.G. Jones. 1997. Alkali treatment for rapid preparation of plant material for reliable PCR analysis. Plant Journal 3(3): 493-494. [ Links ]
Ligarreto, G.A. 1997. Variedades y mejoramiento de fríjol. Boletín Divulgativo. Convenio FENALCE, SENA y SAC. 14 p. [ Links ]
Melotto, M. and J.D. Kelly. 1998. SCAR markers linked to major disease resistance genes in common bean. Annual Report of the Bean Improvement Cooperative (BIC) 41: 64-65. [ Links ]
Molano, P., M. Otoya y M.A. Pastor – Corrales. 1996. Diversidad de razas de Colletotrichum lindemuthianum el patógeno de la antracnosis del fríjol en Rionegro, Antioquia. Fitopatología Colombiana 19(1): 1-14.
Pachón, N.A., D.F. Gracia and G.A. Ligarreto. 2009. Yield evaluation of fourteen populations of climbing bean (Phaseolus vulgaris L.) segregating lines with anthracnose (Colletotrichum lindemuthianum) resistance genes. Agronomía Colombiana 27(1): 7-13. [ Links ]
Pagès, J. 2004. Analyse factorielle de donnees mixte: principe et exemple d’application. Pagès, J. 2004. Analyse factorielle de donnees mixtes: principe et exemple d’application. En: Montpellier SupAgro, http:// www.agro-montpellier.fr/sfds/CD/textes/pages1.pdf; consulta: octubre 2009.
Pastor-Corrales, M.A. 1985. Variación patogénica de Colletotrichum lindemuthianum el agente causal de la antracnosis del fríjol y una propuesta para su estandarización. Documento de Trabajo CIAT: 212-235. [ Links ]
Pastor-Corrales, M.A., M. Otoya y M. Maya. 1993. Diversidad de la virulencia de Colletotrichum lindemuthianum en mesoamerica y la región andina. Fitopatología Colombiana 17(1): 31-37. [ Links ]
Pastor-Corrales, M.A., O.A. Erazo, E.I. Estrada, and S.P. Singh. 1994. Inheritance of anthracnose resistance in common bean accession G-2333. Plant Disease 78: 959-962. [ Links ]
Pastor-Corrales, M.A., M.M. Otoya, A. Molina and S.P. Singh. 1995. Resistance to Colletotrichum lindemuthianum isolates from Middle American and Andean South America in different common bean races. Plant Disease 79: 63-67. [ Links ]
Riascos, J. 2001. Caracterización de la diversidad genética de Colletotrichum lindemuthianum usando marcadores moleculares. Trabajo de grado. Universidad del Valle. Facultad de Ciencias. Cali, Colombia. 70 p. [ Links ]
Rincón, R.L.J. Diversidad genética de Colletotrichum lindemuthianum que afecta fríjol en las zonas productoras de los departamentos de Cundinamarca y Santander. 2007. Trabajo de grado Maestría en Ciencias Agrarias. Universidad Nacional de Colombia. Facultad de Agronomía. Bogotá, 90p. [ Links ]
Santana, G. y G. Mahuku. 2002. Diversidad de razas de Colletotrichum lindemuthianum en Antioquia y evaluación de germoplasma de fríjol crema-rojo por su resistencia a antracnosis. Agronomía Mesoamericana 13(2): 95-103. [ Links ]
Santana, G., M. Blair, F. Morales, G. Mahuku, C. Jara y M. Castaño. 2004. Selección de genotipos de fríjol resistentes a antracnosis y mosaico común utilizando técnicas convencionales y avanzadas de mejoramiento genético. Fitotecnia Colombiana 4(1): 44-54. [ Links ]
SAS Institute INC. 2004. SAS/STAT 9.1 User’s guide.Cary, NC: SAS Institute Inc.
Schoonhoven, A. y M.A. Pastor-Corrales. 1987. Sistema estándar para la evaluación de germoplasma de fríjol. Centro Internacional de Agricultura Tropical. CIAT. Cali, Colombia. 56 p. [ Links ]
Schwartz, H.F., M.A. Pastor-Corrales and S.P. Sing. 1982. New sources of resistance to anthracnose and angular leaf spot of beans (Phaseolus vulgaris L.) Euphytica 31(3): 741-754. [ Links ]
Singh, S.P. 1998. Uso de marcadores y selección de gametos para el mejoramiento simultaneo de caracteres múltiples de fríjol (Phaseolus vulgaris L.) para Mesoamerica y el Caribe. Agronomía Mesoamericana 9(1): 1-9. [ Links ]
Tamayo, P.J. 1995. Manejo y control de las enfermedades del fríjol voluble (Phaseolus vulgaris, L). Corporación Colombiana de Investigación Agropecuaria, CORPOICA, Regional 4, Centro de Investigación “La Selva”. Rionegro, Antioquia, Colombia. Boletín Técnico 40 p.
Vallejo, V. and J.D. Kelly. 2001. Development of a SCAR marker linked to Co-5 locus in common bean. Annual Report of the Bean Improvement Cooperative (BIC) 44:121-122. [ Links ]
Young, R.A. and J.D. Kelly. 1996. Gene pyramiding using marker assisted selection for stable resistance to bean anthracnose. Annual Report of the Bean Improvement Cooperative (BIC) 39: 57-58. [ Links ]














