Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.63 no.2 Medellín July/Dec. 2010
AISLAMIENTO, IDENTIFICACIÓN Y CARACTERIZACIÓN DE NUCLEOPOLIEDROVIRUS NATIVOS DE SPODOPTERA FRUGIPERDA EN COLOMBIA
ISOLATION, IDENTIFICATION AND CHARACTERIZATION OF NATIVE NUCLEOPOLYHEDROVIRUS
OF SPODOPTERA FRUGIPERDA IN COLOMBIA
Juliana Andrea Gómez Valderrama1; Elsa Judith Guevara Agudelo2; Gloria Patricia Barrera Cubillos3; Alba Marina Cotes Prado4 y Laura Fernanda Villamizar Rivero5
1 Investigador P.U. CORPOICA. Laboratorio de Control Biológico. Centro de Investigación Tibaitatá, km 14 vía Mosquera, Cundinamarca, Colombia. <jagomez@corpoica.org.co>
2 Investigador M.Sc. CORPOICA. Grupo de Manejo Integrado de Plagas. Centro.de.Investigación La Libertad, km 17 vía Puerto López, Villavicencio, Colombia. <eguevara@corpoica.org.co>
3 Investigador M.Sc. CORPOICA. Centro de Biotecnología y Bioindustria. Laboratorio de Microbiología Molecular. Centro de Investigación Tibaitatá, km 14 vía Mosquera, Cundinamarca, Colombia. <gbarrera@corpoica.org.co>
4 Investigador Ph.D. CORPOICA. Centro de Biotecnología y Bioindustria. Laboratorio de Control Biológico. Centro de Investigación Tibaitatá, km 14 vía Mosquera, Cundinamarca, Colombia.<acotes@corpoica.org.co>
5 Investigador Ph.D. CORPOICA. Centro de Biotecnología y Bioindustria. Laboratorio de Control Biológico. Centro de Investigación Tibaitatá, km 14 vía Mosquera, Cundinamarca, Colombia. <lvillamizar@corpoica.org.co>
Recibido: Junio 3 de 2010; Aceptado: Noviembre 26 de 2010.
Resumen. El gusano cogollero del maíz Spodoptera frugiperda (J.E. Smith) es considerado la plaga más importante del cultivo en el mundo. En varios países se han empleado exitosamente los nucleopoliedrovirus de la familia Baculoviridae para su control. Sin embargo, en Colombia, no se cuenta ningún bioplaguicida viral registrado para el control de la plaga. En el presente trabajo, se realizó la búsqueda de aislamientos nativos de nucleopoliedrovirus en los departamentos de Tolima, Meta y Córdoba, mediante la recolección de larvas en diferentes cultivos. Las muestras fueron analizadas por microscopía para la búsqueda de partículas virales y los aislamientos encontrados se caracterizaron física y biológicamente. Se recolectaron 2.140 larvas de S. frugiperda en los tres departamentos muestreados. Sin embargo, sólo en un lugar (Cereté, Córdoba), se encontraron larvas con síntomas de infección viral en campo. El 2% de las muestras colectadas mostraron síntomas típicos de infección y en total se identificaron 3 aislamientos codificados como NPV003 (Córdoba), NPV009 (Tolima) y NPV011 (Meta). Los aislamientos presentaron un tamaño de partícula entre 1,93 mm y 2,14 mm. Las concentraciones letales medias (CL50) sobre larvas neonatas oscilaron entre 2,2 x 105 CI/mL y 7,0 x 105 CI/mL y no se registraron estadísticas entre los aislamientos, sugiriendo que todos tienen la misma patogenicidad sobre larvas neonatas del insecto. Estos virus nativos representan la base para el desarrollo de una nueva alternativa biológica para el control de la plaga, siendo necesario iniciar los estudios para su formulación.
Palabras clave: Baculovirus, gusano cogollero, maíz, control biológico.
Abstract. Worldwide, the fall armyworm Spodoptera frugiperda (J.E. Smith) is considered the most important pest of maize crop. Nucleopolyhedrovirus of Baculoviridae family have been successfully used in several countries for its control. However, in Colombia there are not any biopesticide registered for the control of this pest. In the present work, native nucleopolyhedrovirus were isolated from the departments of Tolima, Meta and Córdoba, by collecting larvae in different crops. Samples were analyzed by microscopy in order to find viral particles and the isolates were characterized physically and biologically. A total of 2,140 larvae of S. frugiperda were collected in the three sampled zones. However, larvae with viral infection symptoms in the field were found only in one place (Cereté, Córdoba). The 2% of the samples exhibited typical symptoms of infection and 3 isolates were identified and codified as NPV003 (Córdoba), NPV009 (Tolima) and NPV011 (Meta). Isolates showed a particle size between 1.93 mm and 2.14 mm. The mean lethal concentrations (LC50) over neonate larvae ranged between 2.2 x 105 CI/mL and 7.0 x 105 CI/mL and there were not statistical differences among isolates, suggesting that all have the same pathogenicity on neonate larvae of the insect. Currently, these native viruses represent the base for developing a new biological alternative for the control of this pest, being necessary to being the studies for their formulation
Key words: Baculovirus, fall armyworm, corn, biological control.
El “gusano cogollero del maíz” Spodoptera frugiperda (J.E. Smith, 1797) (Lepidoptera: Noctuidae) es considerado la plaga más importante del cultivo de maíz en muchas regiones de América (López - Ávila, 1981; Murua y Virla, 2004). En Colombia, es plaga secundaria de otros cultivos como sorgo, arroz, caña de azúcar, algodón y pastos (García et al., 2002). Su amplia distribución geográfica y la gran cantidad de hospederos alternos hacen que el daño causado por este insecto, sea uno de los más importantes a nivel económico. La plaga puede causar pérdidas superiores al 34% en maíz (Carnevalli y Florcovski, 1995) y específicamente en Colombia se han descrito pérdidas superiores al 60% en dicho cultivo (ICA, 2008).
El control químico es la práctica más empleada para reducir los efectos de este insecto. Sin embargo, generalmente los productos utilizados son altamente tóxicos causando un impacto ecológico para la entomofauna benéfica y un alto riesgo de intoxicación y residualidad en alimentos. En algunos casos también se ha generado resistencia del insecto a dichos productos, además de interferencia con la llegada y acción de los agentes naturales de control (García y Pulido, 1984; Morillo y Notz, 2001). Por tales razones, el control biológico mediante el uso de virus entomopatógenos surge como una alternativa promisoria y ambientalmente sostenible, debido a su alta especificidad y virulencia.
Una de las familias de entomovirus más estudiada es la Baculoviridae a la cual pertenecen los nucleopoliedrovirus (NPV). Estos se caracterizan por presentar cuerpos de inclusión (CI) que los protegen contra algunos factores ambientales y por afectar sólo a invertebrados, especialmente insectos. Adicionalmente, no representan riesgos para otros organismos incluyendo el hombre, siendo por lo tanto adecuados para ser utilizados como agentes de control biológico (Burges, 1981). Dichos virus han sido descritos en aproximadamente 600 especies de insectos, de las cuales la mayoría pertenecen a los órdenes Lepidóptera y en menor proporción a los órdenes Díptera e Himenóptera (Herniou et al., 2003).
El nucleopoliedrovirus de S. frugiperda (SfMNPV) ha sido aislado de poblaciones del insecto en el norte, centro y sur de América (Loh et al., 1982; Shapiro et al., 1991; Berretta et al., 1998; Escribano et al., 1999). Algunos de estos aislamientos se han evaluado bajo condiciones de campo, demostrando un alto potencial como bioplaguicida para el control de la plaga (Williams et al., 1999; Armenta et al., 2003). Tal es el caso de Brasil en donde se seleccionaron aislamientos nativos de NPV con alta actividad insecticida sobre S. frugiperda, con los cuales EMBRAPA (Empresa Brasilera de Investigación Agropecuaria) desarrolló un producto formulado como un polvo mojable y estandarizó un sistema de producción a escala. Dicho producto se evaluó bajo condiciones de campo obteniendo mortalidades del 90% (Valicente y Da Costa, 1995). En otro trabajo desarrollado también en Brasil, se evaluaron aislamientos de NPV para el control tanto de S. frugiperda como de S. exigua (plaga polífaga que consume hortalizas y otros cultivos en todo el mundo) y se obtuvieron resultados altamente significativos en cuanto a la mortalidad de las dos especies del insecto, con porcentajes de control incluso superiores a los logrados con productos químicos (Guimarães et al., 2003).
Por otra parte, ante la Agencia de Protección Ambiental de los Estados Unidos (EPA) existen actualmente cinco nucleopoliedrovirus registrados para su venta como bioplaguicidas, de los cuales ninguno se recomienda para el control de S. frugiperda (EPA, 2010).
En Colombia, el centro de Biotecnología y Bioindustria (CBB) de CORPOICA produce comercialmente un bioplaguicida a base de un granulovirus de Phthorimaea operculella para su uso como protector de la semilla de papa bajo condiciones de almacenamiento. Su elaboración se realiza en una planta registrada ante el Instituto Colombiano Agropecuario ICA. El Laboratorio de Control Biológico de CORPOICA ha evaluado aislamientos foráneos de NPV para el control de S. frugiperda con resultados promisorios, alcanzando mortalidades de larvas superiores al 90% bajo condiciones de laboratorio. Sin embargo, no se contaba con aislamientos nativos de este virus, que podrían estar más adaptados a las condiciones agroclimáticas del país y no existía ni existe actualmente ningún producto viral registrado en Colombia para el control de este insecto, surgiendo la necesidad de iniciar un trabajo en este tema.
Con base en los antecedentes y considerando la iniciativa expuesta anteriormente, se planteó como objetivo del presente trabajo realizar la búsqueda de aislamientos nativos de NPV de Spodoptera frugiperda y caracterizarlos física y biológicamente, con miras al futuro desarrollo de un bioplaguicida para el control de esta plaga.
MATERIALES Y MÉTODOS
Cría del insecto. Los insectos utilizados para la investigación fueron obtenidos a partir de la cría de S. frugiperda ubicada en el Centro de Biotecnología y Bioindustria de CORPOICA (Mosquera, Cundinamarca) y establecida a partir de larvas colectadas en cultivos de maíz en el municipio del Espinal (Tolima). Los insectos se mantuvieron en un cuarto a 26 ± 2 °C y 60% de humedad relativa, con un fotoperíodo de 12 horas. Las larvas fueron manejadas de manera individual en recipientes plásticos de 25 mL que contenían 15 mL de dieta artificial (harina de maíz 8,3 g; levadura de pan 8,3 g, harina de fríjol 41,6 g; formaldehído al 10% 1 mL; metilparabeno 0,6 g; ácido ascórbico 0,8 g; ácido sórbico 0,7 g; aceite de linaza 2 mL; caseína 0,8 g; agar 4,0 g y agua destilada estéril 300 mL).
Recolección de larvas. La búsqueda de aislamientos de NPV se realizó en los departamentos de Córdoba, Tolima y Meta (Colombia). Para ello se seleccionaron fincas con cultivos de maíz, sorgo, algodón, entre otros, en los que se hubiera detectado la presencia de la plaga. En cada cultivo se observaron las plantas, en las hojas y los cogollos en busca de las larvas de S. frugiperda, las cuales se colocaron individualmente en vasos con dieta artificial. Las larvas muertas o que presentaban algún síntoma de infección viral se recogieron individualmente en tubos Eppendorf con 1 mL de solución salina estéril. Las muestras fueron transportadas al Laboratorio de Control Biológico de CORPOICA para su análisis y allí fueron mantenidas en cuarentena en un cuarto de bioensayos con las condiciones de temperatura y humedad mencionadas anteriormente. Los vasos con dieta y con los insectos se rotularon con los datos de los sitios de recolección.
Búsqueda e identificación de aislamientos nativos de nucleopoliedrovirus. Las larvas se revisaron diariamente registrando todo cambio en su comportamiento o características morfológicas. Cada larva muerta o con síntoma de infección viral se maceró en solución salina y la suspensión obtenida se observó en el microscopio óptico (400x) para la búsqueda de los cuerpos de inclusión del virus, los cuales tienen una forma poliédrica característica.
Aquellas muestras en las que se observaron posibles cuerpos de inclusión o sintomatología de infección viral, se emplearon para realizar una prueba de reproducción de síntomas de la enfermedad. Para esto, se tomaron 100 mL de la muestra y se mezclaron con 100 mL de una solución que contenía sacarosa al 4% y azul de alimentos Tuska® (Azul No 1 y Azul No 2) al 1%. Dicha solución fue suministrada por vía oral a un grupo de larvas de S. frugiperda de segundo estadío que se sometieron previamente a 24 horas de ayuno, empleando el método de la gota descrito por Hughes y Wood (1981). Se tomó el contenido del pozo previamente homogeneizado con una micropipeta de 10 mL y se dispensaron gotas de 2 mL en forma circular en un disco plástico de color blanco. Posteriormente se ubicaron las 40 larvas de S. frugiperda en el interior del círculo y se esperó hasta que bebieran el tratamiento, lo cual se evidenció por la coloración azul en el cuerpo de las mismas, como consecuencia de la ingestión del virus con el colorante. El cambio de color fue detectado mediante observación en un estereoscopio y se seleccionaron aquellas larvas que consumieron el tratamiento en un lapso menor a 10 minutos.
Las larvas inoculadas fueron ubicadas individualmente en vasos con dieta artificial y posteriormente fueron incubadas en un cuarto de bioensayos a 26 ± 2 °C. A partir del quinto día de incubación, se realizó una revisión diaria y se separaron aquellas larvas que presentaron sintomatología típica de la infección viral (coloración blanca lechosa a café clara, pérdida de turgencia y fragilidad del tegumento).
Los aislamientos de nucleopoliedrovirus recuperados y multiplicados en las larvas de S. frugiperda fueron conservados en solución salina estéril a -70 °C e ingresados al Banco de Germoplasma de Microorganismos con Interés en Control Biológico de CORPOICA.
Producción y purificación viral. La producción de los virus para ser empleadas en los bioensayos se realizó mediante la inoculación de larvas de S. frugiperda de tercer estadío, con suspensiones de cada uno de de los aislamientos en estudio, utilizando la misma metodología descrita anteriormente.
Para la purificación viral se uso el método descrito por Valicente et al. (1989) modificado. Las larvas infectadas de cada aislamiento fueron homogeneizadas en un mortero estéril de porcelana con solución de sodio-dodecil-sulfóxido (SDS) al 0,1% estéril y posteriormente se filtraron por tres capas de velo suizo para retirar el tejido del insecto. El líquido se centrifugó a 1000 rpm durante 1 min y se recogió el sobrenadante, el cual se centrifugó a 15000 rpm por 30 min. El sedimento obtenido se resuspendió en 1 mL de tampón Tris HCl 0,1M pH 6,0 y se ubicó sobre un colchón de sacarosa del 40% y 60%. Posteriormente se centrifugó a 15000 rpm durante 30 min y se retiró la banda correspondiente al virus y se realizaron dos lavados con el mismo tampón. La suspensión purificada obtenida se guardó en congelación a -20 °C.
Caracterización de los aislamientos virales
Caracterización física: tamaño de partícula de los cuerpos de inclusión (CI). El tamaño medio de los CI se determinó mediante microscopía óptica, midiendo el diámetro de 100 partículas de cada aislamiento con un micrómetro adaptado al ocular de un microscopio Olympus CH3ORF100 (Hirech et al., 2003). Adicionalmente se fotografiaron los CI mediante microscopía electrónica de transmisión con el fin de analizar su morfología y estructura y para corroborar el tamaño de partícula de las mismas.
Caracterización biológica
Determinación de la concentración letal media CL50. Con todos los aislamientos de NPV se realizó un bioensayo siguiendo la metodología descrita por Támez et al. (2006). Con el virus purificado se preparó una suspensión viral y se determinó la concentración mediante recuento en cámara de Neubauer. A partir de esta suspensión se prepararon cinco concentraciones correspondientes a 2x104, 2x105, 2x106, 2x107 y 2x108 CI/mL. Se colocaron 100 mL de cada concentración en un pozo de una fila de una microplaca de 96 pozos de fondo plano. Posteriormente se adicionaron a cada pozo 100 mL de la solución de sacarosa y colorante azul de alimentos y con la muestra final contenida en cada pozo se inocularon 30 larvas neonatas de S. frugiperda, siguiendo la metodología descrita anteriormente (Hughes y Word, 1981).
Las larvas se ubicaron individualmente en vasos con dieta artificial y se incubaron a 26 ± 2 °C. Se contó con un testigo absoluto que consistió en larvas que no fueron sometidas a ningún tratamiento. Al cabo de siete días se registró la mortalidad de las larvas.
El diseño experimental del bioensayo fue completamente al azar y los resultados de mortalidad fueron sometidos a un análisis Probit (Finney, 1952), mediante el programa Biostat 2007 para la determinación de la concentración letal media.
RESULTADOS Y DISCUSIÓN
Búsqueda e identificación de aislamientos nativos de nucleopoliedrovirus. En total se realizaron cinco muestreos de larvas de S. frugiperda para la búsqueda de aislamientos nativos de NPV en los departamentos de Córdoba, Meta y Tolima en Colombia. Se recolectaron 2.140 larvas en los tres departamentos a partir de diferentes cultivos (Tabla 1).
Tabla 1. Número total de larvas de Spodoptera frugiperda colectadas y número de larvas según su causa de mortalidad.

Las larvas que murieron durante la cuarentena se analizaron mediante microscopía de luz y se encontraron 43 muestras (2%) con cuerpos de inclusión poliédricos característicos de los NPV (Figura 1 A). El departamento con mayor incidencia viral fue Córdoba con 38 muestras positivas, seguido de Meta con cuatro y por último Tolima donde se encontró una sola muestra positiva. Sin embargo, las larvas fueron colectadas en el mismo sitio de muestreo en cada departamento, razón por la cual se seleccionó una sola muestra de cada sitio y se consideró como un aislamiento viral. En total se aislaron 3 NPV de S. frugiperda en Colombia, lo que corresponde a un 0,14% de ocurrencia de este entomopatógeno. Resultados similares fueron encontrados en Brasil, en donde se realizó un muestreo de larvas de S. frugiperda para la búsqueda de diferentes enemigos naturales del insecto y a partir de 14.000 larvas recolectadas se encontraron 21 aislamientos de NPV (0,15% de ocurrencia) (Valicente, 1989; Valicente y Barreto, 1999), lo cual sugiere que probablemente en poblaciones de campo del insecto en Colombia y Brasil, se encuentra una incidencia de NPV promedio del 0,14%, aunque es importante resaltar que la presencia y persistencia de los baculovirus en condiciones de campo se puede ver afectada por diferentes factores como la densidad de población del insecto hospedero, la cantidad de inóculo viral, las condiciones físicas y químicas del suelo, etc. (Williams y Caballero, 2008). Los tres aislamientos encontrados fueron codificados como NPV003 (Córdoba), NPV009 (Meta) y NPV011 (Tolima).
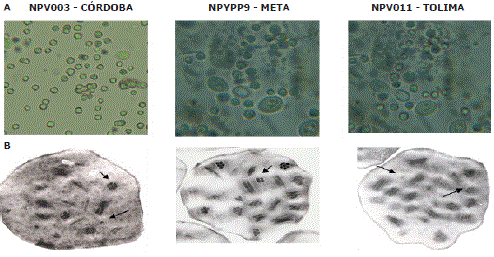
Figura 1. Cuerpos de inclusión de los aislamientos nativos de NPV de Spodoptera frugiperda detectados en la hemolinfa de larvas infectadas. (A) Microscopía de luz (100X), (B) Microscopía electrónica de transmisión. Las flechas señalan los viriones que pueden contener una o varias nucleocápsides.
Los síntomas característicos de las larvas infectadas por NPV fueron la pérdida de apetito y movilidad, cambio en la coloración desde blanco hasta café, fragilidad y ruptura del tegumento, síntomas descritos para este tipo de virus (Caballero, López-Ferber y Williams, 2001; Vásquez, Zeddam y Tresierra, 2002). Sin embargo, dicha sintomatología sólo fue evidente en las larvas mantenidas bajo condiciones de laboratorio, ya que en campo sólo una larva colectada en el departamento de Córdoba presentó sintomatología típica de infección. Como lo describió Laarif et al. (2003) en su estudio sobre la epidemiología de un baculovirus de P. operculella en Túnez, los síntomas de infección exhibidos en campo son difíciles de encontrar y algunas larvas infectadas pueden no mostrar síntomas indicativos de la presencia de la enfermedad. Este fenómeno puede deberse a la presencia de bajas concentraciones del virus en el insecto o a un caso de infección latente. Es por esto que el análisis microscópico, molecular y biológico (reproducción de síntomas virales bajo condiciones de laboratorio), es fundamental para el aislamiento de baculovirus en muestras recolectadas en campo.
El mayor número de larvas de S. frugiperda afectadas por baculovirus se encontró en áreas con cultivo de pastos, seguido por los cultivos de sorgo y maíz. Esto podría deberse a que para que tenga lugar la transmisión del virus, es necesario que haya un transporte de cuerpos de inclusión virales desde el suelo hasta la superficie foliar donde son ingeridos por insectos susceptibles, lo cual puede ocurrir por acción de la lluvia y otros agentes físicos (Williams y Caballero, 2008). En el caso del cultivo de pastos, las partículas virales pueden movilizarse más fácilmente desde sus reservorios (el suelo y la superficie foliar) a la vegetación cercana, así como las larvas pueden pasar más fácilmente de una planta a otra. Igualmente, el rápido crecimiento del maíz o el sorgo comparado con el pasto, hace que se produzca mayor superficie foliar que no se encuentra contaminada por el virus, reduciendo la posibilidad de diseminación de la infección en las larvas presentes (Fuxa, 1982).
Por otra parte y aunque no era el propósito del muestreo, en el departamento de Córdoba se encontraron larvas afectadas por un virus del género granulovirus (Tabla 1), lo cual se evidenció por la presencia de un color blanco lechoso y flacidez sin ruptura del tegumento. Al observar la hemolinfa en microscopio de luz se apreciaron pequeñas partículas con movimiento Browniano que fueron confirmadas como granulovirus al observarlas en microscopio adaptado con campo oscuro. En total se encontró una incidencia de este agente viral del 0,04%. Algunos autores también han reportado la presencia de granulovirus afectando larvas de S. frugiperda (Diez y Lorenzatti, 1986; Dauthduille, Croizier y Ferron, 1988; Valicente 1989), aunque es más común la incidencia de dicho virus sobre larvas de otras especies de Spodoptera como S. litura y S. exigua (Narayanan, 2002; Lau, Sajap y Samad, 2006; Wang et al., 2008). El aislamiento de granulovirus de S. frugiperda encontrado en el presente trabajo fue conservado a -70 °C para ser estudiado en investigaciones futuras y confirmar su identidad mediante herramientas moleculares.
Adicionalmente, de las 24 larvas que presentaron infección por granulovirus, 9 de ellas mostraron también infección con NPV, lo cual sugiere una co-infección de estas muestras con los dos agentes virales (Tabla 1) (Tanada, 1959). La presencia de dos especies virales puede resultar en diferentes mortalidades del hospedero, comparado con infecciones virales simples, pudiendo presentar mayor mortalidad (efecto aditivo o sinérgico) o menor mortalidad (inhibición virus-virus) (Hackett et al., 2000). Sin embargo, el mayor efecto evidenciado ha sido el sinergismo, en el cual la presencia del granulovirus aumenta la infectividad del NPV. Dicho efecto se debe a la expresión por parte del granulovirus de una proteína de la familia de las metaloproteasas denominada “enhancin”, la cual aumenta la permeabilidad de la membrana peritrófica del intestino medio del insecto y degrada la mucina intestinal, sitios de entrada de los viriones de los baculovirus, aumentando la susceptibilidad del insecto a la infección viral (Hoover et al., 2010; Peng, Zhong y Granados, 1999). El efecto de la co-infección encontrada en este trabajo será evaluado posteriormente con el fin de identificar el tipo de interacción entre los dos virus y generar posibles recomendaciones de formulación y aplicación en mezcla de los dos virus.
Caracterización de los aislamientos virales
Caracterización física
Tamaño de partícula de los cuerpos de inclusión (CI). El diámetro de las partículas virales fue determinado mediante microscopía óptica. Los CI virales presentaron diámetros que oscilaron entre 1,93 y 2,14 mm con un valor medio de 2,0 ± 0,5 mm, 1,9 ± 0,4 mm y 2,1 ± 0,5 mm para los aislamientos NPV003, NPV011 y NPV009, respectivamente (Figura 1A). Estos resultados se encuentran dentro del rango de tamaño descrito por Caballero, López-Ferber y Williams (2001) para los NPV, el cual oscila entre 0,5 y 15 mm o del descrito por la Organización para la Cooperación Económica y el Desarrollo, quienes afirman que el diámetro de las partículas virales puede estar entre 0,15 y 15 mm (OECD, 2002).
Los tres aislamientos virales colombianos mostraron varios viriones por cuerpo de inclusión (Figura 1B), los cuales contienen de 1 a 8 nucleocápsides por virión. Estas observaciones permiten clasificar los tres aislamientos nativos dentro del grupo de los NPV múltiples (MNPVs) (Caballero, López-Ferber y Williams, 2001).
Caracterización biológica:
Determinación de la concentración letal media CL50. Se utilizó un modelo Probit para calcular la relación dosis-mortalidad de los aislamientos de NPV nativos sobre larvas neonatas de S. frugiperda a los 7 días post-inoculación. Los valores p obtenidos fueron superiores a 0,05 (Tabla 2), lo que permitió aceptar la hipótesis de que existe una correlación lineal entre la dosis y la mortalidad de las larvas. Los bajos valores de Chi-cuadrado (χ2) sugirieron homogeneidad entre los datos (menores a 5, Tabla 2), lo que además indicó que la distribución experimental se ajustó a la teórica (Zar, 1999).
La mortalidad de las larvas se vio afectada por la concentración viral utilizada y los valores de concentración letal media (CL50) oscilaron entre 1,5 x 105 CI/mL y 7 x 105 CI/mL (Tabla 2). La comparación entre los límites fiduciales (95%) tanto de la concentración como de la potencia relativa indicó que no existen diferencias significativas entre la patogenicidad de los tres aislamientos virales. Sin embargo, según las potencias relativas calculadas, el virus más patogénico fue el aislado en el departamento del Tolima, seguido por el proveniente de Córdoba y por último el obtenido en el Meta (Tabla 2).
Tabla 2. Concentración letal media de los aislamientos nativos de NPV sobre larvas neonatas de Spodoptera frugiperda al séptimo día post-inoculación. Los datos de cada aislamiento corresponden al promedio de las tres repeticiones en el tiempo.
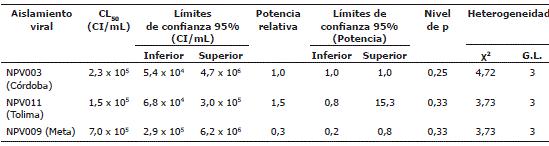
Las concentraciones letales medias determinadas para los aislamientos nativos fueron menores que la mencionada por Villamizar (2008) para el aislamiento NPV001 de S. frugiperda proveniente de Perú, empleando las mismas condiciones y la misma colonia del insecto. Este autor cuantificó un valor de 2,1 x 106 CI/mL, lo que indica que dicho aislamiento viral es entre 3 y 14 veces menos patogénico sobre larvas neonatas de S. frugiperda que los aislamientos colombianos. Esto podría sugerir que los aislamientos obtenidos a partir de larvas de S. frugiperda en el presente trabajo, posiblemente se encuentran mejor adaptados al hospedero y a las condiciones ambientales del país. Resultados similares fueron encontrados en un estudio realizado con el NPV de Trichoplusia ni (TnSNPV) en Canadá, en donde los aislamientos nativos fueron más infectivos y virulentos sobre el insecto, que los aislamientos de sitios geográficos diferentes (Erlandson et al., 2007). Esto indica que existe una fuerte presión selectiva para que el virus mantenga una alta actividad biológica hacia las poblaciones de insectos locales, probablemente mediante el mecanismo de co-evolución hospedero-patógeno (Herniou et al., 2004).
En otro estudio realizado por Escribano et al. (1999) se determinó la actividad biológica de cuatro aislamientos de NPV de S. frugiperda, provenientes de España, USA, Argentina y Nicaragua, obteniendo valores de CL50 similares a los alcanzados en el presente trabajo con los aislamientos de USA y Nicaragua y valores significativamente mayores con los aislamientos de Argentina y Nicaragua (3,1 x 106 CI/mL y 1,2 x 107 CI/mL respectivamente). Esta variación puede estar relacionada con diferencias genéticas entre los aislamientos virales. Sin embargo, los resultados no son completamente comparables, considerando que las metodologías de los experimentos fueron diferentes, debido a que la evaluación de los aislamientos en dicha investigación se realizó con larvas de segundo estadío.
Los aislamientos nativos encontrados en este trabajo, podrían ser genéticamente distintos a otros NPV aislados en diferentes regiones geográficas, lo cual posiblemente tendría efectos variables en su patogenicidad y virulencia. Normalmente, los NPV encontrados en campo son mezclas de varios genotipos (Muñoz et al., 1999; Simon et al., 2004; Simon et al., 2005); por tal razón, es necesaria la caracterización genotípica de estos, con el fin de seleccionar el genotipo o las mezclas con las mejores características biológicas y tecnológicas e iniciar el desarrollo de un bioplaguicida.
CONCLUSIÓN
Se encontraron tres aislamientos nativos de NPV de S. frugiperda en Colombia, los cuales pertenecen al grupo de NPV múltiples y presentaron la misma actividad biológica sobre larvas neonatas del insecto.
AGRADECIMIENTOS
Los autores expresan su agradecimiento al Ministerio de Agricultura y Desarrollo Rural, a la Federación Nacional de Cultivadores de Cereales y Leguminosas FENALCE por el apoyo financiero del presente trabajo, así como al Dr. Miguel López-Ferber, al Dr. Primitivo Caballero y al Dr. Fernando Valicente por su asesoría científica.
BIBLIOGRAFÍA
Armenta, R., A. Martínez, J. Chapman, R. Magallanes, D. Goulson, P. Caballero, R. Cave, J. Cisneros, J. Valle, V. Castillejos, D. Penagos, L.F. Garcia and T. Williams. 2003. Impact of a nucleopolyhedrovirus bioinsecticide and selected synthetic insecticides on the abundance of insect natural enemies on maize in southern Mexico. Journal of Economic Entomology 96(3): 649-661. [ Links ]
Berretta, M.F., M.L. Rios and A. Sciocco de Cap. 1998. Characterization of a nuclear polyhedrosis virus of Spodoptera frugiperda from Argentina. Journal of Invertebrate Pathology 71(3): 280-282. [ Links ]
Burges, H. 1981. Microbial Control of pest and plant diseases 1970-1980. Academic Press, London. 949 p. [ Links ]
Caballero, P. y T. Williams, 2008. Virus entomopatógenos. p. 121 – 126. En: Jacas, J. y A. Urbaneja, (eds.). Control biológico de plagas agrícolas. Unidad Asociada de Entomología UJI-IVIA-CIB. Editorial M.V. Phytoma, España.
Caballero, P., M. López-Ferber y T. Williams. 2001. Los baculovirus y sus aplicaciones como bioinsecticidas en el control biológico de plagas. Universidad Pública de Navarra, Editorial Phytoma, España. 517 p. [ Links ]
Carnevalli, P. e J.L. Florcovski. 1995. Efeito de diferentes fontes de nitrogênio em milho (Zea mays L.) sobre Spodoptera frugiperda (J.E. Smith, 1797). Ecossistema 20: 41-49. [ Links ]
Dauthuille D., G. Croizier and P. Ferron. 1988. A newly isolated granulosis virus from Spodoptera frugiperda (Lepidoptera: Noctuidae) in French Guiana. L’ Agronomie tropicale 43(1): 64-76.
Diez, S. y D. Lorenzatti, 1986. Presencia de virus de poliedrosis nuclear y de granulosis en poblaciones de Spodoptera frugiperda atacando soja en el área de la EEA Ol. IX Reunión Técnica Nacional de Soja. Resistencia, Chaco. Instituto Nacional de Tecnología Agropecuaria, Estación Experimental Agropecuaria Oliveros. República Argentina. [ Links ]
EPA. 2010. Pesticides: Regulating pesticides. In: http://www.epa.gov/pesticies/biopesticides;consulta: marzo de 2010. [ Links ]
Erlandson, M., S. Newhouse, K. Moore, A. Janmaat, J. Myers and D. Theilmann. 2007. Characterization of baculovirus isolates from Trichoplusia ni populations from vegetable greenhouses. Biological Control 41(2): 256-263. [ Links ]
Escribano, A., T. Williams, D. Goulson, R. Cave, J.W. Chapman and P. Caballero. 1999. Selection of a nucleopolyhedrovirus for control of Spodoptera frugiperda (Lepidoptera: Noctuidae): structural, genetic, and biological comparison of four isolates from the Americas. Journal of Economic Entomology 92(5): 1079-1085. [ Links ]
Finney, D. 1952. Probit Analysis. Cambridge, University Press, London. 151 p. [ Links ]
Fuxa, J.R. 1982. Prevalence of viral infections in populations of fall armyworm, Spodoptera frugiperda, in southeastern Louisiana. Environmental Entomology 11(1): 239-242. [ Links ]
García, F. y F. Pulido. 1984. El gusano cogollero del maíz Spodoptera frugiperda (J.E. Smith), su control y perspectivas para su manejo. En: XI Reunión de maiceros de la zona andina. II Reunión latinoamericana del maíz. Ministerio de Agricultura. Instituto Colombiano Agropecuario. Programa Nacional de Maíz y Sorgo, Colombia. 35 p. [ Links ]
García, F., M. Mosquera, C. Vargas y L. Rojas. 2002. Control biológico, microbiológico y físico de Spodoptera frugiperda (Lepidoptera: Noctuidae) plaga de maíz y otros cultivos en Colombia. Revista Colombiana de Entomología 28(1): 53-60. [ Links ]
Guimarães F.; E. Beserra, C. Santiago-Alvarez e E. Vargas-Osuna. 2003. Patogenicidade do nucleopolyhedrovirus (NPV) (Baculoviridae) isolados em larvas de Spodoptera exigua e S. littoralis sobre larvas de S. frugiperda. Revista Manejo Integrado de Plagas y Agroecología (CATIE - Costa Rica) 70: 74-77. [ Links ]
Hackett, K., A. Boore, C. Deming, E. Buckley, M. Camp and M. Shapiro. 2000. Helicoverpa armigera granulovirus interference with progression of H. zea nucleopolyhedrovirus disease in H. zea larvae. Journal of Invertebrate Pathology 75(2): 99-106. [ Links ]
Herniou, E., J. Olszewski, D. O’reilly and J. Cory. 2004. Ancient coevolution of baculoviruses and their insect host. Journal of Virology 78(7): 3244-3251.
Herniou, E., J. Olszewski, J. Cory and D. O’reilly. 2003. The genome sequence and evolution of baculoviruses. Annual Review of Entomology 48: 211-234.
Hirech, K., S. Payan, G. Carnelle, L. Brujes and J. Legrand. 2003. Microencapsulation of an insecticide by interfacial polymerization. Powder Technology 130(1-3): 324-330. [ Links ]
Hoover, K., M. Humphries, A. Gendron and J. Slavicek. 2010. Impact of viral enhancin genes on potency of Lymantria dispar multiple nucleopolyhedrovirus in L. dispar following disruption of the peritrophic matrix. Journal of Invertebrate Pathology 104(2): 150-152. [ Links ]
Hughes, P. and H.A. Wood. 1981. A synchronous per oral technique for the bioassay of insect viruses. Journal of Invertebrate Pathology 37(2): 154-159. [ Links ]
Instituto Colombiano Agropecuario – ICA. 2008. Resolución No. 000879. p. 1-5. En: Ministerio de Agricultura y Desarrollo Rural. Bogotá, Colombia.
Laarif, A., S. Fattouch, W. Essid, N. Marzouki, H. Ben Salah and M. Ben Hammouda. 2003. Epidemiological survey of Phthorimaea operculella granulosis virus in Tunisia. Bulletin OEPP/EPPO 37: 335-338. [ Links ]
Lau, W.H., A.S. Sajap and N. Samad. 2006. A pathogenic insect virus, Spodoptera litura granulovirus, to the armyworm, Spodoptera litura. Agro-Search 11(1): 35-41. [ Links ]
Loh, L.C., J.J. Hamm, C. Kawanishi and E.S. Huang. 1982. Analysis of the Spodoptera frugiperda nuclear polyhedrosis virus genome by restriction endonucleases and electron microscopy. Journal of Virology 44(2): 747-751. [ Links ]
López-Ávila, A. 1981. Estudios básicos para la cría de Meteorus laphygmae (Vierick) parásito de Spodoptera frugiperda (J.E. Smith). Tesis de Maestría. Facultad de Agronomía. Universidad Nacional de Colombia, Bogotá. 103 p. [ Links ]
Morillo, F. and A. Notz. 2001. Resistencia de Spodoptera frugiperda (Smith) (Lepidoptera: Noctuidae) a lambdacihalotrina y metomil. Entomotrópica antes: Boletín de Entomología Venezolana 16(2): 79-87. [ Links ]
Muñoz, D., R. Murillo, P. Krell, J. Vlak and P. Caballero. 1999. Four genotypic variants of a Spodoptera exigua nucleopolyhedrovirus (Se-SP2) are distinguishable by a hypervariable genomic region. Virus Research 59(1): 61-74. [ Links ]
Murua, M. y E.G Virla. 2004. Presencia invernal de Spodoptera frugiperda (Smith) Lepidoptera: Noctuidae) en el área maicera de la provincia de Tucumán, Argentina. Revista de la Facultad de Agronomía, La Plata 105(2): 46-52. [ Links ]
Narayanan, K. 2002. Occurrence of granulosis virus of Spodoptera exigua (Hübner) (Lepidoptera: Noctuidae). Biological control of lepidopteran pests. Proceedings of the Symposium of Biological Control of Lepidopteran Pests, Bangalore, India. [ Links ]
Organization for Economic Cooperation and Development. 2002. Consensus Document on Information used in the Assessment of Environmental Applications involving Baculovirus, Series on Harmonization of Regulatory Oversight in Biotechnology, OECD Environment, Health and Safety Publications, Paris. 20:13. [ Links ]
Peng, J., J. Zhong and R. Granados. 1999. A baculovirus enhancing alters the permeability of a mucosal midgut peritrophic matriz from lepidopteran larvae. Journal of Insect Physiology 45(2): 159-166. [ Links ]
Shapiro, D.I., J.R. Fuxa, H.D. Braymer and D.P. Pashley. 1991. DNA restriction polymorphism in wild isolates of Spodoptera frugiperda nuclear polyhedrosis virus. Journal of Invertebrate Pathology 58(1): 96-105. [ Links ]
Simón, O., T. Williams, M. López-Ferber and P. Caballero. 2004. Genetic structure of a Spodoptera frugiperda nucleopolyhedrovirus population: High prevalence of deletion genotypes. Applied and Environmental Microbiology 70(9): 5579-5588. [ Links ]
Simón, O., T. Williams, M. López-Ferber and P. Caballero. 2005. Functional importance of deletion mutant genotypes in an insect nucleopolyhedrovirus population. Applied and Environmental Microbiology 71(8): 4254-4262. [ Links ]
Tamez, P., V. Zamudio, J. Martínez, C. Rodríguez, R. Tamez y R. Gómez. 2006. Formulaciones granulares de baculovirus en combinación con abrillantadores ópticos para su empleo como bioinsecticidas. Ciencia UANL 9(2): 149-156. [ Links ]
Tanada, Y. 1959. Synergism between two viruses of the armyworm, Pseudaletia unipuncta (Haworth) Lepidoptera, Noctuidae). Journal of Insect Pathology 45(1): 215-231. [ Links ]
United States Environmental Protection Agency –EPA. 2010. Pesticides: regulating pesticides; http://www.epa.gov/pesticides/biopesticides. consulta: marzo de 2010.
Valicente, F. e E. Da Costa. 1995. Controle da la lagarta do cartucho Spodoptera frugiperda (J.E. Smith), com o baculovirus Spodoptera aplicado via água de irrigação. Anais da Sociedade Entomológica do Brasil 24(1): 61-67. [ Links ]
Valicente, F., M. Peixoto, E. Paiva e E. Kitajima. 1989. Identifição e purifição de um virus de poliedrose nuclear da-lagarta-de-cartucho Spodoptera frugiperda. Anais da Sociedade Entomológica Brasileira 18: 71-82. [ Links ]
Valicente, F.H. 1989. Levantamento dos inimigos naturais de Spodoptera frugiperda (J.E. Smith) (Lepidoptera: Noctuidae) em diferentes regiões do estado de Minas Gerais. Anais da Sociedade Entomológica Brasileira 18: 119-130. [ Links ]
Valicente, F.H. e M. Barreto. 1999. Levantamento dos inimigos naturais da lagarta do cartucho do milho, Spodoptera frugiperda (J.E. Smith) (Lepidoptera: Noctuidae), na região de Cascavel, PR. Anais da Sociedade Entomológica Brasileira 28: 333-337. [ Links ]
Vasquez, J., J. Zeddam y A. Tresierra. 2002. Control biológico del “cogollero del maíz” Spodoptera frugiperda, (Lepidoptera: Noctuidae) con el baculovirus SFVPN, en Iquitos-Perú. Folia Amazónica 13(1-2): 25-39.
Villamizar, L. 2008. Evaluación de la microencapsulación como estrategia para la fotoestabilización de un nucleopoliedrovirus de Spodoptera frugiperda (Lepidoptera: Noctuidae) frente a la radiación ultravioleta. Tesis de Doctorado en Ciencias Farmacéuticas. Facultad de Ciencias. Universidad Nacional de Colombia, Bogotá. 190 p. [ Links ]
Wang, Y., Jy. Chii, Jy. Roh, S. Woo, Br. Jin and Y. Je. 2008. Molecular and phylogenetic characterization of Spodoptera litura granulovirus. Journal of Microbiology (Seoul, Korea) 46(6): 704-708. [ Links ]
Williams, T., D. Goulson, P. Caballero, J. Cisneros, A.M. Martínez, J.W. Chapman, D.X. Roman and R. Cave. 1999. Evaluation of a baculovirus bioinsecticide for small-scale maize growers in Latin America. Biological Control 14(2): 67-75. [ Links ]
Zar, J. 1999. Biostatistical analysis. Cuarta edición. Prentice Hall, New Jersey. 523 p. [ Links ]














