Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.63 no.2 Medellín July/Dec. 2010
EVALUACIÓN DEL SECADO DE PEREJIL APLICANDO TÉCNICAS DE DESHIDRATACIÓN OSMÓTICA COMO PRETRATAMIENTO
EVALUATION OF PARSLEY DRYING APPLYING OSMOTIC DEHYDRATION TECHNIQUES AS PRETREATMENT
Maribel García Mahecha1; Misael Cortes Rodríguez2y Eduardo Rodríguez Sandoval3
1 Ingeniera de Alimentos. Universidad Jorge Tadeo Lozano. Facultad de Ciencias Naturales. Programa de Ingeniería de Alimentos. Carrera 4 No. 22-61. Bogotá, Colombia. <belo_g1@hotmail.com>
2 Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779. Medellín, Colombia. <mcortesro@unal.edu.co>
3 Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779. Medellín, Colombia. <edrodriguezs@unal.edu.co>
Recibido: Agosto 31 de 2009; Aceptado:Diciembre 7 de 2010.
Resumen. En este estudio se evaluó el efecto de la temperatura de secado (50 y 60 °C) y los diferentes tipos de pretratamientos (sin pretratamiento, deshidratación osmótica y deshidratación osmótica al vacío) sobre las características fisicoquímicas y nutricionales del perejil deshidratado, midiendo la actividad de agua, densidad, rehidratación, color, contenido de vitamina C y carotenos. Los resultados mostraron que el secado de perejil a una temperatura de 60 °C sin pretratamiento es el más adecuado, presentando un menor tiempo de proceso (68 min), una mayor reducción en la humedad (4,3%) y un menor efecto en los contenidos de vitamina C (8,7 mg de vitamina C/100 g de muestra) y carotenos (36,9 mg de carotenos/100 g de muestra). Los procesos de secado con osmodeshidratación como pretratamiento son más lentos, debido a la formación de una capa de jarabe en la superficie de las muestras, la cual dificulta la salida de la humedad del interior de las hojas. El contenido de vitamina C disminuye en todos los procesos, pero es mayor en aquellos con pretratamiento por la solubilidad de la vitamina en el agua. Los carotenos se reducen en una mayor proporción en los procesos que toman mayor tiempo en llegar a la humedad de equilibrio debido a su termosensibilidad.
Palabras clave: Osmodeshidratación, rehidratación, poscosecha, hortalizas.
Abstract. The influence of the drying temperature (50 and 60 °C) and the different pretreatments (without pretreatment, osmotic dehydration and vacuum osmotic dehydration) were evaluated on the physical, chemical and nutritional characteristics of dried parsley, such as water activity, density, rehydration, color, vitamin C content, and carotene content. The results showed that drying at 60 °C without pretreatment is the best process for drying parsley because the process time (68 min) and the moisture content (4,3%) are lower and the vitamin C (8,7 mg vitamin C/100 g sample) and carotene contents (36,9 mg carotene/100 g sample) are less affected. The drying processes with osmodehydration as pretreatment are slower due to the formation of a syrup coating on the sample surface, making the movement of moisture within the parsley leaves more difficult. The vitamin C content decreases in all processes, but the decrease is higher in the process with pretreatment due to the solubility of the vitamin in the water. The carotene content decreases at a higher rate in the process that takes more time to reach equilibrium moisture content due to its thermosensitivity.
Key words: Osmotic dehydration, rehydration, postharvest, vegetables.
El perejil (Petrosilenum sativum) es una planta originaria del Mediterráneo oriental europeo perteneciente a la familia Umbelliferae (Janick, 1986). El perejil es una hortaliza muy importante debido a su valor nutricional, caracterizándose por tener un alto contenido de vitamina C, b-caroteno, tiamina, riboflavina, y vitamina E (Athar, Spriggs y Liu, 1999; Benamotz y Fishler, 1998).
Actualmente, las pérdidas poscosecha son altas debido a que el perejil presenta una tasa respiratoria muy alta. Una de las alternativas para disminuir estas pérdidas es transformar el perejil fresco en un producto deshidratado aumentando su vida útil. La deshidratación es un proceso empleado para la preservación de alimentos, el cual consiste en la eliminación del agua libre de un sólido, permitiendo la reducción de las reacciones químicas e inhibiendo el crecimiento microbiano, y por ende prolongando la conservación de los materiales biológicos. En la mayoría de casos, la deshidratación de alimentos se realiza por aire caliente. El aire conduce el calor al alimento y éste tiende a liberar vapor de agua. Aunque la deshidratación con aire caliente es costosa con respecto a la deshidratación solar, tiene un alto número de ventajas como las siguientes: el proceso puede ser realizado sin depender del clima, el tiempo de secado es relativamente más corto y la calidad del producto mejora (Janick, 1986; Maldonado y Pacheco-Delahaye, 2003).
Entre las hortalizas más utilizadas para deshidratación por la industria colombiana se encuentran el apio, cilantro, zanahoria, cebolla, ajo y perejil (DANE-SISAC, 2002). Los principales consumidores de hortalizas deshidratadas son las industrias de sopas instantáneas, salsas, especias, cremas y sopas de paquete. La importación de hortalizas deshidratas entre 1994 y 2000 estuvo en un rango de 100 a 350 ton·año-1, siendo las empresas más grandes las principales importadoras debido a la mala calidad, altos precios y falta de abastecimiento en ciertas épocas del año (Rivera y Sánchez, 2001). Una forma conveniente para tomar un segmento del mercado sería incursionando en la sustitución de las importaciones mediante productos de mejor calidad, con precios competitivos y cumpliendo el suministro constante durante todo el año.
La concentración de alimentos mediante la inmersión del producto en una solución hipertónica (por ejemplo con azúcar, sal o sorbitol) se conoce como deshidratación osmótica (DO). La ósmosis consiste en el movimiento molecular de ciertos componentes de una solución a través de una membrana semipermeable hacia otra solución de menor concentración (Ibarz y Barbosa-Canovas, 2005). En la industria de alimentos se utiliza porque ayuda a reducir la actividad acuosa del producto, sin embargo, el alimento debe ser sometido a algún proceso adicional, como secado, liofilización, congelación, para que pueda ser comercialmente estable. La aplicación de esta tecnología permite aumentar la eficiencia energética, mejorar la calidad y la estabilidad del producto (Ramaswamy y Marcotte, 2006; Rahman y Perera, 1999). Para el caso de algunos vegetales y cárnicos, el cloruro de sodio (NaCl) es un excelente agente osmótico debido a su alta capacidad para reducir la actividad de agua, pero es práctico utilizarlo en pequeñas concentraciones (0,5 a 10% de la solución) y mezclado con azúcar (Ramaswamy y Marcotte, 2006; Sharma, Mulvaney y Rizvi, 2000).
Las investigaciones en perejil deshidratado han apuntado a verificar el efecto de diferentes variables de operación en las propiedades del producto final y su relación con la eficiencia del proceso. Berset y Caniaux (1983) relacionaron la prueba de colorimetría con la calidad del perejil deshidratado e indicaron que las muestras que tuvieron una relación alta de clorofila a/clorofila b conservan más su color original. La clorofila a, principal pigmento verde, es menos estable que la b, lo que produce una mayor velocidad de degradación. Díaz-Maroto, Pérez-Coello y Cabezudo (2002) evaluaron el efecto del secado a temperatura ambiente, por convección a 45 ºC y liofilización en los componentes volátiles de perejil y reportaron que las menores alteraciones en los compuestos volátiles se obtuvieron con el secado a temperatura ambiente. Los compuestos que ejercen la mayor contribución en las características del aroma del perejil son el p-metha-1,3,8-trieno y el apiol.
La aplicación de modelos matemáticos para el secado de hojas de perejil en un secador convectivo a diferentes condiciones de proceso fue desarrollado por Akpinar, Bicer y Cetinkaya (2006), cuyos resultados mostraron que no existe un periodo de velocidad constante en la curva de secado, llevándose a cabo el secado completamente en el periodo de velocidad decreciente. Doymaz, Tugrul y Pala (2006) evaluaron el efecto de la temperatura del aire en los tiempos de secado y el color del perejil y el hinojo, encontrando que los tiempos de secado disminuyen con el aumento en la temperatura, además, el proceso de secado se realiza en el periodo de velocidad decreciente. Las muestras deshidratadas a 60 ºC tuvieron un color con altos valores de luminosidad (L) y bajos valores de la razón a/b, lo que se busca en este tipo de productos.
Fatouh et al. (2006) investigaron el efecto de la superficie de carga, la velocidad y temperatura del aire, y el tamaño de producto en las características del perejil, malva y menta deshidratados. Los autores afirmaron que los tiempos de secado se incrementan cuando se aumenta la superficie de carga, o se disminuye la temperatura y la velocidad del aire, las muestras sin pedúnculo tienen menores tiempos de secado y consumo de energía específica. La máxima productividad de secado se obtuvo con una superficie de carga de 28 kg•m-2, una velocidad de secado de 2,7 m•s-1 y una temperatura de 55 ºC. Soysal, Öztekin y Eren (2006) evaluaron el efecto del material de carga en la eficiencia del secado con microondas (900 W, 2450 MHz) de perejil, mencionando que el secado se realiza principalmente en el periodo de velocidad decreciente.
A pesar de las investigaciones mostradas anteriormente, no se ha expresado la utilización de osmodeshidratación como pretratamiento en la obtención de productos deshidratados de perejil. Por esta razón, el objetivo de este trabajo fue aplicar diferentes técnicas de deshidratación (secado con aire caliente, secado con aire caliente + deshidratación osmótica, y secado con aire caliente + deshidratación osmótica al vacío) sobre el perejil fresco y observar el efecto de estas técnicas en las propiedades físicas, químicas y nutricionales del producto seco.
MATERIALES Y MÉTODOS
Materiales. El perejil se adquirió en la finca “La Conejera” ubicada en la localidad de Suba en la Sabana de Bogotá. La temperatura promedio de la zona se encuentra entre los 10 y 14 °C y la humedad relativa es de 82%. Fueron utilizados 5 kg de azúcar (Riopaila®) y 1 kg de sal (Refisal®) obtenidos en el mercado local.
Procedimiento. El perejil utilizado para este trabajo se transportó hasta las instalaciones de la Universidad Jorge Tadeo Lozano en bolsas de plástico a temperatura ambiente. Las hojas eran separadas de las ramas y posteriormente lavadas y desinfectadas con hipoclorito de sodio en una concentración de 150 ppm. Después, dependiendo del tipo de tratamiento, las hojas eran sumergidas en la solución osmodeshidratante con o sin vacío por un espacio de 4 h sin agitación. La deshidratación osmótica se llevó a cabo en frascos de vidrio de 3 L en el caso de la deshidratación al ambiente, y en un desecador adaptado con una bomba (RF3052, Siemens®, Alemania) con una aplicación de 23’’. Hg durante 5 min cada 30 min en el caso de la deshidratación osmótica al vacío, a una temperatura de 18 °C usando una razón producto/solución de 1/20 (p/p) de acuerdo a lo sugerido por Sharma, Mulvaney y Rizvi (2000). El medio osmótico utilizado fue una solución acuosa de azúcar y sal comercial.
Finalmente, las hojas se deshidrataron utilizando un secador de aire caliente a temperaturas de 50 y 60 °C, recomendadas por Doymaz, Tugrul y Pala (2006) para evitar daños en sus propiedades. El producto seco fue almacenado en frascos de vidrio, herméticos y protegidos de la luz. Los siguientes fueron los parámetros de operación del secador:
- Velocidad del aire (2,3 m•s-1), que depende de la configuración del equipo y su ventilador.
- Flujo de aire (0,145 kg·m3) debido a las características del equipo.
- Espesor del producto (0,01 m) debido a la cantidad de producto y la densidad del mismo.
- Área de secado (0,0715 m2), correspondiente al área de las bandejas.
Métodos
Caracterización de materia prima. Se determinó el contenido de proteína, grasa, humedad, cenizas y fibra (AOAC, 1998).
Curvas de secado. Las curvas de secado se realizaron registrando la pérdida de peso de la muestra durante el tiempo de proceso, mediante un sistema de adquisición de datos acoplado al secador. Los pesos obtenidos se convierten en términos de humedad libre empleando las ecuaciones (1) y (2) (Geankoplis, 1993).
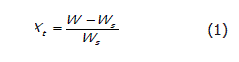
Donde W es el peso del sólido húmedo (kg totales de agua más sólido seco), Ws es el peso del sólido seco (kg sólido seco), y Xt es la relación entre el peso del agua y el peso del sólido seco a un determinado tiempo (kg de agua/kg de sólido seco). Posteriormente, se calcula la humedad libre por medio del contenido de humedad en equilibrio para cada valor de Xt (Ecuación 2).
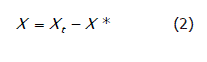
Donde X* es la humedad en equilibrio (kg de agua en equilibrio / kg de sólido seco), X es el contenido de humedad libre (kg de agua libre/kg de sólido seco) para cada valor de Xt.
Solución osmótica. Una cantidad establecida de perejil fue introducida en tres soluciones osmóticas de diferentes concentraciones. Las concentraciones usadas fueron (p/p) 40/10, 30/5 y 20/5 (azúcar/sal). Se dejaron las hojas de perejil por un espacio de 4 h y se determinó el contenido de humedad de las hojas después del pretratamiento. Posteriormente, cada muestra se sometió a secado con aire caliente a una temperatura de 60 ºC.
Actividad de agua (Aw). El equipo que mide actividad acuosa (Model ms1 Set aw, Novasina AG, Suiza) se calibró mediante el uso de diluciones saturadas de sales de actividad de agua conocidas.
Carotenos. Los carotenos del perejil se extrajeron por medio de la acción de un solvente, mezcla de éter de petróleo-acetona (1:1 v/v). El extracto se pasó por una columna cromatográfica que contenía fosfato tricálcico, el cual permitió el paso de los carotenoides, pero retuvo otras sustancias (Bernal, 1998). La absorbancia de la muestra obtenida se determinó en un espectrofotómetro (Modelo 6505, Jenway, Bibby Scientific, Inglaterra) a una longitud de onda de 450 nm, e interpolando en una curva de calibración previamente realizada (Adrian et al., 2000).
Vitamina C. La extracción del ácido ascórbico de las muestras de perejil se realizó con ácido oxálico (0,15% p/v) de acuerdo con la metodología propuesta por Bernal (1998). Se empleó el espectrofotómetro descrito anteriormente a una longitud de onda de 540 nm. La cantidad de vitamina C se determinó tomando en cuenta una curva de calibración previamente realizada (Alibas, Akbudat y Akbudat, 2007).
Color. El color de las muestras se midió en un colorímetro (Modelo CR400, Konica, Minolta, Osaka, Japón). El instrumento fue calibrado con un patrón blanco. El sistema utilizado para medir el color tiene en cuenta tres parámetros: Luminosidad (L*), saturación (C*) y matiz (h*). Posteriormente, se compararon las muestras frescas, con las muestras sometidas a los diferentes tratamientos de secado (Soysal, 2004).
Densidad del producto deshidratado. Una muestra cuidadosamente pesada se transfirió a un picnómetro. Luego, éste se llenó con tolueno hasta que el nivel del solvente estuvo por encima de la ranura del picnómetro. La parte exterior del picnómetro fue secada, y se determinó el peso de éste con el solvente y la muestra. El volumen de la muestra se calculó mediante la ecuación (3).
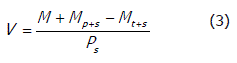
Donde Mt+s es el peso del picnómetro más la muestra y el solvente, Mp+s es el peso del picnómetro más el solvente, Ps es la densidad del solvente, M es el peso de la muestra y V es el volumen ocupado por la muestra. La razón de estas dos últimas variables es la densidad del producto (Yan, Sousa-Gallagher y Oliveira, 2008).
Rehidratación del producto deshidratado. El comportamiento de los alimentos deshidratados en su rehidratación es un indicativo de su capacidad ra absorber agua y adquirir un estado próximo al producto original (Ramaswamy y Marcotte, 2006). La rehidratación del perejil se realizó con 5 g de muestra en un tamiz plástico, el cual se sumergió en recipientes con 1 L de agua destilada durante diferentes periodos de tiempo (5, 10, 15, 20, 25 y 30 min) y se registró el peso después de cada rehidratación. El desempeño de la rehidratación se evaluó mediante el coeficiente de rehidratación (RC) definida por Meda y Ratti (2005).
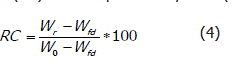
Donde Wr es el peso de la muestra después de la rehidratación, Wfd el peso de la muestra seca, W0 es el peso inicial de la muestra sin ningún proceso.
Diseño experimental y análisis estadístico. La caracterización fisicoquímica del perejil fresco se realizó con análisis de varianza de una sola vía. Adicionalmente se utilizó un diseño experimental factorial aleatorizado de 3*2. El total de tratamientos realizados en la experimentación fueron 18, incluyendo 3 repeticiones. Los datos fueron analizados mediante Statgraphics Plus 5.1 utilizando análisis de varianza a un nivel de significancia del 5% y una prueba de la mínima diferencia significativa (MDS).
RESULTADOS Y DISCUSION
Caracterización fisicoquímica del perejil fresco. En la Tabla 1 se muestra la caracterización fisicoquímica de las ramas y las hojas del perejil, donde se observa que existe diferencia en la composición química de las diferentes muestras, puesto que los tejidos vivos de las plantas están metabólicamente activos y experimentan continuos cambios en su composición (Haard y Chism, 1996). Akpinar, Bicer y Cetinkaya (2006) establecieron que la humedad promedio de las hojas de perejil fue de 84%, siendo superior en este trabajo tanto en las hojas (88%) como en las ramas (89%), debido posiblemente al lugar donde se cultivó el perejil y a la época del año en la que se cosechó, ya que fue una temporada altamente lluviosa. Los valores de actividad acuosa (Aw), difieren entre las ramas y las hojas, a pesar que su contenido de humedad es muy similar. Esta diferencia se explica debido a que la estructura y los componentes del alimento hacen disminuir el agua libre disponible y su presión de vapor. El valor de esta presión depende de la cantidad de agua presente, de la temperatura, de la composición y de la estructura del alimento (Barbosa-Canovas y Vega-Mercado, 1996).
Tabla 1. Caracterización fisicoquímica del perejil.
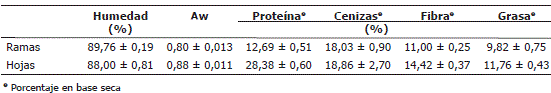
Las proteínas en los vegetales siempre desempeñan papeles importantes como constituyentes estructurales de las membranas celulares y/o biocatalizadores. En las plantas, las proteínas se acumulan en forma significativa constituyendo proteínas de almacenamiento, las cuales actúan disminuyendo la presión osmótica del total de aminoácidos, se unen al amoniaco para mantener la acidez in situ, o sirven como escudos macromoleculares protegiendo a otras sustancias de las acciones enzimáticas (Haard y Chism, 1996). De acuerdo con la Tabla 1, se observa una mayor proporción de proteínas en las hojas (28%) que en las ramas (12%).
El contenido mineral, expresado en porcentaje de cenizas, no varía de manera apreciable en las dos estructuras estudiadas. Las hortalizas aportan numerosos iones minerales necesarios para el mantenimiento de la salud. La cantidad de minerales de las partes comestibles de las hortalizas se afectan por la fertilidad del suelo, la genética de la planta y el medio en el que crece. Los minerales más abundantes en los vegetales son potasio, calcio, magnesio, hierro, fósforo, azufre y nitrógeno. En el perejil, el elemento más significativo es el potasio (Tirilly y Bourgeois, 2001).
Las hortalizas, como el perejil, son ricas en fibra, además es importante señalar que en el perejil de este trabajo se encontró un mayor contenido de fibra en las hojas que en las ramas. Los principales componentes de la fibra son las celulosas, hemicelulosas, lignina y las pectinas (Tirilly y Bourgeois, 2001). El contenido de grasa fue levemente mayor en las hojas que en las ramas. Uno de los compuestos más importantes que se extraen del perejil es el aceite esencial de olor característico, constituido por el apiol. Los carotenoides también se encuentran en cantidades considerables en la fracción lipídica de los vegetales (Haard y Chism, 1996).
Solución osmodeshidratante. La concentración de la solución osmodeshidratante seleccionada para aplicarla en la experimentación tuvo una proporción de 20/5 (p/p) (azúcar/sal), puesto que con ésta se logró una mayor disminución de la humedad en los dos pretratamientos (osmodeshidratación y osmodeshidratación al vacío) y un menor tiempo para alcanzar la humedad en equilibrio en las pruebas preliminares de secado con aire caliente.
Curvas de secado. En la Figura 1 se presenta el cambio de la humedad con respecto al tiempo de las hojas de perejil a 50 °C y 60 °C con cada uno de los pretratamientos. Durante la primera hora, en todos los procesos de secado se observó una disminución significativa de la humedad, en unos casos incluso por debajo de la mitad del valor de la humedad libre inicial del sólido. Lo anterior se debe a que inicialmente la superficie de las hojas de perejil esta muy húmeda y sobre ella hay una película de agua continua. Dicha capa esta constituida por agua libre y actúa como si el sólido no estuviera presente, es decir, no existe una resistencia a la transferencia de masa del vapor por parte del producto (Geankoplis, 1993; Rahman y Perera, 1999).
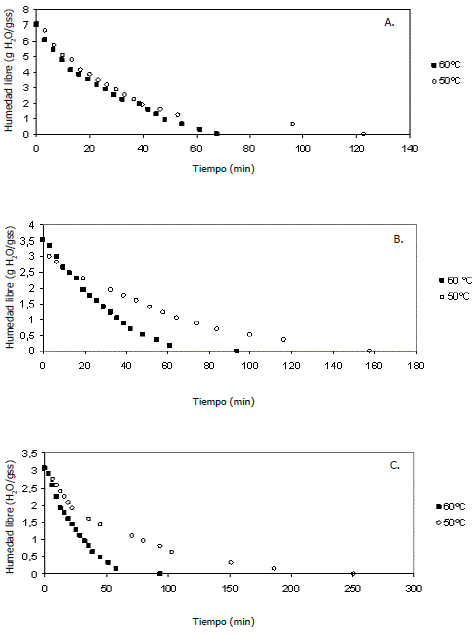
Figura 1. Curvas de secado del perejil a 50 y 60 °C. A. Sin pretratamiento. B. Osmodeshidratadas a presión atmosférica. C. Osmodeshidratadas al vacío.
Al comparar con los resultados de Doymaz, Tugrul y Pala (2006), se puede confirmar que la perdida de humedad en las hojas de perejil depende tanto de la velocidad como de la temperatura del aire. Así, a medida que la temperatura del aire aumenta, la remoción de la humedad es mayor, con un consecuente decrecimiento en el tiempo de secado.
La Figura 1 A muestra el cambio de la humedad libre a través del tiempo de las hojas de perejil sin pretratamiento. Se observa que las hojas tenían una humedad libre inicial de 7 g H2O/g sólidos secos (s.s.), y al ser sometidas a una temperatura de 60 °C, el tiempo para alcanzar la humedad en equilibrio fue de 68 min, mientras que a una temperatura de 50 °C fue de 123 min. Esto se debe a que a la temperatura de 60 °C la evaporación del agua es más alta.
En la Figura 1 B se observa el cambio de humedad libre de las hojas de perejil osmodeshidratadas a presión atmosférica, y secadas a 50 °C y 60 °C. La humedad libre inicial de las muestras osmodeshidratadas previa al proceso de secado fue de 3,5 g H2O/g s.s., la mitad de la humedad libre de las muestras sin pretratamiento. Por esta razón, se esperaba que el tiempo total de secado de las muestras osmodeshidratadas a las temperaturas de proceso fuera menor, pero por el contrario, para llegar a la humedad de equilibrio las hojas de perejil osmodeshidratadas tardaron 93 y 158 min para 60 °C y 50ºC, respectivamente. Esto ocurre posiblemente porque en la deshidratación osmótica el material se contrajo y además, se formó una capa no muy permeable a la humedad que rodea la mayor parte del producto, produciendo una barrera e impidiendo una fácil evacuación de la humedad desde el interior (Rahman y Perera, 1999).
La Figura 1 C muestra el comportamiento de la humedad libre de las hojas osmodeshidratadas a vacío durante el secado con aire caliente. La humedad libre inicial presente en las hojas fue de 3 g H2O/g s.s., debido a que aplicando osmodeshidratación a vacío se redujo el contenido de humedad de 88% a 76%. Esta reducción de la humedad fue mayor que la obtenida con la osmodeshidratación a presión atmosférica, ya que con el vacío se intensifica el flujo capilar, y se incrementa la transferencia de agua, pero sin ninguna influencia en la captación de sólidos (Rahman y Perera, 1999). El tiempo en alcanzar la humedad de equilibrio fue de 98 y 251 min para 60 °C y 50 °C, respectivamente. El tiempo de proceso durante el secado fue alto debido posiblemente a un mayor espesor en la formación de la costra, la cual afecta directamente la velocidad de secado.
Contenido de humedad y actividad de agua. En la Tabla 2 se muestra el contenido de humedad y la actividad acuosa de las hojas de perejil sometidas a los diferentes tratamientos de secado. La humedad en equilibrio se refiere al contenido de humedad de una sustancia que esta en equilibrio con una presión parcial de vapor específica, es decir es la humedad que ya no puede ser retirada del producto. En el proceso de secado se pretende disminuir la humedad del producto a valores por debajo de 10% para no permitir el crecimiento de bacterias y hongos y retrasar lo más posible el desarrollo de ácaros e insectos en el producto (Barbosa- Canovas y Vega- Mercado, 1996).
Tabla 2. Contenido de humedad y actividad acuosa de las hojas perejil secas después de aplicar los diferentes tratamientos de secado.
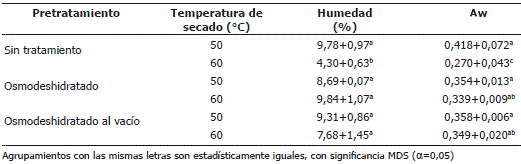
En el caso de las hojas de perejil se obtuvo una humedad final para todos los tratamientos inferior al 10%. No existe diferencia significativa ni entre pretratamientos ni entre temperaturas de secado, con excepción de las muestras sin pretratamiento y secadas a 60 °C, las cuales presentaron el menor contenido de humedad (4,3%). La relación de la humedad y la actividad acuosa (Aw) es directamente proporcional. Para los resultados de Aw, no existe diferencia significativa entre pretratamientos, pero si entre temperaturas de secado, siendo mayor a 50 ºC que a 60 ºC. La mayor reducción de la actividad acuosa fue para las muestras sin pretratamiento y con una temperatura de secado de 60 °C. En todos los procesos de secado, el valor de la actividad acuosa varió entre 0,27 y 0,42, rango en el cual el agua se encuentra ligada moderadamente y se caracteriza por su disponibilidad como disolvente para solutos de bajo peso molecular y para algunas reacciones bioquímicas (Barbosa-Canovas y Vega-Mercado, 1996).
Contenido de vitamina C y carotenos en el perejil. Las vitaminas comprenden un grupo diverso de compuestos orgánicos que son, desde el punto de vista nutritivo, micronutrientes esenciales. El ácido ascórbico o vitamina C, es un compuesto con propiedades ácidas y reductoras, muy polar y, por tanto muy soluble en disoluciones acuosas e insoluble en disolventes apolares. En los alimentos, el ácido ascórbico actúa como nutriente esencial, además inhibe el pardeamiento enzimático, protege los compuestos oxidables mediante efectos reductores y secuestro de radicales libres y de oxígeno (Gregory, 1996).
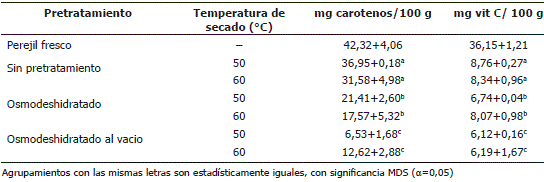
En la Tabla 3 se presentan los resultados del contenido de vitamina C y carotenos en la muestra de perejil seco y deshidratado con diferentes técnicas. El perejil fresco tiene una cantidad alta de vitamina C (36,15 mg/ 100 g) y carotenos (42,32 mg/ 100 g). Hay diferencia significativa entre los tratamientos más no entre las temperaturas de secado consideradas. Las temperaturas utilizadas en este estudio generaron valores similares de vitamina C, aunque en ambas se degrada dicha vitamina debido a su termosensibilidad. En cuanto a los pretratamientos, se observa que las muestras sin pretratamiento tuvieron un mayor contenido de vitamina C, en contraste con las osmodeshidratadas tanto a presión atmosférica como a vacío. Esto se debe posiblemente a que la vitamina C es soluble en agua y parte de la vitamina se disolvió en la solución osmodeshidratante compuesta en su mayoría por agua. Además, las hojas estuvieron en la solución por un espacio de 4 h. Shigematsu et al. (2005) señalan que la pérdida de agua en un proceso de osmodeshidratación ocurre principalmente en las dos primeras horas, perdiéndose también cantidades importantes de vitamina C en el residuo de la solución. La vitamina C se mantiene disuelta hasta que el contenido en agua del alimento es muy bajo pero a medida que el proceso de deshidratación progresa, ésta reacciona con los solutos a mayor velocidad (Gregory, 1996; Shigematsu et al., 2005).
Tabla 3. Contenido de vitamina C y carotenos del perejil fresco y el deshidratado con los diferentes tratamientos de secado.
En las plantas, los carotenos de los cloroplastos están a menudo enmascarados por los pigmentos de la clorofila más dominantes. El papel más importante de los carotenos en la dieta humana es su capacidad para funcionar como precursores de la vitamina A. Aunque existen varios carotenos, el que posee mayor actividad de provitamina A es el b-caroteno. En el perejil, según Benamotz y Fishler (1998) el caroteno que se encuentra en una mayor proporción es el 9–cis–b-caroteno, pero su color está enmascarado por el verde de la clorofila. En general, las mayores concentraciones de carotenos existen en aquellos tejidos con mayores cantidades de clorofilas. Cada molécula de b-caroteno produce dos moléculas de vitamina A, aunque la ineficacia del proceso explica el hecho que el b-caroteno exhiba sólo alrededor del 50% de actividad de vitamina A.
Al observar la Tabla 3 se puede decir que la cantidad de carotenos disminuye en todos los procesos estudiados. Existen diferencias significativas entre pretratamientos pero no en las temperaturas de secado estudiadas. En general las muestras secadas sin pretratamiento fueron las que tuvieron mayor valor de carotenos (32 a 37 mg/100 g de muestra). La mayor pérdida en carotenos la sufrió la muestra osmodeshidratada al vacío y sometida a temperatura de secado a 50 °C, debido al tiempo de exposición de las hojas para alcanzar la humedad en equilibrio. Los carotenos son compuestos lipófilos, por lo tanto su pérdida no se asocia con la solubilización de éste en el agua. Sin embargo, los metales pesados, que actúan como catalizadores de reacciones de oxidación de nutrientes insaturados como el caroteno, están disueltos en la fase acuosa del alimento y a medida que el agua se elimina, la reactividad de los metales aumenta y las reacciones de oxidación (principales en los carotenos) se aceleran. Una de las reacciones, es la catalizada por la lipooxigenasa, que acelera la degradación oxidativa de los carotenos, por un mecanismo indirecto. La lipooxigenasa cataliza primero la oxidación de los ácidos grasos insaturados para producir peróxidos y éstos a su vez reaccionan fácilmente con los carotenos (von Elbe y Schwartz, 1996).
A pesar de que no se realizó una evaluación sensorial, es importante señalar que se percibió en forma subjetiva un cambio en el aroma característico del producto deshidratado. Esto ocurre porque el calor provoca la perdida de algunos componentes volátiles del alimento, debido a la oxidación de los pigmentos, vitaminas, lípidos y a la reacción de Maillard. Los factores que afectan la aparición de sustancias volátiles son la temperatura del aire de secado y el contenido de humedad. La exposición del b - caroteno a altas temperaturas puede generar productos de bajo peso molecular, los cuales influyen en el aroma del producto deshidratado por los volátiles resultantes (Rahman y Perera, 1999).
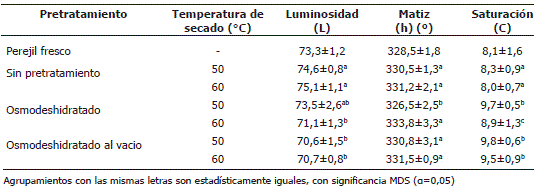
Color. El color es un fenómeno de percepción que depende del observador y las condiciones en la cuales se observa un material. El color de un alimento se vuelve visible cuando la luz de una fuente luminosa choca con su superficie. La medición del color en este trabajo se realizó físicamente por la interacción de la luz (Sahin y Gulum Sumnu, 2006). Existen diferencias significativas entre pretratamientos para los parámetros de luminosidad y saturación, mientras que no hay diferencias significativas para el matiz, con excepción de las muestras osmodeshidratadas y secadas a 50 °C. En los procesos de deshidratación hay cambios y pérdidas de color, ya que se cambian las características de la superficie del alimento y por tanto su color y reflectancia. Asimismo, el pardeamiento enzimático, que se origina por la polifenol oxidasa, provoca un oscurecimiento rápido principalmente en la parte externa de las hojas. Otra de las razones por la cual se presenta un cambio de coloración es la foto-oxidación de los pigmentos por acción de la luz, que en combinación con el oxígeno, produce una grave decoloración, cuanto más largo el proceso de deshidratación y más elevada la temperatura mayores son las perdidas en los pigmentos. El pigmento principal que se altera en el secado con aire caliente es la clorofila, formándose la feofitina que es de un color pardo oliva (Rahman y Perera, 1999; Lee y Schwartz, 2006).
Al observar la Tabla 4, se puede afirmar que los productos sin pretratamiento presentan un valor de luminosidad más alto (74,6-75,1) que el perejil fresco, en contraste con los productos osmodeshidratados tanto a presión atmosférica como a vacío que presentan un valor más bajo (70,6-73,5), esto puede deberse a la formación de la corteza de jarabe, y también a la reacción de caramelización de la sacarosa que queda en las hojas después del proceso de deshidratación osmótica (BeMiller y Whistler, 1996). Los valores de matiz o tono se encuentran entre 326,5° y 333,8°, lo que indica que el color predominante es el verde. En cuanto al grado de saturación se puede afirmar que el color es más intenso en los procesos que combinan la osmodeshidratación que el secado con aire caliente sin pretratamiento.
Tabla 4. Parámetros de color para el perejil fresco y el deshidratado con los diferentes tratamientos de secado.
Densidad del producto deshidratado. En la Figura 2 se muestran los valores de densidad para el perejil deshidratado de los diferentes tratamientos. No existe diferencia significativa entre pretratamientos y tampoco entre temperaturas de secado teniendo en cuenta el análisis estadístico. A pesar de esto, se puede observar que los productos sometidos a un proceso de secado a 60 °C sin pretratamiento y a 50 °C con osmodeshidratación a presión atmosférica fueron los que presentaron una menor densidad con un resultado de 1,10 y 1,07 g•mL-1, respectivamente. Las demás muestras mostraron densidades con valores muy similares (1,38- 1,48 g•mL-1). La densidad en los productos deshidratados esta definida como la masa de las partículas entre el volumen de éstas, teniendo en cuenta la presencia de poros. Las densidades de las hortalizas frescas en general se encuentran entre 0,80- 1,09 g•mL-1, y la de las hojas deshidratadas tienen un rango entre 1,07 y 1,43 g•mL-1. (Sahin y Gulum Sumnu, 2006; Yan, Sousa-Gallagher y Oliveira, 2008).
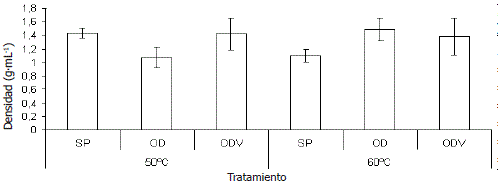
Figura 2. Densidad de las hojas de perejil deshidratado a 50 y 60 °C con los diferentes pretratamientos (SP: Sin pretratamiento, OD: Deshidratación osmótica a presión atmosférica, ODV: Deshidratación osmótica a vacío).
Rehidratación del producto deshidratado. En la Figura 3 se presenta el comportamiento del coeficiente de rehidratación (RC) de las hojas de perejil deshidratadas aplicando los diferentes pretratamientos estudiados. Para todos los tratamientos el comportamiento del coeficiente de rehidratación de equilibrio estuvo entre 40% y 60%, a excepción de las hojas sin pretratamiento deshidratadas a una temperatura de 50 ºC. La rehidratación no es el proceso inverso de la deshidratación, puesto que ésta provoca la pérdida de la presión osmótica celular, cambios en la permeabilidad de la membrana celular, micración de solutos, cristalización de polisacáridos y coagulación de proteínas celulares que contribuyen a que se modifique su textura y estructura, además parte de las sustancias volátiles se pierden de forma irreversible. Las muestras sometidas a una temperatura de secado de 60 ºC con los diferentes pretratamientos presentaron un mayor valor de RC en comparación con las de 50 ºC, debido probablemente a que las hojas deshidratadas tienen una mayor porosidad por los menores tiempos de proceso a mayores temperaturas de secado.
Prothon et al. (2001) afirmaron que la rehidratación es mayor en los productos secados con aire caliente sin pretratamiento debido a que las muestras osmodeshidratadas y sometidas a secado presentan una menor porosidad. Sin embargo, en los resultados obtenidos (Figura 3) se observa lo contrario, posiblemente por la formación de la costra en la superficie del perejil seco aplicando deshidratación osmótica como pretratamiento, lo que disminuye las posibilidades de contracción.
CONCLUSIONES
El proceso de secado de las hojas de perejil a una temperatura de 60 °C sin pretratamiento fue el más adecuado porque presentó el menor tiempo de secado para alcanzar la humedad de equilibrio (68 min), la menor actividad de agua (0,27) y contenido de humedad (4,3%), y un menor efecto en la disminución del contenido de vitamina C (8,7 mg de vitamina C/100 g de perejil) y carotenos (36,9 mg de carotenos/100 g de perejil). El secado del perejil con los diferentes pretratamientos presentó un mayor tiempo de proceso debido a la dificultad de la difusión del vapor por la formación de una capa de jarabe en la superficie de las hojas. La concentración de la solución hipertónica utilizada en los pretratamientos de deshidratación osmótica a presión atmosférica y a vacío tuvo una relación de 20/5 (p/p) de azúcar/sal, porque en las pruebas preliminares retiró la mayor cantidad de humedad con los menores tiempos de secado. Las muestras con pretratamiento tuvieron un cambio de color más oscuro debido a la caramelización del jarabe que permaneció en la superficie de las hojas.
Entre las recomendaciones más sobresalientes se sugiere realizar un análisis sensorial de las muestras deshidratadas para establecer el efecto del pretratamiento en su aroma y sabor. La porosidad del producto deshidratado debería medirse porque es una propiedad de monitoreo del secado que influye en el grado de rehidratación de las muestras y en su densidad. Las condiciones de proceso (concentración de solutos, tiempo de proceso, agitación, temperatura, entre otros) en la osmodeshidratación deberían estudiarse con mayor profundidad para determinar si es posible obtener un producto seco con características apropiadas. Además, se recomienda estudiar un rango de temperaturas de secado más amplio para establecer criterios más confiables en la determinación de la temperatura apropiada de secado del perejil.
AGRADECIMIENTOS
Los autores agradecen la financiación proporcionada por la Universidad Jorge Tadeo Lozano con el proyecto No. 103-03-2007.
BIBLIOGRAFÍA
Adrián, J, J. Potus, A. Poiffait and P. Dauvillier. 2000. Análisis nutricional de los alimentos. Acribia, Zaragoza, España. p. 240-247. [ Links ]
Akpinar, K., Y. Bicer and F. Cetinkaya. 2006. Modelling of thin layer driying of parsley leaves in a convective dryer and under open sun. Journal of Food Engineering 75(3): 308- 315. [ Links ]
Alibas, O.; B. Akbudat and N. Akbudat. 2007. Microwave drying characteristics of spinach. Journal of Food Engineering 78(2): 577-583. [ Links ]
Association of Official Analytical Chemists (AOAC). 1998. Official methods of analysis. AOAC, Washington. [ Links ]
Athar, N., T.W. Spriggs and P. Liu. 1999. The concise New Zealand food composition tables, 4th Ed. New Zealand Institute for Crop and Food Research, Palmerston North, New Zealand. [ Links ]
Barbosa-Cánovas, G.V. and H. Vega-Mercado. 1996. Dehydration of foods. Chapman & Hall, New York, NY. 330 p. [ Links ]
Benamotz, A. and R. Fishler. 1998. Analysis of carotenoides with emphasis in 9-cis-b-carotene in vegetables and fruits commonly consumed in Israel. Food Chemistry 62(4): 515-520. [ Links ]
Bernal, I. 1998. Análisis de alimentos. 3a Ed. Editorial Guadalupe, Bogotá, Colombia. 314 p. [ Links ]
BeMiller, J.N. and R.L. Whistler. 1996. Carbohydrates. pp. 157–224. In: Fennema, O.R. (ed.). Food chemistry. Marcel Dekker, New York, NY. 1067 p.
Berset, C. and P. Caniaux. 1983. Relationship between color evaluation and chlorophyllian pigment content in dried parsley leaves. Journal of Food Science 48(6): 1854-1857, 1877. [ Links ]
DANE-SISAC. 2002. Censo Hortícola. Sabana de Bogotá. Bogotá, Colombia. 29 p. [ Links ]
Díaz-Maroto, M.C., M.S. Pérez-Coello, and M.D. Cabezudo. 2002. Effect of different drying methods on the volatile components of parsley (Petroselinum crispum L.). European Food Research and Technology 215: 227-230. [ Links ]
Doymaz, I., N. Tugrul and M. Pala. 2006. Drying characteristics of dill and parsley leaves. Journal of Food Engineering 77(3): 559–565.
Fatouh, M., M.N. Metwally, A. B. Helali and M.H. Shedid. 2006. Herbs drying using a heat pump dryer. Energy Conversion and Management 47(15): 2629-2643. [ Links ]
Geankoplis, C.J. 1993. Transport processes and unit operations. Pentice Hall International, Englewood Cliffs, NJ. p. 579-634. [ Links ]
Gregory, J.F. 1996. Vitamins. p. 531-616. In: Fennema, O.R. (ed.). Food chemistry. Marcel Dekker, New York, NY. 1067 p. [ Links ]
Haard, N.F. and G.W. Chism. 1996. Characteristics of edible plant tissue. p. 943-1012. In: Fennema, O.R. (ed.). Food chemistry. Marcel Dekker, New Cork, NY. 1067 p. [ Links ]
Ibarz, A. y G.V. Barbosa-Canovas. 2005. Operaciones unitarias en la Ingeniería de Alimentos. Ediciones Mundi-Prensa, Madrid, España. p. 441-443. [ Links ]
Janick, J. 1986. Horticultural science. 4 ed. W.H Freeman and Co, San Francisco, CA. 746 p. [ Links ]
Lee, J.H. and S.J. Schwartz. 2006. Pigmensts in plant foods. p. 14.1-14.13. In: Hui, Y.J. (ed.). Handbook of science, technology and engineering. Taylor & Francis, Boca Raton, FL. 1000 p. [ Links ]
Maldonado, R. and E. Pacheco-Delahaye. 2003. Curvas de deshidratación de brócoli (Brassica oleraceae L var. Italica Plenk) y coliflor (Brassica oleraceae L var. Botrytis L). Revista Facultad de Agronomía 20(3): 306-319. [ Links ]
Meda, L. and C. Ratti, 2005. Rehydration of freeze-dried strawberries at varying temperatures. Journal of Food Process and Engineering 28(3): 233-246. [ Links ]
Prothon, F., L. Ahrne, T. Funebo, S. Kidman, M. Langton and I. Sjoholm. 2001. Effects of combined osmotic and microwave dehydration of apple on texture, microstructure and rehydration characteristics. Lebensmittel - Wissenschaft and Technologie 34(2): 95-101. [ Links ]
Rahman, M.S. and C.O. Perera. 1999. Drying and food preservation. p. 173-216. In: Rahman, M.S. (ed.). Handbook of food preservation. Marcel Dekker, New York, NY. 809 p. [ Links ]
Ramaswamy, H. and M. Marcotte. 2006. Food processing principles and applications. CRC Press, Taylor & Francis Group, Boca Raton, FL. p. 233-277. [ Links ]
Rivera-Vergara, C. y S.A. Sánchez-Berjan. 2001. Diseño de un modelo de tecnología apropiada para la deshidratación de espinacas. Trabajo de grado. Ingeniería Mecánica. Facultad de Ingeniería. Universidad Nacional de Colombia, Bogotá. 273 p. [ Links ]
Sahin, S. and S. Gulum Sumnu, 2006. Physical properties of foods. Springer Verlag, New York, NY. 257 p. [ Links ]
Sharma, S.K., S.J. Mulvaney and S.S.H. Rizvi. 2000. Food process engineering: Theory and laboratory experiments. John Wiley and Sons, New York. p. 205-217. [ Links ]
Shigematsu, E., N. Eik, M. Kimura and M. Mauro. 2005. Influência de prê- tratamentos sobre a desitratacao osmótica de carambolas. Ciência e Tecnología de los Alimentos 25(3): 536- 545. [ Links ]
Soysal, Y. 2004. Microwave drying characteristics of parsley. Biosystems Engineering 89(2):167-173. [ Links ]
Soysal, Y., S.O. Öztekin and Ö. Eren. 2006. Microwave drying of parsley theorical models for fluid bed drying of cut vegetables. Biosystems Engineering 93(4): 403-413. [ Links ]
Tirilly, Y. and C.M. Bourgeois. 2001. Tecnología de las hortalizas. Acribia, Zaragoza, España. 591 p. [ Links ]
Von Elbe, J.H. and S.J. Schwartz.1996. Colorants. p. 651-722. In: Fennema, O.R. (ed.). Food chemistry. Marcel Dekker, New York, NY. 1067 p. [ Links ]
Yan, Z., M. Sousa-Gallagher and F. Oliveira. 2008. Shrinkage and porosity of banana, pineapple and mango slices during air drying. Journal of Food Engineering 84(3): 430-440. [ Links ]














