Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.64 no.2 Medellín July/Dec. 2011
Crecimiento de Plantas de Remolacha (Beta vulgaris L. var. Crosby Egipcia) Bajo Coberturas de Color
Growth of Beet (Beta vulgaris L. var. Crosby Egipcia) under Colored Covers
Fánor Casierra-Posada1 y José Rogelio Pinto-Correa2
1 Profesor Asociado. Universidad Pedagógica y Tecnológica de Colombia - Facultad de Ciencias Agropecuarias. A.A. 661, Tunja, Boyacá, Colombia. <fanor.casierra@uptc.edu.co>
2 Ingeniero Agrónomo. Universidad Pedagógica y Tecnológica de Colombia - Facultad de Ciencias Agropecuarias. A.A. 661, Tunja, Boyacá, Colombia. <joserogeliop@hotmail.com>
Recibido: Enero 26 de 2011; aceptado: Septiembre 07 de 2011.
Resumen. La respuesta de las plantas a diferente color en la iluminación, se atribuye a fotorreceptores que conducen a diversas expresiones fenotípicas en diferentes niveles y etapas del desarrollo vegetal. Para determinar si el color de iluminación en que se cultivan las plantas de remolacha (Beta vulgaris L. var. Crosby Egipcia), afecta su crecimiento, rendimiento y calidad, se realizó en Duitama -; Colombia, un estudio bajo coberturas de color azul, rojo o transparente. Para conseguir los colores se colocaron películas de polietileno, 65 cm por encima del cultivo, dejando un control a plena exposición. Las plantas cubiertas con la película roja presentaron mejor calidad de raíz basada en el diámetro, sólidos solubles totales y peso fresco y seco en comparación con las que crecieron bajo cobertura azul, transparente o los controles. Las plantas bajo la cobertura roja mostraron valores mayores de área foliar y peso seco total. Los valores más bajos se presentaron en plantas bajo la cubierta azul. La radiación monocromática inducida por las coberturas alteró también la distribución de materia seca en los órganos de la planta. La calidad de la luz alteró el crecimiento y la calidad del producto a cosechar en remolacha, por los efectos sobre los fotorreceptores que alteran los patrones de crecimiento.
Palabras clave: Fotomorfogénesis, área foliar, sólidos solubles totales, efecto Emerson.
Abstract. Plant responses to different colors of illumination are attributed to different photoreceptors which operate as light-induced initiators of signalling pathways leading to varying phenotypic expressions at various levels and stages of plant development. To determine whether the color of illumination under which plants are grown, affects the growth, yield and the quality of harvested product, beet plants (Beta vulgaris L. var. Crosby Egipcia) were grown under either blue-enriched, red-enriched, or transparent covers in Duitama -Colombia. To get colors, red, blue and transparent polyethylene films were expanded 65 cm above crop, leaving an uncovered control. A basic growth analysis was done and the quality of harvested roots was measured. Red film covered plants showed better root quality based on diameter, total soluble solids and fresh and dry weight when compared to those growing under blue, transparent covers or controls. Similar results were found with the growth analysis, plants under the red cover showed higher values of absolute and relative growth rate, leaf area and total dry weight. The lowest obtained values for growth parameters in plants were presented under the blue cover. Monochromatic covers altered too the dry matter distribution in plant organs. Light quality alters growth and product quality of beet plants by the effects on the photoreceptors causing altered growth patterns.
Key words: Photomorphogenesis, leaf area, total soluble solids, Emerson effect.
La remolacha (Beta vulgaris L.) es un vegetal cultivado en casi todo el mundo para el consumo en fresco como ensalada, por su contenido de azúcares, minerales y carotina, sustancias de suma importancia para la vitalidad del organismo humano en general. Las hojas tienen gran valor nutritivo, mayor que el de las grandes y suculentas raíces; las que se emplean en la alimentación humana, como forrajes y para la extracción de azúcar según las características de las distintas variedades y especies (Martínez et al., 2005). En el 2010 se cultivaron en Colombia 772 ha con un rendimiento de 19,6 ton ha-1. La mayor área sembrada se encontraba en Boyacá y Antioquia con una participación de 48,63 y 27,44% del área sembrada en el país en ese año (Agronet, 2011). Aunque este cultivo representa un renglón importante en el sector hortícola, se busca mediante la implementación de técnicas que aumenten el rendimiento de las plantas, incrementar su capacidad de competencia en mercados globalizados.
La luz, uno de los factores más importantes del entorno vegetal, no sólo es un sustrato energético, sino también un regulador de procesos fisiológicos en los vegetales (Alyabyev et al., 2002; Schaxov, 1993). Utilizando plantas de Arabidopsis, se han determinado tres tipos de receptores de la luz: el criptocromo 1, el criptocromo 2 y la fototropina, los cuales regulan primordialmente la inhibición del hipocótilo, el momento de la floración y el fototropismo, respectivamente (Lin, 2000). La luz azul afecta muchos aspectos del crecimiento y desarrollo vegetal en la planta. La respuesta de los vegetales a la luz azul incluye la inhibición de la elongación del hipocótilo, la estimulación de la expansión de los cotiledones, la regulación del momento de la floración, la curvatura fototrópica, la apertura estomática, la regulación del ciclo circadiano y la regulación de la expresión genética.
Para determinar si el color de la iluminación afecta la estructura de la antena fotosintética, plantas de Pisum sativum se expusieron a condiciones de luz azul, roja o blanca. El color de la iluminación afectó el LHCII (Light Harvesting Complex II) (Gussakovsky et al., 2007) proponen la existencia de una memoria al color a largo plazo, la cual tiene influencia sobre la susceptibilidad del LHCII a la calidad actual de la luz. La existencia de una memoria sensible al color también fue verificada en un ensayo con semillas de Brassica oleracea var. italica que germinaron bajo coberturas de color amarillo, azul, naranja y transparente y se compararon con las plántulas que crecían a libre exposición. Durante la fase del semillero, las plántulas expuestas a cobertura roja mostraron mayor producción de materia seca en comparación con los demás colores y los controles. Las plántulas que crecieron bajo la cobertura azul mostraron la menor acumulación de materia seca. Esta misma tendencia se mantuvo en condiciones de campo luego de que las plántulas se trasladaran al sitio definitivo de cultivo, a pesar de que en las nuevas condiciones de cultivo, todas las plantas crecieron a plena exposición, sin coberturas de color (Casierra-Posada y Rojas, 2009).
En plántulas de fresa almacenadas a 15 °C durante 15-16 días, se evaluó el crecimiento de nuevas hojas, los niveles de clorofila y de carbohidratos, así como la tasa fotosintética en propágulos expuestos a radiación roja, comparados con material vegetal almacenado en la oscuridad. La radiación roja inhibió la denaturación de la clorofila en hojas. Así mismo, las hojas que emergían de las coronas de plántulas guardadas en oscuridad continua, fueron pequeñas con menor contenido de clorofila y con reducida tasa fotosintética en comparación con las que se irradiaron con luz roja (Nishizawa et al., 1997).
En plantas de Cucumis sativus expuestas a luz púrpura, azul, verde, amarilla, roja y blanca, se evaluó el efecto de la calidad de luz sobre la asimilación de CO2 y la captura de quanta por el Fotosistema II. Los resultados mostraron que todas las plantas que crecieron bajo luz monocromática redujeron el crecimiento, la tasa de asimilación de CO2 y el transporte de electrones a través del Fotosistema II en comparación con las plantas que crecieron bajo condiciones de luz blanca. Esta reducción fue más significativa en plantas que crecieron bajo condiciones de luz verde, amarilla y roja. La reducción en el transporte de electrones a través del Fotosistema II se debió en su mayoría en la disipación fotoquímica (Wang et al., 2009).
Son muchos los ensayos realizados en los que se evaluó el efecto de la calidad de la luz sobre aspectos agronómicos en vegetales. Se estudió el efecto de la luz azul (420-460 nm) y luz roja (620-640 nm) sobre la tasa de consumo y evolución del oxígeno y la tasa de producción de calor en plantas de Triticum sp. expuestas a temperatura de 45 °C durante 30 min. La luz azul, comparada con la luz roja presentó un efecto favorable sobre las tasas de metabolismo del oxígeno. La tasa de producción de calor de las plantas que crecieron bajo luz azul fue mayor que aquellas que fueron expuestas a luz roja (Alyabyev et al., 2002). Frutos de tomate que no habían alcanzado la totalidad de la madurez se expusieron diariamente a pulsos cortos de radiación UV-C, a luz roja o a luz solar durante 21 días. Los resultados indicaron que la concentración de licopeno en el exocarpo de los tomates se incrementó significativamente luego del cuarto día de exposición a la radiación UV-C y a la radiación roja (Liu et al., 2009).
Así mismo, se evaluó el efecto de la irradiación localizada con luz azul sobre el aspecto de plantas de Pelargonium zonale, las cuales presentan epinastia bajo condiciones de luz roja. Los resultados sugieren que la epinastia foliar en estas plantas, está controlada por la elongación celular en la epidermis abaxial motivada por la radiación azul en el lado adaxial de la hoja (Fukuda et al., 2008). De igual forma, se estudió el efecto de la interacción de la luz roja y la luz azul aplicada a propágulos in vitro de manzano M9 (Malus pumila). Bajo condiciones de luz rojo lejano se redujo la elongación del tallo debido a que se formaron muy pocos fitómeros. El crecimiento del brote fue mayor bajo condiciones de luz roja que bajo condiciones de luz azul y rojo lejano, mostrando el papel positivo de los fitocromos en el fotoequilibrio. La dominancia apical se incrementó, pero la ramificación se redujo por efecto de la luz azul (Muleo y Morini, 2008).
Con miras a evaluar la floración de Eustoma grandiflorum expuesta a luz roja y rojo lejano, se expusieron las plantas a diferentes rangos de relación R:FR. La relación R:FR crítica para la aparición o el retraso de la yema floral se presentó con valores de 0,5 y 50, respectivamente (Yamada et al., 2009). Plantas de Acalypha hispaniolae que crecieron en materas de color verde con un sombreado de 60% desarrollaron brotes 10% más largos, con 10% más de materia seca en los mismos y 23% más flores que las que crecieron en materas de color blanco, con el mismo nivel de sombra (Svenson, 1993).
La morfogénesis foliar también se ve fuertemente influenciada por la calidad de la luz. En un estudio llevado a cabo por Heraut et al. (1999 y 2001), una relación baja R:FR modificó la morfología en hojas de Trifolium sp. expresada como el incremento del área foliar. En Citrullus lanatus, la iluminación en el rango del rojo lejano del final del día, incrementó el ángulo del pecíolo en hojas (Heather et al., 1997). Honecke et al. (1992) sugirieron que se necesita la luz azul para el crecimiento normal de plántulas de lechuga que crecen bajo lámparas que emiten luz roja. Si el nivel de luz es bajo, las hojas se vuelven largas.
Se estudiaron las curvas de saturación de luz durante el crecimiento en hojas sombreadas de plantas de Convallaria majalis, una planta tipo C3 y hojas desarrolladas al sol en Hordeum vulgare y Zea mays, plantas tipo C3 y C4, respectivamente; las plantas se expusieron a luz azul y luz roja y se encontró un incremento de la acción de luz azul en los diferentes componentes del aparato fotosintético, dependiendo del tipo ecológico de la planta; en contraste con las hojas sombreadas, la luz azul promovió la actividad de las reacciones fotosintéticas en la fase oscura en las hojas de las plantas expuestas al sol (Bukhov et al., 1995).
Adicionalmente, el color reflejado por la superficie del suelo a las hojas en desarrollo de Daucus carota tuvieron una influencia sobre la producción y la composición de la parte comestible de las raíces (Antonious y Kasperbauer, 2002). Se encontró que las mallas polisombra de color azul y rojo tienen un efecto sobre el crecimiento y la floración de diferentes materiales genéticos de Phalaenopsis sp.; la malla roja indujo precocidad en la mayoría de las variedades evaluadas, mientras que las plantas que crecieron bajo mallas de color azul desarrollaron mayor área foliar (Leite et al., 2008).
El objetivo del presente estudio fue determinar si el color de iluminación en que se cultivan las plantas, afecta el crecimiento, el rendimiento y la calidad del producto a cosechar en plantas de remolacha.
MATERIALES Y MÉTODOS
La investigación se realizó en Duitama, Boyacá, localizada a los 5°49'19,43'' de Latitud Norte y 73°4'19,66'' de Longitud Oeste y a una elevación de 2.578 msnm, con temperatura promedio anual de 15 ºC y HR de 81,4%. Como material vegetal se utilizaron plantas de remolacha de Semicol®. Las semillas se sembraron en surcos y previo a la siembra, se preparó el lote mediante varios pases de arado de tracción animal. Posteriormente, se retiraron los restos de arvenses y se demarcaron parcelas de 4 x 10 m. Luego de la germinación, se realizó un raleo de plantas hasta lograr una distancia aproximada de 20 x 20 cm. La emergencia de las plantas sucedió 14 días después de la siembra.
Una semana luego de la emergencia se colocaron las películas plásticas, para lo cual, se instalaron postes de madera alrededor de las parcelas y las coberturas se extendieron sujetas con alambre, 65 cm sobre la superficie del suelo. Se colocaron coberturas de polietileno de baja densidad con espesor de 180 µm de colores rojo, azul y transparente. Las parcelas de los controles se dejaron a plena exposición. La absorción y transmisión de los materiales de las coberturas se determinaron con espectrómetro Hach DR/2000 (Hach Co®, USA). La absorción promedio determinada entre 400 y 700 nm, para las coberturas plásticas fue de 0,07 en la cobertura transparente, 0,10 para la roja y 2,20 para la cobertura azul. Así mismo, se encontró una transmisión de las coberturas, en el mismo rango de longitud de onda, de 83,15% para la cobertura transparente, 78,25% para la roja y de 2,60% para la cobertura de color azul. Adicionalmente, la opacidad se midió con un luxómetro 0500 (Testoterm GmbH and Co® Lux-meter, Alemania), los datos se presentan en la Tabla 1.
Tabla 1. Temperatura, iluminación y opacidad, determinadas bajo cada cobertura de color y fuera de ellas.
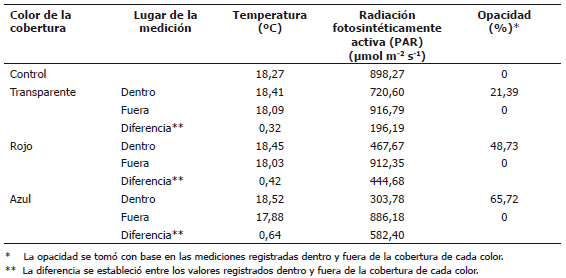
En la calibración del espectrómetro para cada película de color, se tomó un espectro sin muestra alguna, con una absorción de cero y transmisión de uno, luego se procedió a determinar la absorción y transmisión, haciendo pasar el haz de luz a través de cada muestra de cada una de las coberturas de color, a un rango de longitud de onda de 400-700 nm, que corresponde al rango de longitud de onda fotosintéticamente activa.
Cada parcela estaba compuesta por cerca de 1.000 plantas, de las cuales de tomaron al azar 15 plantas como unidad experimental, para los respectivos análisis. El trabajo consistió en un diseño factorial con el uso de diferentes coberturas de color (azul, roja, transparente y un control sin cobertura). Se utilizó un diseño completamente al azar con tres repeticiones. La información se evaluó mediante un análisis de regresión y uno de variancia clásico con la prueba de separación de promedios de Tukey (P<0,05). El análisis estadístico se realizó mediante la aplicación PASW (Predictive Analytics Software) versión 18.0.0 (30-07-2009; IBM Corporation, Somers - USA). Con miras a verificar si existía variación en el suelo, se realizó un análisis de variancia entre las repeticiones del mismo tratamiento (bloques), y se constató que no había diferencia significativa. Para el registro de la información se tomaron semanalmente 15 plantas por parcela, en las cuales se determinó el área foliar, mediante un analizador LI-3000A (Li-Cor®, USA). Cada planta se separó en hojas, peciolos y raíz, para secar los órganos por separado a 85 ºC hasta peso constante.
RESULTADOS Y DISCUSIÓN
La temperatura registrada dentro y fuera de las coberturas (Tabla 1) no presentó variaciones significativas que pudieran influenciar los resultados relacionados con el crecimiento de las plantas. De igual manera, Oren et al. (2001) reportaron que la temperatura del aire registrada en el interior de la fronda de plantas que crecían bajo seis redes coloreadas no mostró diferencias significativas, probablemente debido a la buena ventilación. Además, no hubo diferencias significativas entre la temperatura de las hojas, medida con un analizador CID para fotosíntesis.
El color de la cobertura afectó significativamente las variables presentadas en la Tabla 2. En relación con las plantas control que crecieron sin cobertura, el área foliar se incrementó 22,28% bajo la cobertura roja, pero disminuyó 15,23% bajo la cubierta azul. La cobertura roja indujo un incremento de 21,68% en el peso fresco de la raíz, pero esta se redujo 37,66% bajo la cobertura azul. La cobertura roja provocó un aumento de 20,27% en el diámetro de la raíz, mientras que la cobertura azul lo redujo 22,25%. En relación con los sólidos solubles totales en la raíz, tanto la cobertura transparente como la azul indujeron una reducción en el valor de esta variable, en términos de 2,83 y 13,72%, respectivamente, mientras que la cubierta roja lo incrementó 7,46%. La masa seca total producida por planta fue incrementada 21,43% en las plantas que crecieron bajo la cobertura roja y se disminuyó 28,99% bajo la cobertura azul. La cobertura transparente motivó un incremento de 4,11% en el área foliar, 7,34% en el peso seco de la raíz, 8,38% en el diámetro de la raíz y 7,44% en la masa seca total por planta, mientras que los sólidos solubles totales de la raíz se redujeron 2,83% bajo esta cobertura.
Tabla 2. Parámetros de crecimiento y calidad determinados al momento de la cosecha en plantas de remolacha (Beta vulgaris L. var. Crosby Egipcia) expuestas a coberturas plásticas de colores.
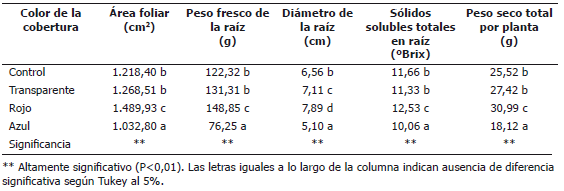
El comportamiento del área foliar bajo la influencia de las coberturas de color fue similar al mencionado por Casierra-Posada y Rojas (2009) en plantas de brócoli expuestas a coberturas de diferente color. Es un hecho reconocido que el sombreado induce diferencias anatómicas extensivas a diferencias metabólicas. Las hojas desarrolladas bajo condiciones de plena exposición tienden a ser más pequeñas, gruesas y con un parénquima de empalizada más diferenciado que las hojas desarrolladas bajo sombra (Lüttge, 1997; Morais et al., 2004); sin embargo, los materiales plásticos utilizados en este trabajo indujeron un sombreado presentado en la Tabla 1. De hecho, el color azul provocó un sombreado del 65,72%, a pesar de lo cual, este tratamiento presentó el área foliar menor.
Por tanto, con base en esta premisa, se asume que los resultados encontrados para el área foliar fueron producto de la exposición espectral más que al sombreado. Esta tendencia se refleja en muchas de las variables evaluadas, como se mostrará más adelante. El incremento del área foliar en plantas expuestas a la luz roja es un hallazgo reiterado en trabajos realizados en fresa (Nishizawa et al., 1997) y en brócoli (Casierra-Posada y Rojas, 2009); sin embargo, en pepino (Cucumis sativus), el resultado fue diferente al encontrado en este estudio, puesto que las plantas desarrollaron mayor área foliar cuando se expusieron a la luz blanca, púrpura y azul que cuando crecieron bajo la influencia de la luz roja y verde (Wang et al., 2009).
En plantas de Phalaenopsis sp. no se registró diferencia significativa en el peso fresco y seco de las raíces, cuando las plantas crecieron bajo mallas polisombra de colores rojo, azul y negro (Leite et al., 2008); sin embargo, se debe tomar en consideración que Phalaenopsis sp. tiene raíz fibrosa, mientras que la remolacha presenta raíz carnosa con un alto poder vertedero y este órgano se constituye en el almacenamiento de fotosintatos; por tanto, si en este estudio el color rojo afectó positivamente el crecimiento de las plantas de remolacha, por ende se produciría un incremento en el peso fresco y diámetro de la raíz.
De manera similar a los resultados del presente trabajo, en plantas de brócoli, la cobertura de color rojo, colocada durante la fase de semillero incrementó 16,2% la acumulación total de materia seca en la planta al momento de la cosecha, en relación con el control sin cobertura. La cubierta de color azul redujo la materia seca total en 53,3%, y a su vez, la cubierta amarilla la redujo 23,6%, en comparación con las plantas del control. No se encontró diferencia significativa entre las plantas que se habían expuesto al color naranja y el control. Por último, la cobertura transparente produjo 11,8% menos materia seca que las plantas del control (Casierra-Posada y Rojas, 2009).
En este estudio, en relación con el alto contenido de sólidos solubles (SST) encontrado en las raíces de remolacha expuestas a la cobertura de color rojo, Kasperbauer et al. (2001) establecieron también que el color rojo del mulch en cultivos de fresa incrementa no sólo el contenido de SST en frutos, sino también la cantidad de ácidos orgánicos y de compuestos aromáticos. Estos autores mencionan que la radiación en el rango del rojo lejano y la relación rojo / rojo lejano, presentes en la luz reflejada por el mulch de color rojo actuó sobre el sistema de fitocromos, el cual indujo la expresión de genes cuya acción tuvo como consecuencia el mejoramiento de la calidad de los frutos de fresa.
Con relación a la asignación porcentual de masa seca a las hojas, peciolos y raíz, se encontró diferencia significativa en todos los casos (Tabla 3). Las plantas acumularon mayor porcentaje de masa seca en las raíces cuando crecieron a libre exposición (control) o bajo la cobertura de color azul o transparente. Los colores rojo y azul provocaron una mayor acumulación de masa seca en los peciolos, en relación con el control sin cobertura y la cobertura transparente. La cubierta azul motivó una mayor acumulación de masa seca en las hojas y el menor valor se presentó bajo la cobertura de color rojo.
Tabla 3. Acumulación de materia seca en los diferentes órganos en plantas de remolacha (Beta vulgaris L. var. Crosby Egipcia) expuestas a coberturas plásticas de colores.
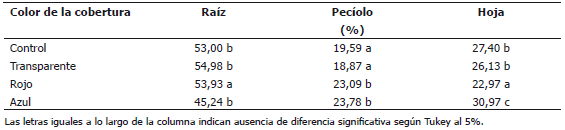
La distribución de materia seca en los órganos del cuerpo del vegetal es otra variable que comúnmente se afecta con la calidad espectral de la luz. Fukuda et al. (1993), encontraron que la exposición de plantas de tomate a la luz amarilla no solo inhibe la elongación del tallo, sino que también reduce la asignación porcentual de materia seca a él. En Amaranthus quitensis la exposición a una radiación rojo / rojo lejano baja aplicada a los tallos aumentó su longitud y contenido de masa seca, pero no afectó el crecimiento de las hojas o las raíces (Ballaré et al., 1991). En consecuencia, las plantas de la especie mencionada que reciben una relación rojo / rojo lejano baja acumulan más materia seca que cuando esta relación es alta. Al parecer, cuando esta relación es baja, se estimula el poder vertedero del tallo, e indirectamente tiene lugar una mayor fotosíntesis. Cuando sólo una hoja del par unido al primer entrenudo está expuesta a una radiación rojo / rojo lejano baja, esta hoja muestra una mayor actividad de la sacarosa fosfato sintetasa. Esta enzima, está implicada en el control de las exportaciones de sacarosa de las hojas, por tanto, se incrementa la exportación de carbono marcado, y se disminuye el crecimiento en comparación con una radiación rojo / rojo lejano alta (Yanovsky et al., 1995).
En hojas de fresa cultivadas in vitro se encontró que la luz azul incrementó, el contenido total de clorofila y la masa seca, lo cual se atribuyó a una alta tasa de reacción fotoquímica de las hojas bajo este color de luz (Miranda y Williams, 2007). En plantas de Phalaenopsis sp. la exposición de las plantas a mallas polisombra de color azul indujo mayor peso seco en las hojas, mientras que la malla de color rojo incrementó el peso seco en los tallos (Leite et al., 2008). Las diferentes respuestas de las plantas a la luz se pueden explicar por las disimilitudes entre las distintas especies, variedades o incluso, en algunos casos las causas de estas respuestas pueden deberse a las características de la luz emitida por las fuentes utilizadas (Piszczek y Glowacka, 2008).
Se observó que desde estados tempranos del crecimiento de las plantas, la cubierta de color azul indujo una producción total de masa seca en las plantas en menor grado, en comparación con los demás colores y con las plantas control. Por su parte, la mayor ganancia en peso seco sucedió en las plantas que crecieron bajo la cubierta de color rojo, a partir de 62 días después de la germinación, como se observa en la Figura 1. Las ecuaciones de regresión de la dinámica del crecimiento en el tiempo para la masa seca total por planta se presentan en la Tabla 4, con las cuales se puede estimar el comportamiento de las variables presentadas con relación a los días después de germinación.
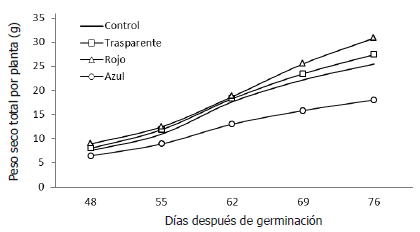
Figura 1. Evolución de los valores de materia seca registrados en plantas de remolacha (Beta vulgaris L. var. Crosby Egipcia) expuestas a coberturas plásticas de colores.
Tabla 4. Ecuaciones de regresión que expresan el comportamiento en el tiempo de diferentes parámetros en plantas de remolacha (Beta vulgaris L. var. Crosby Egipcia) expuestas a coberturas plásticas de colores.
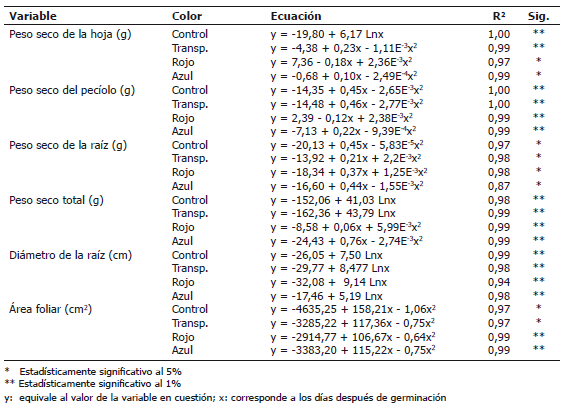
Los patrones de las curvas encontrados fueron todos significativos a nivel del 5% y correspondieron a ecuaciones de tipo logarítmico o cuadrático. La forma de las curvas representan modelos típicos del crecimiento vegetal; sin embargo, la forma de las curvas fue afectada por la calidad de la luz, puesto que las pendientes de las curvas fueron diferentes en cada parámetro, en dependencia del color de la cobertura. Al respecto, Seibert et al. (1975) también encontraron diferencias en las curvas que expresaban el crecimiento in vitro de callos de tabaco expuestos a diferente calidad de luz y mencionan que la longitud de onda y la intensidad de la luz son parámetros importantes para la comprensión de la fotomorfogénesis en los tejidos vegetales. Por tanto, el crecimiento puede ser estimulado o inhibido en comparación con las plantas control, dependiendo del nivel de UV cercano o de la irradiación de luz en el rango del azul.
De manera similar al resultado encontrado en este estudio, Islam et al. (1999) y Alam et al, (2007) al exponer plantas de Catleya sp. y Allium cepa, respectivamente, a la luz roja y azul observaron que el color rojo tuvo un mejor comportamiento en cuanto a la acumulación de masa seca en función del tiempo, seguido por el color azul y en último lugar estuvieron las plantas que crecieron a libre exposición a la radiación solar. A pesar de este resultado, se debe tomar en consideración la dinámica del crecimiento del órgano de interés comercial, ya sea que se trate de la fruta (Kasperbauer, 2001), de la flor (Leite et al., 2008) o de la raíz en el caso del presente trabajo. Los distintos órganos de la planta y los diversos materiales vegetales responden de manera diferente a la calidad del espectro al que se exponen los cultivos, pues en algunos casos, las plantas reaccionan mejor a la luz azul (Miranda y Williams, 2007) y en otros, se comportan mejor bajo exposición a la luz roja (Casierra-Posada y Rojas, 2009) u otras longitudes de onda (Wang et al., 2009).
A diferencia del comportamiento de la masa seca total por planta, presentado en la Figura 1, la acumulación de masa seca en las raíces de las plantas expuestas a la cobertura de color rojo, presentó valores superiores a las demás coberturas y al control, desde estados tempranos del crecimiento de las plantas, mientras que la cobertura de color azul mostró una disminución marcada a partir de 55 días después de germinación. Las ecuaciones que expresan el comportamiento de las curvas se muestran en la Tabla 4.
La dinámica de la acumulación del peso seco en la raíz desde los estados tempranos (Figura 2) pudo ser la consecuencia de la actividad de los fitocromos, que desencadenaron la acción enzimática a favor de un mayor poder vertedero hacia un órgano en especial, como es el caso de las raíces en el presente trabajo, coincidiendo con lo reportado por Yanovsky et al. (1995). Además, se ha establecido que la luz roja fomenta la tasa de crecimiento relativo, en Allium cepa (Alam et al., 2007), lo cual pudo ser una consecuencia de una mayor tasa fotosintética en un área foliar incrementada, bajo la exposición de las plantas de remolacha a la luz roja, como se presentó en la Tabla 2.
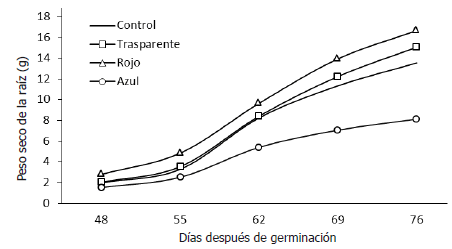
Figura 2. Evolución de los valores de peso seco registrados en raíces de plantas de remolacha (Beta vulgaris L. var. Crosby Egipcia) expuestas a coberturas plásticas de colores
Por último, se debe considerar que los rangos máximos de absorción de las clorofilas se encuentran en los rangos del azul-violeta (400-500 nm) y del naranja-rojo (600-700 nm) del espectro visible (Mc Donald, 2003); por tanto, las plantas expuestas a estos colores se verían favorecidas por una mayor absorción de los quanta por parte de las clorofilas. Sin embargo, en el caso del área foliar, así como para las demás variables evaluadas en este estudio, la cobertura azul tuvo un efecto reductor del crecimiento, mientras que el color rojo lo favoreció, lo cual se podría explicar a través del llamado efecto Emerson (Casierra-Posada y Rojas, 2009), mediante el cual, al proporcionar luz roja de longitud de onda corta (670 nm) al tiempo que longitudes de onda más largas (700 nm), la tasa de fotosíntesis es mayor que la suma de las tasas de fotosíntesis originadas por una sola clase de longitud de onda. En la fotosíntesis cooperan dos fotosistemas y las longitudes de onda larga son absorbidas sólo por el Fotosistema I. El Fotosistema II absorbe longitudes de onda menores a 690 nm, y para una máxima eficiencia debe cooperar con el Fotosistema I (Taiz y Zeiger, 2000; Mc Donald, 2003).
AGRADECIMIENTOS
El estudio, se desarrolló con el apoyo de la Dirección de Investigaciones (DIN) de la Universidad Pedagógica y Tecnológica de Colombia - UPTC, en el marco del plan de trabajo del Grupo de Investigación Ecofisiología Vegetal, adscrito al programa de Ingeniería Agronómica de la Facultad de Ciencias Agropecuarias de la UPTC.
BIBLIOGRAFÍA
Agronet. 2011. Análisis - Estadísticas. En: Ministerio de Agricultura y Desarrollo Rural, República de Colombia, http://www.agronet.gov.co/agronetweb/AnalisisEstadisticas/tabid/73/Default.aspx; consulta: octubre 2011. [ Links ]
Alam, M.N., M.S. Islam, M.K. Ali, M.A. Barkotulla and S.M. Khandaker. 2007. Effect of light qualities on dry matter production, crop growth performance and chlorophyll content in onion plant. Research Journal of Agriculture and Biological Sciences 3(6): 871-875. [ Links ]
Alyabyev, A.J., N.L. Loseva, T.P. Jakushenkova, G.G. Rachimova, V.I. Tribunskih, R.I. Estrina and V.Y. Petrov. 2002. Comparative effects of blue light and red light on the rates of oxygen metabolism and heat production in wheat seedlings stressed by heat shock. Thermochimica Acta 394(1,2): 227-231. [ Links ]
Antonious, G.F. and M.J. Kasperbauer, 2002. Color of light reflected to leaves modifies nutrient content of carrot roots. Crop Science 42: 1211-1216. [ Links ]
Ballaré, C.L., A.L. Scopel and R.A. Sánchez, 1991. On the opportunity cost of the photosynthate invested in stem elongation reactions mediated by phytochrome. Oecologia 86(4): 561-567. [ Links ]
Bukhov, N.G., I.S. Drozdova and V.V. Bondar. 1995. Light response curves of photosynthesis in leaves of sun-type and shade-type plants grown in blue or red light. Journal of Photochemistry and Photobiology B: Biology 30(1): 39-41. [ Links ]
Casierra-Posada, F. y J. Rojas. 2009. Efecto de la exposición del semillero a coberturas de colores sobre el desarrollo y productividad del brócoli (Brassica oleracea var. italica). Agronomía Colombiana 27(1): 49-55. [ Links ]
Fukuda, N., M. Fujita, Y. Ohta, S. Sase, S. Nishimura and H. Ezura. 2008. Directional blue light irradiation triggers epidermal cell elongation of abaxial side resulting in inhibition of leaf epinasty in geranium under red light condition. Scientia Horticulturae 115(2): 176-82. [ Links ]
Fukuda, N., H. Ikeda and M. Nara. 1993. Effects of light quality on the growth of tomato and kidney bean cultured by hydroponics under controled environment. The Society of Agricultural Structures, Japan 23(3): 127-134. [ Links ]
Gussakovsky, E.E., Y. Shahak y D.F. Schroeder. 2007. Color of illumination during growth affects LHCII chiral macroaggregates in pea plant leaves. Journal of Photochemistry and Photobiology B: Biology 86(2): 121-130. [ Links ]
Heather, A., H. Graham and D.R. Decoteau. 1997. Young watermelon plant growth responses to end-of-day red and far-red light are affected by direction of exposure and plant part exposed. Scientia Horticulturae 69: 41-49. [ Links ]
Heraut, V., C. Robin, C. Varlet, D. Afif and A. Guckert. 1999. Light quality (red:far-red ratio): dose it affect photosynthetic activity, net CO2 assimilation, and morphology of young white clover leaves?. Canadian Journal of Botany 77(10): 1425-1431. [ Links ]
Heraut, V., C. Robin, C. Varlet and A. Guckert. 2001. Phytochrome mediated effects on leaves of white clover: consequences of light interception by the plant under competition for light. Annals of Botany 88(1): 737-743. [ Links ]
Honecke, M., R.J. Bula and T.W. Tibbitts. 1992. Importance of 'blue' photon levels from lettuce seedlings grown under red-emitting-diodes. HortScience 27(5): 427-430. [ Links ]
Islam, M.O., S. Matsui y S. Ichihashi. 1999. Effects of light quality on seed germination and seedling growth of catteya orchids in vitro. Journal of the Japanese Society for Horticultural Science 68(6): 1132-1138. [ Links ]
Kasperbauer, M.J., J.H. Loughrin and S.Y. Wang. 2001. Light reflected from red mulch to ripening strawberries affects aroma, sugar and organics acid concentrations. Photochemistry and Photobiology 74(1): 103-107. [ Links ]
Leite, C.A., R.M. Ito, G.T. Lee, R. Ganelevin and M.Â. Fagnani. 2008. Light spectrum management using colored nets aiming to controlling the growth and the blooming of Phalaenopsis sp. Acta Horticulturae 770: 177-184. [ Links ]
Liu, L.H., D., Zabaras, L.E. Bennett, P. Aguas and B.W. Woonton. 2009. Effects of UV-C, red light and sun light on the carotenoid content and physical qualities of tomatoes during post-harvest storage. Food Chemistry 115(2): 495-500. [ Links ]
Lin, C. 2000. Plant blue-light receptors. Trends in Plant Science 5(8): 337-342. [ Links ]
Lüttge, U. 1997. Physiological ecology of tropical plants. Springer Verlag, Heidelberg. 83-84 p. [ Links ]
Martínez, R., A. Solís, A. Cisneros y J. Velázquez. 2005. Determinación del momento óptimo de trasplante en el cultivo de la remolacha (Beta vulgaris L). Ciencias Holguín 11(4): 1-5. [ Links ]
Mc Donald, M.S. 2003. Photobiology of higher plants. John Wiley and Sons, West Sussex, UK. 345 p. [ Links ]
Miranda, J.H. and R. Williams. 2007. Developmental influence of in vitro light quality and carbon dioxide on photochemical efficiency of PS II of strawberry leaves (Fragaria x ananassa). Journal of Applied Horticulture 9(1): 13-16. [ Links ]
Morais, H., M.E. Medri, C.J. Marur, P.H. Caramori, A.M. Ribeiro and J.C. Gomes. 2004. Modifications on leaf anatomy of Coffea arabica caused by shade of pigeonpea (Cajanus cajan). Brazilian Archives of Biology and Technology 47(6): 863-871. [ Links ]
Muleo, R. and S. Morini, 2008. Physiological dissection of blue and red light regulation of apical dominance and branching in M9 apple rootstock growing in vitro. Journal of Plant Physiology 165(17): 1838-1846. [ Links ]
Nishizawa, T., Y. Shishido, M. Kudo, H. Kumakura and H. Hamamoto. 1997. Petiole length, chlorophyll and carbohydrate levels, and photosynthetic rates of June-bearing strawberry plants as influenced by red-light irradiation during storage under cool conditions. Scientia Horticulturae 72(1): 25-33. [ Links ]
Oren, M., E. E. Gussakovsky, E. Shpiegel, A. Nissim, K. Ratner, Y.E. Ovadia and Y. Shahak. 2001. Coloured shade nets can improve the yield and quality of green decorative branches of Pittosporum variegatum. Journal of Horticultural Science and Biotechnology 76(3): 353-361. [ Links ]
Piszczek, P. and B. Glowacka. 2008. Effect of the colour of light on cucumber (Cucumis sativus L.) seedlings. Vegetable Crops Research Bulletin 68: 71-80. [ Links ]
Schaxov, A.A. 1993. Photoenergetics of plants and harvest (en ruso). Nauka, Moscow. 451 p. [ Links ]
Seibert, M., P.J. Wetherbee y D.D Job. 1975. The effects of light intensity and spectral quality on growth and shoot initiation in tobacco callus. Plant Physiology 56: 130-139. [ Links ]
Svenson, S. 1993. Shading and pot color influence growth and flowering of strawberry firetails. Proceedings of the Florida State Horticultural Society 106: 286-288. [ Links ]
Taiz, L. y E. Zeiger. 2000. Physiologie der Pflanzen. Spektrum Verlag, Heidelberg, Alemania. 773 p. [ Links ]
Yamada, A., T. Tanigawa, T. Suyama, T. Matsuno and T. Kunitake. 2009. Red:far-red light ratio and far-red light integral promote or retard growth and flowering in Eustoma grandiflorum (Raf.) Shinn. Scientia Horticulturae 120(1): 101-106. [ Links ]
Yanovsky, M.J., J.J. Casal, G.L. Salerno and R.A. Sánchez. 1995. Are phytochrome-mediated effects on leaf growth, carbon partitioning and extractable sucrose-phosphate synthase activity the mere consequence of stem-growth responses in light-grown mustard?. Journal of Experimental Botany 46(7): 753-757. [ Links ]
Wang, H., M. Gu, J. Cui, K. Shi, Y. Zhou and J. Yu. 2009. Effects of light quality on CO2 assimilation, chlorophyll-fluorescence quenching, expression of Calvin cycle genes and carbohydrate accumulation in Cucumis sativus. Journal of Photochemistry and Photobiology B: Biology 96(1): 30-37. [ Links ]














