Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.64 no.2 Medellín July/Dec. 2011
Determinación de la Infección de Burkholderia glumae en Semillas de Variedades Comerciales Colombianas de Arroz
Determination of the Infeccion of Burkholderia glumae in Comercial Colombian Rice Varieties
Nathalia María Vanesa Flórez Zapata1 y Daniel Uribe Vélez2
1 Bacterióloga. Maestría en Microbiología. Universidad Nacional de Colombia - Sede Bogotá - Facultad de Ciencias - Instituto de Biotecnología. A.A. 14490, Bogotá, Colombia <nvflorezz@unal.edu.co>
2 Profesor Asociado. Universidad Nacional de Colombia - Sede Bogotá - Facultad de Ciencias - Instituto de Biotecnología. A.A. 14490, Bogotá, Colombia <duribev@unal.edu.co>
Recibido: Septiembre 26 de 2011; aceptado: Noviembre 29 de 2011.
Resumen. El añublo bacterial de la panícula del arroz, ocasionado por Burkholderia glumae, es una enfermedad cada vez más difundida en Colombia. Por tal motivo es importante implementar un sistema de evaluación de la infección de este agente fitopatógeno en semilla, ya que ésta es una de las posibles fuentes de la enfermedad en campo. Semillas previamente desinfectadas, fueron sumergidas en suspensiones bacterianas y colocadas en cámara húmeda por siete días, luego de los cuales fueron evaluadas. Este sistema fue validado a través del análisis de la severidad de la infección en siete variedades de arroz y tres concentraciones del patógeno. El análisis reveló que las variedades F60, Panorama y F174, presentaron la menor severidad de la infección, aunque estadísticamente similar entre sí; mientras que, las variedades F369 y F733 presentaron niveles de severidad significativamente mayores y similares entre sí. Todas las variedades, con excepción de F60, presentaron diferencias entre las concentraciones del patógeno evaluadas, encontrándose una relación positiva entre concentración del inóculo y la severidad, la cual osciló según la variedad en la que fue estimada. Se concluyó que el modelo de evaluación de la infección fue exitoso dado que permitió encontrar diferencias en la severidad de la infección entre las variedades de arroz y las concentraciones de inóculo.
Palabras clave: Añublo bacterial del arroz, cereal, concentración inóculo, variedades de arroz.
Abstract. The bacterial panicle blight of rice caused by Burkholderia glumae, is a disease that has gained increasing distribution in Colombia. Therefore it is important to implement an assessment system of infection of this phytopathogen in seeds, since this is one of the possible disease sources on the field. Thus, previously disinfected seeds were dipped in the bacterial suspension and placed in a moist chamber for 7 days, after which they were assessed. This assessment system, was validated by analyzing the infection severity level on seven rice varieties and three concentrations of the pathogen. The analysis revealed that varieties F60, Panorama and F174, had the lowest severity infection level, although statistically similar to each other, whereas the varieties F369 and F733 had similar and significantly higher severity levels. All varieties, except for F60, showed differences among the tested pathogen concentrations, found a positive relationship between inoculum concentration and severity, which varied depending on the rice variety in which it was evaluated. Taking these results into account, it was concluded that the assessment model of infection was successful, because it allowed to find differences in the severity of infection in rice varieties and concentrations of inoculum.
Key words: Rice panicle blight disease, cereal, inoculum concentration, rice varieties.
En Colombia, el arroz es el tercer producto agrícola en extensión, después del café y el maíz, representando cerca del 13% del área cosechada en el país y el 30% de los cultivos transitorios (Espinal et al., 2005). Según el DANE-Fedearroz, en los últimos 10 años se han sembrado alrededor de 457.934 ha, para un rendimiento anual promedio de 2´224.219 toneladas (DANE-Fedearroz, 2010). El cultivo de este cereal, representa el 6% del valor de la producción agropecuaria y el 10% de la actividad agrícola colombiana (Espinal et al., 2005), lo cual, resalta la importancia de la cadena productiva del arroz para el sector agrícola nacional. Sin embargo, existen factores limitantes para la productividad de la misma, tales como la presencia de enfermedades en el cultivo, lo cual se acentúa con los nuevos retos que plantean los efectos del cambio climático a nivel mundial, que en el país se han manifestado con el incremento en la intensidad de algunas enfermedades que hasta hace un tiempo presentaban baja importancia, como son aquellas de origen bacterial (Pérez, 2010).
Dentro de las bacterias patógenas del arroz reportadas en Colombia, se resalta Burkholderia glumae, la cual puede producir síntomas que incluyen el tizón de plántulas y la pudrición de plántulas y granos, los cuales a menudo son considerados como manifestaciones de una enfermedad conocida como añublo bacterial del arroz (Devescovi et al., 2007). Esta bacteria es transmitida por semilla y crece epifitamente en la planta en los estadios tempranos del desarrollo; posteriormente infecta flores, generando lesiones pequeñas con márgenes de color marrón en las hojas y espiguillas, trayendo como resultado el aborto del grano antes de su llenado (Sayler et al., 2006; Nandakumar et al., 2009).
La enfermedad ocasionada por B. glumae, es un problema recurrente en áreas productoras de arroz, y es particularmente importante en otros países como Japón, Tailandia, Vietnam, Korea del Sur, Malasia, Filipinas, Sri Lanka y otras naciones del sureste asiático. También ha sido registrada en América en Estados Unidos, Panamá, Nicaragua, Costa Rica y Colombia, lo cual sumado a que la enfermedad se ha vuelto más prevalente en los años recientes, las pérdidas económicas ocasionadas, y la carencia de métodos efectivos de control y variedades de arroz resistentes, ha generado gran interés en este patógeno a nivel mundial (Zhu et al., 2008; Devescovi et al., 2007; Lim et al., 2009; Nandakumar et al., 2007; Ham et al., 2011). En Colombia la enfermedad fue observada por primera vez en 1989 en muestras de granos decolorados (Zeigler y Álvarez, 1989); posteriormente, en el año 2007 se identifican campos infectados (plantas con espiguillas vanas, decoloración de las mismas y manchado del grano) con esta bacteria en el departamento de Córdoba (Pérez y Saavedra, 2007), por lo cual a partir de allí Fedearroz (Fondo Nacional del Arroz) comenzó una serie de monitoreos fitosanitarios confirmando la presencia del patógeno en diferentes zonas arroceras de Colombia (Pérez y Saavedra, 2011). Dentro de las zonas afectadas, se destacan departamentos del caribe colombiano como Córdoba (La Doctrina, Montería) y Bolívar (María la Baja) (Diago et al., 2009; Pérez y Saavedra, 2011), así como los departamentos de la región central; Tolima (Ambalema, Saldaña) y Huila (Campoalegre) (Diago et al., 2009). Sin embargo, esta bacteria también ha sido detectada a través de la técnica de PCR en muestras de plantas provenientes de los departamentos de Cesar, Meta, Santander, Sucre y Valle del Cauca, demostrando que éste es un patógeno ampliamente distribuido en el país (Mosquera, 2010).
Dado que la bacteria se ve favorecida por temperaturas y humedades relativas altas (Diago et al., 2009), se considera que esta enfermedad puede ocurrir más frecuentemente en países tropicales y semi-tropicales durante épocas de siembra con temperaturas más altas de lo normal (Ham et al., 2011). En Colombia, dicha situación ha sido observada especialmente en los distritos de Montería y Ambalema, los cuales han registrado temperaturas altas (32,4 °C y 37,3 °C), proporcionando un ambiente favorable para el desarrollo del patógeno. Por tanto, dado que se propone que el cambio climático global y el incremento en la incidencia de esta enfermedad a nivel mundial presentan una relación (Ham et al., 2011), es posible que los reportes de este patógeno en las diferentes zonas de Colombia, no sean consecuencia de un desplazamiento de la bacteria, sino de un incremento en la incidencia, como resultado del establecimiento de condiciones ambientales favorables para su desarrollo (FEDEARROZ, 2009)
Cabe resaltar, que aunque no se conoce con exactitud la magnitud de las pérdidas ocasionadas por este patógeno, algunos autores han estimado que las disminuciones en la producción de arroz pueden oscilar entre el 15% y el 80% de la producción (Ham et al., 2011; Shahjahan et al., 2000). En Colombia, no existen informes claros sobre las pérdidas generadas por este patógeno, ya que no es fácil estimar éstas a partir de los componentes de rendimiento, debido entre otras cosas a la diversidad de factores que concurren en el desarrollo de una enfermedad de este tipo como variedad, clima, cantidad de inóculo y manejo del cultivo (Diago et al., 2009). Sin embargo, es evidente que algunos componentes de rendimiento se afectan conforme aumenta el grado de enfermedad, tales como el número de granos llenos y peso de mil granos, los cuales combinados pueden llegar a reducir en un 50% el rendimiento cuando se alcanzan los mayores niveles de enfermedad (Diago et al., 2009). Además de lo anterior, al visitar las zonas afectadas se puede evidenciar una gran desinformación en torno al mecanismo de dispersión del patógeno en campo, incluso de él o los agentes patógenos relacionados con esta enfermedad, y por lo tanto los sistemas de control de la misma. En respuesta a lo anterior, y considerando que existe un riesgo comprobado de transmisión asociado a la semilla (Sayler et al., 2006; Goto y Ohata, 1956), el Instituto Colombiano Agropecuario (ICA) reconociendo la importancia de este patógeno para el país, estableció cuarentena fitosanitaria para la siembra de cultivos de arroz en los predios o lotes arroceros afectados en el territorio nacional, por la presencia de la bacteria B. glumae (ICA, 2009).
Con el propósito de estudiar los factores de patogenicidad y virulencia de diferentes aislamientos de B. glumae así como los aspectos relacionados con la enfermedad que genera, se han realizado evaluaciones a nivel de campo (Pérez, 2010; Diago et al., 2009), invernadero y laboratorio. Dentro de estos últimos, se destacan las pruebas de patogenicidad hechas mediante la inoculación de suspensiones de la bacteria en panículas de plantas en estado de floración (Devescovi et al., 2007; Kang et al., 2008; Chun et al., 2009; Suzuki et al., 2004; Kimet al., 2004; Kim et al., 2007; Cho et al., 2007), la inyección con suspensión bacteriana de hojas de plantas de un mes de edad (Xiong y Yang, 2003; Sayler et al., 2006), el corte de hojas de plántulas de un mes de edad con tijeras previamente sumergidas en la suspensión del patógeno (Cho et al., 2007), la infección de semillas germinadas y evaluación de la enfermedad en las plántulas obtenidas tras dos semanas de desarrollo (Shingu y Yoneyama, 2004), la capacidad de inducción de respuesta de hipersensibilidad en hojas de tabaco infiltradas con la bacteria (Kang et al., 2008; Sayler et al., 2006) y ensayos de infección a través de pruebas de germinación en semillas (Devescovi et al., 2007). Merece destacar este último sistema de evaluación por ser uno de los más eficientes para el estudio de la interacción planta-patógeno, puesto que no requiere de una infraestructura especial (invernaderos o cámaras de crecimiento), permite obtener resultados en un plazo de tiempo corto (7 días) y permite evidenciar diferentes niveles de severidad de la enfermedad.
Dada la importancia que ha cobrado B. glumae como agente fitopatógeno del arroz en Colombia, así como el hecho de que se desconocen factores relevantes de la biología de la relación planta-patógeno con las variedades colombianas, como la capacidad del patógeno de desarrollar la enfermedad a partir de semillas infectadas, lo cual puede ser fácilmente estudiado a través de este sistema de infección, el objetivo de la presente investigación fue evaluar el desarrollo de la infección de B. glumae en siete variedades colombianas de arroz mediante la adecuación de un modelo de infección en semillas. La validación de éste modelo permitirá determinar su utilidad futura en estudios de la interacción planta-patógeno, la evaluación de alternativas de prevención y control de la enfermedad, o como prueba complementaria para la selección de variedades tolerantes a la enfermedad.
MATERIALES Y MÉTODOS
Material biológico. Se utilizaron semillas de arroz provenientes de lotes comerciales certificados y tratados con el fungicida Vitavax® pertenecientes a las variedades Panorama, Fedearroz 733, Fedearroz 369, Fedearroz 174, Fedearroz 50, Fedearroz 60 y Fedearroz 473. Como bacteria patógena, se utilizó la cepa 3200-12 de B. glumae, facilitada por el Laboratorio de Patología de Arroz del Centro Internacional de Agricultura Tropical (CIAT).
Obtención del inóculo bacteriano. El inóculo bacteriano se preparó a partir de cultivos reactivados de la cepa 3200-12 de B. glumae, que se encontraba almacenada a -80 °C en caldo King B con glicerol al 15%. La bacteria se sembró por agotamiento en Agar King B y posteriormente se incubó por 48 h a 28 °C. Transcurrido el tiempo de incubación, y verificada la pureza del aislamiento, una colonia de la bacteria se sembró en 5 mL de caldo King B, seguida de incubación a 28 °C con agitación constante (150 rpm) por 24 h. Luego, la biomasa microbiana se concentró por centrifugación (7.500 rpm por 5 min) y se resuspendió en 20 mL de agua destilada estéril, hasta obtener una suspensión acuosa de la bacteria con una concentración equivalente a una absorbancia de 0,2 ± 0,05 a 600 nm, la cual corresponde a aproximadamente 1,0 x 108 unidades formadoras de colonia (UFC) por mL, según determinaciones realizadas previamente por el grupo de investigación.
Desinfección de las semillas de arroz. Las semillas de arroz fueron previamente lavadas y desinfectadas en una solución de hipoclorito de sodio al 6% por 6 min, con agitación constante. Posteriormente, se descartó la solución desinfectante y se realizaron tres lavados de las semillas con agua destilada estéril. Adicionalmente, se hizo un segundo tratamiento de desinfección con etanol al 70% por 6 min y en agitación constante, seguido por tres lavados con agua destilada estéril, y en algunos casos se efectuaron lavados adicionales, con el propósito de eliminar restos de las soluciones de desinfección o de los agroquímicos adheridos a la semilla. Una vez desinfectadas, las semillas fueron embebidas con agua destilada estéril por 48 h, luego se lavaron una vez más con agua destilada estéril y se transfirieron a cajas de Petri estériles para su posterior utilización.
Inoculación de las semillas de arroz. Se realizó un ensayo preliminar de inoculación utilizando semillas de la variedad Fedearroz 733, con seis concentraciones diferentes del patógeno partiendo de 1,0 x 108 UFC mL-1 y diluciones sucesivas en base diez de la misma hasta 1,0 x 103 UFC mL-1. Posteriormente, las semillas fueron sumergidas en cada suspensión bacteriana por 30 min en agitación constante (150 rpm), cumplido el tiempo se retiró el inóculo y la semilla de cada tratamiento se depositó en cajas de Petri estériles. Las cajas de Petri con las semillas, fueron tratadas con vacío a 20 psi por 10 min en una campana con el objeto de asegurar la infección de las semillas. Finalizado este proceso, la semilla de cada tratamiento se transfirió a cajas de Petri estériles con papel absorbente húmedo, luego se incubaron por siete días en oscuridad a 28 °C y una humedad relativa del 70% en un cuarto temperado. La severidad de la enfermedad en la semilla se evaluó al día siete después de la inoculación utilizando para ello un diseño experimental completamente al azar con tres repeticiones por tratamiento. Cada repetición consistió de 20 unidades experimentales (20 semillas). Como tratamiento testigo, se utilizaron semillas sometidas al mismo tratamiento de desinfección, con la diferencia de que estas fueron sumergidas en agua destilada estéril en lugar de la suspensión bacteriana.
Evaluación de la severidad de la infección. Analizados los resultados del ensayo preliminar de inoculación de las semillas, se seleccionaron tres concentraciones diferentes siguiendo diluciones seriadas en el rango de 1,0 x 105 a 1,0 x 103 UFC mL-1, con el objeto deevaluar la infección de B. glumae en las siete variedades seleccionadas para el estudio, siguiendo la misma metodología descrita anteriormente. La evaluación de la severidad de la infección se hizo en semillas individuales de cada tratamiento según la escala de severidad propuesta por Devescovi et al. (2007) (Figura 1). Merece mencionar que previo a este ensayo se realizó una prueba de germinación a cada una de las fuentes de semillas empleadas para verificar su calidad.

Figura 1. Escala de severidad de la infección de Burkholderia glumae en semillas de arroz.
- Nivel 1: Plántulas completamente verdes e igual de vigorosas a las del control no inoculado.
- Nivel 2: Plántulas completamente verdes, pero con las raíces y la parte aérea menos vigorosas en comparación con el control no inoculado.
- Nivel 3: Plántulas con desarrollo de la parte aérea de la planta, con decoloración parcial en menos de un 50% de la superficie.
- Nivel 4: Plántulas con desarrollo de la parte aérea de la planta, con decoloración parcial en más de un 50% de la superficie.
- Nivel 5: Plántulas con desarrollo de la parte aérea de la planta, con decoloración completa o con crecimiento limitado a menos de 1 cm de altura.
- Nivel 6: Coleóptilo y plúmula macerados, sin desarrollo de la planta.
Con el propósito de confirmar la respuesta de las plantas al patógeno, fue necesaria la construcción de un registro fotográfico de las semillas infectadas, de manera que pudiera ser utilizado como referente para la asignación de un valor dentro de la escala de severidad, para cada semilla evaluada. Cabe resaltar, que las evaluaciones de los diferentes tratamientos fueron realizadas el mismo día por la misma persona, a fin de evitar sesgos en la adjudicación del nivel de severidad. Adicionalmente, se estableció el grado de infección para cada variedad en las diferentes concentraciones evaluadas, utilizando la metodología de Kang et al. (2008) con algunas modificaciones y de acuerdo a la siguiente fórmula:
Grado de infección = Σ (número de semillas en cada nivel x nivel)/número total de semillas.
Este ensayo, fue repetido una vez en el tiempo para todas las variedades evaluadas.
Análisis estadístico. En primer lugar se aplicó la prueba de Kruskal-Wallis (KW) por pares a un valor de significancia P=0,05, para comprobar la existencia de diferencias estadísticamente significativas en la severidad de la infección de las semillas entre las siete variedades diferentes a cada una de las tres concentraciones de inóculo evaluadas, así como entre las tres concentraciones de inóculo probadas. Esta prueba se aplicó ya que el conjunto de datos no cumplió con el supuesto de normalidad necesario para realizar comparaciones a través del análisis de varianza. Así mismo, se realizó un análisis de correlación entre la concentración del inóculo y la severidad de la infección, con el propósito de establecer la relación lineal entre estas dos variables. Los análisis estadísticos fueron ejecutados en el programa estadístico STATA 9.0 (Stata Corp, 2005).
RESULTADOS Y DISCUSIÓN
Adecuación del modelo de evaluación de la infección. La Figura 1 muestra semillas en los seis diferentes niveles de severidad evidenciados y considerados en el presente estudio, lo cual indica que el sistema de inoculación e infección de B. glumae a nivel de semilla fue exitoso, dado que permitió mostrar diferencias en la severidad de la enfermedad, como respuesta a las concentraciones del patógeno utilizadas en las variedades de arroz comerciales evaluadas.
Los resultados del ensayo realizado en la variedad Fedearroz 733 (Figura 2) para identificar el rango de concentración del inóculo del patógeno en el cual se observa desarrollo de la infección, indicaron que no existen diferencias significativas entre variedades y entre tratamientos cuando se emplean concentraciones de la bacteria en un rango entre 1,0x108 y 1,0x106 UFC mL-1). Contrario a esto, cuando se utilizaron las concentraciones inferiores, se observaron diferencias estadísticamente significativas entre variedad y entre tratamientos, lo que llevó a seleccionar éstas como los mejores tratamientos para evaluar la respuesta de todas las variedades de arroz.
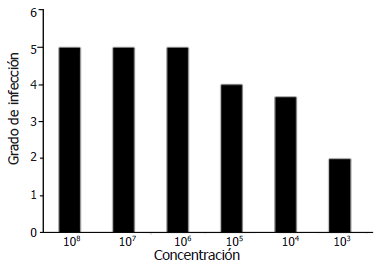
Figura 2. Grado de infección del ensayo preliminar con seis concentraciones del patógeno Burkholderia glumae en la variedad Fedearroz 733.
Evaluación de la severidad de la infección en las diferentes variedades de arroz. De acuerdo a los resultados descritos arriba, las siete variedades de arroz fueron evaluadas empleando tres inóculos bacterianos con concentraciones entre 1,0x105 UFC mL-1 y 1,0x103 UFC mL-1. Se observó infección en todas las semillas inoculadas; sin embargo, se detectaron diferencias estadísticamente significativas entre las variedades, las cuales son indicadas en la Figura 3 y Tabla 1. Estas evaluaciones se hicieron dos veces en tiempos diferentes y en ambas se obtuvieron resultados similares y consistentes, por lo tanto se presentan los datos y análisis de la segunda evaluación.
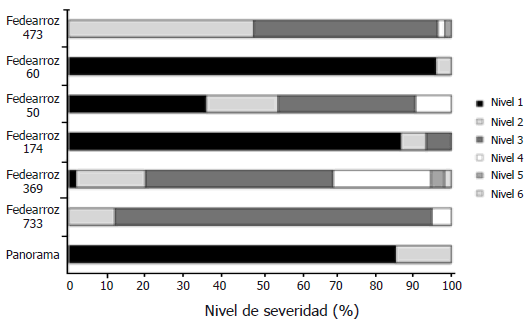
Figura 3. Severidad de la infección de Burkholderia glumae en las semillas de las diferentes variedades de arroz evaluadas a una concentración de inóculo de 1,0 x 104 UFC mL-1.
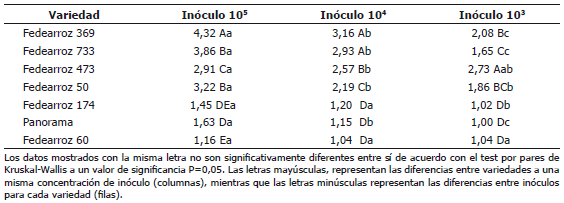
Tabla 1. Grado de infección de Burkholderia glumae en las diferentes variedades de arroz en las tres concentraciones de inóculo evaluadas.
Las semillas de las variedades Fedearroz 60 y Panorama tratadas con suspensiones bacterianas de 1,0 x 104 UFC mL-1 (Figura 3) presentaron los niveles más bajos de infección correspondientes en ambos casos a un nivel dos de severidad, con porcentajes de semilla infectada de 5% y 15% respectivamente. La variedad Fedearroz 174 presentó también un bajo nivel de infección con únicamente 15% de semillas infectadas, la mitad de las cuales se encontraron en nivel tres de infección. En el otro extremo se encontraron las variedades Fedearroz 369 y Fedearroz 473; la primera presentó un 97% de las semillas infectadas, 80% de las cuales se encontraron en nivel tres o superior; además, esta fue la única variedad donde se encontraron los seis niveles de severidad de la enfermedad. La variedad Fedearroz 473 presentó un 55% de las semillas con un nivel de infección tres o superior. Mientras que las variedades Fedearroz 733 y Fedearroz 50 presentan valores de infección intermedios (superiores a los de las variedades Panorama, Fedearroz 174 y Fedearroz 60; pero inferiores a los de las variedades Fedearroz 369 y Fedearroz 473), con alrededor de un 85% a 50% de semillas con niveles de severidad tres y cuatro.
El análisis estadístico mostró que no hay diferencias estadísticamente significativas entre las variedades Panorama, Fedearroz 60 y Fedearroz 174 (P>0,05), pero éstas son significativamente inferiores a las demás variedades cuando son tratadas con suspensiones bacterianas de 1,0 x 103 UFC mL-1 y 1,0 x 104 UFC mL-1 (Tabla 1). La variedad Fedearroz 369 presentó los mayores niveles de severidad cuando es tratada con suspensiones bacterianas a la máxima concentración utilizada (1,0 x 105 UFC mL-1). Mientras que a la menor concentración de patógeno, la variedad Fedearroz 473 presentó el mayor nivel de infección. Las variedades Fedearroz 733 y Fedearroz 50, no presentaron diferencias significativas en términos de severidad cuando se inocularon con la menor y mayor concentración de inóculo.
Al analizar el grado de infección para cada variedad en las diferentes concentraciones de inóculo (Tabla 1), se observa que hay un comportamiento diferencial en términos del grado de infección desarrollado por cada variedad a las diferentes concentraciones. A excepción de la variedad Fedearroz 473, el grado de infección se incrementa a medida que aumenta la concentración del inóculo, siendo generalmente mayor el crecimiento del grado de infección observado entre las concentraciones de 1,0 x 104 UFC mL-1 a 1,0 x 105 UFC mL-1, que el verificado entre las concentraciones de 1,0 x 103 UFC mL-1 a 1,0 x 104 UFC mL-1.
Estudios realizados bajo condiciones de campo por Diago et al. (2009), en los que se analizó la respuesta de 19 variedades de arroz (dentro de las cuales se incluyen las del presente estudio) al añublo bacteriano de la panícula del arroz producido por B. glumae, no mostraron diferencias claras entre variedades susceptibles y tolerantes, dado que todas presentaron algún nivel de incidencia de la infección. Sin embargo, según la escala de incidencia establecida por Pérez y Saavedra (2011), en función de la cual se clasifican las variedades como tolerante, intermedia y susceptible, para evaluaciones realizadas en campo, la variedad Fedearroz 733 presenta un grado de tolerancia alta al patógeno (se enferma pero puede producir un rendimiento normal). Estos resultados no corresponden con lo observado en el presente estudio (Figuras 2, 3 y Tabla 1), ya que dicha variedad fue clasificada como uno de los materiales que presentaron mayor nivel de severidad de la infección en semilla. Del mismo modo, la variedad Fedearroz 174 clasificada en condiciones de campo como susceptible -; intermedia (Pérez, 2010), en el presente estudio presentó un nivel bajo de severidad de la infección.
Según Diago et al. (2009), el nivel de daño de la bacteria en campo está determinado por una compleja interrelación entre clima, variedad, manejo y cantidad de inóculo. Dado que la evaluación de la infección en las variedades evaluadas en el presente estudio se realizó bajo condiciones controladas, las diferencias en la tolerancia/susceptibilidad observada con relación a reportes previos a nivel de campo, es consecuencia de la no intervención de dichos factores medioambientales en el sistema de evaluación desarrollado en este estudio. Los resultados aquí mostrados, son un reflejo de la susceptibilidad intrínseca de cada variedad para desarrollar la enfermedad independientemente de los efectos medioambientales y de manejo que intervienen en el desarrollo de la enfermedad. En este sentido, es posible que variedades como Fedearroz 733, que han sido sugeridas en los estudios en campo como altamente tolerantes a la enfermedad, basen su resistencia en una respuesta a su tolerancia a condiciones de altas temperaturas máximas y mínimas (Castilla et al., 2010), que usualmente promueven el desarrollo de los síntomas de esta enfermedad en campo, más que a su capacidad genética para evitar el desarrollo de esta enfermedad. Por otra parte, es bien conocido el hecho de que B. glumae es capaz de desplegar síntomas de la enfermedad en plántulas de arroz (Saylor et al., 2006), sin embargo, no hay evidencia de que los pocos QTLs identificados actualmente que confieren potencial resistencia contra el desarrollo de los síntomas de esta enfermedad en el estado de floración, estén asociados a resistencia en el estado de plántula de arroz (Pinson et al., 2010). Esta situación, resalta la importancia de buscar modelos alternativos complementarios que proporcionen información acerca de la base genética para la evaluación de la tolerancia/susceptibilidad a la infección con patógenos que como B. glumae, representan nuevos retos desde el punto de vista fitosanitario para el cultivo de arroz en Colombia. En este contexto, la prueba presentada en este estudio contribuye a la evaluación de la base genética de tolerancia a B. glumae en el estado de plántula, en variedades colombianas comerciales de arroz, lo cual es importante para que esta enfermedad que puede ser transmitida a través de la semilla (Saylor et al., 2006; Goto y Ohata, 1956). Así mismo, esta prueba bajo condiciones controladas, evita la intervención de un efecto medioambiental en el desarrollo de la variedad y la enfermedad, permitiendo observar comportamientos diferenciales que representan el potencial genético de tolerancia de la variedad. Esta información cobra importancia toda vez que hasta donde se sabe, actualmente no se han identificado los recursos genéticos que confieran resistencia en arroz a este patógeno en el estado de plántula, información que podría ser útil para el desarrollo de programas de fitomejoramiento, esto sin dejar a un lado estudios en campo que complementen y validen en ultima instancia los resultados obtenidos a través del sistema de infección propuesto en el presente estudio.
Efecto de la concentración del inóculo sobre la severidad de la infección. Como se describió anteriormente, el modelo presentado en este estudio permitió observar diferencias en la severidad de la infección a cada nivel de concentración de inóculo evaluada en las diferentes variedades. En el análisis estadístico mostró que las variedades Panorama, Fedearroz 733 y Fedearroz 369, presentan diferencias estadísticamente significativas (P<0,05) en la severidad entre las tres concentraciones de inóculo; mientras que las variedades Fedearroz 50 y Fedearroz 473 no presentan diferencias entre las concentraciones de inóculo de 1,0 x 103 UFC mL-1 y 1,0 x 104 UFC mL-1, así como en las concentraciones de 1,0 x 105 UFC mL-1 y 1,0 x 104 UFC mL-1, para la variedad Fedearroz 174. La variedad Fedearroz 60 por su parte, que presentó los niveles más bajos de infección, no presentó diferencias significativas en la severidad en ninguna de las tres concentraciones de inóculo evaluadas.
Posteriormente, con el propósito de determinar que tan fuerte era el efecto de la concentración de inóculo sobre la severidad de la infección, se realizó un análisis de correlación entre estas dos variables, (Figura 4). Al analizar los resultados, se observó que para todas las variedades (con excepción de la variedad Fedearroz 473), se encontraron correlaciones positivas, estadísticamente significativas entre las dos variables. Sin embargo, el nivel en que la concentración de inóculo tiene un efecto sobre la severidad de la infección en cada variedad es distinto, destacándose un mayor efecto sobre las variedades que presentan mayores niveles de severidad (Fedearroz 369, Fedearroz 733), y menor para las variedades con menores niveles de severidad (Fedearroz 60).
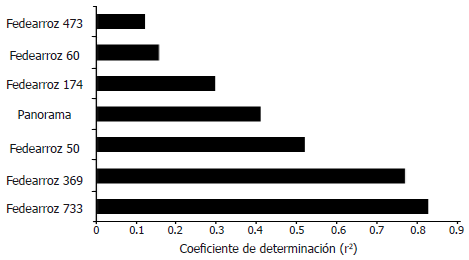
Figura 4. Coeficiente de determinación (r2) de la correlación entre la concentración de inóculo y la severidad de la infección de Burkholderia glumae para las diferentes variedades de arroz evaluadas.
Investigaciones previas en otros patosistemas han indicado, de forma similar a lo observado en el presente estudio, una relación lineal significativa entre la concentración de inóculo y la severidad de la enfermedad (Gray y Achenbach, 1996; Roger et al., 1999; Hong y Hwang, 1998), incluso para patógenos bacterianos (Christiano et al., 2007). En este sentido, Chongo y Bernier (2000), manifiestan que el efecto entre la concentración de inóculo y la severidad de la enfermedad está relacionado con el genotipo de la planta, en la antracnosis de lenteja. Así mismo, Chungu et al. (2001) aprecian una relación más estrecha entre concentración de inóculo y severidad de la infección en cultivares de trigo susceptibles a Septoria tritici, que en cultivares resistentes. Lo anterior, es similar a lo obtenido en este estudio en el que variedades con mayores índices de severidad, presentan una relación más fuerte entre las variables concentración de inóculo y severidad. Sin embargo, otros autores observan que en el patosistema garbanzo Ascochyta rabiei no hay una relación significativa entre concentración de inóculo y severidad para los cultivares susceptibles, pero sí para cultivares moderadamente susceptibles (Trapero y Kaiser, 1992).
Por otra parte, Warren (1975) señala que en cultivares susceptibles de habas, la relación entre la concentración de inóculo de R. solani y la severidad de la enfermedad es curvilinear (a concentraciones bajas de inóculo la relación es lineal, pero a concentraciones mayores de inóculo se observan pocas diferencias), mientras que para cultivares resistentes dicha relación es lineal. Este autor, discute que la relación curvilinear en los cultivares susceptibles, indican la disponibilidad y rápida saturación de sitios infectables o la limitación del huésped de responder a la infección, mientras que en los cultivares resistentes, la relación lineal podría indicar una respuesta generalizada del huésped a la infección. Dado que en este estudio, las variedades que presentaron mayores índices de severidad poseen una relación lineal más fuerte, es posible que a las concentraciones de inóculo evaluadas aún no se saturen los sitios infectables o limiten la respuesta del huésped.
Para B. glumae, la observación de linealidad entre concentración y severidad encontrada en este estudio recobra mayor importancia, dado que se ha reportado que muchos de los factores que determinan su patogenicidad y máxima virulencia, están regulados a través de señales de quórum sensing (QS), es decir que dependen de la densidad de la población para ser expresados. Dentro de estos estudios, se destacan los hallazgos de Kim et al. (2004), quienes demostraron que la señalización por QS es necesaria para la biosíntesis y transporte de la fitotoxina Toxoflavina, la cual es un factor crítico para la patogenicidad de esta bacteria en las plantas de arroz. Años más tarde, el mismo grupo de investigación, también demostró que la síntesis del flagelo de B. glumae está regulada por la acción de moléculas señal de QS, principalmente por su acción sobre el regulador transcripcional de la síntesis de flagelos polares FlhDC, los cuales están involucrados en la motilidad que a su vez desempeña un papel fundamental en su patogenicidad (Kim et al., 2007). Otros estudios, han identificado que la producción de enzimas extracelulares se encuentra igualmente regulada por QS. En este sentido, Devescovi et al. (2007), demostraron que la producción de una lipasa de un aislamiento clínico, capaz de infectar plántulas de arroz, está regulada por mecanismos de QS siendo este un factor importante en la virulencia de éste patógeno en arroz, ya que mutantes para esta enzima exhibían una sintomatología atenuada. Estos hallazgos sugieren entonces que la dosis respuesta encontrada en este estudio, puede estar determinada por la expresión de diferentes factores de virulencia que podrían responder a una regulación dentro del sistema de QS, el cual está presente en la cepa bacteriana empleada en este estudio (resultados no mostrados).
Finalmente, es importante mencionar que la evaluación de la infección a tres concentraciones diferentes es determinante para lograr evidenciar las diferencias entre cultivares, ya que según Warren (1975), líneas con resistencia intermedia podrían ser catalogadas como susceptibles cuando son evaluadas a concentraciones muy altas del agente patógeno. De otro lado, Xue y Hall (1992) refieren que una mayor susceptibilidad se expresa en un rango amplio de concentraciones del inóculo, destacándose que ésta es más evidente a concentraciones más bajas; además, resaltan que las dosis bajas de inóculo podrían ser útiles para la detección de resistencia cuantitativa entre cultivares.
CONCLUSIÓN
El modelo adaptado para el estudio de la infección de B. glumae permitió identificar diferencias entre variedades comerciales de arroz en términos del desarrollo de síntomas de la enfermedad a nivel de semilla. Es importante llevar a cabo estudios de validación de los resultados del presente estudio, hasta el desarrollo completo de la planta a nivel de invernadero y campo y de esta manera determinar la relación, (si existe), entre la tolerancia de las variedades colombianas de arroz a B. glumae en el estado de plántula y en el estado de floración y de esta forma en un futuro emplear este tipo de pruebas para la selección de cultivares resistentes a B. glumae. Por otra parte, este modelo podría ser empleado para el desarrollo de estudios que aborden aspectos relacionados con la interacción entre estos dos organismos, la búsqueda de métodos de prevención-control a nivel de semilla, la determinación de diferencias en la virulencia de aislamientos del patógeno, como prueba complementaria para la clasificación de la susceptibilidad/resistencia de variedades comerciales de arroz a bacterias patógenas y la evaluación de la diseminación de la enfermedad a partir de la semilla entre otros. Lo anterior permite concluir que este estudio representa un aporte importante en el área de fitopatología, considerando la relevancia que ha tomado este patógeno en la cadena productiva del arroz en Colombia.
BIBLIOGRAFÍA
Castilla, L.A, J. Sierra, D. Pineda, J. Echeverry, G. Garcés, R. Perafán, J.J. Ospina y Florez, E. 2010. En: Análisis de la producción arrocera en el Tolima periodo 2009B -; 2010A, http://www.serviarroz.com.co/index/images/pdf/anlisis.pdf. 7 p.; consulta: julio 2011. [ Links ]
Cho, H.S., S.Y. Park, C.M. Ryu, J.F. Kim, J.G. Kim and S.H. Park. 2007. Interference of quorum sensing and virulence of the rice pathogen Burkholderia glumae by an engineered endophytic bacterium. FEMS Microbiology Ecology 60(1): 14-23. [ Links ]
Chongo, G. and C.C. Bernier. 2000. Effects of host, inoculum concentration, wetness duration, growth stage, and temperature on anthracnose of lentil. Plant Disease 84(5): 544-548. [ Links ]
Christiano, R.S.C., M. Dalla Pria, W.C. Jesus Junior, J.R.P. Parra, L. Amorim and A. Bergamin Filho. 2007. Effect of citrus leaf-miner damage, mechanical damage and inoculum concentration on severity of symptoms of Asiatic citrus canker in Tahiti lime. Crop Protection 26(2): 59-65. [ Links ]
Chun, H., O. Choi, E. Goo, N. Kim, H. Kim, Y. Kang, J. Kim, J.S. Moon and I. Hwang. 2009. The quorum sensing-dependent gene katG of Burkholderia glumae is important for protection from visible light. Journal of Bacteriology 191(13): 4152-4157. [ Links ]
Chungu, C., J. Gilbert and F. Townley-Smith. 2001. Septoria tritici blotch development as affected by temperature, duration of leaf wetness, inoculum concentration, and host. Plant Disease 85(4): 430-435. [ Links ]
DANE - Fedearroz. 2010. En: Área, Producción y Rendimientos, http://www.fedearroz.com.co/apr_public.php; consulta: marzo 2011. [ Links ]
Devescovi, G., J. Bigirimana, G. Degrassi, L. Cabrio, J.J. Li Puma, J. Kim, I. Hwang and V. Venturi. 2007. Involvement of a quorum-sensing-regulated lipase secreted by a clinical isolate of Burkholderia glumae in severe disease symptoms in rice. Applied and Environmental Microbiology 73(15): 4950-4958. [ Links ]
Diago, M., J.O Ospina, C.R. Pérez, E. Saavedra, J. Echeverri, A. Cuevas, L.A. Castilla, D.F. Pineda, O. Ramírez y N. Bejarano. 2009. Un buen manejo del cultivo, verdadera barrera contra el añublo bacterial. Revista Arroz 57(482): 30-38. [ Links ]
Espinal, C., H. Martínez y X. Acevedo. 2005. En: La cadena del arroz en Colombia una mirada global de su estructura y dinámica 1991-2005. Ministerio de Agricultura y Desarrollo Rural Observatorio Agrocadenas Colombia, http://www.agronet.gov.co/www/docs_agronet/2005112141728_caracterizacion_arroz.pdf. 38 p.; consulta: junio 2009. [ Links ]
FEDEARROZ, 2009. En: Añublo bacterial de la panícula. http://www.fedearroz.com.co/documentos/2009/Aniublo_bacterial.pdf. 2 p.; consulta: junio 2009. [ Links ]
Goto, K. and K. Ohata. 1956. New bacterial diseases of rice (brown stripe and grain rot). Annals of Phytopathological Society of Japan. 21:46-47. [ Links ]
Gray, L.E. and L.A. Achenbach. 1996. Severity of foliar symptoms and root and crown rot of soybean inoculated with various isolates and inoculum rates of Fusarium solani. Plant Disease 80(10): 1197-1199. [ Links ]
Ham, J.H., R.A. Melanson and M.C. Rush. 2011. Burkholderia glumae: next major pathogen of rice?. Molecular Plant Pathology 12(4): 32-339. [ Links ]
Hong, J.K. and B.K. Hwang. 1998. Influence of inoculum density, wetness duration, plant age, inoculation method, and cultivar resistance on infection of pepper plants by Colletotrichum coccodes. Plant Disease 82(10): 1079-1083. [ Links ]
Instituto Colombiano Agropecuario ICA. 2009. Resolución 3312 de 2009. Diario Oficial No. 47.468. [ Links ]
Kang, Y., J. Kim, S. Kim, H. Kim, J.Y. Lim, M. Kim, J. Kwak, J.S. Moon and I. Hwang. 2008. Proteomic analysis of the proteins regulated by HrpB from the plant pathogenic bacterium Burkholderia glumae. Proteomics 8(1): 106-121. [ Links ]
Kim, J., J.G. Kim, Y. Kang, J.Y. Jang, G.J. Jog, J.Y. Lim, S. Kim, H. Suga, T. Nagamatsu and I. Hwang. 2004. Quorum sensing and the LysR type transcriptional activator ToxR regulate toxoflavin biosynthesis and transport in Burkholderia glumae. Molecular Microbiology 54(4): 921-934. [ Links ]
Kim, J., Y. Kang, O. Choi, Y. Jeong, J.E. Jeong, J.Y. Lim, M. Kim, J.S. Moon, H. Suga, and I. Hwang. 2007. Regulation of polar flagellum genes is mediated by quorum sensing and FlhDC in Burkholderia glumae. Molecular Microbiology 64(1): 165-179. [ Links ]
Lim, J.Y., T.H. Lee, B.H. Nahm, Y.D. Choi, M. Kim and I. Hwang. 2009. Complete genome sequence of Burkholderia glumae BGR1. Journal of Bacteriology 191(11): 3758-3759. [ Links ]
Mosquera, G, 2010. In: Panicle bacterial blight in Colombia: knowing the enemy as a first step in finding control alternatives, http://www.slideshare.net/xescobar/005-panicle-bacterial-blight-in-colombia-gloria-mosquera. 11 p.; consulta: marzo 2011. [ Links ]
Nandakumar, R., M.C. Rush and F. Correa. 2007 Association of Burkholderia glumae and B. gladioli with panicle blight symptoms on rice in Panama. Plant Disease St Paul 91(6): 767. [ Links ]
Nandakumar, R., A.K.M. Shahjahan, X.L. Yuan, E.R. Dickstein, D.E. Groth, C.A. Clark, R.D. Cartwright and M.C. Rush. 2009. Burkholderia glumae and B. gladioli cause bacterial panicle blight in rice in the southern United States. Plant Disease 93(9): 896-905. [ Links ]
Pérez C.R. y E. Saavedra. 2007. En: Añublo bacterial de la panícula del arroz en Colombia Burkholderia glumae (Kurita y Tabei), http://www.fedearroz.com.co/correo/198_art.shtml; consulta: junio 2009. [ Links ]
Pérez, C.R. 2010. Avances en el manejo integrado de Burkholderia glumae. Revista Arroz 58(488): 4-8. [ Links ]
Pérez, C.R. y E. Saavedra. 2011. Avances en el manejo integrado de la bacteria Burkholderia glumae en el cultivo de arroz en el Caribe colombiano. Revista Colombiana de Ciencia Animal 3(1): 111-124. [ Links ]
Pinson, S.R.M., A.K.M. Shahjahan, M.C. Rush and D.E. Groth. 2010. Bacterial panicle blight resistance QTLs in rice and their association with other disease resistance loci and heading date. Crop Science 50(4): 1287-1297. [ Links ]
Roger, C., B. Tivoli and L. Huber. 1999. Effects of temperature and moisture on disease and fruit body development of Mycosphaerella pinodes on pea (Pisum sativum). Plant Pathology 48(1): 1-9. [ Links ]
Sayler, R.J., R.D. Cartwright and Y. Yang. 2006. Genetic characterization and real-time PCR detection of Burkholderia glumae, a newly emerging bacterial pathogen of rice in the United States. Plant Disease 90(5): 603-610. [ Links ]
Shahjahan, A.K.M., M.C. Rush, D. Groth and C. Clark. 2000. Panicle blight recent research points to a bacterial cause. Rice Journal 103: 26-28. [ Links ]
Shingu, Y. and K. Yoneyama. 2004. Essential regulator gene toxR for toxoflavin biosynthesis of Burkholderia glumae. Journal of General Plant Pathology 70(2): 108-114. [ Links ]
StataCorp. 2005. Statistical Software: Release 9. College Station, TX: StataCorp LP. [ Links ]
Suzuki, F., H. Sawada, K. Azegami and K. Tsuchiya. 2004. Molecular characterization of the tox operon involved in toxoflavin biosynthesis of Burkholderia glumae. Journal of General Plant Pathology 70(2): 97-107. [ Links ]
Trapero, A. and W.J. Kaiser. 1992. Influence of temperature, wetness period, plant age, and inoculum concentration on infection and development of Ascochyta blight of chickpea. Phytopathology 82(5): 589-596. [ Links ]
Warren, H.L. 1975. Effect of inoculum concentration on resistance of lima bean to Rhizoctonia solani. Phytopathology 65: 341-345. [ Links ]
Xiong, L. and Y. Yang. 2003. Disease resistance and abiotic stress tolerance in rice are inversely modulated by an abscisic acid-inducible mitogen-activated protein kinase. Plant Cell 15(3): 745-759. [ Links ]
Xue, G. and R. Hall. 1992. Effects of surface wetness duration, temperature, and inoculum concentration on infection of winter barley by Rhynchosporium secalis. Phytoprotection 73(2): 61-68. [ Links ]
Zhu, B., M. Lou, Y. Huai, G. Xie, J. Luo, and L. Xu. 2008. Isolation and identification of Burkholderia glumae from symptomless rice seeds. Rice Science 15(2): 145-149. [ Links ]
Zeigler, R.S. and E. Álvarez. 1989. Grain discoloration of rice caused by Pseudomonas glumae in Latin America. Plant Disease 73:368. [ Links ]














