Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.64 no.2 Medellín July/Dec. 2011
Regeneración Natural del Roble Negro (Colombobalanus excelsa, Fagaceae) en Dos Poblaciones de la Cordillera Oriental de los Andes, Colombia
Natural Regeneration of Black Oak (Colombobalanus excelsa, Fagaceae) in Two Populations from the Cordillera Oriental of the Colombian Andes
César Augusto Parra Aldana1; María Claudia Díez Gómez2 y Flavio Humberto Moreno Hurtado3
1 Ingeniero Forestal. Estudiante Maestría en Bosques y Conservación Ambiental. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias Agropecuarias. A.A. 1779, Medellín, Colombia. <cesaraugusto777@yahoo.es>
2 Profesora Asociada. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias Agropecuarias. A.A. 1779, Medellín, Colombia. <mcdiez@unal.edu.co>
3 Profesor Asociado. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias Agropecuarias. A.A. 1779, Medellín, Colombia. <fhmoreno@unal.edu.co>
Recibido: Marzo 07 de 2011; aceptado: Septiembre 21 de 2011.
Resumen. Colombobalanus excelsa es una especie endémica de la zona andina de Colombia, con cuatro poblaciones aisladas que forman rodales homogéneos denominados robledales negros. Se encuentra en categoría vulnerable de amenaza, debido principalmente a la conversión del bosque para usos agropecuarios; observaciones en campo indican que la regeneración natural bajo su propia cobertura es escasa. Se propone responder las siguientes preguntas: 1. ¿La estructura del bosque evidencia deficiencias en la regeneración natural de dos poblaciones de roble negro localizadas en la cordillera oriental de los Andes? 2. ¿El reclutamiento de fhmoreno@unal.edu.co está limitado por la disponibilidad y viabilidad de las semillas en las dos poblaciones estudiadas? Con este objetivo se establecieron 16 transectos permanentes de 0,1 ha para evaluar la estructura de adultos (DAP>10 cm) y de la regeneración natural. Durante un año se realizó monitoreo sobre las épocas de fructificación, lluvia de semillas, germinación y banco de semillas. Los resultados muestran un suministro extremadamente bajo de renuevos y propágulos de roble negro, lo cual potencialmente puede poner en riesgo la persistencia de estos bosques. Esta situación obedece a diversos factores involucrados en el proceso de regeneración: desde baja producción de semillas de los árboles adultos, altos niveles de depredación pre-dispersión, alta proporción de semillas vacías, baja viabilidad de las semillas sanas, hasta alta mortalidad de las semillas sanas y viables que llegan al suelo. Si bien todos estos factores actúan en cascada, el último de ellos es quizás el que ejerce un efecto más dramático en el bajo éxito reproductivo de esta especie.
Palabras clave: Bosques andinos, fructificación, reproducción sexual, Trigonobalanoideae.
Abstract. Colombobalanus excelsa is an endemic species of the Andean region of Colombia, with four isolated populations, forming pure stands called black oak forests. It has been classified in the threat category ''Vulnerable'', mainly due to conversion of forest to agricultural uses; in addition, field observations indicate that natural regeneration under its own canopy is scarce. In this paper we intend to answer the following two questions: i) ¿Does the forest structure show evidence of deficiencies in the natural regeneration of two populations of black oak located in the eastern cordillera of Colombian Andes? ii) ¿Is the recruitment of fhmoreno@unal.edu.co limited by the availability and viability of seeds in both populations studied? For this purpose, 16 0.1 ha permanent transects were established to evaluate the structure of adults (DBH>10 cm) and natural regeneration. One year monitoring was performed on fruiting times, seed rain, germination, and seed bank. Results show an extremely low supply of seedlings and propagules of black oak, which can potentially endanger the persistence of these forests. This situation is due to various factors involved in the regeneration process: from low seed production of mature trees, high levels of pre-dispersal predation, high proportion of empty seeds, low viability of healthy seeds, to high mortality of the healthy and viable seeds that reach the ground. While all these factors act in cascade, the last one could have the most dramatic effect in the low reproductive success of this species.
Key words: Andean forests, fruiting, sexual reproduction, Trigonobalanoideae.
Los robledales son ecosistemas forestales dominados por especies de la familia Fagaceae ampliamente distribuidos en todo el mundo y de enorme importancia para la humanidad (Manos et al., 2001). En varios de estos ecosistemas se han reportado dificultades en la regeneración de las especies dominantes, como en los robledales de USA y México (Johnson, 2009; Frey et al., 2007; Abrams y Downs, 1990; González et al., 1995), en los de Europa (Plieninger et al., 2010; Pérez, 2007, Pulido, 2002); y en los de Asia (Thadani y Ashton, 1995; Li y Ma, 2003). Algunos de estos estudios establecen que la falta de reclutamiento (particularmente evidenciada en varias especies del género Quercus), podría conducir a la disminución a largo plazo de sus poblaciones naturales (Sork et al., 2002) o a su reemplazo (Nowacki y Abrams, 2008), lo cual incluso podría cambiar la estructura del bosque (Parker y Dey, 2008; Ryniker, et al., 2006; Lorimer et al., 1994).
En Colombia, los pocos estudios de regeneración en robledales, se han desarrollado en bosques donde la especie dominante es Quercus humboldtii (Guerrero et al., 2010; González y Parrado; 2010, Cabezas y Montealegre, 2010; Becerra, 1979) y también se han encontrado problemas en su regeneración natural (León et al., 2009). Colombobalanus excelsa (Lozano et al., 1979; Nixon y Crepet, 1989) conocido como roble negro, es la otra especie de Fagaceae que ocurre en Colombia. Es una especie monotípica y endémica de los bosques andinos premontanos (Cárdenas y Salinas, 2007; Kappelle, 2006). Su distribución actual está restringida a cuatro poblaciones aisladas y muy distantes entre sí, con un área de distribución estimada menor a 1.100 km2. Al igual que otras especies de Fagaceae, el roble negro forma rodales con alta dominancia. Recientemente, las observaciones de campo indican que también en roble negro la regeneración natural bajo su propia cobertura es escasa.
Puesto que la persistencia en el largo plazo de las poblaciones naturales de plantas depende del éxito de su regeneración natural, la identificación de los factores que lo afectan es un aspecto fundamental de la ecología de cualquier especie (Silvertown y Law, 1987, Grime y Hillier 2000). En roble negro, tal identificación es más crucial aún debido a que en el futuro inmediato será necesario desarrollar acciones de conservación y restauración activas para evitar su inminente extinción. Como se dijo, esta especie es endémica de los bosques andinos de Colombia, con un área de distribución natural muy restringida, la cual están disminuyendo a gran velocidad por causa de la expansión de cultivos como el café y la extracción selectiva de su madera, entre otros (Botero et al., 2010); de hecho se encuentra incluida en la categoría ''vulnerable'' de amenaza (Cárdenas y Salinas, 2007; Ministerio de Ambiente, Vivienda y Desarrollo Territorial, 2010), pero probablemente muy pronto estará en una categoría mayor debido a la velocidad con la que aumenta el riesgo para esta especie.
Aunque la regeneración involucra una serie compleja de procesos interdependientes, se han identificado dos tipos básicos de limitaciones para su establecimiento: 1. disponibilidad de semilla; es decir, el suministro insuficiente de semillas condiciona el reclutamiento; y 2. restricción por establecimiento; es decir, la disponibilidad insuficiente de micro-sitios adecuados confina el reclutamiento (Eriksson y Ehrlen, 1992, Clark et al., 1998; Muller et al., 2002; Nathan y Muller, 2000, Münzbergova y Herben, 2005). En algunas especies uno de estos dos factores es más determinante en el establecimiento de la regeneración (Eriksson y Ehrlen, 1992; Clark et al., 1998), pero en otras, por la combinación de ambos factores (Münzbergova y Herben, 2005).
Se han identificado al menos las siguientes tres causas relacionadas con la disponibilidad de semillas 1. insuficiente suministro de semillas para germinar (limitación por fuente) (Eriksson y Ehrlen, 1992); este a su vez está determinado por la abundancia de adultos de la especie (densidad de la fuente) y por su fecundidad (vigor de la fuente) (Clark et al., 1998). La fecundidad, por su parte, puede verse afectada por la baja viabilidad de las semillas debido a la escasa deposición de granos de polen sobre los estigmas de los árboles parentales (Wilson y Burley, 1983) o por la depresión endogámica como consecuencia del cruzamiento entre parientes cercanos (Reed y Frankham, 2003, Petit y Hampe, 2006), la cual puede ocurrir principalmente en poblaciones aisladas de bosques fragmentados (Lowe, 2005). 2. Falla en la dispersión de semillas hasta los sitios potenciales de reclutamiento (limitación por dispersión) (Schupp et al., 2002, Turnbull et al., 2000). 3. Depredación y daño de las semillas antes de su dispersión (Hulme, et al., 2002; Curran y Leighton, 2000).
El roble negro es una especie muy poco estudiada, a pesar de su enorme importancia e inminente peligro de desaparición, por lo cual se desconocen los factores y procesos que podrían estar impidiendo el éxito de su regeneración natural. Los únicos estudios realizados hasta hoy en roble negro, han establecido la posible afectación de la viabilidad de sus semillas por problemas de endogamia o dificultades en el flujo genético (Aguirre, 2009; Palacio y Fernández, 2006).
La investigación pretende responder las siguientes preguntas: 1. ¿La cantidad de renuevos es suficiente para garantizar la persistencia de la población en el largo plazo? 2. ¿Existen evidencias que permitan afirmar que el proceso de regeneración de roble negro es deficiente? Con base en las observaciones preliminares, se postula que la regeneración natural de roble negro, en las dos poblaciones localizadas en la cordillera oriental de los Andes de Colombia, es insuficiente para garantizar la persistencia de esta especie, debido a varios procesos asociados con la limitación por semillas, lo cual podría conducir a su reemplazo en el largo plazo.
MATERIALES Y MÉTODOS
Área de estudio. Este estudio se realizó en las dos áreas de distribución natural del roble negro en la cordillera oriental de Colombia: una al sur del departamento del Huila, en los municipios de Acevedo, Pitalito, Suaza y Timaná (entre las coordenadas planas Xmin: 776.935 - Xmax: 807.648 y Ymin: 676.772 - Ymax 699.428) y otra al oriente del departamento de Santander, en el municipio de Charalá (entre las coordenadas: Xmin: 1.094.266 - Xmax: 1.098.215 y Ymin: 1.166.640 y Ymax: 1.173.121). (Figura 1). Estos bosques se localizan en un rango altitudinal que va desde 1.550 a 2.000 msnm.

Figura 1. Distribución de la especie Colombobalanus excelsa en Colombia. Poblaciones estudiadas de roble negro (•), otras poblaciones de roble negro ( ).
Los bosques de roble negro del Huila se distribuyen sobre la cordillera oriental y un ramal montañoso conocido como serranía de Peñas Blancas o cuchilla de San Marcos, en la cuenca alta del río Magdalena. Las montañas son de rocas sedimentarias compuestas por areniscas, arcillas rojas y grises, conglomerados y aglomerados con acumulación de cenizas volcánicas (Cárdenas et al., 2002), que han dado origen a suelos franco-arcillo-arenosos, en paisajes de laderas largas y fuertes pendientes. La precipitación media anual es de 1.249 mm, bajo un régimen con tendencia monomodal y temperatura promedia de 20,6 ºC (Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt -IavH, 2005). El uso principal de la tierra es el cultivo de café y los frutales de clima frío moderado (Botero et al., 2010).
En el departamento de Santander, los bosques de roble negro se restringen a un territorio perteneciente al corregimiento de Virolín (municipio de Charalá), cuenca del río Oibita y microcuenca de la quebrada La Lejiana. Se trata de relictos de vegetación sobre paisajes de lomerío y valles fuertemente disectados, cuyo relieve ha sido influenciado por las corrientes hidrográficas y procesos erosivos (Pulido, 1980). En la región predominan dos expresiones topográficas: la zona montañosa abrupta, con pendientes que varían entre 25 y 45%, y regiones con relieve plano o suavemente ondulado, formadas por depósitos fluvioglaciares del cuaternario mezclados con materiales de naturaleza blanda como arcillas y lutitas (Pulido, 1980). El uso principal de la tierra corresponde a pastos manejados y en menor escala a cultivos de café. La precipitación media es de 2.643 mm anuales y la temperatura varía entre 17 y 24 ºC (Municipio de Charalá, 2002).
Especie estudiada: El roble negro es un árbol emergente del bosque, que puede alcanzar de 20 a 40 m de altura, con copa globosa y fuste recto, de más de 1 m de diámetro a la altura del pecho, con pequeñas raíces tablares y en gran proporción libre de ramas. Es una especie monoica, con flores masculinas en espigas axilares de 13 a 18 cm y flores femeninas en espigas de 13 cm, sésiles y dispuestas en cúpulas (Lozano et al., 1979). De acuerdo con la morfología floral, es probable que la polinización se realice por viento (Nixon y Crepet, 1989; Nixon, 2008). Los frutos son cúpulas escamosas y erectas que sostienen las semillas cuya forma es ovada-subtriangular, de 8 a 11 mm de longitud y con cotiledones oleíferos. Las semillas se dispersan principalmente por gravedad favorecida por la acción de animales frugívoros que desprenden los frutos; los animales o la escorrentía también mueven los frutos caídos a pequeñas distancias (Hernández et al., 1980). La germinación es de tipo epigea o fanerocotilar (Lozano et al., 1979).
Evaluación de la estructura de los individuos adultos y de la regeneración de roble negro. Para la medición de los árboles adultos (individuos con diámetro normal-DN igual o superior a 10 cm), se instalaron en forma aleatoria 16 transectos de 0,1 ha (50 m x 20 m) en bosques de roble negro: 8 en Santander y 8 en el Huila. A cada individuo se le midió el diámetro del fuste a 1,30 m de altura sobre el suelo (DN), con cinta métrica. Para evaluar la regeneración natural (individuos con DN < 10 cm), se establecieron 48 parcelas de regeneración de 100 m2 (10 m x 10 m) distribuidas sistemáticamente dentro de los transectos ya descritos (3 parcelas por transecto, localizadas en dos esquinas y en la mitad del transecto). Para este análisis, la regeneración natural se dividió en dos grupos: juveniles (árboles con altura H > 150 cm y DN < 10 cm) y renuevos (árboles con H < 150 cm). La altura total de los renuevos se midió con cinta métrica hasta la yema terminal (precisión de 1 cm) y el diámetro normal de los juveniles con calibrador digital (precisión de 0,01 mm). Todos los individuos fueron marcados con una placa metálica y un número consecutivo. Para evaluar la cantidad de plántulas que se establecieron después de un año de iniciado el estudio, se realizó un nuevo censo de todos los individuos existentes en las parcelas de regeneración.
La distribución diamétrica de cada zona de estudio (Huila y Santander), se evaluó mediante el histograma de frecuencias con base en los individuos con DN > 0,01 cm; para ello se establecieron clases diamétricas de igual amplitud y se contabilizó la frecuencia de los individuos por hectárea en cada clase. Así mismo, se construyó el histograma de frecuencias de la distribución de alturas de los renuevos (individuos con H < 150 cm) para cada zona, separados en las categorías plántulas (H < 50 cm), brinzales 1 (50 cm < H < 100 cm) y brinzales 2 (100 cm < H < 150 cm). En todos los casos, las frecuencias de los individuos en cada clase se extrapolaron a valores por hectárea, mediante el uso de factores de expansión apropiados, según el área muestreada en la categoría correspondiente.
Mediante el estadístico t de Student para datos distribuidos normalmente, o W de Wilcoxon para datos que no cumplen el supuesto de normalidad (Gómez, 1997), se realizaron comparaciones entre las dos zonas de estudio de la densidad de individuos para cada clase de tamaño evaluada: adultos, juveniles y renuevos (de manera separada para cada una de las tres categorías consideradas).
Monitoreo de la producción de semillas. Se realizó el seguimiento de la producción de semillas en las dos poblaciones de roble negro, en 10 individuos por población, un número considerado por Fournier (1974) como suficiente para caracterizar la fenología en poblaciones de árboles tropicales. Para este propósito, se seleccionaron al azar individuos adultos, con DN > 30 cm. Las observaciones se realizaron mensualmente, desde marzo de 2009 hasta mayo de 2010 en Santander y de mayo de 2009 a junio de 2010 en Huila. La intensidad del fenómeno en cada individuo se cuantificó en una escala de 0 a 4, de acuerdo a la proporción de la copa del árbol que presenta el evento (0: ausencia, 1: presencia de semillas en 1 a 25% de la copa del árbol, 2: en 26 a 50%, 3: en 51 a 75% y 4: en 76 a 100%) (Fournier, 1974; Fournier y Charpentier, 1975). A partir de los datos registrados en cada árbol, se calculó el Índice de Valor Fenológico (IVF) mensual para la población, como un indicador de la intensidad de la fructificación en la población. Este índice expresa la proporción entre la ocurrencia observada del evento y el valor máximo que podrían alcanzar el evento. Así, el IVF se obtiene sumando las calificaciones obtenidas por cada árbol y dividiendo este valor por la máxima calificación que podría alcanzar la población (los 10 individuos muestreados en cada zona). Con los datos obtenidos cada mes, se evaluó el comportamiento del evento en el tiempo.
Lluvia de semillas. La caída de semillas se monitoreó en 48 trampas circulares (24 en Huila y 24 en Santander), fabricadas de tela de malla con un área de 0,75 m2 cada una y apoyadas en 3 tubos de PVC a 1 m de altura sobre el suelo, con el fin de minimizar el ataque de depredadores (Stevenson y Vargas, 2008). Las trampas se distribuyeron al azar dentro de los transectos (3 trampas por transecto). Todo el material capturado se colectó mensualmente, desde mayo de 2009 hasta mayo de 2010. Las muestras se llevaron al Laboratorio de Ecología (Universidad Nacional de Colombia, Sede Medellín), donde se separaron las semillas de roble negro del resto de material y se clasificaron de acuerdo con las siguientes categorías: semillas sanas (enteras, sin ataques de patógenos o insectos), semillas fraccionadas (partidas o mordidas por predadores), semillas con pudrición y perforaciones (con ataques evidentes de patógenos ó insectos). Los valores de lluvia de semillas obtenidos en cada localidad se extrapolaron a valores por hectárea mediante el uso de factores de expansión apropiados.
Germinación y viabilidad de semillas. Para realizar las pruebas de germinación, en abril de 2009 se colectaron en Santander, semillas maduras de cinco árboles que tenían una cosecha abundante (cantidad similar de semillas por árbol). Se cosecharon semillas maduras y sanas (sin evidencias de ataques de patógenos ó insectos). Los indicadores de madurez fisiológica de la semilla fueron los cambios de color (de verde claro a marrón oscuro), de consistencia (suculenta a leñosa) y de tamaño (de 8 a 11 mm). Las semillas se transportaron en un contenedor hermético entre aserrín húmedo. Una vez en el laboratorio se sembraron 4 repeticiones de 100 semillas cada una, en cubetas de germinación plásticas, utilizando como sustrato una capa de cuarzo fino estéril. No se aplicaron tratamientos pre-germinativos, porque se trata de evaluar la latencia natural de la especie. Las semillas se regaron con agua destilada según necesidad y se verificó diariamente la germinación acumulada. A las semillas que no germinaron después de cuatro meses, se les aplicó una prueba de viabilidad, mediante el corte o escisión del embrión. Para estos procedimientos se siguieron los protocolos del International Seed Testing Association (ISTA, 2005). Todas las pruebas fueron realizadas en el Laboratorio de Ecología de la Universidad Nacional de Colombia, Sede Medellín.
Banco de semillas. Para evaluar la acumulación de semillas viables de roble negro en el suelo, localizadas en las parcelas de regeneración, se tomaron 48 muestras (24 en Santander y 24 en Huila, a razón de 3 muestras por transecto). Se utilizó un marco metálico cuadrado de 10 cm de lado, para tomar una muestra que incluyera la hojarasca y el suelo hasta una profundidad de 5 cm. La hojarasca se revisó manualmente para extraer las semillas de roble y ponerlas a germinar para verificar su viabilidad. El suelo de cada muestra se distribuyó en una bandeja de germinación formando una capa delgada (0,5 cm) sobre un sustrato de de cuarzo (Dalling et al., 1994). Todas las bandejas se protegieron con una lámina transparente de plástico y se instalaron en viveros transitorios localizados cerca a los sitios de muestreo. Se evaluó la germinación durante cuatro meses después de la siembra. El muestreo se repitió tres veces durante un año (abril, agosto y noviembre de 2009), en cada zona de estudio (Santander y Huila), con el fin de evaluar el banco de semillas del suelo, antes, durante y después de los eventos de fructificación.
RESULTADOS
Estructura de los individuos adultos y de la regeneración de roble negro. En ambas poblaciones la estructura diamétrica del roble negro presentó forma de J invertida, pero con grandes diferencias entre ellas en la cantidad de individuos por categoría (Figura 2). La densidad de individuos adultos por ha fue significativamente superior en Huila que en Santander (430 vs. 208, respectivamente. P < 0,023 para el estadístico t). La densidad de juveniles por ha en Huila fue casi cinco veces la de Santander (808 individuos ha-1 vs. 175, respectivamente). No obstante, las diferencias entre localidades en esta categoría no fueron significativas (P = 0,10 para el estadístico W), debido probablemente a la gran variabilidad de las densidades entre los transectos de Huila (desviación estándar de 837 individuos ha-1) en comparación con los de Santander (desviación estándar de 102 individuos ha-1).
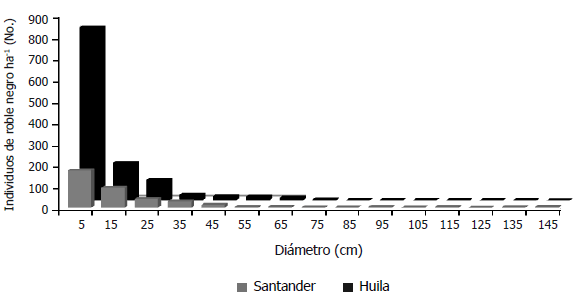
Figura 2. Distribución diamétrica de árboles de roble negro Colombobalanus excelsa para individuos con altura H > 150 cm, en dos poblaciones de la cordillera oriental de Colombia.
La distribución de la regeneración (individuos con altura menor de 1,5 m) por clases de altura, fue diferente entre las dos poblaciones (Figura 3). En todas las clases de tamaño las abundancias en Huila fueron significativamente superiores a las de Santander (P = 0,024 para plántulas; P = 0,0006, para brinzales 1, y P = 0,0004, para brinzales 2).
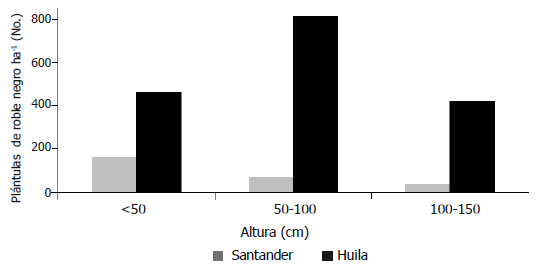
Figura 3. Distribución de renuevos de roble negro Colombobalanus excelsa (individuos con altura H < 150 cm) según categoría de tamaños en dos poblaciones en la cordillera oriental de Colombia.
En Santander, la mayor abundancia se presentó en la categoría más pequeña, que hemos denominado plántulas H = 0,5 m (Figura 3), con diferencias significativas respecto a las otras dos categorías. En Huila, la abundancia de plántulas fue significativamente menor que la abundancia en la siguiente categoría de tamaño, que hemos denominado brinzales 1 (50 cm = H =100 cm) y similar a la que se presentó en la categoría brinzales 2 (Figura 3).
Producción de semillas. Se presentaron diferencias en la intensidad y periodicidad de la producción de semillas de roble negro entre ambas poblaciones durante el período evaluado. En Huila solamente produjo semillas un árbol de los diez seleccionados, mientras que en Santander seis de los diez árboles produjeron semillas (Figura 4). En Santander la población de roble negro presentó dos períodos de producción de semillas durante el año evaluado. El primer período ya estaba finalizando cuando empezaron las mediciones, pero el segundo período se pudo observar desde el inicio hasta su finalización. Este segundo período de producción de semillas duró seis meses y se mantuvo con una intensidad baja, con un máximo valor fenológico de 15% en el mes de febrero de 2010, al final del período de menor precipitación en la zona. En Huila no se presentó producción de semillas durante el año inicialmente considerado para la evaluación (marzo de 2009 a marzo de 2010), por lo cual se amplió el período de evaluación por otros tres meses; solamente al final de este nuevo período de evaluación un árbol empezó a producir semillas. Lluvia de semillas. El ingreso de semillas de roble negro a través de la lluvia de semillas durante el año de seguimiento, resultó diferente para las dos poblaciones evaluadas (Tabla 1). En Santander, la lluvia de semillas ocurrió en dos períodos del año: en mayo de 2009 y marzo-abril de 2010; es decir, el tiempo transcurrido entre los dos períodos de caída de semillas fue de diez meses y cada uno de ellos tuvo una corta duración, pues apenas si superó un mes calendario. Entre tanto, en los bosques del Huila, la lluvia de semillas se registró solamente en dos transectos y ocurrió al final del año (principalmente de octubre a diciembre de 2009), por lo que se consideran como eventos aislados. Estas cronologías de la lluvia de semillas se corresponden con las épocas de producción de semillas en cada localidad, descritas atrás (Figura 4).
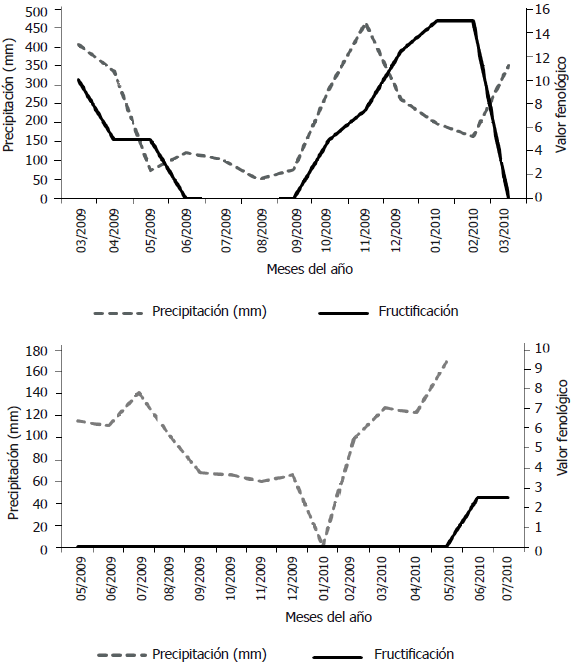
Figura 4. Producción de semillas en dos poblaciones de roble negro Colombobalanus excelsa en la cordillera oriental de los Andes de Colombia: Santander (figura superior) y Huila (figura inferior) en el año 2009-2010. Se presenta también la precipitación mensual de cada zona durante el mismo período.
Tabla 1. Ingreso de semillas de roble negro Colombobalanus excelsa en dos poblaciones de la cordillera oriental en los Andes de Colombia, durante un año de seguimiento y clasificación del estado físico y sanitario de las mismas.
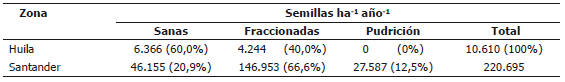
El ingreso de semillas sanas de roble negro por lluvia de semillas en los bosques de Santander fue de 49.444 semillas ha-1 (EE = 25.894) y en los del Huila de 6.667 semillas ha-1 (EE = 6.057). Tabla 1. Estos resultados son coherentes con lo encontrado en el seguimiento a la producción de semillas de los árboles, cuyos valores máximos también resultaron superiores en Santander que en Huila. La evaluación física de las semillas recogidas en las trampas, mostró que un 40,0% en el Huila y un 66,6% en Santander presentaron daños por fraccionamiento; adicionalmente, un 12,5% de las semillas de Santander presentaron pudrición (Tabla 1).
La ocurrencia de un ciclo reproductivo completo durante el año de evaluación fenológica en los bosques de roble negro de Santander, permitió evaluar la correspondencia entre los períodos de fructificación de los árboles objeto de seguimiento fenológico y los períodos de mayor ingreso de propágulos por lluvia semillas (Figura 5).
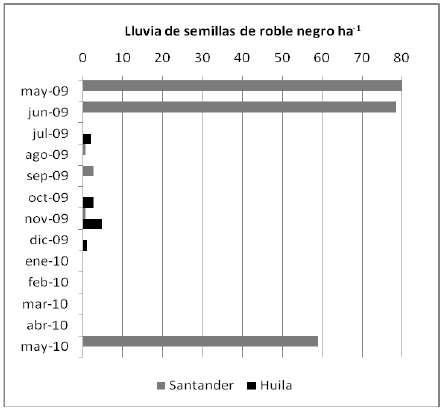
Figura 5. Cantidad de semillas de roble negro Colombobalanus excelsa (estimada en miles ha-1) para dos poblaciones de la cordillera oriental de Colombia, partir de su captura en trampas de lluvia de semillas entre mayo de 2009 y mayo de 2010.
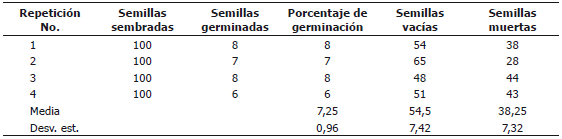
Germinación y viabilidad de semillas. Los resultados de las pruebas de germinación arrojaron un porcentaje de germinación muy bajo (media = 7,25, DE = 0,96%) (Tabla 2). Por su parte, el análisis de viabilidad aplicado a las semillas que no germinaron mediante el corte o escisión del embrión, mostró que el 54,5 % (DE = 7,42) estaban vacías (carecían de embrión) y 38,25% (DE = 7,32) estaban muertas o descompuestas, posiblemente por el ataque de patógenos (Tabla 2).
Tabla 2. Pruebas de germinación y viabilidad de semillas de roble negro Colombobalanus excelsa colectados en la cordillera oriental de los Andes de Colombia.
Banco de semillas. No se encontraron semillas de roble negro en las muestras de hojarasca del suelo, tampoco se produjeron plántulas de roble negro en los ensayos de germinación de los primeros cinco centímetros de suelo, a pesar de haberse registrado dos períodos de fructificación durante el año en Santander, y haber realizado muestreos repetidos durante el año. No obstante, germinaron numerosas plantas de otras especies, tanto en las muestras de hojarasca como en las pruebas de germinación del banco de semillas (datos no mostrados).
DISCUSIÓN
¿La cantidad de renuevos es suficiente para garantizar la persistencia de la población en el largo plazo? Las distribuciones diamétricas en forma de J invertida de las dos poblaciones de roble negro (Figura 2), muestran que se trata de poblaciones disetáneas, con una estructura de tamaños aparentemente balanceada, en la cual existe una mayor cantidad de individuos en las categorías diamétricas menores. Así mismo, estos resultados demuestran la capacidad de la especie para establecer con éxito su regeneración natural bajo el dosel del bosque, la cual potencialmente reemplazará a los individuos adultos cuando éstos lleguen a la senectud. En consecuencia, aparentemente la persistencia de la población no estaría en riesgo (Rollet, 1980; Lamprecht, 1990).
No obstante, la distribución de alturas de los renuevos de roble negro (aquellos con H < 1,5 m), mostró un comportamiento distinto al descrito en el párrafo anterior, pues su densidad fue muy baja (1.704 y 275 individuos ha-1 en Huila y Santander, respectivamente) comparada con ecosistemas similares dominados por Fagaceas (Kappelle, 1996; Gutiérrez et al., 2004; Gómez, 2008; Guerrero et al., 2010) y con los valores esperados para esta categoría, los cuales suelen ser muy superiores a los encontrados en la categoría inmediatamente superior. Por ejemplo, la regeneración evaluada en robledales tropicales de Costa Rica, similares a los bosques de este estudio, presentó un total de 148.000 plántulas ha-1 de Q. copeyensis para individuos menores a 0,5 m de altura (Saenz, 1990); en otro estudio, Guariguata y Sáenz (2002), encontraron una densidad de 11.000 plántulas ha-1 de Q. costarricensis, mientras que en Colombia se registraron apenas 467 plántulas en Huila y 167 plántulas en Santander menores de 50 cm de altura ha-1.
Debido a la alta mortalidad natural en el piso del bosque de las plántulas recién germinadas se requiere un alto número de éstas para mantener la estructura balanceada del bosque en el largo plazo. Por ello, el suministro tan bajo de renuevos de roble negro en el presente estudio, sugiere que podría estar en riesgo la persistencia de esta especie. En este punto es importante considerar las densidades de juveniles (árboles menores de 10 cm de DN), cuyos valores (808 individuos ha-1 frente a 175, en Huila y Santander, respectivamente), en principio están dentro de lo esperado en estructuras disetáneas (Lamprecht, 1990). Pero en ambos bosques, las varianzas fueron mucho mayores que las medias, sobre todo en Huila, lo cual muestra la inmensa variabilidad de la densidad de juveniles entre transectos. Aquellos con mayor densidad de juveniles presentaron mayor densidad de madera muerta, bien sea por disturbios naturales o por explotaciones selectivas (datos no mostrados). La explotación controlada de bosques de roble ha sido una herramienta eficaz para promover su regeneración natural (Guariguata y Saenz, 2002; Guerrero et al., 2010); las causas de este comportamiento son complejas y serán abordadas más adelante.
¿Existen evidencias que permitan afirmar que el proceso de regeneración de roble negro es deficiente? Para que se presente regeneración natural exitosa por la vía sexual (la reproducción asexual se descartó, pues las observaciones preliminares mostraron que es poco viable en esta especie) se requiere que previamente hayan tenido lugar, también exitosamente, varios procesos: producción de semillas, que éstas se dispersen e ingresen al piso del bosque (lo que se conoce como lluvia de semillas), que las semillas germinen y que una vez germinadas, las plántulas se establezcan (Pérez, 2007). A continuación se examinarán estos procesos y su contribución en el éxito reproductivo de la especie.
La fructificación mostró ritmos e intensidades diferentes en ambas localidades (Figura 4), lo cual puede deberse a las interacciones con el ambiente local y evidencia una alta variabilidad intra-específica en la fenología reproductiva. Aun así, la especie exhibió un gran esfuerzo reproductivo al menos en Santander, donde se presentó un ciclo reproductivo completo, con un estimado total de por lo menos 220.000 semillas ha-1 año-1, muy superior al de Huila, donde la producción anual de semillas por hectárea apenas si superó las 10.000. Aunque en este estudio no fue posible estimar la cantidad real de semillas producidas debido a la abundante depredación pre dispersión, el seguimiento a la fructificación sugiere la baja intensidad de esta fenofase en Huila durante el período de evaluación. Curiosamente, son estos bosques los que presentaron mayor densidad de individuos adultos, con capacidad reproductiva (184 frente a 113 individuos ha-1 > 20 cm DN en Huila y Santander, respectivamente). Así mismo, se apreció que los árboles de roble negro localizados en los bordes de bosque, o aislados, fructifican copiosamente, lo cual también ha sido observado en otros bosques de roble (Guarigiata y Saenz, 2002); por ello, se propone que la competencia intraespecífica por recursos (principalmente luz y nutrientes) y las limitaciones al transporte de polen por el viento en bosques muy cerrados con gran distancia entre fragmentos, pueden ser factores que limitan la producción de frutos de esta especie, lo cual explicaría, al menos parcialmente, la mayor regeneración natural en bosques sometidos a disturbios naturales o antrópicos. Sin embargo, no se descarta que además se esté registrando una temporada transitoria de baja producción de semillas, ocasionada por una estacionalidad multianual en las fases reproductivas, lo cual requiere estudios de más largo plazo.
Se conoce que las semillas de roble negro tienen alto contenido alimenticio y agradable sabor, por lo que son una fuente nutricional para algunas especies de aves (Hernández et al., 1980). Esta es probablemente la causa de las visitas masivas de loras de diferentes especies durante la época de fructificación que consumían sus semillas, lo cual se hizo evidente en la alta proporción de semillas fraccionadas que se colectaron en las trampas; 40% en Huila y 66,6% en Santander (Tabla 1), así como por la gran cantidad de ramos con frutos verdes encontrados en el suelo del bosque. La proporción de semillas consumidas debe ser mucho mayor que los valores encontrados, pues es previsible que muchas de ellas sean consumidas totalmente en la copa del árbol, por lo cual no quedaron registradas en las trampas de lluvia de semillas. Estos efectos de la depredación pueden estar fuertemente influenciados, no solo por la escasez de alimentos en estos bosques dominados por roble negro, sino también por su creciente fragmentación (Kolb y Diekmann, 2005), según se ha establecido recientemente para el departamento del Huila en términos de pérdida de coberturas boscosas (Asociación Grupo Arco, 2008). El aporte potencial de propágulos a través de la lluvia de semillas, supone una importante vía reproductiva para la especie, según los datos obtenidos en Santander, donde ingresaron más de 46.000 semillas sanas ha-1 mientras que en Huila la estimación apenas superó las 6.300 semillas ha-1 durante los trece meses de monitoreo. No obstante, la baja viabilidad de las semillas, según las pruebas de germinación de laboratorio (7,5%), supone un obstáculo grande para la regeneración exitosa. Si esta viabilidad fuera similar a la que se presenta bajo condiciones del bosque, solamente unas 3.450 semillas en Santander y 473 en Huila de las que llegaron al suelo durante el año de monitoreo, estarían en condiciones de germinar. No obstante, los ingresos de plántulas en Santander, donde se presentaron dos períodos efectivos de lluvia de semillas, fueron extremadamente bajos: el equivalente a 21 plántulas ha-1, mientras que en Huila, no se registró el ingreso de una sola plántula. Estos resultados sugieren una tasa de mortalidad muy alta (superior al 99%) de las semillas viables y sanas, la cual se constituye en un obstáculo adicional para el éxito de la regeneración de roble negro.
La baja producción de semillas en algunos años y su baja viabilidad se podrían ver compensadas con la acumulación temporal de semillas en el suelo. No obstante, el análisis del banco de semillas germinable mostró que esta especie no forma bancos de semillas, pues no se registró ningún propágulo viable en los ensayos establecidos. Según estos resultados, las semillas que caen al suelo mueren si no germinan de inmediato o en un período corto de tiempo, quizás dentro de las dos semanas siguientes a la caída. Esta conclusión se apoya además en los resultados de las pruebas de germinación, la cual comenzó al cuarto día de iniciada la prueba y concluyó al décimo día. Por ello, otra causa posible de la baja abundancia de plántulas es la alta mortalidad de semillas viables, debido a que probablemente muchas de ellas no encuentran un ambiente propicio para la germinación en el piso del bosque. Pero el bajo éxito reproductivo de las semillas viables que alcanzan el piso también puede deberse a la depredación de las semillas o plántulas recién germinadas, por roedores y otros animales, más aún considerando el tipo de germinación epigea fanerocotilar del roble negro que expone los cotiledones de alto contenido alimenticio y agradable sabor.
Finalmente, no se puede descartar un proceso de deriva genética, ya documentado para esta especie (Palacio y Fernández, 2006), que si bien puede llevar muchos años de gestación, apenas comienza a expresarse de manera evidente y que podría estar generando una progresiva disminución de la capacidad reproductiva de la especie (Swaine et al., 1987). La alta proporción de semillas vacías, 54,5% (Tabla 2), podría ser un síntoma de los efectos de la reducción, aislamiento actual y endogamia de las poblaciones como resultado de la fragmentación (Wang, 2003, Dick et al., 2008, Collevatti et al., 2009.). Esclarecer esta cuestión requerirá de estudios de largo plazo, así como la inclusión de las generaciones de árboles más recientes y no solo los árboles adultos, considerando que el roble negro es una especie longeva.
Los resultados encontrados sugieren un suministro extremadamente bajo de renuevos y propágulos de roble negro, lo cual potencialmente puede poner en riesgo la persistencia de estos bosques. Esta situación obedece a diversos factores involucrados en el proceso de regeneración: desde baja producción de semillas de los árboles adultos, altos niveles de depredación pre-dispersión, alta proporción de semillas vacías, baja viabilidad de las semillas sanas, hasta alta mortalidad de las semillas sanas y viables que llegan al suelo. Si bien todos estos factores actúan en cascada; el último de ellos, es quizás el que ejerce un efecto más dramático en el bajo éxito reproductivo de esta especie.
BIBLIOGRAFÍA
Abrams, M.D. and J.A. Downs. 1990. Successional replacement of old growth white oak by mixed mesophytic hardwoods in southwestern Pennsilvanya. Canadian Journal of Forest Research 20(12): 1864-1870. [ Links ]
Aguirre, N. 2009. Estructura poblacional y diversidad genética de Colombobalanus excelsa en cuatro fragmentos de la serranía de Peñas Blancas departamento del Huila. Trabajo de grado programa de Biología. Facultad de Ciencias Exactas y Naturales. Universidad de Caldas, Manizales. 42 p. [ Links ]
Asociación Grupo ARCO. 2008. Plan General de Ordenación Forestal del Huila. Informe final. Convenio 191 de 2007. Corporación Autónoma Regional del Alto Magdalena CAM-Asociación Grupo Arco, Bogotá D.C. 139 p. [ Links ]
Becerra, J.E. 1979. Ensayo comparativo de tres sistemas silviculturales en un bosque secundario de roble (Quercus humboldtii). Instituto de Investigaciones y Proyectos Forestales y Madereros. Universidad Distrital de Bogotá, Bogotá. 26 p. [ Links ]
Botero, V., M.C. Díez, C.A. Parra, J. Serna, L. Adames y N. Rodríguez. 2010. Plan de conservación para la especie amenazada roble negro-Colombobalanus excelsa (Lozano, Hdz-C. y Henao) Nixon y Crepet, en los ecosistemas de interés del departamento del Huila. Informe de Convenio 210 CAM-Universidad Nacional de Colombia, Sede Medellín, Medellín. 105 p. [ Links ]
Cárdenas, J., J. Fuquen y A. Nunes. 2002. Geología de la plancha 388 Pitalito. Memoria Explicativa Plancha 388: Escala 1:100.000. Pitalito. http//www.siac.gov.co/documentos/DOC_Portal/DOC_Suelo/Estudios%20Deptos/Cauca/210610_IGAC_%20Est_Sue_Cauca_2009_Biblio.pdf; consulta: noviembre 2010. [ Links ]
Cárdenas, D. y N. Salinas. 2007. Roble negro (Colombobalanus excelsa Lozano Hern, Cam. y Henao S.) Nixon y Crepet. pp. 72-74. En: Cárdenas L. y N. Salinas (eds.). Libro Rojo de Plantas de Colombia. Volumen 4. Especies Maderables Amenazadas: I parte. Serie de Libros Rojos de Especies Amenazadas en Colombia. Instituto Amazónico de Investigaciones SINCHI, Ministerio de Ambiente, Vivienda y Desarrollo Territorial, Bogotá. D.C. 232 p. [ Links ]
Clark, J.S., E. Macklin and L. Wood. 1998. Stages and spatial scales of recruitment limitation in southern Appalachian forests. Ecological Monographs 68(2): 213-235. [ Links ]
Collevatti, R.A., G. Estolano, S.F. García and J.D. Hay. 2009. Seed abortion in the bat pollinated neotropical tree species, Caryocar brasiliense (Caryocaraceae). Botany 87(11): 1110-1115. [ Links ]
Curran, L.M. and M. Leighton. 2000. Vertebrate response to spatiotemporal variation in seed production of mast-fruiting Dipterocarpaceae. Ecology Monographs 70(1): 101-128 [ Links ]
Dalling, J.W., M.D. Swaine and N.C. Garwood. 1994. Effect of soil depth on seedling emergence in tropical soil seed-bank investigations. Functional Ecology 9(1): 119-121. [ Links ]
Dick, C.W., F.A. Jones, O.J. Hardy and R. Petit. 2008. Spatial scales of seed and pollen-mediated gene flow in tropical forest trees. Tropical Plant Biology 1: 20-33. [ Links ]
Eriksson, O. and J. Ehrlén. 1992. Seed and microsite limitation of recruitment in plant populations. Oecologia 91(3): 360-364. [ Links ]
Fournier, L.A. y C. Charpentier. 1975. El tamaño de la muestra y la frecuencia de las observaciones en el estudio de las características fenológicas de los árboles tropicales. Cespedesia 7(25-26): 13-20. [ Links ]
Fournier, L.A. 1974. Un método cuantitativo para la medición de características fenológicas en árboles. Turrialba 24(4): 422-423. [ Links ]
Frey, B.R., M.S. Ashton, J.J. McKenna, D. Ellum and A. Finkral. 2007. Topographic and temporal patterns in tree seedling establishment, growth, and survival among masting species of southern New England mixed-deciduous forests. Forest Ecology and Management 245(1-3): 54-63. [ Links ]
Cabezas, A. y R. Montealegre, R. 2010. Análisis del paisaje y de su relación con la regeneración del roble (Quercus humboldtii Bonpl.) en el municipio de Popayán, departamento del Cauca. Colombia Forestal 13(1): 189-200. [ Links ]
Gómez, L. 2008. Spatial patterns of recruitment in Mediterranean plant species: linking the fate of seeds, seedlings and saplings in heterogeneous landscapes at different scales. Journal of Ecology 96(6): 1128-1140. [ Links ]
González, A. y A. Parrado. 2010. Diferencias en la producción de frutos del roble Quercus humboldtii Bonpl., en dos bosques andinos de la cordillera oriental colombiana. Colombia Forestal 13(1): 141-162. [ Links ]
González, M., S. Ochoa, N. Ramírez and P. Quintana. 1995. Current land use trends and conservation of old growth forest habitats in the highland of Chiapas, Mexico. pp. 190-198. In: Wilson M.H and Sader S.A. (eds). Conservation of neotropical migratory birds in Mexico. Maine Agriculture and Forest Experiment Station, Miscellaneous Publication 727 Orono, Maine. [ Links ]
Grime, J.P. and S.H. Hillier. 2000. The contribution of seedling regeneration to the structure and dynamics of plant communities, ecosystems and larger units of landscape. pp. 361-374. In: Fenner, M. (ed.). Seeds: the ecology of regeneration in plant communities. Second edition. CABI Publishing, UK. 410 p. [ Links ]
Gómez, H. 1997. Estadística experimental aplicada a las ciencias agrícolas. Universidad Nacional de Colombia, Sede Medellín. Colombia. 571 p. [ Links ]
Guariguata, M. and G. Sáenz. 2002. Post-logging acorn production and oak regeneration in a tropical montane forest, Costa Rica. Forest Ecology and Management 167(1-3): 285-293. [ Links ]
Guerrero, S.B., E.A. Paz y A. Parrado. 2010. Efectos de la intervención antrópica en la distribución de las semillas y plántulas de roble (Quercus humboldtii Bonpl., Fagaceae), en la cordillera oriental colombiana. Colombia Forestal 13(1): 163-180. [ Links ]
Gutiérrez, A.G., J.J. Armesto and J.C. Aravena. 2004. Disturbance and regeneration dynamics of an old-growth north Patagonian rain forest in Chiloé Island, Chile. Journal of Ecology 92(4): 557-731. [ Links ]
Hernández C., J. Lozano y J.E. Henao. 1980. Hallazgo del género Trigonobalanus Forman, 1962 (Fagaceae) en el neotrópico II. Caldasia 13(61): 9-43. [ Links ]
Hulme, P.E., 2002. Seed-eaters: dispersal, destruction and demography. pp. 257-273. In: Levey, D.J., W.R. Silva and M. Galetti (eds.). Seed dispersal and drugivory: ecology, evolution and conservation. CABI Publishing, UK. 511 p. [ Links ]
Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt - IAvH. 2005. Caracterización biológica del proceso corredor biológico entre los parques naturales nacionales Puracé-Guácharos (Huila) Colombia. Grupo de Exploración y Monitoreo Ambiental - GEMA. Informe técnico final. Villa de Leyva. 186 p. [ Links ]
International Seed Testing Association-ISTA, 2005. International rules for seed testing. Edition 2005. Bassersdorf, CH-Switzwerland. [ Links ]
Johnson, P.S., S.R. Shifley and R. Rogers. 2009. The ecology and silviculture of oaks. Second edition. CABI Publishing. New York. 560 p. [ Links ]
Kappelle, M. 2006. Ecology and conservation of neotropical montane oak forests. Ecologycal studies 185. Springer, Germany. 483 p. [ Links ]
Kappelle, M. 1996. Los bosques de roble (Quercus) de la Cordillera de Talamanca, Costa Rica: biodiversidad, ecología, conservación y desarrollo. Instituto Nacional de Diversidad, Universidad de Amsterdam, Heredia, Costa Rica. 336 p. [ Links ]
Kolb, A. and M. Diekmann. 2005. Effects of life-history traits on responses of plant species to forest fragmentation. Conservation Biology 19(3): 929-938. [ Links ]
Lamprecht, H. 1990. Silvicultura en los trópicos: los ecosistemas forestales en los bosques tropicales y sus especies arbóreas-posibilidades y métodos para un aprovechamiento sostenido. (GTZ) GMBH, Eschborn, Alemania. 335 p. [ Links ]
León, J., G. Vélez y A. Yepes. 2009. Estructura y composición florística de tres robledales en la región norte de la cordillera central de Colombia. Revista de Biología Tropical 57(4): 1165-1182. [ Links ]
Li, Q. and K. Ma. 2003. Factors affecting establishment of Quercus liaotungensis Koidz. under mature mixed oak forest overstory and in shrubland. Forest Ecology and Management 176(1-3): 133-146. [ Links ]
Lorimer, C.G., J.W. Chapman and W.D. Lambert. 1994. Tall understorey vegetation as a factor in the poor development of oak seedlings beneath mature stands. Journal of Ecology 82(2): 227-237. [ Links ]
Lowe, A. 2005 Population genetics of neotropical trees focus issue. Heredity 95(4): 243-245. [ Links ]
Lozano, C., J. Hernández. y J. Henao. 1979. Hallazgo del género Trigonobalanus Forman (Fagaceae) en el Neotropico I. Caldasia 12(60): 517-537. [ Links ]
Manos, P., Z. Zhou and Ch. Cannon. 2001. Systematics of fagaceae: phylogenetic tests of reproductive trait evolution. International Journal of Plant Sciences 162(6): 1361-1379. [ Links ]
Ministerio de Ambiente, Vivienda y Desarrollo Territorial. 2010. Resolución 383 de febrero de 2010. Por la cual se declaran las especies silvestres que se encuentran amenazadas en el territorio nacional y se toman otras determinaciones. Diario Oficial No. 47.635 de 26 de febrero de 2010. [ Links ]
Muller, H.C., S.J. Wright, O. Calderón, S.P. Hubbell, and R.B. Foster. 2002. Assessing recruitment limitation: concepts, methods and case-studies from a tropical forests. pp 35-53. In: Levey, D.J., W.R. Silva and M. Galetti (eds.). Seed dispersal and frugivory: ecology, evolution and conservation. CABI Publishing. UK. 511 p. [ Links ]
Municipio de Charalá, 2003. Esquema de Ordenamiento Territorial Municipio de Charalá EOT, http://charala-santander.gov.co/nuestromunicipio.shtml?apc=mfxx1-&m=d. 76 p.; consulta: marzo 2010. [ Links ]
Münzbergová Z. and Herben T. 2005. Seed, dispersal, microsite, habitat and recruitment limitation: identification of terms and concepts in studies of limitations. Oecologia 145(1): 1-8. [ Links ]
Nathan, R. and H.C. Muller. 2000. Spatial patterns of seed dispersal, their determinants and consequences for recruitment. Tree 15(7): 278-285. [ Links ]
Nixon, K.C. 2008. An overview of Quercus: classification and phylogenetics with comments on differences in wood anatomy. In: II National Oak Wilt Symposium, http://www.texasoakwilt.org/NOWS/conference_assets/conferencepapers/Nixon.pdf. Austin Texas. 26 p.; consulta: noviembre 2010. [ Links ]
Nixon, K.C. and W. Crepet. 1989. Earliest megafossil evidence of Fagaceae: phylogenetic and biogeographic implications. American Journal of Botany 76(6): 842-855. [ Links ]
Nowacki G.J and M.D. Abrams. 2008. The demise of fire and ''mesophication'' of forest in the eastern United States. BioScience 58(2): 123-138. [ Links ]
Palacio, J.D. y J.F. Fernandez. 2006. Estado de la investigación en genética de la conservación de los robles (Fagaceae) en Colombia. pp. 57-72. En: Solano C. y N. Vargas (eds.). Memorias. I Simposio Internacional de Roble y Ecosistemas Asociados. Fundación Natura-Pontificia Universidad Javeriana, Bogotá D.C. 292 p. [ Links ]
Parker, W.C. and D.C. Dey. 2008. Influence of overstory density on ecophysiology of red oak (Quercus rubra) and sugar maple (Acer saccharum) seedlings in central Ontario shelterwoods. Tree Physiology 28(5): 797-804. [ Links ]
Pérez, I. 2007. Factores que condicionan la regeneración natural de especies leñosas en un bosque mediterráneo del sur de la península Ibérica. Ecosistemas 16(2): 131-136. [ Links ]
Petit, R.J. and A. Hampe. 2006. Some evolutionary consequences of being a tree. Annual Review of Ecology, Evolution and Systematics 37: 187-214. [ Links ]
Plieninger, T., V. Rolo and G. Moreno. 2010. Large-scale patterns of Quercus ilex, Quercus suber, and Quercus pyrenaica regeneration in Central-Western Spain. Ecosystems 13(5): 644-660. [ Links ]
Pulido, J.F. 2002. Biología reproductiva y conservación: el caso de la regeneración de bosques templados y subtropicales de robles (Quercus spp.). Revista Chilena de Historia Natural 75: 5-15. [ Links ]
Pulido, O. 1980. Geología de las planchas 131 (San Gil) y 151 (Charalá) departamento de Santander. Boletín Geológico 23(2): 39-78. [ Links ]
Reed, D.H. and R. Frankham. 2003. Correlation between fitness and genetic diversity. Conservation Biology 17(1): 230-237. [ Links ]
Rollet, B. 1980. Organización. p. 126-154. En: UNESCO, UNEP & FAO (eds.). Ecosistemas de los bosques tropicales: Informe sobre el estado de conocimientos. Serie de Investigaciones sobre los Recursos Naturales XVI, Madrid, España. 771 p. [ Links ]
Ryniker, K.A., J.K. Bush, and O.W. Van Auken. 2006. Structure of Quercus gambelii communities in the Lincoln National Forest, New Mexico, USA. Forest Ecology and Management 233(1): 69-77. [ Links ]
Saenz, G. 1990. Densidad y dinámica de plántulas de Quercus copeyensis, bajo dosel y en apertura, en el primer año después de la germinación en los robledales de Villa Mills. Costa Rica. Tesis Master of Science. Programa de Estudios de Posgrado y Capacitación. Centro Agronómico Tropical de Investigación y Enseñanza (CATIE), Turrialba, Costa Rica. 82 p. [ Links ]
Shupp, E., T. Milleron and S.E. Russo. 2002. Dissemination, limitation and the origin and maintenance of species-rich tropical forest. pp. 19-34. In: Levey, D.J., W.R. Silva y M. Galetti. (eds.) Seed dispersal and frugivory: ecology, evolution and conservation. First edition CABI International, Publishing, UK. 511 p. [ Links ]
Silvertown, J. and R. Law. 1987. Do plants need niches? Some recente developments in plant community ecology. Trends in Ecology and Evolution 2(1): 24-26. [ Links ]
Sork, V.L., F.W. Davis, P.E. Smouse, V.J. Apsit, R.J. Dyer, J.F. Fernandez and B. Kuhn. 2002. Pollen movement in declining populations of California Valley oak, Quercus lobata: where have all the fathers gone? Molecular Ecology 11(9): 1657-1668. [ Links ]
Stevenson, P.R. and N.I. Vargas. 2008. Sample size and appropiate design of fruit and seed traps in tropical forests. Journal of Tropical Ecology 24(1): 95-105. [ Links ]
Swaine, M.D., D. Lieberman, and F.E. Putz. 1987. The dynamics of tree populations in tropical forest: a review. Journal of Tropical Ecology 3(4): 359-366. [ Links ]
Thadani, R. and P.M. Ashton. 1995. Regeneration of banj oak (Quercus leucotrichophora A. Camus) in the central Himalaya. Forest Ecology and Management 78(1-3): 217-224. [ Links ]
Turnbull, L.A., M.J. Crawley and M. Rees. 2000. Are plant populations seed-limited? A review of seed sowing experiments. Oikos 88(2): 225-238. [ Links ]
Wang, K.S. 2003. Relationship between empty seed and genetic factors in European beech (Fagus sylvatica L.). Silva Fennica 37(4): 419-428. [ Links ]
Wilson, M.F., and N. Burley. 1983. Mate choice in plants: tactics, mechanisms, and consequences. Princeton University Press, New Jersey. 251 p. [ Links ]














