Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.65 no.1 Medellín Jan./June 2012
Evaluación in vitro de Microorganismos Nativos por su Antagonismo contra Moniliophthora roreri Cif & Par en Cacao (Theobroma cacao L.)
In vitro evaluation of Native Microorganisms for their Antagonism against Moniliophthora roreri Cif & Parin Cocoa (Theobroma cacao L.)
Jorge Enrique Villamil Carvajal1; Jorge Orlando Blanco Valbuena2 y Silvio Edgar Viteri Rosero3
1 Investigador. Universidad Pedagógica y Tecnológica de Colombia. Grupo de Manejo Biológico de Cultivos (GMBC). Línea "Biocontrol de Fitopatógenos e Insectos Plaga". Avenida Central del Norte. Tunja, Boyacá, Colombia. <cavitosa@yahoo.com>
2 Profesor Titular. Universidad Pedagógica y Tecnológica de Colombia. Escuela de Biología. Avenida Central del Norte. Tunja, Boyacá, Colombia. <jblanco@hotmail.com>
3 Profesor Titular. Universidad Pedagógica y Tecnológica de Colombia. Programa de Ingeniería Agronómica. Avenida Central del Norte. Tunja, Colombia. <silvio.viteri@uptc.edu.co>
Recibido: Enero 18 de 2012; aceptado: Febrero 28 de 2012.
Resumen. La moniliasis, causada por Moniliophthora roreri Cif & Par, se ha convertido en la principal enfermedad limitante de la producción de cacao en Colombia y otros países. Con el objetivo de explorar alternativas para el biocontrol de esta enfermedad, hongos y bacterias aislados de frutos y suelo rizosférico de lotes plantados con cacao fueron evaluados por su antagonismo contra M. roreri. La evaluación se realizó en cajas Petri con PDA, para lo cual se colocó en el centro de las mismas, un disco de 5 mm de diámetro colonizado por el patógeno y a 3 cm del borde, sobre los ejes horizontal y vertical, cada uno de los aislamientos. Los microorganismos nativos que inicialmente mostraron antagonismo fueron posteriormente evaluados in vitro por su capacidad de restringir el crecimiento y esporulación de M. roreri. Los resultados indicaron que de 53 aislamientos de frutos y suelo rizosférico, 7 mostraron antagonismo contra M. roreri y entre ellos los más efectivos fueron los hongos H5 y H20 y la bacteria B3, los hongos para la restricción tanto del crecimiento como de la esporulación y la bacteria para el crecimiento. El hongo H20 inhibió en su totalidad el crecimiento de M. roreri. Estos resultados hacen posible que estos aislamientos sean promisorios para su incorporación al manejo de la enfermedad bajo condiciones de campo. De acuerdo con la caracterización morfológica y las pruebas bioquímicas los hongos pertenecen al género Trichoderma y la bacteria al género Bacillus.
Palabras clave: Patógenos,Trichoderma, Bacillus, control biológico.
Abstract. The moniliasis, caused by Moniliophthora roreri Cif & Par, has become the principal disease limiting cocoa production in Colombia and other countries. With the objective of exploring alternatives for the biocontrol of this disease, fungi and bacteria isolated from cocoa fruits and rhizospheric soil from plots planted to cocoa trees were evaluated for their antagonism against M. roreri. The evaluation was conducted in Petri dishes containing PDA, by placing in the center of the plate a 5 mm PDA disk colonized by the pathogen and at 3 cm of the edge, on the X and Y axis, each of the isolated microorganisms. The isolates which initially showed antagonism were then evaluated in vitro for their capacity to inhibit the growth and sporulation of M. roreri. The results indicated that of the 53 isolated microorganisms, seven showed antagonism against M. roreri and among them the most effective were the fungi H5 and H20 and the bacteria B3, the fungi for the restriction of the growth and sporulation and the bacteria for the growth. The fungus H20 totally inhibited the growth of M. roreri. These results generate the possibility that these promissory isolates can be incorporated to the management of the disease under field conditions. According to the morphological characterization and the biochemical tests both fungi belong to the genus Trichoderma and the bacteria to the genus Bacillus.
Key words: Pathogens,Trichoderma, Bacillus, biocontrol.
La producción de cacao (Theobroma cacao L.) en Colombia tiene una connotación muy importante tanto desde el punto de vista ambiental como socioeconómico. De este cultivo se benefician alrededor de 25 mil familias, de las cuales el 90% lleva a efecto el proceso productivo bajo condiciones de economía campesina (Rodríguez, 2006). Dependiendo del manejo de la plantación, la enfermedad conocida como moniliasis, causada por el hongo Moniliophthora roreri Cif & Par, puede ocasionar pérdidas que fluctúan entre el 40 y 100%, convirtiéndose por lo tanto en el factor más limitante para la producción de cacao en el país. Debido a esta infección, la producción ha venido decreciendo de manera regular en los últimos 10 años, se estima que en el 2010, Colombia perdió más del 40% de su cosecha anual, equivalente en términos de grano comercial a 28.000 t de una producción total de 42.294 t. Razón por la cual, la industria nacional ha tenido que recurrir a la importación de cacao desde países vecinos, como Ecuador (FEDECACAO, 2010; Jaimes y Aranzazu, 2010).
En las plantaciones de cacao, el fruto es el único órgano infectado por M. roreri. La penetración y desarrollo del patógeno puede ocurrir en cualquier fase de su desarrollo, pero son más susceptibles en la etapa inicial. Externamente, los síntomas aparecen como puntos aceitosos muy pequeños y circulares, los cuales, se convierten en manchas irregulares de color amarrillo y marrón. El proceso desde la infección a la aparición de la mancha tiene una duración aproximada de 60±10 días, dependiendo de la susceptibilidad del clon de cacao. Entre tres y cuatro días, se desarrolla el micelio blanco sobre las lesiones y luego aparecen las esporas, las cuales confieren un color crema a marrón (Jaimes y Aranzazu, 2010).
El control de la moniliasis se basa en un sistema de manejo integrado, el cual incluye la siembra de materiales genéticos de alta productividad con tolerancia a la enfermedad (Arguello, 1990; Phillips, 2003), la implementación permanente de prácticas culturales (Cubillos y Aranzazu, 1979; Mejía y Argüello, 2000), el control químico (Mejía y Argüello, 2000; Fhia et al., 2003; Sánchez et al., 2003) y el control biológico.
En el campo relativo al control biológico de las enfermedades causadas por M. roreri Cif & Par, M. perniciosa (Stahel) y Phytophthora sp, se han realizado numerosos estudios con los hongos antagonistas Trichoderma sp y Gliocladium sp (Krauss y Soberanis, 2001a; Evans et al., 2003; Krauss et al., 2003a, 2003b; Sánchez, 2005; Phillips et al., 2006; Suárez, 2006; Corpoica 2006; Suárez y Cabrales, 2008; Bailey et al., 2008) y con Bacillus sp y Pseudomonas sp (Benito et al., 2007; Bravo y Victoria, 1981; Krawss y Soberanis, 2001b; Corpoica, 2006), bajo condiciones in vitro y campo en pruebas piloto en Ecuador, Perú, Costa Rica y Colombia, donde evidencian que dichos microorganismos actúan como antiesporulantes de M. roreri y que algunos de ellos inclusive, tienen habilidad para inducir resistencia sistémica en la planta.
El género Trichoderma incluye un grupo de hongos que ha sido utilizado por su capacidad de parasitar una gama amplia de fitopatógenos, entre los cuales figuran los hongos del suelo Phythium sp, Rhizoctonia sp, Fusarium sp y Sclerotinia sp y los del follaje Botrytis sp y Peronospora sp, entre otros. El hongo Trichoderma también actúa mediante la producción de antibióticos, por medio de los cuales inhibe el desarrollo de otros hongos o bacterias que compiten por nutrientes y espacio, como ocurre en flores y frutos con Botrytis y Monilia (Villegas, 2005). En cuanto a las bacterias, Johansson (2003) confirma que los géneros Bacillus sp. y Pseudomonas sp., restringen efectivamente el crecimiento de hongos en diferentes cultivos mediante mecanismos de acción por antibiosis o competencia.
En condiciones in vitro, ha sido posible identificar microorganismos con potencial para el biocontrol de las enfermedades en el cultivo del cacao (Suárez, 2006; Suárez y Cabrales, 2008). Lo anterior permite inferir que existe la posibilidad de encontrar agentes que efectivamente controlen M. roreri, bajo condiciones de campo. Al respecto, desde hace aproximadamente 15 años se han venido realizando investigaciones en Colombia, Centro América y otros países de Sur América, pero han resultado insuficientes debido a la gran capacidad de adaptación del patógeno a las diferentes condiciones agroecológicas donde se desarrolla el cultivo (Jaimes y Aranzazu, 2010); por ende, la contribución investigativa en este campo requiere ampliar y unir los esfuerzos con el fin de identificar y proporcionar a los productores nuevas y efectivas alternativas de manejo.
El objetivo de esta investigación fue evaluar bajo condiciones in vitro la eficacia de aislamientos de hongos y bacterias procedentes de frutos y suelos plantados con cacao, para restringir el crecimiento y esporulación del hongo M. roreri, que está limitando seriamente la producción de cacao en varias regiones del país, particularmente en el municipio de Coper (Boyacá, Colombia). Los resultados servirán de soporte para el diseño de estrategias que conduzcan a un manejo efectivo de la enfermedad en el cultivo.
MATERIALES Y MÉTODOS
Muestras de cacao. Consistieron en mazorcas tomadas de un cultivo abandonado de híbridos, de más de 40 años, en estado avanzado de esporulación de M. roreri, localizado en la finca "Corozales", vereda Resguardo del municipio de Coper - Boyacá (Colombia).
Muestras de rizósfera. Se recolectaron muestras de suelo de rizósfera, de híbridos de cacao no identificados, mayores a 20 años, con alta incidencia de monilia, en la finca "El Diamante" vereda "Cantino", también del municipio de Coper. Para obtener el suelo rizosférico, se hizo poda de raíces y el suelo adherido a éstas se recogió en bolsas plásticas. El suelo presentaba estructura blocosa subangular, textura franco arcillosa y color negro en el horizonte "A", por los altos contenidos de materia orgánica (4%), pH 5,3, sin aluminio intercambiable, alto contenido de nitrógeno, bajo de fósforo y medio de bases intercambiables y elementos menores.
Tanto las muestras de suelo como de frutos se trasladaron al Laboratorio de Control Biológico, del Programa de Ingeniería Agronómica de la Universidad Pedagógica y Tecnológica de Colombia, con sede en Tunja, donde se procedió al aislamiento de los microorganismos.
Aislamiento del M. roreri. Con una aguja previamente esterilizada, se tomó de las mazorcas completamente esporuladas, micelio del hongo y se realizó siembra directa en cajas Petri que contenían el medio de cultivo Papa Dextrosa Agar (PDA) (MCD© Laboratorios S.A.), las cajas se incubaron a 25 °C durante ocho días. Al octavo día, del borde del crecimiento de la colonia se realizaron repiques en PDA hasta lograr una colonia pura (Agrios, 1996). Para la multiplicación del hongo, de las colonias puras se hicieron siembras en diez cajas Petri con PDA y se incubaron a 25 °C durante 15 días (debido al lento crecimiento del hongo). A los 15 días, de las diez cajas se seleccionaron dos para la realización de microcultivos. La identificación del aislamiento de M. roreri se realizó morfológicamente, utilizando las claves taxonómicas de Phillips et al. (2006) y Evans (1981). El aislamiento puro fue conservado en refrigeración para las pruebas de antagonismo con los microorganismos aislados de suelo y frutos.
Aislamiento de microorganismos nativos
De los frutos de cacao. Se preparó una suspensión patrón de 9 mL, utilizando agua destilada estéril y un pequeño trozo de tejido de mazorca infestado de M. roreri, a la cual se le agregó una gota de Tween 80 (Agrios, 1996). De esta suspensión se hicieron diluciones seriadas de 1x10-1 hasta 1x10-7. De cada una de las cuatro mayores diluciones se tomaron dos alícuotas de 500 mL y se depositaron en el centro de cajas Petri que contenían medio PDA y Agar Nutriente (AN) (MCD© Laboratorios S.A.), respectivamente. Por medio de un rastrillo de vidrio, en ángulo de 90°, previamente esterilizado, se esparció el inóculo sobre toda la superficie del medio.
Del suelo rizósférico. Se pesaron 9,5 g de suelo, que se colocaron en una botella de dilución, a la que se adicionó agua destilada estéril hasta completar 100 mL, luego se agitó durante 30 min y de la suspensión se prepararon diluciones de 1x10-1, 1x10-2, 1x10-3. De cada una de las dos mayores diluciones se tomaron alícuotas de 500 mL, para siembras por separado en el centro de cajas Petri que contenían medio de cultivo PDA o AN, en estado semisólido, a 50 °C. Inmediatamente después de depositar la alícuota en el medio de cultivo, las cajas se agitaron en forma circular, en el sentido y en contra de las manecillas de reloj, hasta que la suspensión se dispersó completamente en el medio y se incubaron a 25 °C, durante 8 días. Las colonias de hongos y bacterias que crecieron, fueron luego purificadas realizando repiques consecutivos en cajas Petri con medio PDA o AN, según el microorganismo. Para su reconocimiento en las pruebas, a cada uno de los aislamientos se les asignó un código compuesto de una letra (H para hongo y B para bacteria) seguida de un número. Los aislamientos de los microorganismos purificados fueron almacenados en condiciones de refrigeración, en tubos inclinados con medio PDA o AN, hasta la realización de las pruebas de antagonismo in vitro.
Preselección de los aislamientos nativos por su antagonismo a M. roreri. En el centro de cajas Petri, con medio de cultivo PDA, se colocó un disco de 5 mm de diámetro de medio PDA colonizado durante 12 días por M. roreri y sobre los ejes horizontal y vertical, a una distancia de 3 cm del borde, cada uno de los microorganismos aislados de los frutos y del suelo rizosférico, tomado de un cultivo de 6 días de crecimiento. Las cajas Petri fueron incubadas a 25 °C. Durante un período de 12 de días, cada tercer día se registró el crecimiento de la colonia de M. roreri, el cual fue medido sobre la base de la caja Petri, por el lado más cercano al microorganismo nativo. Las colonias de hongos y bacterias que más afectaron el crecimiento del hongo se preseleccionaron para evaluar su potencial de antagonismo contra M. roreri.
Evaluación del potencial antagónico de los aislamientos preseleccionados. Siguiendo la metodología descrita anteriormente para la preselección de los aislamientos, se evaluó el potencial antagónico de cada uno de los microorganismos. Una vez realizados los montajes respectivos, las cajas Petri se incubaron a 25 °C. Se utilizó el diseño experimental completamente al azar (DCA), con cuatro repeticiones por tratamiento. El testigo consistió en siembras de solo el patógeno en el centro de cajas Petri con PDA. La unidad experimental consistió de una caja Petri con M. roreri en presencia o ausencia del microorganismo nativo. Al finalizar la prueba, a los 12 días, se cuantificó la esporulación de M. roreri, en cada uno de los tratamientos. Para el efecto, sobre cada uno de los ejes horizontal y vertical, a 1 mm del centro de la caja se cortó un disco en el medio de cultivo, utilizando un sacabocados de 5 mm de diámetro. Los cuatro discos obtenidos por caja fueron suspendidos en un tubo de ensayo que contenía 10 mL de agua destilada estéril, se adicionó una gota de Tween 20 y se agitó vigorosamente por 10 min, para facilitar el desprendimiento de los conidios del micelio. El conteo de los conidios se realizó en un microscopio Nikon®, utilizando la cámara de Newbauer. Los datos tanto del crecimiento de la colonia como de la esporulación de M. roreri, fueron sometidos al análisis de varianza y en dependencia de la significancia, las medias se compararon mediante la prueba Tukey (Gómez y Gómez, 1984), utilizando el paquete estadístico SPSS 17.0.
Identificación de los aislamientos con el mayor potencial de antagonismo. Los hongos más eficientes en el biocontrol de M. roreri, fueron identificados a nivel de género, con base en las características morfológicas de los conidióforos y de las conidias, siguiendo el protocolo descrito en la clave taxonómica de Villegas (2005) y Samuels et al. (1999). La identificación de las bacterias se realizó de acuerdo al protocolo de Schaad et al. (2001).
RESULTADOS Y DISCUSIÓN
Aislamiento de M. roreri. Durante el aislamiento de M. roreri, se evidenció la presencia de contaminantes representados por Aspergillus sp, Fusarium sp, bacterias y levaduras que limitan su crecimiento, lo cual es reportado por Suárez (2006). El crecimiento de M. roreri en medio PDA fue muy lento, característica que resulta una gran ventaja para la conservación de las cepas, bajo condiciones de laboratorio. La velocidad de crecimiento de los aislamientos fue de 2,8 mm cada tres días de incubación, suficiente para cubrir toda la superficie de la caja Petri, a los 48 días. Estos resultados son muy aproximados a los de Sánchez (2005), quien encontró que M. roreri a los cuatro días de incubación presentó un diámetro de crecimiento de 3,7 mm.
Inicialmente, los aislamientos mostraron un crecimiento color blanco, que posteriormente se tornó crema-salmón y finalmente café oscuro debido a la formación masiva de esporas, con masa conidial pulverulenta. De acuerdo con Castaño (1952); Cubillos (1970); Barros (1977); Evans (1981) y Suárez (2004), se evidenció una zona micelial formada por filamentos cortos y entreverados, de color blanco al principio y luego crema. Microscópicamente la colonia presentó conidióforos ramificados, dando lugar a una cadena de conidios de forma globosa con maduración basipétala, corroborando lo descrito por Phillips et al. (2006); Argüello (1990); Evans (1981) y Suárez (2004).
Microorganismos nativos aislados de frutos y suelo. En total se obtuvieron 53 aislamientos procedentes del suelo y de los frutos de cacao (Tabla 1). Pese a que en el suelo los grupos de microorganismos más numerosos generalmente son las bacterias y los actinomicetos (Alexander, 1977; Sylvia et al., 1998, 2005) los resultados de los aislamientos indicaron que en este suelo en particular predominan los hongos. Esto es posible puesto que en los suelos bajo el cultivo de cacao, similar a lo que ocurre en bosques maderables y otros forestales, se presentan capas de residuos orgánicos en descomposición, resultantes de la caída de la fitomasa de los árboles maderables nativos e introducidos que generalmente se utilizan para el sombrío permanente, donde es bien conocido que el componente microbiano es dominado por hongos (Alexander, 1977). En cuanto a las bacterias, Kim et al. (1997) mencionan que entre los aislamientos bacterianos de la rizósfera, los géneros Bacillus sp y Pseudomonas fluorescens son comunes y muy eficaces en el biocontrol de fitopatógenos que causan daño al sistema radical y foliar en diferentes cultivos.
Según Kuter et al. (1983), tanto la densidad de población como la diversidad de biocontroladores depende de varios factores, entre los cuales figuran el pH, el contenido de nitrógeno amoniacal, el grado de descomposición de la materia orgánica y la naturaleza de los materiales utilizados. En especies maderables y el cacao, las asociaciones endófitas son altamente diversas y de transmisión horizontal (adquiridos del ambiente) y muestran sólo algún grado de afinidad por el hospedero. Entre los endófitos encontrados en hojas de cacao se han identificado hongos habitantes naturales del suelo, predominando los géneros Trichoderma y Clonostachys (Mejía et al., 2008), y bacterias del género Bacillus (Melnick et al., 2008).
Aislamientos antagónicos a M. roreri preseleccionados. De los 53 aislamientos evaluados in vitro por su capacidad antagónica, los hongos H5 y H6 (provenientes de frutos), los hongos H3, H12 y H20 (procedentes de suelo) y las bacterias codificadas como B1 y B3 (aisladas de suelo) redujeron el crecimiento de M. roreri. Ninguno de los demás aislamientos limitó el crecimiento del patógeno, frente a los cuales el crecimiento del M. roreri fue similar al que se presentó en las placas Petri testigo. Entre los hongos, el aislamiento H20 mostró el mayor potencial antagónico, puesto que su crecimiento fue tan rápido que anuló por completo el avance de M. roreri. Es posible que el hongo H20 secrete sustancias metabólicas que le permiten derivar su nutrición enteramente del M. roreri y de esa manera anular por completo su crecimiento.
Estos resultados confirman que en el cultivo de cacao, existen microorganismos que pueden ser aislados, ya sea de las partes aéreas de las plantas o del suelo, que tienen potencial para el control no solamente de M. roreri y M. perniciosa sino también de Phytophthora sp (Evans et al., 2003; Krauss et al., 2006; Melnick et al., 2008, Mejía et al., 2008 y Hoopen et al., 2003).
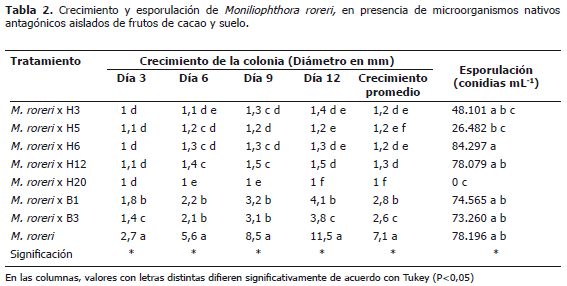
Potencial antagónico de los aislamientos preseleccionados. De los siete aislamientos seleccionados inicialmente como bioantagónicos, los hongos H5 y H20 y la bacteria B3 resultaron ser los aislamientos más efectivos para la restricción de la proliferación del M. roreri, in vitro (Tabla 2).
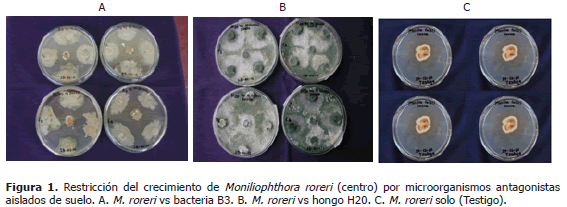
En la Figura 1 se ilustra la restricción del crecimiento de M. roreri, por los aislamientos B3 y H20. En la Figura 1A se puede apreciar que como consecuencia del antagonismo ejercido por la bacteria B3, el crecimiento de la colonia de M. roreri, fue en forma rectangular y no radial como sucedió en el testigo (Figura 1C). El halo de inhibición producido fue de 32,1 mm, resultando significativamente mayor, con respecto al producido por el aislamiento B1, que a los 12 días de evaluación fue de 21,8 mm. De acuerdo con Orietta y Larrea (2001), es posible que el mecanismo ejercido por la bacteria B3, fue el de antibiosis, debido a la producción de metabolitos secundarios, los cuales pueden ser volátiles o difusibles, pero que en cualquiera de los casos, sin entrar en contacto físico con el patógeno, pueden inhibir o restringir su crecimiento. Los mismos autores documentaron que en especies de B. subtilis, se ha registrado la liberación de compuestos con propiedades antifúngicas como la subtilina y otros antibióticos de la familia de las Iturinas. Aunque no se obtuvieron resultados considerablemente significativos con la cepa nativa B3, es bien conocido que el género Bacillus se encuentra integrado por bacterias endosporadas con alto potencial biocontrolador contra patógenos foliares, incluso contra Phytophthora capsici, agente causal de la mazorca negra del cacao (Melnick et al., 2008).
En la Figura 1B, se aprecia claramente que el crecimiento de M. roreri fue inhibido en su totalidad por el hongo H20. De acuerdo con Wells (1986) y Chet (1987); citados por Bernal et al. (2007), es posible que el mecanismo ejercido por el hongo H20 contra M. roreri fue el de parasitismo. Estos autores afirman que en el proceso la mayoría de las especies de hongos bioantagonistas crecen quimiotrópicamente hacia el hospedante, se adhieren a las hifas del mismo y se enrollan en ellas frecuentemente, penetrándolas y secretando sustancias metabólicas que le permiten depender parcial o enteramente de su hospedante para su nutrición. Estos resultados son corroborados por Harman (2001); Ezziyyani (2004); Ordóñez (2000) y Bastos (1996), quienes afirman que hongos del género Trichoderma parasitan hifas de M. roreri y M. perniciosa en cacao, mediante la producción de metabolitos denominados Trichodermina, Dermadina, Suzukacillina, viridin, Alamethicina, richotoxina y enzimas como la b-1,3 glucanasa, quitinasa y celulasa que le permiten además el ataque a un amplio rango de patógenos ejerciendo su efecto sobre las paredes celulares.
Los datos de la Tabla 2 evidencian que el hongo H20 es el aislamiento con el mayor potencial de antagonismo contra M. roreri. En presencia de este aislamiento, el crecimiento de la colonia del patógeno fue consistentemente menor a los tres, seis, nueve y doce días de incubación, con diferencias estadísticas en comparación a los otros aislamientos y al testigo. Estos resultados concuerdan con lo observado en la Figura 1B, mediante la cual se ilustra la contundencia del antagonismo ejercido por el hongo H20 en contra de M. roreri. Al final de la prueba, según los promedios, a los 12 días de incubación, los aislamientos que en orden descendente siguieron al H20 en su capacidad de restringir el crecimiento de M. roreri fueron H5, H6, H3, H12, B1 y B3. A pesar de la variabilidad de los resultados, todos los aislamientos antagónicos se diferenciaron del testigo, indicando que los microorganismos evaluados limitaron en gran medida el crecimiento del patógeno, ya sea mediante parasitismo, competencia, antibiosis, o cualquier otro mecanismo. El aislamiento H5, sin diferenciarse estadísticamente del H20, H6 y H3, también creció rápidamente disminuyendo la capacidad del patógeno de explorar el sustrato para el desarrollo de micelio. De acuerdo con Dennis y Webster (1971), otro mecanismo que es posible de ser ejercido en contra de M. roreri es el de competencia. Según Gary y Kubicek (1998), la competencia es un mecanismo de antagonismo en el cual los microorganismos pugnan por nutrientes. Si el crecimiento del biocontrolador es más rápido que el del patógeno, el patógeno no tiene la capacidad de explorar el sustrato debido a la ausencia de germinación y formación de estructuras. En cacao, se concibe que un biocontrolador eficaz sería aquel capaz de excluir al M. roreri, mediante competencia por nutrientes importantes para su germinación (Jaimes y Aranzazu, 2010).
Respecto al efecto de los aislamientos sobre la esporulación de M. roreri, los resultados (Tabla 2) confirman la muy promisoria capacidad antagónica del aislamiento H20, al inhibir por completo la esporulación del patógeno en las pruebas in vitro. Mediante observaciones microscópicas se pudo evidenciar la presencia delas estructuras del hongo H20 (hifas y esporas), actuando sobre las esporas de M. roreri, hasta deformarlas y causarles la muerte. Se resalta entonces la capacidad antagónica del hongo H20, la cual se manifiesta en dos direcciones, tanto sobre el crecimiento como sobre la esporulación del patógeno. Con los demás aislamientos, incluyendo el testigo, la esporulación osciló entre 26.482 y 78.196 conidias mL-1 (Tabla 2), sin diferencias estadísticas entre sí. En cacao, se ha comprobado la coevolución de micoparásitos con efecto antiesporulante sobre M. roreri, entre los cuales se encuentran Trichoderma ovalisporum, T. koningiopsis y T. paucisporum, seleccionados en pruebas piloto en Ecuador, Perú y Costa Rica (Hebbar, 2007; citado por Jaimes y Aranzazu, 2010).
Frente al hongo H6, la esporulación de M. roreri fue considerablemente superior, aunque sin diferencia significativa. De acuerdo con Melnick et al. (2008) existe la posibilidad que determinados aislamientos microbianos, produzcan metabolitos secundarios que en lugar de restringir estimulan la esporulación de M. roreri.
Según los trabajos de Phillips et al. (2006), en Colombia se encuentra la mayor población de agentes de biocontrol, surgidos por coevolución, por ser el centro de origen de M. roreri. Sin embargo, se debe tener en cuenta que la eficiencia del control por parte de estos agentes está sujeta a la cantidad de inóculo establecido en el lugar (Krauss et al., 2003b) y en el caso específico de las áreas cacaoteras, la mayoría tiene niveles de población del patógeno superiores en número a las del agente de biocontrol; por lo tanto, aunque los antagonistas se encuentran ejerciendo su acción, ésta se hace insignificante o imperceptible para el agricultor. La búsqueda de biocontroladores de M. roreri se ha enfocado hacia las especies de los géneros Trichoderma y Clonostachys. Sin embargo, Melnick et al. (2008) resaltan también la posibilidad de encontrar bacterias como efectivos agentes de biocontrol en el cultivo de cacao.
En general, los resultados conducen a la selección de los hongos H20 y H5 como los aislamientos fúngicos más promisorios para el biocontrol de M. roreri, por sus efectos tanto sobre el crecimiento como sobre la esporulación y de la bacteria B3, por su capacidad para restringir el crecimiento de la colonia. Siguiendo los planteamientos de Suarez y Cabrales (2008), en el sentido que es necesario que los resultados de los ensayos realizados en laboratorio sean comprobados bajo condiciones de campo, inclusive frente a otros fitopatógenos del cultivo, la segunda fase de esta investigación está orientada a evaluar directamente en el campo el comportamiento de estas cepas nativas que en condiciones in vitro muestran un potencial muy promisorio para el biocontrol de M. roreri, fitopatógeno que se ha constituido en uno de los factores más limitantes de la producción de cacao, no solo en Colombia, sino también en la mayoría de países del mundo productores del grano.
Caracterización e identificación de las mejores cepas nativas antagonistas. Los resultados de la caracterización e identificación de los aislamientos más promisorios para el biocontrol de M. roreri son los siguientes:
Hongo H5. Aislado de frutos, cubrió el medio de cultivo PDA a los seis días de incubación a 25 °C. Las colonias mostraron un color verde, sin micelio aéreo. Microscópicamente presentó conidióforos ramificados con forma de árbol pequeño, los cuales se observan como penachos compactados que forman anillos con un sistema de ramas irregular de manera piramidal. Estos terminan en fiálides donde se forman los conidios. Según la clave taxonómica de Villegas (2005) el hongo corresponde al género Trichoderma, clase Hyphomycetes, orden Moliniliales, familia Moniliaceae.
Hongo H20: Aislado del suelo, presentó un crecimiento muy rápido en PDA, cubriendo el medio a los tres días de incubación a 25 °C. La colonia presentó micelio blanco, tornándose posteriormente verde opaco, algo amarillento, con crecimiento flocoso. Microscópicamente se distinguió micelio hialino, septado, hifas primarias, secundarias y terciarias, conidióforos largos y delgados y conidios rugosos, lo cual coincide con las descripciones de la clave taxonómica de Samuels et al. (1999) para las especies del género Trichoderma. El efecto antagónico de Trichoderma ha sido observado por Sesan et al. (1999); Nelson (1991), Betalleluz (2003); Torres et al. (2008) en diferentes cultivos. Varias especies del mismo género han sido ampliamente ponderadas como eficaces biocontroladores de M. roreri in vitro y han sido propuestas como una opción futura para su biocontrol en el campo (Krauss y Soberanis, 2001a; Hoopen et al., 2003; Krauss et al., 2003b; Suárez y Cabrales, 2008). Además, Mejía et al. (2008), registran que los integrantes del género Trichoderma son habitantes naturales de los suelos cultivados con cacao.
Aislamiento B3: Esta bacteria aislada del suelo, presentó un crecimiento rápido en medio AN, a 25 °C, cubriendo el medio de cultivo a los cinco días de incubación. Las colonias presentaron color crema, consistencia butírica, ligeramente elevada, de bordes irregulares, superficie rugosa, aspecto húmedo-mucoso y Gram positiva, con células en forma de bacilos y presencia de endosporas polares. Bioquímicamente, es anaeróbica facultativa, catalasa positiva, reacción negativa a Oxidasa-Kovac's, producción de ácidos a partir de glucosa, celobiosa, arabinosa, manitol, trealosa, sorbitol, xilosa, pero no de ramnosa; mostró reducción del nitrato. La tinción con verde de malaquita para determinar la presencia de endosporas fue positiva, conduciendo por lo tanto a su identificación, como correspondiente al género Bacillus. El efecto antagónico sobre M. roreri encontrado en este estudio, es corroborado por Benito et al. (2007); Bravo y Victoria (1981) y CORPOICA (2006) quienes hallaron antagonismo sobre M. roreri y otros fitopatógenos del cultivo de cacao, in vitro e in vivo con Pseudomonas sp, Bacillus sp y B. subtilis.
CONCLUSIONES
En los cultivos de cacao existen microorganismos nativos que muestran capacidad para actuar como biocontroladores de M. roreri.
A diferencia de los frutos, el suelo representa una fuente más diversa de microorganismos nativos, entre los cuales según las pruebas in vitro se encuentran antagonistas que representan una alternativa muy promisoria para el control biológico de M. roreri.
De los 53 microorganismos nativos aislados de frutos y suelo, siete mostraron antagonismo contra M. roreri y entre ellos los más efectivos fueron los hongos H5 y H20 y la bacteria B3, destacándose el hongo H20, el cual inhibió en su totalidad el crecimiento de M. roreri.
Los hongos H5 y H20 pertenecen al género Trichoderma y la bacteria B3 al género Bacillus.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos al equipo de trabajo del Laboratorio de Control Biológico del Grupo Manejo Biológico de Cultivos (GMBC), del programa de Ingeniería Agronómica de la Universidad Pedagógica y Tecnológica de Colombia (UPTC), con sede en Tunja, por el apoyo incondicional durante todo el proceso de la investigación y al profesor Jorge Velandia Monsalve, por sus valiosos aportes y orientación en la metodología.
BIBLIOGRAFÍA
Agrios, G. 1996. Fitopatología. Segunda edición. Limusa, México. 838 p. [ Links ]
Alexander, M. 1977. Introducción a la microbiología del suelo. Segunda edición. John Wiley y Sons, New York. 467 p. [ Links ]
Arguello, O. 1990. Moniliasis. pp. 98-110. En: Memorias. Seminario Nacional de Actualización en Cacao con Énfasis en Rehabilitación de Plantaciones. Convenio Ministerio de Agricultura e ICA, Manizales, Colombia. [ Links ]
Bastos, C. 1996. Micoparasitismo natural de antagonismo entre Trichoderma viride y Crinipellis perniciosa. Fitopatología Brasilera 21: 50-54. [ Links ]
Barros, O. 1977. Investigaciones sobre el hongo Monilia roreri Cif. y Par, causante de la pudrición acuosa de la mazorca del cacao, sus daños y su control. El Cacaotero Colombiano 3: 42-52. [ Links ]
Betalleluz, V. 2003. Control en tomate de Phytophthora infestans con los hongos antagonistas Trichoderma harzianum, T. lignorum, T. viride y Gliocladium virens bajo condiciones controladas. Trabajo de grado Licenciatura en Biología. Universidad Nacional San Cristóbal de Huamanga, Ayacucho, Perú. 76 p. [ Links ]
Bernal, A., C. Andreu, M. Moya, M. González y O. Fernández. 2007. Utilización de Trichoderma spp. como alternativa ecológica para control de Fusarium oxysporum Schlecht f. sp cubense (E.F. Smith) Snyd & Hans. Revista del Instituto de Investigaciones de Sanidad Vegetal. Cuba 83: 26-29. [ Links ]
Bailey, B., H. Bae, M.Strem, J. Crozier, S. Thomas, G. Samuels, B. Vinyard and K. Holmes. 2008. Antibiosis, mycoparasitism, and colonization success for endophytic Trichoderma isolates with biological control potential in Theobroma cacao. Biological Control 46(1): 24-35. [ Links ]
Benito J., E. Arévalo y L. García. 2007. Manejo integrado del cacao para el control de enfermedades con énfasis en monilia. En: Memorias. Foro Binacional ICT- INIA. Situación actual y perspectivas de investigación en cacao (Theobroma cacao L) en el Perú. APP Cacao Proyecto INIA/ICT, Perú-Ecuador. 39 p. [ Links ]
Bravo, N. y K. Victoria. 1981. Posibilidades para el biocontrol de monilia (M. roreri) del cacao (Theobroma cacao L.). Acta Agronómica 31(1-4): 133-141. [ Links ]
CORPOICA. 2006. Capacitación sobre uso de metodologías y protocolos para realizar investigaciones con fitopatógenos y potenciales antagonistas en cacao (Theobroma cacao L.). Laboratorio de Fitopatología, Corpoica, C.I. Tibaitata, Mosquera (Cundinamarca).15 p. [ Links ]
Cubillos, G. 1970. Monografía sobre la moniliasis del cacao. Universidad de Caldas, Manizales, Caldas. 37 p. [ Links ]
Castaño, J. 1952. Moniliasis del cacao en una región del departamento de Caldas. Agricultura Tropical (Colombia) 8(6): 21-25. [ Links ]
Cubillos, Z. y F. Aranzazu. 1979. Comparación de tres frecuencias de remoción de frutos enfermos en el control de Monilia roreri. El Cacaotero Colombiano 8: 27-34. [ Links ]
Dennis, C., and J. Webster. 1971. Antagonistic properties of species-groups of Trichoderma. I. Production of non-volatile antibiotics. Transactions of the British Mycological Society 57:25-39. [ Links ]
Evans, H. 1981. Pod rot of cacao caused by Moniliophthora (Monilia) roreri. Phytopathological papers 1981. pp. 44. In: http://www.cabdirect.org/abstracts/19811373782.html; consulta: enero 2011. [ Links ]
Evans, H., K. Holmes and A. Reid. 2003. Phylogeny of the frosty pod rot pathogen of cocoa. Plant Pathology 52(4): 476-485. [ Links ]
Evans, H., K. Holmes, S. Thomas and C. Arroyo. 2003. Field screening in Costa Rica of ecuadorian mycoparasites of cocoa frosty pod pathogen Crinipellis (M. roreri). p. 143. In: Proceedings of the XI International Cocoa Research Conference. Accra, Ghana. 200 p. [ Links ]
Ezziyyani, M. 2004. Biocontrol de Phytophthora capsici en pimiento, con combinación de bioantagonistas. Tesis Doctoral. Universidad de Murcia. Facultad de Biología, Murcia, España. 107 p. [ Links ]
Federación Nacional de Cacaoteros (FEDECACAO). 2010. Estadísticas de la producción nacional registrada de cacao en grano., http://www.fedecacao.com.co/cw/index.php?secinfo=15. 1 p.; consulta: septiembre 2011. [ Links ]
Fundación Hondureña de Investigación Agrícola, (FHIA). 2003. Identificación y control de la moniliasis del cacao. Centro de Comunicación Agrícola de la FHIA, La Lima, Honduras. 24 p. [ Links ]
Gary, E. and C. Kubicek 1998. Trichoderma and Gliocladium, enzymes, biological control and commercial applications, http://www.amazon.com/Trichoderma-Gliocladium-Biological-commercial-applications/dp/0748408053#reader_0748408053.2. 396 p.; consulta: octubre 2011. [ Links ]
Gómez, K.A. and A.A. Gómez. 1984. Statistical procedures for agricultural research. Second edition. John Wiley and Sons, New York. 680 p. [ Links ]
Harman, G.E. 2001. Trichoderma spp., including T. harzianum, T. viride, T. koningii, T. hamatum and other spp. Deuteromycetes, moniliales (asexual classification system), http://www.biocontrol.entomology.cornell.edu/pathogens/trichoderma.html; consulta: mayo 2011. [ Links ]
Hoopen, M., R. Rees, P. Aisa, T. Stirrup and U. Krauss. 2003. Population dynamics of epiphytic mycoparasites of the genera Clonostachys and Fusarium for the biocontrol of black pod (Phytophthora palmivora) and moniliasis (Moniliophthora roreri) on cocoa (Theobroma cacao). Mycological Research 107(5): 587-596. [ Links ]
Johansson, M. 2003. Biocontrol of Fusarium in wheat introducing bacteria to a system of complex interactions. Doctoral thesis. Swedish University of Agricultural Sciencens. Uppsala, Swedish. 74 p. [ Links ]
Jaimes, Y. y F. Aranzazu. 2010. Manejo de las enfermedades del cacao (Theobroma cacao L.) en Colombia, con énfasis en monilia (Moniliophthora roreri). Corpoica, E.E. La Suiza. Produmedios, Bogotá. 90 p. [ Links ]
Krauss, U. and W. Soberanis. 2001a. Rehabilitation of diseased cacao fields in Peru through shade regulation and timing of biocontrol measures. Agroforestry Systems 53: 179-184. [ Links ]
Krauss, U. and W. Soberanis. 2001b. Biocontrol of cocoa pod diseases with mycoparasite mixtures. Biological Control 22(2): 149-158. [ Links ]
Kim, D., R. Cook and D. Weller. 1997. Bacillus sp. L324-92 for biological control of three root disease of wheat grown with reduced tillage. Phytopathology 87(5): 551-558. [ Links ]
Krauss, U., M. Ten, E. Hidalgo, A. Martínez, C. Arroyo, J. García, A. Portuguez and M. Palacios. 2003a. Biocontrol of monilia (M. roreri) and black pod (Phytophthora spp.) in Panama with mycoparasites in two formulations. pp. 53-58. In: IV Incoped Seminar Proceedings. Accra, Ghana. [ Links ]
Krauss, U., M. Ten, E. Hidalgo, A. Martínez, C. Arroyo, J. García, A. Portuguez y V. Sánchez. 2003b. Manejo integrado de monilia (Moniliophthora roreri) del cacao (Theobroma cacao L.) en Talamanca, Costa Rica. Agroforestería en las Américas 10: 37-38. [ Links ]
Kuter, G., E. Nelson, H. Hoitink and L. Mad Den. 1983. Fungal populations in container media amended with composted hardwood bark suppressive and conducive to Rhizoctonia damping-off. Phytopathology 73(10): 1450-1456. [ Links ]
Krauss U., M.Hoopen, E. Hidalgo, A. Matínez, T. Stirrup, C. Arroyo, J. García and M. Palacios. 2006. The effect of cane molasses amendment biocontrol of frosty pod rot (Moniliophthora roreri) and black pod (Phytophthora spp.) of cocoa (Theobroma cacao) in Panama. Biological Control 39(2): 232-239. [ Links ]
Mejía, A, y C. Arguello. 2000. Manejo integrado de la monilia en cacao (Theobroma cacao L.) en Santander. pp. 74-84. En: Tecnología para mejoramiento del sistema de producción de cacao. Convenio Corpoica Regional 7 - Ministerio de Agricultura, Bucaramanga. Colombia. 144 p. [ Links ]
Melnick, R., N. Zidack, B. Bailey, S. Maximova, M. Guiltinan and P. Backman. 2008. Bacterial endophytes: Bacillus spp. from annual crops as potential biological control agents of black pod rot of cacao. Biological Control 46: 46-56. [ Links ]
Mejía, L., N. Rojas, Z. Maynard, S. Van Bael, E. Arnold, P. Hebbar, G. Samuels, N. Robbins, E. Allen. 2008. Endophytic fungi as biocontrol agents of Theobroma cacao pathogens. Biological Control 46: 4-14. [ Links ]
Nelson, E. 1991.Handbook of applied mycology. pp. 327-355. In: D.K. Arora, B. Rai, K.G. Mukerji, and GR. Knudsen (eds.). Current limits to biological control of fungal phytopathogens. Volume 1: Soil and Plants. Marcel Dekker, New York. 800 p. [ Links ]
Ordóñez, V. 2000. Producción de enzimas microbianas y aplicaciones en la industria. pp. 67-71. En: Memorias. II Congreso Internacional de Microbiología Industrial. Pontificia Universidad Javeriana, Santa Fé de Bogotá. [ Links ]
Orietta, F y V. Larrea. 2001. Microorganismos antagonistas para el control fitosanitario. Manejo Integrado de Plagas (Costa Rica) 62: 96-100. [ Links ]
Phillips W (2003) Origin, biogeography, genetic diversity and taxonomic affinities of the cacao (Theobroma cacao L.) fungus Moniliophthora roreri (Cif.) Evans et al. as determined using molecular, phytopathological and morpho-physiological evidence. Tesis. University of Reading, UK. 349 p. [ Links ]
Phillips, W., A. Coutiño, C. Ortiz, A. López, J. Hernández and M. Aime. 2006. First report of Moniliophthora roreri causing frosty pod rod (moniliasis disease) of cocoa in Mexico. Plant pathology 55(4): 584. [ Links ]
Rodríguez, E. 2006. Técnica de reducción de inóculo para controlar la monilia del cacao en Santander. Innovación y Cambio Tecnológico-Corpoica 4(4): 4-9. [ Links ]
Sánchez, M. 2005. Efecto antagónico de Trichoderma harzianum y Trichoderma viride sobre Moniliophthora roreri Cif & Par en cacao. Trabajo de grado. Facultad de Ciencias Agropecuarias. Universidad Nacional de Ucayali, Perú. 55 p. [ Links ]
Sánchez, L., E. Gamboa y J. Rincón. 2003. Control químico y cultural de la moniliasis (Moniliophthora roreri Cif & Par) del cacao (Theobroma cacao L.) en el estado Barinas. Revista de la Facultad de Agronomía 20(2): 188-194. [ Links ]
Suárez, L. 2004. Aislamiento e identificación del hongo Moniliophthora roreri a partir de cultivos de cacao ubicados en Norte de Santander-Colombia. Tesina Doctorado. Universidad Pablo de Olavide. Sevilla, España. 26 p. [ Links ]
Suárez, L. 2006. Aislamiento e identificación de M. roreri causante de la monilia en municipios del nororiente Colombiano y ensayos preliminares para su control biológico. Universidad Francisco de Paula Santander 11(2): 3-8. [ Links ]
Suárez, L y C. Cabrales. 2008. Identificación de las especies de cepas nativas de Trichoderma sp. y Bacillus sp. y evaluación de su potencial antagonista in vitro frente al hongo fitopatógeno nativo M. roreri en el departamento de Norte de Santander. Universidad Francisco de Paula Santander 13(1): 45-56. [ Links ]
Sylvia, D., J. Fuhrmann, P. Hartel and D. Zuberer. 1998. Principles and applications of soil microbiology. First edition. Prentice Hall, London. 550 p. [ Links ]
Sylvia, D., J. Fuhrmann, P. Hartel and D. Zuberer. 2005. Principles and applications of soil microbiology. Second edition. Prentice Hall, London. 640 p. [ Links ]
Samuels, G., E. Lieckfeldt and H. Nirenberg. 1999. Trichoderma asperellum, a new species with warted conidia, and redescription of Trichoderma viride. Sydowia 51(1): 71-88. [ Links ]
Schaad, N., J. Jones and W. Chun. 2001. Laboratory guide for identification of plant pathogenic bacteria. Third edition. APS Press, St. Paul, Minnesota. 373 p. [ Links ]
Sesan, T., M. Oprea, A. Podoscu, C. Tica, and F. Oanecea. 1999. Biocontrol of Botrytis cinerea on grapevine with Trichoderma spp. and Saccharomyces chevalieri. Bulletin of the Academy of Sciences Botanical 47(2-4): 197-205. [ Links ]
Torres, E., J. Iannacone and H. Gómez. 2008. Biocontrol del moho foliar del tomate Cladosporium fulvum empleando cuatro hongos antagonistas. Bragantia 67(1): 169-178. [ Links ]
Villegas, M. 2005. Características generales de Trichoderma y su potencial biólogico en la agricultura sostenible, http://www.oriusbiotecnologia.com/escritos - tecnicos/128-trichoderma-pers-caracteristicas-generales -y-su-potencial-biologico-en-la-agricultura-sostenible. 1 p.; consulta: enero 2011. [ Links ]