Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.65 no.1 Medellín Jan./June 2012
Distribución Diferencial de Bacterias con Potencial Biocontrolador de Spongospora subterranea en Plantas de Papa (Solanum tuberosum cv. Diacol Capiro)
Differential Distrubution of Candidadate Biocontrol Bacteria against Spongospora subterranea in Potato Plants (Solanum tuberosum cv. Diacol Capiro)
Juliana Soler Arango1; Luisa Fernanda Posada Uribe2 y Juan Carlos Pérez Naranjo3
1 Ingeniera Biológica. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias - Laboratorio de Microbiología del Suelo. A.A. 3840, Medellín, Colombia. <jsoler@unal.edu.co>
2 Ingeniera de Procesos. Universidad EAFIT, Medellín. Laboratorio de Biotecnología. A.A. 1983, Medellín, Colombia. <lposadau@eafit.edu.co>
3 Profesor Asociado. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias - Escuela de Geociencias. Laboratorio de Microbiología del Suelo. A.A. 3840, Medellín, Colombia. <jcperez@unal.edu.co>
Recibido: Diciembre 21 de 2011; aceptado: Abril 02 de 2012.
Resumen. La búsqueda de microorganismos promisorios para biocontrol de patógenos de plantas en el suelo con frecuencia se ha orientado a la detección de productores de hormonas y enzimas líticas, condiciones asociadas a su capacidad para promover crecimiento vegetal. Sin embargo, el suelo es altamente variable en escalas pequeñas y se conoce poco sobre la distribución espacial de microorganismos que expresan esas funciones. Este estudio determinó la capacidad de producción de indoles totales y quitinasas en bacterias cultivables aisladas del interior de la raíz, la rizósfera, la superficie de los tubérculos o suelo de un cultivo de papa (Solanum tuberosum variedad Diacol Capiro). Las muestras se obtuvieron en un campo comercial en el municipio de la Unión en el departamento de Antioquia, Colombia, en plantas que presentaban síntomas de infección por Spongospora subterranea. Se encontró una producción diferencial de indoles o quitinasas según el sitio de aislamiento de las bacterias. No se encontró una alta producción de ambas actividades en un sólo aislamiento, la mayor producción de indoles totales y quitinasas se encontró en bacterias aisladas a partir de raíz y rizósfera, comparada con las aisladas de tubérculos y suelo. Estos resultados sugieren que en el suelo no es aleatoria la distribución de funciones deseables en controladores biológicos. Con estos resultados es posible orientar su búsqueda para optimizar el uso de recursos y el desarrollo de nuevos bioproductos.
Palabras clave: Control biológico, crecimiento y desarrollo vegetal, fitohormonas, enzimas hidrolíticas.
Abstract. Searching for promising microorganisms to biocontrol soil-borne plant pathogens has been often focused on producers of hormone and lytic enzymes, since these traits are linked to plant growth promotion. However, the environment from inner roots to bulk soil is quite variable, and little is known about the spatial distribution of microorganisms expressing these desirable traits. Using potato plants (Solanum tuberosum var. Diacol Capiro) from a farmers field, in this research we obtained bacteria from inside roots, rhizosphere, tubers peel or bulk soil, and determined in them the production of indol and chitinases. In general, bacteria isolated form inside the roots showed the highest production of total indols and chitinases. Simultaneous high production of both compounds was not detected in these isolates, and the frecuency of bacteria producing both, indol and chitinases was higher in roots and rhizosphere, compared to tubers peel and bulk soil samples. These results suggest that in soil, the distribution of microorganisms and functions linked to biocontrol are not randomly distributed. These findings might be usefull to guide the search for biocontrol agents, optimize resource use and speed up the development of new bioproducts.
Key words: Biological control, plant growth and development, phytohormones, hydrolytic enzymes.
El uso de microorganismos para control biológico de patógenos del suelo, ha sido impulsado por la conciencia actual sobre los efectos indeseables del uso intensivo de pesticidas y agroquímicos. De especial interés son las bacterias denominadas PGPB (por sus siglas en inglés, plant growth promoting bacteria), que estimulan directamente el crecimiento de plantas (Bashan y Holguín, 1998) y un grupo de ellas que coloniza la rizósfera, a menudo referidas como rizobacterias promotoras del crecimiento o PGPR (plant growth promoting rhizobacteria) (Kloepper et al., 1989). Esas bacterias pueden encontrarse en secciones intra o extra celulares de la planta (Kloepper et al., 1989; Glick y Bashan, 1997; Van Loon et al., 1998; Pinton et al., 2007; Hardoim et al., 2008; Martínez et al., 2010).
Los mecanismos de biocontrol por PGPB involucran multiples interacciones que resultan en efectos positivos en el crecimiento y desarrollo vegetal (Jollès y Muzzarelli, 1999; Benítez et al., 2004; Gohel et al., 2006; Bhattacharya et al., 2007). La producción de fitohormonas por bacterias, que favorecen el crecimiento vegetal, representa una interacción indirecta entre el bicontrolador y el patógeno, mientras que la producción de enzimas líticas por biocontroladores, que afectarían negativamente el patógeno, ejemplifica una interacción directa biocontrolador-patógeno (Jollès y Muzzarelli, 1999; Benítez et al. 2004; Gohel et al., 2006; Bhattacharya et al., 2007; Spaepen et al., 2008).
La producción de fitohormonas es considerada uno de los mecanismos más importantes para la promoción del crecimiento vegetal, estos compuestos orgánicos regulan el crecimiento y desarrollo en plantas, y en bajas concentraciones influencian procesos bioquímicos, fisiológicos y morfológicos. El AIA (ácido 3-iindol acético) es la fitohormona más común, mejor caracterizada y la auxina fisiológicamente más activa en las plantas (Dobbelaere et al., 2003; Yasmin et al., 2009; Martínez et al., 2010), que puede ser producida por algunas PGPB y promover también la defensa contra fitopatógenos (Koshiba y Matsuyama, 1993; Tsavkelova et al., 2006; Spaepen et al., 2008; Yasmin et al., 2009). El AIA es el responsable de la división, expansión y diferenciación de las células y tejidos de las plantas y estimula la elongación de las raíces (Martínez et al., 2010; Tsavkelova et al., 2006). Se ha establecido que el AIA es sintetizado a partir del triptófano, sin embargo, se ha propuesto que existen otros intermediarios como el ácido indol 3-pirúvico, indol 3-acetaldoxima, indol 3- acetamina, indol 3-acetonitrito, indol 3-acetaldehido o triptamina (Bialek et al., 1992; Koshiba y Matsuyama, 1993; Dobbelaere et al., 2003; Tsavkelova et al., 2006; Martínez et al., 2010).
Existen microorganismos productores de quitinasa capaces de degradar la quitina y están involucrados en el control biológico de patógenos como hongos e insectos que poseen quitina en sus paredes celulares, o de liberar compuestos que desencadenan respuestas de defensa en la planta (Jollès y Muzzarelli, 1999; Singh et al., 1999; Bashan y de-Bashan, 2005; Duo-Chuan, 2006; Gohel et al., 2006; Bhattacharya et al., 2007). Registros de microorganismos capaces de producir enzimas líticas y ejercer biocontrol por este mecanismo incluyen hongos o bacterias como Trichoderma spp., Talaromyces flavus, Aeromonas, Enterobacter, Serratia, Paenibacillus sp., Streptomyces sp., Bacillus subtilis, Bacillus cereus, Trichoderma atroviride, Stenotrophomonas sp., Serratia marcescens, Streptomyces viridodiasticus, Streptomyces halstedii, Micromonospora carbonacea (Ordentlich et al., 1988; Chet et al., 1990; Inbar y Chet et al., 1991; Madi et al., 1997; Singh et al., 1999; El-Tarabily et al., 2000; Zhang et al., 2001; Compant et al., 2005; Huang et al., 2005; Joo, 2005; Duo-Chuan, 2006; Liu et al., 2011; O'Kennedy et al., 2011). La información anterior sugiere que ambas actividades desarrolladas por las PGPB pueden contribuir sustancialmente a la promoción de crecimiento vegetal. Sin embargo, la actividad promotora de crecimiento se ha registrado en bacterias endófitas, de la rizósfera o del suelo (Sarwar y Kremer, 1995; Patten y Glick, 1996; Lottmann et al., 1999; Sturz et al., 1999; Reiter et al., 2002; Sessitsch et al., 2004; Berg et al., 2005; Hernández et al., 2004). Debido a que los microorganismos presentan límites en sus rangos de adaptación y el ambiente desde el interior de la raíz hasta el suelo, además de ser altamente variable también es afectado por condiciones abióticas y bióticas (De leij et al., 1994; Garbena et al., 2004; Kirk et al., 2004), se hace necesario identificar en el suelo, los sitios con mayor abundancia de microorganismos que expresan actividades asociadas a promoción de crecimiento.
La sarna polvosa de la papa es causada por el patógeno Spongospora subterranea f. sp. subterranea, que depende de la presencia de raíces y tubérculos de papa para completar su ciclo de vida (Harrison et al., 1997; van de Graaf et al., 2007). El patógeno disminuye la calidad y producción de los tubérculos hasta en un 40% (Merz y Falloon, 2009; Gilchrist et al., 2009, 2011). Actualmente, esta enfermedad afecta las principales zonas productoras de papa del mundo, debido a la falta de tratamientos efectivos contra este patógeno y al comercio de tubérculos-semilla infectados (Harrison et al., 1997; Merz, 2008). S. subterranea forma estructuras de resistencia llamadas quistosoros, que poseen una capa de quitina en su estructura (Harrison et al., 1997; Down et al., 2002; Merz y Falloon, 2009). Algunas investigaciones indican que los agentes de control biológico tienen un potencial para reducir la actividad de S. subterranea, posiblemente a través de efectos sobre la viabilidad de los quistosoros o las zoosporas o mediante efectos estimulantes en el crecimiento de la planta (Nielsen y Larsen, 2004; Hoyos et al., 2008; Restrepo et al., 2009). Sin embargo, la eficacia del control biológico de la sarna polvosa en el campo aún no se ha demostrado (Merz y Falloon, 2009).
En este estudio se aislaron bacterias a partir de raíz (endófitos), rizósfera, tubérculos y suelo de un cultivo de papa Solanum tuberosum variedad Diacol Capiro, afectadas por Spongospora subterranea con el fin de determinar si existe distribución diferencial de bacterias productoras de indoles totales y de quitinasas, dependiendo de su localización.
MATERIALES Y MÉTODOS
Localización. Las muestras de suelo, rizósfera, raíz y tubérculo se obtuvieron de un sustrato tipo Andisol en el municipio de la Unión, vereda la Madera, departamento de Antioquia, Colombia, ubicado a 5°58′0″ N 75°21′0″, a una altura de 2.500 msnm y con una temperatura promedio de 13 °C. Se muestrearon al azar nueve plantas en estado de floración, que presentaban síntomas de infección por Spongospora subterranea en un área aproximada de 1 ha de terreno. Las muestras se almacenaron a 4 °C hasta su procesamiento. El aislamiento de las bacterias se realizó en el Laboratorio de Microbiología del Suelo de la Universidad Nacional de Colombia y de Biotecnología de la Universidad EAFIT, en sus sedes de Medellín.
Muestreo y aislamiento de microorganismos. Para aislar las bacterias y preparar medios, se tomaron muestras de suelo (a 10-20 cm desde la base del tallo de las plantas y sin presencia de raíces), suelo rizosférico (adherido a la raíz), raíces (finas y gruesas) y tubérculos de papa. Se prepararon cuatro tipos de medios de cultivo: agar nutritivo al 50%, PGA (papa glucosa agar) y agar extracto de raíz (ER). El PGA se preparó hirviendo 200 g de papa (con cáscara y cortada en cuadrados pequeños) en 1.000 mL de agua destilada por 10 min, se filtró y se llevó a 1 L con agua destilada, se añadieron 20 g de agar y 20 g de glucosa. El agar extracto de raíz se preparó esterilizando 15 g agar, 1 g sacarosa comercial y 0,5 g K2HPO4 en 990 mL de agua destilada. Luego se agregaron 10 mL de extracto estéril de raíces con concentraciones de 1 o 10 gL-1 (ER1 y ER2, respectivamente). Para preparar el extracto de raíz se esterilizó previamente la superficie de la raíz con inmersiones sucesivas de 30 seg en etanol (70%) y 3 min en hipoclorito de sodio al 5%. Luego se pesaron 1 o 10 g de raíces desinfectadas que se licuaron en 100 mL de agua estéril y se esterilizaron en filtro de 0,2 mm estéril.
En cada medio se aislaron bacterias desde suspensiones de raíces esterilizadas superficialmente, suelo rizosférico, suelo y superficie de tubérculos. Los microorganismos de suelo y suelo rizosférico se aislaron al diluir 1 g de suelo en 9 mL de agua estéril, después de mezclar se transfirieron 100 mL a un tubo con 9,9 mL de agua estéril (dilución 1). Esta dilución corresponde al factor de dilución 1/100 en diluciones seriales tradicionales. Para aislar los microorganismos de raíces primero se removió el suelo adherido y se lavaron con agua corriente, se pesaron 3 g y se esterilizaron por inmersión en etanol al 70% (30 segundos), luego en hipoclorito de sodio al 3-5% (3 min), luego se lavaron con agua estéril y se secaron en papel toalla estéril (De Araujo et al., 2000). Las raíces se maceraron en 3 mL de agua destilada estéril y se transfirió 1 mL del macerado a un tubo con 9 mL de agua estéril, se mezcló y de esta suspensión se transfirieron 100 mL a un tubo con 9,9 mL de agua estéril (dilución 1).
Para aislar microorganismos asociados a tubérculos, se lavó la superficie de los tubérculos con agua destilada estéril, se maceraron 3 g de cáscara en 3 mL de agua destilada estéril y se transfirió 1 mL del macerado a un tubo con 9 mL de agua estéril, se mezcló y se transfirieron 100 mL a un tubo con 9,9 mL de agua estéril (dilución 1). Se transfirieron 20 mL de las diluciones 1 de suelo, rizósfera, raíz y tubérculo a tres cajas de Petri con cada medio de cultivo y se distribuyeron uniformemente con espátula Digralsky. La incubación se realizó a temperatura ambiente (aproximadamente 27 °C) y todo el tiempo en oscuridad, revisando diariamente el crecimiento para registrar el número de colonias y su morfología durante tres días. Los aislamientos se conservaron en eppendorf con 1 mL de solución salina 0,85% estéril y se almacenaron en nevera a 4 °C (Dhingra y Sinclair, 1985).
Producción de indoles totales. Los aislamientos bacterianos se sembraron en medio TSA (agar tripticasa de soya) por 24 horas a 30 °C con el fin de obtener colonias individuales. Se seleccionaron tres colonias de cada aislamiento y se transfirieron a un tubo con medio TSB suplementado con 500 ug mL-1 de L-triptofano y se incubaron en agitación constante (150 rpm, 48 horas, 30 °C). Luego se centrifugaron a 4500 rpm por 15 min. A 1 mL del sobrenadante se adicionaron 4 mL de solución de Salkowsky (150 mL de H2SO4 al 99%, 250 mL de agua destilada y 7,5 mL de FeCl3•6H2O 0,5 M), se agitó hasta obtener una suspensión homogénea y se midió absorbancia en un espectrofotómetro a 530 nm. La concentración de indoles totales se determinó con una curva de referencia preparada con 10, 20, 30, 40 y 50 ug mL-1 de AIA diluido en etanol en una concentración 1 M. Se repitió el procedimiento a cada muestra para verificar los resultados.
Producción de quitinasas. Para evaluar la producción de quitinasas los aislamientos bacterianos se sembraron en un medio preparado con quitina, como única fuente de carbono. Un medio con glucosa como única fuente de carbono se empleó como control positivo. Los aislamientos que crecieron en el medio con quitina, fueron capaces de utilizarla como fuente de carbono y un halo claro alrededor de la colonia bacteriana, indicó actividad quitinasa positiva. La producción de quitinasas se evaluó de forma cuantitativa registrando el tamaño del halo de cada colonia diariamente por 10 días. El medio con quitina como única fuente de carbono se preparó modificando los métodos de Atlas (2005) y Cattelan (1999): 20,0 gL-1 de agar, 4,0 gL-1 de quitina coloidal, 0,7 gL-1 de K2HPO4, 0,5 gL-1 de MgSO4•7H2O, 0,3 gL-1 de KH2PO4, 0,01 gL-1 de FeSO4•7H2O, 1,26 gL-1 de MnSO4, 0,001 g L-1 de ZnSO4•7H2O; el pH se ajustó a 8,0 ± 0,2. La quitina se preparó por digestión de hojuelas de quitina en HCl durante 24 horas y realizando un lavado diario con agua destilada durante tres días para retirar los residuos del ácido. En cajas Petri conteniendo medio suplementado con quitina o glucosa se sembraron tres gotas de 4 mL de los microorganismos almacenados en solución salina (NaCl al 0,85%). Todos los aislamientos se evaluaron por triplicado y se calculó el error estándar para estimar la dispersión de las mediciones entre repeticiones.
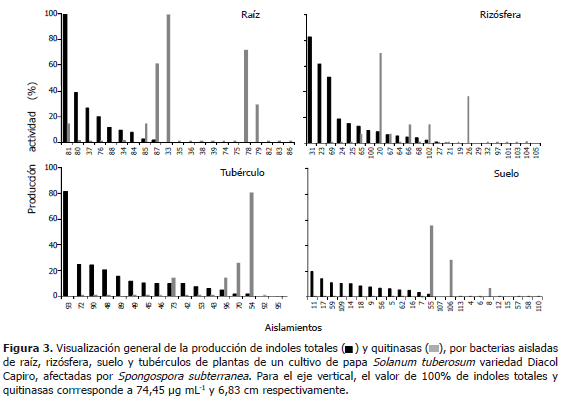
Producción de indoles totales y quitinasa. Para visualizar simultáneamente las proporciones de aislamientos bacterianos con producción de indoles totales y quitinasas, se tomaron las proporciones de la producción de cada actividad en porcentajes, se tomó como el 100% de la producción de indoles totales el mayor valor reportado por los aislamientos y como el 100% de la actividad quitinolitica el mayor tamaño de halo de hidrólisis presentado por los aislamientos.
Análisis de datos. Para visualizar la distribución de bacterias con mayor produccíon de indoles totales y quitinasas en raíces, rizósfera, tubérculos o suelo, se usaron los valores obtenidos de las dos pruebas anteriores. Debido a que las colonias bacterianas se aislaron por ser claramente diferenciables, no se incluyen comparaciones entre sitios de aislamiento, ya que estarían basadas en valores promedios de producción de indoles o quitinasas por bacterias diferentes.
RESULTADOS
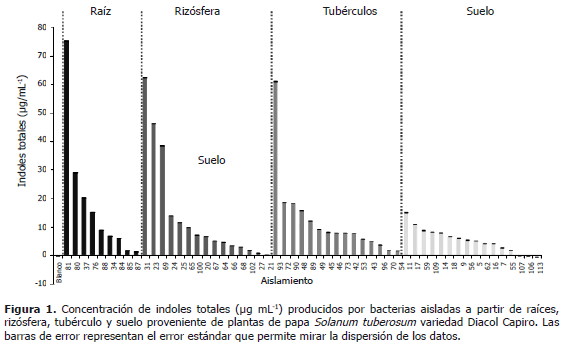
Producción de indoles totales. Se obtuvieron en total 106 aislamientos distribuidos así: 28 colonias de hongos y 78 de bacterias. En raíces se encontraron 26 morfotipos, 23 de suelo rizosférico, 28 de cáscaras de tubérculo y 31 de suelo. La producción de indoles totales se evaluó en 55 de los 78 aislamientos bacterianos que crecieron en el medio TSA (9 aislados a partir de raíz, 15 de rizósfera, 15 de cáscaras de tubérculo y 16 de suelo) (Figura 1). Para la raíz se encontraron concentraciones de indoles totales entre 1,3 y 75,5 mg mL-1; para la rizósfera entre 0,23 y 62,5 mg mL-1; para tubérculos entre 1,6 y 61,2 mg mL-1 y para suelo entre 0 y 15, 1 mg mL-1 (Figura 1). La mayor producción de indoles totales se encontró en la bacteria de raíz número 81, con una concentración de 75,5 mg mL-1. Los aislamientos 81, 31, 23, 69 y 93 producen un alto nivel de indoles totales; mientras que las más bajas producciones de índoles totales fueron observadas en los aislamientos de suelo, principalmente en el 7, 55, 107, 106 y 113 (Figura 1). En general, los valores mas bajos de producción de indoles, se encontraron al analizar bacterias aisladas de suelo, y se observaron diferencias amplias con los valores de indoles producidos por bacterias aisladas de otras zonas.
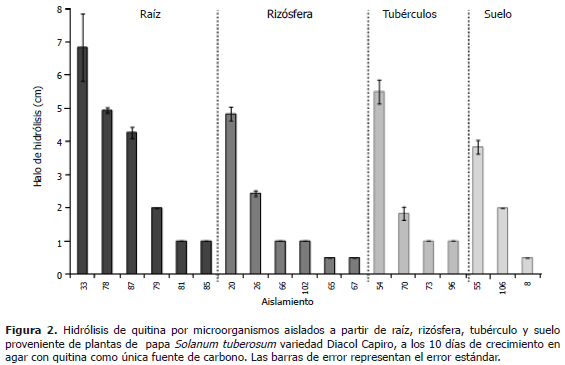
Producción de quitinasas. De los 106 aislamientos sólo 71 aislamientos, 17 hongos y 54 bacterias, crecieron con quitina como única fuente de carbono. Los mayores halos de hidrólisis se presentaron en los aislamientos de raíz, el 33 con un halo de 6,8 cm y el 78 con uno de 4,9 cm; seguido por un aislamiento de tubérculo, el 54 con un halo de 5,5 cm y de rizósfera, el 20 con un halo de 4,8 cm (Figura 2).
Distribución de las bacterias productoras de indoles totales y quitinasas. Para visualizar simultáneamente la producción de indoles totales y quitinasas, se tomaron las proporciones de la producción de cada actividad en porcentaje, se tomó como 100% el mayor valor reportado por los aislamientos de indoles totales (75,45 mg mL-1) y de halo de hidrólisis por quitinasas (6,83 cm). Muy pocos aislamientos presentaron ambas actividades y ninguno de ellos mostró valores altos en ambas pruebas (Figura 3). Aunque debido a la falta de crecimiento, no fue posible esta evaluación en todos los aislamientos, es notable que cuando se presentaron ambas actividades, índoles totales y quitinasas, su relación pareció ser inversamente proporcional (Figura 3).
DISCUSIÓN
Se caracterizaron bacterias aisladas de suelo, suelo rizosférico, raíces y tubérculos de papa por su producción de índoles totales y quitinasas, dos características deseables en controladores biológicos y promotores de crecimiento de plantas. En general, se observó una distribución diferencial de bacterias productoras de estas actividades según el sitio de aislamiento, con tendencia a encontrar proporciones decrecientes de productores de ambas actividades en aislados de raíces, rizósfera, tubérculos o suelo. Estos resultados resaltan la importancia de tres aspectos fundamentales cuando se buscan microorganismos biocontroladores: la distribución, su funcionalidad, así como sus posibles relaciones. El estudio de esos aspectos contribuiría al diseño de mecanismos para buscar y usar eficientemente bacterias y otros microorganismos para biocontrol de Spongospora subterranea en plantas de papa y posiblemente en otros cultivos, previo estudio de antagonismo con los patógenos sujetos a controlar.
La abundancia de organismos y de actividades no esta aleatoriamente distribuída, varía tanto horizontalmente como verticalmente a través del perfil del suelo, diferentes grupos de organismos exhiben diferentes patrones espaciales, porque cada uno de ellos reacciona de manera diferente a las condiciones del suelo (Paul, 2007). Estos resultados sugieren que en el suelo la distribución de microorganismos promotores de crecimiento vegetal, no es aleatoria (Figuras 1 y 2). Esta idea es soportada por estudios anteriores donde se ha encontrado una mayor producción de AIA por microorganismos asociados a rizósfera, comparada con los del suelo (Sarwar et al., 1992), y en rizósfera que en el suelo que rodea los tubérculos (Lottmann et al., 1999). En general, la capacidad de sintetizar AIA ha sido atribuida a bacterias de suelo asociadas a plantas y se ha estimado que alrededor del 80% de las bacterias aisladas de la rizósfera pueden producir AIA (Dobbelaere et al., 2003; Patten and Glick, 1996), esta producción de AIA en la rizósfera ha sido atribuida a la presencia de exudados, liberación de enzimas y abundancia de sustratos y de nutrientes proporcionados por las raíces que sustenta una gran actividad microbiana (Sarwar et al., 1992; Dobbelaere et al., 2003; Pinton et al., 2007; Nannipieri et al., 2007). Sarwar y Kremer (1995), midieron la producción de AIA en rizósfera y suelo y encontraron una producción de 1,06 a 10,94 mg mL-1 de AIA en la rizósfera y de 0,36 a 0,6 mg mL-1 de AIA en el suelo.
En cuanto a funcionalidad de biocontroladores, la síntesis de enzimas u otros compuestos está controlada genéticamente, y la expresión de esas actividades podría depender de la presencia de sustratos, plantas y microorganismos específicos. En conjunto, la expresión de esas funciones podría afectar significativamente el desempeño de los biocontroladores o la planta misma. Registros anteriores indicando promoción de crecimiento por bacterias señalan para el AIA producciones mas bajas que las encontradas aquí. Por ejemplo, Hernández et al. (2004) midieron entre 5,30 y 21,53 mg mL-1 de AIA en un conjunto de cepas de Burkholderia cepacia y Pseudomonas fluorescens, que estimularon el crecimiento de plantas de maíz. Mujahid et al. (2011), investigaron la producción de indoles por varias especies de Rubrivivax benzoatilyticus JA2, encontrando producción de AIA entre 1,5 y 21, 6 mg mL-1.
La producción de indoles y quitinasas han sido ampliamente usadas como parámetros iniciales de selección de microorganismos con potencial biocontrolador o promotor de crecimiento vegetal (Benítez et al., 2004; Gohel et al., 2006; Bhattacharya et al., 2007; Spaepen et al., 2008). Se tienen diferentes reportes de la producción de AIA o quitinasas en diferentes zonas de aislamientos de microorganismo en cultivos de papa. Berg et al. (2005) aislaron bacterias del interior de la raíz, de la superficie de la raíz y de la superficie de las hojas de plantas de papa, evaluaron la actividad quitinolítica, proteolítica y la producción de AIA a los cinco mejores aislamientos de cada microambiente que presentaron antagonismo contra Verticillium dahliae y Rhizoctonia solani; de los 20 aislamientos, solo tres presentaron actividad quitinolítica (dos de la superficie de la hoja y uno de la superficie de la raíz) y siete presentaron producción de AIA (uno de la rizósfera, uno de la superficie de la hoja, cuatro de la superficie de la raíz y uno de la raíz); sólo uno de los aislamientos produjo AIA y quinitinasas, lo que concuerda con este estudio, ya que muy pocos microorganismos mostraron la producción de ambas actividades (Figura 3). Sessitsch et al. (2004), caracterizaron microorganismos endófitos del tallo de un cultivo de papa que presentaba síntomas de Streptomyces scabies, según la producción de enzimas hidrolíticas y metabolitos secundarios como producción de quitinasas, actividad peptinasa, b-glucanasas, proteasas y AIA. En general las bacterias endófitas presentaron una alta producción de enzimas hidrolíticas, el 14% mostraron producción de quitinasas, el 43% de b-glucanasas, el 34% presentó actividad proteolítica y el 31% pectinolítica; además, encontraron que el 77% produjeron sideróforos y aproximadamente el 50% AIA. Patten y Glick (1996) registraron que el 80% de las rizobacterias producen AIA, mientras que Lottmann et al. (1999) encontraron que solo el 33% de bacterias de la rizósfera de cultivos de papa y el 30% de la superficie de los tubérculos producen AIA. Las diferencias entre las producciones de AIA y de quitinasas entre los diferentes investigaciones, puede deberse a que estas actividades podrían estar influenciadas por la presencia de patógenos, en este caso de Spongospora subterranea. A pesar de la importancia del cultivo de la papa en Colombia, no se ha caracterizado en su totalidad la diversidad microbiana asociada a plantas de papas y no se han realizado estudios sobre estimulación de crecimiento vegetal y biocontrol de S. subterranea por microorganismos productores de AIA y quitinasas en plantas de papa.
Es importante anotar que microorganismos con producciones muy altas de AIA también se han asociado con efectos negativos en el crecimiento de plantas. Barazani y Friedman (1999) midieron los efectos fitotóxicos o promotores de crecimiento en fracciones de AIA separadas de raíces de plántulas de lechuga, y atribuyeron ese efecto a rizobacterias deletéreas (DRB) o rizobacterias promotoras de crecimiento (PGPR) productoras de auxinas. El promedio de concentración de AIA producido por las DRB fue 4,7 veces más alto que el producido por las PRPG. Sin embargo, encontraron que Agrobacterium sp. indujo elongación de raíces a pesar de producir niveles muy altos de AIA (88,3 mg mL-1). Además, dos aislamientos de DRB que produjeron bajas cantidades de AIA también suprimieron la elongación de raíces. En este trabajo, microorganismos de raíces rizósfera y tubérculo generaron altas concentraciones de índoles totales, que podrían ser deletéreas. Sin embargo, no está definido que concentración de AIA puede llegar a ser deletérea para plantas de papa.
Los pocos aislamientos que generaron tanto indoles totales y quitinasas, mostraron una producción inversamente proporcional (Figura 1), ninguno de los aislamientos produjo grandes cantidades de las dos, ya que posiblemente sea difícil en términos metabólicos la producción de AIA y enzimas hidrológicas al mismo tiempo, y la expresión de múltiples funciones por un solo microorganismo podría ser desventajosa para el mismo debido al costo metabólico que esto implica (Lang et al., 2009). Similares resultados lograron Berg et al. (2005), que de 20 aislamientos solo uno produjo AIA y quitinanas; Sessitsch et al. (2004) encontraron que de 35 asilamientos que presentaron antagonismos contra Verticillium dahliae, Rhizoctonia solani, Sclerotinia sclerotiorum, Phytophthora cactorum y Erwinia carotovora subsp. atroseptica, sólo dos aislamientos presentaron ambas actividades. Para una mejor evaluación y comparación de ambas actividades se deben diseñar nuevos métodos que permitan el crecimiento de un rango más amplio de microorganismos bajo las mismas condiciones, ya que las pruebas utilizadas limitaban el crecimiento de alguno de ellos, por ejemplo, la prueba de producción de indoles totales se realizó solo a bacterias, debido a la diferencia en el tiempo de crecimiento de éstas y los hongos; además algunos microorganismos aislados inicialmente en medios complejos como agar extracto de raíz y agar papa no crecieron en el medio enriquecido TSA y lo mismo sucedió con el medio con quitina como única fuente de carbono; pero hay que tener en cuenta que el utilizar medios específicos para cada aislamiento interferiría en la lectura de las actividades.
Los mecanismos de biocontrol podrían ser dependientes de combinaciones especificas planta-patógeno. Reiter et al. (2002) establecieron que la estructura de la comunidad de bacterias endófitas de papa, esta correlacionada con la ausencia o presencia de un fitopatógeno (Erwinia carotovora subsp. Atroseptica). En general los patógenos inducen reacciones en la planta produciendo síntesis de metabolitos y señales de estrés como H2O2, ácido abscísico, ácido jasmónico y ácido salicílico. Yang et al. (2001), estudiando raíces de árboles de aguacate infectadas con Phytophthora cinnamomi encontraron que las raíces infectadas sin síntomas visibles de la enfermedad fueron colonizadas por comunidades bacterianas mas diversas, en comparación con plantas con síntomas. A pesar de la importancia del cultivo de la papa en el país, no se conocen cambios en diversidad de otras comunidades por efecto de la infección con patógenos tan limitantes como Spongospora subterranea, o la relación entre niveles de daño con las actividades metabolicas de esas comunidades.
Sturz et al. (1999), sugieren que el funcionamiento de comunidades de bacterias endófitas contribuye a la resistencia de tubérculos de papa (Solanum tuberosum) a patógenos como Fusarium sambucinum, Fusarium avenaceum, Fusarium oxysporum y Phytophthora infestans. Algunos estudios indican que el potencial de promoción del crecimiento es mayor en endófitos comparados con rizobacterias (Sessitsch et al., 2004), esta capacidad como agentes biocontroladores, posiblemente se puede atribuir a que las bacterias endófitas colonizan un nicho ecológico similar al que colonizan los patógenos, por lo que se adaptan mejor que bacterias de la rizósfera y debido al contacto entre los endófitos y células de la planta la resistencia sistémica inducida puede ser un importante mecanismo de control biológico (Reiter et al., 2002). La capacidad de las bacterias de colonizar tejidos internos de las plantas puede conferir una ventaja ecológica sobre las bacterias que solo pueden colonizar tejidos epifitos, aunque no se ha establecido como la planta se beneficia más de un endófito que de una rizobacteria y no es claro que población de microorganismos promueve más el crecimiento de las plantas (Hallmann et al., 1997; Sessitsch et al., 2004; Khan and Doty, 2009; Rosenblueth y Martínez (2006). Debido a que las comunidades aisladas en este estudio fueron obtenidas de plantas afectadas por S. subterranea, es posible que su funcionamiento dependa de condiciones ambientales y biológicas relativamente específicas.
CONCLUSIONES
Se presentó una distribución diferencial de bacterias con potencial biocontrolador de patógenos, con mayor abundancia de productores de indoles totales y de quitinasas aislados del interior de la raíz o de la rizósfera. Aunque es clara la necesidad de realizar estudios adicionales e identificar los aislamientos bacterianos evaluados en esta investigación, estos hallazgos permitirían diseñar estrategias efectivas para la búsqueda de biocontroladores de Spongospora subterranea u otros patógenos del suelo en plantas de papa.
AGRADECIMIENTOS
Los autores agradecen el apoyo logístico y/o económico de Colciencias, del Posgrado en Ciencias - Biotecnología, los Laboratorios de Microbiología del Suelo y Control Biológico de la Universidad Nacional de Colombia, Sede Medellín y al Laboratorio de Biotecnología de la Universidad EAFIT, Sede Medellín.
BIBLIOGRAFÍA
Atlas, R.M. 2005. Handbook of media for environmental microbiology. Second edition. CRC Press, Boca Raton, Florida. 544 p. [ Links ]
Barazani, O. and J. Friedman. 1999. Is IAA the major root growth factor secreted from plant-growth-mediating bacteria? Journal of Chemical Ecology 25(10): 2397-2406. [ Links ]
Bashan, Y. and G. Holguin. 1998. Proposal for the division of plant growth - promoting rhizobacteria into two classifications: biocontrol-PGPB (plant growth promotion bacteria) and PGPB. Soil Biology and Biochemistry 30(8-9): 1225-1228. [ Links ]
Bashan, Y. and L.E. de-Bashan. 2005. Bacteria/plant growth-promotion. Encyclopedia of Soils in the Environment 1: 103-115. [ Links ]
Benítez, T., A.M. Rincón, M.C. Limón and A.C. Codón. 2004. Biocontrol mechanisms of Trichoderma strains. International Microbiology 7:249-260. [ Links ]
Berg, G., A. Krechel, M. Ditz, R.A. Sikora, A. Ulrich and J. Hallmann. 2005. Endophytic and ectophytic potato-associated bacterial communities differ in structure and antagonistic function against plant pathogenic fungi. FEMS Microbiology Ecology 51:215-229. [ Links ]
Bhattacharya, D., A. Nagpure, and R.K. Gupta. 2007. Bacterial chitinases: properties and potential. Critical Reviews in Biotechnology 27(1): 21-28. [ Links ]
Bialek, K., L. Michalczuk and J.D. Cohen. 1992. Auxin Biosynthesis during seed germination in Phaseolus vulgaris. Plant Physiology 100: 509-517. [ Links ]
Cattelan, A.J. 1999. Métodos cuantitativos para determinação de caracteristicas bioquimicas e fisiológicas associadas com bactérias promotoras do crescimento vegetal. Embrapa, Londrina. 36 p. [ Links ]
Chet, I., A. Ordentlich, R. Shapira and A. Oppenheim. 1990. Mechanisms of biocontrol of soil-borne plant pathogens by rhizobacteria. Plant and Soil 129(1): 85-92. [ Links ]
Compant, S., B. Duffy, J. Nowak, C. Clément and E.A. Barka. 2005. Use of plant growth-promoting bacteria for biocontrol of plant diseases: principles, mechanisms of action, and future prospects. Applied and Environmental Microbiology 71(9): 4951-4959. [ Links ]
De Araujo, J.M., A.C. da Silva and J.L. Azevedo. 2000. Isolation of endophytic actinomycetes from roots and leaves of maize (Zea mays L.). Brazilian Archives of Biology and Technology 43(4): 447-451. [ Links ]
De Leij, F.A., J.M. Whipps and J.M. Lynch. 1994. The use of colony development for the characterization of bacterial communities in soil and on roots. Microbial Ecology 27(1):81-97. [ Links ]
Dhingra, O.D. and J.B. Sinclair. 1985. Basic plant pathology methods. CRC Press, Boca Raton, Florida. 355 p. [ Links ]
Dobbelaere, S., J. Vanderleyden and Y. Okon. 2003. Plant growth promoting effects of diazotrophs in the rhizosphere. Critical Reviews in Plant Science 22(2):107-149. [ Links ]
Down, G.J., L.J. Grenville and J.M. Clarkson. 2002. Phylogenetic analysis of Spongospora and implications for the taxonomic status of the plasmodiophorids. Mycological Research 106(9): 1060-1065. [ Links ]
Duo-Chuan, L. 2006. Review of fungal chitinases. Mycopathologia 161(6): 345-360. [ Links ]
El-Tarabily, K.A., M.H. Soliman, A.H. Nassar, H.A. Al-Hassani, K. Sivasithmparam F. Mckenna and G.E. St. J. Hardy. 2000. Biological control of Sclerotinia minor using a chitinolytic bacterium and actinomycetes. Plant Patholology 49: 573-583. [ Links ]
Garbeva, P., J.A. van Veen and J.D. van Elsas. 2004. Microbial diversity in soil: selection of microbial populations by plant and soil type and implications for disease suppressiveness. Annual Review of Phytopathology 42:243-270. [ Links ]
Gilchrist, E., S. Jaramillo y S. Reynaldi. 2009. Efecto sobre la sarna polvosa de cuatro aislamientos del hongo Trichoderma asperellum en tres tipos de suelo. Revista Facultad Nacional de Agronomía Medellín 62(1): 4783-4792. [ Links ]
Gilchrist, E., J. Soler, U. Merz and S. Reynaldi. 2011. Powdery scab effect on the potato Solanum tuberosum ssp. Andigena growth and yield. Tropical Plant Pathology 36(6): 350-355. [ Links ]
Glick, B.R. and Y. Bashan. 1997. Genetic manipulation of plant growth-promoting bacteria to enhance biocontrol of phytopathogens. Biotechnology Advances 15(2): 353-378. [ Links ]
Gohel, V., A. Singh, M. Vimal, P. Ashwini and H.S. Chhatpar. 2006. Bioprospecting and antifungal potential of chitinolytic microorganisms. African Journal of Biotechnology 5(2): 54-72. [ Links ]
Hallmann, J., A. Quadt-Hallmann, W.F. Mahaffee and J.W. Kloepper. 1997. Bacterial endophytes in agricultural crops. Canadian Journal of Microbiology 43(10): 895 -914. [ Links ]
Harrison, J.G., R.J. Searle and N.A. Williams. 1997. Powdery scab disease of potato- A review. Plant Pathology 46(1): 1-25. [ Links ]
Hardoim, P., L.S. van Overbeek and J.D. van Elsas. 2008. Properties of bacterial endophytes and their proposed role in plant growth. Trends in Microbiology 16(10): 463-471. [ Links ]
Hernández, A., N. Rives, A. Caballero, A.N. Hernández y M. Heydrich. 2004. Caracterización de rizobacterias asociadas al cultivo del maíz en la producción de metabolitos del tipo AIA, sideróforos y ácido salicílico. Revista Colombiana de Biotecnología 6(1): 6-13. [ Links ]
Huang, C.J., T.K. Wang, S.C. Chung and C.Y. Chen. 2005. Identification of an antifungal chitinase from a potential biocontrol agent, Bacillus cereus 28-9. Journal of Biochemistry and Molecular Biology 38(1): 82-88. [ Links ]
Hoyos, L.M., S. Jaramillo y S. Orduz. 2008. Evaluación de Trichoderma asperellum como biorregulador de Spongospora subterranea f. sp. Subterranea. Revista Facultad Nacional de Agronomía Medellín 61(2): 4496-4502. [ Links ]
Inbar, J. and I. Chet. 1991. Evidence that chitinase produced by Aeromonas caviae is involved in the biological control of soil-borne plant pathogens by this bacterium. Soil Biology and Biochemistry 23(10): 973-978. [ Links ]
Jollès, P. and R.A. Muzzarelli. 1999. Chitin and chitinases. Birkhäuser Verlag, Basel, Switzerland. 335 p. [ Links ]
Joo, G.J. 2005. Purification and characterization of an extracellular chitinase from the antifungal biocontrol agent Streptomyces halstedii. Biotechnology Letters 27(19): 1483-1486. [ Links ]
Khan. Z. and S.L. Doty. 2009. Characterization of bacterial endophytes of sweet potato plants. Plant Soil 322:197-207. [ Links ]
Kirk, J.L., L.A. Beaudette, M. Hart, P. Moutoglis, J.N. Klironomos, H. Lee and J.T. Trevors. 2004. Methods of studying soil microbial diversity. Journal of Microbiological Methods 58: 169- 188. [ Links ]
Kloepper, J.W., R. Lifshitz and R.M. Zablotowicz. 1989. Free living bacterial inocula for enhancing crop productivity. Trends in Biotechnology 7(2): 39-43. [ Links ]
Koshiba, T. and H. Matsuyama. 1993. An in vitro system of indole-3-Acetic acid formation from tryptophan in maize (Zea mays) coleoptile extracts. Plant Physiology 102: 1319-1324. [ Links ]
Lang, G.I., A.W. Murray and D. Botstein. 2009. The cost of gene expression underlies a fitness trade-off in yeast. Proceedings of the National Academy of Sciences 106(14): 5755-5760. [ Links ]
Liu, Y., J. Tao, Y. Yan, B. Li, H. Li and C. Li. 2011. Biocontrol efficiency of Bacillus subtilis SL-13 and characterization of an antifungal chitinas. Chinese Journal of Chemical Engineering 19(1): 128-134. [ Links ]
Lottmann, J., H. Heuer, K. Smalla and G. Berg. 1999. Influence of transgenic T4-lysozyme-producing potato plants on potentially beneficial plant-associated bacteria. FEMS Microbiology Ecology 29: 365-377. [ Links ]
Madi, L., T. Katan, J. Katan and Y. Henis. 1997. Biological control of Sclerotium rolfsii and Verticillium dahliae by Talaromyces flavus is mediated by different mechanisms. Phytopathology 87(10): 1054-1060. [ Links ]
Martínez, O., M.A. Jorquera, D.E. Crowley, G. Gajardo and M.L. Mora. 2010. Mechanisms and practical considerations involved in plant growth promotion by rhizobacteria. Journal of Soil Science and Plant Nutrition 10(3): 293-319. [ Links ]
Merz, U. 2008. Powdery scab of potato-occurrence, life cycle and epidemiology. Symposium paper. American Journal Potato Research 85(4): 241-246. [ Links ]
Merz, U. and R.E. Falloon. 2009. Review: powdery scab of potato-increased knowledge of pathogen biology and disease epidemiology for effective disease management. Potato Research 52(1): 17-37. [ Links ]
Mujahid, M., C. Sasikala and C.V. Ramana. 2011. Production of indole-3-acetic acid and related indole derivatives from L-tryptophan by Rubrivivax benzoatilyticus JA2. Applied Microbiology Biotechnology 89(4): 1001-1008. [ Links ]
Nannipieri, P., J. Ascher, M.T. Ceccherini, L. Landi, G. Pietramellara, G. Renella and F. Valori. 2007. Microbial diversity and microbial activity in the rhizosphere. Ciencia del Suelo 25(1): 89-97. [ Links ]
Nielsen, S.L. and J. Larsen. 2004. Two Trichoderma harzianum-based bio-control agents reduce tomato root infection with Spongospora subterranea (Wallr.) Lagerh., f. sp. subterranea, the vector of Potato mop-top virus. Journal of Plant Diseases and Protection 111(2): 145-150. [ Links ]
O'Kennedy, M.M., B.G. Crampton, M. Lorito, E. Chakauya, W.A. Breese, J.T. Burger and F.C. Botha. 2011. Expression of a b-1,3-glucanase from a biocontrol fungus in transgenic pearl millet. South African Journal of Botany 77(2): 335-345. [ Links ]
Ordentlich, A., Y. Elad and I. Chet. 1988. The role of chitinase of Serratia marcescens in biocontrol of Sclerotium rolfsii. Phytopathology 78(1): 84-88. [ Links ]
Paul, E.A. 2007. Soil Microbiology, Ecology, and Biochemistry. Third edition. Elsevier, Amsterdam. 535 p. [ Links ]
Patten, C.L. and B.R. Glick. 1996. Bacterial biosynthesis of indole-3-acetic acid. Canadian Journal of Microbiology 42(3): 207-220. [ Links ]
Pinton, R,. Z. Varanini and P. Nannipieri. 2007. The rhizosphere: biochemistry and organic substances at the soil-plant interface. Second edition. CRC Press, Boca Raton, Fl. 472 p. [ Links ]
Reiter, B., U. Pfeifer, H. Schwab and A. Sessitsch. 2002. Response of endophytic bacterial communities in potato plants to infection with Erwinia carotovora subsp. atroseptica. Applied and Environmental Microbiology 68(5): 2261-2268. [ Links ]
Restrepo, A.F., S. Jaramillo y J.M. Cotes. 2009. Efecto de dos microorganismos y un consorcio de micorrizas en combinación con viruta de pino sobre el control de sarna polvosa (Spongospora subterranea) en papa. Revista Facultad Nacional de Agronomía Medellín 62(2): 5047-5054. [ Links ]
Rosenblueth, M. and E. Martínez. 2006. Bacterial endophytes and their interactions with hosts. Molecular Plant-Microbe Interactions 19:(8): 827-837. [ Links ]
Sarwar, M., M. Arshad, D.A. Martens and W.T. Frankenberger. 1992. Tryptophan-dependent biosynthesis of auxins in soil. Plant and Soil 147(1): 207-215. [ Links ]
Sarwar, M. and R.J. Kremer. 1995. Determination of bacterially derived auxins using a microplate method. Letters in Applied Microbiology 20(5): 282-285. [ Links ]
Sessitsch, A., B. Reiter and G. Berg. 2004. Endophytic bacterial communities of field-grown potato plants and their plant-growth-promoting and antagonistic abilities. Canadian Journal of Microbiology 50(4): 239-249. [ Links ]
Singh, P.P., Y.C. Shin, C.S. Park and Y.R. Chung. 1999. Biological control of Fusarium wilt of cucumber by chitinolytic bacteria. Phytopathology 89(1): 92-99. [ Links ]
Spaepen, S., S. Dobbelaere, A. Croonenborghs and J. Vanderleyden. 2008. Effects of Azospirillum brasilense indole-3-acetic acid production on inoculated wheat plants. Plant and Soil 312(1-2): 15-23 [ Links ]
Sturz, A.V., B.R. Christie, B.G. Matheson, W.J. Arsenault and N.A. Buchanan. 1999. Endophytic bacterial communities in the periderm of potato tubers and their potential to improve resistance to soil-borne plant pathogens. Plant Pathology 48(3): 360-369. [ Links ]
Tsavkelova, E.A., S.Y. Klimova, T.A. Cherdyntseva and A.I. Netrusov. 2006. Microbial producers of plant growth stimulators and their practical use: a review. Applied Biochemistry and Microbiology 42(2): 117-126. [ Links ]
Van de Graaf, P., S.J. Wale and A. K. Lees. 2007. Factors affecting the incidence and severity of Spongospora subterranea infection and galling in potato roots. Plant Pathology 56(6): 1005-1013. [ Links ]
Van Loon, L.C., P.A. Bakker and C.M. Pieterse. 1998. Systemic resistance induced by rhizosphere bacteria. Annual Rewiew of Phytopathology 36: 453-483. [ Links ]
Yang, C., D.E. Crowley and J.A. Menge. 2001. 16S rDNA fingerprinting of rhizosphere bacterial communities associated with healthy and Phytophthora infected avocado roots. FEMS Microbiology Ecology 35(2): 129-136. [ Links ]
Yasmin, F., R. Othman, K. Sijam and M.S. Saad, 2009. Characterization of beneficial properties of plant growth-promoting rhizobacteria isolated from sweet potato rhizosphere. African Journal of Microbiology Research 3(11): 815-821. [ Links ]
Zhang, Z., G.Y. Yuen, G. Sarath and A.R. Penheiter. 2001. Chitinases from the plant disease biocontrol agent, Stenotrophomonas maltophilia C3. The American Phytopathological Society 91(2): 204-211. [ Links ]