Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.65 no.1 Medellín Jan./June 2012
Actividades Enzimáticas en Consorcios Bacterianos de Suelos Bajo Cultivo de Papa con Manejo Convencional y Bajo Pastizal
Enzyme Activities in Bacterial Consortium Isolated from Soils with Potato Crop under Conventional Management and under Grassland
Lizeth Manuela Avellaneda-Torres1; Luz Marina Melgarejo Muñoz2; Carlos Eduardo Narváez Cuenca3 y Jimena Sánchez Nieves4
1 Química. Universidad Nacional de Colombia - Sede Bogotá - Facultad de Agronomía. Carrera 45 No. 26-85, Bogotá, Colombia. <lmavellanedat@unal.edu.co>
2 Profesora Asociada. Universidad Nacional de Colombia - Sede Bogotá - Facultad de Ciencias - Departamento de Biología. Carrera 45 No. 26-85, Bogotá, Colombia. <lmmelgarejom@unal.edu.co>
3 Profesor Asistente. Universidad Nacional de Colombia - Sede Bogotá - Facultad de Ciencias - Departamento de Química. Carrera 45 No. 26-85, Bogotá, Colombia. <cenarvaezc@unal.edu.co>
4 Profesora Asistente. Universidad Nacional de Colombia - Sede Bogotá - Facultad de Ciencias - Departamento de Biología. Carrera 45 No. 26-85, Bogotá, Colombia. <jsanchezn@unal.edu.co>
Recibido: Noviembre 04 de 2011; aceptado: Mayo 09 de 2012.
Resumen. Se evaluaron las actividades enzimáticas (ureasa, proteasa, fosfatasa ácida y alcalina, fosfodiesterasa, b-glucosidasa y arilsulfatasa) en consorcios bacterianos (Bacillus subtilis, Brevundimonas diminuta, Flavimonas oryzihabitants) de suelos bajo cultivo de papa variedad Parda Pastusa, con manejo convencional de aplicación de agroinsumos (PCA) y en suelos bajo pastizal sin aplicación de agroinsumos (PSA), en fincas de tres localidades del departamento de Cundinamarca (Tausa, Villapinzón y Zipaquirá), Colombia. Se encontraron efectos por la aplicación de insumos de síntesis química y el tipo de uso del suelo, sobre las actividades enzimáticas; sin embargo, estos fueron diferentes para cada una de las enzimas y localidades. Para el municipio de Villapinzón la actividad de ureasa, fosfatasa ácida, fosfodiesterasa y b-glucosidasa, fue mayor en las muestras PCA con respecto a las PSA en un 89, 71, 67 y 75% respectivamente; para el municipio de Zipaquirá se presentó la misma tendencia en la actividad ureasa, b-glucosidasa y arilsulfatasa con un 50, 71 y 68% respectivamente; finalmente en el municipio de Tausa se mantuvo el mismo comportamiento para la actividad de proteasa, fosfatasa ácida, fosfatasa alcalina, fosfodiesterasa, b-glucosidasa, con un 55, 20, 75, 82 y 87% de mayor actividad en las muestras PCA en relación con las de PSA.
Palabras clave: Ureasa, proteasa, fosfatasas, b-glucosidasa, arilsulfatas, enzimas
Abstract. Enzyme activities were evaluated (urease, protease, acid phosphatase and alkaline phosphodiesterase, b-glucosidase and arylsulfatase) in bacterial consortia (Bacillus subtilis, Brevundimonas diminuta, Flavimonas oryzihabitants) from either soil with potato cropping under conventional management with the application of agrochemicals (PWA) or grassland soils without the use of agrochemicals (GNA) on farms of three municipalities (Tausa, Villapinzón and Zipaquirá) in the department of Cundinamarca, Colombia. The type of land use and the location affected the tested enzymatic activities. In the municipality of Villapinzón urease, acid phosphatase, phosphodiesterase and b-glucosidase activity were higher in PWA than GNA by 89, 71, 67 and 75% respectively. The municipality of Zipaquirá presented the same trend in urease, b-glucosidase and arylsulfatase with higher activity in PWA than GNA by 50, 71 and 68% respectively. Finally in Tausa, the same behavior was found for protease, acid phosphatase, alkaline phosphatase, phosphodiesterase and b-glucosidase with 55, 20, 75, 82 and 87% higher activity in PWA than GNA.
Key words: Urease, protease, phosphatases, b-glucosidase, arylsulfatase, enzymes.
Diversas investigaciones sobre consorcios microbianos han permitido estudiar los mecanismos que emplean los microorganimos para establecerse y permanecer en distintos ambientes incluyendo el sistema suelo (Giordano et al., 2005; Madueño et al., 2009). Así mismo, se ha establecido que los microorganismos y específicamente las bacterias del suelo no actúan de manera aislada, sino que se dinamizan mediante múltiples interacciones que incluyen relaciones de sinergismo y antagonismo, entre otras, las cuales contribuyen al buen funcionamiento y equilibrio ecológico del sistema edáfico (Bottomley, 1998). Por ejemplo, se ha registrado mayor efectividad de los consorcios bacterianos para la degradación de compuestos xenobióticos y derivados orgánicos con respecto a cepas bacterianas individuales (Paixão et al., 2010).
Los suelos contienen diversas poblaciones de microorganismos cuya actividad es fundamental para el mantenimiento de los ciclos biogeoquímicos, destacando que se ha incrementado el interés en estudios microbiológicos edáficos como un indicador sensible de la calidad y salud del suelo, al evidenciar relaciones entre la diversidad microbiana, las plantas, el suelo y la sustentabilidad del ecosistema (Doran et al., 1994; Doran et al., 1999). No obstante, es difícil establecer indicadores de calidad del suelo que permitan estimar y cuantificar el nivel de calidad de éste, especialmente porque muchos cambios ocurren paulatinamente y por lo tanto, las variaciones en la calidad del suelo se perciben cuando todos los efectos se combinan al cabo de determinado tiempo (Doran et al., 1994; Doran et al., 1999).
Los microorganismos son una de las principales fuentes de enzimas del suelo, en el cual las actividades enzimáticas desempeñan un papel importante por su relación con la evolución y procesos degradativos de la materia orgánica, con los ciclos de elementos como nitrógeno, fósforo, carbono, azufre; así como, con el metabolismo intracelular, pudiendo ser considerados como catalizadores que generan información importante para el entendimiento del suelo como ecosistema. Entre los factores que pueden afectar la actividade enzimática del suelo tienen notable importancia la especie vegetal cultivada, el manejo agrícola y el uso de enmiendas (Burns, 1982; Acosta y Tabatabai, 2000; Ahmad et al., 2001). En ese sentido investigaciones sobre la actividad de las enzimas extracelulares en diversos ecosistemas han mostrado que los productos químicos utilizados en agricultura (fertilizantes, plaguicidas, herbicidas, entre otros) influyen sobre las enzimas del suelo (Tabatabai, 1994; Alvear et al., 2006)
En este estudio se evaluó la actividad de enzimas relacionadas con los ciclos del nitrógeno (ureasa, proteasa), fósforo (fosfatasas ácida y alcalina, fosfodiesterasa), carbono (b-glucosidasa) y azufre (arilsulfatasa), a partir de consorcios bacterianos aislados de suelos bajo cultivo de papa con manejo convencional de aplicación de agroquímicos (PCA) y en suelos bajo pastizal sin aplicación de agroquímicos (PSA), en fincas de los municipios de Tausa, Villapinzón y Zipaquirá del departamento de Cundinamarca, Colombia.
MATERIALES Y MÉTODOS
Muestreo. Se muestrearon suelos provenientes de tres fincas del departamento de Cundinamarca-Colombia en los municipios de Tausa (vereda Páramo Bajo, finca: Páramo Bajo N 03o40'14,9"; W 073°39'51,1" y N 03°35'50,4"; W 073°28'56,0"), Zipaquirá (vereda Páramo Guerrero Oriental, finca: Puente de Tierra N 04°05'59,7"; W 072°54'34,6" y N 03°37'32,9"; W 073°37'39,8") y Villapinzón (vereda Salitre Alto, finca: Santa Ana N 03°43'43,5"; W 073°42'18,6" y N 03°43'43,5"; W 073°42'18,6"). Se seleccionaron dos tipos de muestras: 1. Suelos en monocultivo de papa (Solanum tuberosum) en estado poscosecha variedad Parda Pastusa que presentaban al menos diez años de uso agrícola en un esquema de manejo convencional de aplicación de agroquímicos (PCA) que incluían (Agricon®, Carbotox®, Nudrin®, Roxion®, Larvin®, Lorsban®, Lannate®, Eltra®, Methox®, Carbofed®, Furalimor SC, Alodrin®, Fursem®, Furadan®, entre otros), fungicidas (Magricen 80%, Oxicloruro de Cobre, Mancozeb, Acrobat®, Forum®, Antracol®, Fitoraz®, Previcur®, Rhodax®, Curzate®, Manzate®, Kasumin®, entre otros), herbicidas (Glifosato, Sencor®, Gramafin®, Afalon®, Fusilade®, Gramoxone®, Reglone®) y fertilizantes de síntesis química de tipo N:P:K en proporciones de 10:30:10 en cantidades de 200 kg/ha, con reabonamiento de urea a los 40 días en cantidades de 200 kg ha-1. Estos suelos fueron denominados TP, ZP y VP respectivamente; y 2. Suelos bajo pastizal (Calamagrostis sp), los cuales no habían presentado aplicación de agroquímicos (plaguicidas y fertilizantes) en al menos 10 años. Estos suelos fueron denominados T, Z y V respectivamente.
En cada sitio de muestreo se efectuó un recorrido en zig - zag en una parcela de una hectárea para la obtención de tres muestras integradas de suelo, conformadas cada una por diez submuestras (recolectadas cada 15 pasos). Cada submuestra fué tomada en la porción correspondiente a los primeros 20 cm de suelo, cada una con 50 g. Finalmente, las muestras se depositaron en bolsas plásticas estériles y se transportaron al laboratorio para su posterior análisis.
Ensayos in vitro de consorcios bacterianos de los suelos. Se obtuvieron consorcios de morfotipos bacterianos mediante la integración y modificación de diferentes métodos (Chaudhry y Ali, 1988; Chapalamadugu y Chaudhry, 1992; Chaudhry et al., 2002a; Miyatake e Iwabuchi, 2005; Zotta et al., 2007; Zotta et al., 2008), para lo cual:
Se procedió a obtener preinóculos para cada suelo evaluado, para esto se pesaron 3 g de suelo y se suspendieron en 27 mL de caldo nutritivo, incubando a 37 °C, en agitación constante a 120 rpm, durante 24 h. Posteriormente, se obtuvieron los inóculos para cada uno de los suelos evaluados tomando una alícuota de 3 mL del preinóculo y depositándolo en 27 mL de caldo nutritivo, se incubó a 37 °C, en agitación constante a 120 rpm, durante 24 h.
Se obtuvieron curvas de biomasa bacteriana tomando alícuotas de 3 mL del inóculo que fueron adicionadas en 27 mL de caldo nutritivo, posteriormente se incubó a 37 °C, en agitación constante a 120 rpm, determinando cada hora la densidad óptica (DO) a 600 nm. Una vez alcanzada la fase estacionaria se tomaron alícuotas de 0,1 mL y se realizó siembra en placa en superficie en cajas de Petri con agar nutritivo, se documentó el recuento de unidades formadoras de colonia por gramo de suelo (UFC g-1). Los procedimientos se realizaron por triplicado.
Para la caracterización de los morfotipos bacterianos se efectuó la descripción macroscópica y microscópica de las colonias obtenidas, tinción de Gram, montaje de tinta china para observación de presencia de cápsula bacteriana, tinción de Shaeffer-Fulton para observación de endosporas, prueba de pigmentos fluorescentes, así como uso del sistema comercial de identificación bacteriana BBL CRYSTAL® Becton Dickinson, Maryland, USA, cuyos paneles contienen 30 substratos bioquímicos y enzimáticos deshidratados, que son degradados y detectados mediante cambios de color y luz UV. Adicionalmente, se aplicaron diferentes pruebas bioquímicas para evaluar la utilización bacteriana de sustratos tales como rojo de metilo, Voges Proskauer, indol, oxidasa, catalasa, fermentación de carbohidratos, SIM (sulfuro-indol-motilidad), citrato de Simons (Koneman et al., 1992; Holt et al., 1994).
Determinación de las actividades enzimáticas en los consorcios de bacterias cultivables a partir de las muestras de suelo. Previo a la determinación enzimática se efectuó la preparación de las muestras de consorcios bacterianos mediante modificaciones a la metodología propuesta por Chaudhry et al. (2002b) para lo cual se tomaron alícuotas de 10 mL de las células en suspensión obtenidas en la fase estacionaria de la curva de biomasa y se agitaron con vórtex por 5 min (Chaudhry et al., 2002b). Se permitió la decantación de partículas del suelo dispersas aún en el medio. Se tomó el sobrenadante y se centrifugó a 10.000 rpm por 10 min, a 4 °C. Posteriormente, se tomó el pellet y se lavó dos veces con el buffer empleado para la determinación de la respectiva actividad enzimática, se centrifugó a 10.000 rpm por 10 min, a 4 °C. Una vez centrifugado el pellet se resuspendió en 800 mL del respectivo buffer y se aplicó sonicación por 10 min (pulsos de 30 s de sonicación y 15 s de descanso sobre baño de hielo). Finalmente, se determinó la actividad enzimática de acuerdo con los siguientes métodos modificados: ureasa (EC 3.5.1.5) (Kandeler y Gerber, 1988), proteasa (EC 3.4.2.21-24) (Ladd y Butler, 1972), fosfatasa ácida y alcalina (EC 3.1.3.2 y 3.1.3.1 respectivamente) (Tabatabai y Bremner, 1969; Eivazi y Tabatabai, 1988), fosfodiesterasa (EC 3.1.4.1) (Browman y Tabatabai, 1978), arilsulfatasa (EC 3.1.6.1) (Tabatabai y Bremner, 1970) y b-glucosidasa (EC 3.2.1.21) (Tabatabai, 1982; Eivazi y Tabatabai, 1988). Las modificaciones realizadas fueron las siguientes: se partió de 800 mL de suspensión bacteriana y se adicionaron los respectivos reactivos con base en cálculos para 0,2 g de suelo inicial. Las actividades enzimáticas se expresaron en función del volumen de suspensión celular tomada. Este procedimiento se realizó por triplicado.
Análisis estadístico. Se analizaron los supuestos de homogeneidad de varianzas y de normalidad mediante la prueba de Bartlett y Shapiro-Wilk. Se realizó análisis de varianza con arreglo factorial - DCA (municipio y uso de suelo, con tres y dos niveles de tratamiento respectivamente), se aplicaron pruebas de comparaciones múltiples de Duncan.
RESULTADOS Y DISCUSIÓN
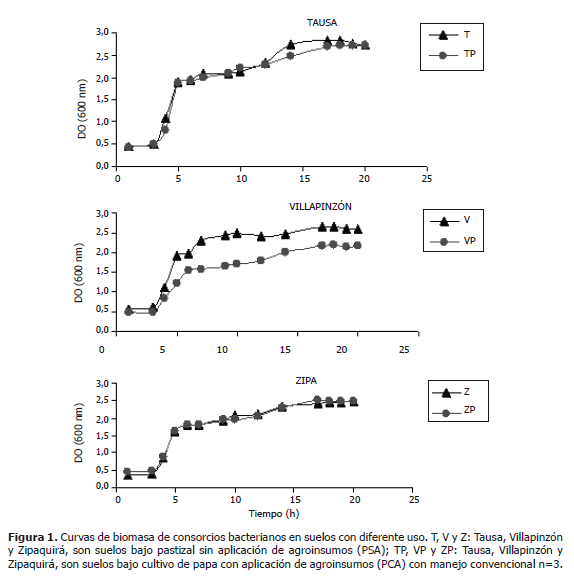
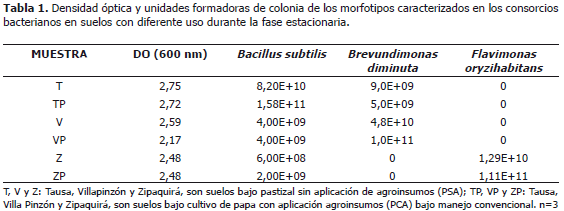
Ensayos in vitro de consorcios bacterianos de los suelos evaluados. De acuerdo con la Figura 1 las fases de latencia para las muestras provenientes de los tres municipios iniciaron con una DO alrededor de 0,5 sin presentarse efecto en cuanto al uso y a la localidad de donde provinieron las muestras de suelo. La fase exponencial para los tres casos inició alrededor de las tres horas y la fase estacionaria hacia la hora siete. En el caso de los consorcios provenientes del municipio de Villapinzón se observó que para las muestras de suelo PSA (sin aplicación de agroinsumos), la DO fue estadísticamente mayor (Tabla 1). Debe notarse que la DO permite estimar el crecimiento de biomasa para cada uno de los consorcios, sin embargo, no representa el número de células viables; por lo cual, los resultados se complementaron mediante el método de series de dilución y siembra en placa para conteo de células viables en superficie.
En los consorcios de Tausa y Villapinzón se caracterizaron dos morfotipos bacterianos presentes en ambos suelos: Bacillus subtilis (99,96% de confiabilidad) y Brevundimonas diminuta (96,71% de confiabilidad). Para el caso de Zipaquirá se encontraron dos morfotipos bacterianos: Bacillus subtilis (99,96% de confiablidad) y Flavimonas oryzihabitans (90,25% de identidad). Debe notarse que en el consorcio de Tausa se obtuvo un mayor recuento para B. subtilis con respecto a B. diminuta (Tabla 1); mientras que en los consorcios provenientes del municipio de Villapinzón la relación es inversa. En cuanto a los consorcios de las muestras de suelo Zipaquirá no se obtuvo crecimiento de B. diminuta, registrando un mayor recuento para F. oryzihabitans en comparación con el recuento obtenido para B. subtilis.
B. subtilis es una bacteria Gram positiva comúnmente encontrada en el suelo, para la cual se ha mencionado que confiere resistencia a las plantas frente a estrés biótico y abiótico (Das y Mukherjee, 2007). Así mismo, para especies del género Bacillus se ha encontrado actividad de promoción del crecimiento vegetal (principalmente mediante solubilización de fosfatos) y de biodegradación de xenobióticos en suelos (Rodríguez y Fraga, 1999).
B. diminuta (denominada también como Pseudomonas diminuta) y F. oryzihabitans (antes conocida como Pseudomonas oryzihabitans) son bacterias Gram negativas que han sido consideradas en biodegradación de diferentes xenobióticos como por ejemplo hidrocarburos aromáticos policíclicos, diclorometano, dicloro difenil tricloroetano (DDT), entre otros (Chang et al., 2007). Adicionalmente, se han establecido otro tipo de actividades para dichos géneros, encontrando que B. diminuta puede ejercer antagonismo contra Colletotrichum gloeosporioides (Kefialew y Ayalew, 2008) y que F. oryzihabitans es un indicador de contaminación (Ávila y Estupiñan, 2006).
Los tres morfotipos bacterianos caracterizados en este estudio, han sido señalados como bacterias encontradas en diferentes hábitats y agroecosistemas, presentando potencial de biodegradación de agentes xenobióticos, promoción de crecimiento vegetal y como indicadores de situaciones de estrés y de problemas ambientales.
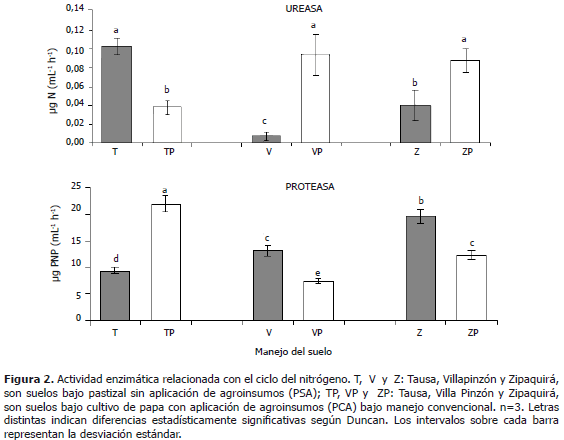
Actividades enzimáticas relacionadas con el ciclo del nitrógeno: ureasa y proteasa. En la Figura 2 se puede observar que en los consorcios provenientes de los suelos de los municipios de Zipaquirá y Villapinzón se presentaron valores mayores y estadísticamente significativos para la actividad de la ureasa en los suelos PCA con respecto a los suelos PSA; lo que podría estar relacionado con el efecto de la fertilización química y la presencia de plaguicidas que posiblemente han promovido la actividad de la ureasa en los consorcios bacterianos evaluados, como respuesta a fenómenos de adaptación microbiana a xenobióticos presentes en el suelo (Hickey, 1998), dada la frecuente aplicación de agroinsumos en el cultivo de papa. Para el suelo del municipio de Tausa se presentó una relación contraria para dicha enzima, por lo cual se podría establecer una variación en el funcionamiento de los consorcios bacterianos, posiblemente por efecto de su historia de uso agrícola, pero, no existe un efecto estadísticamente significativo en cuanto a la localidad a la que pertenecieron los suelos muestreados.
En la Figura 2 se presenta la actividad de la proteasa en los diferentes consorcios bacterianos, observando un comportamiento inverso con respecto a la actividad de la ureasa. Las muestras de suelo PSA de los municipios de Villapinzón y Zipaquirá presentaron mayor actividad de la proteasa, en contraste con los suelos PCA que presentaron menor actividad; en tanto que para las muestras de suelo de Tausa, se observó un comportamiento inverso. Esto indica que para los consorcios obtenidos de las muestras provenientes de los municipios de Villapinzón y Zipaquirá que no han presentado aplicación de agroinsumos, posiblemente se están priorizando los procesos de producción de oligopéptidos a partir de las proteínas, con la subsecuente liberación de compuestos de bajo peso molecular y aminoácidos (Schinner et al., 1996), sobre la hidrólisis de urea o sustratos de tipo ureico para producir CO2 y NH3 como productos de reacción (García et al., 2000), probablemente durante la fase estacionaria de crecimiento de estos consorcios.
Resulta complejo entender la dinámica del ciclo del nitrógeno y por tanto, dichos resultados pueden deberse posiblemente a que durante la fase estacionaria de crecimiento de los consorcios, sea un morfotipo específicamente el que esté encargándose principalmente de la actividad ureasa y otro al desarrollo de la actividad de la proteasa, probablemente debido a que durante la fase estacionaria un morfotipo es mayoritario y el otro minoritario, observando que se presentó esa relación inversa entre la actividad de la ureasa y la proteasa. Adicionalmente, puede deberse a que la actividad de la ureasa y la proteasa esté determinada por la fase de crecimiento en la que se encuentre uno de los géneros bacterianos dentro del consorcio y que por tanto durante la fase estacionaria, se dé prioridad ya sea a la actividad de la proteasa o la ureasa, dependiendo del tipo de suelo, es decir, que no se desarrollen simultáneamente ambas actividades enzimáticas. De esta manera se encuentra que se han detectado cambios en las actividades enzimáticas de los consorcios en lo que se refiere a la proteasa y la ureasa, posiblemente por efecto de su historia de uso agrícola. Adicionalmente, se señala que en ambos casos no se encuentra un efecto estadísticamente significativo en cuanto al sitio de donde provienen las muestras. Se ha mencionado que la actividad de la proteasa generalmente es mayor en suelos de pastura y ricos en materia orgánica y menor en suelos minerales o cultivados (Bolaños, 2006) y de igual forma, se ha encontrado que la mayor actividad de la proteasa también puede estar asociada con residuos de plantas en diferentes estados de descomposición, así como con un aumento en la población microbiana que puede ocurrir en suelos con aplicación de enmiendas, lo que a su vez está directamente relacionado con la cantidad de materia orgánica en el suelo (Gunapala y Scow, 1988), por lo tanto, el leve aumento observado en los suelos PSA probablemente se deba a una elevada actividad microbiana presente en estas localidades.
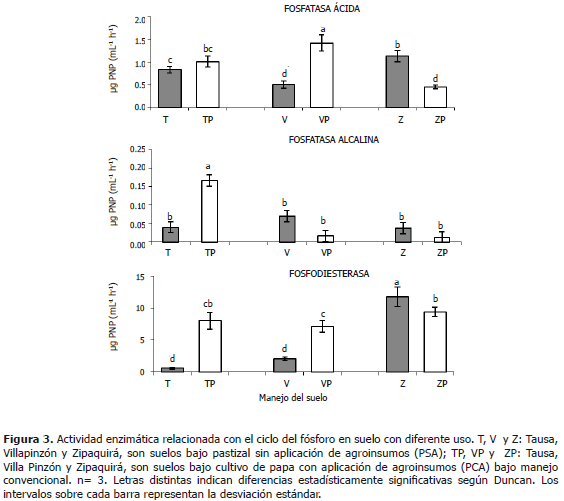
Actividades enzimáticas relacionadas con el ciclo del fósforo: fosfatasa ácida, alcalina y fosfodiesterasa. La fosfatasa es una hidrolasa que activa la transformación de fósforo orgánico a inorgánico, haciéndolo por tanto asimilable por las plantas (García et al., 2000). Se puede observar en la Figura 3 que en los consorcios bacterianos provenientes de las muestras de los suelos de los municipios de Tausa y Villapinzón se presentó mayor actividad de la fosfatasa ácida en los suelos PCA con respecto a los suelos PSA. Sin embargo, estas diferencias sólo son estadísticamente significativas para los consorcios del municipio de Villapinzón. En el caso de los consorcios del municipio de Zipaquirá, la relación fue inversa y estadísticamente significativa. Esto indica que existió promoción de la actividad de la fosfatasa ácida en los consorcios probablemente por efecto de la fertilización y manejo convencional en los suelos de los municipios de Tausa y Villapinzón, en contraste con lo obtenido para los suelos del municipio de Zipaquirá. Se detectaron variaciones en la actividad de la fosfatasa ácida de los consorcios bacterianos, posiblemente relacionados con efectos del cultivo de papa y de la aplicación de agroinsumos, sin embargo, se observó que no hay un efecto estadísticamente significativo en cuanto al sitio de donde provenían las muestras.
Este aumento de la actividad de la fosfatasa ácida posiblemente esté dado por la alta aplicación de agroquímicos que modifican el pH del suelo, favoreciendo la actividad de la fosfatasa ácida. Así mismo, se ha indicado que la aplicación de insecticidas al suelo produce un incremento en la actividad de la fosfatasa (Dick y Tabatabai, 1984). Por otro lado se ha observado que la actividad de las proteasas y fosfatasas ácidas es estimulada por efecto de los fungicidas comerciales y por el estado de desarrollo de las plantas y adicionalmente, las actividades enzimáticas de la fosfatasa ácida, proteasa y celulasa, presentan comportamientos significativamente diferentes entre cultivos convencionales y orgánicos (Perucci et al., 1988; Murcía, 2002; Bolaños, 2006). Se ha apreciado también incremento en las actividades enzimáticas después de la adición de fertilizantes (NPK) y de abonos de corral (Kandeler et al., 1999), lo que concuerda con los resultados para las consorcios bacterianos de los suelos de los municipios de Villapinzón y Tausa. Por el contrario, otros autores encuentran mayor actividad de esta enzima en suelos no intervenidos (como por ejemplo en suelos de selva tropical) en comparación con suelos bajo labranza convencional, mostrando su relación con el uso del suelo (Dalurzo et al., 2000); lo que concuerda con los resultados obtenidos para los consorcios de los suelos del municipio de Zipaquirá. Así mismo, Gálviz et al. (2007) en su estudio sobre la actividad de la fosfatasa ácida en suelos bajo cultivo de papa y pastos (Catambuco - Pasto, Colombia), encontraron que en suelos de pastizal tanto en época de lluvias como de sequía, la actividad de la fosfatasa ácida en los suelos con pasto superó a la actividad encontrada en suelo cultivados con papa, siendo proporcional a los contenidos de materia orgánica (Gálviz et al., 2007).
La fosfatasa alcalina al igual que la fosfatasa ácida es una hidrolasa, su actividad óptima es a un pH básico, por lo cual su actividad es favorecida en suelos básicos. En la Figura 3, se puede observar que la actividad de la fosfatasa alcalina en los consorcios bacterianos es baja con respecto a la de la fosfatasa ácida, esto tiene sentido si se tiene en cuenta que la acidez de los suelos muestreados es alta (en todos los casos el pH fue inferior a 5,1 -datos no mostrados-). Para dicha enzima no se presentaron diferencias estadísticamente significativas con respecto al uso de los suelos, ni a la localidad de donde provinieron las muestras. Por lo tanto, no se detectaron cambios en la actividad de la fosfatasa alcalina de los consorcios bacterianos por posible efecto de la aplicación de agroinsumos.
La actividad de la fosfodiesterasa en los consorcios bacterianos (Figura 3) mantuvo la misma tendencia que la fosfatasa ácida, en el sentido que los consorcios provenientes de las muestras de suelo PCA para los municipios de Tausa y Villapinzón presentaron una actividad de la fosfodiesterasa estadísticamente mayor con respecto a los suelos PSA que no han tenido aplicación de agroquímicos; esto puede estar indicando que los procesos de hidrólisis de la transformación del fósforo orgánico a sus formas inorgánicas está correlacionado con la conversión de di-ester-fosfatos a mono-éster-fosfatos y con la degradación de los ácidos nucleicos. En el caso de la muestra de suelo del municipio de Zipaquirá, la relación fue inversa. De otro lado, en cuanto al efecto generado por la localidad de donde provinieron las muestras, la actividad de la fosfodiesterasa de los consorcios bacterianos de los suelos del municipio de Zipaquirá fue diferente estadísticamente con relación a las otras muestras. De esta manera se encontró que la actividad de la fosfodiesterasa de los consorcios bacterianos presentó variaciones, posiblemente por efecto de la aplicación de agroquímicos en el cultivo de papa, así como por efecto de la localidad de donde provinieron las muestras de suelo.
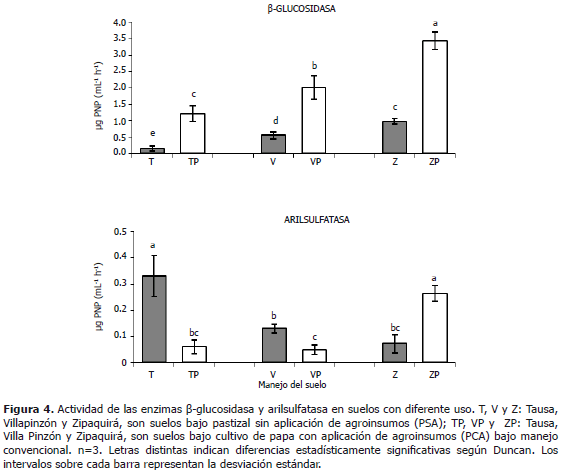
Actividades enzimáticas relacionadas con el ciclo del carbono y azufre: b-glucosidasa y arilsulfatasa respectivamente. En relación a la actividad b-glucosidasa en los consorcios bacterianos (Figura 4) se puede observar que la tendencia es la misma para los suelos de las tres localidades estudiadas, en el sentido que las actividades enzimáticas son superiores en aquellas muestras que han tenido cultivo de papa y manejo convencional (PCA). Estos resultados presentan similitudes en la tendencia presentada con la enzima ureasa para las muestras de suelo de los municipios de Villapinzón y Zipaquirá y con las enzimas fosfatasa ácida y fosfodiesterasa para las muestras de los municipios de Tausa y Villapinzón. También se observó que hay efecto estadísticamente significativo en cuanto a la localidad de donde provinieron las muestras, siendo el suelo PCA del municipio de Zipaquirá (ZP) el que tuvo mayor actividad b-glucosidasa y la muestra del suelo PSA del municipio de Tausa (T) la que menor actividad presentó. De esta manera, se encontró que la actividad de la b-glucosidasa de los consorcios bacterianos presentó variaciones, posiblemente por efecto de la aplicación de agroinsumos en el cultivo de papa (PCA) y la localidad de donde provienen las muestras, lo que sugiere una fuerte correlación entre su actividad y la biodisponibilidad de carbono en el suelo (Cañizares et al., 2011). Se ha reportado igualmente que su actividad depende del manejo del cultivo, sistema de cultivo y tipo de suelo (Kandeler et al., 2001). También se ha señalado que la b-glucosidasa refleja el estado de descomposición de la materia orgánica y que pertenece al grupo de enzimas que cataliza la conversión hidrolítica de la celulosa a glucosa, fuente de alimento de los microorganismos del suelo (Knight y Dick, 2004); en consecuencia, es probable que el comportamiento de la actividad de la b-glucosidasa en los consorcios sea indicativo de la tasa descomposición de la materia orgánica de los suelos de donde provienen.
La actividad de la arilsulfatasa (Figura 4) en general fue baja, tendencia similar a lo presentado por la fosfatasa alcalina. Esta actividad enzimática fue mayor en las muestras del municipio de Zipaquirá cuando se presentó aplicación de insumos de síntesis química, estos resultados están en consonancia con los de Pozo et al. (2003), en los cuales las actividades enzimáticas no fueron inhibidas por la presencia de 3,3-Diaminobencidina en el suelo. En los experimentos de los autores referidos, las actividades de la fosfatasa alcalina y arilsulfatasa, fueron estimuladas después de 7 días de incubación (Pozo et al., 2003).
CONCLUSIONES
En el municipio de Villapinzón se encontró que las actividades de las enzimas ureasa, fosfatasa ácida, fosfodiesterasa y b-glucosidasa, fue mayor en las muestras PCA con respecto a las PSA en un 89, 71, 67 y 75% respectivamente; para el municipio de Zipaquirá se presentó la misma tendencia en la actividad de las enzimas ureasa, b-glucosidasa y arilsulfatasa con un 50, 71 y 68% respectivamente; finalmente en el municipio de Tausa se mantuvo el mismo comportamiento para la actividad de las enzimas proteasa, fosfatasa ácida, alcalina, fosfodiesterasa, b-glucosidasa con un 55, 20, 75, 82 y 87% de mayor de actividad en las muestras PCA sobre las PSA. Los resultados indican que en lo que respecta al ciclo del nitrógeno, fósforo y carbono, probablemente hay un efecto de promoción por la fertilización, el uso de plaguicidas y el cultivo de papa sobre las actividades enzimáticas de los consorcios. En el municipio de Villapinzón la actividad de las enzimas proteasa, fosfatasa alcalina y arilsulfatasa fueron mayores en las muestras PSA sobre las PCA con un 50, 83 y 58% respectivamente; en el municipio de Zipaquirá se presenta la misma tendencia para las enzimas proteasa, fosfatasa ácida, fosfatasa alcalina y fosfodiesterasa con un 34, 63, 67 y 21% respectivamente; en el municipio de Tausa se presentó el mismo comportamiento para la actividad de las enzimas ureasa y arilsulfatasa con un 70 y 81% respectivamente, lo que indica un posible efecto inhibitorio de la fertilización por el uso de plaguicidas y prácticas convencionales de manejo. Finalmente, la sactividades enzimáticas encontradas en este estudio no presentaron un patrón universal o generalizado en cuanto al cultivo de papa con aplicación de agroquímicos y manejo convencional, con respecto al suelo bajo pastizal sin aplicación de agroquímicos.
AGRADECIMIENTOS
A la División de Investigaciones de la Universidad Nacional de Colombia, Sede Bogotá, por la financiación del proyecto "Búsqueda y caracterización bioquímica y molecular de microorganismos con potencial para degradar agentes xenobióticos" código 2004803947. A Sandra Milena Campos Alba, por su colaboración con el manejo de los datos y caracterización bacteriana. A los agricultores de las fincas en mención y a FEDEPAPA por la información proporcionada y las facilidades logísticas para el muestreo.
BIBLIOGRAFÍA
Acosta, V. and M.A. Tabatabai. 2000. Enzyme activities in a limed agricultural soil. Biology and Fertility of Soils 31(1): 85-91. [ Links ]
Ahmad, Z., M. Ateeq and M. Arshad. 2001. Soil enzymes research: a review. OnLine Journal of Biological Sciences 1: 299-307. [ Links ]
Alvear, Z., B. Pino, C. Castillo, C. Trasar y F. Gil. 2006. Efecto de la cero labranza sobre algunas actividades biológicas en un alfisol del sur de Chile. Journal of Soil Science and Plant Nutrition 6(2): 38-53. [ Links ]
Avila, S. and S. Estupiñan. 2006. Bacteriological quality of the water of the humedal of Jaboque, Bogotá, Colombia. Caldasia 28(1): 67-78. [ Links ]
Bolaños, B. 2006. Actividad enzimática y disponibilidad de nutrimentos. pp. 75-97. En: Castilla, A.L. (ed.). La biofertilización una alternativa viable para la nutrición vegetal. Sociedad Colombiana de la Ciencia del Suelo, Bogotá. 195 p. [ Links ]
Bottomley, P. 1998. Microbial ecology. pp. 149-167. In: Sylvia, D., J. Fuhrmann, P. Hartel and D. Zuberer. (eds.). Principles and applications of soil microbiology. Prentice Hall, New Jersey. 672 p. [ Links ]
Browman, M. and M. Tabatabai. 1978. Phosphodiesterase activity of soils. Soil Science Society of America Journal 42(2): 284-290. [ Links ]
Burns, R.G. 1982. Enzyme activity in soil: Location and a posible role in microbial ecology. Soil Biology and Biochemistry 14(5): 423-427. [ Links ]
Cañizares, R., E. Benitez and O. Ogunseitan. 2011. Molecular analyses of b-glucosidase diversity and function in soil. European Journal of Soil Biology 47: 1-8. [ Links ]
Chang, Y.T., J.F. Lee and H.P. Chao. 2007. Variability of communities and physiological characteristics between free-living bacteria and attached bacteria during the PAH biodegradation in a soil/water system. European Journal of Soil Biology 43(5-6): 283-296. [ Links ]
Chapalamadugu, S. and G.R. Chaudhry. 1992. Microbiological and biotechnological aspects of metabolism of carbamates and organophosphates. Critical Reviews in Biotechnology 12(5-6): 357-389. [ Links ]
Chaudhry, G.R., A. Mateen, B. Kaskarã, M. Bloda and S. Riazuddin. 2002a. Purification and biochemical characterization of the carbamate hydrolase from Pseudomonas sp. 50432. Biotechnology and Applied Biochemistry 36(1): 63-70. [ Links ]
Chaudhry, G.R., A. Mateen, B. Kaskar, M. Sardessai, M. Bloda, A.R. Bhatti and S.K. Walia. 2002b. Induction of carbofuran oxidation to 4-hydroxycarbofuran by Pseudomonas sp. 50432. FEMS Microbiology Letters 214(2): 171-176. [ Links ]
Chaudhry, G.R. and A.N. Ali. 1988. Bacterial metabolism of carbofuran. Applied and Environmental Microbiology 54(6): 1414-1419. [ Links ]
Dalurzo, H., D. Toledo y S. Vázquez. 2000. Efecto del uso del suelo sobre la actividad de la fosfatasa ácida en Ultisoles del sur de Misiones. Universidad Nacional del Nordeste. Facultad de Ciencias Agrarias. Comunicaciones Científicas y Tecnológicas, Argentina. 3 p. [ Links ]
Das, K. and A.K. Mukherjee. 2007. Crude petroleum-oil biodegradation efficiency of Bacillus subtilis and Pseudomonas aeruginosa strains isolated from a petroleum-oil contaminated soil from North-East India. Bioresource Technology Bioresource Technology 98(7): 1339-1345. [ Links ]
Dick, W.A. and M.A. Tabatabai. 1984. Kinetic parameters of phosphatases in soils and organic waste materials. Soil Science 137(1): 7-15. [ Links ]
Doran, J.W., M.A. Jones and J.E. Arshad. 1999. Determinants of soil quality and health. pp. 39-57. In: Lat, R. (ed.). Soil quality and soil erosion. CRC Press, Boca Raton, Florida. 329 p. [ Links ]
Doran, J.W. D.C. Coleman, D.F. Bezdicek and B.A. Stewart. 1994. Defining soil quality for a sustainable environment. Soil Science Society of America. Special publication. No. 35. [ Links ]
Eivazi, F. and M.A. Tabatabai. 1988. Glucosidases and galactosidases in soils. Soil Biology and Biochemistry 20(5): 601-606. [ Links ]
Gálviz, C., O. Burbano y C. Bonilla. 2007. Actividad de fosfatasa ácida en suelos cultivados con papa y praderas del corregimiento de Catambuco, Pasto, Colombia. Acta Agronómica 56(1): 13-16. [ Links ]
García, C., T. Hernández, J. Pascual y M.R. Moreno. 2000. Actividad microbiana de suelos del sureste español sometidos a procesos de degradación y desertificación. Estrategias para su rehabilitación. pp. 43-92. En: García, C. y T. Hernández (eds.). Investigación y perspectivas de la enzimología de suelos en España. Centro de Edafología y Biología Aplicada del Segura (CSIC), Murcia. 352 p. [ Links ]
Giordano, A., L. Stante, F. Pirozzi, R. Cesaro and G. Bortone. 2005. Sequencing batch reactor performance treating PAH contaminated lagoon sediments. Journal of Hazardous Materials 119(1-3): 159-166. [ Links ]
Gunapala, N. and K.M. Scow. 1988. Dynamics of soil microbial biomass and activity in conventional and organic farming systems. Soil Biology and Biochemistry 30(6): 805-816. [ Links ]
Hickey, W., 1998. Biochemistry and metabolism of xenobiotic chemicals. pp. 149-167. In: Sylvia, D., J. Fuhrmann, P. Hartel and D. Zuberer. (eds.). Principles and applications of soil microbiology. Prentice Hall, New Jersey. 672 p. [ Links ]
Holt, J., N. Krieg, P. Sneath, J. Staley and S. Williams. 1994. Bergey's manual of determinative bacteriology. Ninth edition. Lippincott Williams & Wilkins, Baltimore, Maryland. 787 p. [ Links ]
Kandeler, E. and H. Gerber. 1988. Short-term assay of soil urease activity using colorimetric determination of ammonium. Biology and Fertility of Soils 6: 68-72. [ Links ]
Kandeler, E., J. Luxhøi, D. Tscherko and J. Magid. 1999. Xylanase, invertase and protease at the soil-litter interface of a loamy sand. Soil Biology and Biochemistry 31: 1171-1179. [ Links ]
Kandeler, E., D. Tscherko, M. Stemmer, S. Schwarz and M. Gerzabek. 2001. Organic matter and soil microorganisms-investigations from the micro-to the macro-scale. Die Bodenkultur 52(2): 117-131. [ Links ]
Kefialew, Y. and A. Ayalew. 2008. Postharvest biological control of anthracnose (Colletotrichum gloeosporioides) on mango (Mangifera indica). Postharvest Biology and Technology 50(1): 8-11. [ Links ]
Knight, T.R. and R.P. Dick. 2004. Differentiating microbial and stabilized ß-glucosidase activity relative to soil quality. Soil Biology and Biochemistry 36(12): 2089-2096. [ Links ]
Koneman, E.W., S.D. Allen, V.R. Dowell, W.M. Janda, H.M. Sommers and W.C. Winn. 1992. Diagnóstico microbiológico. Editorial Medica Panamericana, Buenos Aires. 909 p. [ Links ]
Ladd, J.N. and J.H. Butler. 1972. Short-term assays of soil proteolytic enzyme activities using proteins and dipeptide derivatives as substrates. Soil Biology and Biochemistry 4(1): 19-30. [ Links ]
Madueño, L., B.M. Coppotelli e I.S. Morelli. 2009. Efecto de la inoculación de la cepa Sphingomonas paucimobilis 20006FA sobre la composición de un consorcio bacteriano degradador de fenantreno. Revista Argentina de Microbiología 41(2): 65-72. [ Links ]
Miyatake, F. and K. Iwabuchi. 2005. Effect of high compost temperature on enzymatic activity and species diversity of culturable bacteria in cattle manure compost. Bioresource Technology 96: 1821-1825. [ Links ]
Murcía, P. 2002. Evaluación preliminar del efecto que sobre algunas enzimas del suelo tienen diferentes mecanismos de control del hongo (Phytophthura infestans) en el cultivo de papa (Solanum tuberosum) bajo dos tipos de manejo agrícola (orgánico y convencional). Departamento de Biología. Universidad Nacional de Colombia, Bogotá. 201 p. [ Links ]
Paixão, D.A., M.R. Dimitrov, R.M. Pereira, F.R. Accorsini, M.B. Vidotti and E.G. Lemos. 2010. Molecular analysis of the bacterial diversity in a specialized consortium for diesel oil degradation. Revista Brasileira de Ciência do Solo 34: 773-781. [ Links ]
Perucci, P., L. Scarponi and M. Monotti. 1988. Interference with soil phosphatase activity by maize herbicidal treatment and incorporation of maize residues. Biology and Fertility of Soils 6(4): 286-291. [ Links ]
Pozo, C., M.V. Martínez, B. Rodelas and J. González. 2003. Response of soil microbiota to the addition of 3,3-diaminobenzidine. Applied Soil Ecology 23: 119-126. [ Links ]
Rodriguez, H. and R. Fraga. 1999. Phosphate solubilizing bacteria and their role in plant growth promotion. Biotechnology Advances 17: 319-339 [ Links ]
Schinner, F., R. Öhlinger, E. Kandeler and R. Margesin. 1996. Methods in soil biology. Springer, New York. 426 p. [ Links ]
Tabatabai, M., 1982. Soil enzymes. pp. 903-947. In: Page, A., E. Millar and D. Kenney (eds.). Part 1. Methods of soil analysis. Part 2. Chemical and microbiological properties. American Society of Agronomy, Madison. 1159 p. [ Links ]
Tabatabai, M., 1994. Enzymes. pp. 775-833. In: Weawer, R., S. Augle, P. Bottomly, D. Bezdicek, S. Smith, A. Tabatabai and A. Wollum (eds.). Methods of soil analysis. Microbiological and biochemical properties. Soil Science Society of America, Madison. 1692 p. [ Links ]
Tabatabai, M. and J. Bremner. 1970. Arylsulfatase activity in soil. Soil Science Society of America Journal 34(2): 225-229. [ Links ]
Tabatabai, M.A. and J.M. Bremner. 1969. Use of p-nitrophenyl phosphate for assay of soil phosphatase activity. Soil Biology and Biochemistry 1(4): 301-307. [ Links ]
Zotta, T., A. Ricciardi and E. Parente. 2007. Enzymatic activities of lactic acid bacteria isolated from Cornetto di Matera sourdoughs. International Journal of Food Microbiology 115(2): 165-172. [ Links ]
Zotta, T., A. Ricciardi, R. Rossano and E. Parente. 2008. Urease production by Streptococcus thermophilus. Food Microbiology 25(1): 113-119. [ Links ]