Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.65 no.1 Medellín Jan./June 2012
Determinación del Área Foliar en Fotografías Tomadas con una Cámara Web, un Teléfono Celular o una Cámara Semiprofesional
Leaf Area Measurement in Photographs Taken with a Webcam, a Cell Phone or a Semi Professional Camera
Natalia Rincón Guerrero1; Manuel Andrés Olarte Quintero2 y Juan Carlos Pérez Naranjo3
1 Estudiante de Zootecnia. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias Agrarias. A.A. 1779, Medellín, Colombia. <narincongu@unal.edu.co>
2 Estudiante de Zootecnia. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias Agrarias. A.A. 1779, Medellín, Colombia. <maolarteq@unal.edu.co>
3 Profesor Asociado. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias. A.A. 3840, Medellín, Colombia. <jcperez@unal.edu.co>
Recibido: Noviembre 08 de 2011; aceptado: Mayo 02 de 2012.
Resumen. Las determinaciones de área foliar son muy usadas en investigación agrícola. Para su cuantificación existen equipos automáticos, pero costosos y de escasa disponibilidad. Para superar estos limitantes, en esta investigación se acoplaron el uso de cámaras digitales (de un teléfono celular, una cámara web o una cámara digital semiprofesional) y un software libre para análisis de imágenes (ImageJ), con el fin de determinar el área foliar en forma simple, precisa y a bajo costo. Para estimar la sensibilidad de este sistema, en la primera prueba se compararon las áreas generadas por un medidor de área foliar y por las fotografías tomadas con tres tipos de cámara digital, sobre cuadrados de papel verde de áreas conocidas. En la segunda prueba se correlacionaron los valores de área foliar obtenidos con el medidor de área foliar y los obtenidos a partir del análisis de fotografías de hojas tomadas con las tres cámaras digitales, en cinco especies vegetales, que variaban en morfología y color de hojas. Los resultados indicaron coeficientes de correlación mayores a 0,99 entre los valores de área real de las piezas de papel y los valores de área estimados por el medidor de área foliar o de las fotografías. En la segunda prueba, las mediciones de area foliar obtenidas con el medidor de area foliar y con las cámaras digitales presentaron coeficientes de correlación muy altos (r=1). Los coeficientes de líneas de regresión entre las áreas del medidor de área foliar y de las fotografías del teléfono celular estuvieron entre 0,98 y 1,02, indicando una desviación máxima de 2% comparado con las mediciones del medidor de área foliar. Estos resultados sugieren una gama amplia de posibilidades para este sistema como herramienta para la investigación agrícola y biológica, debido a la disponibilidad de estos equipos que son de bajo costo, fáciles de usar y portátiles.
Palabras clave: Análisis de imágenes, cámaras digitales, medidor de área foliar, imageJ.
Abstract. Leaf area is a plant trait widely assessed in plant science. It is measured by using expensive specialized equipment which is not available to all laboratories. To overcome these constraints, in order to measure plant leaf area, along this research we coupled a free image analysis software (ImageJ) to the use of cellular phone, web o semi professional digital cameras. The sensitivity of this system was initially tested by challenging the real area of 18 pieces of green colored paper to the area estimated by a commercial leaf area meter or obtained from pictures taken by each digital camera. A further correlative based test, was designed to obtain leaf area measurements from pictures of those digital cameras or by using the leaf area meter on detached leaves of five plant species, varying in color and morphology. In the first test, real area values were well correlated (r = 0.99) to area values obtained from the leaf area meter or from digital images obtained from each digital camera. During the second test with detached leaves, high correlation coefficients (r=1) were also obtained among area measurements made by the leaf area meter and from each leaf digital picture. A regression analysis between leaf area measurements with these systems indicated a maximum deviation of 2% when areas of the cellular phone camera are compared to those obtained from the leaf area meter. These results foresee on this system a promising and easy to use tool for research. The components used here are true mobile and are widely available at a very low cost. This should help researchers on plant science even under very limiting technological conditions.
Key words: Image analyses, digital camera, leaf area meter. imageJ.
La determinación de área foliar se realiza con mucha frecuencia en la investigación agrícola, y durante décadas se ha empleado en estudios básicos de fisiología (Enciso y Gómez, 2004; Meyer y Davison, 1987), mejoramiento (Kolukisaoglu y Thurow, 2010), sanidad (James, 1974) o nutrición vegetal (Pagola et al., 2009; Takebe y Yoneyama, 1989). Para medir el área u otros parámetros de crecimiento de hojas se han desarrollado sistemas altamente sensibles, precisos y costosos. Esos equipos se componen básicamente de cámaras de video o scanners acoplados a computadores con software especializado para análisis de imágenes que determinan el área de las hojas (Kolukisaoglu y Thurow, 2010). La disponibilidad de computadores, software y cámaras digitales ha favorecido el análisis de imágenes en disciplinas tan diferentes como medicina humana (Maintz y Viergever, 1998), o análisis de cobertura vegetal a escalas geográficas (Hansen et al., 2003). El análisis de imágenes comprende la generación de imágenes por diferentes métodos, la eliminación posterior de elementos indeseables para mejorar la calidad, y finalmente el uso de algoritmos para análisis computarizado.
En estudios con plantas se han usado poco las cámaras fotográficas de los teléfonos celulares, cámaras web o incorporadas en computadores, aunque éstas permiten capturar imágenes con resolución razonable en cualquier lugar. Para el análisis de imágenes existen en internet plataformas de software libre como ImageJ (Rasband, 2007), que permite determinar el área de objetos gráficos en los que se introduce una referencia de tamaño conocido. Si se acoplan estos elementos para la medición del área u otros parámetros de crecimiento foliar, se tendrá un sistema portátil, económico y preciso que apoyaría la investigación y toma de decisiones, aún en lugares con recursos tecnológicos muy limitados.
Esta investigación evaluó el uso de una cámara web, la cámara incorporada en un teléfono celular y una cámara digital semiprofesional para determinar el área foliar a partir del análisis computarizado de fotografías de hojas. Para evaluar la eficacia del método se seleccionaron cinco especies vegetales con hojas diferentes morfológicamente. Los resultados indican que a partir de estas fotografías puede medirse el área foliar en forma relativamente rápida, precisa y a bajo costo, en comparación con el uso de medidores de área foliar, utilizados tradicionalmente en las investigaciones.
MATERIALES Y MÉTODOS
La investigación comprendió dos etapas: una fase de calibración de equipos mediante la comparación de las áreas generadas por un medidor de área foliar u obtenidas del análisis de fotografías tomadas con tres cámaras digitales. Para ello se midieron cuadrados de papel verde de áreas previamente conocidas. En la segunda fase se evaluó la utilización de fotografías de hojas de plantas tomadas con las cámaras digitales para estimar en cinco especies vegetales, las áreas de hojas de diferentes tamaños, colores y formas.
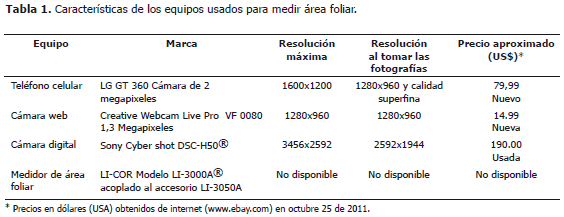
Determinación de la sensibilidad de las cámaras digitales. Se prepararon 18 cuadros de color verde con áreas entre 0,36 y 22,09 cm2, cada uno se midió en el medidor de área foliar y luego se fotografiaron usando cada una de las cámaras cuyas características se presentan en la Tabla 1.
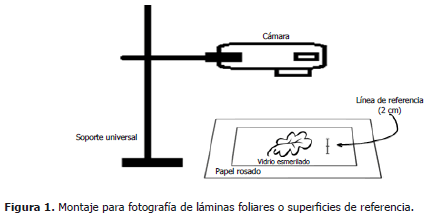
Montaje para fotografía. Las hojas o piezas de papel con área conocida se fotografiaron sobre un fondo de color rosado (papel albanene, color 2.5 RP 7/10 según tabla de referencia de colores "Munsell Book of Color®) con una línea de referencia de 2 cm de longitud dibujada al lado del sitio de ubicación de las hojas. Para extender las hojas completamente se cubrieron con un vidrio transparente de 15 x 20 cm y 3 mm de espesor, de superficie esmerilada para evitar brillos (Figura 1).
Para fotografiar cuadros verdes de área conocida las cámaras se fijaron sobre un soporte universal a 19 cm de altura. Para fotografiar hojas se ubicó así: 28 cm para la cámara web, 18 cm para el teléfono celular y 15 cm para la cámara Sony®.
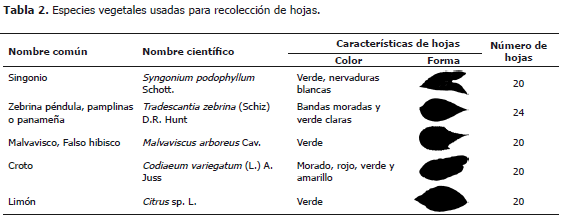
Medición de área foliar en cinco especies vegetales a partir fotografías tomadas con tres tipos de cámara digital. Para asegurar diferentes condiciones para el procesamiento de imágenes, entre 20 y 24 hojas de diferentes formas, colores y tamaños se recolectaron de cinco especies de plantas del campus de la Universidad Nacional de Colombia, Sede Medellín (Tabla 2).
Medición de área foliar en el software ImageJ. Para las imágenes de hojas de cada cámara, se abrió una fotografía en el software libre ImageJ (Versión 1.45) (Rasband, 2007) y se fijo una medida de referencia de tamaño para los análisis posteriores. Para ello, sobre la fotografía visible en la pantalla se trazó con el ratón del computador una línea de referencia sobre la marca de 2 cm dibujada anteriormente sobre el papel rosado. Luego se usaron secuencialmente los comandos Analyze> Set Scale> Known distance: 2, Unit of length: cm, Global scale. Para procesar imágenes se usaron los comandos: Process> Binary> Make binary. Cuando la imagen de la hoja no apareció negra sobre fondo blanco, se invirtió la imagen con los comandos Edit>invert.
Para la medición de área se seleccionó la región de la hoja con la herramienta "Wand" y se utilizaron los comandos Analyze>Measure. Las fotografías se analizaron en el software ImageJ 1.45 instalado en un mini computador portátil Qbex® Aero 1A00 (procesador Intel® Atom N450, 1.6 GHz, 2 GB RAM).
Análisis estadístico. Para estimar el ajuste entre cada método se calcularon coeficientes de correlación de Pearson entre área real de los cuadrados (área conocida) y el valor de área obtenido con cada sistema de fotografía. Adicionalmente, se visualizaron en diagramas de dispersión las diferencias entre valores de área reales y esperados. Las áreas de hojas medidas a partir de las fotografías se correlacionaron con el valor de área obtenido en el medidor de área foliar. Las desviaciones entre las medidas generadas por imágenes de cada cámara digital y el medidor de área foliar, se estimaron a partir de coeficientes de regresión lineal. Los análisis se realizaron en el software Systat 12®.
RESULTADOS Y DISCUSIÓN
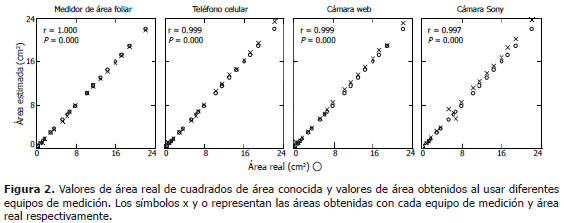
Sensibilidad de cámaras digitales y un medidor de área foliar para medir áreas conocidas. Cada valor de área obtenido con el medidor de área foliar, se superpuso con su correspondiente valor real. Las mediciones obtenidas a partir de fotografías tomadas con la cámara del teléfono celular o la cámara web, presentaron una tendencia similar excepto al medir cuadros con área mayor a 20 cm2 (Figura 2). Las áreas reales de los cuadrados estimadas por las fotografías tomadas con el teléfono celular o con la cámara web, presentaron alta correlación (r= 0,999) con las áreas arrojadas por el medidor de área foliar. La correlación entre medidas de área real de cuadros y el área obtenida de las fotografías tomadas con la cámara Sony, fue ligeramente menor a la obtenida con las otras dos cámaras (r = 0,997) (Figura 2).
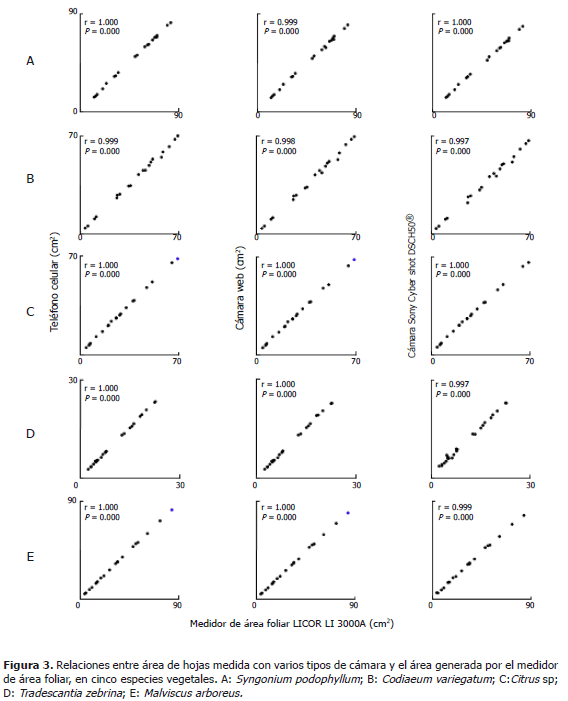
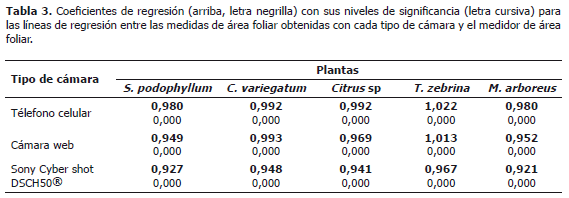
Medición de área foliar en cinco especies vegetales a partir fotografías tomadas con tres tipos de cámara digital. Para cada cámara y para todas las especies, los valores de área foliar medidos a partir de fotografías o en el medidor de área foliar, presentaron una asociación lineal altamente significativa (Figura 3, Tabla 3). El mejor desempeño para la medición de área foliar lo presentaron la cámara del teléfono celular o la cámara web. Los coeficientes de líneas de regresión entre las áreas generadas por el medidor de área foliar variaron de 0,98 a 1,02 para la cámara del teléfono, y 0,95 a 1,01 para la cámara web, indicando así los valores más cercanos entre las mediciones de cada sistema, con una desviación de 2 a 5% del medidor de área foliar.
Aunque las hojas utilizadas presentaban formas y coloración variable e irregular (Tabla 2), en general se observó una buena relación entre las medidas de área foliar obtenidas de las imágenes tomadas con las cámaras digitales, o determinadas con el medidor de área foliar. Anteriormente se empleó un software para determinación semiautomática del área de hojas a partir de las imágenes de un escáner (Bylesjö et al., 2008). Ese sistema, además de ser poco móvil requiere algún conocimiento previo sobre procesamiento de imágenes para retirar interferencia presente en ellas y poder diferenciar adecuadamente los bordes de las hojas. Para obtener valores de área muy cercanos a los generados por un equipo especializado, el sistema de fotografía empleado aquí no requirió ningún procesamiento de las imágenes, excepto la conversión en blanco y negro.
Recientemente se adaptaron dispositivos de teléfonos celulares para cultivar y monitorear cultivos de células animales en tiempo real (Zheng et al., 2011), o se convirtieron cámaras digitales en multiespectrales, para monitorear condiciones nutricionales en cultivos (Lebourgeois et al., 2008), lo que indica el uso potencial de estas cámaras digitales. Aquí no se usaron montajes especiales para sostener las cámaras, ni correcciones ópticas o algoritmos complejos para procesar imágenes. Es posible que esos ajustes se requieran en otras condiciones experimentales, como medidas no destructivas, uso de hojas de mayor tamaño que las usadas en esta investigación o en otras combinaciones de cámaras y condiciones generales de iluminación. En cualquier caso estos resultados sugieren que a partir de adaptaciones mínimas, es posible desarrollar un sistema semiautomático que permitiría detectar variaciones especiales en hojas de plantas de manera fácil, precisa y a muy bajo costo.
Las variaciones morfológicas en hojas pueden reflejar respuestas al ambiente (Enciso y Gómez, 2004; Parkhurst and Loucks, 1972) o procesos de expresión génica (Lincoln et al., 1994), y pueden usarse para selección de variedades con atributos deseables (Stiller et al., 2004). ImageJ es un software versátil que permite medir características morfológicas complejas (Nicotra et al., 2008). Pero las investigaciones en que se determina la morfología de hojas, tradicionalmente han usado equipos costosos que no siempre están disponibles o requieren entrenamiento especializado para su uso. Las características de las cámaras empleadas en este estudio son mínimas y su disponibilidad es paralela a la de teléfonos celulares, minicomputadores portátiles, tabletas y otros implementos electrónicos de uso común que incorporan cámaras digitales. Estos resultados estimularían la evaluación y uso de nuevas tecnologías precisas y baratas, que apoyen investigación agrícola aún bajo condiciones tecnológicas o presupuestales muy limitadas.
CONCLUSIONES
El análisis computarizado de las imágenes de hojas obtenidas con la cámara de un teléfono celular, una cámara web o una cámara digital semiprofesional permitió estimar en forma simple el área de hojas variables en morfología y color, en cinco especies de plantas. Los tres tipos de cámara generaron imágenes adecuadas para la determinación del área foliar.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a los Laboratorios de Fisiología Vegetal y de Control Biológico de la Facultad de Ciencias Agrarias de la Universidad Nacional de Colombia, Sede Medellín, por facilitar el acceso a sus equipos. Varios revisores anónimos mejoraron con sus sugerencias la versión final de este manuscrito. Esta investigación fue apoyada por los integrantes del grupo de investigación Sistemas Simbióticos y el Laboratorio de Microbiología del Suelo de la Universidad Nacional de Colombia, Sede Medellín.
BIBLIOGRAFÍA
Bylesjö, M., M. Segura, R. Soolanayakanahally, A. Rae, J. Trygg, P. Gustafsson, S. Jansson and N. Street. 2008. LAMINA: a tool for rapid quantification of leaf size and shape parameters. BMC Plant Biology 8: 82-91. [ Links ]
Enciso, B.E. y C. Gómez. 2004. Comparación de las respuestas de cuatro cultivares de mora (Rubus sp.) a las variaciones del factor luz. Agronomía Colombiana 22(1): 46-52. [ Links ]
James, W.C. 1974. Assessment of plant diseases and losses. Annual Review of Phytopathology 12:27-48. [ Links ]
Hansen, M.C., R.S. DeFries, J.R. Townshend, M. Carroll, C. Dimiceli and R.A. Sohlberg. 2003. Global percent tree cover at a spatial resolution of 500 meters: First results of the MODIS vegetation continuous fields algorithm. Earth Interactions 7(10): 1-15. [ Links ]
Lebourgeois, V., A. Bégué, S. Labbé, B. Mallavan, L. Prévot, and B. Roux. 2008. Can commercial digital cameras be used as multispectral sensors? A crop monitoring test. Sensors 8: 7300-7322. [ Links ]
Lincoln, C., J. Long, J. Yamaguchi, K. Serikawa and S. Hake. 1994. A knotted1-like homeobox gene in Arabidopsis is expressed in the vegetative meristem and dramatically alters leaf morphology when overexpressed in transgenic plants. Plant Cell 6(12): 1859-1876. [ Links ]
Kolukisaoglu, Ü. and K. Thurow. 2010. Future and frontiers of automated screening in plant sciences. Plant Science 178(6): 476-484. [ Links ]
Maintz, J.B. and M.A. Viergever. 1998. A survey of medical image registration. Medical Image Analysis 2(1): 1-36. [ Links ]
Meyer, G.E. and D. Davison. 1987. An electronic image plant growth measurement system. Transactions of the American Society of Agricultural and Biological Engineers (ASABE) 30: 242-248. [ Links ]
Nicotra, A.B., M.J. Cosgrove, A. Cowling, C.D. Schlichting and C.S. Jones. 2008. Leaf shape linked to photosynthetic rates and temperature optima in South African Pelargonium species. Oecologia 154(4): 625-635. [ Links ]
Pagola, M., R. Ortiz, I. Irigoyen, H. Bustince, E. Barrenechea, P. Aparicio-Tejo, C. Lamsfus, and B. Lasa. 2009. New method to assess barley nitrogen nutrition status based on image colour analysis: Comparison with SPAD-502. Computers and Electronics in Agriculture 65(2): 213-218. [ Links ]
Parkhurst, D.F. and O.L. Loucks. 1972. Optimal leaf size in relation to environment. Journal of Ecology 60(2): 505-537. [ Links ]
Rasband, W.S. 2007. ImageJ, US National Institutes of Health, Bethesda, Maryland, USA, http://rsbweb.nih.gov/ij/; consulta: october 2011. [ Links ]
Stiller, W.N., P.E. Constable and A. Gregory. 2004. Maturity and leaf shape as traits influencing cotton cultivar adaptation to dryland conditions. Agronomy Journal 96(3):656-664. [ Links ]
Takebe, M. and T. Yoneyama. 1989. Measurement of leaf color scores and its implication to nitrogen nutrition of rice plants. Japan Agricultural Research Quarterly (JARQ) 23(2): 86-93. [ Links ]
Zheng, G., S.A. Lee, Y. Antebi, M.B. Elowitz, and C. Yang. 2011. The ePetri dish, an on-chip cell imaging platform based on subpixel perspective sweeping microscopy (SPSM). Proceedings of the National Academy of Sciences of the United States of America PNAS 108: 16889-16894. [ Links ]