Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Facultad Nacional de Agronomía Medellín
versão impressa ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín v.65 n.1 Medellín jan./jun. 2012
Efecto del Polimorfismo del Intrón 6 del Gen LTF Bovino con Algunas Enfermedades de Alta Incidencia en la Producción Lechera
Effect of the Polymorphism in the Intron 6 of the Bovine LTF Gene with Some Diseases of High Incidence in Dairy Production
Nancy Rodríguez Colorado1; Albeiro López Herrera2 y Julián Echeverri Zuluaga3
1 Zootecnista. Universidad Nacional de Colombia - Sede Medellín. Facultad de Ciencias Agrarias. A.A. 1779, Medellín, Colombia. <nrodrig@unal.edu.co>
2 Profesor Asociado. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias Agrarias. A.A. 1779, Medellín, Colombia. <alherrera@unal.edu.co>
3 Profesor Asistente. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias Agrarias. A.A. 1779, Medellín, Colombia. <jjecheve@unal.edu.co>
Recibido: Febrero 24 de 2012; aceptado: Mayo 03 de 2012.
Resumen. El objetivo de la investigación fue determinar la asociación del polimorfismo (C/T) del intrón 6 del gen de la bLTF, con la incidencia de algunas enfermedades en ganado lechero. Para ello fueron observadas 482 vacas Holstein, durante al menos una lactancia, determinando la incidencia de algunas de las enfermedades mas importantes en la ganaderia de leche. La genotipificación para el polimorfismo de bLTF, se hizo usando la técnica de PCR-RFLP con DNA extraído de sangre periférica mediante la técnica de salting out. Para estudiar la asociación de los alelos del gen LTF, se utilizó el alelo B como control y se determinó el Odds Ratio (OR). Como resultados se obtiene que las frecuencias de los alelos A y B para el gen bLTF fueron 0,78 y 0,22 respectivamente. Las frecuencias genotípicas fueron 0,60, 0,36 y 0,04 para AA, AB y BB respectivamente. Una asociación altamente significativa (P≤0,001) fue hallada entre la incidencia de mastitis clínica y el polimorfismo del gen LTF. Los individuos portadores del alelo B tuvieron una probabilidad de incidencia de mastitis dos veces superior a los portadores del alelo A (OR=2.115 IC del 95%, 1.392-3.213). En el caso de la mastitis subclínica la probabilidad de incidencia fue de 1,6 veces más en los portadores del alelo B, con un OR=1.637 IC del 95% 1.184-2.264. Para la incidencia de enfermedades metabólicas, reproductivas, respiratorias, parasitarias, cáncer y cojeras, no se halló diferencia significativa (P>0,05) y se encontró asociación del alelo B del polimorfismo del intrón 6 del gen bLTF con la incidencia de mastitis clínica y subclínica.
Palabras clave: Análisis molecular, asociación con afecciones, caracterización genética, mastitis.
Abstract. The research objective was to determine the association of polymorphism (C/T) of intron 6 bLTF gene, with the incidence of some diseases on dairy cattle. A total of 482 Holstein cows located in different herds in the department of Antioquia - Colombia, were used to follow the incidence of disease, for at least a full lactation. Genotyping was performed using PCR-RFLP with DNA extracted from peripheral blood by salting out technique. DNA amplification was obtained of the 482 samples with frequencies of alleles A and B of 0.78 and 0.22 respectively. The genotype frequencies were 0.60, 0.36 and 0.04 for AA, AB and BB respectively. This study find a significant association (P ≤ 0.001) between the incidence of clinical mastitis and LTF gene polymorphism. It was found a two fold risk of infection in animals that had the B allele compared with those with the A allele (OR = 95% 2115, 1392-3213). Shared situation in the case of subclinical mastitis with an OR = 95% 1637 1184-2264. In the case of metabolic diseases, reproductive, respiratory, parasitic, cancer and lameness, there were no significant difference (P>0.05). It was found association of B allele of ribosomal gene 6 intron of the bLTF with the incidence of clinical and subclinical mastitis.
Key words: Molecular analysis, genetic characterization, association with medical conditions, mastitis.
El gen de la lactoferrina bovina (bLTF) está localizado en el cromosoma 22 del genoma bovino, se extiende sobre 33,4 kb, contiene 17 exones, 16 intrones y 1122 pb (pares de bases) de región promotora (referencia NCBI: NC_007320.4). Los promotores del gen bLTF poseen características, particulares de genes constitutivos relacionados con un amplio espectro de tejidos, como el mamario y mucosas, en los cuales el gen se expresa (Zheng et al., 2005).
A la proteína bLTF de 80 kDa se le atribuyen múltiples funciones biológicas, incluyendo actividades bactericidas y bacteriostáticas, respuestas anti y proinflamatorias e inducción de proliferación y maduración de células B y T (Zimecki et al., 2002). La proteína LTF humana presenta un efecto antimicrobiano contra bacterias patógenas tanto, in vitro como in vivo, inhibiendo o retardardando el crecimiento de bacterias gram positivas y gram negativas. La LTF humana también es un componente abundante de los neutrófilos y puede ser liberada al plasma sanguíneo por la acción de éstos (Wakabayashi et al., 2004).
Las cualidades encontradas en el gen bLTF, en humanos y en bovinos lo convierten en un potencial marcador molecular en programas de mejoramiento animal. En bovinos lecheros, la investigación realizada en este gen, podría permitir la disminución en la incidencia de patologías tales como mastitis, laminitis, afecciones parasitarias, respiratorias y del tracto reproductivo; las cuales son las de mayor incidencia y las que generan mayores mermas productivas, y tienen efectos adversos sobre el bienestar animal. Según el sistema de información epidemiológica del Instituto Colombiano Agropecuario (ICA), en el año 2007 se presentaron pérdidas por más de 764 millones de pesos, en sólo 690 casos reportados de estas enfermedades (ICA, 2008), además pueden ejercer un daño potencial a la salud humana, causado por patógenos de transmisión alimentaria (Máttar et al., 2000).
Dentro de las afecciones antes nombradas, la más importante es la mastitis, definida como la inflamación de la ubre causada comúnmente por bacterias patógenas contagiosas y ambientales, que producen una infección intramamaria (Chaneton et al., 2008). Esta enfermedad presentó una prevalencia de 12,5% en un estudio realizado en el municipio de San Pedro de los Milagros en Antioquia, Colombia (Ramírez et al., 2001) y causa grandes perjuicios a los productores lecheros debido a los altos costos en tratamientos veterinarios y al descarte temprano de la vacas dentro del hato (Wojdak-Maksymiec et al., 2006). La importancia de la bLTF en los procesos inflamatorios, como la mastitis, está dada por su capacidad de reducir la liberación de interleucinas y de prostaglandina E, que son las responsables de los procesos inflamatorios (O'Halloran et al., 2009).
Importantes asociaciones entre el gen LTF con enfermedades infecciosas han sido halladas (Sharma et al., 2006), acrecentando la importancia de la caracterización de este gen para la especie bovina y de este modo estructurar un adecuado estudio que permita identificar, las posibles asociaciones con características de importancia en las poblaciones antioqueñas de ganado Holstein, haciendo factible el planteamiento de un programa adecuado de selección asistida por marcadores moleculares (MAS), dirigido a la búsqueda de una población de animales resistentes a enfermedades importantes en lechería.
Debido a la asociación encontrada en humanos del gen de la lactoferrina, este estudio tiene como objetivo encontrar asociaciones entre un polimorfismo del gen bLTF (encontrado en el intrón 6 (C/T), ligado éste a su vez a polimorfismos en el exón 4 y en el exón 11 y algunas enfermedades en ganado Holstein del Departamento de Antioquia, Colombia.
MATERIALES Y MÉTODOS
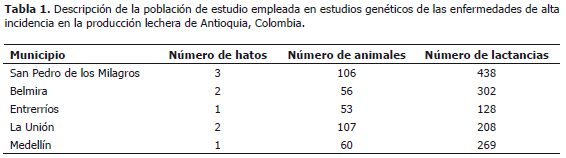
Área y población de estudio. En esta investigación se incluyeron 382 vacas de la raza Holstein durante algunas lactancias, pertenecientes a nueve unidades de producción lechera ubicadas en el departamento de Antioquia, Colombia (Tabla 1).
Extracción del ADN de células de sangre y PCR-RFLP. Para la obtención del ADN de sangre periférica se utilizó el método de "saltin gout", descrito por Miller et al. (1988) y se almacenó a 4 °C hasta el momento del análisis. La cantidad y calidad del ADN extraído se evaluó en gel de agarosa al 0,8% teñido con bromuro de etidio y se cuantificó en un espectrofotómetro Thermo Scientific® NanoDrop ND 2000. Sólo el ADN genómico con una pureza ideal entre 1,8-2,0 se consideró para los análisis moleculares posteriores.
El ADN aislado fue usado para la amplificación por PCR de 301 pb (pares de bases) con los siguientes primers: Directo: 5'-GCC TCA TGA CAA CTC CCA CAC-3' Reverso: 5'-CAG GTT GAC ACA TCG GTT GAC-3', según Seyfert y Kuhn (1994). La PCR contenía 0,5 U de Taq polimerasa (Bioline®), 2,5 mL de Buffer para PCR 10x, 30 ng de DNA, 0;5 mL de MgCl2 a 50 nM, 0,5 mL de dNTPs a 20 nM y 0,5 mL de cada primer y se aforó con agua desionizada y estéril para un volumen total de 25 mL.
Se estandarizó la PCR de la siguiente manera: desnaturalización inicial a 95 °C por 3 min, seguido de 28 ciclos a 95 °C por 45 s, 60 °C por 30 s, 72 °C por 20 s, con una extensión final a 72 °C por 3 min. El producto de la PCR se analizó por electroforesis en gel de agarosa al 2% y bromuro de etidio. Luego se realizó la RFLP usando la enzima de restricción EcoRI, el mix se hizo de la siguiente forma: 5 mL de reacción de PCR, 2 m de Buffer EcoRI (Fermentas®), 0,5 m EcoRI (Fermentas®) y 12,5 mL de agua desionizada y estéril, para un volumen total de 20 mL, se incubó por 3 h a 37 °C, el producto se observó por electroforesis en gel de agarosa al 2,5% y bromuro de etidio. El patrón de restricción esperado para el genotipo AA corresponde a un fragmento de 301 pb, para el genotipo AB tres fragmentos (301 pb, 201 pb y 100 pb) y para el genotipo BB dos fragmentos (201 pb y 100 pb).
Análisis estadístico. Las frecuencias alélicas y genotípicas, se calcularon mediante el programa GenAlEx 6.4 (Peakall y Smouse, 2006). Se obtuvo información histórica, suministrada por cada hato, de eventos sanitarios de los animales dentro del estudio; estos hatos además, fueron visitados periódicamente por lo menos durante una lactancia completa con el fin de mantener actualizados los registros sanitarios y realizar con frecuencia, el CMT (California Mastitis Test) como indicador de la salud de la ubre.
Para la realización del CMT se empleó un reactivo constituido por un detergente (alkil aril sulfato de sodio) y un colorante (púrpura de bromocresol), sus resultados fueron interpretados según instrucciones del fabricante (California S.A.®) así: lectura de cuarto sano, trazas, una cruz (+), dos cruces (++) y tres cruces (+++), según se apreció el cambio en la consistencia de la leche, pasando de fluida a viscosa al ser mezclada con el reactivo.
Las afecciones identificadas se agruparon en ocho categorías: tumores oculares (lesiones visibles), cojeras, padecimientos metabólicos, parasitarios, reproductivos y respiratorios, mastitis clínica y subclínica durante toda la lactancia. Las afecciones registradas (casos), se compararon con las vacas sanas (controles).
Con el fin de estudiar la asociación de los alelos del gen LTF, se usó el alelo B como control y se determinó el Odds Ratio (OR), que indica la frecuencia relativa de la exposición entre los casos y los controles utilizando el software PLINK (Purcell et al., 2007). Los valores de OR menores que 1 indican que estos animales presentan bajo riesgo de presentar la enfermedad y fueron considerados como resistentes (asociación positiva), valores de OR mayores que 1 indican que estos animales presentan alto riesgo de presentar la enfermedad y fueron considerados susceptibles (asociación negativa). Se realizó test de chi-cuadrado (X²) para determinar la significancia estadística de los valores de OR usando el software PLINK (Purcell et al., 2007).
RESULTADOS
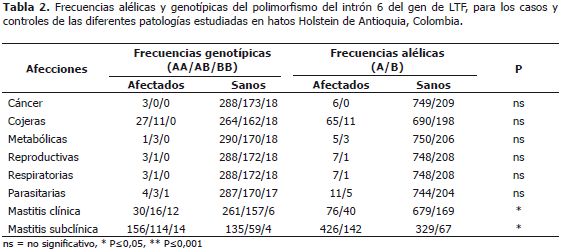
Las frecuencias de los alelos A y B fueron 0,78 y 0,22 respectivamente. Los alelos controlan la incidencia de tres genotipos AA, AB y BB, con frecuencias observadas de 0,60, 0,36 y 0,04 respectivamente.
Durante el seguimiento de los casos clínicos en los hatos se hallaron casos de carcinoma ocular de células escamosas, con lesiones visibles; dentro de las enfermedades metabólicas se encontraron casos de hígado graso e hipocalcemia; en padecimientos reproductivos se identificaron casos de reabsorciones embrionarias, metritis, abortos y retención de placenta; para el grupo de afecciones respiratorias se diagnosticó tos inespecífica y neumonía; en infecciones parasitarias se observaron coccidiosis, anaplasmosis y babesiosis; en el grupo de cojeras se registraron casos de pododermatitis aséptica difusa. Se reconocieron otras sintomatologías como fiebres, diarreas e inflamaciones inespecíficas, que no fueron tenidas en cuenta en la evaluación.
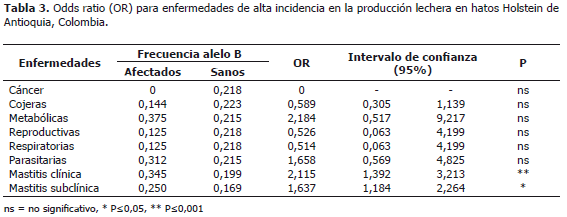
A pesar de no establecerse diferencia significativa (P>0,05) entre los genotipos para LTF y la incidencia de enfermedades metabólicas, reproductivas, respiratorias, parasitarias, cáncer ni cojeras (Tabla 2), las vacas que presentaron casos de infestaciones parasitarias tenían en mayor frecuencia el alelo B (OR=1.658, IC 0,569-4.825) al igual que las vacas con enfermedades metabólicas (OR=2.184, IC 0.517-9.217), por el contrario, para las vacas una mayor frecuencia de afecciones reproductivas y respiratorias se encontró el alelo B en menor frecuencia (OR=0,526, IC 0.063-4.199) (Tabla 3).
Hubo asociación significativa (P≤0,001) entre la incidencia de mastitis clínica y el polimorfismo del gen LTF (Tabla 3), determinándose doble riesgo de infección en los animales que poseen el alelo B en comparación con los que tienen el alelo A (OR=2115, IC del 95% 1.392-3.213). Para el caso de la mastitis subclínica se notó asociación significativa (P≤0,05) con el polimorfismo del gen LTF (Tabla 3), con un riesgo de infección de 1.637 (IC del 95% 1.184- 2.264.) para las vacas con el alelo B.
DISCUSIÓN
En un trabajo ejecutado por Šrubařová y Dvořák (2009) en una población de 94 vacas Holstein en República Checa, se encontró una frecuencia de 0,57 para el genotipo AA, 0,43 para el genotipo AB y no se halló el genotipo BB; las frecuencias para el alelo A fueron de 0,79 y para el alelo B de 0,21, frecuencias alélicas muy similares a las obtenidas en esta investigación. Por otra parte en un estudio realizado por Wojdak-Maksymiec et al. (2006) en una población de 124 vacas de la raza Holstein en Polonia, se observaron frecuencias alélicas y genotípicas, que difieren de las precisadas en este estudio con 0,68, y 0,33 para los alelos A y B respectivamente del gen LTF, y para los genotipos AA, AB, y BB, frecuencias de 0,38, 0,60 y 0,20 respectivamente. Estas diferencias posiblemente son debidas a los factores ambientales en que están los animales.
Otras investigaciones realizadas in vivo ratifican la acción de la bLTF encontrada en el presente estudio y la incidencia de mastitis, como el trabajo realizado por Pawlik et al. (2009) quienes determinaron como la bLTF en la leche ejerce su efecto inhibidor sobre el crecimiento microbiano en la glándula mamaria. Además concluyeron que la leche de ganado con infecciones intramamarias presentaba aumento de las concentraciones de bLTF. Kawai et al. (2007), también encontraron que dosis bajas de bLTF pueden inhibir bacterias asociadas a mastitis; ellos estudiaron la concentración mínima inhibitoria (CMI) de LTF hidrolizada y LTF nativa requerida para impedir el crecimiento bacteriano en 74 aislados obtenidos de leche con mastitis, encontrando como desde dosis tan bajas como 0,001 mg mL-1 se pueden inhibir bacterias causantes de mastitis clínica y subclínica.
Concordante con los resultados obtenidos en este estudio donde el alelo A tiene mayor resistencia a mastitis subclínica, Wojdak-Maksymiec et al. (2006) identificaron asociación entre el genotipo AA y un recuento menor de células somáticas que el genotipo AB. Contrariamente en el mismo polimorfismo Sender et al. (2006), citado por Pawlik (2009) vieron asociación entre el genotipo BB y un recuento menor de células somáticas en leche.
La tendencia encontrada en los individuos con el alelo B de resistencia a afecciones respiratorias, debe ser ampliamente investigada ya que estudios realizados en la especie humana por Fischer et al. (2009) detectaron en la expresión génica de la submucosa, así como en el lumen glandular del pulmón, una importante expresión de LTF humano, los mismos autores afirman, que la perturbación de la función de este tejido y la expresión correcta de sus secreciones, están involucradas en la patogénesis de varias enfermedades, incluyendo asma, enfermedad pulmonar obstructiva crónica y fibrosis quística.
El riesgo detectado para los individuos con el alelo B y la incidencia de enfermedades metabólicas, puede encontrar su razón biológica en la capacidad de la LTF de unirse sinérgicamente con el ion carbonato (CO3 2-), ya que es bien sabido que estas enfermedades se desencadenan por desequilibrios ácido-básicos de la sangre y aunque la LTF se encuentra en menor proporción en suero sanguíneo, está en mayor proporción en el intestino delgado y es allí donde se da la absorción de iones y cationes que mantienen la neutralidad eléctrica (Chaneton et al., 2008). Para tener certeza de la acción de la bLTF y su asociación con enfermedades metabólicas, se hacen necesarios más trabajos que involucren una población mayor y seguimiento constante durante la vida completa del animal.
El estudio realizado precisó en su mayoría eventos parasitarios causados por protozoos del género Babesia que causan babesiosis o del género Eimeria que causan coccidiosis; estos protozoos parásitos, necesitan adquirir una gran cantidad de nutrientes a partir de sus hospederos, para lo cual emplean proteínas de transporte (Landfear, 2011). La aplicación de los enfoques genético moleculares y la realización de proyectos como el de Wilson et al. (2002) evidenciaron como estos parásitos pueden utilizar el hierro unido a la transferrina, lactoferrina, u otros quelatos. Esto podría revelar la capacidad del parásito de utilizar el hierro de fuentes múltiples y como éste puede verse afectado con los cambios en la expresión de la bLTF, lo cual puede explicar cómo los cambios presentados en la proteína por el polimorfismo en estudio puede alterar la frecuencia de estas afecciones teniéndose una tendencia mayor en los individuos con el alelo B.
Aunque no se registraron reportes de tumores oculares, su asociación con bLTF, se ha percibido en ratas inhibiendo significativamente el cáncer de colon, esófago, pulmón y vejiga, cuando se administra por vía oral en la etapa de post-iniciación, posiblemente por la supresión en la fase I de enzimas, como el citocromo P450 1A2 (CYP1A2), que es preferentemente inducida por las aminas heterocíclicas cancerígenas (Tsuda et al., 2002). Yang et al. (2002) también apreciaron como péptidos derivados de la región N-terminal del hélice a de la bLTF, poseían características antitumorales muy activas, frente a líneas tumorales MethA (fibrosarcoma murino), adenocarcinoma colorectal humano línea celular HT-29 y carcinoma mamario humano línea celular MT-1.
CONCLUSIONES
Se encontró asociación del alelo B del polimorfismo del intron 6 del gen bLTF con la incidencia de mastitis clínica y subclínica. Fue posible establecer tendencias para enfermedades parasitarias, donde se advirtió que el alelo B se presenta con mayor frecuencia en animales con infestaciones parasitarias, caso contrario se observó para las afecciones reproductivas y respiratorias.
Este estudio es pionero en la asociación del polimorfismo del intrón 6 del gen LTF con enfermedades de importancia en producción lechera en el departamento de Antioquia - Colombia, los resultados son alentadores para seguir en la búsqueda de asociaciones que permitan el reconocimiento genético de susceptibilidad o resistencia a enfermedades de importancia en las ganaderías locales. Se requieren aún más esfuerzos por parte de los investigadores, para aumentar el tamaño muestral y conseguir resultados que generen mayor confiabilidad en cuanto a los marcadores genéticos, utilizados en los programas de mejoramiento animal.
BIBLIOGRAFÍA
Chaneton, L., L. Tirante, J. Maito, J. Chaves and L. Bussmann. 2008. Relationship between milk lactoferrin and etiological agent in the mastitis bovine mammary gland. Journal of Dairy Science 91(5): 1865-1873. [ Links ]
Fischer, J., L. Goss, E, Scheetz, L. Wohlford-Lenane, M. Snyder and B. McCray Jr. 2009. Differential gene expression in human conducting airway surface epithelia and submucosal glands. American Journal of Respiratory Cell and Molecular Biology 40(2): 189-199. [ Links ]
ICA. 2008. Sistema de Información y Vigilancia Epidemiológica: Colombia, sanidad animal 2008. Informe técnico. En: Instituto Colombiano Agropecuario, http://www.ica.gov.co/getattachment/e205da92-1991-4de4-b412-29d6dae2ae40/2008-(1).aspx. 120 p.; consulta: mayo 2011. [ Links ]
Landfear, S.M. 2011. Nutrient transport and pathogenesis in selected parasitic protozoa. Eukaryotic Cell 10(4): 483-493. [ Links ]
Máttar, S.V., J.S. Visbal y A.O. Bermúdez. 2000. Zoonosis: cerca o lejos de nosotros? Revista MVZ Córdoba 5(1): 5-9. [ Links ]
Miller, S.A., D.D. Dykes and H.F. Polesky. 1988. A simple saltingout procedure for extracting DNA from human nucleated cells. Nucleic Acids Research 16(3):1215. [ Links ]
O'Halloran, F., B. Bahar, F. Buckley, O. O'Sullivan, T. Sweeney and L. Giblin. 2009. Characterisation of single nucleotide polymorphisms identified in the bovine lactoferrin gene sequences across a range of dairy cow breeds. Biochimie 91(1): 68-75. [ Links ]
Pawlik, A., G. Sender and A. Korwin-Kossakowska. 2009. Bovine lactoferrin gene polymorphism and expression in relation to mastitis resistance. A review. Animal Science Papers and Reports 27(4): 263-271. [ Links ]
Peakall, R. and P.E. Smouse. 2006. GENALEX 6: genetic analysis in Excel. Population genetic software for teaching and research. Molecular Ecology Notes 6(1): 288-295. [ Links ]
Purcell, S., B. Neale, K. Todd-Brown, L. Thomas, M.A. Ferreira, D. Bender, J. Maller, P. Sklar, P.I. Bakker, M.J Daly and P.C. Sham. 2007. PLINK: a toolset for whole-genome association and population based linkage analysis. The American Journal of Human Genetics 81(3): 559-575. [ Links ]
Sharma, B., L. Jansen, N. Karrow, D. Kelton and Z. Jiang. 2006. Detection and characterization of amplified fragment length polymorphism markers for clinical mastitis in canadian holsteins. Journal of Dairy Science 89(9): 3653-3663. [ Links ]
Ramírez N., G. Gaviria, O. Arroyave, B. Sierra y J. Benjumea. 2001. Prevalencia de mastitis en vacas lecheras lactantes en el municipio de San Pedro de los Milagros, Antioquia. Revista Colombiana de Ciencias Pecuarias 14(1): 76-86. [ Links ]
Seyfert, H.M. and C. Kühn. 1994. Characterization of a first bovine lactoferrin gene variant, based on an EcoRI polymorphism. Animal Genetics 25(1): 54. [ Links ]
Tsuda, H., K. Sekine, K. Fujita and M. Iigo. 2002. Cancer prevention by bovine lactoferrin and underlying mechanisms. A review of experimental and clinical studies. Biochemistry and Cell Biology 80(1): 131-136. [ Links ]
Wakabayashi, H., M. Kurokawa, K. Shin, S. Teraguchi, Y. Tamura and K. Shiraki. 2004. Oral lactoferrin prevents body weightloss and increases cytokine responses during herpes simplex virus type 1 infection of mice. Bioscience Biotechnology and Biochemistry 68(3): 537-544. [ Links ]
Wilson, M.E., T.S. Lewis, M.A. Miller, M.L. McCormick and B.E. Britigan. 2002. Leishmania chagasi : uptake of iron bound to lactoferrin or transferrin requires an iron reductase. Experimental Parasitology 100(3): 196-207. [ Links ]
Wojdak-Maksymiec, K., M. Kmiec and J. Ziemak.2006. Associations between bovine lactoferrin gene polymorphism and somatic cell count in milk.Veterinarni Medicina 51(1): 14-20. [ Links ]
Yang, N., W. Stensen, J.S. Svendsen and Ø. Rekdal. 2002. Enhanced antitumor activity and selectivity of lactoferrina derived peptides. The Journal of Peptide Research 60(4): 187-197. [ Links ]
Zheng, J.,J.L. Ather, T.S. Sonstegard and D.E. Kerr. 2005. Characterization of the infection responsive bovine lactoferrin promoter. Gene 353(1): 107-117. [ Links ]
Zimecki, M., M. Kocieba and M. Kruzel. 2002.Immunoregulatory activities of lactoferrin in the delayed type hypersensitivity in mice are mediated by a receptor with affinity to mannose. Immunobiology 205(1):120-131. [ Links ]