Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.65 no.1 Medellín Jan./June 2012
Aliso en Simbiosis Dual con Frankia y Endomicorrizas y Respuesta a Boro en un Andisol
Alder in Dual Symbiosis whith Frankia and Endomycorrhizae and Response at Boron in an Andisol
Marisol Medina Sierra1; Jesús Oswaldo Velásquez Restrepo2 y Luz Mary Pinzón Sarmiento3
1 Profesora Asistente. Universidad de Antioquia - Facultad de Ciencias Agrarias. A.A.1226, Medellín, Colombia. <solmedina@agronica.udea.edu.co>
2 Profesor Asociado. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias - Escuela de Biociencias. A.A. 050034, Medellín, Colombia. <jovelasq@unal.edu.co>
3 Licenciada en Matemáticas. Universidad Pedagógica Nacional. C.P. 37008, Salamanca, España. <luz_mary_pinzon@hotmail.com>
Recibido: Octubre 24 de 2011; aceptado: Febrero 02 de 2012.
Resumen. Se evaluó la respuesta del aliso (Alnus acuminata Kunth) a la inoculación dual con cepas de Frankia spp. y de hongos endomicorrizógenos con dos niveles de boro (B) (0,3 y 0,6 mg kg-1 suelo) y la aplicación de nitrógeno (N) (40 kg ha-1), fósforo (P) (30 mg kg-1 suelo) y un control sin inoculación ni elementos químicos. Se empleó un diseño completamente aleatorizado, con 41 tratamientos y 20 repeticiones. Para el análisis estadístico de componentes principales se empleó el programa Multibiplot. Las variables respuesta correspondieron a la biomasa seca aérea y sus contenidos de N, P, Calcio (Ca) y cenizas (cen). Se encontró que los tratamientos de P y N y las cepas nativas de Frankia spp. (UdeA902, UdeA904 y CUNMS502) combinados con hongos micorrizógenos (UdeA1905 y Glomus fistulosum) respectivamente, favorecieron el rendimiento y contenido de N del aliso. La aplicación de B en algunos casos mejoró el rendimiento y en otros lo afectó negativamente; pero potenció la respuesta de algunas inoculaciones especialmente cuando estuvo presente G. fistulosum aún en el caso de estar acompañado de la cepa de Frankia (CUNMS502). Esta cepa, que presentó bajo rendimiento en otros tratamientos, se vio favorecida notablemente con la adición de B. La inoculación dual es efectiva para favorecer el manejo forestal del aliso siempre y cuando se haga la selección adecuada de las cepas, lo cual puede además condicionar la respuesta a algunos nutrientes como en el caso del B.
Palabras clave: Alnus acuminata, Glomus fistulosum, HMA (hongos micorrizógenos arbusculares), inoculación dual (Frankia-HMA).
Abstract. It was evaluated the response of alder (Alnus acuminata Kunth) to the dual inoculation of strains of Frankia spp. and endomycorrhizal fungi with two levels of boron (B) (0.3 and 0.6 mg kg-1 soil) and the application of nitrogen (N) (40 kg ha-1), phosphorus (P) (30 mg kg-1 soil) and a control without inoculation or chemical elements. The experimental design was completely randomized; it was composed kg-1of 41 treatments and 20 replications. The statistical analysis consisted of a Principal Component Analysis using a Multibiplot software. The response variables were: dry-aboveground biomass and the content of N, P, calcium (Ca) and ashes. Results indicated that P and N treatments and the wild strains of Frankia spp. (UdeA902, UdeA904 and CUNMS502) combined with the mycorrhizal fungi (UdeA1905 and Glomus fistulosum) respectively, promoted the yield and the N content of alder. The application of B improved the yield of alder, although in some cases it was affected negatively. Nevertheless, the B promoted the response of some inoculations, especially where G. fistulosum was present, even when it was accompanied by the strain of Frankia (CUMS502). This strain, which showed a low yield in other treatments, was improved significantly with the application of B. Dual inoculation is effective to promote the forest management of alder's trees, as long as the appropriate selections of strains are made. This selection can also influence the response to some nutrients as in the case of B.
Key words: Alnus acuminata, Glomus fistulosum, AMF (arbuscular mycorrizal fungi), dual inoculation (Frankia-AMF).
El aliso (Alnus acuminata Kunth) de la familia betulácea es una especie importante en la región alto-andina por su amplia gama de usos, tales como materia prima de papel, rehabilitación y recuperación de suelos degradados y como componente arbóreo para sistemas silvopastoriles, entre otros. Su adaptación a condiciones de suelos pobres y degradados se fundamenta en la capacidad de formar simbiosis con microorganismos diversos, como el actinomiceto Frankia spp. (Frankiaceae) (Cervantes et al., 1992; Dommergues, 1997; Roy et al., 2007) y hongos micorrizógenos tanto de carácter endomicorrizal (Russo et al., 1993; Medina et al., 2008; Molina et al., 2008), como ectomicorrizal (Becerra et al., 2009) lo cual le permite tomar el nitrógeno (N) del aire y explorar grandes volúmenes de suelo para aprovechar los nutrientes necesarios para su crecimiento y desarrollo en condiciones ecológicas limitantes.
Se han reportado efectos positivos para el desarrollo del aliso con la inoculación dual en Alnus cordata con Glomus sp. y Frankia spp. (Isopi et al., 1994); en Alnus glutinosa con G. intrarradices y Frankia spp. (Oliveira et al., 2005). Orozco et al. (2005) encontraron efecto positivo de aislamientos nativos de Frankia spp. y de G. fistulosum en condiciones de suelos similares a las del presente estudio.
Los Andisoles donde generalmente crece el aliso, se caracterizan por alta capacidad de retención de fósforo (P) y boro (B) y disponibilidad de N limitada, debido a la baja mineralización de la materia orgánica, lo cual se va a expresar en deficiencias nutricionales en estos elementos, especialmente en plantas jóvenes (Brown y Courtin, 2007).
En Colombia, en suelos de alta montaña, Carlson y Dawson (1985) registraron incrementos de 279 kg ha-1 de N, en plantaciones de Alnus acuminata (syn. A. jorullensis) con dos años de establecimiento y densidades de 1.200 árboles ha-1.
Una evaluación en 190 suelos agrícolas en diferentes regiones del mundo estableció que el 31% de los suelos presentaba deficiencias de B para la producción de cultivos (Sillampää, 1990). Dell et al. (2001, 2008) identificaron deficiencias de B en reforestación en suelos volcánicos del norte de Sumatra. Según trabajos recientes, la micorriza juega un papel importante en el transporte del B en las plantas y en la retraslocación del B (Lehto et al., 2010) y se ha demostrado alta retención de algunos elementos en el micelio de hongos micorrizógenos; gran parte del B puede ser retenido y es de gran importancia en áreas de baja disponibilidad (Högberg y Högberg, 2002). Inclusive se ha trabajado con la interacción de algunas especies de hongos formadores de ecto y endomicorrizas para el fitomanejo de suelos con niveles tóxicos de B (Robinson et al., 2007).
La interacción dual Frankia spp.-micorriza, de acuerdo con la revisión de literatura, podría verse particularmente afectada por la deficiencia de B dado el bajo contenido en el suelo evaluado (0,1 mg kg-1). Debido a que la respuesta de las plantas no siempre es favorable a las diversas especies y cepas de Frankia spp. o de hongo micorrizógeno, en este estudio se evaluó la influencia de la inoculación dual con cepas de estos microorganismos y su respuesta a la doble simbiosis interactuando con B a nivel de invernadero, en un andisol como sustrato.
MATERIALES Y MÉTODOS
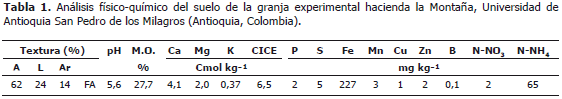
Condiciones del estudio. Se obtuvieron plántulas de Alnus acuminata a partir de semilla sexual certificada, desinfectadas en su superficie con etanol al 70%, hipoclorito de sodio al 1,2%, lavadas diez veces con agua destilada estéril y germinadas en cuarzo estéril bajo condición de riego manual con agua destilada estéril (Sieverding, 1991). A las doce semanas, las plántulas se trasplantaron a bolsas de polietileno que contenían 2 kg de suelo. El suelo fue recolectado de un lote sin fertilización previa de la granja experimental la Montaña de la Universidad de Antioquia (Tabla 1) mezclado con viruta al 2% y desinfectado previamente con Basamid® (3,5-dimetil-(2H)-tetrahidro-1,3,5-tiadazina-2-tiona al 98%) al 0,05%. El ensayo se mantuvo bajo invernadero con riego por aspersión dos veces por semana durante un período de nueve meses en el municipio de San Pedro de los Milagros (Antioquia, Colombia) ubicado a 06°27'de latitud Norte y 75°33'de longitud Oeste.
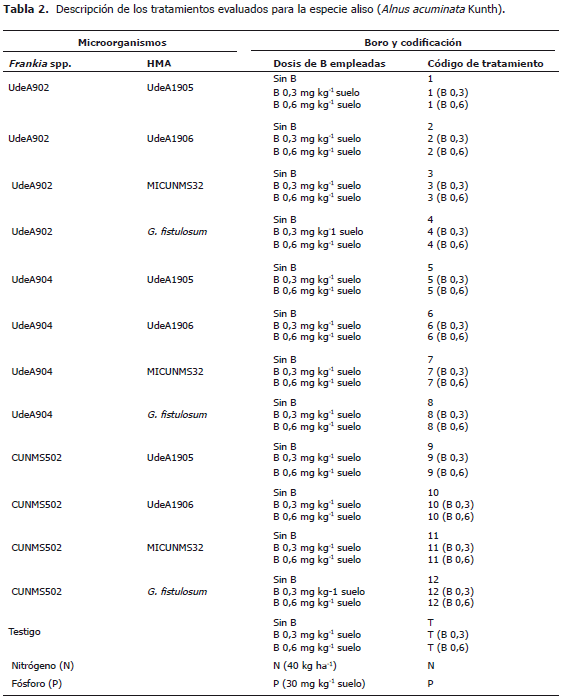
Los microorganismos usados en este estudio están codificados como UdeA hacen referencia a la colección de la Universidad de Antioquia, CUNMS (Colección Universidad Nacional Microbiología de Suelos, Medellín) y MICUNMS (Micorrizas Universidad Nacional Microbiología de Suelos, Medellín). La cepa UdeA902 proviene de un sistema silvopastoril con aliso del municipio de Manizales (Caldas, Colombia), las cepas UdeA904 y UdeA1905 de San Pedro de los Milagros de la granja experimental La Montaña y las cepas CUNMS502 y MICUNS32 del Centro Agropecuario San Pablo de la Universidad Nacional de Colombia, Sede Medellín (Rionegro, Antioquia) y la cepa de Glomus fistulosum proveniente de Chinchiná, Caldas (Tabla 2).
Tratamientos. Correspondieron a la inoculación conjunta de una cepa de Frankia spp. y uno de hongo endomicorrizógeno arbuscular; ambos de diferentes procedencias de plantaciones de aliso. Cada combinación de organismos correspondió a un tratamiento con 20 unidades experimentales. Para cada tratamiento, el primer código correspondió a una cepa de Frankia spp. y el segundo código a una cepa de hongo endomicorrizógeno, los cuales se inocularon de acuerdo a los tratamientos propuestos en la Tabla 2. Las cepas de Frankia spp. se multiplicaron previamente en medio agar caseína a 33 °C con agitación a 40 rpm en oscuridad (Orozco et al., 2005). Se inoculó un mL de una suspensión del cultivo de Frankia spp. con 2,4x108 unidades formadoras de colonias (UFC). Las cepas de hongos micorrizógenos se multiplicaron previamente en cultivos trampa de Lolium perenne L. en un sustrato compuesto de suelo, cuarzo y vermiculita en relación 5:1:0,5 esterilizado y se aplicó solución de Hoagland's (Millner y Kitt, 1992) alternada con agua destilada estéril durante 16 semanas, después de las cuales se empleó como inóculo el sustrato con raíces con un contenido promedio de 60 esporas de hongos micorrizógenos arbusculares (HMA) por cada unidad experimental. Los tratamientos con B correspondieron a la aplicación de este nutrimento en dos tratamientos (0,3 y 0,6 mg kg-1 suelo en forma de H3BO3) y combinación de éstos con cada uno de los grupos de microorganismos evaluados. Un tratamiento de N (40 kg ha-1 en forma de CO(NH2)2) y un tratamiento de P (30 mg kg-1 en forma de H3PO4 grado comercial).
Estimación de variables experimentales. La biomasa aérea se determinó por secado de las plantas a 65 °C por 72 h, la determinación del contenido foliar de los elementos se realizó según la AOAC (1995), el N se determinó por Kjeldahl (metodología 954,01), el P por fotocolorímetría (metodología 965,17) y el Ca por formación de complejo con EDTA y posterior valoración colorimétrica (AOAC, 1995), metodologías adaptadas por Ayala (2008).
Diseño experimental y análisis estadístico. Se empleó un diseño completamente aleatorizado, con efecto fijo, balanceado con 41 tratamientos y 20 repeticiones. Para el análisis estadístico se utilizó el método de componentes principales con un gráfico biplot mediante el programa de libre acceso denominado multibiplot (Vicente-Villardón, 2003).
RESULTADOS
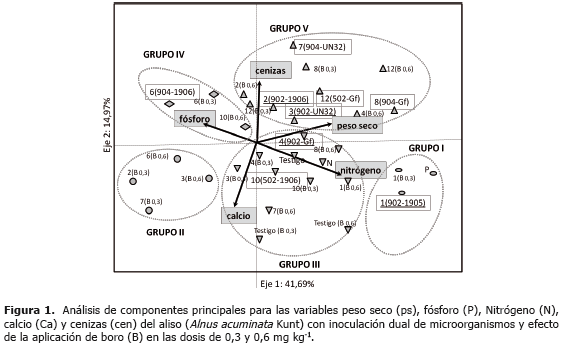
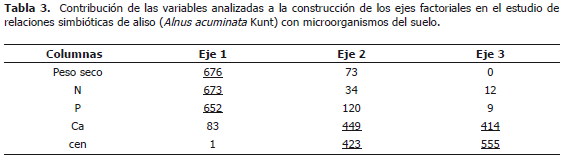
El análisis de componentes principales con las variables peso seco (ps), N, P, Ca y cenizas (cen) explica para el primer componente el 41,69% de los datos y el segundo el 14,97%; estos dos componentes elucidan en total el 57% de la variabilidad de los datos (Figura 1). El eje 1 está definido por las variables ps, contenido de N y contenido de P. El eje 2 por las variables Ca y cen (Tabla 3). Con los tratamientos 5, 9 y 11 (no se ilustran en la gráfica) se presentaron valores de bajo ps y en ellos el B exhibió efecto negativo sobre el ps. Los tratamientos 9, 10 y 11 que se caracterizaron por tener todos la cepa CUNMS502 combinada con las cepas de HMA UdeA1905, 1906 y MICUNS32 respectivamente, presentaron bajos rendimientos; mientras que el tratamiento 12 con la misma cepa de Frankia spp. (CUNMS502) combinada con G. fistulosum superó ampliamente a los tratamientos antes descritos en las variables ps, N y el B no presentó efecto negativo evidenciando el efecto de la especificidad entre Frankia spp. y HMA y también la interacción del B con los diferentes cepas probadas.
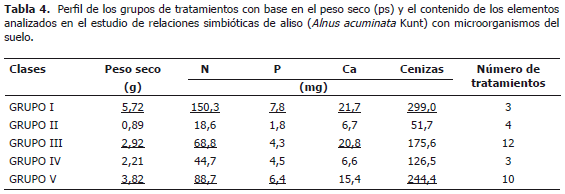
Adicionalmente se realizó un análisis de agrupación de los tratamientos por el método de Ward, lo que permitió caracterizarlos. Se encontraron cinco grupos (Tabla 4) de los cuales los grupos I, III y V presentan los mayores niveles de ps y N (P<0,05). Específicamente el grupo I muestra los mayores niveles, seguido del grupo V, mientras que el grupo III además exhibe altos contenidos de Ca similar al grupo I. El grupo II que produjo baja cantidad de biomasa, ostenta también los menores contenidos de los elementos evaluados.
Con base en la Tabla 5 con un nivel de significancia de (P<0,5) se puede afirmar que la aplicación de B favorece la absorción de Ca ya que incrementó significativamente sus niveles foliares. Por otro lado, éste no presentó efectos significativos sobre la absorción de P, efectos negativos en el ps de las plantas y en el contenido de N cuando se aplicó la menor dosis del elemento (0,3 mg de B kg-¹ suelo) (Tabla 5).
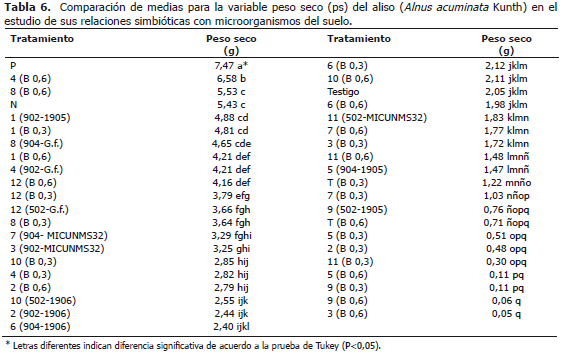
En la Tabla 6 se expresa un compendio de los resultados organizados en forma descendente de ps de los promedios de todos los parámetros evaluados. Se observa que P y N son limitantes de primer orden para la respuesta del aliso en este sustrato y que los tratamientos biológicos (micorrizas y Frankia spp.) que favorecen la absorción de estos dos elementos, pueden subsanar estas deficiencias y solo así se presenta algún efecto positivo de la aplicación del B.
DISCUSIÓN
De acuerdo con los resultados, es claro que los principales limitantes para el crecimiento del aliso en las condiciones de este estudio, son el P y el N y que los tratamientos biológicos en una adecuada combinación de hongo micorrizógeno y Frankia spp. pueden corregir estos limitantes. Las inoculaciones duales de Frankia spp. UdeA902, 904 y CUMNS 502 con los hongos endomicorrizógenos UdeA1905 o G. fistulosum pueden corregir esta deficiencia. La aplicación de B presenta respuesta positiva cuando se corrigen dichas deficiencias. Letho et al. (2010) afirman que la deficiencia de B afecta la formación de la asociación micorrizal y el crecimiento de los primordios radicales; pero aún no se conoce si el B es un elemento indispensable para el desarrollo de los hongos micorrizales; dado que el N y el P son esenciales en el crecimiento radical, es probable que el B afecte la colonización de determinadas especies. Sword y Garrett (1994) y Marschner (1995) sugieren que el mecanismo para incrementar la colonización micorrizal por adición de B es una reducción de fenoles en la planta. Bolaños et al. (2002) manifiestan que el B es esencial para la estructura y función de nódulos simbióticos de Frankia spp.; por otra parte, en la simbiosis es conocida la función del B en la estabilidad de la cubierta de las vesículas fijadoras de N2 que previene el acceso de oxígeno.
Hay especificidad entre los tres componentes biológicos; por ejemplo, la cepa UdeA902 de Frankia spp. formó adecuada asociación con la micorriza UdeA1905; la cepa de G. fistulosum presentó mejor respuesta cuando se combinó con las cepas UdeA 902 y 904, pero además favoreció notablemente la repuesta de Frankia spp. CUMNS502, como informaron Orozco et al. (2005) en condiciones similares pero en este estudio esta cepa presentó efectos negativos sobre la planta cuando se combinó con los hongos evaluados.
Similarmente, Brown y Courtin (2007) establecieron el efecto positivo de la aplicación de P en varios tipos de suelos en la Isla de Vancouver en A. rubra sobre diferentes variables de crecimiento en evaluaciones realizadas a los tres y diez años de su aplicación. Estos autores sostienen que las respuestas al P fueron significantes a los tres años pero el patrón de respuesta cambió a los diez años cuando el P fue menos limitante en árboles con asociaciones micorrizales. Brown et al. (2010) anuncian tasas máximas de crecimiento del aliso en suelos similares de la Isla de Vancouver asociadas a la aplicación de P entre 20 y 30 g árbol-1, pero no encontraron respuesta a la aplicación de otros elementos incluyendo B (0,6 g árbol-1). En este estudio, incluso hubo respuesta negativa a la aplicación de B, muy por debajo del testigo cuando se suministró solo en cualquiera de las dosis. Seeds y Bishop (2009) encontraron máximas tasas de crecimiento de A. viridis en suelos volcánicos del monte St. Helens (Estados Unidos de América) con tratamientos de Frankia spp.-micorriza, superando el tratamiento con P. Estos mismos autores dicen que tratamientos con adición de N y P muestran que muchas plantas vasculares estuvieron más limitadas por deficiencia de N y no por P, pero que plantas fijadoras de N2 y el suministro de N son limitados por el P del suelo. Estos mismos autores señalan escasos crecimientos de plántulas de esta especie a los 175 d con mínimas respuestas a aplicaciones de P (6 y 12 g kg-1) en ausencia de microorganismos.
Olivera et al. (2005) en plántulas de Alnus glutinosa en suelos degradados alcalinos antropogénicos hallaron efectos altamente positivos en diferentes variables de rendimiento. La inoculación individual con Frankia spp. sola fue superior a la inoculación con G. intrarradices, mientras que Frankia spp. sola aumentó un 197% el contenido de N en las hojas, en tanto que con ambos simbiontes se presentó un incremento del 277% y con el contenido de P no hubo efecto de los simbiontes inoculados individualmente pero este incremento fue de 240% cuando se inocularon conjuntamente. El incremento en K fue de 129% mientras que en Ca no se obtuvo incremento significativo en las inoculaciones individuales ni conjuntas. En esta misma investigación, la inoculación con el hongo micorrizógeno favoreció notablemente la nodulación de Frankia spp.
La respuesta a la aplicación de 0,6 mg kg-1 de B, como se esperaba, solo ocurrió cuando se inocularon las cepas efectivas de Frankia spp. y el G. fistulosum, lo que demuestra que aún siendo limitante el B, las plantas sólo responden a su aplicación cuando se corrigen deficiencias de P. Al respecto, Rojas et al. (2002), para la especie A. rubra, como en este caso, determinaron también respuesta negativa del B, en un estudio en un Bosque de Oregon, (Estados Unidos de América) donde se adicionaron dosis recomendadas de micronutrientes para la especie incluido el B. La inoculación con G. intrarradix con Frankia spp. tuvo un efecto amortiguador de la disminución de la fijación de N por la influencia de los micronutrientes.
Se observa que los grupos II y IV se caracterizan por contener en su tratamiento la cepa UdeA1906 de hongo micorrizógeno independiente de las cepas de Frankia spp. acompañantes con o sin B en sus dos dosis evaluadas (véase tratamientos 2, 3, 10 y la cepa MICUNMS 32 en los tratamientos 3 y 7); lo cual indica que esta inoculación dual con cepas de Frankia spp. las cuales presentaron resultados sobresalientes con otros hongos, en esta combinación no manifiestan compatibilidad o en su defecto el resultado positivo observado en los tratamientos que contenían la misma cepa de Frankia spp. deben este comportamiento al hongo micorrizógeno. El grupo de mayor concentración de N (2,6%) fue el I, donde la única cepa de Frankia spp. que aparece es la UdeA902, lo que podría explicar el buen funcionamiento de éste; reforzando el supuesto de incompatibilidad de algunas combinaciones Frankia-hongo micorrizógeno.
Lumini et al. (1994) comprobaron, en parcelas de reforestación de aliso italiano (A. cordata) que la inoculación dual con Frankia spp. y G. fasciculatum, superaron en producción de biomasa aérea a otros tratamientos con microorganismos individuales de Frankia spp. (AcI4) y HMA y a las combinaciones de Frankia ssp. con G. mosse, pero al año de ser trasplantados a un suelo residual de mina de carbón, ambas combinaciones de hongos con la misma cepa de Frankia spp. superaron ampliamente a las inoculaciones de los microorganismos en forma individual aunque en el caso de la inoculación sola con Frankia spp. superó de igual manera al testigo tanto en biomasa como en la concentración de N en las hojas (2% vs. 0,86%).
CONCLUSIONES
El desarrollo de plántulas de Aliso (Alnus acuminata) en Andisoles es ampliamente reducido por la deficiencia de P y N aprovechables, estos limitantes pueden ser subsanados por la aplicación directa de estos elementos o por la doble inoculación de Frankia spp. y HMA compatibles.
Los mejores resultados para esta especie en estas condiciones, en materia seca y acumulación de N foliar, se obtuvieron con las combinaciones de Frankia spp. cepas UdeA902 y UdeA904 con los hongos micorrizógenos G. fistulosum y UdeA1905 y Frankia spp. cepa CUNMS502 con G. fistulosum.
Aunque hubo respuesta positiva a la aplicación de B en el sustrato, el suministro de B presenta además, interacciones positivas o negativas dependiendo de las asociaciones duales de microorganismos Frankia spp.-HMA. Las respuestas positivas fueron superiores cuando las asociaciones duales funcionaron, pero el B presentó efecto negativo sobre la biomasa aérea y la concentración foliar de N cuando las combinación de cepas Frankia spp.-HMA no funcionaron adecuadamente con el aliso, como en la combinación UdeA902 con MICUMNS32 o la combinación CUNMS502 cuando se inoculó con las otras cepas de HMA.
En planes de manejo de la especie forestal, con miras a obtener la sostenibilidad, es evidente la respuesta a la inoculación dual con los microorganismos adecuados, con el posible riesgo que se puede correr de tener un efecto completamente opuesto al esperado.
AGRADECIMIENTOS
Los autores agradecen a CODI (Comité para el Desarrollo de la Investigación) de la Universidad de Antioquia por la financiación del proyecto con código E00750, a la Unidad Municipal de Asistencia Técnica Agropecuaria (UMATA) del municipio de San Pedro de los Milagros (Antioquia), al Departamento Académico de Haciendas de la Universidad de Antioquia, a Jorge Ochoa Sánchez Zoot, Director de la hacienda La Montaña y a Silvio Ayala Lopera, Coordinador del Laboratorio Integrado de Nutrición Animal, Bioquímica y de Pastos y Forrajes de la Universidad. Especial gratitud al Profesor Francisco Hernando Orozco P. por su asesoría, colaboración y acompañamiento en esta investigación.
BIBLIOGRAFÍA
AOAC - Association of Official Agricultural Chemists. 1995. Official methods of analysis. 16th edition. AOAC, Maryland. 684 p. [ Links ]
Ayala, S.A. 2008. Manual para el laboratorio de nutrición animal. Universidad de Antioquia, Facultad de Ciencias Agropecuarias, Medellín. 68 p. [ Links ]
Becerra, A.G., E. Menoyo, I. Lett and C.Y. Li. 2009. Alnus acuminata in dual symbiosis with Frankia and two different ectomycorrhizal fungi (Alpova austroalnicola and Alpova diplophloeus) growing in soilless growth medium. Symbiosis 47: 85-92. [ Links ]
Bolaños, L., M. Redondo, L. Bonilla and L.G. Wall. 2002. Boron requirement in the Discaria trinervis (Rhamnaceae) and Frankia symbiotic relationship. Its essentiality for Frankia BCU110501 growth and nitrogen fixation. Physiologia Plantarum 115(4): 563-570. [ Links ]
Brown, K.R., P.J. Courtin and R.W. Negrave. 2010. Effects of fertilization on red alder growth on Vancouver Island, year 10 results. In: Forest Research, Extension Note EN-028, http://www.for.gov.bc.ca/RCO/Research/HardwoodReports/EN28%20all8.pdf. 6 p.; consulta: marzo 2011. [ Links ]
Brown, K.R. and P.J. Courtin 2007. Phosphorus additions increase the early growth of red alder (Alnus rubra Bong.) on Vancouver Island. Western Journal of Applied Forestry 22(2): 116-123. [ Links ]
Carlson, P.J. and J.O. Dawson. 1985. Soil nitrogen changes, early growth, and response to soil internal drainage of a plantation of Alnus jorullensis in the Colombian highlands. Turrialba 35(2): 141-150. [ Links ]
Cervantes, E., C. Rodríguez, D. Norris and A.K. Varma. 1992. Chapter 22: Relationships between the mycorrhizal and actinorhizal symbioses in non-legumes. pp. 417-432. In: Norris, J.R., D.J. Read and A.K. Varma (eds.). Methods in Microbiology. Volume 24. Academic Press, London. 450 p. [ Links ]
Dell, B., N. Malajczuk, D. Xu and T.S. Grove. 2001. Nutrient disorders in plantation eucalypts. 2nd edition. Monograph No. 74. ACIAR, Canberra, Australia. 188 p. [ Links ]
Dell B., G. Hardy and T. Burgess. 2008. Health and nutrition of plantation eucalypts in Asia. Southern Forests 70(2): 131-138. [ Links ]
Dommergues, Y.R. 1997. Contribution of actinorhizal plants to tropical soil productivity and rehabilitation. Soil Biology and Biochemistry 29(5-6): 931-941. [ Links ]
Högberg, M. and N. Högberg P. 2002. Extramatrical ectomycorrhizal mycelium contributes one third of microbial biomass and produces, together with associated roots, half the dissolved organic carbon in a forest soil. New Phytologist 154: 791-795. [ Links ]
Isopi, R., E. Lumini, M. Frattegiani, G. Puppi, M. Bosco, F. Favilli and E. Buresti 1994. Inoculation of Alnus cordata with selected microsymbionts: effects of Frankia and Glomus spp. on seedling growth and development. Symbiosis 17(2-3): 237-245. [ Links ]
Lehto, T., T. Ruuhola and B. Dell. 2010. Boron in forest trees and forest ecosystems. Forest Ecology and Management 260(12): 2053-2069. [ Links ]
Lumini, E., M. Bosco, G. Puppi, R. Isopi, M. Frategiani, E. Buresti and F. Favilli. 1994. Field performance of Alnus cordata Loisel (Italian alder) inoculated with Frankia and VA-mycorrhizal strains in mine-spoil afforestation plots. Soil Biology and Biochemistry 26(5): 659-661. [ Links ]
Marschner, H. 1995. Mineral nutrition of higher plants. Academic Press, New York. 889 p. [ Links ]
Medina, M., H. Orozco y C. Díez. 2008. Establecimiento de un sistema silvopastoril mediante las especies Alnus acuminata H.B.K. y Acacia decurrens Willd y respuesta al empleo de organismos rizosféricos en San Pedro (Antioquia). Livestock Research for Rural Development. 20(1). Article No.7. Retrieved December 16, 2010, from http://www.lrrd.org/lrrd2020/2011/medi20007.htm. [ Links ]
Millner, P.D. and D.G. Kitt. 1992. The Beltsville method for soilless production of vesicular-arbuscular mycorrhizal fungi. Mycorrhiza 2(1): 9-15. [ Links ]
Molina, M., M. Medina y L. Mahecha. 2008. Microorganismos y micronutrientes en el crecimiento y desarrollo del Aliso (Alnus acuminata H.B.K.) en un sistema silvopastoril alto andino. Livestock Research for Rural Development 20(4). Article No.54. Retrieved December 16, 2010, from http://www.lrrd.org/lrrd2020/2014/moli20054.htm. [ Links ]
Oliveira, R.S., P.M. Castro, J.C. Dodd and M. Vosátka. 2005. Synergistic effect of Glomus intraradices and Frankia spp. on the growth and stress recovery of Alnus glutinosa in an alkaline anthropogenic sediment. Chemosphere 60(10): 1462-1470. [ Links ]
Orozco, F.H., M. Medina y P. Sarria. 2005. Aislamiento y evaluación de microorganismos endófitos de aliso (Alnus acuminata var. Acuminata). Livestock Research for Rural Development. 17(1), Article No.10. Retrieved May 22, 111, from http://www.lrrd.org/lrrd117/111/oroz17010.htm. [ Links ]
Robinson, B.H., S.R. Green, B. Chancerel, T.M. Mills and B.E. Clothier. 2007. Poplar for the phytomanagement of boron contaminated sites. Environmental Pollution 150: 225-233. [ Links ]
Rojas, N.S., D.A. Perry, C.Y. Li and L.M. Ganio. 2002. Interactions among soil biology, nutrition, and performance of actinorhizal plant species in the H.J. Andrews Experimental Forest of Oregon. Applied Soil Ecology 19: 13-26. [ Links ]
Roy, S., D.P. Khasa and C.W. Greer. 2007. Combining alders, frankiae and mycorrhizae for the revegetation and remediation of contaminated ecosystems. Canadian Journal of Botany 85(3): 237-251. [ Links ]
Russo, R.O., J.C. Gordon and G.P. Berlyn. 1993. Evaluation alder-endophyte (Alnus acuminata-Frankia-mycorrhizae) interactions: growth response of Alnus acuminata seedlings to inoculation with Frankia strain ArI3 and Glomus intraradices, under three phosphorus levels. Journal of Sustainable Forestry 1(1): 93-110. [ Links ]
Seeds, J.D. and J.G. Bishop. 2009. Low Frankia inoculation potentials in primary successional sites at Mount St. Helens, Washington, USA. Plant and Soil 323(1-2): 225-233. [ Links ]
Sieverding, E. 1991. Vesicular-arbuscular mycorrhiza management in tropical agrosystems. Technical Cooperation, Federal Republic of Germany, Eschborn, Germany. 371 p. [ Links ]
Sillampää, M. 1990. Micronutrient assessment at country level: an international study. Food & Agriculture Organization of the United Nations (FAO). Soils Bulletin No. 63. FAO, Rome. 208 p. [ Links ]
Sword, M.A. and H.E. Garrett. 1994. Boric acid-phenolic relationships within the Pinus echinata-Pisolithus tinctorius ectomycorrhizal association. Tree Physiology 14(10): 1121-1130. [ Links ]
Vicente-Villardón, J.L. 2003. Multipbiplot: un programa para análisis de datos multivariantes basado en Biplot. Departamento de Estadística, Universidad de Salamanca, Salamanca, http://biplot.usal.es/ClassicalBiplot/documen tation/info/index.html; consulta: marzo de 2011. [ Links ]