Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.65 no.2 Medellín June/Dec. 2012
GERMINACIÓN DEL POLEN DE BERENJENA (Solanum melongena L.) EN CONDICIONES In Vitro
In Vitro POLLEN GERMINATION OF EGGPLANT (Solanum melongena L.)
Hermes Araméndiz Tatis1; Carlos Cardona Ayala2 y Elis Angélica Lugo Torres3
1 Profesor Titular. Universidad de Córdoba - Facultad de Ciencias Agrícolas - Departamento de Ingeniería Agronómica y Desarrollo Rural, carrera 6 No. 76-103, Montería, Colombia. <haramendiz@hotmail.com>
2 Profesor Titular. Universidad de Córdoba - Facultad de Ciencias Agrícolas - Departamento de Ingeniería Agronómica y Desarrollo Rural, carrera 6 N° 76-103, Montería, Colombia. <ccardona@sinu.unicordoba.edu.co>
3 Ingeniero Agrónomo. Asistente Técnico Particular, Montería. <elanluto@hotmail.com>
Recibido: Diciembre 07 de 2011; aceptado: Abril 22 de 2012.
Resumen: Se evaluó la viabilidad del polen de berenjena (Solanum melongena L.) mediante el método de germinación in vitro. Botones florales de la variedad Lila criolla con características de pre-antesis fueron colectados de las 07:00 a las 08:00 horas. Los granos de polen fueron extraídos con un vibrador eléctrico y rehidratados en cámara húmeda durante dos horas a temperatura de 25 ºC. Posteriormente, para la germinación en condiciones in vitro, los granos fueron dispersados, utilizando un pincel, en un medio de cultivo constituido por 100 g de sacarosa (C12H22O11), 500 mg de nitrato de calcio [Ca (NO3)2 4H2O], 120 mg de sulfato de magnesio (MgSO4), 100 mg de nitrato de potasio (KNO3) y 120 mg de ácido bórico (H3BO3) disueltos en 1.000 mL de agua destilada. Seguidamente, se agregaron 10 g de agar y el pH fue ajustado a 6,0. El polen fresco fue incubado durante ocho horas con lecturas cada dos horas. Los resultados indican que el método es confiable para cuantificar la viabilidad de granos de polen, ya que después de ocho horas de incubación se logró un 79% de germinación, 0,50 mm de longitud del tubo polínico y 0,0532 mm de diámetro del mismo. Por lo tanto, el uso de polen con ocho horas de almacenamiento es favorable para la producción de semilla híbrida a través de la hibridación artificial, por haber registrado un aumento de germinación de 0,4942% con efecto cuadrático, por cada hora de incubación.
Palabras clave: Semilla híbrida, hibridación artificial, viabilidad del polen, fisiología de semillas.
Abstract: We assessed the viability of pollen of eggplant (Solanum melongena L.) using in vitro germination method. The collection of flower buds in pre-anthesis of the Lila criolla variety was carried out in the morning from 07:00 to 08:00 hours. Pollen grains were extracted with an electric vibrator and rehydrated in a humid chamber for two hours at a temperature of 25 ºC. Subsequently, for germination in vitro, were dispersed, using a paintbrush, in a culture medium container 100 g of saccharose (C12H22O11), 500 mg of calcium nitrate [Ca (NO3)2 4H2O], 120 mg of magnesium sulfate (MgSO4), 100 mg of potassium nitrate (KNO3) and 120 mg boric acid (H3BO3) dissolved in 1,000 mL of distilled water. Subsequently, it was added 10 g of agar and the pH was adjusted to 6.0. The fresh pollen was incubated in a culture medium for eight hours and observations were made every two hours. The results indicate that the method used is reliable to quantify the viability of pollen grains, because after eight hours of incubation achieved the highest percentage of germination (79%), the pollen tube length was of 0.50 mm and diameter of 0.0532 mm. Therefore, the use of pollen with 8 hours of storage is favorable for hybrid seed production through artificial hybridization, to have been an increase of 0.4942% germination with quadratic effect, for each hour of incubation.
Key words: Hybrid seed, artificial hybridization, viability of pollen, seed physiology.
La berenjena (Solanum melongena L.) es una solanácea de importancia económica para Colombia, cultivada principalmente en los departamentos de Córdoba, Sucre, Bolívar y el Valle del Cauca. Los rendimientos en los departamentos del Caribe colombiano no son competitivos, oscilan entre 7,9 y 10,9 t/ha, debido al uso de materiales no mejorados y/o factores ambientales como altas temperaturas, que durante la floración afectan la formación de semillas tanto en monocotiledóneas como dicotiledóneas (Young et al., 2004); en tanto que, en el Valle del Cauca los registros corresponden a 40,1 t/ha, como consecuencia de la siembra de híbridos y mejor manejo agronómico (Filgueira, 2000; Araméndiz et al., 2008a; Agronet, 2011).
El rendimiento de los híbridos es mayor de 58 t ha-1, con respecto a las variedades de polinización abierta; además, los híbridos registran resistencia a enfermedades, uniformidad de frutos, precoces, carencia de espinas en el cáliz y en otras partes de la planta y en general presentan mejores características agronómicas (Sekara et al., 2007; França et al., 2009). En los últimos años se está incrementando el uso de híbridos al aire libre, dado que la berenjena es un cultivo que presenta vigor híbrido para caracteres relacionados con la producción al cruzar parentales no relacionados (Prohens et al., 2005). La utilización de germoplasma local, adaptado a las condiciones de cultivo al aire libre, podría contribuir al desarrollo de nuevos híbridos mejorados, en razón a que el tamaño de las flores facilita el proceso de producción de semillas.
Los estudios relacionados con la calidad del polen son de gran importancia en investigaciones relacionadas con la reproducción sexual, especialmente en las condiciones del trópico cálido y húmedo, porque permiten asegurar el éxito de las hibridaciones e incrementar la eficiencia del mejoramiento (González et al., 2002), lo que conllevaría al mejoramiento de los rendimientos y de la producción de semilla para la obtención de híbridos con mejores características agronómicas y de calidad del fruto, perfeccionando la competitividad del sistema de producción.
En los programas de mejoramiento genético, el conocimiento de la viabilidad del polen es un factor esencial cuando se desea utilizar la técnica de la hibridación artificial como mecanismo en la producción de semilla híbrida, dado que la relación polen estigma depende de la viabilidad del polen, receptividad del estigma y la interacción genética entre el polen y el estigma, por la existencia de mecanismos de incompatibilidad que afectan la producción de semilla después de la fertilización (Weller et al., 2007), de tal manera que ello se vea reflejado en una mejor calidad de la semilla y homogeneidad del fruto, pues el tamaño de la flor de berenjena permite la producción de semilla hibrida sin ninguna dificultad (Araméndiz et al., 2008b; Soares et al., 2008; Vieira et al., 2009).
Diferentes métodos pueden ser aplicados en el estudio de la viabilidad del polen, entre ellos la tinción con colorantes nucleares o las pruebas de germinación in vitro (Parfitt y Ganeshan, 1989; Heslop et al., 1984; Koyuncu et al., 2000; Voyiatsiz and Paraskevopoulou, 2002). El objetivo de la técnica de tinción es determinar en el grano de polen la actividad enzimática de la membrana y la integridad y color del núcleo (Norton, 1966; Vizintin y Bohanec, 2004). Las pruebas de tinción son más rápidas y más fáciles que las pruebas de germinación in vitro del polen, pero, en algunos casos, pueden obtenerse diferentes resultados en muchas especies. Por lo tanto, para determinar la cantidad real de polen viable, las pruebas de germinación in vitro son necesarias, ya que pueden determinar la influencia de las condiciones externas sobre la germinación del polen y el subsecuente crecimiento del tubo polínico (Martínez et al., 2000) e igualmente, la presencia de glutatión es esencial para la germinación del polen, y su consumo, al igual que las auxinas, está asociado con la longitud del tubo polínico (Zechmann et al., 2011).
La germinación in vitro es una metodología para evaluar pequeñas cantidades de polen en un medio de cultivo y a través de esta técnica, es posible observar al microscopio el porcentaje de granos de polen que desarrollan el tubo polínico después de un período determinado. Esta metodología ha sido aplicada en maní (Craufurd et al., 2003), algodón (Kakani et al., 2005), ají (Reddy y Kakani, 2007), berenjena (Franca et al., 2009), papa (Suárez et al., 2010) y tomate (Karapanos et al., 2010).
Considerando los bajos rendimientos del fruto de berenjena en el Caribe colombiano, el objetivo de la investigación fue evaluar la viabilidad in vitro del polen de berenjena (Solanum melongena L.).
MATERIALES Y MÉTODOS
El estudio se adelantó en el laboratorio de Genética y Fitomejoramiento de la Facultad de Ciencias Agrícolas y Centro de Investigación Piscícola (CIMPIC) de la Universidad de Córdoba en Montería, Colombia, en el período de abril a mayo de 2011. Fueron colectadas flores en pre-antesis de un lote comercial de la variedad "Lila criolla", las cuales presentaron coloración Lila (Araméndiz et al., 2008b). La colecta se realizó en horas de la mañana entre las 07:00 a las 08:00 horas; las muestras se empacaron en bolsas de papel para luego, en las dos primera horas de apertura floral (con la ayuda de un vibrador eléctrico), extraer los granos de polen siguiendo las indicaciones de Araméndiz et al. (2008a).
Para determinar la viabilidad del polen en condiciones in vitro se utilizó el medio de cultivo propuesto por Reddy y Kakani (2007), constituido por 100 g de sacarosa (C12H22O11), 500 mg de nitrato de calcio [Ca (NO3)2. 4H2O], 120 mg de sulfato de magnesio (MgSO4), 100 mg de nitrato de potasio (KNO3) y 120 mg de ácido bórico (H3BO3) disueltos en 1.000 mL de agua destilada. Posteriormente, se le agregaron 10 g de agar y el pH fue ajustado a 6,0. Esta técnica permite observar el desarrollo del tubo polínico después de cierto tiempo, lo que constituye una ventaja respecto a la tinción, que no admite distinguir entre granos de polen coloreados y no coloreados por el tamaño de los mismos o por la dificultad de colocarlos en el papel filtro (França et al., 2009).
El medio de cultivo (28 mL) fue vertido en cajas Petri de vidrio, de aproximadamente 9,0 cm de diámetro; los granos de polen fueron rehidratados durante dos horas en cámara húmeda a temperatura ambiente, para la restauración de los lípidos en las membranas celulares (Peñaloza, 2001; Franca et al., 2010), antes de su dispersión en el medio de cultivo con la ayuda de un pincel y facilitar así la germinación. El periodo de incubación fue de 8 horas a temperatura de 25 °C, humedad relativa del 66% y bajo luz; las lecturas se realizaron cada 2 horas de acuerdo con la metodología de Guler et al. (1995).
Los conteos fueron visuales tomando cinco campos ópticos de cada repetición, siguiendo el sentido de las manecillas del reloj. Un grano de polen se consideró germinado cuando el tubo polínico registró una longitud mayor o igual al diámetro del grano de polen, siguiendo las indicaciones de Singh y Shono (2003), França et al. (2009) y Suárez et al. (2010). Las variables de respuesta fueron: longitud del tubo polínico (mm), diámetro del grano de polen (mm) y porcentaje de granos de polen germinados, el cual fue obtenido por el cociente del número de granos de polen germinados en cada campo óptico con relación al total de granos de polen en el mismo, sobre la base de 50 granos tomados al azar por repetición, de acuerdo a Sorkheh et al. (2011). Para las observaciones, conteo y fotografía de los granos de polen germinados, se utilizó un estereoscopio óptico Carl Zeiss® (Stani 2000-C) con aumento de 4x, acoplado a una cámara fotográfica (Canon® Power Shot G10) con visualización en un monitor Philips; las mediciones se realizaron utilizando el Software analizador de imagen Carl Zeiss®, AxioVision 4.3.
El diseño experimental aplicado fue completamente al azar con cuatro tratamientos, correspondientes al tiempo de incubación (2, 4, 6 y 8 h) y cinco repeticiones. La estructura del diseño de tratamientos fue de gradiente, por lo que las estimaciones se hicieron mediante análisis de regresión. Como complemento se llevó a cabo la prueba de Tukey al 5%. Se analizaron los datos con el paquete estadístico SAS (2004).
RESULTADOS Y DISCUSIÓN
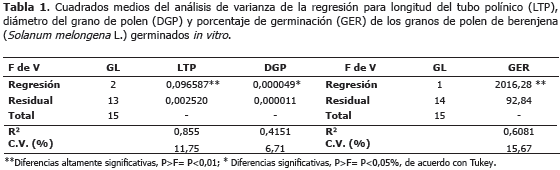
Los análisis de regresión de las variables longitud del tubo polínico (LTP), porcentaje de germinación (GER) y diámetro del grano de polen (DGP), se encuentran consignados en la Tabla 1. Se observa que la regresión resultó altamente significativa para LTP y GER, y significativa para la DGP, lo que indica que la variación observada depende del tiempo en el cual se realiza la lectura, además de los factores ambientales como temperatura y humedad relativa, no considerados como variables explicativas en el análisis de regresión realizado, que marcan una notable influencia en la viabilidad polínica (Pagliarini et al., 2000; Taschetto et al., 2003; Karapanos et al., 2010; Pozzobon et al., 2011).
Los coeficientes de variación reportados en el análisis de varianza de la regresión de cada variable de respuesta, son semejantes a los mencionados por Usman et al. (1999) en ají, e inferiores a los encontrados por González et al. (2002) en papa, lo que denota confiabilidad en los resultados y poca influencia de factores externos sobre los tratamientos.
Para la longitud del tubo polínico, la ecuación estimada resultó ser:
LTP = -0,0754+0,1893(TIEMPO) - 0.01478(TIEMPO)2.
Según esta ecuación, la longitud del tubo polínico aumenta en 0,1893 mm, con efecto lineal, y disminuye en 0,0148 mm, con efecto cuadrático, por cada hora de incubación en el medio de cultivo.
Entre tanto, la ecuación estimada para el diámetro del grano de polen:
DGP = -0,06137 - 0,00532(TIEMPO) + 0,00046(TIEMPO)2, permite afirmar que el aumento es de 0,00046 mm, con efecto cuadrático, y la disminución es 0,00532 mm, con efecto lineal, por cada hora transcurrida de incubación en el medio de cultivo.
Para el porcentaje de germinación de los granos de polen, el modelo estimado: GER = 46,674 + 0,4942(TIEMPO)2 , indica que el aumento de germinación es de 0,4942% con efecto cuadrático, por cada hora de incubación.
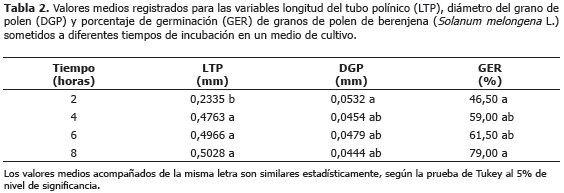
Los valores medios de longitud, diámetro y porcentaje de germinación del tubo polínico, están registrados en la Tabla 2. Se puede observar que después de cuatro horas de incubación de los granos de polen, la LTP y DGP alcanzan valores que permiten su llegada rápida al estigma, para alcanzar la ovocélula y producirse la fecundación, lo cual es coincidente con lo establecido en algodón y tomate por Burke et al., 2004 y Karapanos et al. (2010), respectivamente, quienes resaltan que tal evento se explica por el incremento de la tasa de respiración. De igual manera, el porcentaje de germinación acusó incremento progresivo, más no constante, entre dos y ocho horas. Después de este tiempo, se compromete el proceso de fecundación, ya que el grano de polen no encuentra las condiciones ambientales ideales para cumplir su objetivo en la reproducción sexual y en la formación de semillas y frutos de buen tamaño y calidad, como lo resaltan algunos autores (Pagliarini et al., 2000; Taschetto et al., 2003 y Pozzobon et al., 2011).
El porcentaje de germinación del polen osciló entre 46% y 79%, siendo superior al informado por Franca et al. (2009) en berenjena, quienes después de cuatro horas de incubación no encontraron germinación de granos de polen. También es superior al 66% hallado después de 24 horas en el mismo estudio, lo que puede obedecer al tipo de cultivar y condiciones ambientales de reducida actividad respiratoria y consecuente baja producción de CO2, como lo indican Hoekstra y Bruinsma (1975). Esta última condición puede incidir en la capacidad de germinar en un estigma receptivo y compatible para la producción de semilla (Barbosa et al., 1991; Dafni y Firmage, 2000). En este sentido, Thomson et al. (1994) resaltaron que la pérdida de viabilidad es una variable continua en razón a la actividad de muchas enzimas que degradan gradualmente la capacidad de germinación, de tal manera que un valor del 50% puede ser considerado como el límite inferior de viabilidad de acuerdo a Kumar et al. (1995) y Scorza y Sherman (1995).
La Porta y Roselli (1991) opinan que la germinación in vitro da un valor próximo a lo que ocurre en la realidad, al evaluar el porcentaje de germinación y el crecimiento del tubo polínico en cereza. En tanto que Karapanos et al. (2010) afirman que existe una alta correlación entre el porcentaje de germinación y la longitud del tubo polínico, debido a la actividad respiratoria después de dos horas de incubación en un rango de 15 °C a 35 °C.
La germinación del polen in vitro se inició a las dos horas con incrementó notable a través del tiempo, logrando su mayor porcentaje a las ocho horas de incubación. Esto permite asegurar que el medio de cultivo es confiable y admite una evaluación certera de la viabilidad del polen ya que se tienen granos con una longitud de tubo polínico mayor o igual a su diámetro y por esto se consideran granos de polen germinados (Karapanos et al., 2006). Aun cuando los granos de polen comenzaron a germinar a la segunda hora de ser puestos en el medio de cultivo y alcanzaron su máximo porcentaje de germinación, 79%, a las ocho horas, el resultado no concuerda con el de Franca et al. (2009), quienes no encontraron germinación después de cuatro horas de incubación con el mismo medio de cultivo. Posiblemente este hecho obedezca al genotipo utilizado y a la calidad y cantidad de reservas de nutrientes del polen, propiciadas por las condiciones ambientales donde se produjo el material genético utilizado en el experimento. Por lo tanto, el cultivar "lila criolla" por su adaptación a las condiciones ambientales del valle del Sinú, posee un buen potencial como parental masculino en programas de hibridación artificial, dado que el porcentaje de germinación y rápido crecimiento del tubo polínico en 8 horas así lo indican, pudiendo llegar éste al saco embrionario y con los dos núcleos espermáticos realizar la doble fecundación y posterior formación de frutos y semillas.
Por todo lo anteriormente señalado, la germinación in vitro es un método fiable y no destructivo para determinar el porcentaje de germinación y el crecimiento del tubo polínico, como lo señalan Scorza and Sherman (1995); circunstancia que debería ser corroborada con estudios complementarios como son: el corte de flores en distintos estadios de desarrollo de la germinación y el número de granos de polen germinados analizados en un microscopio con la técnica de fluorescencia.
CONCLUSIONES
El porcentaje de germinación de los granos de polen registró un aumento cuadrático de 0,4942% por cada hora de incubación, lo cual garantiza su calidad para el uso en la hibridación artificial.
El polen colectado en botones florales en pre-antesis entre las 07:00 y las 08:00 horas y almacenado por 8 horas, puede ser usado sin reducción significativa de la viabilidad para la producción de semilla híbrida a través de la hibridación artificial.
BIBLIOGRAFÍA
Agronet, 2011. Portal para la toma de decisiones. Estadísticas. Área y Producción Agrícola y Pecuaria. Ministerio de Agricultura y Desarrollo Rural, http://www.agronet.gov.co.; consulta septiembre 2011. [ Links ]
Araméndiz, T.H., A.C. Cardona, A. Jarma y C.M. Espitia. 2008a. El cultivo de la Berenjena (Solanum melongena L.). Primera edición. Editorial Produmedios, Bogotá. 152 p. [ Links ]
Araméndiz, T.H., A.C. Cardona y D. Pérez. 2008b. Hibridación artificial en berenjena (Solanum melongena L.): efecto sobre la producción de frutos y semillas. Revista UDCA 11(2): 121-130. [ Links ]
Barbosa, W., F. Campo, M. Ojima, F. Picarelli e Y. Sellito. 1991. Conservação e germinação do pólen, polinização e frutificação efetiva em pessegueiros e nectaríferas subtropicais. Bragantia 50(1): 17-28. [ Links ]
Burke, J.J., J. Velten and M. Oliver. 2004. In vitro analysis of cotton pollen germination. Agronomy Journal 96(2): 359-368. [ Links ]
Craufurd, P.Q., P.V. Prasad, V.G. Kakani, T.R. Wheeler and S.N. Nigam. 2003. Heat tolerance in groundnut. Field Crops Research 80(1): 63-77. [ Links ]
Dafni, A. and D. Firmage. 2000. Pollen viability and longevity: practical, ecological and evolutionary implications. Plant Systematics and Evolution 222(1-4): 113-132. [ Links ]
França, L.V., W. Nascimento, R. Carmona e R. Freitas. 2009. Viability of eggplant pollen. Crop Breeding and Applied Biotechnology 9(4): 320-327. [ Links ]
França, L.V., W. Nascimento, R. Carmona e R. Freitas. 2010. Tolerância à dessecação de pólen de berinjela. Revista Brasileira de Sementes. 32 (1): 53-59. [ Links ]
Filgueira, F.A.R. 2000. Novo manual de olericultura. Agrotecnologia moderna na produção e comercialização de hortaliças. Terceira edição. UFV, Viçosa. 402 p. [ Links ]
González, M., A. Estévez, J. Castillo, J. Salomón, O. Moré y M. Hernández. 2002. La Calidad del polen: requisito indispensable del mejoramiento tradicional de la papa en Cuba. Revista Latinoamericana de la Papa 13(1): 75-94. [ Links ]
Guler, H.Y., K. Abak and S. Eti. 1995. Method, medium and incubation time suitable for in vitro germination of eggplant (S. melongena) pollen. Acta Horticulture 412: 99-105. [ Links ]
Heslop, J., Y. Heslop and K.R. Shivanna. 1984. The evaluation of pollen quality and a further appraisal of the flourochromatic (FCR) tests procedure. Theoretical and Applied Genetics 67(4): 367-375. [ Links ]
Hoekstra, F.A. and J. Bruinsma. 1975. Respiration and vitality of binucleate and trinucleate pollen. Physiologia Plantarum 34(3): 221-225. [ Links ]
Kakani, V.G., K.R. Reddy, S. Koti, T.P. Wallace, P.V. Prasad, V.R. Reddy and D. Zhao. 2005. Differences in in vitro pollen germination and pollen tube growth of cotton cultivars in response to high temperature. Annals of Botany 96(1): 59-67. [ Links ]
Karapanos, I.C., K.A. Akoumianakis, C.M. Olympios and H. Passam. 2010. Tomato pollen respiration in relation to in vitro germination and pollen tube growth under favourable and stress-inducing temperatures. Sex Plant Reproduction 23(3):219-224. [ Links ]
Karapanos, I.C., K. Akoumianakis, C.M. Olympios and H.C. Passam. 2006. The influence of gelling agent purity and ion additions on in vitro tomato pollen germinability and pollen tube growth on semi-solid substrates. Plant Cell, Tissue and Organ Culture 87 (2): 181-190. [ Links ]
Kumar, A., R.K. Chowdhury and O.S. Dahiya. 1995. Pollen viability and stigma receptivity in relation to meteorological parameters in pearl millet. Seed Science and Technology 23(1): 147-156. [ Links ]
Koyuncu, F., H. Yilmaz and M.A. Aşkin. 2000. An investigation on the pollen production capacities and germination rates of some strawberry cultivars. Turkish Journal of Agriculture and Forestry 24(6): 699-703. [ Links ]
La Porta, N. and G. Roselli. 1991. Relationship between pollen germination in vitro and fluorochromatic reaction in cherry clone F12/1 (Prunus avium L.) and some of its mutants. The Journal of Horticultural Science 66(2): 171-175. [ Links ]
Norton, J.D. 1966. Testing of plum pollen viability with tetrazolium salts. Proceedings American Society Horticultural Science 89: 132-134. [ Links ]
Martínez, P., T.M. Gradziel E. Ortega and F. Dicenta. 2000. Short-term storage of almond pollen. Hortscience 35(6): 1151-1152. [ Links ]
Parfitt, D.E. and S. Ganeshan. 1989. Comparison of procedures for estimating viability of Prunus pollen. Horticultural Science 24(2): 354-356. [ Links ]
Pozzobon, M.T., K.R. Souza, I.C. Carvalho e F.J. Reifschneider. 2011. Meiose e viabilidade polínica em linhagens avançadas de pimenta. Horticultura Brasileira 29(2): 212-216. [ Links ]
Prohens, J., J.E. Muñoz, A. Rodríguez y F. Nuez. 2005. Últimos avances en la mejora genética de la berenjena. Vida Rural 217: 52-56. [ Links ]
Pagliarini, M.S., P.M. Freitas and L. Batista. 2000. Chromosome stickiness in meiosis of a Brazilian Paspalum accession. Cytologia 65(3): 289-294. [ Links ]
Peñaloza, P. 2001. Semillas de hortalizas. Manual de producción. Universidad Católica de Valparaiso. Ediciones Universitarias de Valparaiso. 36 p. [ Links ]
Reddy, K.R. and V.G. Kakani. 2007. Screening capsicum species of different origins for high temperature tolerance by in vitro pollen germination and pollen tube length. Scientia Horticulturae 112(2): 130-135. [ Links ]
SAS. 2004. Statistical Analysis System. User's guide: Basics SAS System Institute Inc. Cary, N.C: USA. [ Links ]
Scorza, R. and W.B. Sherman. 1995. Peaches. pp. 325-440. In: Janik, J and J.N. Moore (eds.). Fruit breeding. John Wiley and Sons, New York. 477 p. [ Links ]
Sekara, A., S. Cebula and E. Kunicki. 2007. Cultivated eggplants-origin, breeding objectives and genetic resources. A review. Folia Horticulturae 19(1): 97-114. [ Links ]
Singh, I. and M. Shono. 2003. Effect of 24- epibrassinolide on pollen viability during heat- stress in tomato. Indian Journal of Experimental Biology 41(2): 174- 176. [ Links ]
Soares, T.; S. Oliveira, M.A. Carvalho, J. Santos-Serejo, A. Souza, L. Morais lino, E. Souza and O. Jesus, 2008. In vitro germination and viability of pollen grains of banana diploids. Crop Breeding and Applied Biotechnology 8 (2): 111-118. [ Links ]
Sorkheh, K., B. Shiran, V. Rouhi and M. Khodambashi. 2011. Influence of temperature on the in vitro pollen germination and pollen tube growth of various native Iranian almonds (Prunus L. spp.) species. Trees 25(5): 809-822. [ Links ]
Suárez, L., Y. Castilla, M. Hernández, J. Salomón, A. Estévez, O. Céspedes y B. Araujo. 2010. Efecto del PECTIMORF® en la germinación in vitro del polen de papa (Solanum tuberosum). Temas de Ciencia y Tecnología 14(40): 43-46. [ Links ]
Taschetto, O.M., J.C. Pintro and M.M. Pagliarini. 2003. Chromosome stickiness during microsporogenesis in Pfaffia glomerata and P. tuberosa (Amaranthaceae). The Nucleus 46(3): 128-137. [ Links ]
Thomson, J.D., L.P. Rigney, K.M. Karoly and B.A. Thomson. 1994. Pollen viability, vigor, and competitive ability in Erythronium grandiflorum (Liliaceae). American Journal of Botany 81(10): 1257-1266. [ Links ]
Usman, I.S., A.S. Mamat, H. Mohd, H. Aishah and A. Anuar. 1999. The non-impairment of pollination and fertilization in the abscission of chilli (Capsicum annuum L. var. Kulai) flowers under high temperature and humid conditions. Scientia Horticulturae 79(1-2): 1-11. [ Links ]
Vieira, L., W.M. Nascimento, R. Carmona and R. Alves de Freitos. 2009. Viability of eggplant pollen. Crop Breeding and Applied Biotechnology 9(4): 320-327. [ Links ]
Voyiatsiz, D.G. and P. Paraskevopoulou. 2002. Factors affecting the quality and in vitro germination capacity of strawberry pollen. Horticultural Science and Biotechnology 77(2): 200-203. [ Links ]
Vizintin, L. and B. Bohanec. 2004. In vitro manipulation of cucumber (Cucumis sativus L.) pollen and microspores: isolation procedures, viability tests, germination, maturation. Acta Biologica Cracoviensia, Series Botánica 46: 177-183. [ Links ]
Weller, S., C. Domínguez, F. Molina, J. Fornoni and G. Lebuhn. 2007. The evolution of distyly from tristyly in populations of Oxalis alpina (Oxalidaceae) in the sky islands of the Sonoran desert. American Journal of Botany 94(6): 972-985. [ Links ]
Young, L.W., R.W. Wilen and P.C. Bonham. 2004. High temperature stress of Brassica napus during flowering reduces micro and megagametophyte fertility, induces fruit abortion, and disrupts seed production. Journal of Experimental Botany 55 (396): 485-495. [ Links ]
Zechmann, B., B. Koffler and S. Russell. 2011. Glutathione synthesis is essential for pollen germination in vitro. BMC Plant Biology 11(54): 1-11. [ Links ]