Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.66 no.1 Medellín Jan./June 2013
Estabilidad Fisicoquímica y Funcional de Uchuva (Physalis peruviana L.) Impregnada a Vacío con Calcio y Vitaminas B9, D y E, Durante el Almacenamiento Refrigerado
Phisicochemical and Functional Stability of Cape Gooseberry (Physalis peruviana L.) Vacuum Impregnated with Calcium and Vitamin B9, D and E, During Refrigerated Storage
Ruth Fabiola Peña Correa1; Misael Cortés Rodríguez2 y Jesús Humberto Gil González3
1 Química de Alimentos, Magister en Ciencia y Tecnología de Alimentos. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias Agrarias - Departamento de Ingeniería Agrícola y Alimentos. A.A. 1779, Medellín, Colombia. <rfpenac@unal.edu.co>
2 Profesor Asociado. Universidad Nacional de Colombia -Sede Medellín -Facultad de Ciencias Agrarias -Departamento de Ingeniería Agrícola y Alimentos. A.A. 1779, Medellín, Colombia. <mcortesro@unal.edu.co>
3 Profesor Asociado. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias Agrarias - Departamento de Ingeniería Agrícola y Alimentos. A.A. 1779, Medellín, Colombia. <jhgilg@unal.edu.co>
Recibido: Enero 19 de 2011; aceptado: Febrero 06 de 2012.
Resumen
Debido a la creciente demanda de alimentos saludables, la industria alimentaria está mejorando el valor nutritivo de estos, modificando su composición nutricional. Las frutas tropicales son ampliamente aceptadas por los consumidores y a la vez representan una alternativa ideal para la obtención de alimentos funcionales a través de la incorporación de vitaminas y minerales. El objetivo de este estudio fue evaluar, en el transcurso del tiempo, variaciones en las propiedades fisicoquímicas, el contenido de vitaminas (C, B9, D y E) y calcio, y la capacidad antioxidante (Folin, DPPH• y ABTS•+), de un producto de uchuva mínimamente procesado, fortificado por la técnica de impregnación a vacío (IV). Los resultados indican que una porción de 200 g de uchuva fortificada aporta el 81,6%; 72,3%; 38,9% y 50,2% de los valores diarios de referencia (VDR) respectivos de las vitaminas B9, C, D y E, y el 15,4% de los de calcio. Durante el almacenamiento se encontró disminución de la concentración de las vitaminas B9 y E. Un comportamiento similar al de la vitamina E se presentó en la capacidad antioxidante (CA) medida en la fracción liposoluble. La incorporación de componentes fisiológicamente activos en el interior de la estructura de las uchuvas mediante la técnica de IV, le confieren a la fruta mejores propiedades antioxidantes y funcionales respecto a las uchuvas frescas.
Palabras clave: Alimentos nutracéuticos, componentes fisiológicamente activos, capacidad antioxidante, propiedades fisicoquímicas.
Abstract
Due to the increasing demand of healthy foods, the food industry is improving the nutritional value of these by changing their nutritional composition. Tropical fruits are widely accepted by consumers and are an ideal alternative for obtaining functional foods through the addition of vitamins and minerals. The aim of this study was to evaluate, over time, variations in the physicochemical properties, vitamins (C, B9, D and E) and calcium, and the antioxidant capacity (Folin, DPPH• and ABTS•+), in a cape gooseberry minimally processed product, fortified by the technique of vacuum impregnation (VI). The results indicate that 200 g of fortified cape gooseberry contributes with the 81.6%; 72.3%; 38.9% and 50.2% of the reference daily values (RDV) for vitamins B9, C, D and E, and 15% of calcium. During storage was found decreased concentration of vitamins B9 and E. A similar behavior of vitamin E was found in the antioxidant capacity (CA) measured in the liposoluble fraction. The incorporation of physiologically active components within the structure of cape gooseberry by the technique of IV, give to the fruit the best antioxidant and functional properties with respect to the fresh cape gooseberry.
Key words: Nutraceutical foods, physiologically active components, antioxidant capacity, physicochemical properties.
La uchuva (Physalis peruviana L.) es una fruta típica de los Andes Suramericanos, que se caracteriza por ser un fruto azucarado con un alto contenido compuestos bioactivos como ácido ascórbico (Vitamina C), β-caroteno (provitamina A) y fenoles, entre otros, capaces de atrapar radicales libres mejorando la defensa antioxidante del organismo. El sinergismo de estos compuestos proporciona un efecto antirradicalario mayor que el obtenido en forma individual (Encina et al., 2007). Fawzy (2011) encontró que 100 g de porción comestible de uchuva aportan alrededor de 20 mg de ácido ascórbico y 0,2 mg de provitamina A, lo que corresponde al 65 y el 26% de los valores diarios de referencia (VDR) respectivamente, para una porción de 200 g, según la normatividad colombiana (Ministerio de la Protección Social, 2011); también es fuente de minerales como calcio (2% VDR/200 g), hierro y fósforo (Puente et al., 2011). Esta fruta, hasta hace poco tiempo desconocida en los mercados internos y externos, durante la última década es una de las frutas más importante en términos de exportaciones para Colombia en la categoría de promisorios y diferentes de las tradicionales (CCI, 2006).
Las perspectivas de comercialización de la uchuva ecotipo Colombia, tanto fresca como procesada, obligan a los productores a mejorar las condiciones de manejo poscosecha, de tal forma que le confieran a la fruta una mayor vida útil sin demeritar sus propiedades fisicoquímicas y nutricionales. Uno de los limitantes que se presentan en su almacenamiento son los cambios relacionados con el proceso de maduración, siendo >más notorios en la uchuva sin capacho (Lanchero et al., 2007). Esta fruta se ha clasificado como una fruta intermedia entre comportamiento climatérico y no climatérico ya que con el máximo de intensidad respiratoria, las mejores características sensoriales y la mejor relación de madurez (sólidos solubles/acidez titulable) no coinciden entre sí (Galvis et al., 2005); por lo tanto, los cambios fisicoquímicos que se aprecian pueden atribuirse al estrés de la separación del fruto de la planta o a los tratamientos usados en la poscosecha (Rodríguez, 2003).
La impregnación a vacío (IV) es una técnica que se ha utilizado en la obtención de productos mínimamente procesados con características funcionales, introduciendo componentes fisiológicamente activos (CFA) en la estructura porosa de diferentes frutas, con cinéticas de transferencia de masa rápidas, tiempos cortos y una mínima alteración del sabor y el aroma del producto fresco, cambiando su composición y por lo tanto sus propiedades funcionales (Fito y Chiralt, 2000). Los alimentos funcionales han surgido tras la preocupación de los gobiernos en general por la salud de la población, la conciencia de los consumidores sobre la importancia de las frutas en la dieta y las evidencias científicas que apoyan los efectos positivos de los CFA. Estos productos alimentarios, con una apariencia similar a la de un alimento convencional, se consumen como parte de una dieta normal y >además de su función nutritiva básica, presentan propiedades fisiológicas beneficiosas y reducen el riesgo de contraer enfermedades crónicas (Cortés et al., 2005; Prada et al., 2006).
Las vitaminas son compuestos orgánicos que los seres vivos necesitan para el adecuado funcionamiento de sus células. La mayoría de ellas no se sintetizan en el organismo humano, lo que hace necesario ingerirlas a través de los alimentos. Las vitaminas C y E son nutrientes frecuentemente utilizados en la industria de alimentos por su poder antioxidante, el cual se da por transferencia de hidrógenos reductores. Algunos estudios han demostrado que los radicales libres presentes en el organismo humano causan daño oxidativo en diferentes moléculas tales como lípidos, proteínas y ácidos nucléicos, y estos están involucrados en la fase de iniciación de algunas enfermedades degenerativas (Soto y Raventós, 2008). Los antioxidantes pueden ser producidos por el mismo cuerpo humano (glutationa, coenzima Q-10, etc.), pero debido a factores externos como la contaminación ambiental, la luz ultravioleta, la radiación solar y el consumo de cigarrillo y alcohol, entre otros, cada vez se hace más necesaria la ingesta de éstos (Tymoschouk, 2004), preferiblemente del mismo alimento para aprovechar su sinergismo: la biodisponibilidad de la vitamina A aumenta en presencia de la vitamina E, y esta última es regenerada por un donador de hidrógenos como la vitamina C. La vitamina B9 o ácido fólico, se ha destacado por su importante participación en la síntesis de ADN, ARN y el metabolismo de algunos aminoácidos, previniendo defectos del tubo neural del feto, lo que la hace indispensable en la dieta de las madres gestantes; también se han encontrado efectos positivos en la prevención de cáncer del seno y en el control del envejecimiento cerebral (Kruman et al., 2002). La Vitamina D es una prohormona que se encuentra en la sangre en dos formas químicas distintas: la vitamina D2 (ergocalciferol), de origen vegetal, y la vitamina D3 (colecalciferol), sintetizada en la piel u obtenida en la dieta alimenticia (Fennema, 2000). La función más importante de la forma activa de la vitamina D, la hormona 1,25(OH)2D3, es estimular la absorción, fijación y eliminación de calcio, gracias a los receptores específicos que tiene en el intestino, huesos y riñones (Holick, 2006), lo que resulta vital en el crecimiento y desarrollo normal de los huesos y dientes, junto con una adecuada ingesta de calcio, importante en la infancia y la adolescencia para el desarrollo de un buen pico de masa ósea. Se requieren en la adolescencia, el embarazo y la menopausia cerca de 1,5 g de calcio al día para mineralizar el esqueleto (NIH Osteoporosis and Related Bone Diseases, 2009).
El objetivo fue evaluar las propiedades fisicoquímicas, la concentración de los CFA y la capacidad antioxidante (CA) de uchuva mínimamente procesada y fortificada con calcio y vitaminas B9, D y E por la técnica de IV, durante el almacenamiento a 4 °C.
Materiales y Métodos
Material vegetal. Se utilizaron uchuvas frescas (UF) (Physalis peruviana L.) ecotipo Colombia (La Unión, Antioquia) enteras, de entre 6 y 8 g de peso sin cáliz, un diámetro entre los 20 y 25 mm, y un grado de madurez entre 4 y 6, según la escala de la Norma Técnica Colombiana NTC 4580 (ICONTEC, 1999a), desinfectadas por inmersión en solución de cloro de 50 ppm.
Emulsión de impregnación (EI). Se utilizaron como CFA: ácido ascórbico, colecalciferol (vitamina D3), DLα-tocoferol acetato, ácido fólico (vitamina B9), cloruro de calcio y fumarato de calcio con un contenido del 8,35% p/p; además, sacarosa, Tween 80, Span 60, sorbato de potasio, pectina de bajo metoxilo, proteína aislada de soya y agua potable (91,65%). La EI se homogenizó en un Ultraturrax (UTL 50 INLINE, Janke & Kunkel IKA® Labortechnik) a 10.000 rpm durante 10 min. Las cantidades de CFA en la formulación se obtuvieron a partir del balance de materia fruta-E (Peña, 2010), previo cálculo de la fracción másica de impregnación con una solución isotónica al fruto (X=0,035 ± 0,007%) y según la metodología descrita por Fito et al. (1996) y Salvatori et al. (1998), donde se tuvo como criterio de fortificación el 20% de los VDR de calcio y vitaminas D y B9, y el 50% para vitamina E, en una porción de 200 g.
Impregnación al vacío y almacenamiento. El proceso de IV fue realizado a 20 °C, en una cámara de vacío en acero inoxidable a una presión de vacío de 31,4 mm Hg durante 5 min, seguido de 5 min a presión barométrica local (640 mm Hg). Las UF y las uchuvas impregnadas (UI) se empacaron en recipientes termoformados de polietilen teraftalato con 8 perforaciones circulares, 4 en la tapa y 4 en el fondo, cada una con un diámetro de 5 mm. La masa de producto en cada empaque fue de aproximadamente 200 g y se almacenaron a 4 °C durante 21 días en ausencia de luz.
Propiedades fisicoquímicas. Se determinaron los sólidos solubles (°Brix) en refractómetro manual (Leica® Auto ABBE) a 20 °C (AOAC 932.12/1980); la acidez titulable expresado como ácido cítrico (%) (AOAC 942.15A/1965); el índice de maduración, a partir de la relación °Brix/acidez (%); el pH (AOAC 981.12/1980); la actividad de agua (aw) utilizando un higrómetro de punto de rocío a 25 °C (Aqualab serie 3TE, Decagon®) (AOAC 978.19Bc) y la humedad por secado a 105 °C durante 6 h (AOAC 7.003/84).
Extracción y cuantificación de CFA. Inicialmente se preparó una muestra de 100 g homogenizada en un Ultra Turrax® T25 a 10.000 rpm durante 5 min. La extracción de vitamina C se realizó modificando la metodología de Gutiérrez et al. (2007); a 7 g del homogenizado se adicionaron 20 mL de agua tipo III, la mezcla se sometió a agitación magnética durante 15 min a 900 rpm y filtración con una membrana de 0,45 µm, separando la fase acuosa (FA) y aforándola hasta un volumen 50 mL. La extracción de vitamina B9 se realizó con base en la metodología de Arcot y Shrestha (2005); a 7 g del homogenizado se adicionaron 20 mL de agua tipo III, la mezcla se hidrolizó (pH 12) con NaOH 2 M bajo agitación magnética por 20 min y posteriormente se neutralizó con buffer fosfato 1 M y filtró con una membrana de 0,45 µm, separando la fase acuosa (FA) y aforándola hasta un volumen de 50 mL. La extracción de vitaminas liposolubles D y E se hizo de acuerdo a la metodología de Cortés (2004), donde el solvente se rotaevaporó en el equipo Heidolph® Laborta 4001 a 40 °C.
La cuantificación de las vitaminas se llevó a cabo en un equipo de cromatografía líquida de alta resolución (Prominence 20A, Shimadzu®, Japón), provisto de una columna de fase reversa (Premier C18, 250 mm x 4,6 mm x 5 µm), detector UV/VIS con arreglo de diodos, a partir de curvas de calibración con estándares primarios Supelco DL-α- tocoferol acetato, colecalciferol, ácido ascórbico y ácido fólico. Se trabajó con temperaturas del horno de 35 °C, para las vitaminas C y B9, y a 45 °C, para las vitaminas D y E. Para la vitamina C se utilizó una fase móvil de buffer KH2PO4 (0,02 M, ajustado a pH = 3,0 con ácido ortofosfórico y se detectó a 244 nm. En la vitamina B9 se utilizó una fase móvil de Buffer KH2PO4 0,05 M/acetonitrilo (90/10) y se detectó a 283 nm. Las vitaminas D y E se detectaron a 264 y 285 nm, respectivamente, con una fase móvil metanol/acetonitrilo (75/25). En todas las vitaminas se trabajó a un flujo de 1 mL/min. La extracción y cuantificación de calcio se realizó bajo el protocolo de la NTC 4807 (ICONTEC, 2000), utilizando un espectrofotómetro de absorción atómica (AAnalyst 100, Perkin Elmer®, Waltham, USA) y titrisol estándar de calcio Merck®.
Capacidad antioxidante (CA). Con el fin de apreciar diferencias en la CA, por efecto de la incorporación de vitamina E, se obtuvo un extracto oleoso (EO), evitando el sinergismo que esta tiene con componentes hidrosolubles de características reductoras (Abudu et al., 2004). A 7 g del homogenizado de uchuva se les adicionó 10 mL de agua tipo III y n-hexano (2x10 mL) y se llevó a agitación magnética a 900 rpm durante 30 min. Se congeló la fracción acuosa a -18 °C y se separó la fracción liposoluble. El solvente de ésta última se removió por rotoevaporación (Heidolph® Laborta) a 40 °C y el EO obtenido se redisolvió en 1 mL de metanol. La CA se determinó por tres métodos: 1) Folin-Ciocalteau, modificado de Waterman y Mole (1994), sobre el EO y la FA obtenida para cuantificación de vitamina C; para ello se mezclaron 200 µL de extracto, 250 µL de reactivo de Folin-agua tipo III en relación 1:1 y 1.250 µL de Na2CO3 al 20%. Se construyó la recta de calibración con ácido gálico (Y = 0,08904356 X - 0,056412; R2=0,99812) a concentraciones de 0,00 - 0,10 mg/mL a 725 nm (espectrofotómetro Thermo Sientific®, Evolution 60), sobre la cual se hizo lectura de las mezclas de reacción después de 2 h de incubación, expresando el contenido de fenoles como equivalentes de ácido gálico (EqAG). 2) El método DPPH•, modificado de Brand et al. (1995), se aplicó en la FA. 3) El método ABTS•+, modificado de Re et al. (1999) en el EO. Para los métodos DPPH• y ABTS•+ se tomaron 20 µL de extracto con 1.980 µL de los reactivos. Se construyeron las rectas de calibración con el antioxidante sintético Trolox de referencia (Y=0,87646X - 0,03173, R2= 0,99943 para DPPH•; y Y=0,6456X - 0,04429; R2= 0,99961 para ABTS•+, a concentraciones de 0 - 15 µM en etanol, a longitudes de onda de 517 nm en DPPH• y 732 nm en ABTS•+. Las lecturas de las muestras se hicieron después de 7 y 30 min de incubación. Se calculó el porcentaje de inhibición como [(Ao-Ae)/Ao] x 100, donde Ao es la absorbancia sin extracto y Ae es la absorbancia con extracto.
Características nutricionales. Se analizaron las proteínas, por el método Kjeldahl descrito en la NTC 4657 (ICONTEC, 1999b); cenizas, por el método oficial 942.05 de la AOAC; grasa bruta, mediante extracción Soxhlet del extracto etéreo con inmersión basado en la NTC 668 (ICONTEC, 1979).
Diseño experimental y análisis de datos. Se utilizaron diseños factoriales completamente aleatorizados, donde los factores evaluados fueron tratamiento (T) y tiempo (D), donde las variables de respuesta se valoraron en un número de lotes (L) y repeticiones (R), siendo el total de muestras para las propiedades fisicoquímicas (TxDxLxR) de (2x8x3x5), la concentración de CFA y CA (2x9x3x3), y las propiedades nutricionales (2x1x3x1). Los datos fueron analizados a partir de análisis de varianza ANAVA, aplicando el método LSD (mínimas diferencias significativas) como método de comparaciones múltiples, con un nivel de significancia del 95% (α=0,05) y una potencia del 80%, en el paquete estadístico Statgraphics Centurion XV.
Resultados y discusión
Análisis fisicoquímico. La Figura 1 presenta los valores medios con intervalos LSD (95%) de °Brix, % acidez, índice de maduración, pH, aw y % humedad de las UF y las UI durante el almacenamiento. Los resultados muestran que no hubo diferencias significativas (P>0,05) en las propiedades con respecto al factor IV. Sin embargo, por efecto del factor tiempo, hubo diferencias significativas (P<0,05) en el % acidez, donde los días 18 y 21 forman un grupo homogéneo con valores inferiores a los días anteriores, esto como consecuencia del metabolismo de ácidos en los procesos de maduración y senescencia normales (Míguez, 2001). En efecto, el índice de maduración del día 21 de las UF fue significativamente diferente de los demás. El % humedad también presentó diferencias significativas (P<0,05) con respecto al factor tiempo, donde se presentaron 3 grupos homogéneos en las UF (días 0 - 12, 3 - 15 y 18 - 21), y 4 en las UI (días 0 - 12, 3 - 15, 15 - 18 y 18 - 21); este comportamiento se atribuye a la diferencia del potencial químico del agua entre el fruto de aw en el rango de 0,980 - 0, 984 y el ambiente (4 °C, 75% HR), que provoca la transferencia de masa desde el fruto hacia el ambiente. Las UI presentan una menor transferencia de masa en el tiempo que las UF, esto probablemente por el efecto gelificante de la pectina de bajo metoxilo y el calcio presentes en la emulsión de impregnación (Capel, 2006).
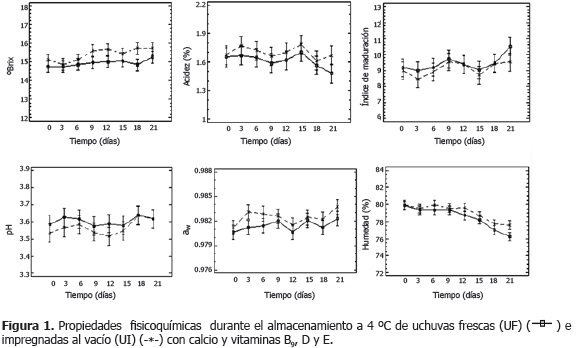
En las UI los valores medios de °Brix, aw, acidez (%) y humedad (%), fueron mayores que los de las UF, atribuible al contenido de humedad y al comportamiento asociado con las propiedades fisicoquímicas de la EI, la cual aporta un contenido de sólidos solubles correspondientes a 18 °Brix, provenientes de azúcares, sales y ácidos orgánicos. Botero (2008) y Restrepo (2008), también encontraron incremento de los °Brix después de impregnar uchuvas con soluciones de glucosa y sacarosa, respectivamente. Otros autores han reportado valores semejantes de acidez, pH y °Brix en uchuvas recién cosechadas (Botero, 2008; Herrera, 2000; Lanchero et al., 2007; Novoa et al., 2006; Restrepo, 2008); y de acuerdo a la NTC 4580 (ICONTEC, 1999a), UF y las UI tienen características fisicoquímicas propias del estado de maduración 6.
Cuantificación de CFA. La Figura 2 presenta los valores medios con intervalos LSD (95%) de los contenidos de CFA presentes en 200 g de producto, En las UF, el contenido de vitamina C fue 39,6 ± 3,8 durante el almacenamiento. Los contenidos de CFA presentes en 200 g de producto, durante el almacenamiento. Los contenidos de calcio y vitaminas B9, D, E presentan diferencias significativas (P<0,05) entre las UI y UF, debido a que el proceso IV incorpora estos CFA con la EI. La vitamina C no presentó diferencias significativas (P>0,05) por efecto de los factores proceso IV y tiempo; debido a que su composición en la EI es baja, utilizándose solo para ajustar su pH (Peña, 2010).
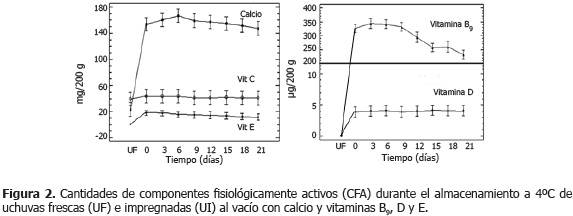
En las UF, el contenido de vitamina C fue 39,6 ± 3,8 mg/200 g, encontrándose dentro del rango reportado por Encina et al. (2007); el calcio fue 23,2 ± 3,7 mg /200 g, similar a lo mencionado por Repo y Encina (2008) en uchuvas peruanas, mientras que Flórez et al., (2000) y Andes Export Company S.A. (2006) registraron valores entre 7 y 9 mg Ca+2/100 g y Leterme et al. (2006) valores de 23 mg Ca+2/100 g; las vitaminas B9, D y E en las UF no fueron detectadas en las UF. Las UI alcanzaron niveles de calcio y vitaminas B9, C, D y E /200 g de 153,6 ± 21,3 mg; 326,4 ± 42,0 µg; 43,4 ± 2,5 mg; 3,9 ± 1,3 µg y 15,1 ± 1,6 mg, respectivamente.
Los contenidos de vitaminas B9 y E presentaron diferencias significativas (P<0,05) por efecto del factor tiempo; mientras que no hubo diferencias significativas para el calcio y la vitamina C. La vitamina B9 presentó tres grupos homogéneos (días 0 a 12, 12 a 15 y 15 a 21), su disminución durante el almacenamiento en las condiciones ácidas de la uchuva, se atribuyen a que el enlace amídico puede sufrir escisión a pH bajo (Arcot y Shrestha, 2005); además en condiciones oxido-reductoras (ácido ascórbico) y en medio ácido pueden haber cambios en el anillo de pteridina. La vitamina E presentó dos grupos homogéneos (días 0 a 15 y 9 a 21), donde los cambios observados fueron muy pequeños; debido a que la vitamina E sintética es muy estable a la temperatura de refrigeración y a la protección a la luz y a la oxidación que ofrece la matriz como medio de encapsulamiento del CFA (Restrepo, 2008); ahora bien, estos cambios pueden ser asociados a diferencias en los niveles de impregnación de las diferentes muestras que llevan a concentraciones iniciales diferentes en cada una de ellas (Cortés, 2004).
La Figura 3 presenta los valores medios con intervalos LSD (95%) de las cantidades de los CFA en términos de %VDR, durante el almacenamiento. Se observa que el contenido original de calcio y vitamina C en la UF aporta 2,32 ± 0,37 y 65,86 ± 6,59% VDR/200 g, respectivamente; mientras que las UI recién impregnadas alcanzan niveles de calcio y vitaminas B9, C, D y E de 15,4 ± 2,13; 81,6 ± 10,5; 72,3 ± 4,2; 38,9 ± 12,5 y 50,24 ± 5,21% VDR/200 g, respectivamente.
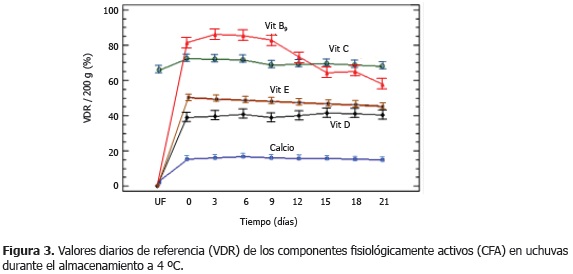
De acuerdo al criterio de fortificación, solamente la vitamina E alcanzó aproximadamente el valor teórico esperado (50% VDR), mientras que el calcio fue menor del 20% VDR y las vitaminas B9 y D mayores del 20% VDR; esta situación se atribuye a la complejidad microestructural de la matriz de uchuva, debido a las características impermeables de la epidermis, a la alta relación de áreas de epidermis y pedúnculo (aproximadamente 95/5) y a una distribución porosa muy irregular en el área del pedúnculo, que permite el ingreso del líquido de impregnación al interior de la estructura, donde no existe una relación directa ni del área ni la cantidad de líquido impregnado con el peso o tamaño de la uchuva (Peña, 2010). Por otro lado, puede estar influyendo la adhesión de CFA en la superficie de la epidermis del fruto, la cual para efectos de los cálculos teóricos, se consideró despreciable por sus características impermeables. Al final del almacenamiento (21 días), las UI alcanzaron niveles de calcio y vitaminas B9, C, D y E de 14,8 ± 3,2; 58,0 ± 3,9; 67,9 ± 1,7; 40,4 ± 6,8 y 45,6 ±2,3% VDR/200 g, respectivamente; lo cual permite identificar a este producto con el descriptor de "Excelente fuente de vitaminas B9, C, D y E" y "Buena fuente de calcio", en el marco de la normativa colombiana.
Capacidad antioxidante. La Figura 4 presenta los valores medios con intervalos LSD (95%) de la capacidad antioxidante de las UI durante el almacenamiento. Los resultados muestran diferencias significativas (P<0,05) en los métodos aplicados al EO (ABTS•+ y Folin) por efecto del proceso IV, lo que indica que la presencia de la vitamina E incrementa la actividad antiradicalaria. Las UI presentaron diferencias significativas (P<0,05) en los mismos métodos por efecto del factor tiempo, donde se observan 2 grupos homogéneos para ABTS•+ (días 0 -18 y 9 - 21), y tres grupos en Folin-EO (días 0 - 6, 9-18 y 18-21); ambos comportamientos se asemejan al comportamiento en el contenido de vitamina E en las UI en el tiempo (Figura 2). La CA medida en la FA (DPPH• y Folin) no mostraron diferencias estadísticas (P<0,05), ni por efecto del proceso IV, ni por el almacenamiento, comportamiento semejante al observado en el contenido de vitamina C en el tiempo (Figura 2). El contenido de EqAG en la FA fue significativamente superior que en el EO, lo cual se correlaciona con la cantidad de vitamina C, potente agente reductor, proveniente en su mayoría, en forma natural. La disminución de la actividad antioxidante (ABTS•+) durante el almacenamiento puede ser debida a fenómenos de oxidación de los fenoles por acción de enzimas como la polifenoloxidasa.
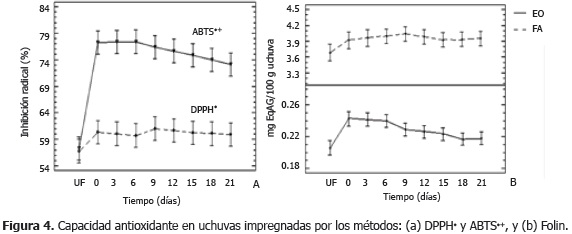
Los equivalentes Trolox de las muestras analizadas por al método DPPH• en las UF fueron de 0,039 ±0,002 µmol equivalentes Trolox/g y en las UI entre 0,039 a 0,045 µmol equivalentes Trolox/g. Por el método ABTS•+ se obtuvieron valores de 0,0010 ± 0,0001 µmol equivalentes Trolox/g en UF, el cual tuvo diferencias significativas (P<0,05) con respecto a las UI en todos los días de almacenamiento, oscilando sus valores entre 0,0014 a 0,0018 µmol equivalentes Trolox/g.
Resultados significativamente superiores han sido señalados por otros autores a partir de un único extracto que reúne componentes con actividad antioxidante de diferentes polaridades, presentándose un efecto sinérgico entre compuestos lipofílicos e hidrofílicos, lo que potencializa la actividad antiradicalaria (Encina et al., 2007). Repo y Encina (2008) encontraron en uchuvas peruanas valores de 2,9 y 4,2 µmol equivalentes Trolox/g en los métodos DPPH• y ABTS•+, respectivamente, y 154 mg EqAG/100 g uchuva, sobre un único extracto metanólico de la muestra homogénea. Vasco et al. (2008) reportaron valores de 0,7 y <5 µmol equivalentes Trolox/g por los métodos DPPH• y ABTS•+, respectivamente, y 87 mg EqAG/100 g de fruta, en extractos obtenidos con mezcla de solventes metanol:agua y acetona:agua. En extractos etanólicos de uchuvas fortificadas con vitaminas C y E, Botero (2008) encontró valores de CA de ≅ 2,42 µmol equivalentes Trolox/g por el método DPPH• y ≅ 48 mg EqAG/100 g de fruta. Restrepo (2008) estableció por los mismos métodos, en un extracto metanólico al 1% en HCl de uchuvas fortificadas con Vitamina E, aproximadamente 2,0 µmol equivalentes Trolox/g por el método DPPH• y aproximadamente 50 mg EqAG/100 g. Estas diferencias se atribuyen principalmente al método de extracción, a la variabilidad genética y a los factores climáticos y agro culturales de las frutas.
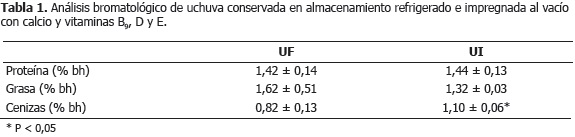
Características nutricionales. La Tabla 1 muestra los valores medios más la desviación estándar de la caracterización bromatológica para UF, UI. Las cenizas presentaron diferencias significativas (P<0,05) por efecto del proceso de IV, esto como consecuencia de la fortificación con calcio. El contenido de proteína y grasa no presentó diferencias estadísticas significativas (P>0,05), debido a que la composición de la proteína de soya y vitaminas oleosas en la EI son bajas, al igual que los niveles de impregnación. Resultados semejantes en cenizas y proteínas de UF colombianas han sido reportados por otros autores (CCI, 2006; Castro et al., 2008). Encina et al. (2007) determinaron un valor de 0% en grasa para uchuvas peruanas.
Conclusiones
El proceso de IV permitió obtener un producto mínimamente procesado de uchuva, de mayor actividad antiradicalaria y funcional, sin cambios significativos en sus propiedades fisicoquímicas, nutricionales y antioxidantes en 21 días de almacenamiento a 4 °C. El balance de materia fruta - emulsión, estuvo coherente con los contenidos obtenidos para vitamina E, más no con los otros CFA, presentándose valores inferiores a los esperados para el calcio y superiores para las vitaminas B9 y D. Esto, identifica la uchuva como una matriz compleja para la aplicación del proceso IV, donde los niveles de impregnación dependen de diversos factores: área y porosidad de la epidermis, área y porosidad del pedúnculo, composición del fruto, composición y reología de la EI, condiciones de proceso IV, entre otros. En el marco de la normativa colombiana, la uchuva impregnada con los CFA en estudio, permite ser identificada en el rotulado con el descriptor de "Excelente fuente de vitaminas B9, C, D y E" (aporte >20% VDR/200 g) y "Buena fuente de calcio" (aporte entre el 10 - 19% VDR/200 g), lo •e para generar valor agregado en esta fruta identificado como promisorio de exportación.
Bibliografía
Abudu, N., J. Miller, M. Attaelmannan and S. Levinson. 2004. Vitamins in human arteriosclerosis with emphasis on vitamin C and vitamin E. Clinica Chimica Acta 339(12): 11 -25. [ Links ]
Andes Export Company S.A. 2006. Uchuva. Colombia. En: http://www.andesexport.com/spanish/News/Uchuva.html; consulta: diciembre 2009. [ Links ]
AOAC, Association of Official Analytical Chemist; Official methods of analysis, USA. 2000. [ Links ]
Arcot, J. and A. Shrestha. 2005. Folate: methods of analysis. Trends in Food Science and Technology 16(6-7): 253-266. [ Links ]
Botero, A. 2008. Aplicación de la ingeniería de matrices en el desarrollo de uchuva (Physalis peruviana L.) mínimamente procesada fortificada con calcio y vitaminas C y E. Tesis de Maestría en Ciencias Farmacéuticas. Facultad de Química Farmacéutica y Alimentos. Universidad de Antioquia. Medellín. 185 p. [ Links ]
Brand, W., M. Cuvelier and C. Berset. 1995. Use of a free radical method to evaluate antioxidant activity. LWT - Food Science and Technology 28(1): 25-30. [ Links ]
Capel, F., T. Nicolai, D. Durand, P. Boulenguer and V. Langendorff. 2006. Calcium and acid induced gelation of (amidated) low methoxyl pectin. Food Hydrocolloids 20:901-907. [ Links ]
Castro, A., L. Rodríguez y E. Vargas. 2008. Secado de uchuva (Physalis peruviana L.) por aire caliente con pretratamiento de osmodeshidratación. VITAE 15(2): 226-231. [ Links ]
CCI. 2006. Monitoreo internacional: uchuva fresca. Corporación Colombia Internacional, 13:12. En: http://www.agronet.gov.co/www/docs_agronet/200662012611_UCHUVA.pdf. 5 p.; consulta: octubre 2010. [ Links ]
Cortés, M. 2004. Desarrollo de productos de manzana deshidratados enriquecidos con vitamina E. Tesis Doctoral en Ingeniería de Alimentos. Universidad Politécnica de Valencia. Valencia, España. 254 p. [ Links ]
Cortés, M., A. Chiralt y L. Puente. 2005. Alimentos funcionales: una historia con mucho presente y futuro. Vitae 12(1): 5-14. [ Links ]
Encina, C., M. Ureña y P. Repo. 2007. Determinación de compuestos bioactivos del aguaymanto (Physalis peruviana, Linnaeus, 1753) y de su conserva en almíbar maximizando la retención de ácido ascórbico. ECIPERU 4(1):6-10. [ Links ]
Fennema, O. 2000. Química de los Alimentos. Acribia Editorial S.A., Zaragoza, España. 1.258 p. [ Links ]
Fito, P., A. Andrés, A. Chiralt and P. Pardo. 1996. Coupling of hydrodynamic mechanism and deformation-relaxation phenomena during vacuum treatments in solid porous food-liquid systems. Journal of Food Engineering 27(3): 229-240. [ Links ]
Fito, P. and A. Chiralt. 2000. Vacuum Impregnation of Plant Tissues. pp. 293-305. In: Alzamora, S.M., M.S. Tapia and A. López-Malo (eds.). Design of minimal processing technologies for fruits and vegetables. Aspen Publishers, Maryland. 376 p. [ Links ]
Florez, V., G. Fischer y A. Sora. 2000. Producción, poscosecha y exportación de la uchuva. Trabajo de grado. Facultad de Agronomía. Universidad Nacional de Colombia, Bogotá. 175 p. [ Links ]
Galvis, J., G. Fischer y O. Gordillo. 2005. Cosecha y poscosecha de la uchuva. pp. 165-188. En: Fischer, G., D. Miranda, W. Piedrahita y J. Romero (eds.). Avances en cultivo, poscosecha y exportación de la uchuva (Physalis peruviana L.) en Colombia. Unibiblos, Bogotá. 221 p. [ Links ]
Gutiérrez, T., O. Hoyos y M. Páez. 2007. Determinación del contenido de ácido ascórbico en uchuva (Physalis peruviana L.), por cromatografía líquida de alta resolución (CLAR). Revista Biotecnología en el Sector Agropecuario y Agroindustrial 5(1): 70-79. [ Links ]
Herrera, A. 2000. Manejo poscosecha. En: Flórez, V.J., G. Fischer y A.D. Sora (eds.). Producción, poscosecha y exportación de la uchuva (Physalis peruviana L.). FNFH, Produmedios, Bogotá. 175 p. [ Links ]
Holick, M. 2006. Resurrection of vitamin D deficiency and rickets. Journal of Clinical Investigation 116(8):2062-2072. [ Links ]
ICONTEC - Instituto Colombiano de Normas Técnicas y Certificación. 1979. NTC 668. Alimentos y materias primas. Determinación de los contenidos de grasa y fibra cruda. 5 p. [ Links ]
ICONTEC - Instituto Colombiano de Normas Técnicas y Certificación. 1999a. NTC 4580. Frutas frescas: Uchuva. Especificaciones. 15 p. [ Links ]
ICONTEC - Instituto Colombiano de Normas Técnicas y Certificación. 1999b. NTC 4657. Alimento para animales. Determinación del contenido de nitrógeno y cálculo del contenido de proteína cruda. Método Kjeldahl. 11 p. [ Links ]
ICONTEC - Instituto Colombiano de Normas Técnicas y Certificación. 2000. NTC 4807. Productos de frutas y verduras. Determinación del contenido de cobre. Método espectrométrico de absorción atómica de llama. 8 p. [ Links ]
Kruman, I., I. Kumaravel, A. Lohani, W. Pedersen, W. Cutler, Y. Kruman, N. Haughey, J. Lee and M. Evans. 2002. Folic acid deficiency and homocysteine impair DNA repair hippocampal neurons and sensitize them to amyloid toxicity in experimental models of Alzheimer disease. Journal of Neuroscience 22(5): 1752-1762. [ Links ]
Lanchero, O., G. Velandia, G. Fischer, N. Varela y H. García, 2007. Comportamiento de la uchuva (Physalis peruviana L.) en poscosecha bajo condiciones de atmósfera modificada activa. Revista Corpoica - Ciencia y Tecnología Agropecuaria 8(1): 61-68. [ Links ]
Leterme, P., A. Buldgen, F. Estrada and A. Londoño. 2006. Mineral content of tropical fruits and unconventional foods of the Andes and the rain forest of Colombia. Food Chemistry 95(4): 644-652. [ Links ]
Míguez, J. 2001. Bioquímica de postcosecha y postsacrificio. Edimpresos,Tunja, Boyacá [ Links ].
Ministerio de la Protección Social. 2011. Resolución 333 de 2011. Por la cual se establece el reglamento técnico sobre requisitos de rotulado o etiquetado nutricional que deben cumplir los alimentos envasados para consumo humano. Colombia. 56 p. [ Links ]
Fawzy, M. 2011. Bioactive phytochemicals, nutritional value, and functional properties of cape gooseberry (Physalis peruviana L.): An overview. Food Research International 44(7): 1830-1836. [ Links ]
National Institutes of Health Osteoporosis and Related Bone Diseases (NIH) 2009. Calcium supplements: what to look for. USA. 3 p. [ Links ]
Novoa, R., M. Bojaca and J. Galvis. 2006. Fruit maturity and calyx drying influence post-harvest behavior of cape gooseberry (Physalis peruviana L.) stored at 12 °C. Agronomía Colombiana 24(1): 77-86. [ Links ]
Prada, G., E. Gamboa y M. Jaime. 2006. Representaciones sociales sobre alimentación saludable en población vulnerable. Salud UIS 38(3): 181-188. [ Links ]
Peña, R.F. 2010. Desarrollo de uchuva (Physalis peruviana L.) mínimamente procesada adicionada con calcio y vitaminas B9, D y E. Tesis de Maestría en Ciencia y Tecnología de Alimentos -Facultad de Ciencias Agrarias - Universidad Nacional de Colombia. Medellín. 103 p. [ Links ]
Puente, L., C. Pinto, E. Castro and M. Cortés. 2011. Physalis peruviana Linnaeus, the multiple properties of a highly functional fruit: A review. Food Research International 44(7): 1733-1740. [ Links ]
Re, R., N. Pellegrini, A. Proteggente, A. Pannala, M. Yang and C. Rice. 1999. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine 26(9-10): 1231- 1237. [ Links ]
Repo, R. y C. Encina. 2008. Determinación de la capacidad antioxidante y compuestos bioactivos de frutas nativas peruanas. Revista de la Sociedad Química del Perú 74(2): 108-124. [ Links ]
Restrepo, A. 2008. Nuevas perspectivas de consumo de frutas: uchuva (Physalis peruviana L.) mínimamente procesadas fortificadas con vitamina E. Tesis de Maestría en Ciencia y Tecnología de Alimentos - Facultad de Ciencias Agrarias -Universidad Nacional de Colombia, Medellín. 123 p. [ Links ]
Rodríguez, M. 2003. Estudio de la conservación de la uchuva (Physalis peruviana L.) utilizando los métodos de atmósfera modificada, refrigeración y encerado. Departamento de Química. Universidad Nacional de Colombia, Bogotá. 123 p. [ Links ]
Salvatori, D., S.A. Andre, A. Chiralt and P. Fito. 1998. Characterisation of some properties of fruits related to vacuum impregnation. Journal of Food Process Engineering 21:59-73. [ Links ]
Soto, M. y H. Raventós. 2008. Papel del estrés oxidativo en la esquizofrenia. Acta Médica Costarricense 50(3): 197-202. [ Links ]
Tymoschouk, A. 2004. Mercado y tecnologias de extraccion de antioxidantes. En: Nuevas fuentes de antioxidantes naturales. Instituto de Desarrollo y Diseño INGAR, Avellaneda, República Argentina. pp. 31-44. [ Links ]
Vasco, C., J. Ruales and A. Kamal-Eldin. 2008. Total phenolic compounds and antioxidant capacities of major fruits from Ecuador. Food Chemistry 111(4): 816-823. [ Links ]
Waterman, P. and S. Mole 1994. Analysis of Phenolic Plant Metabolites. Blackwell Science Ltd., Camdbridge. 248 p. [ Links ]













