Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.66 no.1 Medellín Jan./June 2013
Cambios en la Actividad Antioxidante Durante el Desarrollo de Frutos de Psidium cattleianum Sabine (Myrtaceae)
Changes in the Antioxidant Activity During the Development in Fruits of Psidium cattleianum Sabine (Myrtaceae)
Verónica Villacorta Lozano1; Luis Fernando Osorio Vélez2 y Benjamín Alberto Rojano3
1 Ingeniera Técnica Agrícola Especialidad Industrias Agrarias y Alimentarias. Universidad Nacional de Colombia -Sede Medellín - Facultad de Ciencias Agrarias - Departamento de Ingeniería Agrícola y Alimentos. Calle 59A No. 63-20, Medellín, Colombia. <vvillacortal@unal.edu.co>
2 Profesor Asociado. Universidad Nacional de Colombia -Sede Medellín -Facultad de Ciencias Agrarias -Departamento de Ciencias Forestales. Calle 59A No. 63-20, Medellín, Colombia. <lfosoriv@unal.edu.co>
3 Profesor Asociado. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias - Escuela de Química. Calle 59A No. 63-20, Medellín, Colombia. <brojano@unal.edu.co>
Recibido: Octubre 11 de 2012; aceptado: Diciembre 2 de 2012.
Resumen
Psidium cattleianum Sabine, conocida como cas dulce, guayaba japonesa, guayaba peruana y guayaba fresa, es un árbol originario de América del Sur. Estudios preliminares en esta especie han sugerido una elevada actividad antioxidante, un alto contenido fenólico y un gran potencial nutricional y funcional. En esta investigación se analizó la evolución de varios componentes del sistema de defensa antioxidante no enzimático, durante el crecimiento y maduración de los frutos de Psidium cattleianum Sabine. El periodo de crecimiento de los frutos presentó la actividad antioxidante más elevada, medida a través de las técnicas TEAC-DPPH y TEAC-ABTS (Trolox equivalent antioxidant capacity), FRAP (Ferric reducing/antioxidant power) y ORAC (Oxigen Radical Absorbance Capacity), así como el contenido máximo de fenoles totales, entre los que destacaron los ácidos clorogénico, cafeico y p-coumárico, y de sustancias no polifenólicas como el ácido ascórbico. Durante el periodo de maduración, se observó una disminución de la actividad antioxidante, posiblemente promovida por la pérdida gradual de algunos compuestos polifenólicos, así como también, debido a la aparición de otros compuestos como las antocianinas. Los resultados mostraron que estos frutos contienen un alto contenido de sustancias con actividad antioxidante, lo cual soporta el desarrollo de esta especie como nueva alternativa productiva.
Palabras clave: Polifenoles, ácido ascórbico, maduración, alternativa productiva.
Abstract
Psidium cattleianum Sabine, known as cas sweet, japanese guava, peruvian guava and strawberry guava, is a tree native to South America. Preliminary studies in this species have suggested a high antioxidant activity, a high phenolic content and great nutritional and functional potential. In this study, the evolution of some components of the non-enzimatic antioxidant defense system was analized during growth and ripening of fruit of Psidium cattleianum Sabine. The growing period of the fruits presented the highest antioxidant activity, measured by techniques DPPH, ABTS, FRAP and ORAC, and the maximum content of total phenols, among which found chlorogenic, caffeic and p-coumaric acids, and non-polyphenolic substances such as ascorbic acid. During the ripeness period, a decrease in antioxidant activity was observed, possibly promoted by the gradual loss of some polyphenolic compounds as well as the appearance of other compounds such as anthocyanins. The results showed that these fruits contained a high content of substances with antioxidant activity, which supported the development of this species as new productive alternative.
Key words: Polyphenols, ascorbic acid, ripening, productive alternative.
Las especies reactivas del oxígeno (ERO), tales como el radical superóxido, el peróxido de hidrógeno y el radical hidroxilo, son generadas inevitablemente como consecuencia del metabolismo normal (Mondal et al., 2004, 2009). En las células vegetales, la producción de ERO está centrada fundamentalmente en el proceso de respiración celular y metabolismo peroxisomal (Mondal et al., 2009; Matamoros et al., 2010), así como en la fijación de nitrógeno y en la fotosíntesis (Matamoros et al., 2010). Con el objetivo de evitar la sobreacumulación de estas especies, los organismos poseen mecanismos de defensa antioxidantes, los cuales incluyen enzimas como la superóxido dismutasa, catalasa, peroxidasa, ascorbato peroxidasa y glutatión peroxidasa, entre otras, componentes solubles en agua como la vitamina C, compuestos polifenólicos y glutatión, y componentes solubles en lípidos como los carotenoides, la vitamina E y los tocoferoles (Prior y Cao, 2000; Mondal et al., 2004, 2009; Shen et al., 2008; Krishnaiah et al., 2011; Oliveira et al., 2011).
En la vida del fruto pueden distinguirse cuatro fases: cuajado, crecimiento activo, maduración y senescencia (Coleto, 1994). El período de crecimiento de los frutos, se corresponde con una elevada tasa de respiración celular (Coleto, 1994), y una actividad fotosintética mayor (Gil - Albert, 1995); es decir, con dos de los procesos fundamentales generadores de ROS, principalmente radical superóxido y peróxido de hidrógeno (Mondal et al., 2009; Matamoros et al., 2010), y en consecuencia determinantes de la actividad antioxidante, tanto enzimática como no enzimática (Abassi et al., 1998; Mondal et al., 2009; Matamoros et al., 2010).
La maduración es un proceso que, desde el punto de vista metabólico, conlleva una diferenciación de tejidos, síntesis específica de enzimas y modificaciones físico-químicas que se reflejan en un cambio de las propiedades y atributos de calidad (Hernández y Sastre, 1999); este proceso culmina en la madurez del fruto, que puede ser de tres tipos: madurez comercial o de recolección, madurez de consumo o gustativa y madurez fisiológica (Coleto, 1994). Asimismo, durante esta etapa, probablemente con el fin de facilitar los cambios metabólicos asociados a este proceso, es necesario, generalmente, la disminución de la actividad del sistema de defensa antioxidante, a través de la pérdida parcial tanto de la actividad enzimática como del contenido de sustancias no enzimáticas, conllevando al incremento del estrés oxidativo generado por la acumulación de ERO, tales como el radical superóxido y el peróxido de hidrógeno (Abassi et al., 1998; Mondal et al., 2004; Kulkarni y Aradhya, 2005; Huang et al., 2007).
No obstante, a pesar de los efectos deletéreos de las ERO, determinadas concentraciones de las mismas cumplen un importante papel en procesos como el reconocimiento de patógenos, desarrollo vegetal, regulación de la fotosíntesis y síntesis de la pared celular (formación de lignina) (Iturbe, 1996; Shen et al., 2008; Matamoros et al., 2010).
Psidium cattleianum Sabine pertenece a la familia Myrtaceae, y es conocida vulgarmente con los nombres de cas dulce, guayaba japonesa, guayaba peruana y guayaba fresa; es originaria de América del Sur, concretamente de Uruguay y de las zonas templadas de Brasil, aunque posteriormente se propagó por América Central y del Norte, Asia, África y Europa. Los frutos de esta especie son bayas redondas, de color rojizo y con una pulpa blanquecina, aromática y de sabor entre dulce y agridulce (Janick y Paull, 2008). Es un fruto potencialmente comercial, altamente perecedero y con un patrón respiratorio típicamente climatérico. Se ha encontrado para esta especie una elevada actividad antioxidante, un alto contenido fenólico y un gran potencial nutricional y funcional, propiedades que se han relacionado con el efecto protector de los extractos sobre células eucarióticas, usando la levadura Saccharomyces cereviasiae, con el efecto antimicrobiano frente a la bacteria patógena Salmonella enteritidis y con el efecto antiproliferativo sobre las células humanas cancerígenas MCF - 7 y Caco - 2 (Coelho de Souza et al., 2004; Silva et al., 2007; Lisboa et al., 2011).
De tal manera que el objetivo de la investigación fue determinar el potencial antioxidante, durante el crecimiento y maduración de frutos de Psidium cattleianum, con la intención de promover su desarrollo como nueva alternativa productiva a través de la asignación de valores de existencia, opción y utilización, así como a la promoción de su preservación y potenciar la agro-industria colombiana.
Materiales y Métodos
Reactivos y equipos. El radical DPPH (2,2-difenil1-picrilhidracilo), ABTS (diamonio 2,2'-azino-bis (3-etilbenzo-thiazolina-6-sulfonato) y los compuestos Trolox (6-hidroxi-2, 5, 7, 8- tetrametil croman-2-ácido carboxílico), TPTZ (2, 4, 6[tri[2-piridil-s-triazina))), ácido gálico (ácido 3,4,5 - trihidroxi benzoico), reactivo de Folin Ciocalteu, carbonato de sodio, ácido L- ascórbico, metanol, ácido fórmico, cloruro de hierro, buffers (pH: 1,0; 3,6; 4,5; 7,4), fluoresceína y AAPH (2,2'-azobis (2-amidino propano) diclorhidrato) fueron obtenidos de Merck® (Alemania). El agua usada en los experimentos fue de tipo supra-pura. Se utilizó un espectrofotómetro UV-vis (Jenway® 6405), un espectrofluorímetro (Perkin Elmer® Precisely LS 55) y un equipo de cromatografía de alta resolución (Shimadzu®).
Frutos. El material de trabajo se obtuvo de una población de P. cattleianum establecida en el Centro de Investigación La Selva de Corpoica, situado en la vereda Llanogrande - Rionegro, Antioquia, Colombia. Dentro del sistema de clasificación ecológica de las zonas de vida (Holdridge, 1967), corresponde al bosque húmedo montano bajo (bh-MB), situado a 2.120 msnm, con una temperatura promedio de 17 °C, humedad relativa promedio del 78% y coordenadas de ubicación 06° 08' 06'' latitud Norte y 75° 25' 03'' longitud Oeste. Los frutos fueron seleccionados en función del color de su epidermis, realizándose en total seis recolecciones, correspondientes a seis estados de desarrollo, constituidas por cuatro repeticiones. El estado de desarrollo identificado como 0, hizo referencia a frutos caracterizados por una epidermis de color verde oscuro, perteneciente al periodo de crecimiento. El estado de desarrollo 1, hizo referencia a frutos de color verde claro, en madurez de recolección o en estado verde maduro. Los estados de desarrollo 2, 3, 4 y 5, hicieron referencia a frutos caracterizados por menos de un 20%, 50%, 90% y por un 100% de superficie rojiza, respectivamente. Los cuatro estados conformaron el periodo de maduración organoléptica, el cual se inició a partir del estado 1 y finalizó en el estado 5, correspondiente a madurez de consumo.
Preparación de extractos. 5 g de cada una de las 24 muestras fueron homogeneizados en un ultraturrax (Janke and Kunkel®), usando como solvente de extracción de agua desionizada (50 mL). Cada homogeneizado fue filtrado al vacío, usando papel filtro Whatman No. 4. Las soluciones de trabajo fueron almacenadas en viales rotulados a temperatura de refrigeración de 4 °C.
TEAC-DPPH. Se determinó mediante el método de Brand-Williams (1995), con modificaciones de Rojano et al. (2008). Se valoró la decoloración del radical 2,2'-difenil-1-picrilhidracilo, ocasionada por un proceso de reducción promovido por el extracto antioxidante. Se construyó una curva patrón utilizando como estándar Trolox®. Posteriormente, se prepararon diluciones a partir de las soluciones de trabajo, de forma que 10 µL de cada dilución obtenida fueron mezclados con 990 µL de solución estandarizada de DPPH a 0,300 unidades, con el objetivo de obtener lecturas a 517 nm, después de permanecer por media hora en ausencia de luz, comprendidas en un intervalo determinado de la curva patrón. Los resultados se expresaron como µmol equivalentes de Trolox (TEAC) por cada 100 g de fruta fresca.
TEAC-ABTS+. Esta técnica fue aplicada con base en la metodología propuesta por Re et al., 1999, con modificaciones de Rojano et al., 2008. Se construyó una curva patrón utilizando como estándar Trolox®. Posteriormente, se prepararon diluciones a partir de las soluciones de trabajo, de forma que 10 µL de cada dilución obtenida fueron mezclados con 990 µL de solución estandarizada de ABTS a 0,700 unidades, con el objetivo de obtener lecturas a 734 nm, después de permanecer por media hora en ausencia de luz, comprendidas en un intervalo determinado de la curva patrón. Los resultados se expresaron como µmoles equivalentes de Trolox (TEAC) por cada 100 g de fruta fresca.
Poder reductor FRAP. El método FRAP, se basó en la capacidad de los extractos acuosos de transferir un electrón al complejo [Fe(III)(TPTZ)2]+3 para reducirlo al complejo [Fe(II)(TPTZ) 2]+2. De acuerdo con la metodología propuesta por Benzie y Strain, 1996, con modificaciones de Gaviria et al., 2009, se construyó una curva patrón utilizando como estándar el ácido ascórbico. Posteriormente, se prepararon diluciones a partir de las soluciones de trabajo, de forma que 50 µL de cada dilución obtenida fueron mezclados con 50 µL de buffer de pH 3,6 y 900 µL de solución de FRAP, constituida en una proporción determinada de TPTZ, FeCl3 y buffer de pH 3,6, con el objetivo de obtener lecturas a 590 nm, después de permanecer por media hora en ausencia de luz, comprendidas en un intervalo determinado de la curva patrón. Los resultados se expresaron como mg equivalentes de ácido ascórbico por cada 100 g de fruta fresca.
Actividad ORAC. Mediante la técnica ORAC se evaluó la inhibición de la reacción de oxidación en cadena inducida por los radicales peroxilo, generados por la descomposición térmica del AAPH. El mecanismo se fundamentó en reacciones de transferencia de átomos de hidrógeno, del antioxidante a los radicales peroxilo, los cuales reaccionaron con la fluoresceína formando productos cuantificables. Se utilizaron condiciones controladas de temperatura (37 °C) y pH (7,4). El efecto protector se calculó usando las diferencias de áreas bajo la curva de decaimiento de la fluoresceína entre el blanco y la muestra, se comparó con la curva de Trolox® y los resultados fueron expresados en µmoles equivalentes de Trolox por cada 100 g de fruta fresca, de acuerdo a la siguiente ecuación (1).
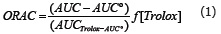
Donde AUC es el área bajo la curva de la muestra; AUC° es el área bajo la curva para el control; AUCTrolox es el área bajo la curva para el trolox y f el factor de dilución de los extractos (Romero et al., 2010).
Determinación de fenoles totales. La determinación del contenido de fenoles totales se realizó por el método colorimétrico Folin-Ciocalteu (Singleton y Rossi, 1965, modificado por Gaviria et al., 2009). Se construyó una curva patrón utilizando como estándar ácido gálico. Posteriormente, se prepararon diluciones a partir de las soluciones de trabajo, de forma que 50 µL de cada dilución fueron mezclados con 425 µL de agua supra- pura, 125 µL del reactivo Folin y 400 µL de carbonato de sodio, con el objetivo de obtener lecturas a 760 nm, después de permanecer por una hora en ausencia de luz, en un intervalo determinado de la curva patrón. Los resultados se expresaron como mg equivalentes de ácido gálico por cada 100 g de fruta fresca.
Determinación de antocianinas totales. Para la determinación de antocianinas totales, se utilizó el método diferencial de pH (Giusti y Wrolstad, 2000, modificado por Gaviria et al., 2007), de forma que a cada 100 µL de solución de trabajo sin diluir se le adicionaron 900 µL de buffer pH 1 y 900 µL de buffer pH 4,5, de manera independiente, procediendo a efectuarse las lecturas a 530 y 700 nm, después de permanecer por media hora en ausencia de luz, para ambos pH. Los resultados fueron expresados en mg equivalentes de cianidin-3-glucósido por cada 100 g de fruta fresca.
Perfil cromatográfico de ácidos fenólicos, antocianidinas y ácido ascórbico. Se determinaron mediante análisis por HPLC. El extracto acuoso se filtró (tamaño de poro 0,45 µm) y se hicieron diluciones en agua supra-pura, antes de la inyección al cromatógrafo, equipado con un auto inyector SIL20A /HT, un módulo de comunicación CBM-20A y un detector con arreglo de fotodiodos (PDA) SPD-M20A, calibrado a 280 nm. Se empleó una columna C-8 ultra acuosa (5 µm de tamaño de partícula, 250 x 4,6 mm). La razón de flujo de la fase móvil fue 1,0 mL/min, 25 °C y condiciones isocráticas. El espectro UV-visible fue recorrido de 200 a 600 nm para todos los picos. Para determinar el perfil de los ácidos fenólicos y las antocianidinas se empleó como fase móvil metanol acidulado con ácido fórmico al 0,1%; mientras que el acido ascórbico se eluyó con ácido fórmico al 0,1%. La identificación y cuantificación de los compuestos se realizó con curvas de calibración para cada uno de los ácidos fenólicos (Naranjo et al., 2011), las antocianidinas (Rojano et al., 2011; Rojano et al., 2012) y el ácido ascórbico (Shakya y Navarre, 2006).
Análisis estadístico. Con la información recolectada se caracterizó la dinámica de las variables en función del estado de desarrollo durante el periodo de medición, utilizando el programa estadístico Statgraphics Centurion XVI.
Se realizaron análisis de varianza (ANAVA) para cada variable en función de los estados de desarrollo, con un nivel de significancia del 5%. Las medias que tuvieron una letra en común no difirieron significativamente al 5%, acorde con la prueba de Fisher (LSD).
Resultados y discusión
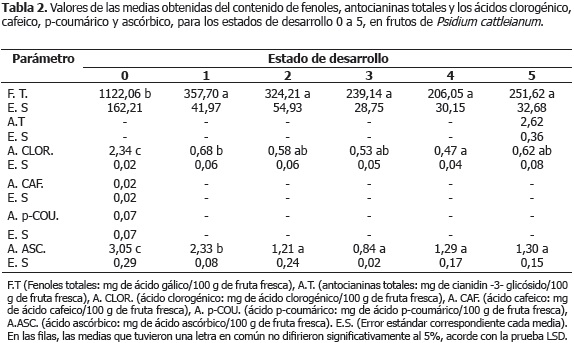
Las Tablas 1 y 2 muestran los resultados obtenidos de la actividad antioxidante (técnicas TEAC-DPPH, TEACABTS, FRAP y ORAC), así como el contenido de fenoles totales (ácido clorogénico, cafeico y p-coumárico), ácido ascórbico y antocianinas totales, evaluados en cada uno de los estados de desarrollo de frutos de P. cattleianum Sabine seleccionados.
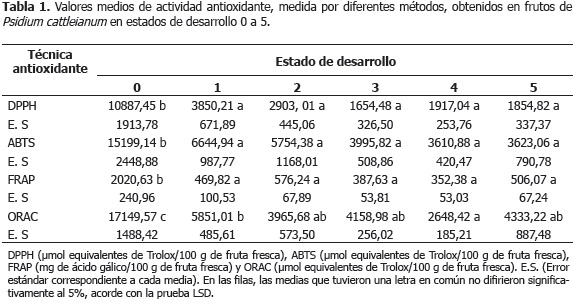
La etapa de crecimiento (estado de desarrollo 0), correspondiente a frutos con una epidermis verde oscura, presentó la actividad antioxidante más elevada, medida a través de todas las técnicas antioxidantes (Tabla 1), debido a la alta concentración de los compuestos polifenólicos (Tabla 2). Esta situación estuvo probablemente orientada a proteger a las células vegetales del daño oxidativo causado por la elevada producción de especies reactivas del oxígeno, derivadas de la elevada tasa de respiración celular y una mayor actividad fotosintética, características de este periodo (Coleto, 1994; Gil-Albert, 1995). Al respecto, frutos como los aguacates (Persea americana Mill.) cv. Hass, tienen el potencial de realizar actividad fotosintética, cuya contribución a los propios requerimientos de carbono, es mayor durante los primeros estados de desarrollo (Gandolfo, 2008). De igual manera, en arándanos azules (Vaccinium corymbosum L.) y rojos (Vaccinium vitisidaea L.) se han reportado durante las etapas iniciales de crecimiento, actividades antioxidantes muy elevadas, debidas a la alta concentración de ácidos hidroxicinámicos y de flavanoles, así como de procianidinas, respectivamente (Stoner y Seeram, 2011). En los estados verdes de Vaccinium vitisidaea L., se encontraron los mayores valores de ORAC, DPPH y contenido de fenoles totales (Stoner y Seeram, 2011). Asimismo, estudios realizados en extractos metanólicos de Myrtus communis L. (Fadda y Mulas, 2010) y en extractos acuosos de granada (Punica granatum Linn.) (Kulkarni y Aradhya, 2005), mostraron durante las etapas iniciales de crecimiento concentraciones máximas de fenoles totales, con valores de 4.896,6 (mg/100 g fruta fresca) y de 506 (mg/100 g fruta fresca), respectivamente, así como de ácido ascórbico, con un valor de 36 (mg/100 g fruta fresca) (Kulkarni y Aradhya, 2005), lo que se tradujo en una elevada actividad antioxidante medida por el método DPPH.
Entre el estado 0 y 1, correspondiente este último a frutos verdes maduros, se observó la disminución de la actividad antioxidante, medida a través de todas las técnicas (Tabla 1), contemporánea a la reducción del contenido de las sustancias antioxidantes mostradas en la Tabla 2. A partir del estado 1, comenzó el periodo de maduración organoléptica, el cual abarcó los estados 2, 3, 4 y 5, este último correspondiente a frutos en estado de madurez de consumo. Durante este periodo pudo observarse el decremento estadísticamente significativo de la actividad antioxidante medida por ORAC (Tabla 1), la pérdida gradual de los compuestos determinados con dicha actividad, ácido ascórbico y clorogénico (Tabla 2), el inicio de la acumulación de antocianinas en la epidermis de los frutos a partir del estado 2, detectables cuantitativamente en el estado 5 (Tabla 2) y una ligera disminución, aunque no estadísticamente significativa, del contenido de fenoles totales (Tabla 2), probablemente debida a la disminución de algunos reductores. Sin embargo, hubo una acumulación progresiva de las antocianinas totales (Tabla 2) y de la antocianidina malvidina (Tabla 3). Al respecto, durante las etapas que siguen a la fase inicial de crecimiento, y con el objetivo de facilitar muchos de los cambios metabólicos asociados a los procesos de maduración, se produce generalmente la disminución de los compuestos que integran el sistema de defensa antioxidante, tanto enzimático como no enzimático, y en consecuencia el aumento del estrés oxidativo generado por la acumulación de especies reactivas del oxígeno, tales como el radical superóxido y el peróxido de hidrógeno (Abassi et al., 1998; Mondal et al., 2004; Kulkarni y Aradhya, 2005; Huang et al., 2007). En tomate (Lycopersicon esculentum Mill. cv. Lichun) ha sido observado, durante los primeros estadios de maduración organoléptica, un fuerte incremento en la acumulación de peróxido de hidrógeno en las semillas, contemporáneo a los cambios más notables observados en la producción de etileno, respiración y composición antioxidante, sugiriendo la gran influencia de esta especie reactiva del oxígeno en la regulación de esta etapa (Shen et al., 2008). Asimismo, la reducción del contenido de fenoles totales, puede estar asociado a que estos compuestos son usados en la síntesis de la estructura química fundamental de las antocianidinas y antocianinas, el anillo flavilium, y que su pérdida está relacionada con la minimización de la actividad de las enzimas causantes del pardeamiento durante las etapas que preceden a la senescencia, en las cuales esta actividad no es deseada (Shen et al., 2008; Fadda y Mulas, 2010).
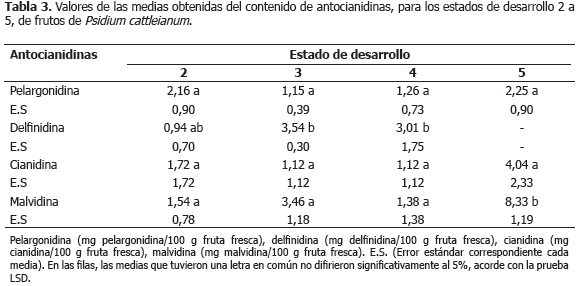
Huang et al., 2007 reportaron en naranja (Citrus sinensis L.), que la etapa de maduración organoléptica se caracterizó por la evolución decreciente de FRAP como consecuencia de la reducción del contenido de ascorbato y de los compuestos polifenólicos propios de este tipo de fruta. Otros autores han reportado, por el contrario, en granada (Punica granatum Linn.) y Rubus ideaus L. el aumento de DPPH, y de DPPH y ORAC, respectivamente, durante la etapa de maduración organoléptica, como consecuencia, posiblemente, de la formación de antocianinas (Kulkarni y Aradhya, 2005; Stoner y Seeram, 2011). En extractos acuosos de tres genotipos de P. cattleianum Sabine en estado de madurez de consumo, se determinó un contenido de antocianinas totales entre 4,82 y 6,29 mg/100 g fruta fresca, así como un contenido de fenoles totales entre 581,02 y 632,56 mg de ácido gálico/100 g de fruta fresca (Lisboa et al., 2011).
En cuanto al ácido ascórbico, se han observado en los estados maduros de Psidium cattleianum Sabine valores entre 0,12 y 0,45 mg de ácido ascórbico/100 g fruta fresca (Lisboa et al., 2011), y en extractos acuosos de granada (Punica granatum L.) en estado maduro, de aproximadamente 6 mg/100 g de fruta fresca (Kulkarni y Aradhya, 2005). En Rubus fruticosus y Vaccinium corymbosumse se obtuvieron unos contenidos del mismo compuesto en los estados maduros de 15,5 y 12,4 mg/100 g de fruta fresca, respectivamente (Szajdek y Borowska, 2008). En guayaba (Psidium guajava L.), se reportó que el contenido de ácido ascórbico mostró un comportamiento sigmoidal (Mondal et al., 2009), similar al de esta investigación, durante la maduración organoléptica.
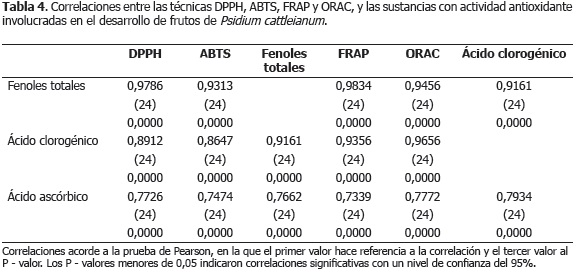
Finalmente, el contenido de fenoles totales y la actividad antioxidante evaluada por las diferentes metodologías presentó una elevada correlación (Tabla 4); por lo tanto, es posible inferir que en función de las características estructurales asociadas a la actividad antioxidante de los compuestos fenólicos; que éstos fueron posiblemente los principales responsables de la actividad antioxidante de los frutos de Psidium cattleianum Sabine.
Conclusiones
Los frutos de P. cattleianum Sabine que crecen bajo las condiciones del bosque húmedo montano bajo, de Colombia, tienen un alto contenido de sustancias con actividad antioxidante, lo que apoya el desarrollo de esta especie como nueva alternativa productiva; otorgando, por lo tanto, a la misma un valor de existencia, opción y utilización. El estudio de la evolución de la actividad antioxidante de los frutos a lo largo del periodo de desarrollo, permite describir asimismo el proceso de estrés oxidativo. Los elevados valores de actividad antioxidante y contenido de las sustancias involucradas, observados en los estados de madurez de cosecha y de consumo, posicionan a la guayaba fresa como una fruta con un alto potencial nutracéutico, que se puede cultivar extensivamente en las zonas alto andinas de Colombia.
Bibliografía
Abassi, N.A., M.M. Kushad and A.G. Endress. 1998. Active oxygen -scavenging enzymes activities in developing apple flowers and fruits. Scientia Horticulturae 74(3): 183-194. [ Links ]
Benzie, I.F. and J.J. Strain. 1996. The ferric reducing ability of plasma (FRAP) as a measure of "antioxidant power": the FRAP assay. Analytical Biochemistry 239(1): 70-76. [ Links ]
Coelho de Souza, G., A.P. Haasb, G.L. von Poserc, E.E. Schapovalc and E. Elisabetsky. 2004. Ethnopharmacological studies of antimicrobial remedies in the south of Brasil. Journal of Ethnopharmacology 90(1): 135-143. [ Links ]
Coleto, J.M. 1994. Crecimiento y desarrollo de las especies frutales. Segunda edición. Ediciones Mundiprensa, España. 167 p. [ Links ]
De Souza, G., A.P. Haasb, G.L. von Poserc, E.E. Schapovalc and E. Elisabetsky. 2004. Ethnopharmacological studies of antimicrobial remedies in the south of Brasil. Journal of Ethnopharmacol 90(1): 135-143. [ Links ]
Fadda, A. and M. Mulas. 2010. Chemical changes during myrtle (Myrtus communis L.) fruit development and ripening. Scientia Horticulturae 125(3): 477-485. [ Links ]
Gandolfo, S.P. 2008. Factores Ecofisiológicos Relacionados con el crecimiento vegetativo, floración y desarrollo del fruto del aguacate. Tesis doctoral. Departamento de Producción Vegetal. Universidad Politécnica de Valencia, Valencia, España. 211 p. [ Links ]
Gaviria, C.A., O.A. Cifuentes, C.E. Monsalve y B. Rojano. 2007. Actividad antioxidante de extractos metanólicos de Attalea butyraceae. Scientia et Technica 13(33): 297-298. [ Links ]
Gaviria, C., C. Ochoa, N. Sánchez, C. Medina, M. Lobo, P. Galeano, A. Mosquera, A. Tamayo, Y. Lopera y B. Rojano. 2009. Actividad antioxidante e inhibición de la peroxidación lipídica de extractos de frutos de mortiño (Vaccinium meridionale SW). Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas 8(6): 519-528. [ Links ]
Gil - Albert, V.F. 1995. Tratado de Arboricultura Frutal. Volúmen 1. Morfología y fisiología del árbol frutal. Cuarta edición. Ediciones Mundiprensa, Madrid. 102 p. [ Links ]
Hernández, M. y A. Sastre. 1999. Tratado de nutrición. Ediciones Díaz de Santos S.A., Madrid. 1.496 p. [ Links ]
Holdridge, LR. 1967. Life zone ecology. Tropical Science Center, San José, Costa Rica. 206 p. [ Links ]
Huang, R., R. Xia, L. Hu, Y. Lu and M. Wang. 2007. Antioxidant activity and oxygen - scavenging system in orange pulp during fruit ripening and maturation. Scientia Horticulturae 113(2): 166-172. [ Links ]
Iturbe, I. 1996. Sistemas antioxidantes en plantas de guisante sometidas a estreses ambientales. Tesis doctoral. Consejo Superior de Investigaciones Científicas, Zaragoza, España. 129 p. [ Links ]
Janick, J. and R.E. Paull. 2008. The enciclopedia of fruit and nuts. CABI North American Office, Cambridge, USA. 954 p. [ Links ]
Krishnaiah, D., R. Sarbatly and R. Nithyanandam. 2011. A review of the antioxidant potential of medicinal plant species. Food and Bioproducts Processing 89(3): 217-233. [ Links ]
Kulkarni, A.P. and S.M. Aradhya. 2005. Chemical changes and antioxidant activity in pomegranate arils during fruit development. Food Chemistry 93(2): 319-324. [ Links ]
Lisboa, A., L.I. Reckziegel, F. Clasen, M. Salvador, R. Carlos, W. Padilha da Silva, L. Nora, and C. Valmor. 2011. Araçá (Psidium cattleianum Sabine) Function of antioxidant enzymes and metabolites during maturation of pea. Food Chemistry 128(4): 916-922. [ Links ]
Matamoros, M.A., J. Loscos, K.J. Dietz, P.M. Aparicio and M. Becana. 2010. Function of antioxidant enzymes and metabolites during maturation of pea fruits. Journal of Experimental Botany 61(1): 87-97. [ Links ]
Mondal, K., N.S. Sharma, S.P. Malhotra, K. Dhawan and R. Singh. 2004. Antioxidant systems in ripening tomato fruits. Biologia Plantarum 48(1): 49-53. [ Links ]
Mondal, K., Malhotra, SP., Jain, V. and Singh, R. 2009. Oxidative stress and antioxidant systems in Guava (Psidium guajava L.) fruits during ripening. Anual Review of Plant Physiology and Plant Molecular Biology 15(4): 328-334. [ Links ]
Naranjo, M., T. Vélez, y B. Rojano. 2011. Actividad antioxidante de café colombiano de diferentes calidades. Revista Cubana de Plantas Medicinales 16(2): 164-73. [ Links ]
Oliveira, I., P. Baptista, R. Malheiro, S. Casal, A. Bento and J.A. Pereira. 2011. Influence of strawberry tree (Arbutus unedo L.) fruit ripening stage on chemical composition and antioxidant activity. Food Research International 44(5): 1401-1407. [ Links ]
Prior, RL. and G. Cao. 2000. Analysis of botanicals and dietary supplements for antioxidant capacity: a review. Journal of AOAC Internacional 83(4): 950-956. [ Links ]
Re, R., N. Pellegrini, A. Proteggente, A. Pannala, M. Yang and C. Rice-Evans. 1999. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine 26(9- 10): 1231-1237. [ Links ]
Rojano, B., C.A. Gaviria, M.A. Gil, J.A. Saez, G. Schinella y H. Tournier. 2008. Actividad antioxidante del isoespintanol en diferentes medios. Vitae 15(1): 173-181. [ Links ]
Rojano, B., I.C. Zapata y F. Cortes. 2012. Estabilidad de antocianinas y valores de capacidad de absorbancia de radicales oxígeno (ORAC) de extractos acuosos de corozo (Bactris guineensis). Revista Cubana de Plantas Medicinales 17(3): 244-255. [ Links ]
Rojano, B.A., I.C. Zapata, A.F. Alzate, A.J. Mosquera, F.B. Cortes y L. Gamboa. 2011. Polifenoles y actividad antioxidante del fruto liofilizado de palma naidi (Açai Colombiano) (Euterpe oleracea Mart). Revista Facultad Nacional de Agronomía Medellín 64(2): 6213-6220. [ Links ]
Romero, M., B. Rojano, J. Mella, C.D. Pessoa, E. Lissi and C. López. 2010. Antioxidant capacity of pure compounds and complex mixtures evaluated by the ORAC - Pyrogallol red assay in the presence of Triton X-100 micelles. Molecules 15(9): 6152-6167. [ Links ]
Shakya, R. and D.A. Navarre. 2006. Rapid screening of ascorbic acid, glycoalkaloids, and phenolics in potato using high-performance liquid chromatography. Journal of Agricultural and Food Chemistry 54(15): 5253-5260. [ Links ]
Shen, L., Y. Ruan, K. Liu and J. Sheng. 2008. Metabolism of reactive oxygen dynamic changes during tomato fruit ripening and senescence. Acta Horticulturae 768: 517-523. [ Links ]
Singleton, V.L. and J.A. Rossi. 1965. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture 16(3): 144-158. [ Links ]
Silva, A., N. Fernández, M.A. Bacarin and M de G. De souza. 2007. Chemical composition and growth respiration in Psidium cattleyanum Sabine fruits during development cycle. Revista Brasileira de Fruticultura 29(1): 61-66. [ Links ]
Stoner, G.D and N.P. Seeram. 2011. Berries and cancer prevention. Springer, New York. 305 p. [ Links ]
Szajdek, A. and E.J. Borowska. 2008. Bioactive compounds and health-promoting properties of berry fruits: a review. Plant Foods for Human Nutrition 63(4): 147-156. [ Links ]













