Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.66 no.2 Medellín July/Dec. 2013
Alternativas Microbiológicas para Mejorar el Crecimiento del Caupí
Microbiological Alternatives for the Improvement of Cowpea Growth
Joaquín Guillermo Ramírez Gil1; Laura Osorno Bedoya2; Nelson Walter Osorio Vega3 y Juan Gonzalo Morales Osorio4
1 Ingeniero Agrónomo. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias Agrarias - Departamento de Ciencias Agronómicas. A.A. 1779. Medellín, Colombia. <jgramireg@unal.edu.co>
2 Ingeniera Biológica. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias - Escuela de Biociencias. A.A. 1779. Medellín, Colombia. <lauraosornobedoya@gmail.com>
3 Profesor Asociado. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias - Escuela de Biociencias. A.A. 3840. Medellín, Colombia. <nwosorio@unal.edu.co>
4 Profesor Asociado. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias Agrarias - Departamento de Ciencias Agronómicas. A.A. 1779. Medellín, Colombia. <jgmoraleso@unal.edu.co>
Recibido: Marzo 20 de 2013; aceptado: Junio 25 de 2013.
Resumen. La baja disponibilidad de fósforo (P) en el suelo, la ineficiencia que presenta su absorción y el costo de la fertilización fosfórica son limitantes para la productividad agrícola. Una alternativa biotecnológica para manejar este problema es mediante el uso de microorganismos del suelo, capaces de mejorar la disponibilidad y la absorción de P y la eficiencia de la fertilización con fertilizantes más económicos como la Roca Fosfórica (RP). En este trabajo se evaluó bajo condiciones de casa de malla, el efecto de un hongo micorrízico arbuscular (HMA) (Glomus fasciculatum) y un microorganismo solubilizador de P (MSP) (Mortierella sp.) sobre la toma de P y el crecimiento de plantas de caupí (Vigna unguiculata L. Walp.), con adición de tres niveles de RP (0, 100 y 300 mg de P kg-1 suelo). Los resultados mostraron un incremento significativo (P<0,05), de la biomasa seca, diámetro medio y altura de la planta y P foliar, para las plantas inoculadas con HMA, comparado con las no inoculadas. La adición de RP y la inoculación con MSP, no tuvo un efecto estadísticamente significativo (P>0,05) sobre las variables de crecimiento evaluadas. Sin embargo, en todos los tratamientos en donde se aplicó el MSP, se incrementó significativamente el P soluble. Con base en lo encontrado en este trabajo, se puede plantear que el hongo micorrízico arbuscular evaluado (HMA), mejora la eficiencia de absorción de P y el crecimiento del caupí bajo las condiciones evaluadas.
Palabras clave: Glomus fasciculatum; Mortierella sp.; Vigna unguiculata; microorganismos.
Abstract. The low phosphorus (P) availability in soil, absorption inefficiency and high costs of phosphate fertilization are limiting factors for agricultural productivity. A biotechnological alternative is the use of soil microorganisms, capable of improving P disponibility, absorption and the use of fertilizer cheaper as rock phosphate fertilization (PR). This experiment was performed under screen house conditions aiming to evaluate the effect of an arbuscular-mycorrhizal fungus (HMA) (Glomus fasciculatum) and a P solubilizing fungus (MSP) (Mortierella sp.) on P uptake and cowpea (Vigna unguiculata L. Walp.) growth, planted with three concentrations (0, 100 and 300 mg of P per each kg of soil) of PR. A significant increase (P≤0.05) in dry mass, plant height, mean stem diameter and foliar phosphorus, was observed in the HMA-inoculated plants compared with the HMA-non inoculated plants. No significant differences were identified when PR was added or MSP was inoculated. The results suggest that the use of HMA may improve P absorption and cowpea growth under the evaluated conditions.
Key words: Glomus fasciculatum; Mortierella sp.; Vigna unguiculata; microorganisms.
Los suelos tropicales presentan bajos niveles de nutrientes, especialmente de fósforo (P), lo que condiciona la productividad de los cultivos (Wakelin et al., 2004) debido a que es un nutriente indispensable para el crecimiento y desarrollo de las plantas (Randhawa et al., 2006; Osorio, 2011). Esta deficiencia ha generado la utilización continua de fertilizantes fosfóricos solubles, ocasionando fenómenos de fijación, lixiviación y precipitación del P en el suelo, los cuales acarrean una baja eficiencia en la nutrición, contaminación ambiental y altos costos de producción de los cultivos (Osorio, 2011).
Para incrementar la eficiencia de la fertilización con P en el trópico se han evaluado diferentes estrategias, como el uso de distintas fuentes del nutriente, el tiempo, el método de aplicación y la combinación con enmiendas minerales y otros fertilizantes, entre otros; sin embargo, la eficiencia de la fertilización con P todavía es muy baja (5-10%) (Osorio, 2007).
Una alternativa que podría ser técnica y económicamente viable, para incrementar la solubilidad del P en el suelo y mejorar su absorción por las plantas, es el uso de algunos microorganismos solos o combinados con roca fosfórica (RP) como fuente de P (Shrivastava et al., 2007; Osorio, 2011). Los hongos micorrízico arbuscular como Glomus fasciculatum (HMA) y microorganismos solubilizadores de fósforo (MSP), como Mortierella spp., son frecuentemente citados en la literatura para mejorar la eficiencia de la fertilización fosfórica y aumentar la solubilidad de este en el suelo (Whitelaw, 1999; Osorio y Habte, 2001; Osorio 2011). La relación simbiótica entre la planta y el HMA, se presenta debido a que la planta mediante los exudados radicales le suministra una fuente de energía al hongo, el cual aumenta la superficie de exploración del sistema de raíces, mejorando la absorción de nutrientes en especial el P (Hause y Fester, 2005). Por otro lado, el proceso de solubilización del P por MSP, obece a que la producción de ácidos orgánicos y la liberación de protones hacia la solución del suelo por parte del microorganismo implicado que permite solubilizar fuentes de P insolubles como es el caso de la RP (Singh y Reddy, 2011; Osorio, 2011).
El caupí (Vigna unguiculata L. Walp.) es una leguminosa cultivada en regiones de África, Asia y América, ha sido utilizada ampliamente en la alimentación humana y animal, gracias a los altos contenidos proteicos que posee y a su amplia capacidad de adaptación a condiciones de sequía y baja fertilidad de los suelos (Ehlers y Hall, 1997; Kongpun et al., 2011). Las investigaciones indican que estas características se deben en gran parte a la simbiosis benéfica con hongos formadores de micorriza, los cuales incrementan la toma de nutrientes, la absorción del agua y la resistencia a condiciones de estrés (Rajapakse et al., 1989; Dialloa et al., 2001; Kongpun et al., 2011).
El objetivo de este trabajo fue evaluar el efecto de una cepa de G. fasciculatum y una de Mortierella sp., sobre la absorción de P y parámetros de crecimiento de plantas de V. unguiculata fertilizadas con tres niveles de RP.
MATERIALES Y MÉTODOS
Localización. Este trabajo se realizó en el laboratorio de Microbiología del Suelo y casa de malla de la Universidad Nacional de Colombia - Sede Medellín (6°15N, 75°35'W, 1.495 msnm).
Sustrato. Se preparó un sustrato en una relación 3:1:1 de suelo, cascarilla de arroz y cuarzo respectivamente, con el fin de mejorar algunas propiedades físicas. El suelo que se utilizó fue un Oxisol pH 4,8, proveniente del centro experimental Carimagua de CORPOICA, Vichada-Colombia (Tabla 1). Para mejorar las condiciones de desarrollo del trabajo, el pH del suelo fue ajustado a 5,6 con la adición de CaO, previa curva de incubación de cal. El sustrato de crecimiento se esterilizó dos veces en autoclave a 120 °C y 0,15 MPa durante 1 hora, con un período de 24 h entre cada esterilización. Cada planta se sembró en una maceta con 1.500 g de sustrato (base seca).
Microorganismos utilizados en la inoculación del suelo. Las cepas de microorganismos utilizadas en este trabajo, se obtuvieron de la colección general del laboratorio de microbiología del suelo de la Universidad Nacional de Colombia - sede Medellín. G. fasciculatum fue originalmente proporcionado por el Doctor M. Habte de la Universidad de Hawaii (Honolulú, EUA) y posteriormente multiplicado en raíces de sorgo y kudzú. El hongo Mortierella sp. fue originalmente aislado en la Universidad de Hawaii a partir de un Andisol (Osorio y Habte, 2001). El sustrato se inoculó con 35 g kg-1 de inoculo crudo de G. fasciculatum, que contenía 47 propágulos infectivos g-1 (Porter, 1979). Para el control con sustrato no inoculado se utilizaron 35 g kg-1 de inóculo crudo esterilizado (0,15 MPa, 120 °C por 60 min), al cual se le adicionaron 10 mL del filtrado (10 mm) de una suspensión al 10% de la fuente de inoculo original. El hongo Mortierella sp., se multiplicó en medio PDA (5 días a 25 °C). El micelio obtenido se mezcló de manera homogénea con agua destilada estéril, la solución se ajustó a una concentración de 7 x 106 (UFC) mL-1, y se adicionaron 5 mL en el sitio de siembra por cada unidad experimental. Para los controles se adicionó la misma solución esterilizada en autoclave (0,15 MPa, 120 °C por 60 min).
Fuente de fósforo evaluada. Se evaluaron tres niveles diferentes de RP (26% P2O5): 0, 100 y 300 mg kg-1 de P, pasada previamente por un tamiz de 250 mm.
Material vegetal. La especie que se utilizó para este experimento fue el caupí, la cual ha sido reportada como una planta altamente dependiente de la asociación micorrízica (Rajapakse et al., 1989). Las semillas se pre-germinaron por 24 horas en cámara húmeda en condiciones a temperatura ambiente y se sembraron tres por pote. A las tres semanas se seleccionó una plántula por pote (dejando los potes homogéneos en tamaño), estas se mantuvieron en casa de malla durante dos meses, fertilizadas con solución nutritiva Hoagland libre de P y en condiciones de 30 - 40% de máxima capacidad de retención de humedad del sustrato.
Variables analizadas. Al final del experimento (2 meses después), se tomaron las siguientes variables respuesta para cada tratamiento: altura de la planta (cm), diámetro medio del tallo (mm), masa seca (60 ºC por 72 h), área foliar y P foliar mediante muestreo no destructivo (Aziz y Habte, 1987) y determinación cuantitativa en laboratorio por el método de azul de molibdato (Murphy y Riley, 1962).
Se determinó la colonización micorrízica por decoloración de las raíces con KOH (10%) por 24 h (Phillips y Hayman, 1970), tinción con fuscina ácida (0,15%) (Kormanik et al., 1980) y cuantificación mediante las líneas de intercepción (Giovanetti y Mosse, 1980). A partir de muestras tomadas del suelo se realizó el re-aislamiento de Mortierella sp. y la medición de fósforo soluble (0,01 M de CaCl2).
Análisis estadístico. Se utilizó un diseño completamente al azar, con arreglo factorial de 3 x 2 con 3 repeticiones, el cual consiste en la adición de 0, 100 y 300 mg de P kg-1 sustrato, usando RP como fuente de P y la inoculación o no con G. fasciculatum y Mortierella sp., en forma individual o combinada. Se analizó la homocedasticidad y la normalidad de los datos (P<0,05), utilizando los criterios de Levene y Kolmogorov-Smirnov, respectivamente; posteriormente, se sometieron a análisis de varianza y comparación de medias por la prueba de Tukey (P<0,05).
RESULTADOS Y DISCUSIÓN
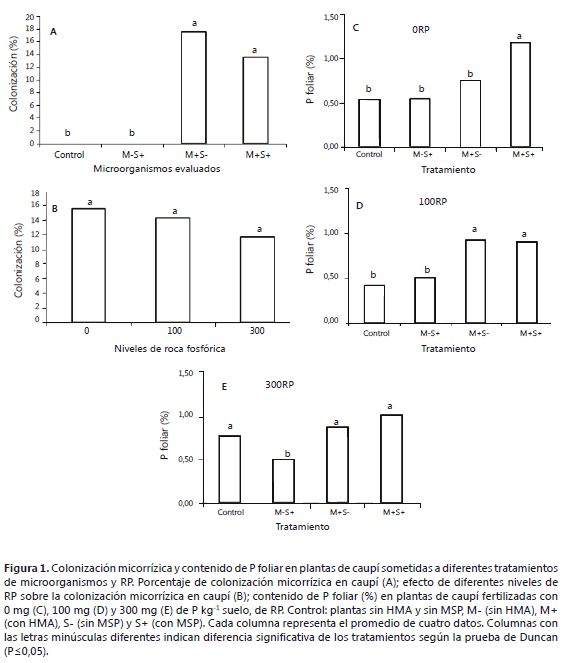
Colonización micorrízica y fósforo foliar. Las plantas inoculadas con G. fasciculatum (M+S-), presentaron un valor de colonización micorrízica promedio de 17,6%, el cual no presentó diferencia significativa con la adición del MSP (Figura 1A). En el tratamiento sin aplicación de RP se encontró el mayor porcentaje de colonización micorrízica. Los diferentes niveles evaluados de RP, no incidieron sobre el parámetro de colonización micorrízica (Figura 1B). Como se esperaba, en los controles no inoculados con micorrizas HMA (M-S-, M-S+), no se observó colonización (P<0,05) (Figura 1A).
El porcentaje de colonización micorrízica de las plantas de caupí, encontrado en este trabajo se considera medio para esta especie (Rajapakse et al., 1989); sin embargo, se observaron efectos positivos en los parámetros de crecimiento de la planta. Se han estudiado varios aspectos que afectan el porcentaje de colonización micorrízica, como la eficiencia de la cepa utilizada, el suministro de agua, el pH, la cantidad de P en solución y el porcentaje de materia orgánica entre otros (Osorio, 2011). Se ha observado que la aplicación de P en el suelo puede disminuir el porcentaje de colonización micorrízica de las plantas de caupí (Saidou et al., 2012). Estos hallazgos han sido confirmados por Kongpun et al. (2011) quienes observaron alta colonización micorrízica en caupí y efectos positivos sobre los parámetros de crecimiento y desarrollo del frijol, en suelos ácidos (pH 5) con bajos niveles de P. Resultados reportados por Ngwene et al. (2010), sugieren que la disponibilidad de P proveniente de la RP, está relacionada con un mayor suministro de NH4+, relativo a NO3-; sin embargo, esta relación afecta negativamente el porcentaje de colonización micorrízica.
El caupí está adaptado a zonas marginales, con suelos de muy baja fertilidad, degradados y muy secos (Edwards et al., 1981; Ehlers y Hall, 1997). En áreas con las características anteriormente descritas, Rajapakse et al. (1989) encontraron valores promedios de 80% de colonización micorrízica. Se conoce que el grado de asociación micorrízica en caupí, disminuye drásticamente, cuando los niveles de P en el suelo son >30 ppm. Por lo tanto, el contenido de P en el suelo, es una de las variables que más influencia tiene sobre la relación simbiótica del HMA en esta especie (Rajapakse et al., 1989). En este trabajo se utilizó un oxisol con 24 mg kg-1 de P (Bray II) y 0,022 mg kg-1 de P soluble y 6% de materia orgánica (Tabla 1), lo cual pudo haber incidido en el grado de colonización media observado.
El mayor valor de P foliar, se observó (P<0,05) en el tratamiento sin presencia de RP (0 mg de P kg-1 suelo) e inoculado con el HMA y el MSP (M+S+) (Figura 1C). Una hipótesis para explicar este resultado, es que el suelo original posee niveles de P, pero no disponibles para la planta; sin embargo, el MSP podría hacerlo disponible por medio de desorción-disolución (Osorio y Habte, 2013), seguido de absorción por el HMA. Para los dos niveles restantes de RP (100 y 300 mg de P kg-1 suelo), los valores más altos de P foliar (P<0,05), se presentaron en los tratamientos donde se realizó la inoculación individual del HMA o en combinación con el MSP (M+S- y M+S+) (Figuras 1D y E). Los niveles de P foliar observados en este trabajo indican que la cepa de micorriza usada, incrementa la absorción de P por la planta sin la adición de RP, lo que podría representar ahorro en costos de fertilizantes. Es necesario evaluar esta cepa en suelos con niveles bajos de P, en donde se podría identificar el efecto económico de disminución de aplicación de fertilizantes.
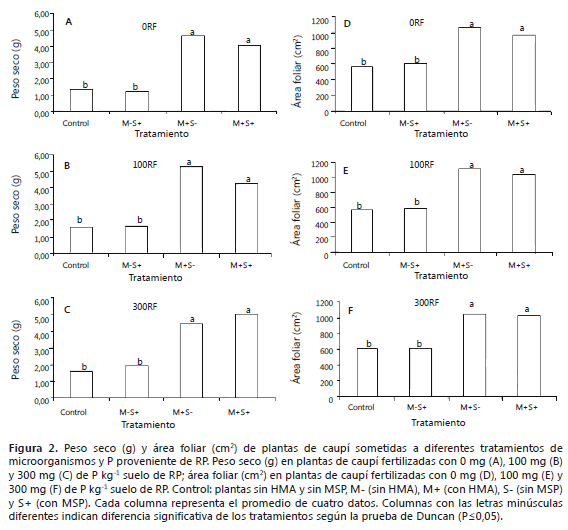
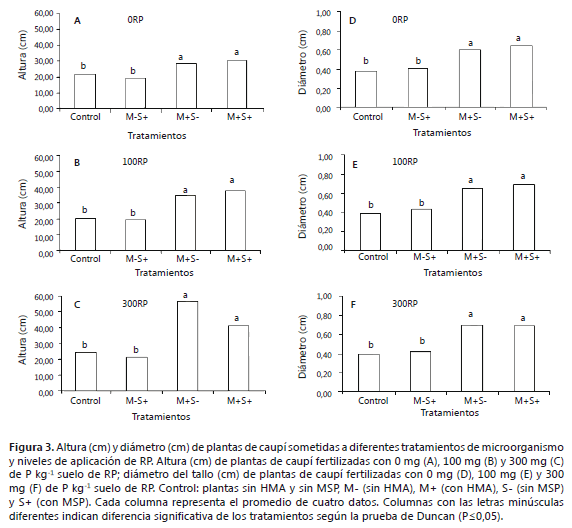
Variables biométricas. En las plantas inoculadas con el HMA, (M+S-), se observó un incremento significativo (P<0,05) en la biomasa seca (69%), el área foliar (47%), la altura (44%) y el diámetro medio del tallo (41%), en comparación con las plantas donde no se realizó inoculación del HMA (M-S- y M-S+), independientemente del nivel de la dosis de RP aplicada (M-S-, para 0, 100 y 300 mg de P kg-1 suelo) (Figuras 2 y 3). Las plantas inoculadas simultáneamente con el HMA y el MSP (M+S+), mostraron resultados similares a las plantas inoculadas únicamente con el HMA (Figuras 2, 3 y 5). Estos resultados confirman el efecto positivo reportado de la inoculación de caupí con micorrizas en general (Yaseen et al., 2011) y en particular con G. fasciculatum (Rajapakse, et al., 1989; Diallo et al., 2001; Kongpun et al., 2011).
El efecto benéfico reportado sobre la asociación del caupí con el HMA, se ha explicado principalmente por la mejora en la absorción de P y otros nutrientes (Dialloa et al., 2001). Autores como Kongpun et al. (2011), plantean que la asociación micorrízica es necesaria y quizás más importante que la fijación biológica de nitrógeno, llevada a cabo con bacterias de los géneros Rhizobium y Bradyrhizobium. Además de la mejora en la nutrición de las plantas, los HMA contribuyen significativamente a mejorar la estructura del suelo, incrementan la resistencia de la planta al estrés biótico y abiótico y favorece el establecimiento de interacciones con otros microorganismos benéficos (Mansfeld et al., 2002; Johansson et al., 2004; Boby et al., 2008). Además, dentro de los cambios que ocurren cuando se da esta simbiosis está el aumento del potencial hídrico de la hojas y mantenimiento de la transpiración, proceso que se da gracias al incremento de la longitud y desarrollo de las raíces, confiriéndole a la planta una mayor área de exploración tanto en longitud como en profundidad (Davies et al., 1992; Hoeksema et al., 2010).
La adición de RP (100-300 mg de P kg-1 suelo), no mejoró el desarrollo del caupí en este trabajo, lo cual aparentemente contrasta con lo encontrado por Akande et al. (2011), quienes registran un aumento entre el 20 y 35%, en los rendimientos de esta especie cuando se utilizó como la RP como fuente de P. Las diferencias encontradas en los dos trabajos podrían deberse a múltiples factores como, el contraste entre los suelos usados, ya que la dinámica del P puede ser diferente, al poco tiempo de duración del experimento, ya que por su naturaleza, la RP no parece ser muy efectiva en ciclos cortos y al nivel inicial de P y otros nutrientes en el suelo, entre otros factores, puesto que el mayor efecto se ha observado en suelos con bajos niveles de P (Chien y Hammond, 1978; Osorio, 2011). Debido a la inhibición de la colonización micorrízica, en suelos con alto contenido de P y a la lenta liberación de P desde la RP, la mayor utilidad de la aplicación de RP y cepas de microorganismos, quizás sea en suelos con bajos niveles de nutrientes y en donde se ha aplicado la RP con suficiente antelación para que el P sea liberado y tomado efectivamente por la planta.
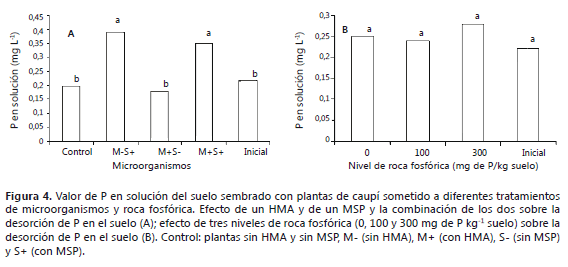
Efecto de Mortierella sp. Los mayores niveles de P soluble en el suelo, comparado con los niveles iniciales se registraron en todos los tratamientos donde se inoculó el MSP (M-S+ y M+S+) y sin presentarse interacción con las diferentes dosis de roca fosfórica aplicadas al suelo (P>0,05). En todos los tratamientos en donde se inoculó el MSP, se logró re-aislar Mortierella sp. (Figura 4A y 4B).
Los resultados encontrados indican que el hongo Mortierella sp. fue efectivo para la desorción de P en el suelo. Este efecto observado para los MSP, se ha explicado por la liberación de H+ y formación de Ca2+complejo de ácido oxálico (Whitelaw, 1999; Welch, 2002; Osorio, 2011). En diversos trabajos se ha encontrado, que los hongos solubilizadores de fosfatos pueden mejorar directamente la disponibilidad del P en suelos fertilizados y no fertilizados, demostrando su aplicabilidad en el incremento de la productividad de diferentes cultivos (Tarafdar y Rao, 1996; Vázquez et al., 2000). La eficiencia de las mezclas de especies y cepas de microorganismos, sobre la producción de cultivos, es un fenómeno complejo el cual depende de la compatibilidad y genotipo de las cepas, el clima, los suelos, la disponibilidad de nutrientes y los genotipos de plantas, entre otros (De Lima et al., 2011). Se ha encontrado que el caupí responde muy bien a las adiciones de P, cuando el suelo presenta niveles menores de 10 ppm de este elemento; sin embargo, las adiciones de P en suelos con concentraciones superiores, no han mostrado respuestas significativas (Adetunji, 1994). En el presente trabajo se partió de una concentración inicial de 24 ppm, lo cual podría explicar parcialmente, porqué la presencia del hongo Mortierella sp., no incrementó significativamente los parámetros de desarrollo de las plantas de caupí (Figura 4). Otros aspectos que pueden limitar el uso de los MSP son la capacidad para establecerse en la rizosfera y la posibilidad de que el P solubilizado puede ser fijado nuevamente en el suelo (Pérez et al., 2004). Para explorar la aplicabilidad en cultivos en campo, de las cepas usadas en este trabajo, se debe evaluar su efecto sobre diferentes tipos de suelos, localidades, clima, niveles de nutrientes y genotipos de plantas, entre otros factores, con el fin de encontrar aquellas condiciones en donde efectivamente puedan contribuir como alternativas económicas para su uso en los suelos tropicales (Akintokun et al., 2003; Akande et al., 2008).
En este trabajo se encontró que la incorporación de la cepa usada de G. fasciculatum, incrementó significativamente el crecimiento de las plantas de caupí bajo condiciones de casa de malla. Esta cepa presentó potencial para ser evaluada en las diversas condiciones que se pueden encontrar en cultivos en campo, con el fin de buscar alternativas para reducir costos y mejorar la productividad de la leguminosa. Se debe evaluar también la co-inoculación del HMA con MSP, en suelos con baja disponibilidad de P, para determinar si se obtienen efectos significativos sobre las plantas de caupí.
BIBLIOGRAFÍA
Adetunji, M. 1994. Phosphorus requirement of a maize-cowpea sequential cropping on a paleudult. Fertilizer Research 39(3): 161-166. [ Links ]
Akande, M., E. Makinde and M. Adetunji. 2011. Response of maize and cowpea grown sequentially to application of phosphate rock in the humid tropics. Communications in Soil Science and Plant Analysis 42(9): 1027-1037. [ Links ]
Akande, M., M. Adetunji and S. Ojeniyi. 2008. Effects of phosphate rock on chemical properties of soil in maize/cowpea grown in sequence. Nigerian Journal of Soil Science 18(1): 99-107. [ Links ]
Akintokun, O., M. Adetunji and P. Akintokun. 2003. Phosphorus availability to soybean from an indigenous phosphate rock sample in soil from southwest Nigeria. Nutrient Cycling in Agroecosystems 65(1): 35-41. [ Links ]
Aziz, T. and M, Habte. 1987. Determining vesicular-arbuscular micorrízica effectiveness by monitoring P status of leaf disk. Canadian Journal of Microbiology 33(12): 1097-1101. [ Links ]
Boby V., A. Balakrishna and D. Bagyaraj. 2008. Interaction between Glomus mosseae and soil yeasts on growth and nutrition of cowpea. Microbiological Research 163(6): 693-700. [ Links ]
Chien, S. and L. Hammond. 1978. A comparison of various laboratory methods for predicting the agronomic potential of phosphate rocks for direct application. Soil Science Society of America Journal 42(6): 935-939. [ Links ]
Davies, F., J. Potter and R. Linderman. 1992. Mycorrhiza and repeated drought exposure resistance affect drought resistance and extraradical hyphae development on pepper plants independent of plant size and nutrient content. Journal of Plant Physiology 139(3): 289-294. [ Links ]
De Lima, A., T. Xavier, C. De Lima, J. Oliveira, A. Mergulhao and M. Figueiredo. 2011. Triple inoculation with Bradyrhizobium, Glomus and Paenibacillus on cowpea (Vigna unguiculata [L.] Walp.) development. Brazilian Journal of Microbiology 42(3): 919-926. [ Links ]
Dialloa, A., P. Sambb and H. Macauley. 2001. Water status and stomatal behaviour of cowpea, Vigna unguiculata (L.) Walp, plants inoculated with two Glomus species at low soil moisture levels. European Journal of Soil Biology 37(3): 187-196. [ Links ]
Edwards, D., B. Kang and K. Danso. 1981. Differential response of six cowpea (Vigna unguiculata (L.) Walp) cultivars to liming in an ultisol. Plant and Soil 59(1): 61-73. [ Links ]
Ehlers, J. and A. Hall. 1997. Cowpea (Vigna unguiculata L. Walp.). Field Crops Research 53(1-3): 187-204. [ Links ]
Giovanetti, M. and M. Mosse. 1980. An evaluation of techniques for measuring vesicular-arbuscular mycorrhizal infection in roots. New Phytologist 84(3): 489-500. [ Links ]
Hause, B. and T. Fester. 2005. Molecular and cell biology of arbuscular mycorrhizal symbiosis. Planta 221(2): 184-196. [ Links ]
Hoeksema, J., V. Chaudhary, C. Gehring, N. Johnson, J. Karst, R. Koide, A. Pringle, C. Zabinski, J. Bever, J. Moore, G. Wilson, J. Klironomos and J. Umbanhowar. 2010. A meta-analysis of context-dependency in plant response to inoculation with mycorrhizal fungi. Ecology Letters 13(3):394-407. [ Links ]
Johansson, F., R. Paul and R. Finlay. 2004. Microbial interactions in the mycorrhizosphere and their signicance for sustainable agriculture. FEMS Microbiology Ecology 48(1):1-13. [ Links ]
Kongpun, A., B. Dell and B. Rerkasem. 2011. Alleviating acid soil stress in cowpea with a local population of arbuscular mycorrhizal fungi. African Journal of Biotechnology 10(65): 14410-14418. [ Links ]
Kormanik, P., A.W. Bryan and R. Schultz. 1980. Procedures and equipment for staining large numbers of plant root samples for endomycorrhizal assay. Canadian Journal of Microbiology 26(4): 536-538. [ Links ]
Mansfeld, K., J. Karsen and L. Bødker. 2002. Bacterial populations associated with mycelium of the arbuscular mycorrhizal fungus Glomus intrarradices. FEMS Microbiology Ecology 41(2): 133-140. [ Links ]
Murphy, J. and J. Riley. 1962. A modified single solution method for the determination of phosphate in natural waters. Analytica Chimica Acta 27(1): 31-36. [ Links ]
Ngwene, B., E. George, W. Claussen and E. Neumann. 2010. Phosphorus uptake by cowpea plants from sparingly available or soluble sources as affected by nitrogen form and arbuscular-mycorrhiza-fungal inoculation. Journal of Plant Nutrition and Soil Science 173(3): 353-359. [ Links ]
Osorio, N. 2007. A review on beneficial beneficial effects of rhizosphere bacteria on soil nutrient availability and plant nutrient uptake. Revista Facultad Nacional de Agronomía Medellín 60(1): 3621-3643. [ Links ]
Osorio, N. 2011. Microorganismos del suelo y su efecto sobre la disponibilidad de nutrientes en suelo ácidos del trópico. Suelos Ecuatoriales 41(1): 74-91. [ Links ]
Osorio, N. and M. Habte. 2001. Synergistic influence of an arbuscular mycorrhizal fungus and a P solubilizing fungus on growth and P uptake of Leucaena leucocephala in an Oxisol. Arid Land Research and Management 15(3): 263-274. [ Links ]
Osorio. N. and M. Habte. 2013. Phosphate desorption from the surface of soil mineral particles by a phosphate-solubilizing fungus. Biology and Fertility of Soils 49(4):481-486. [ Links ]
Phillips, J. and D. Hayman. 1970. Improves procedures for clearing roots and staining parasitic and vesicular arbuscular mycorrhizal fungi for rapid assessment of infection. Journal Transactions of the British Mycological Society 55(1): 158-161. [ Links ]
Pérez, J., N. Osorio y C. Álvarez. 2004. Crecimiento, absorción de fósforo y morfología de la raíz en espárragos inoculados con hongos micorrízicos y Pseudomonas fluorescentes. Revista Facultad Nacional de Agronomía Medellín 57(2): 2373-2381. [ Links ]
Porter, W. 1979. The "Most Probable Number" method of rennumerating infective propagules of vesicular arbuscular micorrízica fungi in soil. Australian Journal of Soil Research 17(3): 515-519. [ Links ]
Rajapakse, S., D. Zuberer and J. Miller. 1989. Influence of phosphorus level on VA Mycorrhizal colonization and growth of cowpea cultivars. Plant and Soil 114(1): 45-52. [ Links ]
Randhawa, P., L. Condron, H. Di, S. Sinaj and R. McLenaghen. 2006. Phosphorus availability in soils amended with different phosphate fertilizers. Communications in Soil Science and Plant Analysis 37(1-2): 25-39. [ Links ]
Saidou, A., B. Singh, R. Abaidoo, E. Iwuafor and N. Sanginga. 2012. Response of cowpea lines to low phosphorus tolerance and response to external application of P. African Journal of Microbiology Research 6(26): 5479-5485. [ Links ]
Shrivastava, M, B. Bhujbal and S. D'Souza. 2007. Agronomic efficiency of Indian rock phosphate in acidic soils employing radiotracer A-value technique. Communications in Soil Science and Plant Analysis 38(3-4): 461-471. [ Links ]
Singh. H. and M. Reddy. 2011. Effect of inoculation with phosphate solubilizing fungus on growth and nutrient uptake of wheat and maize plants fertilized with rock phosphate in alkaline soils. European Journal of Soil Biology 47(1): 30-34. [ Links ]
Tarafdar, J. and A. Rao. 1996. Contribution of Aspergillus strains to acquisition of phosphorus by wheat (Triticum aestivum L.) and chick pea (Cicera rietinum Linn.) grown in a loamy sand soil. Applied Soil Ecology 3(2): 109-114. [ Links ]
Vázquez, P., G. Holguín, M. Puente, A. López and Y. Bashan. 2000. Phosphate solubilizing microorganisms associated with the rhizosphere of semiarid mangroves in a semiarid coastal lagoon. Biology and Fertility of Soils 30(5-6):460-468. [ Links ]
Wakelin, A., R. Warren, P. Harvey and P. Ryder. 2004. Phosphate solubilization by Penicillium spp. closely associated with wheat roots. Biology and Fertility of Soils 40(1): 36-43. [ Links ]
Welch, S., A. Taunton and J. Banfiled. 2002. Effect of microorganisms and microbial metabolites on apatite dissolution. Geomicrobiology Journal 19(1): 343-367. [ Links ]
Whitelaw, M. 1999. Growth promotion of plants inoculated with phosphate solubilizing fungi. Advances in Agronomy 69(1): 99-151. [ Links ]
Yaseen, T., T. Burni and F. Hussain. 2011. Effect of arbuscular mycorrhizal inoculation on nutrient uptake, growth and productivity of cowpea (Vigna unguiculata) varieties. African Journal of Biotechnology 10(43): 8593-8598. [ Links ]