Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.68 no.1 Medellín Jan./June 2015
https://doi.org/10.15446/rfnam.v68n1.47830
Aplicación de Antagonistas Microbianos para el Control Biológico de Moniliophthora roreri Cif & Par en Theobroma cacao L. Bajo Condiciones de Campo
Application of Microbial Antagonists for the Biological Control of Moniliophthora roreri Cif & Par in Theobroma cacao L. Under Field Conditions
Jorge Enrique Villamil Carvajal1; Silvio Edgar Viteri Rosero2 y William Luciano Villegas Orozco3
1 Ingeniero Agrónomo. Joven Investigador, Colciencias-UPTC. Universidad Pedagógica y Tecnológica de Colombia Facultad de Ciencias Agropecuarias - Programa de Ingeniería Agronómica. Avenida Central del Norte. Tunja, Colombia. <cavitosa@yahoo.com>
2 Profesor Titular. Universidad Pedagógica y Tecnológica de Colombia - Facultad de Ciencias Agropecuarias - Programa de Ingeniería Agronómica. Avenida Central del Norte. Tunja, Colombia. <silvio.viteri@uptc.edu.co>
3 Ingeniero Agrónomo. Investigador Corporación Centro de Innovación del Trópico Alto Sostenible-CEI3TAS. Universidad Pedagógica y Tecnológica de Colombia. Avenida Central del Norte. Tunja, Colombia. <willvillegas@gmail.com>
Recibido: Agosto 8 de 2013; Aceptado: Mayo 26 de 2014.
doi: http://dx.doi.org/10.15446/rfnam.v68n1.47830
Resumen. En Colombia, las pérdidas ocasionadas por Moniliophthora roreri Cif & Par en el cultivo de cacao continúan siendo considerables. El objetivo del presente estudio fue investigar la actividad antagónica de dos aislamientos autóctonos de Trichoderma sp. y uno de Bacillus sp. ante M. roreri, en condiciones de campo. Los tratamientos fueron: T1, hongo H5; T2, hongo H20; T3, bacteria B3 y T4, testigo. Se evaluó incidencia y severidad externa e interna en los frutos. Los resultados de severidad externa e interna mostraron que respecto al control la disminución del daño en los frutos fue del 19,5 y 11,2% en el T1, del 28 y 19,5% en el T2 y del 13,5 y 8,5% en el T3, respectivamente con diferencias estadísticas a favor del T2. Se concluye que entre los tres antagonistas evaluados, el hongo H20 (Trichoderma sp.) tiene el mayor potencial para el control de la moniliasis del cacao en condiciones de campo.
Palabras clave: Moniliasis, Trichoderma, Bacillus, bioantagonistas.
Abstract. In Colombia, the economic losses caused by Moniliophthora roreri Cif & Par in the cocoa cultivation continue being considerable. The objective of this study was to investigate the antagonistic activity of two indigenous isolates of Trichoderma sp and one of Bacillus sp. over M. roreri under field conditions. The treatments were: T1, fungus H5; T2, fungus H20; T3, bacteria B3; T4, control. The variables evaluated on the cocoa fruits were incidence and external and internal severity. The results of the external and internal severity showed that with respect to the control the damage reduction on the cocoa fruits was 19,5 and 11,2% in T1, 28 and 19,5% in T2, and 13,5 and 8,5% in T3, respectively with statistical differences in favor of T2. It is concluded that among the three evaluated antagonists, the fungus H20 (Trichoderma sp.) has the greatest potential for the biocontrol of frosty pod rot in the cocoa cultivation under field conditions.
Key words: Frosty pod rot, Trichoderma, Bacillus, bioantagonists.
La búsqueda de microorganismos antagonistas para el control biológico de patógenos en cultivos de importancia económica ha despertado especial interés debido a sus potencialidades y a la gravedad de los impactos ecológicos causados por la constante y creciente aplicación de agroquímicos en los agroecosistemas (Acebo et al., 2012; Suárez y Alba, 2013). Los hongos antagonistas del género Trichoderma tienen la capacidad de actuar contra una amplia variedad de patógenos del suelo (Fusarium spp., Rhizoctonia spp., Pythium spp., Phytophthora spp. y Sclerotinia sp.) y del follaje (Botrytis spp. y Peronospora sp.) (Hoyos et al., 2008; Reyes et al., 2008; Tchameni et al., 2011; Rodríguez et al., 2010; Acebo et al., 2012; Martínez et al., 2013).
Con relación a M. roreri y M. perniciosa, especies de los géneros Trichoderma y Gliocladium han sido ampliamente calificadas como agentes eficaces en el control biológico de las enfermedades causadas por estos patógenos, tanto en condiciones in vitro como in situ, en diferentes áreas geográficas (Hebbar, 2007; Bailey et al., 2008; Suárez y Cabrales, 2008; Krauss et al., 2010; Medeiros et al., 2010; Villamil, 2011; Villamil et al., 2012; Hernandez et al., 2014). Resultados similares han sido obtenidos utilizando bacterias del género Bacillus con actividad antagónica eficaz ante M. roreri (Benito et al., 2007; Jaimes et al., 2008; Melnick et al., 2008; Melnick et al., 2011; Suárez y Alba 2013). Entre los mecanismos de acción utilizados por Trichoderma spp. se destacan la competencia por el espacio y los nutrientes, el micoparasitismo, la producción de compuestos inhibidores, la inactivación de enzimas del agente patógeno y la inducción de resistencia en la planta (Martínez et al., 2008; Shoresh et al., 2010; Tchameni, 2011; Hernández et al., 2014). La multiplicidad de estos mecanismos en un aislamiento es una característica importante para su selección como agente de control biológico (Hoyos et al., 2008).
La competencia se relacciona con el comportamiento desigual de dos o más organismos ante un mismo requerimiento, siempre y cuando la utilización del mismo por uno de ellos, reduzca la cantidad necesaria para los demás (Martínez et al., 2008). Trichoderma spp. puede parasitar las hifas del patógeno a través de enrollamientos, ganchos y cuerpos de tipo apresorios, que penetran la pared celular por la acción hidrolítica de las enzimas quitinasas, glucanasas y celulasas (Bernal et al., 2007; Vinale et al., 2008). El efecto de antibiosis se debe a la producción de metabolitos secundarios, los cuales pueden ser volátiles o difusibles, pero que en cualquiera de los casos, sin entrar en contacto físico con el patógeno pueden inhibir o restringir su crecimiento (Rodríguez et al., 2010). Algunas cepas de Trichoderma producen trichodermina, dermadina, suzukacilina, viridina, alameticina, richotoxina, metabolitos que son responsables del mecanismo antagónico (Vinale et al., 2006). La desactivación de los factores de patogenicidad de Trichoderma contra hongos fitopatógenos constituye un mecanismo de antagonismo indirecto poco estudiado (Martínez et al., 2013). Es posible que el potencial enzimático de Trichoderma para detener el proceso infeccioso de los patógenos sea mucho mayor, pues este controlador biológico secreta más de 70 metabolitos, entre ellos: sustancias estimuladoras del crecimiento y desarrollo de las plantas (Howell, 2003).
Las cepas de Trichoderma pueden activar un mecanismo nativo de defensa en las plantas contra diferentes plagas, conocido como Resistencia Sistémica Inducida (SIR- Systemic Induced Resistance) (Shoresh et al., 2010; Martínez et al., 2013). Diversas clases de compuestos pueden ser liberados por Trichoderma en la zona de la rizosfera y estar relacionados con la IRS en las plantas (Shoresh et al., 2010). Aún no se esclarecen y amplían los conocimientos acerca de Trichoderma como inductor de resistencia, pero es indiscutible su función en la defensa de las plantas (Martínez et al., 2013).
Los principales mecanismos involucrados en el control biológico de fitopatógenos con el uso de bacterias antagonistas como Bacillus sp., son la competencia por nutrientes, minerales y espacio; la síntesis de metabolitos, tales como sideróroros, antibióticos, toxinas y biosurfactantes, y la inducción de resistencia sistémica en la planta (Melnick et al., 2011; Singh et al., 2011; Acebo et al., 2012). Estos mecanismos son potenciados por alta motilidad del microorganismo y su capacidad de formar biopelículas (Acebo et al., 2012).
Así, el objetivo de este estudio se enfoca a determinar la actividad antagónica de dos aislamientos autóctonos de Trichoderma sp. y uno de Bacillus sp. ante Moniliophthora roreri Cif & Par, para el diseño de estrategias que permitan el manejo integrado de la moniliasis en el cultivo de cacao.
MATERIALES Y MÉTODOS
Área de estudio. El estudio se realizó en la finca "Corozales", vereda Resguardo del municipio de Coper, occidente de Boyacá (Colombia), coordenadas 05º 28' 45,6" N, 74º 02' 23,1 O a una altura de 825 msnm, temperatura promedio de 22 a 32 ºC, precipitación pluvial acumulada de 1.557 mm y humedad relativa de 84,12%.
Definición de los tratamientos. Se evaluaron los aislamientos autóctonos Trichoderma sp. H5 y H20, y Bacillus sp. B3. Se establecieron los siguientes tratamientos: T1, Trichoderma sp. H5; T2, Trichoderma sp. H20; T3, Bacillus sp. B3 y T4, testigo. Se utilizó un diseño experimental completamente al azar (DCA), con cuatro tratamientos, cuatro repeticiones, cuatro frutos por repetición.
Obtención de inoculantes microbianos. Los biocultivos fueron suministrados por el cepario del Laboratorio de Control Biológico del Grupo Manejo Biológico de Cultivos (GMBC) del Programa de Ingeniería Agronómica, de la Universidad Pedagógica y Tecnológica de Colombia. Los antagonistas microbianos autóctonos se obtuvieron previamente de suelo rizosférico y de frutos de cacao de arboles procedentes de semilla, de diversos cruzamientos interclonales mayores a 40 años de las fincas Diamante y Resguardo del municipio de Coper (Boyacá). Como criterio de selección se tuvo en cuenta su potencial para reducir el crecimiento y esporulación de M. roreri en condiciones in vitro (Villamil et al., 2012). El aislamiento de M. roreri, se obtuvo a partir de frutos completamente esporulados, coleccionadas en la finca Corozales, de los cuales, se tomó el micelio del hongo y se realizó siembra directa en cajas Petri en medio de cultivo Agar Papa Dextrosa (PDA).
La multiplicación de los antagonistas y el patógeno se hizo en cajas de Petri en medio PDA (hongos) y Agar Nutriente (AN) (bacterias). Los hongos fueron sembrados a los 62 días de la polinización de los híbridos e incubados a 25 °C, durante 8 días, y la bacteria a los 66 días de la polinización e incubada a 28 °C, durante 4 días (Agrios, 2005). El patógeno se sembró a los 45 días de la fecundación de los frutos y se incubó a 25 °C, durante 25 días.
Obtención e inoculación de frutos sanos. Los frutos sanos de cacao, se cosecharon de 16 árboles mayores de 25 años en competencia perfecta en un lote de arboles procedentes de semilla, de diversos cruzamientos interclonales, con similares características en cuanto a color y forma de frutos, que presentaban susceptibilidad a la moniliasis. Manualmente se fecundaron ocho flores del tercio medio superior por cada árbol con polen procedente del material varietal IMC 67.
A los 70 días de la polinización se seleccionaron cuatro árboles procedentes de cruzamiento interclonal para cada tratamiento. Para el conteo de conidios se preparó una suspensión de cada uno de los antagonistas en solución salina (NaCl 0,85%) en un patrón de 9 mL, utilizando 1 g de PDA colonizado por el biocontrolador y una alícuota de 400 μL de Tween 80, para la dispersión de las conidios. De esta suspensión se hicieron diluciones seriadas de 1X10-1, 1X10-2 y 1X10-3, tomando de esta ultima una alícuota de 500 μL para hacer los conteos en cámara Neubauer (Agrios, 2005). La densidad de la suspensión de cada hongo fue ajustada a 2,6x107 conidias mL-1. Para la bacteria se siguió el mismo procedimiento utilizado para los hongos, con el adicional de diluciones seriadas de 1x10-1 hasta 1x10-5, tomando de esta ultima una alícuota de 500 μL para hacer los conteos en cámara Petroff Hausser (Agrios, 2005). La densidad de la bacteria fue 3,2x109 células mL-1. De cada árbol procedente de cruzamiento interclonal se inocularon 4 frutos con 2,2 mL de suspensión del antagonista respectivo mediante aspersión con atomizador manual en un área de 3 cm2, sobre los canales de la parte media del fruto. Después de la inoculación cada fruto se protegió con una bolsa plástica de color azul, abierta en su parte inferior, con el fin de evitar el lavado por lluvia y concentración de mayor humedad alrededor del fruto. Cinco días posteriores a la inoculación con los antagonistas, se preparó una suspensión de esporas del patógeno sigiendo la metodología anteriormente descrita para hongos autóctonos, con una concentración de 2,6x106 conidias mL-1 y se inocularon los frutos utilizando 2 mL de inóculo por fruto mediante aspersión con atomizador sobre la misma área donde fue inoculado el antagonista. Simultáneamente, los frutos de los 4 árboles procedentes de cruzamiento interclonal asignados al testigo fueron inoculados con 2,2 mL de la suspensión del patógeno. Esta inoculación también se realizó mediante aspersión con atomizador manual en una área de 3 cm2, sobre los canales de la parte media del fruto (Jaimes y Aranzazu, 2010).
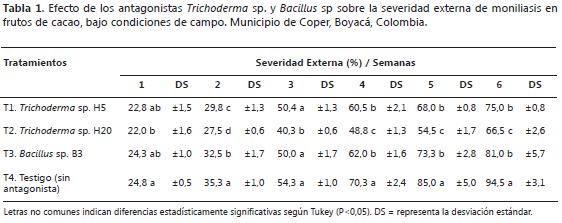
Variables evaluadas. Se llevó un registro semanal de la incidencia y severidad externa de la enfermedad, a partir de la aparición de los primeros síntomas, durante un período de 6 semanas. La severidad interna se determinó cuando los frutos alcanzaron madurez de cosecha, 48 días posteriores a la inoculación. La incidencia de la enfermedad en cada semana se calculó en porcentaje mediante la fórmula de Arguello (2000), contando el número de frutos con el síntoma de la enfermedad. La severidad externa se evaluó, primero con base en el porcentaje de tejido afectado en el fruto, utilizando la escala dada en grados y porcentaje de daño (Grado 1= 0 fruto sano; Grado 2= 1-25 protuberancia; Grado 3= 26-50 inicio de mancha; Grado 4= 51-75 mancha; Grado 5= 76-100 esporulación) y luego mediante la sumatoria de los grados de daño en porcentaje sobre el número total de datos por el mayor dato del porcentaje de severidad (Cárdenas y Giraldo, 1986). Para comparar el efecto de los tratamientos sobre la severidad externa se calculó el área abajo la curva del progreso de la enfermedad (AACPE), mediante la aplicación de la fórmula planteada por Shaner y Finney (1977). Para introducir los datos, se tuvo en cuenta el % de daño externo y el número del día en el cual se hizo la evaluación después de la aplicación de los tratamientos (Pérez y Forbes, 2008). Cuando los frutos alcanzaron madurez de cosecha se abrieron longitudinalmente para determinar la severidad interna, la que se expresó en términos de porcentaje de daño, empleando la escala en grados y porcentaje de daño: (Grado 0 = 0% de daño, Grado 1= 1-20%, Grado 2= 21-40%; Grado 3= 41-60%, Grado 4= 61-80%; Grado 5= 81-100% de daño) (Jaimes y Aranzazu, 2010).
Análisis biométricos. Se analizaron los supuestos de normalidad y homogeneidad de varianza para los datos obtenidos en cada variable mediante la prueba de Shapiro-wilk y Bartlett, se corrió el análisis de varianza ANOVA y se aplicaron las pruebas de comparación múltiple de Tukey (Gómez y Gómez, 1984), utilizando el paquete estadístico R versión 3.0.2 copyright©.
RESULTADOS Y DISCUSIÓN
Incidencia de moniliasis en los frutos tratados. Los primeros síntomas (gibas) de la enfermedad se observaron 40 días posteriores a la inoculación del patógeno. De acuerdo con Suárez (1972), en frutos inoculados a los 70 días de desarrollo el periodo de incubación desde la penetración hasta la aparición de los primeros síntomas generalmente es de 40-60 días. Una de las características de este fitopatógeno es el prolongado periodo de incubación (Evans, 2007; Phillips et al., 2007).
Los resultados de los tratamientos sobre la incidencia de moniliasis en los frutos de cacao mostraron menores porcentajes en lo tratamientos con los antagonistas, durante las dos primeras semanas, después de la aparición de los síntomas, sin diferencia estadística frente al control. Aunque las diferencias no alcanzaron los niveles de significación se destaca que la menor incidencia ocurrió en los frutos inoculados con el hongo antagonista H20 (T2), aislamiento que en condiciones in vitro inhibió por completo el crecimiento y esporulación de M. roreri (Villamil et al., 2012). A partir de la tercera semana la incidencia de moniliasis fue del 100% en todos los tratamientos, independientemente de la presencia de antagonista.
Severidad externa. El menor porcentaje de severidad externa se encontró en los frutos inoculados con el antagonista H20 (T2). Las diferencias en cuanto a la severidad externa entre el tratamiento T2 y el testigo (T4) fueron significativas durante las seis semanas del estudio y frente a los otros dos antagonistas, a partir de la semana 3. Entre los tratamientos T1 (hongo H5) y T3 (bacteria B3) no se presentaron diferencias significativas en el tiempo del estudio, pero los dos también se diferenciaron del testigo (T4), a partir de la semana 4 (Tabla 1). Específicamente, según los datos registrados en la semana 6, al comparar el porcentaje en la disminución del daño externo en los tratamientos con aislamientos antagonistas respecto al control (5,5%), se deduce que el efecto del biocontrol en el T1 fue del 19,5%, en el T2 del 28% y en el T3 del 13,5%. La severidad del daño externo ocasionado por el patógeno en presencia y ausencia de bioantagonistas se puede apreciar en la Figura 1. En general, el incremento de la severidad de la moniliasis en todos los tratamientos podría estar relacionada con el aumento progresivo de la precipitación pluvial y la temperatura ocasionada por las bolsas plásticas empleadas en las pruebas durante el desarrollo del experimento (Tabla 1), lo que generó en el ambiente condiciones de humedad relativa favorables, para el crecimiento y esporulación del patógeno. Esta observación concuerda con Phillips y Wilkinson (2007) y Phillips et al. (2007) quienes afirmaron que el conidio necesita de la presencia de agua para germinar, por lo que la moniliasis se incrementa en los meses de lluvia; en general, el hongo prospera con precipitación anual de 780 a 5.500 mm, temperatura promedio anual de 18,6 a 28 °C y 85% de humedad relativa, condiciones que se corresponden con las óptimas de crecimiento del patógeno.
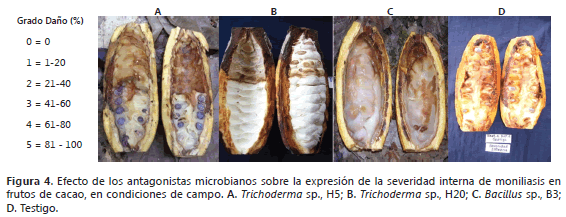
Los frutos inoculados con Trichoderma sp. H5 y Bacillus sp. B3 presentaron el síntoma de mancha de color chocolate, que se hizo mayor en el tejido a medida que aumentó la precipitación, pero no evidenciaron esporulación del patógeno (Figura 1, A y C). Estos resultados están de acuerdo con Infante et al. (2009) y Martinez et al. (2013) quienes registraron que Trichoderma sp. tiene una alta capacidad de competencia por el sustrato.
Respecto a Bacillus sp., Jaimes et al. (2008) y Suárez y Alba (2013) corroboraron que especies de este género pueden inhibir a M. roreri in vitro, mediante la liberación de metabolitos secundarios. Específicamente cepas de B. cereus y B. subtilis han sido utilizadas para el control biológico de Phytophthora spp. tanto in vitro como en suelos infestados con el patógeno (Melnick et al., 2008; Melnick et al., 2011; Acebo et al., 2012; Hernández et al., 2014).
En contraste a los tratamientos T1 y T3, los frutos inoculados con el hongo antagonista H20 (T2), mostraron una disminución considerable en la esporulación del patógeno (Figura 1B). Estos resultados se corroboran con lo expuesto por Torres (2010), quien afirma que un antagonista que inhiba crecimiento micelial, puede reducir la capacidad de M. roreri para infectar el tejido de la planta y causar la enfermedad. Al respecto, Sánchez (2005) informó que Trichoderma sp., presenta alta actividad competitiva frente a M. roreri, lo que tiene importancia especialmente en la fase saprofita ya que impide su desarrollo en el mismo sustrato. El hongo Trichoderma sp. produce enzimas como viridin, trichodermin, exo y endogluconasas, celobiasas, quitinazas y el compuesto 6-pentyl-α-pirona (6PAP), que presenta actividad antifúngica (Martínez et al., 2013). Por su parte, Mejia et al., (2008) y Lopes et al. (2009) encontraron que Trichoderma sp. mostró ser parásito de hifas de Moniliophthora spp. y Phytophthora spp., reportándose como posible agente de control de estos fitopatógenos del cacao. Betalleluz (2003) mencionó que Trichoderma sp. ejerció antagonismo mediante el micoparasitismo y antibiosis contra P. infestans. (Ezziyyani, 2004; Vera et al., 2005; Quiroz y Ferrera, 2008; Reyes, 2008 y Torres et al., 2008) evidenciaron el alto potencial antagónico de Trichoderma spp., como micoparásito, al penetrar y causar lisis del micelio de Sclerotium cepivorum y Rhizotocnia solani en ajo, Sclerotium rolfsii, Phytophthora spp., Rosellinia sp., Fusarium oxysporum, Botrytis cinerea, Verticillium dahliae y Cladosporium fulvum en diferentes cultivos.
La tendencia en la severidad externa del patógeno a través del tiempo mostró que el menor porcentaje de expresión de severidad externa de M. roreri durante las seis semanas del experimento fue el H20, etapa en la que los porcentajes de severidad fueron significativamente los más bajos (Tabla 1).
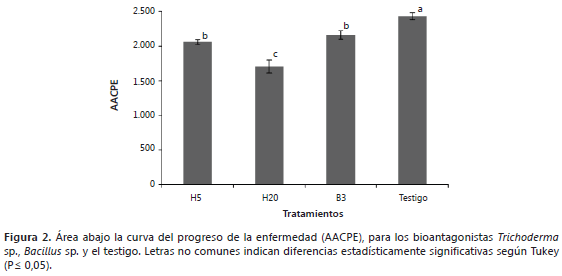
Área abajo la curva del progreso de la enfermedad (AACPE). Los valores del AACPE para cada tratamiento fueron: T1 (H5) 2060, T2 (H20) 1707, T3 (B3) 2161 y T4 (testigo) 2435. Los datos más altos corresponden a los tratamientos con menor efecto de biocontrol sobre la moniliasis. La Figura 2 muestra que el hongo H20 tuvo el mejor efecto antagónico contra M. roreri seguido de los otros dos antagonistas H5 y B3.
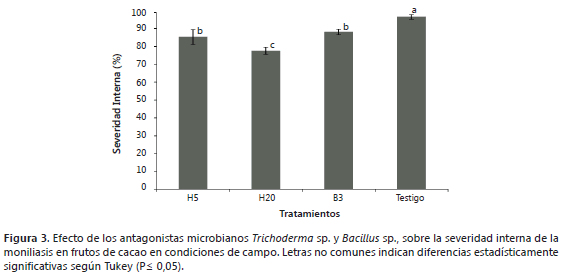
Severidad interna. Los frutos que alcanzaron madurez de consumo presentaron disminución en el número de semillas y anormalidades en su desarrollo (Figura 3), similar a lo observado por Evans (2007) en frutos infectados por M. roreri menores a 2 meses. Estos resultados ratifican que entre los antagonistas evaluados en este estudio, el aislamiento autóctono H20 es el hongo con el mayor potencial de control biológico de este patógeno. Al igual que en el caso de la severidad externa, en este tratamiento se presentó el menor porcentaje de daño interno en los frutos (77,5%) con diferencias significativas respecto al hongo H5 (85,2%), la bacteria B3 (88%) y al testigo (96,5%). Los tratamientos T1 (H5) y T3 (B3) no presentaron diferencias estadísticas entre sí, pero si con el testigo.
Al confrontar la disminución en el porcentaje de daño interno en los tratamientos con los antagonistas respecto al testigo (3,5%), se infiere que el efecto de biocontrol en el T1 (H5) fue de 11,2%, en el T2 (H20) 19,5% y en el T3 (B3) 8,5%. La Figura 4 ilustra la severidad del daño interno ocasionado por el patógeno en los diferentes tratamientos. Como consecuencia de los más bajos porcentajes de daño externo (Tabla 1) e interno (Figura 3) la mayor disminución de daño en los frutos de cacao se registró en el tratamiento T2, lo que demuestra que el aislamiento de Trichoderma sp. H20 tiene capacidad antagónica sobre M. roreri en condiciones de campo. Resultados similares fueron reportados por Benito et al. (2007); Bailey et al. (2008) y Osorio (2010), quienes al evaluar cepas de T. viride, T. Harzianum y T. hamatum, encontraron antagonismo sobre M. roreri in vitro e in situ. Al respecto, Krauss et al. (2010) mencionan que los bioensayos realizados con Trichoderma sp. han sido efectivos y que por su naturaleza, el control biológico no elimina, sino que reduce las poblaciones del patógeno y, como consecuencia, reduce la incidencia de la enfermedad. No obstante; a pesar de las potencialidades de estos antagonistas autóctonos, se debe profundizar en el estudio, usando un mayor número de repeticiones por tratamiento y haciendo aspersiones masivas sobre el dosel de T. cacao, para mejorar su efectividad cuando sean aplicados como inoculantes microbianos.
Lo anterior sugiere que para un mejor aprovechamiento del potencial de control biológico de M. roreri en cacao demostrado en este estudio, especialmente por el hongo H20 (Trichoderma sp.), la aplicación de estos antagonistas microbianos debe integrarse con practicas de prevención de diseminación de la enfermedad como el uso de cortinas rompevientos, desinfección de herramientas, traslado de material vegetal y el trasporte de animales o el mismo hombre entre lotes de cacao (Jaimes y Aranzazu, 2010). Las medidas de control para el manejo integrado de plagas y enfermedades en el cultivo involucran la siembra de materiales genéticos de alta productividad con tolerancia o resistencia parcial a la enfermedad, podas semestrales, regulación del sombrio permanente, manejo trimestral de arvenses, nutrición balanceada con base en análisis de suelos y foliar, sistemas adecuados de drenaje, remoción semanal de frutos enfermos (Rodríguez et al., 2005; Jaimes y Aranzazu, 2010) y la aplicación de la mezcla de fungicidas protectantes (a base de cobre) y sistémicos (i.a.Azoxistrobin) en cultivos altamente productivos (Argüello, 2000; Ayala, 2008; Isai, 2012).
CONCLUSIONES
Los aislados autóctonos Trichoderma sp. H5 y H20 y Bacillus sp. B3 son potencialmente eficientes en el control biológico de Moniliophthora roreri Cif & Par en T. cacao en condiciones de campo, lo que indica que si existen alternativas biológicas para el control de este patógeno.
Trichoderma sp. H20 demuestra tener la mayor capacidad antagónica contra M. roreri al inducir en condiciones de campo los menores porcentajes de severidad externa e interna, la menor área abajo la curva del progreso de la enfermedad y en consecuencia la mayor disminución de daño en los frutos de cacao, por lo que se destaca como un agente con el mayor potencial para el control de dicho patógeno.
Las potencialidades demostradas por estos antagonistas sugieren la necesidad de continuar las evaluaciones a gran escala, en condiciones de campo, utilizando aplicaciones masivas sobre el cultivo, mayor número de repeticiones y esclareciendo los mecanismos a través de los cuales ejercen su acción, para mejorar su efectividad cuando sean aplicados como inoculantes microbianos.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos al equipo de trabajo del Laboratorio de Control Biológico Grupo Manejo Biológico de Cultivos-GMBC, del Programa de Ingeniería Agronómica de la Universidad Pedagógica y Tecnológica de Colombia, sede Tunja, por el apoyo incondicional durante todo el proceso de la investigación y especialmente a los profesores Jorge Velandia, Jorge Orlando Blanco y Donald Riascos por sus valiosos aportes y orientación en la metodología.
BIBLIOGRAFÍA
Agrios, G.N. 2005. Fitopatología. Quinta edición. Limusa, México. D.F. México. 819 p. [ Links ]
Argüello, O. 2000. Manejo integrado de la monilia en cacao (Theobroma cacao L.). pp. 74-84. En: Mejía, L., O. Arguello (ed.). Tecnología para el mejoramiento del sistema de producción de cacao. CORPOICA. Impresores Colombianos, Bucaramanga. 144 p. [ Links ]
Ayala, F. 2008. Manejo integrado de moniliasis (Moniliophthora roreri) en el cultivo de cacao (Theobroma cacao L.) mediante uso de fungicidas, combinado con labores culturales. Guayaquil. Tesis Ingeniero Agropecuario. Facultad de Ingeniería en Mecánica y Ciencias de la Producción. Escuela Superior Politécnica del Litoral. Guayaquil, Ecuador 115 p. [ Links ]
Acebo, Y., A. Hernández, M. Heydrich, M. El Jaziri and A.N. Hernández. 2012. Management of black pod rot in cacao (Theobroma cacao L.): a review. Fruits 67(1): 41-48. [ Links ]
Bernal, A., C. Andreu, M. Moya, M. González y O. Fernández. 2007. Utilización de Trichoderma spp. como alternativa ecológica para control de Fusarium oxysporum Schlecht f. sp cubense (E.F. Smith) Snyd & Hans. Fitosanidad 83: 26-29. [ Links ]
Bailey, B.A., H. Bae, M.D. Strem, J. Crozier, S.E. Thomas, G.J. Samuels, B.T. Vinyard and K.A. Holmes. 2008. Antibiosis, mycoparasitism, and colonization success for endophytic Trichoderma isolates with biological control potential in Theobroma cacao. Biological Control 46(1): 24-35. [ Links ]
Betalleluz, V. 2003. Control en tomate de Phytophthora infestans con los hongos antagonistas Trichoderma harzianum, T. lignorum, T. viride y Gliocladium virens bajo condiciones controladas. Ayacucho. Tesis Licenciatura en Biología. Facultad de Biología Universidad Nacional San Cristóbal de Huamanga. Ayacucho, Perú. 76 p. [ Links ]
Benito, J., E. Arévalo y L. García. 2007. Manejo integrado del cacao para el control de enfermedades con énfasis en monilia. 39 p. En: Memorias Foro Binacional ICT- INIA. Situación actual y perspectivas de investigación en cacao (Theobroma cacao L.) en el Perú. APP Cacao Proyecto INIA/ICT. Perú-Ecuador. [ Links ]
Cárdenas, C y J. Giraldo. 1986. Evaluación de la respuesta de algunos cultivares del cacao (Theobroma cacao L.) a Moniliophthora roreri mediante dos métodos de inoculación en frutos y en semilla en estado radicular. Trabajo de grado Ingeniero Agrónomo. Facultad de Agronomía. Universidad de Caldas. Manizales, Colombia. 107 p. [ Links ]
Federación Nacional de Cacaoteros. FEDECACAO. 2014. Colombia: estadísticas de la producción nacional registrada de cacao en grano. En: http://www.fedecacao.com.co; consulta: agosto 2014. [ Links ]
Evans, H. 2007. Cacao diseases: The trilogy revisited. Phytopathology 97(12): 1640-1643. [ Links ]
Ezziyyani, M. 2004. Biocontrol de Phytophthora capsici en pimiento, con combinación de bioantagonistas. Tesis Doctoral en Biología Vegetal. Facultad de Biología. Universidad de Murcia. Murcia, España. 107 p. [ Links ]
Gómez, K.A. and A.A. Gómez. 1984. Statistical procedures for agricultural research. Second edition. John Wiley and Sons, New York. 680 p. [ Links ]
Howell, C. 2003. Mechanisms employed by Trichoderma species in the biological control of plant diseases: The history and evolution of current concepts. Plant Diseases 87(1): 4-10. [ Links ]
Hoyos, L., P. Chaparro, M. Abramsky, I. Chet y S. Orduz. 2008. Evaluación de aislamientos de Trichoderma spp., contra Rhizoctonia solani y Sclerotium rolfsii bajo condiciones in vitro y de invernadero. Agronomía Colombiana 26(3): 451-458. [ Links ]
Hebbar, P. 2007. Cacao diseases: A global perspective from an industry point view. Phytopathology 97(12): 1658-1663. [ Links ]
Hernández, A., Y. Ruíz, Y. Acebo, Y. Miguélez y M. Heydrich. 2014. Antagonistas microbianos para el manejo de la pudrición negra del fruto en Theobroma cacao L. Estado actual y perspectivas de uso en Cuba. Protección Vegetal 29(1): 11-19. [ Links ]
Isai, Q.D. 2012. Evaluación de fungicidas sistémicos y de contacto en el control de la Moniliasis (Moniliophthora roreri) del cacao (Theobroma cacao L.). Tesis Magister en Ciencias. Posgrado Producción Agroalimentaria en el Trópico. Colegio de Postgraduados. 86 p. [ Links ]
Infante, D., B. Martínez, N. González y Y. Reyes. 2009. Mecanismos de acción Trichoderma frente a hongos fitopatógenos. Protección Vegetal 24(1): 14-21. [ Links ]
Jaimes, Y. y F. Aranzazu. 2010. Manejo de las enfermedades del cacao (Theobroma cacao L.) en Colombia, con énfasis en monilia (Moniliophthora roreri). CORPOICA, Produmedios, Bogotá. 90 p. [ Links ]
Jaimes, A., R. Coronado y Y. Jaimes. 2008. Evaluación in vitro e in vivo de cinco cepas de Bacillus sp. como agentes de biocontrol de Moniliophthora roreri. pp. 26-27. En: Memorias Seminario Internacional de Cacao: Avances de Investigación. Ministerio de Agricultura y Desarrollo Rural. Instituto Colombiano Agropecuario. Federación Nacional de Cacaoteros. Bucaramanga, Colombia. [ Links ]
Krauss, U., E. Hidalgo, R. Bateman, V. Adonijah, C. Arroyo, J. García, J. Crozier, N.A. Brown, G. M. ten Hoopen and K. Holmes. 2010. Improving the formulation and timing of application of endophytic biocontrol and chemical agents against frosty pod rot (Moniliophthora roreri) in cocoa (Theobroma cacao). Biological Control 54(3): 230-240. [ Links ]
Lopes, L.L., A. Carvalho, G. Rocha, J.T. De Souza and A.W. Villela. 2009. Selection of Trichoderma stromaticum isolates for efficient biological control of witches broom disease in cacao. Biological Control 51(1): 130-139. [ Links ]
Medeiros, F.H., A.W. Pomella, J.T. de Souza, G.R. Niella, R. Valle, R.P. Bateman, D. Fravel, B. Vinyard and P.K. Hebbar. 2010. A novel, integrated method for management of witches broom disease in cacao in Bahia, Brazil. Crop Protection 29(7): 704-711. [ Links ]
Melnick, R.L, C. Suárez, B.A. Bailey and P.A. Backman. 2011. Isolation of endophytic endospore-forming bacteria from Theobroma cacao as potential biological control agents of cacao diseases. Biological Control (57)3: 236-245. [ Links ]
Martínez, B., D. Infante y Y. Reyes. 2013. Trichoderma spp. y su función en el control de plagas en los cultivos. Protección Vegetal 28(1): 1-11. [ Links ]
Mejía, L.C., E.I. Rojas, Z. Maynard, S. Van Bael, A.E. Arnold, P. Hebbar, G.J. Samuels, N. Robbins and E.A. Herre. 2008. Endophytic fungi as biocontrol agents of Theobroma cacao L. pathogens. Biological Control 46(1): 4-14. [ Links ]
Melnick, R., N. Zidack, B. Bailey, S. Maximova, M. Guiltinan and P. Backman. 2008. Bacterial endophytes: Bacillus spp. from annual crops as potential biological control agents of black pod rot of cacao. Biological Control 46(1): 46-56. [ Links ]
Martínez, B., Y. Reyes, D. Infante, E. González, H. Baños y A. Cruz. 2008. Selección de aislamientos de Trichoderma spp. candidatos a biofungicidas para el control de Rhizoctonia sp. en arroz. Protección Vegetal 23(2): 118-125. [ Links ]
Osorio, R. 2010. Estudio del efecto de Trichoderma harzianum en el control de Moniliophthora roreri en plantas de Theobroma cacao en la provincia de Esmeraldas. Quito. Tesis ingeniero Agro industrial. Escuela Politécnica Nacional. Facultad de Ingeniería Química y Agroindustrial. 125 p. [ Links ]
Pérez, W. y G. Forbes. 2008. Manual Técnico. El Tizón Tardío de la papa. Centro Internacional de la Papa (CIP). Comercial Grafica Sucre, Lima, Perú. 12 p. [ Links ]
Phillips, W., M. Aimes and M. Wilkinson. 2007. Biodiversity and biogeography of the cacao (Theobroma cacao) pathogen Moniliophthora roreri in tropical America. Plant Pathology 56(6): 911-922. [ Links ]
Phillips, W and M. Wilkinson. 2007. Frosty pod of cacao: A disease with limited geographic range but unlimited potential for damage. Phytopathology 97(12): 1644-1647. [ Links ]
Quiroz, V. y C. Ferrera. 2008. Antagonismo in vitro de cepas de Aspergillus y Trichoderma hacia hongos filamentosos que afectan al cultivo del ajo. Revista Mexicana de Micología 26: 27-34. [ Links ]
Reyes, Y., B. Martínez y D. Infante. 2008. Evaluación de la actividad antagónica de trece aislamientos de Trichoderma spp. sobre Rhizoctonia sp. Protección Vegetal 23(2): 112-117. [ Links ]
Rodríguez, E., J. Mujica y G. Cubillos. 2005. Manejo integrado de la moniliasis en el cultivo del cacao. Corpoica, Bucaramanga. 25 p. [ Links ]
Rodríguez, J.E., J. Velandia y S.E. Viteri. 2010. Evaluación de microorganismos aislados de gallinaza por su potencial para el biocontrol de fusarium (F. oxysporum) en plántulas de uchuva (Physalis peruviana). Revista Facultad Nacional de Agronomía Medellín 63(2): 5499-5509. [ Links ]
Suárez, C. 1972. Mecanismo de penetración y proceso de infección de Moniliophthora roreri en frutos de cacao (Theobroma cacao L.). pp. 506-510. En: Memorias IV Conferencia Internacional de Investigaciones en Cacao. Trinidad y Tobago. [ Links ]
Suárez, L y C. Cabrales. 2008. Identificación de las especies de cepas nativas de Trichoderma sp., y Bacillus sp., y evaluación de su potencial antagonista in vitro frente al hongo fitopatógeno nativo M. roreri en el departamento de Norte de Santander. Revista de la Universidad Francisco de Paula Santander 13(1): 45-56. [ Links ]
Sánchez, M. 2005. Efecto antagónico de Trichoderma harzianum y Trichoderma viride sobre Moniliophthora roreri Cif & Par en cacao. Ucayali. Tesis de Agronomía. Facultad de Ciencias Agropecuarias. Universidad Nacional de Ucayali. Pucallpa, Perú. 55 p. [ Links ]
Shoresh, M., G. Harman and F. Mastouri. 2010. Induced systemic resistance and plant responses to fungal biocontrol agents. Phytopathology 48: 21-43. [ Links ]
Shaner, G. and R.E. Finney. 1977. The effect of nitrogen fertilization on the expression of slow-mildewing resistance in Knox wheat. Phytopathology 67: 1051-1056. [ Links ]
Suárez, L. y R. Alba. 2013. Aislamiento de microorganismos para el control biológico de Moniliophthora roreri. Acta Agronómica 62(4): 370-378. [ Links ]
Singh, J.S., V.C. Pandey and D.P. Singh. 2011. Efficient soil microorganisms: A new dimension for sustainable agriculture and environmental development. Agriculture, Ecosystems and Environment 140(3-4): 339-353. [ Links ]
Torres, E., J. Iannacone y H. Gómez. 2008. Biocontrol del moho foliar del tomate Cladosporium fulvum empleando cuatro hongos antagonistas. Bragantia 67(1): 169-178. [ Links ]
Torres, M. 2010. Progreso temporal y manejo integrado de la moniliasis [Moniliophthora roreri (Cif y Par.) Evans et al.] del cacao (Theobroma cacao L.) en Tabasco, México. Tesis doctorado en Fitosanidad-Fitopatología. Colegio de Postgraduados. Texcoco, México. 99 p. [ Links ]
Tchameni, S.N., M.E. Ngonkeu, B.A. Begoude, L. Wakam, R. Fokom, A.D. Owona, J.B. Mbarga, T. Tchana, P.R. Tondje, F.X. Etoa and J. Kuaté. 2011. Effect of Trichoderma asperellum and arbuscular mycorrhizal fungi on cacao growth and resistance against black pod disease. Crop Protection 30(10): 1321-1327. [ Links ]
Villamil, J. 2011. Evaluación de hongos y bacterias en la capacidad antagónica a monilia (Moniliophthora roreri) en cacao (Theobroma cacao L.) in vitro y en campo. Trabajo de grado Ingeniero Agrónomo. Facultad de Ciencias Agropecuarias. Universidad Pedagógica y Tecnológica de Colombia. Tunja. 78 p. [ Links ]
Vera, R., B. Moreno, R. Acevedo y E. Trujillo. 2005. Caracterización de aislamientos de Trichoderma spp., por tipo de antagonismo y electroforesis de isoenzimas. Revista Fitopatología Venezolana 18(1): 1-7. [ Links ]
Villamil, J., J. Blanco y S. Viteri. 2012. Evaluación in vitro de microorganismos nativos por su antagonismo contra Moniliophthora roreri Cif & Par en cacao (Theobroma cacao L.). Revista Facultad Nacional de Agronomía Medellín 65(1): 6305-6315. [ Links ]
Vinale, F., K. Sivasithamparam, E. Ghisalberti, R. Marra, L. Woo and M. Lorito. 2008. Trichoderma-plant-pathogen interactions. Soil Biology and Biochemistry 40(1): 1-10. [ Links ]
Vinale, F., R. Marra, F. Scala, L. Ghisalberti, M. Lorito and K. Sivasithamparam. 2006. Major secondary metabolites produced by two commercial Trichoderma strains active againt different phytopatogens. Letters in Applied Microbiology 43(2): 143-148. [ Links ]