Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.68 no.1 Medellín Jan./June 2015
https://doi.org/10.15446/rfnam.v68n1.47832
Inoculación de Cilantro (Coriandrum sativum L.) con Rizobacterias en Villa del Rosario, Norte de Santander
Inoculation of Cilantro (Coriandrum sativum L.) with Rhizobacterias in Villa del Rosario, Norte de Santander
Katherine Carrillo Becerra1; Andreína Colmenares2; Lilian Ramírez Caicedo3; Laura Moreno Rozo4 y Diana Cárdenas Caro5
1 Ingeniera Biotecnológica. Universidad Francisco de Paula Santander - Facultad de Ciencias Básicas. Avenida Gran Colombia No. 12E-96, San José de Cúcuta, Colombia. <katherine6@hotmail.com>
2 Ingeniera Biotecnológica. Universidad Francisco de Paula Santander - Facultad de Ciencias Básicas. Avenida Gran Colombia No. 12E-96, San José de Cúcuta, Colombia. <andreinacol@hotmail.com>
3 Profesora Catedrática. Universidad Francisco de Paula Santander - Departamento de Ciencias del Medio Ambiente - Grupo de Investigación Ambiente y Vida. Avenida Gran Colombia No. 12E-96, San José de Cúcuta, Colombia. <lili_biotecnology@yahoo.es>
4 Profesora Asociada. Universidad Francisco de Paula Santander - Departamento de Biología. Avenida Gran Colombia No. 12E-96, San José de Cúcuta, Colombia. <lauramoreno_08@hotmail.com>
5 Profesora Auxiliar. Universidad Francisco de Paula Santander - Departamento de Biología. Avenida Gran Colombia No. 12E-96, San José de Cúcuta, Colombia. <diana.cardenascaro@hotmail.com>
Recibido: Noviembre 14 de 2012; Aceptado: Agosto 02 de 2013.
doi: http://dx.doi.org/10.15446/rfnam.v68n1.47832
Resumen. Las rizobacterias promotoras de crecimiento vegetal representan una alternativa de biofertilización. En este estudio se evaluó el efecto de su inoculación en plantas de cilantro y la utilización de la práctica de quema de cascarilla de arroz en la preparación del suelo para el establecimiento del cultivo. Se empleó un diseño experimental en parcelas divididas donde, las parcelas principales correspondieron a la preparación del suelo con quema de cascarilla de arroz y sin quema con la inoculación previa de Trichoderma sp. Las subparcelas eran los tratamientos con la inoculación simple y en co-inoculación de Azospirillum RzH132 y Azotobacter RzH120 y los testigos absoluto y químico. Una vez se comprobaron los supuestos en los residuales del modelo, normalidad, homogeneidad de varianzas y aleatoriedad, se realizó el análisis de varianza y pruebas de comparación múltiple por el test de Tukey y un análisis de componentes principales como técnica de reducción de dimensiones. Los resultados mostraron un efecto positivo en el crecimiento de las plantas inoculadas con las rizobacterias en las dos parcelas con quema y sin quema de cascarilla de arroz; sin embargo, en la variable rendimiento no se obtuvieron diferencias significativas (P≤0,05). Así mismo, se encontró que la población de bacterias rizosféricas en los medios de cultivo NFb semisólido, Ashby y King B, se vio favorecida por la no quema de cascarilla de arroz en el suelo. Es importante resaltar que los resultados se obtuvieron con la disminución al 30% de la fertilización química, con lo cual se puede reducir el uso de estos productos químicos.
Palabras clave: Azotobacter, Azospirillum, inoculante biológico, manejo del suelo.
Abstract. Plant growth promoting rhizobacteria (PGPR) represent an alternative biofertilization form. In this study, was evaluated PGPR inoculation in cilantro plants. Likewise, was evaluated the practice of burning rice husk in soil preparation for crop establishment. An experimental design was used in a split plot where the main plots were soil preparation with burning rice husk and without burning rice husk with prior inoculation of Trichoderma sp. The subplots correspond to treatments with simple inoculation and co-inoculation of Azotobacter RzH120 and Azospirillum RzH132 and chemical and absolute control. Once the assumptions were tested in model residuals, normality, homogeneity of variance and randomness, an analysis of variance and multiple comparison tests by Tukey's test and principal component analysis technique was performed as size reduction. According to principal component analysis, the results showed a positive effect on the growth of plants inoculated with PGPR in the two plots with burning and without burning rice husk, however, the variable yield (P≤0.05). Also, it was found that the population of bacteria in the rhizosphere culture media NFb semisolid, Ashby and King B, was not favored by the burning of rice husks on the soil. Importantly, the results were obtained with the 30% decrease in the chemical fertilizer, which can reduce the use of these chemicals.
Key words: Azotobacter, Azospirillum, biological inoculant, soil management.
El cultivo de hortalizas en el país tiene una participación de 6,3% del total de área sembrada de uso agrícola representada en 30.239 ha plantadas y una producción de 342.916 t (DANE, 2014). Norte de Santander esta entre los departamentos de mayor importancia en la producción de hortalizas, sobresaliendo en el segundo puesto con el cultivo de tomate y cimarrón, con el tercer puesto con los cultivos de cebolla, acelga, apio, aromáticas, brócoli, coliflor y espinaca y el cuarto productor de ajo, cilantro, haba, lechuga y remolacha (Ministerio de Comercio, Industria y Turismo, 2013). En el municipio de Villa del Rosario, Los principales cultivos transitorios son cilantro, cimarrón, espinaca, habichuela, lechuga, maíz, plantas aromáticas, tomate, arroz, pimentón y tabaco rubio (Ministerio del Trabajo, 2013), la producción agrícola en su mayoría es realizada por pequeños y medianos productores, se basa en el esquema convencional de agricultura con una alta dependencia de insumos químicos, además incluye la realización de prácticas nocivas para el ecosistema, como la quema de cascarilla de arroz para la reducción de problemas fitosanitarios especialmente en el establecimiento del cultivo de cilantro.
Esta forma tradicional extractiva de los cultivos no permite que se recupere la capacidad productiva del suelo ya que, por tratarse de cultivos de ciclo corto, el tiempo transcurrido entre períodos de una nueva quema de cascarilla en el suelo, oscila entre 4 y 10 meses. Lo anterior, implica un aumento significativo en los costos de producción especialmente por la quema de cascarilla de arroz y los fertilizantes químicos utilizados para suplir la deficiencia de nutrientes. Hasta el momento, en estos cultivos de hortalizas, sólo se ha utilizado la incorporación de abonos orgánicos como un componente de buenas prácticas agrícolas, sin tener presente que existe una gran diversidad de microorganismos que pueden mejorar la situación actual de los suelos, actuando como movilizadores de minerales, descomponedores de materia orgánica, fijadores de nitrógeno, productores de fitohormonas, sideróforos y otros compuestos que promueven el crecimiento de las plantas.
Las hortalizas son uno de los productos del sector agroindustrial contemplado en las Apuestas Productivas, con las cuales se tiene como objetivo posicionar a Norte de Santander como el segundo departamento productor en Colombia (DNP, 2007) el sector horticultor de esta región del país, por lo que deberá incursionar en estrategias que le permitan aumentar sus áreas sembradas, diversificar la producción, mejorar las tecnologías de riego, seleccionar semillas e incorporar prácticas de fitoprotección, biofertilización y manejo integrado de cultivos, para sobresalir en rendimientos y calidad de estos productos que son de consumo directo y que deben presentar características de inocuidad para satisfacer el mercado regional, nacional e internacional.
De esta forma, el uso racional de los recursos biológicos de los suelos, como las rizobacterias promotoras del crecimiento vegetal, asociadas a los cultivos regionales que pueden actuar como biofertilizantes, es considerado como una alternativa para mejorar su productividad (Montañez et al., 2012). En consideración a que estos microorganismos se encuentran adaptados a las condiciones ambientales de los suelos donde serán posteriormente inoculados (Käragoz et al., 2012), su utilización permitirá el desarrollo de los cultivos de hortalizas, la protección de la salud humana y el medio ambiente en el corregimiento de Juan Frío, Villa del Rosario (Norte de Santander), por lo que esta investigación tuvo como objetivo evaluar el efecto en el crecimiento vegetal, rendimiento y población bacteriana rizosférica, por la inoculación con rizobacterias de los géneros Azospirillum y Azotobacter en parcelas experimentales cultivadas con cilantro.
MATERIALES Y MÉTODOS
Microorganismos evaluados. Se utilizaron dos aislados de rizobacterias de los géneros Azospirillum RzH132 y Azotobacter RzH120, asociados a cultivos de hortalizas de Villa del Rosario, conservados en el Banco de Cepas del Laboratorio de Investigaciones en Microbiología y Genética Molecular de la Universidad Francisco de Paula Santander. Las cepas, se activaron en Agar Batata, Agar Ashby según los géneros Azospirillum y Azotobacter, respectivamente y se incubaron a 32 °C. Una vez obtenidos los cultivos viables se realizó un Banco de Trabajo de 4 cajas Petri por cada microorganismo, posteriormente se obtuvo una suspensión celular en solución salina estéril de cada una de las rizobacterias. Se tomaron 100 µL de esta suspensión celular obtenida y se inocularon 50 mL de caldo DYGS. Los cultivos se incubaron en agitación durante 48 h a 120 rpm y 32 oC. La concentración celular se ajustó a una densidad óptica de 0.5 a 600 nm en un espectrofotómetro Spectroquant® NOVA 60.
Evaluación en parcelas experimentales. La evaluación de las bacterias promotoras de crecimiento en parcelas experimentales de cilantro se realizó en el municipio de Villa de Rosario, Corregimiento de Juan Frío, en predios de la Finca Villa Fabiola (N 07°47'30.6"; W 072°28'25.7"; msnm: 491 m). Se seleccionó un terreno con un área de 64 m2 en el que se realizaron las debidas prácticas culturales antes del establecimiento de la investigación. Posteriormente, se realizó el muestreo del suelo para el análisis fisicoquímico, establecer la presencia de Fusarium spp. utilizando el cultivo en agar PDA, de nematodos según el protocolo de Bearmann y la determinación de microlepidópteros por la observación directa en el estereoscopio.
Se empleó un diseño experimental en parcelas divididas donde las parcelas principales correspondieron a la preparación del suelo con quema de cascarilla de arroz y sin quema de cascarilla de arroz. Las subparcelas correspondieron a los tratamientos con la inoculación de las rizobacterias Azospirillum sp. RzH132 + 30% de fertilización química, Azotobacter sp. RzH120 + 30% de fertilización química y la coinoculación con Azospirillum sp. RzH132 + Azotobacter sp. RzH120 + 30% de fertilización química. Se compararon con un testigo absoluto y testigo químico (100% de fertilización química). Cada tratamiento constó de tres repeticiones.
Se diferenciaron dos áreas en partes iguales dejando un espacio de 1 m entre ellas, para conformar las parcelas principales del diseño experimental. Posteriormente, se procedió a realizar la quema de cascarilla de arroz sobre una de las parcelas principales y en la otra se inoculó una suspensión de Trichoderma sp. en una dosis de 500 g/100 L con una concentración de (108 conidios viables/g de producto formulado en gránulos dispersables), como medida de biocontrol de hongos patógenos. Este inoculante se dejó actuar durante 15 días, lo cual reemplaza la técnica de la quema de cascarilla de arroz en el suelo. Estas dos parcelas se subdividieron en 15 subparcelas con una dimensión de 1,80 m x 1,20 m y con una altura ± 0,30 m. Las unidades correspondieron a los tratamientos de inoculación de las rizobacterias y sus testigos con tres repeticiones. La siembra de la semilla, se realizó por el método del "voleo" más la aplicación de los respectivos tratamientos con las rizobacterias. Para cada subparcela se usó un volumen de 43,3 mL del inoculante bacteriano, correspondiente a una dosis de 1 L ha-1, únicamente en las parcelas que lo requerían según el diseño experimental.
Los fertilizantes químicos se aplicaron 3 días después de la germinación, en una proporción del 30% lo que equivale a 24 g de Triple 15 (NPK) por subparcela exceptuando los testigos químicos, a los que se les adicionó el 100% del fertilizante, es decir, 80 g de Triple 15 (NPK).
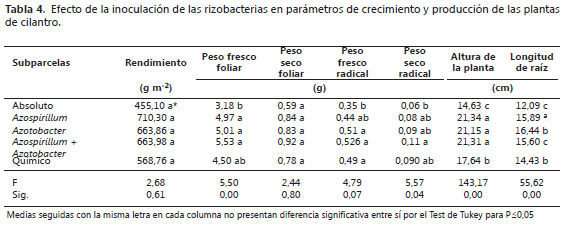
Transcurridos 45 días de habersen establecido los tratamientos, se midieron en las plantas de cilantro las variables peso fresco y seco radical, peso fresco y seco foliar, altura de la planta, longitud radical, rendimiento del cultivo (peso de las plantas con respecto al área de la unidad experimental g m-2). También se realizó el recuento de la población bacteriana en medio semisólido NFb, agar Ashby, agar SRSM y en agar King B.
Análisis estadístico. Se determinaron los supuestos en los residuales del modelo, normalidad, homogeneidad de varianzas y aleatoriedad. Una vez se comprobaron estos supuestos, se efectuó el análisis de varianza y pruebas de comparación múltiple por el test de Tukey con 0,05 de significancia y un análisis de componentes principales como técnica de reducción de dimensiones. Se utilizó el programa estadístico IBM SPSS Statistics 19.
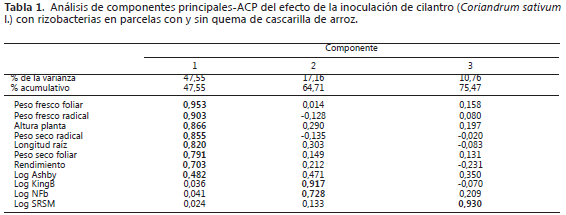
RESULTADOS Y DISCUSIÓN
El análisis multivariado obtenido explicó un 75,47% de la variabilidad del experimento. Este análisis permitió correlacionar la primera componente principal y se denominó Factor Crecimiento de la planta y explica por sí sola el 47,55% de la variabilidad del experimento (Tabla 1). De las 11 variables estudiadas, siete quedaron incluidas en esta componente (PC1) y correspondieron a peso fresco y seco radical, peso fresco y seco foliar, altura de la planta, longitud radical y rendimiento del cultivo. La segunda componente (PC2) contiene tres variables que demuestran el efecto sobre poblaciones microbianas que se denominó Factor efecto sobre poblaciones bacterianas rizosféricas y explica el 17,16% de la variabilidad del experimento. La última componente explicó el 10,76% de la variabilidad del experimento y se denominó efecto sobre la población de bacterias rizosféricas con potencial fosfatodisolvente.
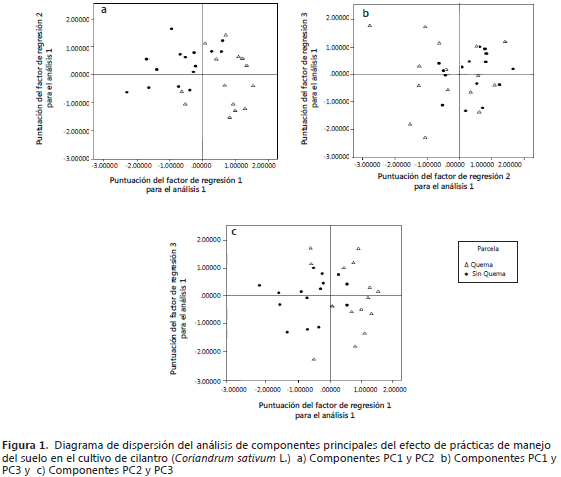
Efecto de la quema de cascarilla de arroz en el crecimiento de las plantas de cilantro. En las parcelas donde se realizó la quema de cascarilla de arroz, se registró un aumento en el crecimiento de las plantas (Figura 1a). Esta parcela se ubicó hacia el lado positivo de la componente 1 (PC1). Un efecto contrario que indica la disminución del crecimiento de las plantas de cilantro, se observó en la parcela donde no se realizó la quema de cascarilla de arroz. Sin embargo, la población de bacterias rizosféricas en los medios de cultivo NFb semisólido, Ashby y King B (PC2), se vio favorecida por la no quema de cascarilla de arroz en el suelo (Figura 1b). Con respecto a la población bacteriana en agar SRSM que representa la componente 3 (PC3), se observó que no hubo una tendencia definida debido a que sin la quema las poblaciones microbianas favorecen su desarrollo y en presencia de la quema, las cenizas aportan fosfatos insolubles que pueden aumentar la actividad fosfato disolvente que se determina en el agar SRSM (Figura 1c).
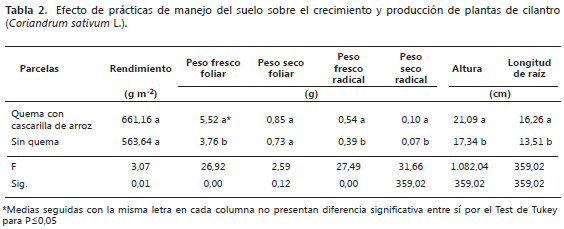
El análisis de varianza mostró diferencias significativas entre las parcelas principales (Quema y Sin Quema) en las variables de peso fresco foliar, peso fresco radical, altura de las plantas y longitud de las raíces. Por su parte, el rendimiento y el peso seco foliar no presentaron diferencias significativas (P≤0,05) (Tabla 2).
Las variables de peso fresco foliar, peso fresco y seco radical, altura y longitud de raíz, mostraron valores superiores en las parcelas donde se quemó la cascarilla de arroz en la preparación del suelo. Sin embargo, se evidenció que las plantas cultivadas en las parcelas sin quema desarrollaron tallos más gruesos y su color verde fue más intenso y por tanto pueden ser plantas más atractivas al consumidor.
Los resultados sugieren que, aunque la quema de biomasa sobre los suelos agrícolas es una práctica tradicional en la preparación de los suelos (Jiménez et al., 2007; Aboim, et al., 2008); sin embargo, no significa que sea adecuada puesto que ocasiona efectos negativos sobre las propiedades de los suelos (Hebel et al., 2009; Dias et al., 2010). En el municipio de Villa del Rosario (Norte de Santander), los horticultores realizan dicha práctica cada vez que se prepara el suelo para la siembra de cilantro, con el objetivo de disminuir los problemas fitosanitarios y mejorar el crecimiento y desarrollo de las plantas; ya que si no se realiza, las plantas mueren entre el tercer y quinto día después de la germinación. Los resultados de este estudio mostraron que las plantas podrían establecerse y desarrollarse sin realizar la práctica de quema de cascarilla de arroz. Aunque las plantas se desarrollaron en las dos parcelas, las gráficas de dispersión (Figura 1) mostraron un efecto positivo en aquéllas que fueron cultivadas en la parcela con quema de cascarilla de arroz, específicamente en las variables peso fresco foliar, la longitud de la raíz, peso fresco y seco radical. Este efecto puede atribuirse a la disponibilidad de formas asimilables de nutrientes como P, N, Mg, K y Ca, ya que después de la quema de material vegetal en el suelo, estos pueden permanecer en las cenizas (Kallinhoff et al., 2009; Scharenbroch et al., 2012), lo cual podría explicar que en el primer ciclo de cultivo de cilantro, las plantas tienen disponibles estos nutrientes y por tanto se favorece su crecimiento y desarrollo.
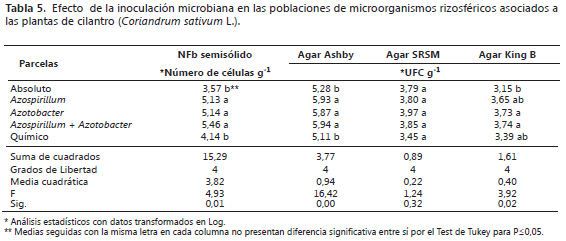
Sin embargo, se observó el mayor desarrollo de raíces laterales y secundarias en las plantas cultivadas en suelo sin quema de biomasa, probablemente favorecido por el aumento de la población de rizobacterias microaerofílicas, que fueron registradas en el medio de cultivo NFb semisólido, la cual fue significativamente superior con respecto a las parcelas donde se quemó la cascarilla de arroz (Tabla 3). Así mismo, se encontró un aumento significativo en el recuento obtenido en el en agar King B, en la parcela sin quema de cascarilla de arroz. Por su parte, en el recuento de población de bacterias en los medios de cultivo Ashby y SRSM, no se encontraron diferencias significativas.
En el medio de cultivo NFb semisólido, se favorece el crecimiento de bacterias microaerofílicas fijadoras de Nitrógeno del género Azospirillum (Döbereiner et al., 1995; Cárdenas et al., 2010; Guzmán et al., 2012), las cuales promueven el desarrollo radical principalmente por la producción de fitohormonas tipo auxinas (Cassán et al., 2008; Sarabia et al., 2010; Bécquer et al., 2012). Esta condición podría haber facilitado la absorción de nutrientes en las plantas cultivadas en la parcela sin quemar y registrar un valor de peso seco foliar similar a las plantas de la parcela con quema de cascarilla. Este efecto de mejoramiento en la absorción de nutrientes por el desarrollo de raíces en plantas inoculadas con respecto a las no inoculadas, ha sido reportado también en plantas de maíz (Wu et al., 2005) inoculadas con Azotobacter chrocooccum y Bacillus subtilis, de rábano (Cordero et al., 2008) inoculadas con Pantoea sp., tomate (Escobar et al., 2011) inoculadas con cepas de Azotobacter spp.
Por su parte, el resultado de la variable rendimiento (g m-2) no mostró diferencias significativas entre las dos parcelas, lo cual indica que este proceso de quema de biomasa no es necesario para aumentar la productividad del cultivo de cilantro por lo que se evitaría la utilización de este tipo de práctica agronómica que afecta los procesos de mineralización y volatilización de nutrientes, contribuye a la pérdida de materia orgánica, desestabilización de agregados y disminución de grupos funcionales microbianos (Aboim et al., 2008; Kumar et al., 2013; McFarland et al., 2013).
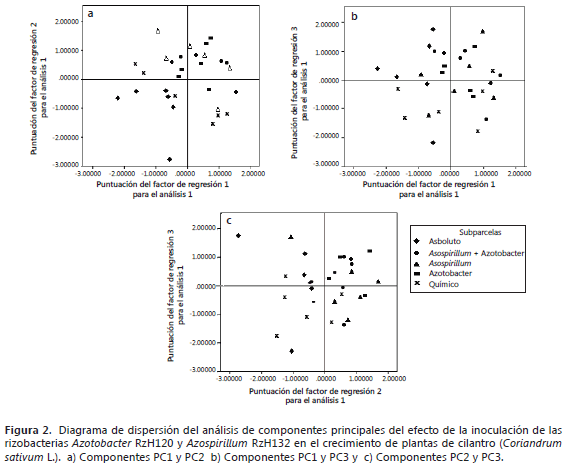
Efecto de la inoculación de rizobacterias sobre el crecimiento de las plantas de cilantro. Cuando se analizaron las subparcelas, la componente 1 (PC1 Factor Crecimiento de la planta) se ubicó en el lado positivo del plano, lo que indica un aumento en las variables del crecimiento de la planta, lo cual fue observado en los tratamientos inoculados y el tratamiento con fertilización química (Figura 2). El tratamiento testigo absoluto registró un efecto negativo sobre las variables de crecimiento vegetal. Así mismo, se observó un efecto negativo de este tratamiento sobre la población de bacterias rizosféricas en los medio de cultivo NFb semisólido, Ashby y King B, los cuales representan la componente 2 (PC2). El tratamiento con fertilización química mostró una tendencia a disminuir la población de bacterias en estos medios de cultivo. Los tratamientos inoculados con rizobacterias registraron un efecto positivo sobre la población bacteriana en los tres medios de cultivo. Con respecto a la PC3 (Población bacteriana en agar SRSM) se encontró una influencia negativa por la fertilización química completa. Los demás tratamientos no mostraron correlación en esta variable.
Cuando se analizaron los efectos entre las subparcelas se encontraron valores superiores significativamente (P≤0,05) en las variables altura de la planta, longitud de la raíz, peso fresco foliar, peso fresco y seco radical en los tratamientos inoculados con las rizobacterias con respecto al testigo absoluto (Tabla 4). Las variables de rendimiento y peso seco foliar no registraron diferencias significativas. Todas las variables presentaron valores similares en las plantas de los tratamientos inoculados a los cuales se les redujo a un 30% de fertilización química con respecto a las del testigo químico (100% fertilización química).
El efecto benéfico de la inoculación de rizobacterias en las variables de crecimiento de las plantas puede atribuirse a la producción de fitohormonas, como las auxinas y giberelinas que promueven el desarrollo radical y caulinar de las plantas (Cassán et al., 2008; Sarabia et al., 2010; Guzmán et al., 2012). Sin embargo, este crecimiento vegetal también es favorecido por la disponibilidad de macronutrientes como el P y el N los cuales pueden mejorar su disponibilidad en el suelo debido a la actividad microbiana (Yu et al., 2012). Teniendo en cuenta, que las rizobacterias inoculadas fueron seleccionadas por su capacidad de fijación biológica de nitrógeno atmosférico y la solubilización de fosfatos inorgánicos (Cárdenas et al., 2013), estos microorganismos probablemente realizaron estas actividades biofertilizantes en el suelo rizosférico de las plantas de cilantro por lo que promovieron su desarrollo radical, mejoraron su capacidad de exploración y toma de agua y nutrientes como lo indicaron Acebo et al. (2007) y Cordero et al. (2008). Lo anterior explica el aumento significativo en las variables peso fresco foliar, peso fresco y seco radical, altura de la planta y longitud de la raíz de las plantas inoculadas, con respecto a las plantas del tratamiento testigo absoluto. Similares resultados fueron obtenidos por Felici et al. (2008), en plantas de soya y maíz en inoculación simple y coinoculacion de Azospirillum brasilense Az39 y Bradirhizobium japonicum E109 (Cassán et al., 2009). Y en plantas de tomate inoculadas con B. subtilis y A. brasilense y con Azotobacter spp. (Escobar et al., 2011). Es importante resaltar, que el comportamiento de estas variables fue similar entre las plantas inoculadas con rizobacterias y aquellas a las que se les aplicó la fertilización química completa (testigo químico), con lo cual se sugiere que al biofertilizar con estas rizobacterias, puede suplirse parcialmente la fertilización química sin afectar significativamente el crecimiento de las plantas de cilantro.
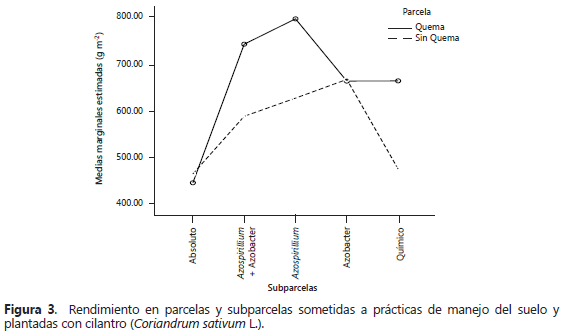
La variable rendimiento no registró diferencias estadísticas entre las subparcelas, aunque las medias registradas en los tratamientos inoculados con rizobacterias fueron superiores a los testigos químicos y absoluto. En la Figura 3, se describe el efecto de la interacción entre las parcelas principales y subparcelas, y se observa que no se registraron diferencias significativas en la variable rendimiento (g m-2) en las parcelas donde se realizó la práctica de la quema de cascarilla de arroz en la preparación de suelos. En las parcelas con quema de cascarilla de arroz, el mejor tratamiento fue el inoculado por el aislado de Azospirillum RzH132 y en las parcelas sin quema de cascarilla el mejor tratamiento resultó el inoculado con Azotobacter RzH120.
Las plantas inoculadas con Azospirillum presentaron un aumento de 255 y 141 g con respecto a los testigos absoluto y químico, respectivamente y la co-inoculación e inoculación simple con Azotobacter de 208 y 95 g con respecto a los testigos absoluto y químico. Este aumento corresponde aproximadamente entre un 14 - 30% comparado con la fertilización química completa, la cual es la que se utiliza actualmente en el cultivo de cilantro en el municipio de Villa del Rosario.
En otras investigaciones también se ha establecido que no existen diferencias significativas estadísticamente en los rendimientos de plantas de trigo inoculadas con A. brasilense y P. fluorescens (Naiman et al., 2009), de arroz inoculadas con A. brasilense (Pedraza et al., 2009) y de maíz inoculadas con A. brasilense (González et al., 2011). Sin embargo, se obtuvieron aumentos entre 13-37,7% en las plantas inoculadas con respecto a los testigos absoluto y químico. De acuerdo con Rodrígues et al. (2005) estos incrementos moderados alrededor de un 20%, aunque no presenten diferencias estadísticas significativas, son considerados comercialmente significativos en la agricultura moderna y en términos económicos y ecológicos, estos resultados son promisorios ya que podría aumentar la relación costo/beneficio del cultivo por la disminución de la aplicación de fertilizantes químicos y la promoción de la conservación de los suelos (García-Olivares et al., 2007; Naiman et al., 2009).
Entre estos aspectos de conservación de suelos, la actividad microbiana tiene un papel muy importante en el ciclaje de nutrientes y el mejoramiento de su disponibilidad para las plantas, en la bioregulación de organismos patógenos por lo que el aumento de su población es favorable para el crecimiento y desarrollo vegetal (Montañez et al., 2012; Käragoz et al., 2012; Yu et al., 2012). Las prácticas agronómicas inadecuadas como el uso excesivo de fertilizantes químicos, pesticidas y la quema de material vegetal afectan negativamente la población microbiana del suelo (Yu et al., 2012; McFarland et al., 2013).
Respecto, al efecto de la inoculación sobre la población de bacterias rizosféricas, se encontraron diferencias significativas en todos los medios de cultivo, excepto en el recuento en agar SRSM (Tabla 5). Los tres tratamientos inoculados mostraron un aumento significativo en la población de bacterias rizosféricas en todos los medios de cultivo, excepto en el agar SRSM, con respecto al testigo absoluto y en el agar Ashby además, se registró diferencia significativa con el testigo químico.
Se observó que, además del efecto sobre el crecimiento de las plantas, la inoculación de rizobacterias, aumentó la población de bacterias en medio de cultivo semisólido NFb y en agar Ashby con respecto a los testigos químico y absoluto lo cual sugiere la influencia de las rizobacterias de los géneros Azospirillum y Azotobacter inoculadas sobre esta población microbiana. Por su parte, la quema de cascarilla de arroz en el suelo, influyó negativamente en la población de rizobacterias determinada en medio semisólido NFb y en agar KingB, pero en los agares SRSM y Ashby no se registraron diferencias entre las dos parcelas con y sin quema. Similares resultados encontraron Oliveira et al. (2009) en la rizósfera de plantas de caña de azúcar inoculadas con bacterias diazotróficas, las cuales aumentaron su población, cuantificada en medios semisólidos NFb, LGI, LGI-P y JMV según los géneros Herbaspirillum, Azospirillum, Gluconacetobacter y Burkholderia. Este efecto de la inoculación microbiana y de la quema de material vegetal sobre la población de microorganismos del suelo, al igual que las propiedades físico químicas, también han mostrado variación en los diferentes estudios, de acuerdo a las características de intensidad del fuego, humedad del suelo, combustibles utilizados, entre otros factores referentes a la quema (García-Villaraco et al., 2009; Zhao et al., 2012; Fontúrbel et al., 2012) y a la capacidad de colonizar las raíces por la rizobacterias inoculadas, la competencia con los microorganismos autóctonos del suelo, la variedad vegetal y sus exudados producidos (McFarland et al., 2013).
CONCLUSIONES
En todas las variables de crecimiento vegetal las plantas de cilantro tuvieron un mejor comportamiento en el área con quema de cascarilla de arroz, sin embargo, en la variable rendimiento no se registraron diferencias significativas, situación que evidencia que no es necesario utilizar esta práctica agrícola para aumentar la productividad del cultivo.
Se encontró un efecto promotor sobre el crecimiento de plantas de cilantro con la inoculación de Azospirillum sp. y Azotobacter sp. en las parcelas con quema de cascarilla de arroz y sin quema, respectivamente. La fertilización química puede reducirse en un 70% y suplementarse con la inoculación simple o co-inoculación con las rizobacterias, lográndose un aumento en el rendimiento entre 14-30% con respecto a la fertilización completa y un testigo absoluto.
La inoculación simple y co-inoculación aumentó la población de rizobacterias en medio semisólido NFb y en agar Ashby, aunque se vieron afectadas con la práctica de la quema de cascarilla de arroz.
AGRADECIMIENTOS
Al Fondo de Investigaciones de la Universidad Francisco de Paula Santander, FINU, por la financiación del proyecto de investigación.
BIBLIOGRAFÍA
Aboim, M.C., H.L. Coutinho, R.S. Peixoto, J.C. Barbosa and A.S. Rosado. 2008. Soil bacterial community structure and soil quality in a slash-and-burn cultivation system in southeastern Brazil. Applied Soil Ecology 38(2): 100-108. [ Links ]
Acebo, Y., N. Rives, M. Heydrich y A. Hernández. 2007. Efecto promotor del crecimiento vegetal de cepas de Azospirillum sp. en el cultivo del Arroz. Cultivos Tropicales 28(3): 29-32. [ Links ]
Bécquer, C,J., G. Lazarovits, L. Nielsen, M. Quintan, M. Adesina, L. Quigley, I. Lalin y C. Ibbotson. 2012. Efecto de la inoculación con bacterias rizosféricas en dos variedades de trigo. Fase II: invernadero. Revista Mexicana de Ciencias Agrícolas 3(5): 985-997. [ Links ]
Cárdenas, D.M., M.F. Garrido, R.R. Bonilla y V.L. Baldani. 2010. Aislamiento e identificación de cepas de Azospirillum sp. en pasto guinea (Panicum maximun Jacq) del valle del Cesar. Pastos y Forrajes 33(3): 285-300. [ Links ]
Cárdenas, D.M., L.T. Ramírez, L.Y. Moreno, Y.K. Carrillo y A. Colmenares. 2013. Caracterización de actividades promotoras del crecimiento vegetal por rizobacterias y su efecto en el cultivo de cilantro (Coriandrum sativum L.). Ecoe Ediciones. Universidad Francisco de Paula Santander, Bogotá. 121 p. [ Links ]
Cassán, F., V. Sgroy, D. Perrig, O. Masciarelli and V. Luna. 2008. Capítulo 4. Producción de fitohormonas por Azospirillum sp. Aspectos fisiológicos y tecnológicos de la promoción del crecimiento vegetal. pp. 61-86. En: Cassan, F.D. and I. Garcia de Salamone (eds.). Azospirillum sp.: cell physiology, plant interactions and agronomic research in Argentina. Asociacion Argentina de Microbiología, Buenos Aires. 276 p. [ Links ]
Cassan, F., D. Perrig, V. Sgroy, O. Masciarelli, C. Penna and V. Luna. 2009. Azospirillum brasilense Az39 and Bradyrhizobium japonicum E109, inoculated singly or in combination promote seed germination and early seedling growth in corn (Zea mayz L.) and soybean (Glycine max L.). European Journal of Soil Biology 45(1): 28-35. [ Links ]
Cordero, J., P. Ortega-Rodés y E. Ortega. 2008. La inoculación de plantas con Patoea sp., bacteria solubilizadora de fosfatos, incrementa la concentración de P en los tejidos foliares. Revista Colombiana de Biotecnologia 10(1): 111-121. [ Links ]
Departamento Administrativo Nacional de Estadísticas, DANE. Encuesta Nacional Agropecuaria - ENA. 2013. En: http://www.dane.gov.co/files/investigaciones/agropecuario/enda/ena/2013/cp_ena_2013.pdf; consulta: octubre 2014. [ Links ]
Departamento Nacional de Planeación (DNP). 2007. Agenda interna para la productividad y la competitividad. Documento regional Norte de Santander. Bogotá, D.C. 52 p. [ Links ]
Dias, J.M., R.S. Oliveira, A.R. Franco, K. Ritz, N. Nunan and P.M. Castro. 2010. Assessment of mycorrizal colonisation and soil nutrients in unmanaged fire-impacted soils from two target restoration sites. Spanish Journal of Agricultural Research 8(S1): S86-S95. [ Links ]
Döbereiner, J., V.L. Baldani e J.I. Baldani. 1995. Como isolar e identificar bactérias diazotróficas de plantas ñao leguminosas. EMBRAPA-SPI. Brazil. 60 p. [ Links ]
Escobar, C., Y. Horna, C. Carreño y G. Mendoza. 2011. Caracterización de cepas nativas de Azotobacter spp. y su efecto en el desarrollo de Lycopersicon esculentum Mill. 'tomate' en Lambayeque Scientia Agropecuaria 2(1): 39-49. [ Links ]
Felici, C., L. Vettori, E. Giraldi, L.M. Costantina, A. Toffanin, A.M. Tagliasacchi and M. Nuti. 2008. Single and co-inoculation of Bacillus subtilis and Azospirillum brasilense on Lycopersion esculentum: Effects on plant growth and rhizosphere microbial community. Applied Soil Ecology 40(2): 260-270. [ Links ]
Fontúrbel, M.T., A. Barreiro, J.A. Vega, A. Martín, E. Jiménez, T. Carballas, C. Fernández and M. Díaz. 2012. Effects of an experimental fire and post-fire stabilization treatments on soil microbial communities. Geoderma 191: 51-60. [ Links ]
García-Olivares, J.G., V.R. Moreno, I.C. Rodríguez, A. Mendoza y N. Mayek. 2007. Efecto de cepas de Azospirillum brasilense en el crecimiento y rendimiento de grano del maíz. Revista Fitotecnia Mexicana 30(3): 305-310. [ Links ]
García-Villaraco, A., A. Probanza, F.J. Gutiérrez, A. Cruz, J.M. Moreno and J.A. Lucas. 2009. Effect of fire and retardant on soil microbial activity and functional diversity in a Mediterranean pasture. Geoderma 153(1-2): 186-193. [ Links ]
Gobierno en Línea del Orden Territorial (GELT). Villa del Rosario, Norte de Santander. En: http://villadelrosario-nortedesantander.gov.co/index.shtml; consulta: octubre 2009. [ Links ]
González, A., D. Pérez, O. Fraco, A. Balbuena, F. Gutiérrez y H. Romero. 2011. Respuesta de tres cultivares de maíz a la inoculación con Azospirillum brasilense bajo cuatro diferentes dosis de nitrógeno. Ciencia Ergo Sum 18(1): 51-58. [ Links ]
Guzmán, A., M. Obando, D. Rivera y R. Bonilla. 2012. Selección y caracterización de rizobacterias promotoras de crecimiento vegetal (RPCV) asociadas al cultivo de algodón (Gossypium hirsutum). Revista Colombiana de Biotecnología 14(1): 182-190. [ Links ]
Hebel, C.L., J.E. Smith and K. Cromack. 2009. Invasive plant species and soil microbial response to wildfire burn severity in the Cascade Range of Oregon. Applied Soil Ecology 42: 150-159. [ Links ]
Jiménez, A.E., M.E. Stromberger, W.J. Massman, J.M. Frank and W.D. Shepperd. 2007. Microbial community structure and activity in a Colorado Rocky Mountain forest soil scarred by slash pile burning. Soil Biology and Biochemistry 39: 1111-1120. [ Links ]
Kalinhoff, C., A. Cáceres y L. Lugo. 2009. Cambios en la biomasa de raíces y micorrizas arbusculares en cultivos itinerantes del Amazonas venezolano. Interciencia 24(8): 571-576. [ Links ]
Karagöz, K., F. Ates¸ H. Karagöz, R. Kotan and R. Çakmakç. 2012. Characterization of plant growth-promoting traits of bacteria isolated from the rhizosphere of grapevine grown in alkaline and acidic soils. European Journal of Soil Biology 50: 144-150. [ Links ]
Kumar, M., M.A. Sheikh, J.A. Bhat and R.W. Bussmann. 2013. Effect of fire on soil nutrients and under storey vegetation in Chir pine forest in Garhwal Himalaya, India. Acta Ecologica Sinica 33(1): 59-63. [ Links ]
McFarland, J.W., M.P. Waldrop and M. Haw. 2013. Extreme CO2 disturbance and the resilience of soil microbial communities. Soil Biology and Biochemistry 65: 274-286. [ Links ]
Ministerio de Comercio, Industria y Turismo. 2013. Departamento Norte de Santander. Oficina de Estudios Económicos. Bogotá, D.C. 30 p. [ Links ]
Ministerio de Trabajo. 2013. Perfil productivo municipio de Villa del Rosario. Insumo para el diseño de las estrategias y alternativas para la generación de empleo a las víctimas de la violencia. Bogotá, D.C. 126 p. [ Links ]
Montañez, A., A. Rodríguez, C. Barlocco, M. Beracochea and M. Sicardi. 2012. Characterization of cultivable putative endophytic plant growth promoting bacteria associated with maize cultivars (Zea mays L.) and their inoculation effects in vitro. Applied Soil Ecology 58: 21-28. [ Links ]
Naiman, A.D., A. Latrónico and I. García. 2009. Inoculation of wheat with Azospirillum brasilense and Pseudomonas fluorescens: Impact on the production and culturable rhizosphere microflora. European Journal of Soil Biology 45: 45-51. [ Links ]
Oliveira, A.L., M. Stoffels, M. Schmid, V.M. Reis, J.I. Baldani and A. Hartmann. 2009. Colonization of sugarcane plantlets by mixed inoculations with diazotrophic bacteria. European Journal of Soil Biology 45(1): 106-113. [ Links ]
Pedraza, R., C. Bellone, S. Carrizo, P. Fernandes, and D. dos Santos. 2009. Azospirillum inoculation and nitrogen fertilization effect on grain yield and on the diversity of endophytic bacteria in the phyllosphere of rice rainfed crop. European Journal of Soil Biology 45(1): 36-43. [ Links ]
Rodrigues, V., S. Santos, V. Polon, J. Guilherme, P. Bolle y A. Parada. 2005. Ocurrencia e efeito de bacterias diazotroficas em genotipos de trigo. Revista Brasileira de Ciência do Solo 29: 345-352. [ Links ]
Sarabia, M., R. Madrigal, M. Martínez y Y. Carreón. 2010. Plantas, hongos micorrizicos y bacterias: su compleja red de interacciones. Biológicas 12(1): 65-71. [ Links ]
Scharenbroch, B.C., B. Nix, K.A. Jacobs and M.L. Bowles. 2012. Two decades of low-severity prescribed fire increases soil nutrient availability in a Midwestern, USA oak (Quercus) forest. Geoderma 183-184: 80-91. [ Links ]
Wu, S.X., Z.H. Cao, Z.G. Li, K.C. Cheung and M.H. Wong. 2005. Effects of biofertilizer containing N-fixer, P and K solubilizers and AM fungi on maize growth: a greenhouse trial. Geoderma 125(S 1-2): 155-166. [ Links ]
Yu, X., X. Liu, T.H. Zhu, G.H. Liu and C. Mao. 2012. Co-inoculation with phosphate-solubilzing and nitrogen-fixing bacteria on solubilization of rock phosphate and their effect on growth promotion and nutrient uptake by walnut. European Journal of Soil Biology 50: 112-117. [ Links ]
Zhao, H., D.Q. Tong, Q. Lin, X. Lu and G. Wang. 2012. Effect of fires on soil organic carbon pool and mineralization in a northeastern China wetland. Geoderma 189-19. [ Links ]