Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actualidades Biológicas
versión impresa ISSN 0304-3584
Actu Biol v.29 n.86 Medellín ene./jun. 2007
ARTÍCULOS IV CONGRESO COLOMBIANO DE BOTÁNICA
LAS PLANTAS ACUÁTICAS EN EL SISTEMA LACUSTRE–RIBERINO LAGARTOCOCHA, RESERVA DE PRODUCCIÓN FAUNÍSTICA CUYABENO, ECUADOR
THE AQUATIC PLANTS OF LAGARTOCOCHA'S LACUSTRINE–RIVERINE SYSTEM, AT THE RESERVE FOR FAUNISTIC BREEDING OF CUYABENO, ECUADOR
Esteban Terneus1
1 Fundación AGUA. Casilla: 17–26–098, Tumbaco. Quito, Ecuador. Correo electrónico: <esteban@fagua.org>.
Resumen
Se realizó una evaluación de la composición florística de las plantas acuáticas vasculares en el sistema lacustre–riberino Lagartococha, de la Reserva de Producción Faunística Cuyabeno (RPFC), en la Amazonía ecuatoriana. Los objetivos del estudio fueron investigar la composición y estructura de la vegetación acuática dentro del sistema, con miras a identificar objetos de conservación para monitoreos posteriores, y determinar las preferencias de hábitat de las especies usando análisis de estadística no paramétrica. Se establecieron 28 transectos a lo largo del sistema, los mismos que fueron ubicados sobre los diferentes tipos de vegetación. Se analizaron las similitudes en la distribución de las especies con el índice de Jaccard, mientras que las similitudes en los patrones de cobertura se analizaron con el índice de Steinhaus. La variación de los parámetros ambientales en los puntos de muestreo fue confrontada con un análisis de componentes principales (PCA). Se identificaron tres tipos de vegetación: gramalote, dominante en ambientes lóticos (río y meandros); mandial, presente únicamente en las lagunas de Delfincocha e Imuya; y la vegetación de rivera, común en la mayoría de ambientes lénticos (lagunas). Se identificaron 28 especies de plantas acuáticas entre tolerantes (helófitas) y estrictas (hidrófitas), de las cuales únicamente cinco tienen amplia distribución dentro del sistema y tres se encuentran restringidas a un solo tipo de ambiente. Se registraron cuatro formas de vida: las plantas enraizadas flotantes, que dominan (43% de las especies), las enraizadas emergentes (32%), las flotantes libres (14%) y las enraizadas sumergidas (11%). Por la riqueza de especies y los diferentes tipos de vegetación presentes en las lagunas de Imuya y Delfincocha es necesario considerar estos ambientes como objetos de conservación, tomando en cuenta que existen además pequeñas poblaciones de Cabomba furcata Schult. & Schult. f, (Cabombaceae), Hydrocotyle ranunculoides L. f. (Apiaceae) y Najas arguta Kunth (Najadaceae) creciendo en estas dos lagunas y consecuentemente podrían ser los únicos registros dentro del sistema.
Palabras clave: cobertura, gramalote, lagunas, mandial, rivera, vegetación acuática
Abstract
An assessment of floristic assemblage of aquatic vascular plants was carried out in the Lagartococha riberine system of the Reserva de Producción Faunística Cuyabeno (RPFC) in the Amazon basin of Ecuador. The aims of the study were to determine the structure and composition of aquatic vegetation within riparian environments, aimed to recognize conservation targets for monitoring programs and identify the species habitat preferences applying non parametric statistic analysis. Twenty eight transects were established across the riverine system, located over different types of vegetation. The similarities in aquatic plants distribution were analysed with Jaccard Index, while the similarities of cover patterns were analysed by Steinhaus Index. The changing patterns of environment conditions in the sampling places were correlated by a Principal Component Analysis. Three kinds of vegetation were determined: gramalote, dominant in lotic environments; mandial, growing only in Delfincocha and Imuya lakes and riparian vegetation spread along the most lentic environments (lakes). Twenty eight aquatic vascular plants were recorded including amphibians and submersed life forms. Only five species have widespread distribution across the river system and three species were restricted to one kind of environment. Four life forms were recorded: the rooted floating plants, which are dominants (43% of the overall species), the emergent rooted plants (32%), the free floating plants (14%) and the submersed rooted plants (11%). According with the species richness and the different kinds of vegetation which are growing in Delfincocha and Imuya lakes is necessary to consider those environments as a priority target of conservation in the area. Moreover in those environments there are a few populations of Cabomba furcata Schult. & Schult. f. (Cabombaceae), Hydrocotyle ranunculoides L. f. (Apiaceae) y Najas arguta Kunth (Najadacae) that are likely unique records for this riparian system.
Key words: cover, gramalote, lakes, mandial, riberine, aquatic vegetation
INTRODUCCIÓN
El sistema lacustre–riberino Lagartococha es uno de los humedales más representativos de la Amazonía ecuatoriana por su heterogeneidad de hábitats y su biodiversidad. Está conformado por más de 30 lagunas ubicadas en el borde sur este de la reserva las mismas que se encuentran esparcidas en más de 20 km a lo largo del cauce del río (Sáenz, 1998). Sus aguas tienen origen amazónico (Sioli, 1950) y se caracterizan por presentar un alto contenido de componentes húmicos (aguas negras) como resultado de la descomposición de la materia orgánica procedente de la hojarasca del bosque (polifenoles, taninos, ácidos fúlvicos), caracterizándolas por ser aguas pobres en nutrientes, carentes de sólidos en suspensión y con bajos niveles de oxígeno, lo que les distingue de las del río Aguarico provenientes de los Andes y que se caracterizan por la gran cantidad de sedimentos (aguas blancas).
Tanto las aguas provenientes de los Andes como aquellas que se originan en zonas intermedias y bajas confluyen en la Amazonía. Según Junk y Howard–Williams (1984) al menos el 20% de toda la Amazonía de América del Sur puede ser clasificada como humedal, esta clasificación incluye una gran variedad de hábitats favorables para el desarrollo de plantas acuáticas como las riveras de los ríos, los igapós, las várzeas, las lagunas, los pantanos y los meandros, lo que ha provocado que estos ecosistemas presenten gran heterogeneidad en los tipos de vegetación de los humedales amazónicos.
Además de los tipos de ambientes y el origen de sus aguas hay que considerar la hidrología de la zona y la morfología de los hábitats, ya que de esto depende la intensidad de las fluctuaciones en los niveles de agua dentro del sistema en las diferentes épocas del año. Prance (1979) clasificó los bosques inundados de la Amazonía en planos inundados, pequeños riachuelos, áreas pantanosas, lagunas aisladas poco profundas, rápidos y cascadas tomando en cuenta los parámetros hidrológicos e hidroquímicos usando las estacionalidades y la concentración de nutrientes en el medio. El sistema lacustre–riberino Lagartococha presenta cambios continuos en sus patrones hidrológicos durante el año (Asanza, 1985), que seguramente alteran la composición química del agua dependiendo de la estacionalidad y consecuentemente provocan cambios en la estructura y composición florística de las plantas acuáticas.
La información sobre los patrones hidrológicos en la Amazonía es limitada, no así la información taxonómica sobre las plantas acuáticas de la Amazonía que es abundante pero dispersa, principalmente en la Amazonía brasileña (Cook et al., 1974). Las comunidades de plantas acuáticas de la Amazonía han sido estudiadas por Miranda (1908), Black (1950), Mitchell y Thomas (1972) y Silva (1981) entre otros, quienes han aportado con información significativa sobre aspectos ecológicos en estos ambientes.
El presente estudio se realizó en la época invernal y pretende caracterizar los tipos de vegetación acuática presentes en el sistema lacustre–riberino Lagartococha e identificar las especies que conforman cada tipo de vegetación y que podrían ser consideradas como objetos de conservación para monitoreos posteriores y el desarrollo de planes de manejo destinados además a identificar los posibles usos potenciales de algunas plantas acuáticas en la recuperación y restauración de cuerpos de agua.
MATERIALES Y MÉTODOS
Área de estudio. La Reserva de Producción Faunística Cuyabeno (RPFC) está ubicada en el extremo nororiental de la Amazonía ecuatoriana, en la provincia de Sucumbíos y parte de la provincia del Napo. Se encuentra a 100 km de la población de Nueva Loja, cantón Lago Agrio, entre las coordenadas 00º 7' N; 76º 43' O y 00º 17' S; 75º 51' O. Cuenta con una extensión aproximada de 603.380 ha y está incluida dentro de la zona de vida conocida como bosque siempre–verde de tierras bajas (Palacios et al., 1999). Su ámbito altitudinal va desde los 200 a 280 msnm con una precipitación anual entre 2.000–4.000 mm y una temperatura media anual entre los 18 y 36 ºC (Asanza, 1985).
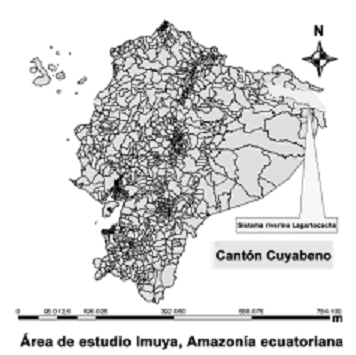
El sistema lacustre–riberino Lagartococha se encuentra dentro de la reserva y sus lagunas, canales y riachuelos que lo alimentan colindan con la frontera peruana (figura 1). Las aguas de este río tienen su origen en la quebrada norte o Zancudo, quebrada central y quebrada sur, formando numerosos meandros que desembocan en el Aguarico (Utreras, 1996). Los bosques de Igapó (inundados la mayor parte del año por aguas negras) existentes en el área de estudio presentan diferencias en la composición química del agua con respecto a los ríos de aguas blancas. Estas diferencias en la calidad del agua están estrechamente relacionadas con aspectos geológicos, geoquímicos y petrográficos de la región (Gibbs, 1967; Sioli, 1968), y se ponen de manifiesto en la heterogeneidad de hábitats lo que provoca la formación de diferentes tipos de vegetación, creando ambientes que abarcan una riqueza biológica única y poco explorada.
Figura 1. Área de estudio dentro del sistema lacustre del río Lagarto, Reserva de Producción Faunística Cuyabeno, Amazonía ecuatoriana.
Metodología. Se trazaron 28 transectos a lo largo de todo el sistema, los mismos que fueron ubicados donde era evidente las diferencias en la composición de especies y el tipo de vegetación, comenzando desde la bocana del río Lagartococha hasta la laguna Garzacocha. Dieciocho transectos corresponden a lagunas y diez al río.
Se aplicó la metodología de transectos de profundidad propuesta por Pedralli (1990) para el análisis cuantitativo. Los transectos fueron ubicados sobre el espejo de agua con la ayuda de una cuerda con flotadores desde la orilla hacia el centro del cuerpo de agua. Cada transecto tuvo una longitud de 10 m, dividido en subunidades (cuadrantes) de 1 m2. La profundidad de cada transecto varió con la topografía del fondo del río.
Se estimó la distribución de las especies en cada cuadrante usando datos dicotómicos de presencia (1) y ausencia (0) de especies, mientras que para analizar los patrones de cobertura de las especies, se realizó estimaciones porcentuales de la superficie ocupada por cada especie en cada cuadrante.
Al final se colectó cada especie con la ayuda de un trinche manual y se la preservó en papel de cera para su posterior procesamiento e identificación en el herbario de la Universidad Católica de Quito (QCA), mediante el uso de material preservado y el apoyo de claves taxonómicas. El material disecado se encuentra depositado en el herbario QCA de la Pontificia Universidad Católica del Ecuador y en el Herbario QZNE del Museo de Ciencias Naturales del Ecuador.
Los datos ambientales tomados in situ (pH, conductividad, alcalinidad, temperatura, oxígeno disuelto y transparencia del agua), fueron empleados para confrontarlos con la información florística y determinar sus posibles interacciones.
Todas las plantas acuáticas registradas adoptan una forma de vida en particular. Para clasificarlas se siguió el sistema propuesto por Luther (1951) quien toma en cuenta las formas de adherencia al sustrato con los tipos básicos de crecimiento. Se registraron las siguientes formas de vida: plantas acuáticas enraizadas emergentes, enraizadas sumergidas, enraizadas flotantes y libre flotadoras.
Análisis de datos. Las similitudes en la distribución de las especies y su composición florística fueron examinadas mediante análisis multivariado. Se utilizó el índice de Jaccard para identificar sitios similares en la composición de especies, mientras que para identificar las similitudes en los patrones de cobertura se utilizó el índice de Steinhaus.
l índice de Jaccard se define como J = c/(a + b + c), donde c = al número de especies encontradas en los sitios (a y b), a = número de especies encontradas en el sitio a, y b = al número de especies encontradas en el sitio b (Legendre y Vaudor, 1991).
Mientras que el índice de Steinhaus se define como S = < (a1 y a2) x 2 / a1+ a2 + b + c, donde a1 y a2 son los porcentajes de cobertura de las dos especies compartidas; b = porcentaje de cobertura de las especies encontradas en el sitio b; y c = porcentaje de cobertura de las especies encontradas en el sitio c (Kent y Coker, 1992; Legendre y Vaudor, 1991). La variación de los datos ambientales sobre los puntos de muestreo fue confrontada con un análisis de componentes principales (PCA).
RESULTADOS
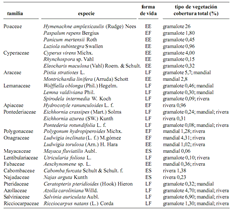
Se encontraron un total de 17 familias y 28 especies de plantas acuáticas, entre tolerantes (helófitas) y estrictas (hidrófitas) en los 28 puntos de muestreo del sistema Lagartococha. La mayoría de especies fueron plantas con flores (doce dicotiledóneas, doce monocotiledóneas) y el resto fueron plantas de otros linajes (tres helechos y una hepática) (tabla 1).
Dentro de los tipos de vegetación los gramalotes están dominados, en su mayoría, por vegetación emergente de Poaceae y Cyperaceae [Hymenachne aplexicaulis (Rudge) Nees, Paspalum repens Bergius, Panicum mertensii Roth (Poacaeae); Luziola subintegra Swallen y Cyperus virens Michx.) (Cyperaceae)]. Se registraron 18 especies de diferentes linajes que conforman este tipo de vegetación (tabla 1), las mismas que están localizadas principalmente en los bordes de las lagunas y en algunos tramos del río entre el hito 60, en la bocana del río Lagartococha y la laguna Loracocha 1. En los siguientes tramos, hasta la laguna Garzacocha, este tipo de vegetación desaparece por completo.
Los mandiales están conformados por una mezcla de vegetación emergente y flotante con dominio de Montrichardia linifera (Arruda) Schott (Araceae), que además se caracterizan por ser islotes móviles que llevan su propio sustrato y pueden desplazarse distancias considerables, dependiendo de la dirección del viento y la profundidad del agua. Este tipo de vegetación está conformada por alrededor de quince especies estrictamente acuáticas (tabla 1). Se encuentran únicamente en las lagunas Delfincocha e Imuya.
Tabla 1. Composición florística, formas de vida y tipos de vegetación de las macrófitas acuáticas en el sistema lacustre–riberino Lagartococha, Amazonía ecuatoriana (EE = enraizada emergente; EF = enraizada flotante; ES = enraizada sumergida; LF = libre flotadora)
La vegetación de rivera se encuentra conformada por cerca de quince especies, en su mayoría libre flotadora y enraizada sumergidas. Las especies dominantes son: Eichhornia azurea (SW.) Kunth, Pontederia rotundifolia L. f. (Pontederiaceae), Polygonum hydropiperoides Michx (Polygonaceae), y Ludwigia inclinata (L. f.) M. Gómez (Onagraceae) (tabla 1). La mayoría de estas especies ocupan aguas poco profundas (< 2,5 m), y se encuentran creciendo a las orillas de la mayoría de lagunas y en especial en la cabecera de la laguna Imuya.
Los tipos de vegetación presentes en el área de estudio y la variación de las características ambientales entre el río y las lagunas permiten dividirla en tres zonas: la zona uno incluye únicamente ambientes lóticos del río Lagartococha y está comprendida entre el hito 60 en la bocana del río Lagartococha y 500 m río arriba desde la bocana de la laguna Loracocha 1; la zona dos la conforman las lagunas de Delfincocha e Imuya; y la zona tres corresponde a la laguna Garzacocha (figura 1) donde la vegetación acuática reaparece con apenas tres especies de plantas acuáticas, diferenciándola del resto de lagunas del sistema.
Todas las especies que conforman los tipos de vegetación mencionados se enmarcan dentro de las cuatro formas de vida. Las plantas flotantes libres fueron dominantes con doce especies, seguidas por las enraizadas emergentes con nueve, las enraizadas flotantes con cuatro y las enraizadas sumergidas con tres especies (tabla 1). únicamente cinco de las 28 especies registradas (Eichhornia crassipes, Pontederia rotundifolia (Pontederiaceae), Azolla caroliniana Willd, Salvinia auriculata Aubl. (Salviniaceae) y Ricciocarpus natans (L.) Corda (Hepaticae) se encuentran formando parte de los tres tipos de vegetación.
Se obtuvo un solo registro de dos poblaciones de Najas arguta (Najadaceae) y Cabomba furcata (Cabombaceae) creciendo en la cabecera de la laguna Imuya en aguas poco profundas (< 2,5 m). Mayaca fluviatilis Aubl. (Mayacaceae) estuvo asociada únicamente a la vegetación de mandial.
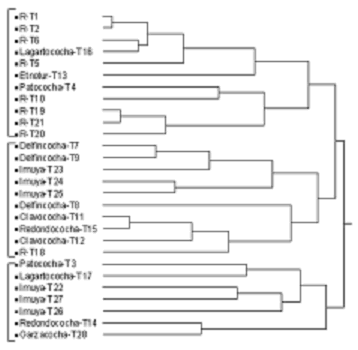
El análisis de conglomerados de Jaccard muestra que la composición florística entre el río y las lagunas es diferente. La clasificación aglomerativa separa tres grupos de transectos, aquellos que provienen de ríos forman el primer grupo y los que provienen de lagunas forman los dos restantes (figura 2).
El análisis de conglomerados de Steinhaus separa tres grupos de transectos diferentes entre si en sus patrones de cobertura (figura 3). Esto demuestra que la cobertura entre la vegetación acuática de ríos y lagunas también es diferente, especialmente entre la vegetación de mandial y gramalote.
Figura 2. La clasificación aglomerativa muestra tres grupos de transectos diferentes en su composición florística. El primer grupo está formado, en su mayoría, por transectos ubicados en ambientes lóticos (ríos), mientras que los dos últimos están formados por transectos ubicados en ambientes lénticos correspondientes a lagunas
Figura 3. Clasificación aglomerativa basada en los patrones de cobertura de las plantas acuáticas del sistema lacustre–riberino Lagartococha. Se distinguen tres grupos diferentes entre sí. Los dos primeros están formados por ríos y lagunas mientras el último está formado, en su mayoría, por lagunas
En la vegetación de mandial, Montrichardia linifera (52%), Azolla caroliniana (10%) y Salvinia auriculata (8%) son las especies con mayor cobertura, mientras que en la vegetación de gramalote, Hymenachne amplexicaulis (50%), Salvinia auriculata (10%) y Pistia stratiotes L. (Araceae) (10%) tienen mayor cobertura. En la vegetación de rivera, Hymenachne amplexicaulis (21%) y Ludwigia inclinata (15%) son las especies con mayor cobertura.
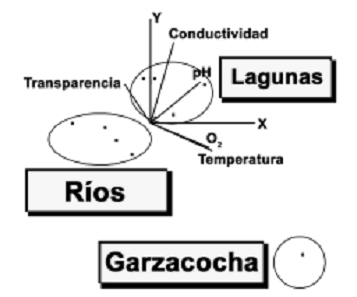
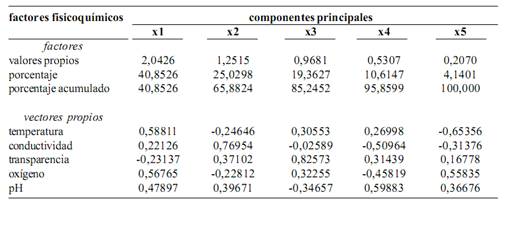
El análisis de componentes principales muestra que la temperatura, el oxígeno y el pH explican mejor la variación ambiental en los diferentes sitios de muestreo, especialmente en ambientes lénticos (lagunas). En ambientes lóticos (ríos y meandros) no existe un parámetro específico que marque tendencias de variación (figura 4, tabla 2).
Figura 4. Factores físicos–químicos asociados con la distribución de las especies. La figura muestra que el oxígeno y la temperatura tienen mayor incidencia en la laguna Garzacocha mientras que el pH y la conductividad tienen mayor incidencia en el resto de lagunas. No existe una tendencia definida de las variables hacia los ríos (ver tabla 2)
Tabla 2. Análisis de componentes principales de los factores físico–químicos del sistema lacustre–riberino Lagartococha, Amazonía ecuatoriana y su relación con las macrófitas acuáticas
DISCUSIÓN
El sistema lacustre–riberino Lagartococha presenta tipos de vegetación heterogéneos como consecuencia de las intensas fluctuaciones de los niveles de agua en las diferentes épocas del año. En la época seca (diciembre–marzo), los niveles de agua pueden disminuir hasta 5 m desde su nivel más alto, mientras que en la época lluviosa (abril–julio) éstos pueden alcanzar los 12 m en los lugares más profundos (Asanza, 1985).
Los frecuentes cambios en el nivel de agua provocan inestabilidad de hábitats, y en consecuencia cambios fisico–químicos en el agua que inciden en el establecimiento de la vegetación acuática (Junk, 1986; Furch, 1984). Cada tipo de vegetación presenta especies propias pero también existen especies que pueden coexistir en uno u otro tipo de vegetación. Las plantas flotantes libres son dominantes y forman parte de los tres tipos de vegetación (Azolla caroliniana, Pistia stratiotes, Salvinia auriculata y Ricciocarpus natans) y se encuentran dispersas por todo el sistema.
La dominancia de las plantas enraizadas emergentes en la mayoría de ambientes lóticos (ríos y meandros) del sistema, posiblemente se deba a que este grupo de plantas son perennes y poseen un sistema radical rizomatoso que les permite captar nutrientes del sustrato y emerger del agua para mantener un intercambio gaseoso adecuado sin ser afectadas por las corrientes y las fluctuaciones del nivel del agua. Además, la reproducción por rizomas es la más frecuente y eficiente en ambientes acuáticos porque permite la regeneración permanente de tallos juveniles y su propagación es continua (Hutchinson, 1975; Philbrick y Donald, 1996; Sculthorpe, 1967).
Posiblemente los cambios en los niveles de agua en las lagunas de Imuya y Delfincocha no sean tan drásticos como en el resto del sistema, lo cual mantiene una relativa estabilidad de los hábitats en las características físico–químicas del agua y favorece el establecimiento de comunidades de plantas enraizadas flotantes y sumergidas. La estabilidad de los hábitats contribuye al establecimiento de las comunidades de plantas acuáticas y permite que estas especies se desarrollen sin sufrir cambios significativos en su estructura (Prance, 1979).
La presencia de Najas arguta y Cabomba furcata en la cabecera de la laguna Imuya posiblemente se debe a la influencia de la microcuenca que alimenta la laguna donde seguramente la calidad del agua es distinta a la del resto del sistema. Existe un pequeño remanente de Hydrocotyle ranunculoides que se encuentra creciendo exclusivamente en el canal Imuya, posiblemente influenciado también por la calidad de agua. En definitiva, las aguas del canal Imuya podrían tener un origen diferente a las del resto del sistema y consecuentemente estarían influyendo en la composición florística de las lagunas de Imuya y Delfincocha, por lo cual deberían ser consideradas como objetos de conservación para futuros monitoreos ambientales.
El uso de algunas especies (Najas arguta, Cabomba furcata e Hydrocotyle ranunculoides) como bioindicadoras podrían ayudar a estimar la calidad del agua en el sistema, como herramientas para el desarrollo de programas de monitoreo a largo plazo por su sensibilidad a la variación iónica y a la concentración de oxígeno (Shijun y Jingsong, 1989). Algunas especies podrían ser utilizadas como restauradoras de cuerpos de agua [Eichhornia crassipes, Pistia stratiotes, Salvinia auriculata y Spirodela intermedia W. Koch (Algae)] ayudando a mitigar la contaminación orgánica generada por aguas servidas provenientes de campamentos y asentamientos humanos en el sector. La construcción de pequeñas plantas de sedimentación y purificación de aguas servidas usando plantas acuáticas como retenedoras de elementos contaminantes podría ser el mecanismo más idóneo para alcanzar este propósito (León, 1997).
En el caso de existir explotación petrolera en el sector, el uso de algunas plantas acuáticas, especialmente del grupo de las Pontederiaceae y Lemnaceae, podrían ayudar a mitigar la contaminación por metales pesados generados por esta actividad. Estudios realizados en Venezuela usando plantas acuáticas para la remoción de metales pesados así lo demuestran. Por ejemplo, Eichhornia crassipes puede remover hasta 40,2 mg de cadmio, 34 mg de cobalto, 39 mg de plata y 36 mg de fenoles en un metro cuadrado por día (Velásquez, 1994).
La presencia de vegetación enraizada sumergida y enraizada flotante en las riveras de las lagunas de Imuya y delfincocha podría estar generando recursos alimenticios para grupos de peces atractivos para la dieta de mamíferos acuáticos como el delfín amazónico (Inia geoffrensis Blainville) y el manatí (Trichechus inunguis Natterer). Es importante conservar estos ecosistemas que no solo encierran una riqueza florística y faunística única sino que funcionan como una unidad integrada entre los factores bióticos y abióticos de la zona.
La principales fuentes de amenaza para el sistema lacustre–ríberino Lagartococha constituyen la explotación petrolera y el turismo. La posible extracción petrolera del Campo Imuya por parte de PetroEcuador pone en riesgo permanente la salud de las comunidades biológicas asociadas al sistema. La quebrada Imuya al estar conectada con las lagunas de Imuya y Delfincocha, estarían en riesgo permanente de ser contaminadas si existiese un derrame de crudo en el sector afectando además a todas las zonas aledañas al sector y que se mantienen inundadas la mayor parte del año.
La actividad turística y los asentamientos humanos en el sector también son otra fuente de contaminación para el sistema, sin embargo, estos no tendría la misma incidencia que el anterior al ser la combustión de los motores fuera de borda y los desechos sólidos generados por el hombre los principales agentes contaminantes de menor intensidad y de fácil remoción.
Frente a este escenario, las autoridades del Estado ecuatoriano deben tomar las consideraciones del caso para garantizar que estos ecosistemas acuáticos amazónicos únicos en el Ecuador se mantengan en buen estado de salud como única remanencia de ambientes prístinos en nuestra amazonía.
AGRADECIMIENTOS
Agradezco al proyecto Conservación de la Biodiversidad en el Ecuador (EcoCiencia) por financiar ésta investigación. A todas las personas que formaron parte del equipo de ecología acuática y que participaron en el trabajo de campo (Jorge Celi, Blanca Ríos, Claudia Sangurima, Carlos Carrera, Juan José Vásconez, Karol Fierro, Cecilia Puertas, Gimena Carrillo y Patricio Salazar). A Miguel Vázquez, Juan Fernando Freile y Patricio Salazar por sus valiosos comentarios al manuscrito. A todos los guías y nativos por su valiosa colaboración en el trabajo de campo, en especial a Rodrigo Shihuango y Ernesto Coquinche.
REFERENCIAS 1. Asanza E. 1985. Distribución, biología reproductiva y alimentación de cuatro especies de Alligatoridae, especialmente C. crocodilus en la Amazonía del Ecuador. Tesis de licenciatura, Pontificia Universidad Católica del Ecuador. Quito, Ecuador. [ Links ] 2. Black GA. 1950. Os capins aquáticos da Amazonia. Boletin Tecnico do Instituto Agricola Norte, 19:53–94. [ Links ] 3. Cook CD, Gut BI, Bix EM, Schneller T, Seitz M. 1974. Water plants of the World. W. Junk, Dordrecht Ed. The Hague, The Netherlands. [ Links ] 4. Furch K. 1984. Water chemistry of the Amazon basin: the distribution of chemical elements among freshwaters. Pp. 167–199. En: Sioli H (ed.). The Amazon Limnology and Landscape Ecology of a Mighty Tropical River and its Basin. W. Junk, Dordrecht Ed. The Hague, The Netherlands. [ Links ] 5. Gibbs RJ. 1967. The geochemistry of the Amazon river system, I: The factors that control the salinity and the composition and concentration of suspended solids. Geological Society American Bulletin, 78:1203–1232. [ Links ] 6. Hutchinson GE. 1975. A treatise on limnology. Pág. 660. En: Hutchinson GE. Limnological botany. Vol. 3. Wiley J. & Sons Eds. New York. [ Links ] 7. Junk WJ. 1986. Aquatic plants of the Amazon system. Pp. 319–337. En: Davies BR, KF Walker (eds.). The ecology of river systems. W. Junk Publishers. Dordrecht, The Netherlands. [ Links ] 8. Junk WJ, Howard–Williams C. 1984. Ecology of aquatic macrophytes in Amazonia. Pp. 269–293. En: Sioli H (ed.). The Amazon–Limnology and landscape ecology of a mighty tropical river and its basin. Junk, W. Dordrecht, The Netherlands. [ Links ] 9. Kent M, Coker P. 1992. Vegetation description and analysis. Belhaven Press. London. [ Links ] 10. Legendre P, Vaudor A. 1991. The R–package clustering analysis. Département de Sciences Biologiques, Université de Montréal. Montréal. [ Links ] 11. León B. 1997. Uso actual de la flora y vegetación en los humedales de la costa central del Perú. En: Cano A, Young K (eds.). Biología y conservación de los pantanos de Villa y su contexto regional en el Perú. Serie de divulgación, Museo de Historia Natural. [ Links ] 12. Luther H. 1951. Verbreitung und okologie der hoheren wasserpflanzen in brakwasser der ekenas–gegend in Sudfinnland. Acta Botanica Fennica, 49:1–231; 50:1–370. [ Links ] 13. Miranda VC. 1908. Os campos de Marajó a sua flora. Boletin do Museu Goeldi de Historia Naturale, 5:96–151. [ Links ] 14. Mitchel DS, Thomas BA. 1972. Ecology of water weeds in the neotropics– an ecological survey of the aquatic weeds Eichhornia crassipes and Salvinia species and their natural enemies in the neotropics. UNESCO. Tech. Pap. Hydrol., 12:50. [ Links ] 15. Palacios W, Cerón C, Valencia R, Sierra R. 1999. Las formaciones naturales de la Amazonía del Ecuador. Pp.109–120. En: Sierra R (ed.). Propuesta preliminar de un sistema de clasificación de vegetación para el Ecuador continental. Proyecto INEFAN/GEF–BIRF y EcoCiencia. Quito, Ecuador. [ Links ] 16. Pedralli G. 1990. Macrófitas acuáticas: técnicas y métodos de estudio. Pontificia Universidad Católica de Paraná (Curitiba), 26:5–24. [ Links ] 17. Philbrick CT, Donald HL. 1996. Evolution of aquatic angiosperm reproductive systems. BioScience, 46(11):813–826. [ Links ] 18. Prance GT. 1979. Notes on the vegetation of amazonia III. The terminology of Amazonian forest type subject to inundation. Brittonia, 31:26–38. [ Links ] 19. Sáenz M. 1998. Caracterización ecológica del sistema de lagunas Imuya, en base a sistemas de información geográfica, en la Reserva de Producción Faunística Cuyabeno, Sucumbios–Ecuador. Proyecto de Grado para el Baccalaureus Scientiae. Universidad San Francisco de Quito. Quito, Ecuador. [ Links ] 20. Sculthorpe CD. 1967. The biology of aquatic vascular plants. St. Martin's Press. New York. [ Links ] 21. Shijun M, Jingsong Y. 1989. Ecological engineering for treatment and utilization of wastewater: an introduction to ecotechnology. U. S. A. [ Links ] 22. Silva CJ. 1981. Observacao sobre a biologia reproductiva de Pistia stratiotes L. (Araceae). Acta Amazonica, II:487–504. [ Links ] 23. Sioli H. 1950. Das Wasser im Amazonasgebiet. Forsch. Fortschr., 26:274–280. [ Links ] 24. Sioli H. 1968. Hydrochemistry and Geology in the Brasilian Amazon Region. Amazoniana, 1:267–277. [ Links ] 25. Utreras VM. 1996. Estimación de la abundancia, aspectos ecológicos y etológicos del Delfin Amazónico Inia geoffrensis geoffrensis (Cetacea: Iniidae) en el río Lagartococha, Amazonía ecuatoriana. Tesis de licenciatura. Pontificia Universidad Católica del Ecuador. Quito, Ecuador. [ Links ] 26. Velásquez J. 1994. Plantas acuáticas vasculares de Venezuela. Universidad Central de Venezuela, Consejo de Desarrollo Científico y Humanístico. Caracas, Venezuela. [ Links ]