Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.29 no.87 Medellín July/Dec. 2007
ARTÍCULOS DE INVESTIGACIÓN
REPRODUCCIÓN Y HÁBITOS ALIMENTICIOS DEL NICURO, PIMELODUS BLOCHII (VALENCIENNES, 1840) (PISCES: PIMELODIDAE), EN LA CIÉNAGA DE CACHIMBERO, RÍO MAGDALENA, COLOMBIA
REPRODUCTION AND FEEDING OF NICURO, PIMELODUS BLOCHII (VALENCIENNES, 1840) (PISCES: PIMELODIDAE), IN CACHIMBERO FLOODPLAIN LAKE, MAGDALENA RIVER BASIN, COLOMBIA
Silvia López–Casas1; Luz F. Jiménez–Segura2
1Laboratorio de Ictiología. Instituto de Biología. Universidad de Antioquia. Medellín (Antioquia), Colombia. Dirección electrónica: <silvilopezcasas@yahoo.com>
2Instituto de Biología, Universidad de Antioquia. A. A. 1226, Medellín (Antioquia), Colombia. Dirección electrónica: <ljimenez@matematicas.udea.edu.co>
Resumen
Analizamos aspectos tróficos y reproductivos de Pimelodus blochii en el sistema cenagoso de Cachimbero (cuenca media del río Magdalena, Colombia), en tres periodos del ciclo pluviométrico del año 2003. Colectamos 384 individuos con una biomasa total de 31,4 kg y un intervalo de longitud estándar (LS) de 52,4 a 253,0 mm. No observamos diferencias entre las capturas en los diferentes periodos del ciclo pluviométrico, ni entre estaciones de muestreo. El coeficiente alométrico (b)y el factor de condición no mostraron diferencias entre periodos de muestreo ni entre sexos. La población estuvo representada en su mayoría por individuos en estados inmaduros. En octubre de 2003, observamos un pico de madurez gonadal para las hembras. El número de oocitos de las hembras fue igual entre los tres periodos pluviométricos. La proporción machos:hembras mostró una mayor cantidad de hembras que de machos. La relación gonadosomática y hepatosomática fluctuó estacionalmente para las hembras, mientras que en los machos se mantuvo constante. En los contenidos estomacales, encontramos restos de animales acuáticos y terrestres pertenecientes a 16 taxas, lo que sugiere que la especie tiene un nicho trófico amplio y se comporta como omnívoro oportunista.
Palabras clave: Alimentación, Cachimbero, Pimelodus blochii, Plano inundable, Reproducción, Río Magdalena
Abstract
We analyzed trophic and reproductive aspects of Pimelodus blochii in the Cachimbero floodplain lake (Magdalena river basin, Colombia) in three raining periods of year 2003. We collected 384 individuals with a total biomass of 31.4 kg and a standard length (LS) interval between 52.4 and 253.0 mm. Differences were not observed neither on the catches among three periods of the pluviometric cycle, nor among sampling stations. The allometric coefficient (b) and the condition factor did not show differences among pluviometric periods or sexes. Population was mainly represented by immature individuals. On October 2003, we observed a gonadic matureness peak for females. Relative number of oocytes was equal between in stomach contents, we pluviometric raining periods. Sex ratio showed a greater number of females than males. Females gonadosomatic and hepatosomatic relationships showed a seasonal fluctuation. Found aquatic and terrestrial animal fragments of at least 16 taxa, it suggests that this species has a wide trophic niche and an a opportunistic omnivorous feeding behaviour.
Key words: Feeding, Floodplain, Magdalena River, Pimelodus blochii, Reproduction
INTRODUCCIÓN
En la cuenca del Magdalena se encuentran dos especies del género Pimelodus: el nicuro Pimelodus clarias (Bloch, 1785) y el capaz Pimelodus grosskopfii (Steindachner, 1879) (Dahl, 1971; Miles, 1971). Lundberg y Littmann (2003) no reconocen a P. clarias como una especie y la incluyen dentro del complejo Pimelodus blochii (Valenciennes, 1840) con una distribución que abarca las cuencas del Golfo de Paria (Brasil), río Amazonas, Essequibo, Tocantis y Orinoco. En este trabajo, asumimos el planteamiento de Maldonado et al. (2004) que incorporan a P. clarias al complejo Pimelodus blochii.
Pimelodus blochii es una especie importante para la pesca artesanal en la cuenca del río Magdalena (INPA, 2002) y es identificada como una especie migratoria (Valderrama y Zarate, 1989), cuyo comportamiento trófico y reproductivo, al igual que el de otras especies de su género, está asociado en parte, con la dinámica hidrológica de los sistemas donde se presenta (Prada–Pedreros, 2003).
El objetivo de este trabajo es aportar información biológica sobre aspectos reproductivos y tróficos de la población de P. blochii presente en la ciénaga de Cachimbero, un humedal relativamente aislado del cauce principal del río Magdalena y que presenta un comportamiento hidrológico particular dentro de la cuenca magdalénica, con oscilaciones en el nivel de sus aguas que no superan los 1,2 m (Piza y Molina, 2004) durante el ciclo anual.
MATERIALES Y MÉTODOS
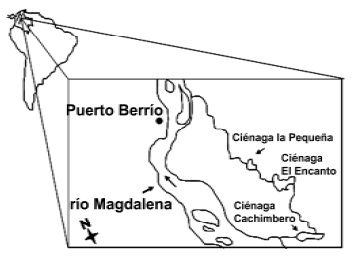
Área de estudio. La ciénaga de Cachimbero (figura 1) hace parte de un complejo cenagoso localizado en la parte media de la cuenca del río Magdalena [(Zona II, según Kapetsky et al., (1978)] (6° 27' N y 74° 22' O). El sistema, localizado sobre los 200 msnm, tiene un área de espejo de agua de 3,7 km2 con una faja perimetral de vegetación hidrófila de 11 km2 y una cuenca de drenaje de 141,16 km2. El promedio de precipitación es de aproximadamente 2.200 mm anuales con lluvias distribuidas durante casi todo el año, con épocas de precipitación alta entre abril–junio y agosto–noviembre y periodo de estiaje entre diciembre–marzo y un veranillo en julio (Cortés, 1982).
Figura 1. Ubicación de la ciénaga de Cachimbero, Cimitarra (Santander), Colombia.
La ciénaga de Cachimbero hace parte de un sistema de ciénagas consecutivas presentes en la margen derecha del río Magdalena (ciénaga de Cachimbero–ciénaga Perdida –ciénaga El Encantociénaga La Pequeña–río Magdalena) y que se intercomunican mediante el caño Negro. Sin embargo, la comunicación con Cachimbero que se da a través de este caño está limitada por la construcci ón de un dique. El sistema, se comunica a su vez hacía el sur–oeste con el río Magdalena mediante el caño Cachimbero, no obstante, esta comunicación es limitada debido a la formación de una barrera de macrofitas que colonizaron su cauce, obstruyendo la entrada al ambiente cenagoso.
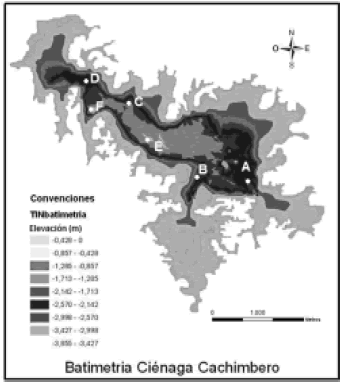
Metodología. Para conocer la distribución espacio–temporal de la población de P. blochii dentro de la ciénaga, realizamos los muestreos durante el periodo de estiaje (marzo) y los periodos de altas precipitaciones (mayo y octubre) del año 2003 en seis estaciones. En cada una de ellas y en cada periodo, expusimos una red estacionaria, tanto en la zona litoral como en la limnética. Las estaciones 'choza' y 'piscina' corresponden a estaciones limnéticas (figura 2).
Figura 2. Batimetría y localización de las seis estaciones de muestreo en la ciénaga de Cachimbero, Cimitarra (Santander), Colombia. Estaciones A: Entre Caños; B: Tierradentro; C: Hondonada; D: Complejo, E: Choza, F: Piscina (Tomado de Piza y Molina, 2004).
Cada red estaba compuesta por cinco paneles de tamaños de malla diferentes (4; 5,6; 9; 12 y 14 cm de distancia entre nudos) para permitir la captura de individuos de diferentes tamaños. Éstas fueron abiertas durante un periodo continuo de 48 horas en marzo y mayo, y 65 horas en octubre. Utilizamos también líneas de anzuelos (12 horas por periodo y estación de muestreo). Los peces capturados fueron fijados en solución de formaldehído (10%), posteriormente medimos longitud estándar (LS) y pesamos cada individuo capturado.
Calculamos la captura por unidad de esfuerzo (CPUE), expresada en términos de número de individuos y biomasa por tiempo [horas (h)] de exposición de los artes de pesca en cada periodo, estación y ambiente de muestreo, como una expresión de la abundancia relativa de la especie de acuerdo en el espacio y el tiempo. Verificamos las diferencias en la CPUE entre periodos de muestreo mediante una prueba de chi2, y las diferencias entre estaciones y ambientes con un ANOVA de Friedman.
Para establecer el patrón de crecimiento de la población, estimamos el coeficiente de alometría partir de la ecuación de la regresión talla–peso de los individuos de acuerdo con el sexo y el periodo de captura. Para identificar si existían diferencias entre periodos de captura y entre sexos comparamos las pendientes de las regresiones con el método sugerido por Zar (1996).
Calculamos el factor de condición o factor de bienestar k (peso/longitudb) según Vazzoler (1996). Determinamos las diferencias en el factor de condición k entre sexos, estaciones y periodos de muestreo con un análisis de varianza paramétrico para cada factor.
Para el análisis de los aspectos reproductivos y tróficos tomamos una submuestra de 135 individuos seleccionados al azar (44 de marzo, 45 de mayo y 46 de octubre). Definimos siete grupos de tallas con base en la longitud estándar. A cada individuo le determinamos el estadio de desarrollo gonadal de acuerdo con la propuesta de Vazzoler (1996): estadio A: individuos inmaduros vírgenes; estadio B: individuos en maduración; estadio C: individuos maduros próximos al desove; estadio D: individuos desovados recientemente; y estadio E: individuos en reposo. Las gónadas y el hígado fueron pesados en una balanza electrónica con precisión de 0,01 g. Determinamos el número de oocitos totales por gónada según la propuesta volumétrica de Vazzoler (1996), y lo relativizamos al peso total de cada hembra. Estimamos la condición reproductiva de los peces a partir de la relación gonadosomática propuesta por Vazzoler (1996): RGS = peso de la gónada/(peso total – peso de la gónada). Para estimar la significancia en sus diferencias entre meses y sexos realizamos un análisis de varianza.
Para la evaluación de los hábitos alimenticios de la especie, pesamos el estómago y el intestino de cada individuo. Posteriormente extrajimos, pesamos y separamos bajo un estereoscopio el contenido de cada tracto digestivo. Estimamos el índice de plenitud, como la expresión del aporte del tracto digestivo y su contenido al peso total del individuo, el cual se determina como la relación porcentual del peso del tracto digestivo lleno sobre el peso total del individuo, y el peso del contenido del tracto digestivo sobre el peso total del individuo (Prejs y Colomine, 1981). Evaluamos la diversidad de recursos utilizados por la población por medio del cálculo de la diversidad trófica a partir del índice de Shannon–Weaver (1948).
A partir de la separación de los diferentes ítems presentes en los contenidos estomacales determinamos la frecuencia de ocurrencia y el volumen de cada ítem según las estimaciones volumétricas propuestas por Mejía (2003) y, Prejs y Colomine (1981). Con estos datos definimos la importancia de cada ítem en la dieta del individuo mediante la estimación del índice alimentario propuesto por Kawakami y Vazzoler (1978), definido por la expresión/ecuación I. A. = [(Fi*Vi)/Ó(Fi*Vi)], donde Fi = frecuencia relativa del ítem i, y Vi = volumen relativo del ítem i. Para evaluar la variación temporal de la dieta realizamos un análisis discriminante que es una técnica estadística multivariante que nos permitió establecer si existían diferencias significativas en la dieta entre periodos de muestreo basados en los valores del índice alimentario de cada ítem consumido.
Para todas las pruebas de hipótesis se usó un nivel de confianza de 95%. Usamos los paquetes estadísticos Statistica 6.0 y SPSS 13.0.
RESULTADOS
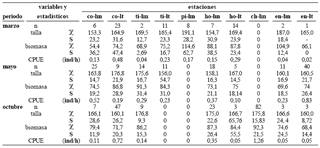
Aspectos generales. Colectamos 384 individuos con una biomasa total de 31,4 kg y un intervalo de longitud estándar entre 52,4 y 253,0 mm. Registramos la mayor captura por unidad de esfuerzo en el periodo de lluvias de mayo (2,77 ind/h) y la menor en el periodo de estiaje de marzo (1,54 ind/h). Aunque capturamos individuos de P. blochii en las seis estaciones de muestreo de la ciénaga de Cachimbero detectamos diferencias significativas en la abundancia relativa entre las estaciones y entre los ambientes litorales y limnéticos (χ2 (0,05; 2) = 64,7; p < 0,001), con mayor número de capturas en las estaciones con un ambiente litoral con un abundante desarrollo de macrófitas (tabla 1).
Tabla 1. Talla (mm) y biomasa (g) por estaciones y ambientes de muestreo en la ciénaga de Cachimbero en el año 2003 (estaciones: co = complejo, ti = tierradentro, pi = piscina, ho = hondonada, ch = choza, en = entrecaños, lm = limnético, lt = litoral; estadísticos: χ= media aritmética, S = desviación estándar, CPUE = captura por unidad de esfuerzo, individuos/h)
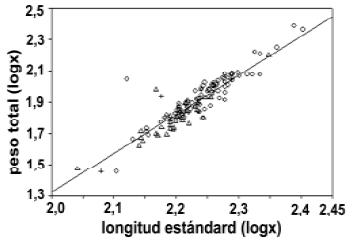
Relación longitud/peso y factor de condición. El valor de b fue 3,675 para toda la población. La relación entre el peso y la longitud estándar fue significativa (r2 = 0,82; F(1, 134) = 623,3; p < 0,001) y se ajusta a la ecuación log (peso) = –3,675 + 2,512 [log (LS)] (figura 3), sugiriendo que los individuos de esta población aumentan poco en su peso con relación a su incremento de talla.
No detectamos diferencias en el coeficiente alométrico b entre los sexos (marzo t (2; 37) = 0,006; mayo t (2; 38) = 0,001 y octubre t (2; 40) = 0,002), ni entre periodos de muestreo (F(2, 129) = 0,001), indicando que tanto machos como hembras presentan el mismo patrón de crecimiento a lo largo de todo el año.
Figura 3. Regresión longitud estándar – peso para P. blochii presente en la ciénaga de Cachimbero en el año 2003 (º = hembras,  = machos, + = indiferenciados).
= machos, + = indiferenciados).
No encontramos diferencias significativas en el factor de condición k entre los tres periodos pluviométricos (F (1, 134) = 2,24; p = 0,11), entre estaciones de muestreo (F (1, 134) = 0,79; p = 0,06), ni entre sexos dentro de un mismo periodo de muestreo (marzo F (1, 42) = 1,41; p = 0,24; mayo F (1, 43) = 0,24; p = 0,63; octubre F (1, 44) = 0,16; p = 0,69). El valor medio de k para la población fue de 0,0017 durante el periodo de muestreo, sugiriendo que los individuos de esta población no sufren cambios drásticos en su biomasa a lo largo del año.
Madurez gonadal. Durante marzo y mayo la población estuvo representada por un mayor número de hembras en estado B (en maduración) y machos en estado E (en reposo). En octubre, la mayoría de hembras capturadas se encontraron en estado C (maduras, próximas a desovar) y los machos se encontraron en su mayoría en estado B. Las hembras maduras presentaron tallas entre los 132,0 y los 216,0 mm de LS, y el único macho maduro capturado tenía 180,0 mm de LS.
La media muestral del número de oocitos totales y relativos de las hembras fue igual entre los dos periodos en los que se capturaron hembras maduras: mayo y octubre (Foocitos totales (1, 19) = 1,15; p = 0,34 y Foocitos relativos (1, 19) = 1,22; p = 0,318), presentando valores de 42.172,6 ovocitos por hembra y 428,5 ovocitos/g (por peso total de la hembra), respectivamente.
Encontramos variación estacional en la relación gonadosomática (RGS) sólo para las hembras de P. blochii (F hembras (2, 84) = 25,26; p < 0,05; F machos (2, 37) = 2,16; p = 0,13), detectando los valores más altos en las hembras capturadas en octubre. La relación hepatósomática (RHS) presentó el mismo comportamiento estacional de la RGS tanto en las hembras como en los machos (F hembras (2, 84) = 7,81; p < 0,05; F machos (2, 35) = 0,114; p = 0,89), indicando que las hembras realizan mayor inversión para la síntesis de tejido gonadal y reproducción en el periodo de lluvias de octubre. La proporción sexual para la población presentó una tendencia poligínica con una proporción macho:hembra de 1:2,25 (χ2 (0,05; 1) = 18,90).
Hábitos alimenticios. La población de P. blochii consumió al menos 58 ítems diferentes durante los tres periodos de capturas, alimentándose principalmente de macroinvertebrados planctónicos, bentónicos y aquellos asociados a macrófitas. Dentro de las presas identificamos al menos 16 taxas diferentes (tabla 2): varios tipos de insectos, crustáceos y peces, e incluso algunos insectos terrestres [Orthoptera e Hymenoptera (familias Vespidae, Formicidae y Ecytoninae)]. Dentro del material vegetal fue común encontrar pelos absorbentes del sistema radicular de macrófitas y varios tipos de semillas: gramíneas y leguminosas (familia Fabaceae).
El índice de plenitud fue diferente entre los periodos de muestreo (F(1, 133) = 7,91; p < 0,001) indicando que los individuos tuvieron el estómago más lleno en marzo y octubre respectivamente, que en mayo.
La media del índice de diversidad trófica de S–W fluctuó entre 3,424 y 2,932 presentando la mayor diversidad en el periodo de lluvias de octubre y la más baja en el mes de marzo. A nivel individual, la diversidad trófica fue igual entre periodos de muestreo (F (2, 134) = 0,52; p = 0,59) y entre clases de tamaño (F(1, 134) = 0,39; p = 0,89). Encontramos un valor medio de 1,06 ± d. s. 0,41, indicando que todos los individuos, independientemente de su tamaño, consumían el mismo número de ítems.
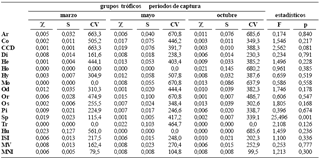
Las presas más importantes en el mes de marzo fueron los ostrácodos y los conchostracodos (Spinicaudata: Cyclestheridae) con volúmenes altos, seguidos de los peces, larvas y pupas de dípteros (Chaoboridae y Chironomidae) que aunque presentaron volumenes más bajos tienen frecuencia de ocurrencia alta. En mayo las presas más importantes fueron restos de insectos no identificados, material vegetal (pelos absorbentes del sistema radicular de macrófitas), restos de peces y larvas y pupas de Diptera. En octubre insectos no identificados realizaron el mayor aporte en biomasa; sin embargo, larvas y pupas de díptera, al igual que ostrácodos presentaron frecuencias de ocurrencia más altas, aunque con menores aportes en volumen. A pesar de que se observaron variaciones temporales en la frecuencia de ocurrencia y el volumen de algunos grupos tróficos, sólo el aporte de ostrácodos fue diferente (tabla 2). No detectamos cambios en la dieta asociados con los periodos pluviométricos (Wilks' Lambda (1, 36) = 0,918, p = 1,00).
Tabla 2. Indice alimentario (IA) para cada grupo trófico en los tres periodos de capturas de P. blochii en la ciénaga de Cachimbero del 2003 (grupos tróficos: Ar = Arachnida, Co = Coleoptera, CCD = Copepoda, Cladocera y Crustacea, Di = Diptera, He = Hemiptera, Ho = Homoptera, Hy = Hymenoptera, Mo = Mollusca, Od = Odonata, Or = Orthoptera, Os = Ostracoda, Pi = Pisces, Sp = Spinicaudata, Tr = Trichoptera, Hu = huevos de invertebrados, ISI = insectos sin identificar; MV = material vegetal; MNI = material no identificado; estadísticos: χ = media aritmética, S = desviación estándar y CV = coeficiente de variación)
DISCUSIÓN
La población de P. blochii de la ciénaga de Cachimbero prefiere las estaciones con mayor cantidad de macrófitas. Reportes de la subespecie del Catatumbo (Galvis et al., 1997) y otras especies del mismo género (Le Bail et al., 2000. Citado por Lundberg y Littmann, 2003) coinciden en que la especie es de hábitos gregarios y es común encontrarla bajo troncos en el fondo de los ambientes acuáticos. Nuestras capturas por unidad de esfuerzo no reflejan dichas preferencias pues el mayor número de individuos capturados provino de la zona limnética y de las estaciones que presentaban mayor desarrollo de la franja litoral de macrófitas (complejo, entrecaños y hondonada) o de macrófitas libres flotantes (choza).
Los cambios en las condiciones ambientales de la ciénaga asociados al régimen pluviométrico no influencian cambios importantes en el crecimiento para ninguno de los sexos. Diversos estudios en sistemas suramericanos confirman que el periodo de aguas altas es el mayor periodo de alimentación y crecimiento para la biota acuática habitante en dichos sistemas (Lowe–McConell, 1987; Wootton, 1999) pues la oscilación en la hidrología de ríos y lagos suponen grandes cambios en el paisaje (Junk et al., 1989) que traen consigo cambios en la oferta de los recursos (Lowe–McConell, 1987). Diferentes especies de pimelódidos son conocidos por reducir la relación longitud–peso de acuerdo con el periodo hidrológico (Arboleda, 1985). La ciénaga Cachimbero es un ambiente particular ya que las variaciones en el volumen de agua almacenado son reflejo principalmente de las precipitaciones locales, más que de los aportes del canal principal del río Magdalena (Piza y Molina, 2004). A pesar de que las lluvias ocasionan algún cambio en el área inundada de la ciénaga, el comportamiento de P. blochii no presenta diferencias importantes en su coeficiente alométrico ni en su factor de condición. Esto indica que los individuos de esta población tienden a crecer isométricamente, al menos, en los tres periodos pluviométricos muestreados, reflejando la sutileza de los cambios temporales en la ciénaga.
La población de P. blochii en la ciénaga de Cachimbero, se reproduce sólo durante la época de máximas lluvias. Poblaciones de esta especie en otras cuencas con régimen hidrológico monomodal, presentan una estrategia reproductiva estacional, con un solo desove a lo largo de todo el año, asociado con movimientos migratorios entre los ríos y su plano inundable en busca de los lugares de desove (Carolsfeld et al., 2004; Galvis et al., 1997; Mojica y Jiménez, 2001). A pesar de que el volumen de agua de la ciénaga de Cachimbero está determinado por el régimen pluviométrico local, éste mantiene el régimen bimodal de la cuenca Magdalénica. Es interesante observar que a pesar de que la población de P. blochii presenta valores de bienestar (factor de condición) constantes, resultado del consumo permanente de diferentes presas, la mayor inversión en reproducción (aumento en relación gonadosomática y mayor proporción de individuos maduros) ocurre en el momento de máximas precipitaciones (octubre).
La proporción sexual de la población de P. blochii muestra una tendencia poligínica. En la cuenca alta del río Cauca se ha reportado una tendencia a la poligínia atribuida a alteraciones hormonales de la población producidas por cambios ambientales resultantes del vertimiento al río de residuos provenientes de la cría intensiva de aves (Torres, 2003). Sin embargo, la ciénaga de Cachimbero es un sistema que está siendo promovido como área de reserva ambiental, debido a sus buenas condiciones de conservación y baja intervención antrópica, de acuerdo con esto, es posible que este comportamiento reproductivo sea una estrategia de la especie más que el resultado de alteraciones en las condiciones ambientales del sistema.
Los periodos de sequías han sido caracterizados como periodos de escasez o de baja oferta de recursos tanto alimenticios como de hábitat (Lowe–McConell, 1987; Wootton, 1999). Esta reducción en la oferta de recursos se explica con base en la reducción del espejo de agua, lo que aumenta las interacciones competitivas y disminuye la disponibilidad de alimento alóctono, principalmente insectos (Wolf et al., 1988; Zavala–Camin, 1996). El índice de plenitud sugiere que P. blochii es una especie oportunista pues presentó los valores más altos de llenado estomacal (índice de plenitud) durante el periodo de estiaje (marzo).
Sumado a lo anterior, la población de P. blochii en la ciénaga de Cachimbero mostró hábitos alimentarios oportunistas reflejados en el amplio rango de presas utilizadas. La frecuencia de ocurrencia de cada ítem alimenticio fluctuó temporalmente, sugiriendo gran adaptabilidad trófica atribuida a la utilización de diversas presas (Gerking, 1994; Zavala–Camin, 1996).
Los cambios estacionales en la dieta son generalmente consecuencia de la disponibilidad de alimento (Wooton, 1999; Zavala–Camin, 1996). Wolf et al. (1988) encontraron que ciertos grupos de insectos presentan mayor abundancia durante los meses de mayor precipitación, generando una mayor oferta de presas en estos meses. Sin embargo, en la dieta de la población del nicuro en la cienaga de Cachimbero, sólo el índice alimentario (I. A., frecuencia de ocurrencia y volumen) de los conchostracodos (Spinicaudata: Cyclestheridae) fluctuó temporalmente, lo que parece indicar que las poblaciones de estas presas presentan tamaños poblacionales más elevados en marzo o bien, que dichas poblaciones no se ven afectadas por el régimen pluviométrico del sistema.
AGRADECIMIENTOS
Agradecemos a Idea Wild Biodiversity Conservation Organization por la donación de equipos que hicieron posible esta investigación. Así como también al fondo CODI de la Universidad de Antioquia, al Club Rotario, a la Corporación Académica Ambiental y al Grupo GAIA de la Universidad de Antioquia por el apoyo financiero, administrativo y logístico, que hizo posible la realización de este proyecto. A Juliana Cardona, Mauricio Castaño, Ana Lucía Estrada y José Andrés Posada por su colaboración con la identificación de los restos de insectos y plancton. A Javier Lobón y Castor Guisande por su orientación e ideas. A Nelson Molina por ceder los mapas del área. A todos los compañeros que participaron en las jornadas de campo y que acompañaron el arduo trabajo de laboratorio, especialmente a Ariel, Alex, David y Carlos. Y finalmente, agradecemos a los diferentes evaluadores que, con su cuidadosa revisión, contribuyeron sustancialmente a mejorar el resultado final de este trabajo.
REFERENCIAS
1. Arboleda A. 1985. Biología pesquera de los Grandes Bagres del río Caquetá. COA, (informe de trabajo). Bogotá, Colombia. [ Links ]
2. Carolsfeld J, Harvey B, Baer A, Ross C. 2004. Migratory fishes of South America: Biology, social importance and conservation status. World Fisheries Trust/Banco Mundial/IDRC. Victoria, Canada. [ Links ]
3. Cortés A. 1982. Los suelos del valle del Magdalena sector alto y medio. IGAC. Bogotá, Colombia. [ Links ]
4. Dahl G. 1971. Los peces del norte de Colombia. INDERENA. Bogotá, Colombia. [ Links ]
5. Galvis G, Mojica JI, Camargo M. 1997. Peces del Catatumbo. Asociación Cravo Norte. D'Vinni Editorial Ltda. Santafé de Bogotá, Colombia. [ Links ]
6. Gerking SD. 1994. Feeding ecology of fish. Academic Press, Inc. San Diego (California), U. S. A. [ Links ]
7. INPA. 2002. Boletín estadístico de pesca. Instituto Nacional de Pesca y Acuicultura, Ministerio de Agricultura. Bogotá, Colombia. [ Links ]
8. Junk WJ, Bayley PB, Sparks RE. 1989. The flood pulse concept in river–floodplain systems. Pp. 110–127. En: Dodge DP (ed.). Proceedings of the International Large River Symposium. Canadian Special Publication, Fisheries and Aquatic Sciences106. Ottawa (Ontario), Canada. [ Links ]
9. Kapestky JM, Escobar JJ, Arias P, Zárate M. 1978. Algunos aspectos ecológicos de las ciénagas del plano inundable del Magdalena. Proyecto para el desarrollo de la pesca continental INDERENA–FAO. Cartagena, Colombia. [ Links ]
10. Kawakami E, Vazoler G. 1978. Método gráfico e estimativa de alimentar aplicado no estudo de alimentação de peixes. V Simposio Latino–americano sobre oceanografía biológica. São Paulo, Brasil. [ Links ]
11. Lowe–McConnell RH. 1987. Ecological studies in tropical fish communities. Cambridge University Press. U. K. [ Links ]
12. Lundberg JG, Littmann MW. 2003. Family Pimelodidae (long–whiskered catfishes). Pp. 432–446. En: Reis RE, Kullander SO, Ferraris CJ Jr. (eds.). Checklist of the freshwater fishes of South and Central America. EDIPUCRS. Porto Alegre, Brasil. [ Links ]
13. Mejía P. 2003. Algunos aspectos de la ecología trófica de una comunidad de anfibios y reptiles de hojarasca, en un bosque fragmentado del municipio de Caucasia–Antioquia. Tesis de pregrado. Instituto de Biología, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia. Medellín, Colombia. [ Links ]
14. Miles C. 1971. Los peces del río Magdalena. Universidad del Tolima. Centro Audiovisual. UT Ediciones. Ibagué, Colombia. [ Links ]
15. Mojica JI, Jiménez LF. 2001. Revisión de la información hidrobiológica del Proyecto Hidroeléctrico Miel I. Informe final. Bogotá, Colombia. [ Links ]
16. Piza C, Molina N. 2004. Evaluación del comportamiento hídrico de la ciénaga de Cachimbero, implementando un modelo de balances de flujo. Tesis de pregrado. Facultad de Ingeniería, Universidad de Antioquia. Medellín, Colombia. [ Links ]
17. Prada–Pedreros S. 2003. Biologia, dinâmica populacional e avaliaçao do estoque de mandi–amarelo Pimelodus meculatus Lacépède, 1803, (Ostariophysi: Siluriformes, Pimelodidae) da bacia do alto e medio Rio Paraná, Brasil. Tese de Doutorado. Instituto de Biociências, Universidade Estadual Paulista. Río Claro (Sao Paulo), Brasil. [ Links ]
18. Prejs R, Colomnie G. 1981. Métodos para el estudio de alimentos y las relaciones tróficas de peces. Universidad Central de Venezuela, Instituto Zoología Tropical/Universidad de Varsovia. Varsovia, Polonia. [ Links ]
19. Shannon CE, Weaver W. 1948. The mathematical theory of communication. University Illinois Press. Urbana. Illinois, U. S. A. [ Links ]
20. Torres H, Zamora H, Montoya PN. 2003. Aspectos fenotípicos relevantes en la diferenciación del capaz Pimelodus grosskopfii Steindachner, 1880 entre poblaciones de los ríos Magdalena y Alto Cauca. Pp. 58. En: Olaya–Nieto CW, Atencio–García VJ (eds.). Memorias del VII Simposio Colombiano de Ictiología. 28 al 31 de mayo de 2003. Universidad de Córdoba. Montería, Colombia. [ Links ]
21. Torres H. 2003. Estudio descriptivo de la biología del capaz del Alto Cauca Pimelodus grosskopfii (Pises: Pimelodidae) en el valle del Cauca. Pp. 56. En: Olaya–Nieto CW, Atencio–García VJ (eds.). Memorias del VII Simposio Colombiano de Ictiología. 28 al 31 de mayo de 2003. Universidad de Córdoba. Montería, Colombia. [ Links ]
22. Valderrama–Barco M, Zárate–Villarreal M. 1989. Some ecological aspects and present state of the fishery of the Magdalena river basin, Colombia, South America. Pp. 409–421. En: Dodge DP (ed). Proceedings of the international large river symposium. Canadian Special Publication, Fisheries and Aquatic Sciences106. Ottawa (Ontario), Canada. [ Links ]
23. Vazzoler AE. 1996. Biologia da reprodução de peixes teleósteos: teoria e práctica. Editora DAUFSC. Maringá (Paraná), Brasil. [ Links ]
24. Wolf M, Matthias U, Roldan G. 1988. Estudio del desarrollo de los insectos acuáticos, su emergencia y ecología en tres ecosistemas diferentes en el departamento de Antioquia. Actualidades Biológicas, 17(63):2–27. [ Links ]
25. Wootton RJ. 1999. Ecology of teleost fishes. Second edition. Fish and fisheries series/Kluwer Academic Publishers. The Netherlands. [ Links ]
26. Zar JH. 1999. Comparing simple linear regression equations. Pp. 360–376. En: Biostatistical analysis. Fourth edition. Prentice Hall. New Jersey, U. S. A. [ Links ]
27. Zavala–Camin LA. 1996. Introduçâo aos estudos sobre alimentaçâo natural em peixes. EDUEM/Editora da Universidade Estadual de Maringá. Maringá (Paraná), Brasil. [ Links ]
Recibido: abril 2007
Aceptado: noviembre 2007