Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.30 no.88 Medellín Jan./June 2008
ARTÍCULOS DE INVESTIGACIÓN
ALGUNOS ASPECTOS BIOLÓGICOS DE LA POBLACIÓN DE PROCHILODUS MAGDALENAE EN LAS CIÉNAGAS DE TUMARADÓ (RÍO ATRATO), COLOMBIA
SOME BIOLOGICAL ASPECTS OF PROCHILODUS MAGDALENAE POPULATION IN TUMARADÓ FLOODPLAIN LAGOONS (ATRATO RIVER), COLOMBIA
Ursula Jaramillo–Villa1; Luz F. Jiménez–Segura2
1 Grupo Ictiología Universidad de Antioquia (GIUA). Instituto de Biología, Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia. ujaramillo@yahoo.com.
2 Grupo Ictiología Universidad de Antioquia (GIUA). Instituto de Biología, Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia. ljimenez@matematicas.udea.edu.co.
Resumen
Se colectaron 355 individuos de Prochilodus magdalenae provenientes de las capturas realizadas por los pescadores artesanales de las ciénagas de Tumaradó, ubicadas en la cuenca baja del río Atrato (Chocó), Colombia, dentro del Parque Nacional Natural Katios. Las colectas se realizaron entre julio y diciembre de 2004, durante el periodo de aguas altas. Las tallas de captura variaron entre 190–380 mm de longitud estándar (LE); aunque no se observaron diferencias significativas entre los meses de muestreo, en el mes de diciembre se registraron los individuos de mayor talla. Las proporciones sexuales mostraron diferencias significativas, predominando las hembras en todos los meses. La abundancia de individuos maduros, la relación gonadosomática, el factor de condición y el coeficiente de alometría evidencian que la época reproductiva de la especie en el bajo Atrato comienza entre diciembre y julio. El número de ovocitos promedio por hembra fue de 52.698; los diámetros presentaron un amplio rango de variación en los meses de muestreo. 22,25% de las capturas se encontraron por debajo de la talla mínima de captura reglamentaria.
Palabras clave: Prochilodus magdalenae, río Atrato, época reproductiva, lagos de plano de inundación, Colombia
Abstract
It was obtained 355 individuals of Prochilodus magdalenae from local fisheries in Tumaradó floodplain lagoons, low Atrato basin (Chocó), Colombia located in Katios National Natural Park. Sampling was made along high water period in July–December 2004. Range of fish standard length was 190–380 mm; in spite of there were not significant differences in months, individual's length was higher in December. Sexual ratio was different between months; female's number was always higher. Mature individual abundance, gonadosomatic relationship, condition factor, and allometric coefficient suggest that reproductive period of P. magdalenae occurs between December and July. Oocites mean number by female was 52.698. Oocyte diameter showed high variation along sampling months. 22.25% of the fishes collected were under the permit minimum capture size.
Key words: Prochilodus magdalenae, Atrato river, reproductive seasonality, floodplain lakes, Colombia.
INTRODUCCIÓN
Prochilodus magdalenae (Steindachner, 1879) es la especie dulceacuícola con mayor importancia comercial en Colombia; ha sustentado por muchos años el mayor porcentaje de las pesquerías en el Magdalena, Sinú y Atrato (Mojíca et al., 2002; Olaya–Nieto et al., 2003; Rivas et al., 1999; Valderrama et al., 1993) y por lo tanto la seguridad alimentaría y subsistencia de los pescadores y pobladores ribereños. En los últimos años se ha registrado una alarmante disminución del volumen de esta especie en las pesquerías de todo el país; para la cuenca del Magdalena se registra una pérdida del 84% al aporte de volumen a las pesquerías desde 1978 hasta 1999 (Mojíca et al., 2002). En la cuenca del Sinú la especie aportaba el 47,2% de la captura total en el periodo 1997–2002, en el periodo 2000–2002 este aporte disminuyó a 22,7% (Valderrama, 2002).
En la cuenca del Atrato a pesar de ser ésta la especie ictíca más estudiada (Rivas et al., 1999), no se cuenta con suficiente información sobre la dinámica de las poblaciones, especialmente en la cuenca baja. En el medio Atrato, P. magdalenae es la especie más consumida y comercializada, registrándose en Quibdó un aporte del 84,9% al total del volumen que llega al puerto de la ciudad, según los registros del Instituto Colombiano de Desarrollo Rural Incoder en 2005.
En las ciénagas de Tumaradó, la especie aporta el 79,5% al volumen total de la pesquería artesanal (Jaramillo–Villa, 2005). El presente estudio tiene como objetivo determinar algunas características biológicas de la población de P. magdalenae explotada por los pescadores en los planos de inundación del río Atrato, con el fin de proporcionar información útil para el manejo de las pesquerías dentro del área del Parque Nacional Natural Katios y en la región del bajo Atrato.
MATERIALES Y MÉTODOS
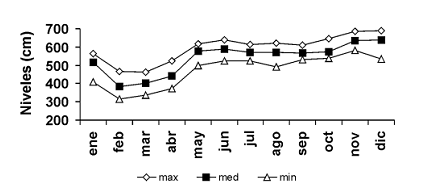
Área de estudio. El río Atrato tiene una cuenca hidrográfica de 37.700 km2, una longitud aproximada de 500 km y es considerado uno de los ríos más caudalosos del mundo. La temperatura promedio es de 26,4 °C, presentando poca variación a través del año (Azobional, 1989). La precipitación presenta una media anual de 3.200 mm3 y un régimen unimodal (lluvias entre mayo a noviembre y estiaje entre diciembre y abril; se observa un pequeño estiaje en junio) lo que repercute en cambios temporales del nivel del agua del río y en su influencia sobre el plano de inundación (figura 1).
Figura 1. Promedio de los niveles del agua del río Atrato entre 1990–1993, Colombia (IDEAM, 1995)
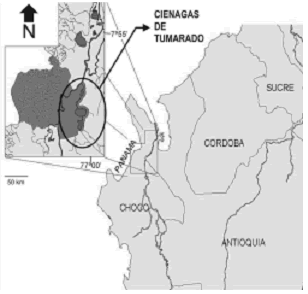
El tramo final del río, presenta un extenso plano de inundación conformado por lagos y caños de conexión entre ellas y el cauce principal del río. Entre estos lagos (localmente denominados ciénagas), se encuentra el complejo de las ciénagas de Tumaradó formado por cuatro cuerpos de agua que ocupan un área aproximada de 2.563 ha, dentro del parque Nacional Natural Katios (Chocó), Colombia (Mora 1990) (figura 2).
Figura 2. Ubicación geográfica de las ciénagas de Tumaradó (Chocó), Colombia
Las ciénagas de Tumaradó actúan activamente como amortiguador de caudal, su función hidráulica es extremadamente importante, pues sus conexiones con el río León y el río Atrato permiten amortiguar los cambios drásticos en el nivel del agua generados por la dinámica de las lluvias (Azobional, 1989). Estos sistemas son poco profundos y presentan productividades primarias netas bajas. Sus aguas son oligotróficas, presentan color parduzco y no se observa estratificación térmica. El plancton es escaso pero diverso y su productividad es baja (Palacio et al., 2002).
Trabajo de campo. Entre julio y diciembre del 2004 se realizaron muestreos mensuales en los puertos de pescadores Tumaradó y Puerto Plata. Cada muestreo tuvo una duración que varió entre diez y quince días. En cada puerto se tomó una muestra al azar de ejemplares de P. magdalenae capturados por los pescadores; de cada ejemplar se registró longitud estándar (LE) y peso, y se definió sexo y estadio de madurez gonádica. Para definir el estadio de madurez gonádica fue considerada la clasificación de Vazzoler (1996) que asume cinco estadios de maduración: A = virgen; B = en maduración; C = maduro; D = desovado; E = reposo. Las gónadas fueron fijadas en formaldehído al 5% para su posterior procesamiento en laboratorio.
Trabajo de laboratorio. Las gónadas fueron pesadas en una balanza con precisión de 0,001 g. Para confirmar el estadio de madurez gonadal, las gónadas fueron observadas nuevamente en el laboratorio con la ayuda de microscopio estereoscópico. Para estimar el número de ovocitos, se realizó el conteo del número de unidades presentes en un gramo de gónada de todas las hembras en estadio C y luego se estimó el número total de acuerdo con el peso de las gónadas. El diámetro de cada ovocito fue medido con la ayuda de una reglilla milimétrica instalada en el ocular del estereoscópico.
Procesamiento y análisis de los datos. Se calculó la talla mínima, media y máxima de captura para cada sexo y la frecuencia de tallas. Para comprobar si existían diferencias significativas entre las tallas para los meses de muestreo, se realizó una prueba de varianza no paramétrica (Kruskal–Wallis, 1952).
El coeficiente de alometría se estimó mediante la relación talla–peso de los individuos para cada uno de los meses de captura. Para definir si existían diferencias significativas entre los meses de captura se realizó una comparación de pendientes siguiendo la propuesta de Zar (1998).
Las proporciones sexuales se estimaron por mes de muestreo y se probó si existían diferencias significativas entre estas realizando un Chi2. Se determinaron los periodos reproductivos calculando la variación temporal de la frecuencia de estadios de maduración para cada sexo separadamente, considerando los individuos colectados en cada mes como el 100%. La relación gonadosomática (RGS) y el factor de condición (K) fueron calculados de acuerdo con Vazzoler (1996); para definir si existían diferencias significativas entre estos índices en los meses de muestreo se realizó una prueba de varianza no paramétrica (Kruskal–Wallis, 1952).
La talla media de madurez sexual se determinó a partir de la distribución de frecuencias acumuladas de machos y hembras en estadio de desarrollo gonadal C por clase de tamaño, según Vazzoler (1996). Se estimó el número de huevos por gramo de hembra y, a partir de las distribuciones de frecuencias de los diámetros de los huevos de la totalidad de las hembras en estadio de madurez gonadal en C, se determinó el tipo de desove.
Para todas las pruebas fue asumido un nivel de significancia del 95% (a = 0,05) y fue utilizado el programa STATGRAPHICS 6.0.
RESULTADOS
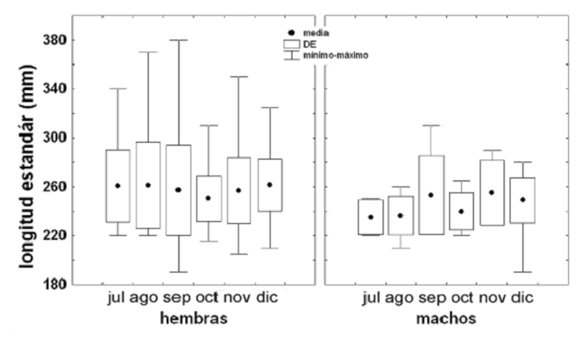
La muestra de individuos analizados tuvo un N = 355. La talla media de captura fue de 255 mm de LE, siendo que para las hembras fue de 257 (190–380) mm de LE y para los machos de 245 (190–310) mm de LE. No se observaron diferencias entre los meses de muestreo (H = 8,801; p = 0,117). La talla mínima de captura (190 mm) se registro en septiembre y diciembre y la mas alta en septiembre (380 mm) (figura 3).
Figura 3. Longitud estándar (LE) mínima, media y máxima de captura de P. magdalenae para hembras y machos en las ciénagas de Tumaradó (Chocó), Colombia, durante el periodo julio–diciembre de 2004
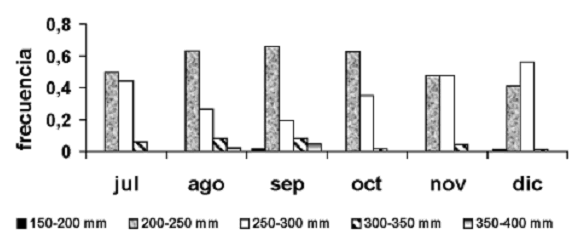
Las clases de tamaño dominantes en las capturas fueron las de 200–250 mm y de 250–300 mm; sólo en el mes de septiembre se observó representación de todas las clases de tamaño en las capturas (figura 4).
Figura 4. Distribución de tallas de P. magdalenae en las ciénagas de Tumaradó (Chocó), Colombia, durante el periodo julio–diciembre de 2004
La relación longitud–peso presentó una tendencia a la isometría, evidenciada en el valor del coeficiente de alometría (b) que fluctuó alrededor de 3. No existen diferencias significativas en el coeficiente de alometría entre los meses (F (5; 342) = 0,000045; p > 0,05), sin embargo, este valor fue muy bajo en septiembre (tabla 1).
Tabla 1. Coeficientes de alometría (b) estimados a partir de la relación longitud–peso mensual de Prochilodus magdalenae de las ciénagas de Tumaradó (río Atrato), Colombia, durante el periodo julio–diciembre de 2004
La proporción sexual fue significativamente diferente (X2 = 42,1; g. l. = 1; p < 0,05); con una proporción macho:hembra de 17,6:82,4. Presentándose un predominio de hembras en todos los meses. En diciembre se presentó la menor diferencia entre la proporción de sexos (X2julio = 56,25; X2agosto = 38,32; X2septiembre = 69,9; X2octubre = 54,15; X2noviembre = 66,94; X2diciembre = 7,95; g. l. = 1).
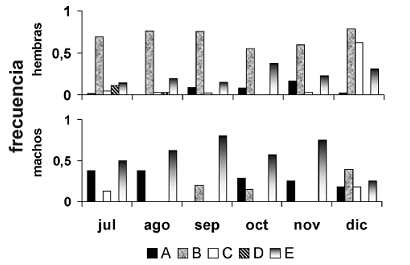
En todo el periodo de muestreo, dominaron los individuos en estadio gonadal virgen (A), en maduración (B) y en reposo (E). Solo en diciembre y julio se observaron individuos maduros (C); y solamente en julio se observaron individuos desovados (D) (figura 5).
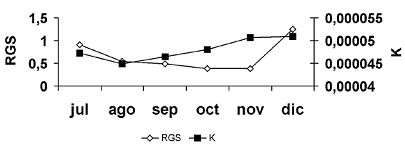
La RGS no fue diferente entre los meses de muestreo (p > 0,05), sin embargo sus valores disminuyen progresivamente en el periodo julio–noviembre, y en diciembre se presenta un aumento notable. El factor de condición (K) tampoco es diferente entre los meses de muestreo (p > 0,05); presentando una disminución en el periodo julio–agosto y posteriormente un aumento progresivo en el periodo septiembre–diciembre (figura 6).
Figura 5. Distribución de frecuencias de estadios de madurez gonadal de P. magdalenae para hembras y machos en las ciénagas de Tumaradó (Chocó), Colombia, durante el periodo julio–diciembre de 2004
Figura 6. Promedio mensual de la relación gonadosomática (RGS) y el factor de condición (K) de P. magdaleanae en las ciénagas de Tumaradó (Chocó), Colombia, durante el periodo julio–diciembre de 2004
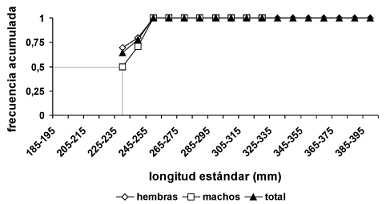
No fue posible determinar con exactitud la talla media de madurez sexual, pues en los intervalos de tallas menores, el número de capturas fue muy bajo por lo que estos individuos tuvieron que ser eliminados del análisis. De este modo la curva obtenida no muestra, de manera evidente, cual es la talla a la que el 50% de los individuos ha madurado, sin embargo, la curva obtenida muestra que por encima de 245 mm de LE, el 100% de los individuos se encuentran maduros y es posible asumir, que por lo menos para machos, la talla media de madurez es cercana a 230 mm LE (figura 7).
Figura 7. Talla media de madurez sexual para hembras y machos de P. magdalenae en las ciénagas de Tumaradó (Chocó), Colombia, durante el periodo julio–diciembre de 2004
El 22,25% del total de los individuos analizados se encontraban por debajo de la talla mínima de captura determinada por el INCODER (Instituto Colombiano de Desarrollo Rural) para esta cuenca (24 cm de LE) y el 14,55% de los individuos maduros se encontraban por debajo de esta talla.
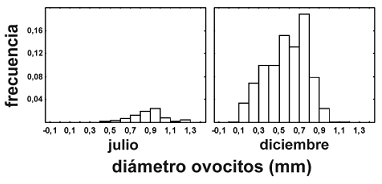
Solo se encontraron hembras con gónadas maduras en julio y en diciembre. El promedio de ovocitos por hembra en julio fue 99.475 (70.251–128.700) y en diciembre 40.223 (10.546–72.538). El número de ovocitos por gramo de hembra en julio fue de 268,39 y en diciembre de 92,46. El diámetro de los ovocitos, presentó una distribución de frecuencias homogénea, con variaciones entre 0,4 y 1,3 mm en julio, y entre 0,08 y 1,22 mm en diciembre, sugiriendo que la especie realiza desove total (figura 8).
DISCUSIÓN
Las tallas de captura encontrados en este trabajo no divergen mucho de las reportados por otros autores para la región del bajo Atrato (160–395 mm de LE; Arango, 2001) y medio Atrato (220–340 mm de LE; Román–Valencia, 1993). En otras cuencas colombianas la amplitud de los intervalos de tallas reportadas es mayor: 150–385 mm de LE en la cuenca media–alta del Magdalena (Arce et al., 2005); 105–500 mm de LE en la cuenca baja del Magdalena (Valderrama y Petrere, 1994); 95–435 mm de LE en la cuenca del Sinú (Valderrama, 2004); 130–360 mm LE en las ciénagas de Lorica y Betancí, en el bajo Sinú (Valderrama y Vejarano, 2001). La talla de captura de P. magdalenae depende de las especificaciones en los aparejos de pesca; en las ''cienagas'' colombianas, la pesca se realiza principalmente con redes de espera, conocidas como ''trasmallos'' y con otros aparejos como atarrayas, trampas y arpones. En la cuenca baja del río Atrato, el aparejo de pesca mas utilizado es el trasmallo (Jaramillo–Villa, 2005), mientras que en las cuencas de los ríos Magdalena y Sinú, la diversidad de aparejos es mayor y esto repercute en la amplitud de los intervalos de tallas reportadas. Por otro lado en las ciénagas de Tumaradó el tamaño de ojo de malla de los trasmallos es regulado por las autoridades del Parque Nacional Natural Katios, lo que resulta en tallas de captura mayores, comparadas éstas con otros sitios donde no hay regulación.
Figura 8. Distribución de diámetros de los ovocitos de la todas las hembras de P. magdalenae en C, capturadas en julio y diciembre de 2004 en las ciénagas de Tumaradó (Chocó), Colombia
Las tallas de captura no presentaron diferencias entre los meses, debido a que todos los muestreos se realizaron durante el periodo de aguas altas, época de condiciones ambientales muy similares, sin embargo en diciembre se capturó el mayor porcentaje de individuos grandes (> 250 mm LE) debido a que en este momento termina el periodo de varios meses de alimentación dentro de las ciénagas y comienza desarrollo gonadal, lo que resulta en la captura de individuos mas grandes. Para estas mismas ciénagas se reportan diferencias significativas en las tallas de captura entre el periodo de aguas altas y bajas (Arango, 2001).
En la población de P. magdalenae estudiada, predominaron las hembras; solo en diciembre la población presentó tendencia al equilibrio de sexos. Román–Valencia (1990) en el medio Atrato, reporta un equilibrio entre los sexos, con una leve tendencia al predominio de hembras. En la cuenca del Sinú, Olaya–Nieto et al. (2003) reportaron que hay predominio de machos en las capturas. La tendencia encontrada en las ciénagas estudiadas puede ser evidencia de que los aparejos de pesca son selectivos a las hembras, debido a su mayor tamaño.
La época de reproducción de P. magdalenae está íntimamente relacionada con los patrones hidrológicos de inundación y estiaje en las cuencas (Dahl, 1965; Olaya–Nieto et al., 2003; Valderrama y Petrere, 1994). Este comportamiento es similar al que presentan otras especies del mismo género en ríos suramericanos (Duque et al., 1998; Carosfield et al., 2003). En el medio Atrato la especie presenta un solo periodo reproductivo, con una fase pre–reproductiva que se extiende desde abril hasta diciembre, maduración gonadal entre diciembre y abril durante la subienda (migración hacia el río) y desove en abril y mayo cuando se presenta la bajanza o migración río abajo (Cala y Román–Valencia, 1999).
En el río Sinú la época de desove se presenta entre marzo y septiembre, con pico reproductivo en mayo y junio (Olaya–Nieto et al., 2003) y en el río Magdalena la especie tiene dos periodos reproductivos sincronizados con el régimen hidrológico bi–modal de esta cuenca (Jiménez–Segura, 2007).
La captura en las ciénagas de Tumaradó de individuos iniciando maduración gonadal y maduros, en los meses de noviembre y diciembre, coincide con el patrón observado por estudios previos en esta cuenca (Cala y Román–Valencia, 1999), donde los eventos reproductivos de esta especie migratoria se sincronizan con las épocas de menor precipitación e inicio de lluvias, que para esta cuenca se ajusta a un régimen unimodal.
Los valores del factor de bienestar, de la relación gonadosomática y del coeficiente de alometría, son otras evidencias que confirman los momentos reproductivos de la especie en la cuenca baja del río Atrato, pues en los meses de julio y diciembre se presentan los valores más altos de estas relaciones. Esto evidencia que durante estos meses los individuos ya metabolizaron su energía acumulando grasas, patrón típico que se presenta antes del comienzo de la migración y que se asocia con los eventos reproductivos (Vazzoler, 1996).
Los resultados encontrados acerca de los periodos reproductivos de la especie coinciden con lo reportado en los trabajos de Román–Valencia (1993) y, Cala y Román–Valencia (1999), sin embargo, se observa un leve desfase en el comienzo de la reproducción, pues en la cuenca baja se presenta en el mes de diciembre, mientras que Cala y Román–Valencia (1999) señalan que para el sector medio de la cuenca, el inicio del momento reproductivo se presenta un mes después (enero). A pesar de que son resultados de estudios realizados en tiempos diferentes, se puede inferir que la iniciación del periodo reproductivo de esta especie dependerá de la ubicación de sus individuos en la cuenca (baja, media o alta), determinados por la influencia diferencial de los cambios hidrológicos en cada sector.
Se presentaron dificultades para determinar la talla media de madurez sexual, pues el número de individuos capturados en los intervalos de tallas menores no fue suficiente, debido a que el tamaño de ojo de malla en las ciénagas de Tumaradó es regulado. La talla media de madurez sexual encontrada para machos (230 mm de LE) es menor, que la determinada para la cuenca media del río Atrato en 241 mm LE para machos y 251 mm LE para hembras (Román–Valencia, 1990, 1993). Sin embargo los resultados aquí encontrados deben asumirse con precaución pues corresponden a un periodo hidrológico limitado y que tiene en cuenta solamente el rango de tallas capturado por los pescadores. Para el río Sinú, la talla media de madurez sexual se ha establecido en 242 mm de LE para ambos sexos según Valderrama y Vejarano (2001); y en 284 mm de longitud total (LT) para ambos sexos según Olaya–Nieto et al. (2003); para el río Magdalena esta talla se ha establecido en 267 de LE mm para machos y 345 mm de LE para hembras (Valderrama y Zarate, 1989).
Solo el 14,55% de los individuos maduros se encontraban por debajo de la talla mínima de captura reglamentada, y solo el 22,25% de los individuos capturados por los pescadores se encontraban por debajo de la talla mínima de captura. Estos resultados muestran que la extracción de P. magdalenae que se está llevando a cabo en estas ciénagas se ajusta a la reglamentación que determina que la talla mínima de captura para la cuenca del río Atrato es de 240 mm LE según el Incoder, y que dicha talla está determinada apropiadamente pues permite que un alto porcentaje de los individuos explotados haya alcanzado la primera reproducción al momento de ser capturada. Es decir que la extracción artesanal que se permite dentro del área del parque no ejerce una fuerte presión de captura sobre la población de esta especie, como es lo esperado para un área de reserva como el Parque Nacional Natural Katios. Este resultado contrasta con las demás cuencas del país donde se presenta un alto porcentaje de capturas por debajo de la talla mínima reglamentaria, como en el Magdalena medio donde un 87% de las capturas se encuentran por debajo de la talla reglamentaria de 25 cm LE (Arce et al., 2005).
Para el medio Atrato se reporta un promedio de 148.942 (111.546–240.055) ovocitos con un diámetro entre 0,67 y 0,83 mm (Román–Valencia, 1990, 1993). Nuestros resultados muestran un número de ovocitos y diámetro, menor al reportado por Román–Valencia. Además nuestros valores fueron menores en diciembre que en julio, sugiriendo que en diciembre se tuvieron en cuenta hembras que todavía se encontraban en proceso de maduración, en estadio B tardío. Sien embargo, el número de ovocitos encontrado está dentro del rango de variación reportado por Dahl (1965) para la especie y es común que se presenten variaciones amplias entre los valores máximos y mínimos (Florez, 1985). Los resultados encontrados respecto a los ovocitos sugieren que la maduración gonadal comienza en diciembre y que este proceso sucede al interior de las ciénagas, y que este proceso se extiende hasta julio, mes en el que aun se capturan hembras maduras en la parte baja de la cuenca. La distribución homogénea que presentaron los rangos de los diámetros de los ovocitos, confirman que la especie presenta desoves totales.
Finalmente es importante tener en cuenta que al analizar características biológicas de P. magdalenae en una ciénagaes fundamental considerar que la migración es el factor determinante de dichas características, pues toda la fisiología, comportamiento y estructura poblacional de la especie reflejan y dependen del fenómeno migratorio. En esta investigación debe tenerse en cuenta que los resultados obtenidos solo corresponden al periodo de aguas altas (julio–diciembre) y por lo tanto no aportan información sobre aspectos ecológicos de P. magdalenae en las ciénagas durante el periodo de aguas bajas; información que es vital para esclarecer la dinámica poblacional y el efecto de la pesca artesanal sobre esta especie.
AGRADECIMIENTOS
A la Embajada Real de los Países Bajos–Holanda por la financiación de la investigación ''Actividad pesquera en las ciénagas de Tumaradó y aspectos sobre la biología de las especies explotadas'', en el marco del proyecto Parques del Pacifico; a la Corporación para la Protección Ambiental, Cultural y el Ordenamiento Territorial (CORPACOT), a la Unidad Administrativa Especial del Sistema de Parques Nacionales – Seccional Noroccidental (UAESPNN) y al Parque Nacional Natural Katios por la ejecución de dicha investigación. A todos los integrantes del Grupo de Ictiología Universidad de Antioquia (GIUA) por la asesoría, compañía y asistencia. A los Pescadores y sus familias en Tumaradó y Puerto plata por permitir tomar los datos de esta investigación y a Luís Zapata por las valiosas correcciones al documento inicial.
REFERENCIAS
1. Arango GA. 2001. Algunos aspectos biológico–pesqueros de cuatro especies ícticas en la ciénaga de Tumaradó. Trabajo de grado. Instituto de Biología. Universidad de Antioquia. Medellín (Antioquia), Colombia. [ Links ]
2. Arce MA, Gutiérrez AL, Sánchez P. 2005. Evaluación del estado poblacional y análisis de distribución espacial de Prochilodus magdalenae (Steindachner 1879), Pseudoplatystoma fasciatum (Linnaeus, 1766) y Sorubim cuspicaudus (Littman, Burr y Nass, 2000), en la cuenca media–alta del río Magdalena durante la subienda 2003–2004. Pp.121–125. En: Rivas TS, Rincón CE, Mosquera HR (compiladores). Memorias VIII Simposio Colombiano de Ictiología. Quibdo (Chocó), Colombia. Universidad Tecnológica del Chocó Diego Luís Córdoba. Chocó, Colombia. [ Links ]
3. Azobional. 1989. Plan guía de manejo Parque Nacional Natural Katios. Informe presentado a Unidad Administrativa Especial del Sistema de Parques Nacionales Naturales (UAESPNN) por Azobional (Universidad Nacional de Colombia). Bogotá, Colombia. [ Links ]
4. Cala P, Román–Valencia C. 1999. Cambios cíclicos histomorfológicos en las gónadas del bocachico Prochilodus magdalenae (Pisces: Curimatidae), del río Atrato, Colombia. Dahlia (Revista Asociación Colombiana de Ictiología), 3:3–16. [ Links ]
5. Carosfield J, Harvey R, Ross C, Baer A. 2003. Migratory fishes of South America: biology, fisheries and conservation status. Co–published by IDRC and the World Bank. British Columbia, Canada. [ Links ]
6. Dahl G, Medem F, Ramos H. 1965. El bocachico, contribución al estudio de su biología y ambiente. Departamento de Pesca de la Corporación Autónoma Regional de los Valles del Magdalena y el Sinú. Banco de la República. Bogotá, Colombia. [ Links ]
7. Duque AB, Taphorn D, Winemiller K. 1998. Ecology of the coporo, Prochilodus mariae and status of annual migrations in Western Venezuela. Environmental Biology of Fishes, 55:33–46. [ Links ]
8. Florez F. 1985. Observaciones ecológicas sobre los peces bocachico real (Prochilodus mariae) y bocachico cardumero (Suprasinelepichthys laticeps) del sistema del río Mética y algunos datos comparativos del bocachico (Prochilodus reticulatus magdalenae) del río Cauca, afluente del río Magdalena, Colombia. Acta Biológica Colombiana, 1(2):10–31. [ Links ]
9. IDEAM. 1995. Estadísticas hidrológicas de Colombia 1990–1993. Tomo I. Ministerio del Medio ambiente. Bogotá, Colombia. [ Links ]
10. Jaramillo–Villa U. 2005. Actividad pesquera en las ciénagas de Tumaradó y aspectos sobre la biología de algunas de las especies de peces explotadas. Trabajo de grado. Instituto de Biología. Universidad de Antioquia. Medellín (Antioquia), Colombia. [ Links ]
11. Jiménez–Segura LF. 2007. Ictioplancton y periodos reproductivos de los peces en la cuenca media del río Magdalena. Tesis de doctorado. Instituto de Biología. Universidad de Antioquia. Medellín (Antioquia), Colombia. [ Links ]
12. Mojíca JI, Castellanos C, Usma S, Álvarez R. 2002. Libro rojo de los peces dulceacuícolas de Colombia. La serie libros rojos de especies amenazadas de Colombia. Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Ministerio del Medio Ambiente. Bogotá, Colombia. [ Links ]
13. Mora JM. 1990. Impacto ambiental de la pesca sobre el complejo de ciénagas de Tumaradó Parque Nacional Natural Katios, Chocó–Colombia. Trabajo de grado. Universidad Jorge Tadeo Lozano. Bogotá, Colombia. [ Links ]
14. Olaya–Nieto CHW, Segura–Guevara FF, Bru–Cordero SB, Blanco–Viellar HM. 2003. Biología reproductiva del bocachico (Prochilodus magdalenae Steindachner 1878) en el río Sinú (Colombia). Revista II Congreso Iberoamericano Virtual de Acuicultura CIVA 2003:723–734. <http://www.revistaaquatic.com/civa2003/>. Fecha de consulta: 24 de agosto de 2005. [ Links ]
15. Palácio JA, Ramírez JJ, Delgado R, Arango GA, Naranjo G. 2002. Evaluación ecológica y socioeconómica de las ciénagas de Tumaradó con miras a un ordenamiento pesquero. Informe presentado a la Unidad Administrativa Especial del Sistema de Parques Nacionales (UAESPNN) – Seccional Noroccidental, por Corporación Ambiental Universidad de Antioquia y Grupo de Gestión y Modelación Ambiental (GAIA). Medellín (Antioquia), Colombia. [ Links ]
16. Rivas T, Conto B, Puentes E, Cuesta E, Mena M, Ramírez A, Blandón M, Casas Y, Carrascal O, Rivas W. 2002. Estado actual de la pesca en la cuenca media del río Atrato, Choco – Colombia. Revista Universidad Tecnológica del Chocó, 15: 25–32. [ Links ]
17. Román–Valencia C. 1990. Hidrobiología sistema del medio río Atrato. Informe final presentado a Colciencias y Corporación Autónoma regional del Chocó (Codechoco). Bogotá, Colombia. [ Links ]
18. Román–Valencia C. 1993. Ciclo biológico del bocachico Prochilodus magdaelenae (Steindachner 1879) (Pisces: Prochilodontidae) en la cuenca del río Atrato, Colombia. Brenesia, 39(40):59–70. [ Links ]
19. Valderrama M. 2002. Monitoreo y estadística pesquera en la cuenca del río Sinú con participación comunitaria. Informe final período marzo 2001– febrero 2002. Informe presentado a Urrá S. A., E. S. P. Montería (Córdoba), Colombia. [ Links ]
20. Valderrama M. 2004. Estado de la población de bocachico Prochilodus magdalenae (Pisces: Characiformes) y su manejo en la cuenca del rio Sinú, Colombia. Dahlia (Revista Asociación Colombiana de Ictiología), 7:3–12. [ Links ]
21. Valderrama M, Petrere M. 1994. Crecimiento del bocachico Prochilodus magdalenae (Steindachner 1878) (Prochilodontidae), y su relación con el régimen hidrológico en la parte baja de la cuenca del río Magdalena (Colombia). Boletín Científico Instituto Nacional de Pesca y Acuicultura, 23:37–40. [ Links ]
22. Valderrama M, Vejarano S. 2001. Monitoreo y estadística pesquera en la cuenca del río Sinú con participación comunitaria. Informe final período marzo 2000–febrero 2001. Informe presentado a Urrá S. A., E. S. P. Montería (Córdoba), Colombia. [ Links ]
23. Valderrama M, Zarate M. 1989. Some ecological aspects and present state of the fishery in the Magdalena river basin, Colombia – South America. Pp. 409–421. En: Dodge DP (ed.). Proccedings of the International Large River Symposium. Canadian Special Publications of Fish and Aquatic Science. Canada. [ Links ]
24. Valderrama M, Petrere M, Zarate M, Uribe G. 1993. Parámetros poblacionales (mortalidad y rendimiento máximo sostenible) y estado de explotación del bocachico Prochilodus magdalenae del bajo Magdalena, Colombia. Boletín Científico Instituto Nacional de Pesca y Acuicultura, 1:43–60. [ Links ]
25. Vazzoler AE A de M. 1996. Biología da reprodução de peixes teleósteos: teoria e practica. Editora da Universidade Estadual da Maringá. Maringá, Brasil. [ Links ] [ Links ]
26. Zar H. 1998. Statistical Analisis. University of New York. New York, United States of America.