Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.30 no.89 Medellín July/Dec. 2008
ECOLOGÍA
SOMBRA DE SEMILLAS, SUPERVIVENCIA DE PLÁNTULAS Y DISTRIBUCIÓN ESPACIAL DE LA PALMA OENOCARPUS BATAUA, EN UN BOSQUE DE LOS ANDES COLOMBIANOS
SEED SHADOWS, SEEDLING SURVIVAL AND SPATIAL DISTRIBUTION OF THE PALM OENOCARPUS BATAUA, IN A FOREST OF THE COLOMBIAN ANDES
Rosario Rojas–Robles1; Adolfo Correa2; Elizabeth Serna–Sánchez3
1Departamento de Biología. Universidad Nacional de Colombia (Sede Bogotá). Bogotá (Cundinamarca), Colombia. Dirección eletrónica: <mrrojas@unal.edu.co>
2Maestría, Bosques y Conservación Ambiental. Departamento de Ciencias Forestales. Universidad Nacional de Colombia (Sede Medellín). Medellín (Antioquia), Colombia. Dirección: <milpesos@epm.net.co>
3Maestría en Geomorfología y Suelos. Facultad de Ciencias. Universidad Nacional de Colombia (Sede Medellín). Medellín (Antioquia), Colombia. Direción electrónica: <eserna@unalmed.edu.co>
Resumen
El objetivo de este trabajo fue cuantificar aspectos demográficos de una población de la palma Oenocarpus bataua tales como sombra de semillas, supervivencia de plántulas, densidad y distribución espacial de semillas, plántulas, juveniles y adultos, en un bosque húmedo premontano de Antioquia (Colombia), mediante parcelas circulares y otras de media hectárea y de una hectárea. Esta palma de dosel y sub–dosel produce frutos de tamaño grande que son consumidos por frugívoros. La abundante producción de frutos y las cortas distancias de dispersión, generan una sombra de semillas espacialmente restringida (a pesar de las altas tasas de remoción), la cual produce una distribución agregada de plántulas y juveniles, posiblemente relacionada con la defaunación de estos bosques por transformación del hábitat y cacería, no contándose así con la calidad y abundancia de dispersores de larga distancia como aves y mamíferos grandes. Sin embargo, ardillas (Microsciurus mimulus y Sciurus granatensis) y guatines (Dasyprocta punctata) contribuyen en la dispersión a corta distancia, aunque en menor proporción mostraron evidencias de dispersión a mayores distancias (53–62 m). A diferencia de los estadios juveniles los adultos mostraron un patrón aleatorio que podría ser explicado por la mortalidad denso–dependiente de los estadios de semillas, plántulas y juveniles. A pesar de las limitaciones en la dispersión, la semilla grande y bien dotada de esta palma genera plántulas robustas que producen una regeneración exitosa, al punto que O. bataua es una de la especie dominantes en el bosque estudiado. Estudios como este son fundamentales para el manejo y conservación de esta palma promisoria, cuya abundancia ha disminuido debido a la explotación intensiva y a la transformación y reducción de su hábitat de bosque natural.
Palabras clave: dinámica poblacional, dispersión de semillas, Oenocarpus bataua, palma, patrones de distribución espacial, reclutamiento
Abstract
The objective of this work was to quantify some aspects of the demography of a population of the Oenocarpus bataua palm such as seed shadows, seedling survival, density and spatial distribution of seeds, seedlings, juveniles and adults, in a premontane humid forest of Antioquia (Colombia), using circular plots and others of half hectare and one hectare. This palm of canopy and sub–canopy produces fruits of great size consumed by frugivores. The abundant production of fruits and the short distances of dispersion generate spatially restricted seed shadows, in spite of the high rates of removal, which produces an aggregated distribution of seedlings and juveniles. It can be related to defaunation of these forests by transformation of habitat and hunting, which reduce the quality and abundance of long–distance dispersers like large birds and mammals. Nevertheless, squirrels (Microsciurus mimulus y Sciurus granatensis) and agoutis (Dasyprocta punctata) contribute to short–distance dispersal, although to a lesser degree they performed dispersal to greater distances (53–62 m). In contrast to juveniles, the adults showed a random distribution pattern that could be explained by density–dependent mortality of the seeds, seedling and juvenile stages. In spite of limited dispersal, the large seeds of this palm generate robust seedlings and successful regeneration, to the point that O. bataua is one of the dominant species in the forest. These kinds of studies are important for the management and conservation of this promissory palm, whose abundance has declined due to intensive exploitation and transformation and reduction of its natural forest habitat.
Key words: Oenocarpus bataua, palm, recruitment, spatial distrubution patterns, seed dispersal
INTRODUCCIÓN
Las palmas son extremadamente diversas en número de especies y abundantes en cantidad de individuos, siendo un importante componente de los ecosistemas tropicales (Henderson, 2002); también son fuente de alimento para la fauna silvestre consumidora de néctar, polen, semillas y frutos. Adicionalmente, son un elemento destacado en la economía de subsistencia de varios pueblos neotropicales, tanto indígenas como agricultores y campesinos y están profundamente involucradas en las creencias mágicas y místicas de las comunidades locales (Balick, 1992). A pesar de la gran cantidad de expectativas que se han generado sobre sus usos potenciales y posibilidades de domesticación y de que el neotrópico es la segunda región más diversa en especies de palma, este es uno de los grupos de plantas con más especies amenazadas de extinción debido a su explotación intensiva e insostenible (Johnson, 1988). A pesar de la importancia ecológica y económica de las palmas, existe gran desconocimiento de aspectos básicos de la biología, ecología y aspectos demográficos de este importante grupo de plantas.
De otra parte, la presencia y abundancia de palmas en bosques húmedos neotropicales está fuertemente influenciada por condiciones ambientales (Svenning, 2001a), incluyendo luz (Svenning, 1999), factores edáficos (Clark et al., 1995, 1998; Svenning 1999), topográficos (Svenning, 1999b; Vormisto et al., 2004), de drenaje y condiciones de agua en el suelo (Khan y Castro, 1985; Khan y de Granville, 1992). La ocurrencia de palmas también se encuentra afectada por la extracción selectiva y la historia de los disturbios (Clark et al., 1995), al igual que por procesos de dispersión de semillas (Boll et al., 2005).
La dispersión de semillas no solo juega un papel importante en la colonización de nuevas áreas, sino que tiene un efecto directo en los patrones demográficos de las nuevas generaciones (Barot et al., 1999a) y se considera un proceso clave que determina la estructura espacial y la dinámica de las poblaciones de plantas (Nathan y Muller–Landau, 2000); establece el área potencial de reclutamiento y de esta forma, la base para subsecuentes procesos tales como depredación, germinación, competencia y crecimiento (Barot et al., 1999b; Nathan y Muller–Landau, 2000), lo cual ha sido documentado para algunas especies de palmas (Barot et al., 1999a, b; Boll et al., 2005; Silva y Tabarelli, 2001; Souza y Martins, 2002).
La dispersión de semillas espacialmente restringida se plantea como una de las causas de las limitaciones en el reclutamiento de palmas (Almeida y Galetti, 2007; Silva y Tabarelli, 2001; Souza y Martins, 2002), entendida ésta como la falla de una especie para adicionar nuevas plántulas a la población, en todos los sitios disponibles y favorables (Clark et al., 1998; Hubbell et al., 1999). Bajas tasas de remoción de semillas y cortas distancias de dispersión generan una sombra de semillas espacialmente restringida (Forget, 1990; Forget et al., 1994; Peres y Baider, 1997). Estas condiciones han sido documentadas para varias especies de palmas tropicales como las responsables de los patrones de distribución agregados que con frecuencia muestran estas plantas (Almeida y Galetti, 2007; Boll et al., 2005; Silva y Tabarelli, 2001). Además de limitaciones en la dispersión y de condiciones ambientales, eventos históricos y denso–dependientes pueden causar una distribución agrupada (Boll et al., 2005).
Oenocarpus bataua Martius (1823), es una palma de importancia económica y ecológica y a lo largo de su ámbito de distribución es ampliamente explotada, pero no manejada racionalmente por falta de conocimiento sobre sus poblaciones. Los trabajos realizados sobre esta especie en los últimos años tratan sobre su distribución geográfica, características botánicas, aspectos taxonómicos (Bernal et al., 1991; Galeano y Bernal, 1987; Henderson et al., 1995), usos y alternativas de aprovechamiento (Balick, 1992) y aspectos generales sobre ecología y biología reproductiva (Balick 1992), fenología (Collazos y Mejía, 1988; Miller, 2002; Ruiz y Alencar, 2004), polinización (Küchmeister et al., 1998) y algunos aspectos demográficos (Arango, 2004), pero su demografía y dinámica poblacional siguen prácticamente desconocidas, especialmente en poblaciones andinas.
El objetivo de este trabajo fue cuantificar aspectos demográficos de O. bataua tales como sombra de semillas, supervivencia de plántulas, distribución espacial de semillas, plántulas, juveniles y adultos, y densidad poblacional, para relacionar estos patrones con algunas variables físicas y con las interacciones con la fauna mediante la dispersión de semillas. Este estudio está articulado a otros sobre biología reproductiva (Núñez y Rojas 2008), fenología (Rojas–Robles y Stiles, artículo aceptado para publicación en el 2009), frugivoría, dispersión y germinación de semillas (Rojas datos no publicados). Esta información resulta importante debido al acelerado deterioro de los ecosistemas que alojan las poblaciones de la palma O. bataua, como herramienta para el proceso de domesticación de la especie iniciado hace varios años y sobre todo, como insumo para la elaboración de planes de manejo que tengan en cuenta un uso racional para la conservación de las poblaciones de esta especie ampliamente utilizada y promisoria.
MATERIALES Y MÉTODOS
Especie en estudio. La palma O. bataua es conocida localmente como “Milpesos”, se distribuye en toda la región tropical de Suramérica (Balick, 1992; Galeano y Bernal, 1987; Henderson et al., 1995) hasta los 1.400 metros de elevación (Borchsenius et al., 1998). Es una palma arborescente con alturas de 4 a 26 m y un elemento dominante del dosel y el sub–dosel, monoica, con inflorescencias de hasta dos metros de largo, produce abundantes frutos de 3,53 ± 0,28 cm de largo, 2,13 ± 0,2 cm de diámetro, 10,92 ± 2,09 gramos de peso (media ± 1DS; n = 100), que sirven como alimento a la fauna silvestre frugívora y ampliamente utilizada y promisoria. La composición química del aceite extraído de sus frutos es muy similar a la del aceite de oliva y tiene diversos usos como el medicinal para tratar afecciones bronquiales y pulmonares, como alimento (Balick, 1992) y como tónico capilar. La pulpa contiene proteínas de alta calidad (Balick y Gershoff, 1981) y de ella se elaboran diferentes tipos de bebidas. Los frutos se comercializan intensamente en época de fructificación tanto en el Pacífico colombiano como en la Amazonía. Las hojas se utilizan para techado de construcciones provisionales y la confección de canastas y en el área de estudio se utiliza la hoja principal de individuos juveniles para hacer escobas; los troncos se utilizan en la construcción de viviendas (Balick, 1992; Galeano y Bernal, 1987; Henderson et al., 1995). Aunque suele ser abundante en los lugares donde se encuentra, las poblaciones de O. bataua han sido reducidas por la explotación intensiva y por la transformación y disminución de sus hábitats naturales.
Área de estudio. La investigación se llevó a cabo en un área de bosque húmedo premontano (bh–PM), en la cuenca media del río Porce (6° 46’ N, 75° 06’ O), sobre la Cordillera Central andina al nordeste del departamento de Antioquia, con elevaciones entre 925 y 1100 m. La precipitación media anual es de 1.915 mm, con una estación seca entre diciembre y febrero (precipitación mensual menor de 100 mm) y una estación húmeda entre marzo y noviembre con una leve disminución de la precipitación entre junio y agosto. De acuerdo con los datos de la estación climática El Mango —a unos 7 km del área de estudio y a la misma elevación—, entre mayo de 2003 y mayo de 2007 la temperatura media fue de 22.7 °C. La humedad media mensual durante el mismo periodo varió entre 77,9 y 100% y la radiación solar varió entre 181,5 y 256,8 watts/m2. Los suelos son poco evolucionados, de baja a muy baja fertilidad, natural debido a que las condiciones climáticas producen un intenso lavado de bases; corresponden a los órdenes Entisoles e Inceptisoles (Jaramillo, 1989).
Métodología. Parcelas. Las parcelas del estudio se construyeron en tres fragmentos de bosque remanentes: a) Normandía–Calandria, un fragmento continuo donde se establecieron dos puntos de muestreo por ser el área de mayor tamaño; b) La Piedra, más pequeño, separado del anterior por una carretera. Estos dos fragmentos fueron catalogados como bosque primario intervenido. Las especies de mayor importancia ecológicas en estos bosques son Jacaranda copaia, O. bataua, Pseudolmedia sp. y Virola sebifera (Castaño y Riascos, 2000); c) San Ignacio, a 10 km de los dos anteriores, aislado y de difícil acceso, rodeado de pastizales y algunos parches de bosque secundario, que se caracterizó como bosque primario muy intervenido. Algunas de las especies más importantes en este fragmentos son Casearia javitensis, Cordia bicolo, Jacaranda copaia y Myrsine sp., (Castaño y Riascos, 2000). Los dos primeros fragmentos se encuentran sobre la carretera y a pesar de que hay guardabosques, los pobladores entran a cazar y extraer las hojas de O. bataua, a diferencia de lo que ocurre con San Ignacio que por ser de difícil acceso es poco frecuentado. Se eligieron estos tres fragmentos por ser los bosques más representativos y conservados del área de estudio, por contener las mejores poblaciones de la palma O. bataua, pertenecer a una empresa pública y estar relativamente conservados y protegidos.
Sombra de semillas y germinación. En Normandia–Calandría se establecieron parcelas circulares de 5 m de radio (78,5 m2) alrededor de cinco individuos de O. bataua con racimos maduros presentando lluvia de frutos. Se hicieron divisiones concéntricas cada metro para facilitar el conteo de frutos y semillas. Se tomó esta distancia corta para evaluar la lluvia de semillas próxima al árbol parental, evitar superposición con otras palmas y controlar que los frutos que se estaban contando pertenecieran al individuo focal. En cada parcela se contaron y mapearon los frutos caídos. Durante tres días consecutivos se realizó el mismo procedimiento y se marcó con pintura de diferente color los frutos nuevos para registrar la dinámica de semillas alrededor del árbol fuente. Esta medida solo se tomó durante tres días por lo difícil y dispendioso del procedimiento. Se evaluó la caída de semillas alrededor de la fuente semillera en relación a distancia y dirección. A las semillas marcadas se les hizo seguimiento durante 45 días para determinar la proporción de germinación y mortalidad.
Mortalidad y reclutamiento debajo de la palma parental. En las mismas parcelas circulares se numeraron y marcaron con cinta reflectiva plántulas de una cohorte diferente a la de las semillas y se les hizo seguimiento para evaluar mortalidad y reclutamiento a partir del número de individuos iniciales (datos tomado entre junio y agosto) y finales (datos tomado en diciembre del 2004). Para evaluar mortalidad y reclutamiento se aplicó las fórmulas de Sheil et al. (1995). Se analizaron variables edáficas como: contenido de calcio, magnesio, potasio, pH y temperatura del suelo a 5 cm de profundidad. Adicionalmente, se estimó el porcentaje de área cubierta por troncos, ramas y hojas grandes caídas dentro de cada parcela, posición fisiográfica de las parcela y se midió el incremento promedio en la altura de las plántulas.
Distribución espacial de semillas y plántulas. Para determinar patrones de distribución de semillas y plántulas en cada fragmento, un área de una hectárea se subdividió en 100 cuadrantes de 10 x10 m y en el vértice de cada cuadrante se hicieron sub–parcelas de 1 x 1 m, para un total de 100 sub–parcelas en cada fragmento. Estos vértices se hicieron trazando el cuadrante y tomando la medida en el punto exacto, sin hacer montaje de parcelas ni cuadrículas, pues al hacerlo se altera el área pisoteando semillas y plántulas. En ellas se contó el número de semillas y plántulas (hasta 40 cm y una hoja) y se midió la distancia del centro del cuadrante al vecino reproductivo más cercano, definido como la palma más cercana mostrando eventos reproductivos como racimos, racimos secos en la palma o en el suelo.
Distribución espacial de juveniles y adultos. En el 2003 se creó en cada fragmento una parcela de 50 x 50 m, subdividida en 25 cuadrantes de 10 x 10 m, para facilitar la ubicación y mapificación de las palmas. Las categorías de tamaño que se cuantificaron en cada parcela fueron: juveniles pequeños (1,0–2,5 m de longitud de las hojas sin tronco); juveniles medianos (sin tronco con hojas entre 2,51 y 5,0 m); sub–adultos (con tronco visible menor a 4 m y hojas entre 5,1 y 10 m); adultos (palma con tronco visible mayor a 4 m). A cada individuo se le tomaron coordenadas X, Y y la distancia a la palma adulta (no necesariamente reproductiva) más cercana.
En el 2006 se establecieron aleatoriamente dos parcelas en Normandia (llamadas Normandía y Cariaño) y una en La Piedra de 100 x 100 m, subdivididas en 25 cuadrantes de 20 x 20 m. En cada parcela se contabilizaron sub–adultos (individuos con tronco visible menor a 4 m y hojas entre 5 y 10 m), y adultos (palmas con troncos visibles mayores a 4 m). Para cada adulto o juvenil se le tomaron coordenadas X, Y y la distancia al adulto (no necesariamente reproductiva) más cercano.
Se presentan los datos de los dos tipos de parcelas para aprovechar el estudio del 2003 y ver si hubo cambios en los patrones de distribución en el tiempo y con el tamaño de las parcelas. No era posible utilizar las mismas parcelas pues estas no eran permanentes y se habían desmontado. En el 2006 se hicieron parcelas de 100 x 100 m, debido a que ya se había documentado en el área eventos de dispersión de semillas por fauna hasta de 60 m y uno de los objetivos de la investigación era relacionar los patrones de distribución con eventos de dispersión.
Análisis de datos. Para determinar los patrones de distribución espacial de semillas y plántulas se utilizó el índice de dispersión de Morisita (1962), estandarizado (Smith–Gill, 1975 citado en Krebs, 1999) y para juveniles y adultos se utilizó el método del vecino más cercano (Clark y Evans, 1954; Krebs, 1999). Como los valores de las distancias de semillas y plántulas al vecino reproductivo más cercano no presentaron una distribución normal, ni al realizar transformación logarítmica, se uso la prueba no paramétrica de Kruskal–Wallis (H) para comparar el comportamiento de las distancias al vecino más cercano en los fragmentos muestreados.
Mediante correlaciones de Spearman (rs) se relacionó variables de mortalidad y reclutamiento con variables abióticas. De igual forma, se efectuó esta prueba para relacionar semillas y plántulas con la distancia al vecino reproductivo más cercano; y juveniles y adultos con variables de micro–hábitat. Se utilizó esta prueba no paramétrica por el bajo número de parcelas (5) o debido a que las variables no presentaron comportamiento normal.
RESULTADOS
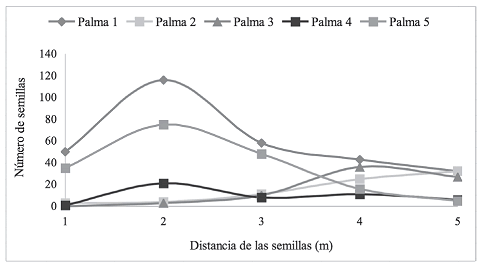
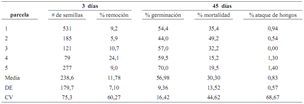
Sombra de semillas y germinación en parcelas circulares. Oenocarpus bataua generó una sombra de semillas corta, distribuida en un radio pequeño: el promedio de la distancia de dispersión primaria fue de dos metros. Para los individuos evaluados la sombra de semillas fue asimétrica, unimodal, presentando la mayor concentración cerca de la fuente. Las palmas 2 y 3 tuvieron un comportamiento diferentes a las otras al aumentar el número de semillas con la distancia desde la fuente, por estar localizadas en una pendiente mayor al 50% (figura 1). Las semillas se concentraron hacia la dirección de los racimos y/o de la pendiente, con las densidades disminuyendo con la distancia al árbol parental, generando patrones de dispersión fuertemente agregados, factor que influyó en la mortalidad de semillas debajo del progenitor, como pudo ser corroborado al evaluar el ataque por insectos perforadores (tabla 1).
Figura 1. Número de semillas y distancia de estas desde el tronco en cinco individuo de Oenocarpus bataua en parcelas circulares (5 m de radio), cada una alrededor de una palma, en el fragmento Normandía–Calandria en un bosque de los Andes en Colombia
Los frutos removidos de las parcelas circulares fueron roídos y pelados parcial o totalmente y presentaron marcas de dientes de roedores, posiblemente ardillas (Microsciurus mimulus y Sciurus granatensis), ratas espinosas (Proechimys sp.), ñeques (Dasyprocta punctata) o destruidos casi completamente por guaguas (Cuniculus paca),
Tabla 1. Número de semillas contadas y marcadas durante tres días consecutivos y evaluación de germinación y mortalidad de estas semillas durante 45 días, en cinco parcelas circulares alrededor de individuos de la palma Oenocarpus bataua en el fragmento Normandía–Calandria en un bosque de los Andes en Colombia (CV = coeficiente de variación; DE = desviación estándar)
especies registradas en el área de estudio (Rojas–Robles, datos no publicados). La mortalidad observada fue principalmente debida al ataque de insectos que perforan las semillas. La correlación positiva y significativa entre número de semillas en el suelo de parcelas circulares y mortalidad (rs = 0,9; p = 0,04; n = 5), aparentemente reflejando factores de mortalidad denso–dependientes. De igual forma, se presentó una correlación más leve entre número de semillas y ataque por hongos (rs = 0,82; p = 0,09; n = 5).
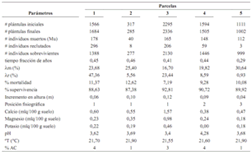
Mortalidad y reclutamiento de plántulas debajo de la palma parental. La tasa de reclutamiento de las palmas mostró mayor variabilidad entre parcelas que la tasa de mortalidad, ya que el número de individuos reclutados en cada parcela fue muy diferente (tabla 2). En las cinco parcelas circulares se presentaron correlaciones positivas en el número de plántulas iniciales y finales (rs = 0,9; p = 0,04), supervivientes y número de plántulas iniciales (rs = 1,0; p < 0,01; n = 5), supervivientes y finales (rs = 0,9; p = 0,04). La temperatura a 5 cm del suelo, estuvo correlacionada negativamente con número de plántulas iniciales (rs = –0,97; p < 0,01), plántulas finales (rs = –0,87; p = 0,05) y supervivientes (rs = –0,97; p = 0,00). También se presentó correlación negativa
Tabla 2. Tasas de mortalidad y reclutamiento de plántulas de Oenocarpus bataua medidas unas en un periodo de 3 y otras en un periodo de 6 meses y variables abióticas en cinco parcelas circulares (78,5 m2 ) en el fragmento Normandía–Calandria en un bosque de los Andes en Colombia [λm = tasa anual de mortalidad; λr = tasa anual de reclutamiento; posición fsiográfca = cima de una colina (1), parte media de la colina (2), parte baja (3); mlq/100 gr suelo = mili equivalentes en 100 gramos de suelo; ºT = temperatura (ºC) a 5 cm de profundidad; % AC = porcentaje de área cubierta por troncos y hojarasca (1 = 0 –5%; 2 = 6 –10%; 3 = 11–20%; 4 = 21– 40%; 5 = > 40%)]
entre plántulas iniciales y tasa de mortalidad (rs = –0,9; p = 0,04) (tabla 2).
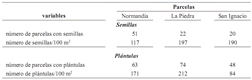
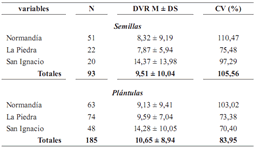
Distribución espacial e índices de dispersión de semillas y plántulas. Normandía presentó el mayor número de parcelas de 1 m2 con semillas pero en total la menor cantidad de semillas. La Piedra presentó el mayor número de semillas y plántulas (tabla 3). En promedio se encontraron 163 semillas y 155 plántulas en 100 m2. La producción de frutos en el área de estudio no es continua en el tiempo, lo cual podría permitir distinguir “cohortes de semillas”. Adicionalmente, las parcelas se hicieron entre diciembre de 2005 y mayo de 2006, cuando el pico de producción de frutos maduros había finalizado (Rojas–Robles y Stiles, artículo aceptado para publicación en el 2009) y ya los frutos habían caído. Esto podría explicar el alto número de semillas y el hecho de que muchas de las semillas estuvieran ya muertas al hacer el conteo en las parcelas. Sin embargo, dado el ciclo supra–anual de producción de semillas, este dato podría variar mucho en el tiempo.
Tanto para semillas como para plántulas y en los tres fragmentos, los valores de los índices de dispersión mostraron patrones de distribución agregados. San Ignacio presentó las mayores distancias medias al vecino reproductivo más cercano, tanto para semillas como para plántulas (tabla 4).
Tabla 3. Número de semillas y plántulas de Oenocarpus bataua en 100 parcelas de 1 m2 en cada uno de los tres fragmentos de bosque húmedo premontano de los Andes colombiano en los que se realizó el muestreo
Tabla 4. Media (M), desviación estándar (DS) y coeficiente de variación (CV) de las distancias de semillas y plántulas de Oenocarpus bataua al vecino reproductivo más cercano en los tres fragmentos de bosque Andino (DVR = distancia al vecino reproductivo)
Existe una amplia variación en las distancias de semillas y plántulas al vecino reproductivo más cercano, representada en los altos valores del coeficiente de variación (tabla 4). Se presentó una correlación negativa entre el número de semillas (rs = –0,36; p = 0,00027; n = 93) y de plántulas (rs = –0,31; p < 0,001; n = 185) y la distancia al vecino reproductivo más cercano, esto es, que a mayor distancia de la palma parental menor número de semillas y plántulas.
Las distancias de semillas al vecino reproductivo más cercano estuvieron entre 0 y 50 m, pero la mayoría estuvo entre los 0 y 15 m , comportamiento muy parecido al de las plántulas. Los valores extremos evidencian eventos de dispersión de semillas por frugívoros, debido a que por el peso estas semillas no son dispersadas por viento, en el área no son trasportadas por agua, y en algunos casos, el vecino reproductivo se encontró pendiente abajo. Por otra parte, las cortas distancias al adulto reproductivo más cercano corroboran el gregarismo encontrado en los índices.
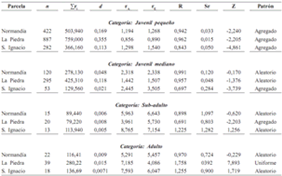
Tabla 5A. Patrones de distribución espacial en O. bataua, mediante el método de Clark y Evans (1954), basado en la distancia al vecino (adulto) más cercano en tres parcelas de 50 x 50 m (n = número de individuos; Σr = sumatoria de las distancias al vecino más cercano; d = densidad; rA = distancia media al vecino más cercano; rE = distancia esperada al vecino más cercano; R = índice de agregación (R = 1 aleatorio, R = 0 agregado, R > 1 patrón uniforme); Sr = error estándar de la distancia esperada al vecino más cercano; Z = desviación normal estándar]. Patrón aleatorio entre –1,96–1,96; patrón agregado < –1,96; patrón uniforme > 1,96
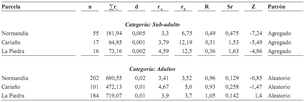
Tabla 5B. Patrones de distribución espacial en O. bataua, mediante el método de Clark y Evans (1954), basado en la distancia al vecino (adulto) más cercano en tres parcelas de 50 x 50 m y tres de 100 x 100 m cada una (n = número de individuos; Σr = sumatoria de las distancias al vecino más cercano; d = densidad; rA = distancia media al vecino más cercano; rE = distancia esperada al vecino más cercano; R = índice de agregación (R = 1 aleatorio, R = 0 agregado, R > 1 patrón uniforme); Sr = error estándar de la distancia esperada al vecino más cercano; Z = desviación normal estándar]. Patrón aleatorio entre –1,96–1,96; patrón agregado < –1,96; patrón uniforme > 1,96
No se presentaron diferencias entre las medias de las distancias de las semillas al vecino reproductivo más cercano (Kruskall–Wallis H = 3,60; p = 0,16; n = 3) entre los tres fragmentos muestreados mientras las plántulas sí mostraron diferencias significativas en las distancias entre los fragmentos (H =13,1; p = 0,001). Las distancia de plántulas al vecino reproductivo más cercano estuvieron entre 0 y 50 m, pero la mayoría solo llegaron a 14 m.
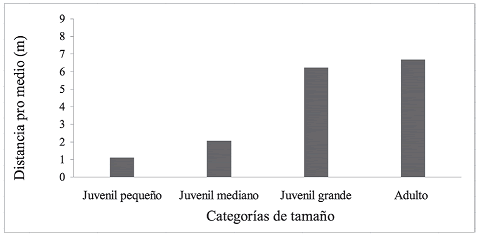
Distribución espacial de palmas juveniles y adultas. Tanto en las parcelas de 50 x 50 m como en las de 100 x 100 m, las categorías de tamaño juveniles mostraron patrón agregado, mientras los adultos presentaron patrones de distribución aleatorios (tablas 5A y 5B). En las parcelas de 50 x 50 m, la distancia al adulto más cercano aumentó de 0,85 m para los juveniles pequeños hasta 8,76 m para los juveniles grandes (figura 2).
Figura 2. Distancia promedio al adulto más cercano según las categorías de tamaño, para individuos de Oenocarpus bataua en tres parcelas de 50 x 50 m en un bosque de los Andes en Colombia
En las parcelas de una hectárea, las distancias al adulto más cercano de juveniles y adultos no superaron los 18 m y la mayoría de los valores se concentran antes de 6 m. Los patrones agregados en los estadios juveniles son el resultado de las cortas distancias al adulto más cercano.
Variables físicas en cuadrantes de parcelas de una hectárea. Únicamente se presentó una correlación positiva entre número de individuos adultos y cobertura del dosel (rs = 0,26; p = 0,04), y ninguna otra correlación entre adultos y juveniles con las variables físicas.
DISCUSIÓN
Sombra de semillas y germinación. La tasa de remoción de frutos en el suelo fue relativamente alta (11,7% en tres días) a pesar del corto tiempo de muestreo. El amontonamiento de semillas debajo de la palma parental se debe a la gran producción de semillas pesadas (11 g) y a la intensa remoción de frutos del racimos, que hacen las ardillas (Microsciurus mimulus y Sciurus granatensis) (Rojas–Robles, datos no publicados). Los frutos de esta palma no poseen adaptaciones morfológicas para dispersarse a grandes distancias y requieren ser removidas por la fauna frugívora y el amontonamiento podría deberse también a la disminución de frugívoros como aves grandes y roedores de mediano porte, que contribuyen con la dispersión de larga distancia y que en el área de estudio se han visto reducidas por la cacería (Rojas–Robles, obs. pers.) y la extracción de madera que ha transformado esta área en un bosque primario intervenido. Sin embargo, no se tienen datos directos sobre la defaunación en el área de estudio. Adicionalmente, las especies de aves grandes que quedan en la zona prefieren frutos carnosos ornitócoros y no se les han observado consumiendo frutos de O. bataua. La defaunación es común en bosques fragmentados e intervenidos y en remanentes con fauna empobrecida, la dispersión de semillas se restringe a guatines (Dasyprocta puncatata) y ardillas (Microsciurus mimulus y Sciurus granatensis) como lo pudimos corroborar en los fragmentos estudiados (Rojas–Robles, obs. pers.).
En lugares con fauna de vertebrados más intacta, las semillas de O. bataua son dispersadas por aves y mamíferos grandes que remueven las semillas a mayores distancias, posiblemente generando un patrón de distribución menos agregado como en la Guayana Francesa, donde los principales consumidores de frutos de O. bataua son las aves que depredan pero que también pueden ser potenciales dispersores como Amazona ochrocephala, A. farinosa, Pionites melanocephala, Pionus fuscus y primates (Sist, 1989), o en la Amazonía, donde también han sido registradas aves grandes como A. farinosa, A. ochrocephala, Penelope marail, Perissocephalus tricolor, Pionites melanocephala, Pionus fuscu y Ramphastos tucanus, además de ardillas Sciurus aestuans y primates como Ateles paniscus y Cebus nigrivittatus consumiendo frutos de O. bataua (Kahn y de Granville, 1992). Sin embargo, en estos sitios más conservados y de bosques continuos, no se cuenta con investigaciones similares a este estudio sobre O. bataua para poder comparar el efecto de la fauna frugívora en la dispersión de semillas.
En O. bataua, la abundante producción de frutos y las cortas distancias de dispersión generan una sombra de semillas espacialmente restringida, responsable de los patrones de distribución agregados en plántulas y juveniles, aspecto que ha sido documentado para otras especies de palmas (Almeida y Galetti, 2007; Boll et al., 2005; Forget, 1990; Forget et al., 1994; Peres y Baider, 1997; Silva y Tabarelli, 2001; Wright et al., 2000; Wright y Duber, 2001). Los bajos porcentaje de ataque por hongos (0,83%) y valores relativamente bajos de ataque por insectos perforadores (30,3%) de este estudio comparados con los de otras especies de plantas (Janzen y Vásques–Yañez, 1991), se deben posiblemente a que semillas de tamaño grande como las de O. bataua pueden poseer defensas estructurales y morfológicas contra patógenos y herbívoros (Dalling, 2002).
La germinación de las semillas de O. bataua es rápida y se presenta en alto porcentaje (en 45 días germinó el 57% de las semillas) y es favorecida por ambientes húmedos (Martínez–Ramos, 1985) y con baja luminosidad. Posiblemente con mayor tiempo de seguimientos este valor aumente, dadas las características de alta viabilidad y robustez de la semilla (Rojas–Robles, datos no publicados). De otra parte, la rápida germinación de las semilla de O. bataua puede ser vista como una estrategia de escape para evitar los depredadores de semillas (Bodmer, 1991). La producción de frutos provistos de una semilla grande, con alto contenido de recursos nutritivos proteínas y aceites ayuda al establecimiento exitoso de las plántulas (Dalling, 2002), como es el caso de O. bataua.
Mortalidad y reclutamiento de plántulas debajo de la palma parental. El porcentaje de mortalidad de plántulas fue bajo (15% en menos de seis meses), menor que lo hallada para O. bataua oligocarpa (60%) en la Guayana Francesa (Sist, 1989) y mucho más bajo que el de Bactris acanthocarpa, que presentó 80% de mortalidad temprana de plántulas que se encontraban debajo de la copa de la palma parental (Silva y Tabarelli, 2001). Los bajos valores de mortalidad encontrados pueden estar relacionados con la robustez de las plántulas debido a que O. bataua tiene germinación ligulada, adyacente e hipogea (Balick, 1992) y los cotiledones funcionan como órganos de reserva, lo que conlleva al establecimiento de plántulas robustas, en buena parte resistentes al daño físico y al ataque por herbívoros, lo que hace que los valores de mortalidad sean bajos.
La adición de nuevas plántulas a la población (reclutamiento) también fue relativamente baja durante el periodo de observación, quizás por el corto tiempo de muestreo y en algunos casos tal vez por falta de sombra que es esencial para la germinación y el crecimiento temprano de la plántula (Lofgren, 1995), mientras el crecimiento posterior requiere más luz como lo plantearon Sist y Puig (1987) en un estudio de O. bataua oligocarpa en la Guayana Francesa. También pudimos notar que algunas semillas germinan y después las plántulas mueren tapadas por hojas secas que caen de la palma madre o de otras palmas.
Patrón de distribución de semillas y plántulas. La mayoría de semillas y plántulas en parcelas de 1 m2 se encontraron a una distancia menor a 15 m del vecino reproductivo más cercano, lo que generó un patrón de distribución agregado. En mucha menor frecuencia, se encontraron semillas y plántulas a distancias de hasta 50 m, lo que puede evidenciar eventos de dispersión por fauna. En experimentos de dispersión Rojas–Robles (datos no publicados) encontró que semillas de O. bataua fueron transportadas hasta 53 m por frugívoros. De igual forma observamos que una ardilla (Sciurus granatensis) transportó un pedazo de raquila con frutos unos 62 m para luego enterrarlos. Estos eventos poco comunes o tal vez difíciles de observar son de gran importancia para la semilla, si ésta es llevada a un micro–hábitat óptimo para la germinación o el crecimiento posterior de juveniles.
Un patrón de distribución agregado para semillas y plántulas es el más común en la mayoría de especies con frutos pesados y grandes y para aquellas que requieren de la acción de dispersores para alejarse del árbol parental, especialmente cuando ésta es deficiente (Silva y Tabarelli, 2001). Por ejemplo Fragoso (1997), encontró que el 98% de las semillas de la palma Maximiliana maripa permanecieron a cinco metros del tronco. En O. bataua la densidad de semillas disminuye conforme aumenta la distancia del árbol parental, así encontramos una correlación negativa entre las dos variables. De otra parte, las cortas distancias al vecino reproductivo más cercano, corroboraron el gregarismo encontrado en los índices de dispersión. Posiblemente semillas y plántulas de O. bataua poseen como otras plantas, capacidad para sobrevivir en agregaciones densas (Howe, 1985) ya que a pesar de las limitaciones en la dispersión es una de las especies dominantes en el área de estudio (Cataño y Riascos, 2000).
Patrón de distribución de juveniles y adultos. El patrón de distribución espacial encontrado para juveniles de O. bataua fue agregado, como resultado de la agregación de semillas y del reclutamiento alrededor del adulto. Este patrón coincidió con lo reportado por Svenning (2001a), quien registró un fuerte agrupamiento relacionado principalmente con el reclutamiento que ocurre cerca de las palmas adultas y que no puede ser explicado completamente por la heterogeneidad ambiental que presenta la estructura del bosque, sino por la dispersión espacialmente restringida de las semillas.
En nuestra área de estudio encontramos al igual que Lofgren (1995), que los juveniles de O. bataua presentaron una distribución agregada, mientras los adultos se encontraron distribuidos al azar. La distancia al adulto más cercano se encuentra relacionada positivamente con el tamaño de la palma; a medida que aumenta el tamaño, aumenta la distancia entre los individuos. De esta forma, la distribución espacial cambia con la ontogenia y el patrón agregado que se observó en O. bataua en las etapas iniciales, es reemplazado posteriormente en sub–adultos y principalmente en adultos por un patrón principalmente aleatorio.
Hay una tendencia general hacia un patrón menos agregado a lo largo del ciclo de vida en algunas especies de palmas (Barot et al., 1999b), que puede deberse a que la relación especies–ambiente también cambia con la ontogenia (Svenning, 1999, 2001a, b; Svenning y Balslev, 1999). En la mayoría de los estudios la mortalidad denso–dependiente, ha sido señalada como la razón principal para esta reducción en el grado de agrupamiento (Barot et al., 1999a). Los diferentes estadios de vida comprenden grupos de individuos que comparten morfologías y rasgos fisiológicos específicos (Lawson y Poethig, 1995) y pueden presentar en cada etapa requerimientos fisiológicos distintos. Por ello, la modificación en el patrón espacial de palmas en las diferentes etapas, como ocurrió en O. bataua, puede indicar la acción de diferentes procesos y mecanismos, presentándose probabilidades diferenciales de sobrevivencia en cada una de ellas (Souza y Martins, 2002).
Las fuentes de mortalidad (ataque por insecto, hongos, enfermedades, etc.) en el caso de O. bataua son contagiosas o denso–dependiente como lo corroboramos para semillas, pues existe una relación entre patrones espaciales y patrones de mortalidad durante el ciclo de vida. Posteriormente, el decrecimiento en la agregación puede deberse también a la mortalidad denso–dependiente (auto–agrupamiento). Más adelante, el proceso aleatorio de formación de claros puede hacer posible que los sub–adultos alcancen el estadio adulto. Si un claro es necesario para que un individuo inmaduro de O. bataua llegue a adulto y los claros se forman de manera aleatoria, la distribución de los adultos será aleatoria (Lofgren, 1995), pero esto no lo pudimos medir en nuestro estudio. En el estadio juvenil la competencia tanto intra–como interespecífica por luz puede ser el factor más importante para alcanzar el estadio reproductivo. Patrones aleatorios en los adultos sugieren una caída en la mortalidad dependiente de la densidad, quizás debida al hecho de que pocos adultos del agrupamiento se mantienen (Barot et al., 1999b).
Densidades. Para las tres parcelas de una hectárea se determinó una densidad media de juveniles de 29,3 individuos/ha y adultos de 163 individuos/ha. Lofgren (1995) en bosque húmedo premontano del norte de Bolivia, halló mayor número de juveniles, seguido por sub–adultos y adultos con densidades de 45,2 individuos/ha (6,8 adultos, 12,4 sub–adultos, 26 juveniles). Kahn y Mejía (1991), en el Perú encontraron densidades de sub–adultos y adultos mucho más altas (425/ha), con bajas densidades de adultos y gran variación en las densidades dentro de pequeñas áreas. Densidades altas de juveniles y muy bajas de adultos fueron encontradas por Sist y Puig (1987), en la Guayana Francesa para O. b. oligocarpa. Esta situación es similar a lo hallado en las parcelas de 50 x 50, pero difiere de lo encontrado en parcelas de una hectárea, donde predominaron los adultos sobre los juveniles. Las densidades tanto de juveniles como de adultos son muy variables dependiendo de la región y como pudimos notarlo aun en cortas distancias, pues la variabilidad ambiental a pequeña escala afecta las poblaciones de palmas (Svenning, 1999).
En estado juvenil O. bataua puede sobrevivir bajo condiciones de poca luz manteniendo un crecimiento lento hasta que haya condiciones óptimas de iluminación y pueda crecer en altura (Balick, 1992). El tiempo durante el cual una palma es juvenil antes de alcanzar el dosel es muy variable y depende de la formación de claros, así que puede ser una etapa muy transitoria. Lo anterior unido al hecho de que tiene un ciclo supra–anual de producción de semillas–plántulas con adultos de larga vida (mortalidad < al 2% anual (Rojas–Robles y Stiles, artículo aceptado para publicación en 2009), puede producir una aparente deficiencia de juveniles como la encontrada en las parcelas de una hectárea. Cambios sucesionales en el bosque por tala selectiva en diferentes periodos produciendo claros, posiblemente ha alterado la estructura de edades y la distribución espacial de la población. El menor número de juveniles también podría estar relacionado con la explotación de los estadios juveniles que se utilizan para hacer escobas, la cual es la única forma de uso de la palma en la región y que se ha incrementado en los últimos años, pero esto no se cuantificó en esta etapa del trabajo.
Consideraciones para manejo y conservación. Es importante enfatizar que O. bataua es una palma de bosque y no se observó ningún individuo en bosque secundario o áreas abiertas adyacentes al área de estudio, por otra parte, la reproducción de esta palma en plantaciones no ha sido del todo exitosa e individuos aislados en áreas de pastizales al parecer no producen frutos (E. Enciso, com. pers.). Por otra parte, muchas poblaciones de O. bataua han sido reducidas por su explotación intensiva o por la trasformación o reducción de su hábitat natural, alterando procesos ecológicos que son fundamentales para el mantenimiento de sus poblaciones. Por lo tanto, el manejo y explotación de esta palma en el futuro dependerá en gran medida de la conservación de los hábitats de bosque donde ella es un elemento dominante.
La sobre–explotación de frutos como se hace en diferentes regiones, o de los estadios juveniles de esta palma como se presenta en nuestra área de estudio, puede afectar la estructura de edades de la población y su potencial de extracción futura. Debido a ello, un uso sustentable solo será posible cuando se conozca más a fondo diferentes aspectos de la demografía de O. bataua. Concretamente para la región en la que se hizo esta investigación se requiere hacer un estudio de supervivencia y mortalidad de todas las etapas para saber si la población está creciendo, decreciendo o se encuentra en equilibrio; cuantificar el aprovechamiento y evaluar su impacto; evaluar el estado de las poblaciones de fauna que dispersa las semillas, investigar depredación de semillas por insectos entre otros estudios.
AGRADECIMIENTOS
Los autores agradecen a la División de Investigaciones de la Universidad Nacional de Colombia (UN), Sede Medellín (DIME) por la financiación del proyecto; al Departamento de Ciencias Forestales (UN–Medellín) y al Instituto de Estudios Ambientales (IDEA–UN–Bogotá) por conceder el tiempo para el desarrollo de esta investigación; al Posgrado en Biología y al Instituto de Ciencias Naturales (UN–Bogotá); a Empresas Públicas de Medellín (EPM) por el apoyo logístico. También queremos agradecer muy especialmente a Gary Stiles por su constante apoyo y paciencia en la revisión del manuscrito; a los auxiliares de campo Enrique Gutiérrez, Cesar Cuervo y Jaime Bello por su colaboración en el extenuante trabajo de campo y a los tres evaluadores anónimos quienes hicieron valiosos aportes y comentarios al manuscrito.
REFERENCIAS
1. Almeida LB, Galetti M. 2007. Seed dispersal and spatial distribution of Attalea geraensis (Arecaceae) in two remnants of Cerrado in Southeastern Brazil. Acta Oecologica, 32(2):180–187. [ Links ]
2. Arango DA. 2004. Crecimiento y mortalidad de la regeneración de Euterpe oleracea y Oenocarpus bataua (Medio Atrato, Colombia). Tesis Maestría en Bosques y Conservación Ambiental. Universidad Nacional de Colombia, Medellín. [ Links ]
3. Balick MJ, Gershoff S. 1981. Nutritional evaluation of the Jessenia bataua palm. Source of high quality protein and oil from tropical America. Economic Botany, 25:261–271. [ Links ]
4. Balick MJ. 1992. Jessenia y Oenocarpus: Palmas aceiteras neotropicales dignas de ser domesticadas. Estudio FAO Producción y protección vegetal 88. FAO. Roma, Italia. [ Links ]
5. Barot S, Gignoux J, Menaut JC. 1999a. Population structure and life cycle of Borassus aethiopum Mart.: Evidence of early senescence in a palm tree. Biotropica, 31(3):439–448. [ Links ]
6. Barot S, Gignoux J, Menaut JC. 1999b. Demography of a savanna palm tree: predictions from comprehensive spatial pattern analyses. Ecology, 80(6):1987–2005. [ Links ]
7. Bernal R. Galeano G, Herdeson A. 1991. Notes on Oenocarpus in the Colombian Amazon. Brittonia, 43: 154 – 164. [ Links ]
8. Bodmer RE. 1991. Strategies of seed dispersal and seed predation in Amazonian ungulates. Biotropica, 23(3):255–261. [ Links ]
9. Boll T, Svenning J–C, Vormisto J, Normand S, Grández C, Balslev H. 2005. Spatial distribution and environmental preferences of the piassaba palm Aphandra natalia (Arecaceae) along the Pastaza and Urituyacu rivers in Peru. Forest Ecology and Management, 213:175–183. [ Links ]
10. Borchsenius F, Borgtoft–Pedersen H, Balslev H. 1998. Manual to the palms of Ecuador. AAU Report 37: 1–240. Department of Systematic Botany, University of Aarhus, Denmark. [ Links ]
11. Castaño G, Riascos E. 2000. Índice de Valor de Importancia. Pp. 47–57. En: Urrego DH, González C (ads.). Estudios Ecológicos en el área de influencia del proyecto hidroeléctrico Porce II. Empresas Públicas de Medellín. Medellín, Colombia. [ Links ]
12. Clark DA, Clark DB, Sandoval MR, Castro CMV. 1995. Edaphic and human effects on ladscape–scala distributions of tropical rainforest palms. Ecology, 76(8):2581–2594. [ Links ]
13. Clark JS, Macklin E, Wood L. 1998. Stages and spatial scales of recruitment limitation in southern Appalachian forests. Ecological Monographs, 68:213–235. [ Links ]
14. Clark PJ, Evans FC. 1954. Distance to nearest neighbor as a measure of spatial relationships in populations. Ecology, 35:445–453. [ Links ]
15. Collazos M, Mejía M. 1988. Fenología y poscosecha de milpesos Jessenia bataua (Mart) Burret. Acta Agronómica, 38 (1):53–63. [ Links ]
16. Dalling JW. 2002. Ecología de semillas. Pp. 345–375. En: Guariguata M, Kattan G (eds.). Ecología y conservación de bosques neotropicales. Libro Universitario Regional. Cartago, Costa Rica. [ Links ]
17. Forget PM. 1990. Seed–dispersal of Vouacapoua americana (Caesalpiniaceae) by caviomorph rodents in French Guiana. Journal of Tropical Ecology, 6:459–468. [ Links ]
18. Forget PM, Muñoz E, Leigh EG. 1994. Predation by rodents and bruchid beetles on seeds of Scheelea palms on Barro Colorado Island, Panama. Biotropica, 26(4):420–426. [ Links ]
19. Fragoso JMV. 1997. Tapir–generated seed shadows: scale–dependent patchiness in the Amazon rain forest. Journal of Ecology, 85:519–529. [ Links ]
20. Galeano G, Bernal R. 1987. Palmas del departamento de Antioquia: Región Occidental. 1 ed. Universidad Nacional de Colombia. Bogotá, Colombia. [ Links ]
21. Henderson A. 2002. Evolution and ecology of palms. The New York Botanical Garden Press. U.S.A. [ Links ]
22. Henderson A, Galeano G, Bernal R. 1995. Field guide to the palms of the Americas. Princeton Univesity Press. Princeton (NJ), E. U. A. [ Links ]
23. Howe HF. 1985. Gomphothere fruits: a critique. The American Naturalist, 125:853–865. [ Links ]
24. Hubbell SP, Foster RB, O'brien ST, Harms KE, Condit R, Wechsler B, Wright SJ, Loo LaoS. 1999. Light–gap disturbances, recruitment limitation, and tree diversity in a Neotropical forest. Science, 283:554–557. [ Links ]
25. Janzen DH, Vásques–Yañez C. 1991. Aspects of tropical seed ecology of relevance to management of tropical forest wildlands. Pp. 137–157. En: Gomez–Pompa A, Whitmore TC, Handley M (eds.). Rain forest regeneration and management. Unesco France and Parthenon Press. England. [ Links ]
26. Jaramillo DF. 1989. Estudio general de suelos, erosión y uso potencial agropecuario para los proyectos hidroeléctricos Porce II y Porce III. Empresas Públicas de Medellín. Medellín (Antioquia), Colombia. [ Links ]
27. Johnson D. 1988. Worldwide endangerment of useful palms. Advances in Economic Botany, 6:268–273. [ Links ]
28. Khan F, Castro A. 1985. The palm community in a forest central Amazonia, Brazil. Biotropica, 17:210–216. [ Links ]
29. Kahn F, Mejía K. 1991. The palm communities of two terra firme forest in Peruvian Amazonia. Principes, 35:22–26. [ Links ]
30. Kahn F, de Granville JJ. 1992. Palms in forest ecosystems of Amazonia. Springer Verlang. Berlin, Germany. [ Links ]
31. Krebs CJ. 1999. Ecological methodology. Addison Wesley Longman, Inc. Menlo Park, (CA), E. U. A. [ Links ]
32. Küchmeister H, Webber A, Gottsberger G, Silberbauer–Gottsberger I. 1998. A polinização e sua relação com a termogênese em espécies de Arecaceae e Annonaceae da Amazônia Central. Acta Amazonica, 28:217– 245. [ Links ]
33. Lawson E, Poethig RS. 1995. Shoot development in plants: time for a change. Trends in Genetics, 11:263–268. [ Links ]
34. Lofgren A. 1995. Distribution patterns and population structure of an economically important Amazon palm, Jessenia bataua (Mart.) Burret ssp. bataua in Bolivia. Botaniska Institutionen Stockholmos Universitet, 2:1–21. [ Links ]
35. Martínez–Ramos A. 1985. Claros, ciclos vitales de los árboles tropicales y regeneración natural de las selvas altas perennifolias. Pp. 191–239. En: Gómez–Pompa, del Amo S (eds.). Investigaciones sobre la regeneración de selvas altas en Veracruz, México. Vol. II. Alhambra Mexicana, México. [ Links ]
36. Miller C. 2002. Fruit production of the Ungurahua palm (Oenocarpus bataua subsp. bataua, Arecaceae) in an indigenous managed reserve. Economic Botany, 56(2):165–176. [ Links ]
37. Morisita M. 1962. Id–index, a measure of dispersion of individuals. Researches in Population Ecology, 4:1–7. [ Links ]
38. Nathan R, Muller–Landau C. 2000. Spatial patterns of seed dispersal, their determinants and consequences for recruitment. Tree, 7(7): 278–285. [ Links ]
39. Núñez–Avellaneda L, Rojas–Robles R. 2008. Biología reproductiva y ecología de la polinización de la palma milpesos Oenocarpus bataua en los Andes colombianos. Caldasia, 30(1):99–123. [ Links ]
40. Peres CA, Baider C. 1997. Seed dispersal, spatial distribution and population structure of brazilnut trees (Bertholletia excelsa) in southeastern Amazonia. Journal of Tropical Ecology, 13(4): 595–616. [ Links ]
41. Ruiz RR, Alencar JC. 2004. Comportamento fenologico da palmeira patauá (Oenocarpus bataua) na floresta Adolfo Ducke, Manaus, Amazonas, Brasil. Acta Amazônica, 34:553–558. [ Links ]
42. Sheil D, Burslem D, Alder D. 1995. The interpretation and misinterpretation of mortality rate measures. Journal of Ecology, 83:331–333. [ Links ]
43. Silva MG, Tabarelli M. 2001. Seed dispersal, plant recruitment and spatial distribution of Bactris acanthocarpa Martius (Arecaceae) in a remnant of Atlantic forest in northeast Brazil. Acta Oecologica, 22:289–268. [ Links ]
44. Sist P, Puig H. 1987. Regeneration, dynamique des populations et dissemination d'un palmier de Guyane française: Jessenia bataua (Mart.) Burret subsp. ologocarpa (Griseb. & H.Wendl.) Balick. Bull. Mus. natn. Hist. nat., Paris 4º ser., 9, section B. Adansonia, 3:317–336. [ Links ]
45. Sist P. 1989. Strategies de regeneration de quelques palmiers en foret Guyanaise. Tesis de Doctorado. Universidad de Paris. Paris, France. [ Links ]
46. Smith–Gill SJ. 1975. Cytophysiological basis of disruptive pigmentary patterns in the leopard frog Rana pipiens. II. Wild type and mutant cell specific patterns. Journal of Morphology, 146:35–54. [ Links ]
47. Souza AF, Martins FR. 2002. Spatial distribution of an undergrowth palm in fragments of the Brazilian Atlantic Forest. Plant Ecology, 164:141–155. [ Links ]
48. Svenning J–C. 1999. Recruitment of tall arborescent palms in the Yasuni National Park, amazonian Ecuador: are large treefall gaps important?. Journal of Tropical Ecology, 15(3):355–366. [ Links ]
49. Svenning J–C. 2001a. On the role of micro environmental heterogeneity in the ecology and diversification of Neotropical rainforest palms (Arecaceae). Botanical Review, 67:1–53. [ Links ]
50. Svenning J–C. 2001b. Environmental heterogeneity, recruitment limitation and mesoscale distribution on palms in a tropical montane rain forest (Maquipucuna, Ecuador). Journal of Tropical Ecology, 17:97–113. [ Links ]
51. Svenning J–C, Balslev H. 1999. Microhabitat–dependent recruitment of Iriartea deltoidea (Arecaceae) in amazonian Ecuador. Ecotropica, 5:69–74. [ Links ]
52. Vormisto J, Tuomisto H, Oksanen J. 2004. Palm distribution patterns in Amazonian rainforests: What is the role of topographic variation? Journal of Vegetation Science, 15:485–494. [ Links ]
53. Wright SJ, Zeballos H, Dominguez I, Gallardo MM, Moreno MC, Ibanez R. 2000. Poachers alter mammal abundance, seed dispersal, and seed predation in a Neotropical forest. Conservation Biology, 14(1): 227–239. [ Links ]
54. Wright SJ, Duber HC 2001. Poachers and forest fragmentation alter seed dispersal, seed survival, and seedling recruitment in the palm Attalea butyraceae with implications for tropical tree diversity. Biotropica, 33(4):583–5595. [ Links ]
Recibido: agosto 2008
Aceptado para publicación: diciembre de 2008