Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.30 no.89 Medellín July/Dec. 2008
ICTIOLOGÍA
ESTUDIO HISTOLÓGICO Y MORFOLÓGICO PRELIMINAR DE LA HIPÓFISIS DE ALEVINOS DE CACHAMA BLANCA, PIARACTUS BRACHYPOMUS (CUVIER) (CHARACIDAE)
PRELIMINARY MORPHOLOGICAL AND HISTOLOGICAL STUDY OF THE PITUITARY OF PARAPITINGA ALEVINS, PIARACTUS BRACHYPOMUS (CUVIER) (CHARACIDAE)
Biviana Barrera–Bailón1; María L. Caldas2; Hernán Hurtado–Giraldo3
1Laboratorio de Histoembriología, Facultad de Ciencias Básicas, Universidad Militar Nueva Granada, Cra. 11, # 101–80. Bogotá–Colombia. Dirección electrónica: <bivianabb@gmail.com>
2Laboratorio de Histoembriología, Facultad de Ciencias Básicas, Universidad Militar Nueva Granada, Cra. 11, # 101–80. Bogotá–Colombia. Dirección electrónica: <mcaldas@umng.edu.co>
3Laboratorio de Histoembriología, Facultad de Ciencias Básicas, Universidad Militar Nueva Granada, Cra. 11, # 101–80. Bogotá–Colombia. Dirección electrónica: hurtado@umng.edu.co<hurticos@yahoo.com>
Resumen
Piaractus brachypomus es una especie de gran importancia económica en colombia. el propósito de este trabajo fue efectuar un análisis de la hipófisis de alevinos de esta especie a nivel histológico y anatómico. Se realizaron cortes sagitales y transversales de 5 y 7 µm de las hipófisis de veinte alevinos, para estudios histológico y de reconstrucción tridimensional. En los alevinos, la hipófisis se ubica en la zona ventral del cerebro, posterior al quiasma óptico, parcialmente integrada entre el nucleus tuberalis ventralis (TV) y el hypotalamus periventriculares caudalis (Hc) del hipotálamo, la que parece estar conectada por tejidos conectivo y nervioso. La hipófisis presenta células basófilas (B) con núcleos grandes y excéntricos, y cromófobas (C) con núcleos pequeños y un citoplasma sin tinción, no hay presencia de acidófilas (A). La irrigación sanguínea está presente en todas las zonas de la hipófisis. Las diferencias con la literatura son atribuidas a la inmadurez de la glándula.
Palabras clave: alevinos, cachama blanca, desarrollo, hipófisis, Piaractus brachypomus, teleósteos
Abstract
Piaractus brachypomus is a species of great economic importance in Colombia. The purpose of this study is to accomplish an analysis at the histological and anatomical level of alevin pituitary of this species. We realized sagittal and transversal cuts of 5 and 7 µm of 20 alevin pituitaries for a histological and three–dimensional reconstruction studies. The pituitary of these specific alevins is located in the ventral zone of the brain, posterior to the optic chiasm, partially integrated by connective and nervous tissues between the nucleus tuberalis ventralis (TV) and hypotalamus periventriculares caudalis (Hc). The pituitary contains basophils with large and non–centric nuclei, as well as chromophobes (C) with small nuclei and unstained cytoplasm. There is no presence of acidophils (A); however, blood flow reaches all parts of the pituitary. Discrepancies between our study and that of literature are attributed to glandular immaturity.
Key words: alevin, development, parapitinga, Piaractus brachypomus, pituitary, teleost
INTRODUCCIÓN
Se han realizado estudios neuroanatómicos profundos en teleósteos (Anken y Bourrat, 1998), principalmente en pez cebra [Danio rerio (hamilton–Buchanan, 1822)], aun así se desconocen muchos aspectos de su biología básica, y sobre todo en las especies tropicales. La cachama blanca, Piaractus brachypomus (cuvier, 1818), es una especie originaria de las cuencas Amazónica y del Río Orinoco (Useche, 1999), la cual en los primeros 15 años de su cultivo a escala comercial en colombia, se incremento su producción anual en un 400% (Barreto y Mosquera, 1998; Torres, 2000).
En peces la reproducción es un evento condicionado por diferentes factores etológicos, ambientales y fisiológicos inicialmente detectados por el sistema nervioso del pez. Interviene principalmente el hipotálamo, la hipófisis y las gónadas. (Bently, 1998; Prieto–Gómez y Velásquez–Paniagua, 2002; Tyagi y Sukla, 2002a, b). La cachama para reproducirse realiza largas migraciones una vez iniciado el periodo lluvioso (otero, 2000), no se reproduce en condiciones de cautiverio de manera natural ya que se bloquea su sistema endocrino en la etapa de ovulación (Useche, 1999), por lo que se realiza una inducción por inoculación de dosis hormonales provenientes de otras especies, generalmente carpa, lo que genera una limitante en la producción de un mayor número de larvas y alevitos.
La cachama blanca es de crecimiento indeterminado, lo que implica grandes cambios en tamaño corporal, teniendo consecuencias para los mecanismos de adaptación del sistema nervioso (mommsen, 2001). esta clase de crecimiento sumado con el bloqueo del sistema endocrino, hace necesario conocer los aspectos de biología básica y fisiología del sistema neuroendocrino, principalmente del desarrollo de la hipófisis, glándula que produce y secreta las hormonas gonadotropicas (FSH y LH).
La hipófisis es la glándula endocrina clave para el control hormonal de diferentes funciones, tales como: reproducción, metabolismo, osmoregulación, desarrollo y crecimiento; debido a que es un lugar de síntesis, almacenaje y liberación de varias hormonas peptídicas que actúan sobre estos procesos (Bentley, 1998). La secreción de la hipófisis está controlada por el hipotálamo, que está bajo la influencia del estímulo nervioso de los centros superiores del sistema nervioso central, y por una retroalimentación de los niveles de hormonas circulantes producidas por glándulas dependientes de ella (Young y Heath, 2000). Esta glándula endocrina está conformada por dos partes distintas (Anderson y Mitchum, 1974; Barrington, 1975; Bentley, 1998; Evans, 1998; Ross et al., 1997; Scout, 1983; Tyagi y Sukla, 2002c; Young y Heath, 2000):
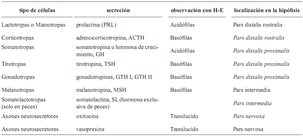
1.–adenohipófisis: anatómicamente presenta tres partes diferenciadas (Bentley, 1998; Ross et al., 1997): Pars intermedia (Pi), Pars distalis proximalis (PDP) y Pars distalis rostralis (PDR) o tuberalis. Peces y lagartos no tienen PDR como tal, aunque si existen las células secretoras de prolactina (PRL) y adrenocorticotropina (ACTH), que se observan en el PDR del resto de vertebrados (Bently, 1998; Tyagi y Sukla, 2002a, b) (tabla 1);
2.–neurohipófisis: formada por neuronas que se originan en el núcleo paraventricular y el núcleo preóptico, en el caso de anfibios y peces, está compuesta por tres partes (Bently, 1998): a) la eminencia media, usualmente conectada por un sistema portal de vasos sanguíneos (no es tan aparente en peces, sobre todo en ciclóstomos); b) el saco hipofisiario o infundibular, constituido por axones de células nerviosas de los núcleos hipotalámicos (es la parte en comunicación directa con el hipotálamo) y; c) la pars nervosa o lóbulo neural, que hace nexo con el saco infundibular, formada por terminaciones de neuronas de los núcleos hipotalámicos y que penetran dentro de la glándula en un proceso digitiforme (Tyagi y Sukla, 2002c) (tabla 1).
Tabla 1. Tipos celulares de la hipófsis, su secreción, ubicación dentro de la hipófsis y tipo de tinción (Bently, 1998; Bern, 1967; Herrero–Turion et al., 2002; Jure et al., 2003; Ross et al., 1997; Tyagi y Sukla, 2002a, b)
Los tipos celulares de la adenohipófisis pueden ser clasificados de dos maneras (tabla 1):
1. –Por tipo de tinción. Existen dos grupos según la afinidad que estás tengan a la tinción: a) acidófilas (A) que son redondeadas y de menor tamaño que las basófilas, sus gránulos citoplasmáticos se colorean fuertemente con eosina y; b) basófilas (B) que son largas y ovaladas con núcleo lateral, los gránulos citoplasmáticos no son abundantes.
También se pueden observar células más pequeñas que no adquieren coloración y se definen como cromofóbicas (C), representan células cromofílicas en descanso o degranuladas (Young y Heath, 2000; Jure et al., 2003).
2. –Por tipo de secreción. Se encuentran células productoras de adrenocorticotropina (ACTH), hormona luteizante (LH), hormona estimulante de folículos (FSH), melanotropina (MSH), prolactina (PRL), somatolactina (SL), somatotropina (GH) y tirotropina (TSH) (Bern, 1967; Jure et al., 2003; Tyagi y Sukla, 2002c).
MATERIALES Y MÉTODOS
Metodología. Se obruvieron 20 alevinos en un ámbito de 2,5–3,5 cm, en el establecimiento comercial acuagranja®, los cuales se anestesiaron con choque hipotérmico a –18 ºC para posteriormente realizarles un corte en la médula espinal por la salida del cráneo. a continuación, se separaron las cabezas completas, en el caso de los alevinos de mayor tamaño, se extrajo el cerebro (después de una prefijación) y se colocaron nuevamente en paraformaldehído al 4% para asegurar una buena fijación.
Las muestras se procesaron siguiendo el tratamiento de histología clásica estandarizado en el laboratorio de histoembriología de la universidad Militar Nueva Granada (Prophet et al., 1995; Schreck y Moyle, 1990): se introdujo la cabeza en paraformaldehído al 4% durante cinco días a 4 °C, se abrió previamente en la parte superior posterior del cráneo una ventana haciendo un raspado de la piel dejando al descubierto el cráneo. La cabeza se introdujo en una solución compuesta de 1:1 de ácido clorhídrico al 8% y ácido fórmico al 8%, a 4 °C, permanecieron en esta solución (cambiada a diario) durante cuatro días. Se realizaron tres lavados de una hora en amortiguador fosfato, de una hora cada uno y posteriormente, se realizó la deshidratación con lavados de etanol en concentraciones crecientes, de una hora. a continuación se realizaron dos baños de xilol de una hora cada uno. Finalmente se hizo la impregnación en parafina a 58 °C, realizándose tres baños de 1 hora cada uno.
Con micrótomo rotatorio se hicieron cortes seriados de un espesor de 7 µm en alevinos de 2,5 cm y de 5 µm en alevinos de 3,5 cm. Se tiñeron con hematoxilina–eosina (H–E) (Prophet et al., 1995; Schreck y Moyle, 1990) y se cubrieron los cortes con entellan®.
RESULTADOS
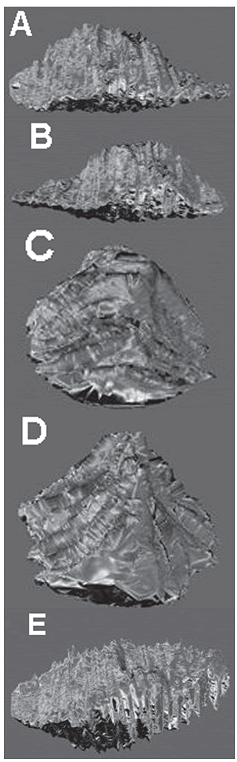
Reconstrucción tridimensional. Al realizarse la reconstrucción tridimensional se obtuvo una vista completa de la forma de la hipófsis de alevinos de P. brachypomus. como se puede observar en la figura 1, la estructura es de forma oblonga y con delgadas prolongaciones tanto hacia la parte anterior como posterior, siendo más delgada y prolongada en la parte posterior.
Histología. En los alevinos de P. brachypomus la hipófsis se localizó en la parte ventral del cerebro,
Figura 1. Visualización de la estructura tridimensional de la hipófsis de alevinos de P. brachypomus. A. Vista lateral derecha. B. Vista lateral izquierda. C. Vista frontal. D. Vista posterior. E. Vista superior
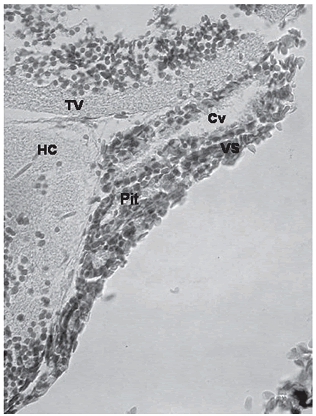
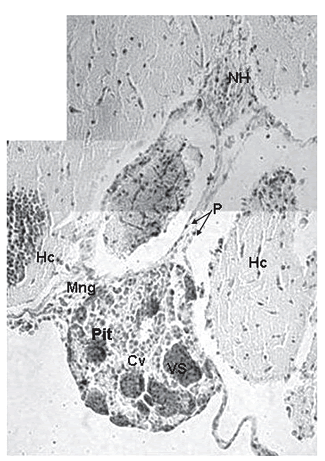
morfológicamente integrada parcialmente, como se puede observar en las figuras 2 y 3C, entre el nucleus tuberalis ventralis (TV) e hypothalamus periventricularis caudalis (Hc) del hipotálamo.
Figura 2. Sección sagital de la hipófsis de P. brachypomus, H–E 160x. (Pit = hipófsis; Cv = cavidad; VS = vaso sanguíneo; TV = nucleus tuberis ventralis; Hc = hypotalamus periventricularis caudalis)
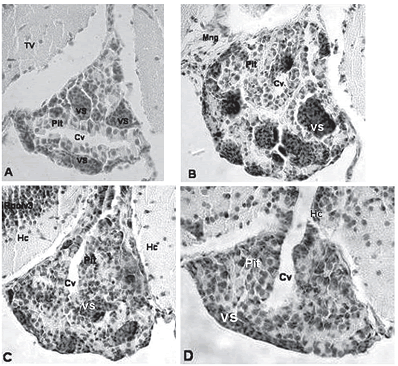
Figura 3. secciones transversales a diferentes niveles de corte de hipófsis de P. brachypomus, H–E 160x. (Pit = hipófsis; Cv = cavidad; VS = vaso sanguíneo; TV = nucleus tuberis ventralis; Hc = hypotalamus periventricularis caudalis; Mng = meninges)
Se determinó que el tejido que rodeaba la hipófsis de los alevinos era tejido conectivo laxo vascularizado, correspondiente a las meninges, como se puede observar en las figuras 3B y 4. En cuanto a la unión con el hipotálamo, se observó que la zona anterior de la hipófsis conectaba con el hipotálamo por tejido conectivo laxo, mientas que en la zona caudal se genera una unión al hipotálamo con un tejido nervioso, como se puede observar en la figura 4. En la figura 4 se pudieron destacar dos aspectos diferentes, el primero es la observación de la unión directa de la hipófsis con lo que se consideró un núcleo hipotalámico, esta unión estaría compuesta por los axones provenientes de los núcleos preóptico y paraventricular, y el segundo aspecto, es la observación de células que según la literatura corresponden a pituicitos (Tyagi y Sukla, 2002c; Young y Heath, 2000). Se puede observar ya una unión mayor entre el tejido hipofsiario y el hipotalámico, en la zona más caudal, que es donde se presenta la unión con el hc, como se puede observar en las figuras 3D y 5C.
Figura 4. Detalle de sección transversal de cerebro de alevino de P. brachypomus, H–E 400x. (NH = núcleo hipotálmico; Pit = hipófsis; Cv = cavidad; VS = vaso sanguíneo; Hc = hypotalamus periventricularis caudalis; P = pituicitos; Mng = meninges)
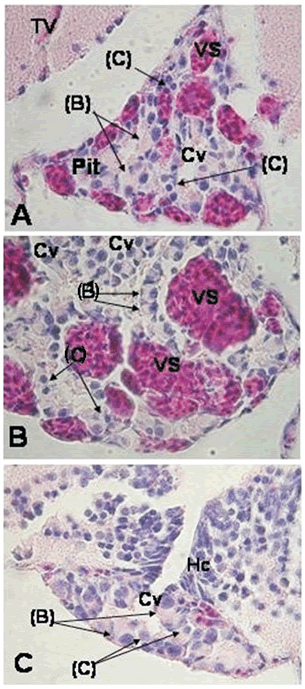
Figura 5. A. y C. Secciones transversales de hipófsis de alevino de P. brachypomus H–E 400x. B. Detalle de sección transversal de hipófsis de alevino de P. brachypomus h–e 400x. (Pit = hipófsis; Cv = cavidad; VS = vaso sanguíneo; TV = nucleus tuberis ventralis; Hc = hypotalamus periventricularis caudalis; (B) = células basófilas; (C), cromofóbicas)
La zona media de la glándula es mucho más ancha y en ella se encuentra la mayoría de las células, las cavidades y una gran vascularización. La figura 5 muestra que la mayoría de las células de la hipófisis de alevino de cachama son células basófilas (B) o cromofóbicas (C) de tamaños variados, ésto se repite en todos los niveles de los cortes de la hipófisis. No se observaron células acidofilas (A). Las células basófilas (B) no presentaban una forma definida, podían ser ovaladas o alargadas, la identificación de estas células se dio por la coloración, la distribución del citoplasma y el núcleo excéntrico de gran tamaño.
Las células cromófobas (C), el otro tipo encontrado, se identificaron al observarse núcleos en medio de espacios que parecían vacíos, pero cuando se observaban a un mayor aumento se podían ver que estaban rodeados por una membrana y en algunos casos se observaba un poco de coloración dentro del citoplasma. Las células (C) eran células que en comparación con las (B) eran muy pequeñas y generalmente redondas, pero en algunos casos se veían alargadas pero sin tanta coloración como las (B), además de que el núcleo es más pequeño y oscuro. No se observa una distribución definida de estos dos tipos celulares, pero si se observan cavidades dentro de la hipófisis donde puede que se liberen sus productos.
En cuanto a lo que correspondería a la neurohipófisis, en la zona caudal se observó que estaba muy poco desarrollada, ya que aun en presencia de fibras con pituicitos y una unión directa con el hipotálamo, no se observaba un proceso digitiforme (figuras 3D, 4 y 5C).
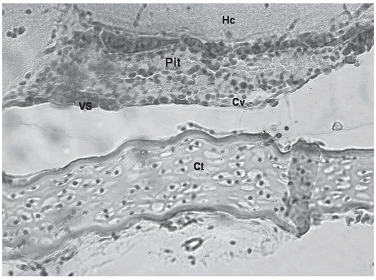
En las figuras 3 y 5 se observaron zonas en las que se presentaba una alta irrigación, la cual estaba muy cercana a las cavidades donde se encontraba una especie de gránulos. tanto en los cortes sagitales como en los transversales (figuras 2–6) se pudo ver que la hipófisis tenía una gran irrigación sanguínea a través de toda su estructura, diferente distribución a través de los cortes. La irrigación se observó inicialmente en la región anterodorsal de la hipófisis y a medida que se fue desplazando por los cortes hacia su parte caudal, aumentando en su parte ventral. en la parte inferior de la hipófisis de los alevinos que se les cortaron la cabeza completa se encontró cartílago hialino cercano a la glándula (figura 6), éste se encontró en todos los cortes que contenían la hipófisis.
Figura 6. Corte sagital de hipófsis de alevino de p. brachypomus, H–E 160x. (Pit = hipófsis; Cv = cavidad; VS = vaso sanguíneo; Hc = hypotalamus periventricularis caudalis; Ct = cartílago hialin)
DISCUSIÓN
Reconstrucción tridimensional. Al comparar la forma de la hipófsis con las descripciones de diferentes especies de teleósteos en la literatura consultada (Bently, 1998; Tyagi y Sukla, 2002a, c), se encontró cierta similitud que puede variar dependiendo de cuan elongada sea, en el caso del alevino de P. brachypomus, aparentemente más alargada que en los casos descritos en la literatura. este factor no se puede tomar como una diferencia entre especies, por que como se dijo anteriormente, este estudio se realizó en alevinos y no en adultos, no se puede determinar que las diferencias se deban a tiempos de maduración diferentes o a una diferencia especie específca.
Histología. La hipófsis de los alevinos de P. brachypomus se encuentra en la ubicación esperada, en la zona ventral al hipotálamo, y posterior al nervio óptico (ross et al., 1997). Es diferente al caso del Oryzias latipes (también teleósteo) en el cual la hipófsis se encuentra en una zona más anterior que en la cachama, apoyando lo expresado por Tyagi y Sukla (2002c) y Anderson y Mitchum (1974), quienes sostienen que en diferentes especies de peces pueden existir diferencias morfológicas y de ubicación. La hipófsis se encontró parcialmente integrada en el cerebro, diferencia notable con lo descrito por Anken y Bourrat (1998) en el medaka, aun así no parece haber conexiones directas cerebro– hipófsis anterior que no sean por tejido conectivo.
En cuanto al tipo de células presentes, hay una gran discrepancia con la literatura pues en este estudio se encontraron, en su gran mayoría células basófilas, pero no se observaron células acidófìlas, lo que en un principio resultaría extraño porque las células de GH son acidóflas. Según Saga et al. (1999), en los peces de agua dulce aparecen las células de prolactina (basófilas) antes de la GH. También concuerda con la información que se encuentra sobre las células TSH (basófilas), según Saga et al. (1999) éstas se presentan 50 días después de eclosión.
Lo que se describió como tejido nervioso (figuras 3, 4C, D y 5C), probablemente corresponde a la eminencia media de la hipófsis y a un inicio de la pars nervosa. aun así no se observa el proceso digitiforme característico de la pars nervosa (Bently, 1998; Tyagi y Sukla, 2002a, c), que cuando se compara con garcía (2006), donde juveniles de Pimelodus pictus muestran un proceso digitiforme avanzado, se puede determinar que en alevinos de P. brachypomus la pars nervosa no está desarrollada, aun así se necesitarían estudios inmunohistoquímicos o con marcadores moleculares para determinar si hay presencia de neurosecreción y ver con claridad la conexión hipotálamo– hipófsis.
Se ha descrito que en teleósteos no existe un sistema portal hipofsiario, sino solamente una pequeña entrada de vasos sanguíneos en la parte superior de la glándula, que tienen un recorrido bastante cortó hacia la región ventral de la hipófisis (Bently, 1998). En este estudio se encontró una clara irrigación, y parece ser más abundante que lo descrito para teleósteos adultos, lo cual podría corresponder a una real diferencia en la especie, o simplemente a que no se conocen descripciones sobre si hay alguna variación en el nivel de vascularización durante el desarrollo de la hipófsis esta o de otras especies de peces, y que la diferencia observada sea debida a que se trabajo con individuos supremamente jóvenes (Bently, 1998; Tyagi y Sukla, 2002c).
La presencia de cartílago en la parte inferior de la hipófsis puede señalar que en el desarrollo hay una posibilidad de que este se convierta en la silla turca; según Tyagi y Sukla (2002c) algunas especies de teleósteos presentan silla turca, aun que está sea una rara variación en peces. aún así, sin un estudio de desarrollo no se puede determinar si es la silla turca en proceso de formación.
En conclusión, se observaron diferencias en los diferentes aspectos histológicos de la hipófsis de alevinos de P. brachypomus con los observados en otros peces, inclusive dentro de los teleósteos. Sin embargo se tiene que tomar en cuenta que estos son alevinos y no juveniles ni adultos, en los cuales ya se ha dado un mayor o un total desarrollo del cerebro y de las glándulas, por lo que cabe la posibilidad de que lo discutido aquí varíe a través del desarrollo del pez. Existe un gran vacío en la literatura sobre la estructura de la hipófsis de alevinos, y peor aún en el caso de especies colombianas.
Este desconocimiento es particularmente notorio en la histología (excepto, en el pez cebra; Detrich et al., 1999; ELI, 1998), ya que lo que se encuentran son estudios inmunocitoquímicos de la presencia o ausencia de las hormonas en los diferentes estadios de desarrollo del pez, pero no se da una base histológica completa del desarrollo de la glándula.
AGRADECIMIENTOS
Se agradece a la universidad militar nueva granada por el apoyo técnico y fnanciero que hizo posible la realización de este trabajo.
REFERENCIAS
1. Anderson BG, Mitchum DL. 1974. Atlas of trout histology. Bulletin N.º 13. Wyoming Game and Fish Department. Wyoming, USA. [ Links ]
2. Anken R, Bourrat F. 1998. Atlas of the Medakafish (Oryzias latipes). Institut National de la Recherché Agronomique. Paris, Francia. [ Links ]
3. Barreto CG, Mosquera BJ. 1998. Boletín estadístico pesquero. Instituto Nacional de Pesca y Acuicultura (INPA). Bogotá, Colombia. [ Links ]
4. Barrington EJW. 1975. Organización y evolución de la hipófisis. Pp. 65–98. En: Barrington EJW. Introducción endocrinología general y comparada. H. Blume Ediciones. Madrid, España. [ Links ]
5. Bentley PJ. 1998. Comparative vertebrate endocrinology. 3era. ed. Cambridge University Press. Cambridge, UK. [ Links ]
6. Bern HA. 1967. Hormones and endocrine glands of fishes. Science, 158(38):455–462. [ Links ]
7. Budantsev AY, Jakovlev YY. 2000. 3–D Reconstruction of biological objects: The potential of Standard Computer Programs. Microscopy and Analysis, 2000 (September):17–19. [ Links ]
8. Detrich HM, Westerfield M, Zon LI. 1999. The zebrafish biology. Academic Press. Londres, Inglaterra. [ Links ]
9. ELI. 1998. Zebrafish information server. Disponible en: <http://zebra.biol.sc.edu/>. Fecha de consulta: Diciembre 2005. [ Links ]
10. Evans PH. 1998. The physiology of fishes. 2nd ed. CKC Press. Boca Raton (FL), USA. [ Links ]
11. Fiala JC, Harris KM. 2002. Computer–based alignment and reconstruction of serial sections. Microscopy and Analysis, 52:5–7. [ Links ]
12. García M. 2006. Estudio histológico preliminar de la hipófisis de bagre tigrito (Pimelodus pictus). Proyecto de iniciación científica. Facultad de Biología. Universidad Militar Nueva Granada. Bogotá, Colombia. [ Links ]
13. Herrero–Turion MJ, Velasco A, Concepción M, Durán R, Rodríguez R, Aijón J, Lara J. 2002. Localización de los ARNm de los dos tipos de somatolactina, de la hormona de crecimiento y de la prolactina en hipófisis de dorada Sparus auratus L., 1758. Boletín Instituto Español Oceanográfico, 18(1–4):229–238. [ Links ]
14. Hibbard LS, McGlone JS, Davis DW, Hawkins RA. 1987. Three–dimensional representation and analysis of brain energy metabolism. Science, 236:1641–1646. [ Links ]
15. Jure V, Kronau M, Máscareño S. 2003. Ilustrados.com. Disponible en: <http://www.ilustrados.com/publicaciones/EpypZlEZkyfleRRCxM.php>. Fecha de consulta: Noviembre 2005. [ Links ]
16. Kongsberg SIM. 2000. VRML View 3.0. Kongsberg SIM. Disponible en: <http://www.km.kongsberg.com/sim>. Fecha de consulta: Octubre 2004. [ Links ]
17. Mommsen TP. 2001. Paradigms of growth in fish. Comparative Biochemistry and Physiology (Part B), 129:207–219. [ Links ]
18. Otero RJ. 2000. La cachama blanca, con futuro abierto. Acuioriente, 8:16–18. [ Links ]
19. Prieto–Gómez B, Velásquez–Paniagua M. 2002. Fisiología de la reproducción: hormona liberadora de gonadotropinas. Revista de la Facultad Medicina (UNAM), 45(6):252–257. [ Links ]
20. Prophet E, Mill B, Arrington J, Sobin L (eds.). 1995. Métodos histoembriológicos. Registro de patología de los Estados Unidos de América (ARP). Washington, D. C., Estados Unidos de América. [ Links ]
21. Ramm P. 1994. Advanced image analysis systems in cell, molecular and neurobiology applications. Journal of Neuroscience Methods, 54:131–149. [ Links ]
22. Ross MH, Romrell JL, Kaye GI. 1997. Glándulas endocrinas. Pp.594– 633. En: Ross MH, Romrell JL, Kaye GI (eds.). Histología: Texto y Atlas. 3ra. ed. Editorial Médica Panamericana. México. [ Links ]
23. Saga T, Yamak K, Doi Y, Yoshizuka M. 1999. Chronological study of the appearance of adenohypophysial cells in the Ayu (Plecoglossus altevelis). Anatomy and embryology, 200(5):469–475. [ Links ]
24. Schreck CB, Moyle PB. 1990. Methods for fish biology. American Fisheries Society. Maryland, USA. [ Links ]
25. Scout WB. 1983. On the development of the pituitary body in Petromyzon, and the significance of that organ in other type. Science, 2(28):184–186. [ Links ]
26. Suárez JM, Córdoba LA, Hurtado H. 2005. Desarrollo de la inervación del mmiembro posterior de la rata blanca (Rattus norvergicus Berkenhout, 1769). Actualidades Biológicas, 27(83):127–141. [ Links ]
27. Torres E. 2000. La cachama blanca, con futuro abierto. Acuioriente, 8:12–13. [ Links ]
28. Tyagi R, Shukla AN. 2002a. Hormones in development. Pp. 205–238. En: Anatomy of Fishes. Anmol Publications PVT. CTD. New Delhi, India. [ Links ]
29. Useche M. 1999. Universidad Nacional Experimental Del Táchira. <http://www.unet.edu.ve/~frey/varios/decinv/piscicultura/cachama/>. Fecha de consulta: Diciembre 2005. [ Links ]
30. Weninger WJ, Meng S, Streicher J, Müller GB. 1998. A new episcopic method for rapid 3–D reconstruction: applications in anatomy and embryology. Anatomy and Embryology, 197:341–348. [ Links ]
31. Whiten S, Smast S, McLachlan J, Aiton J. 1998. Computer–aided interactive three– dimensional reconstruction of the embryonic human heart. Journal of Anatomy, 193:337–345. [ Links ]
32. Young B, Heath JW. 2000. The endocrine glands. Pp. 310– 329. En: Young B, Heath JW. Wheater's funcional histology. Harcourt Publishers Limited. Londres, Inglaterra. [ Links ]
Recibido: julio 2008
Aceptado para publicación: octubre de 2008