Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.31 no.1 Medellín July/Dec. 2009
ARTÍCULOS DE INVESTIGACIÓN
CARACTERIZACIÓN DE LA COMPOSICIÓN MICROBIANA DE CUATRO QUEBRADAS DEL PARQUE NACIONAL NATURAL GORGONA
CHARACTERIZACION OF THE MICROBIAL COMPOSITION OF FOUR STREAMS GORGONA NATURAL NATIONAL PARK
Sandra M. Valencia–G.1; Pilar X. Lizarazo–M.2
1 Instituto de Biología, Universidad de Antioquia, A. A. 1226. Medellín (Antioquia), Colombia. smvalencia29@gmail.com
2 Docente. Instituto de Biología, Universidad de Antioquia, A. A. 1226. Medellín (Antioquia), Colombia. pixilime@gmail.com.
Resumen
En el trópico y particularmente para Colombia son escasos los estudios de la composición microbiana de quebradas de ambientes insulares y su posible uso como bioindicadores. Este trabajo contribuye a llenar este vacío de información describiendo la composición de la microbiota presente en algunos microhábitats en quebradas de la isla Gorgona. Este estudio determinó la abundancia microbiana de hongos, bacterias heterótrofas y coliformes en hojarasca, en biopelícula de piedras sumergidas y en agua. Estas muestras fueron colectadas en pozos y rápidos, a 10 y 50 msnm, en dos quebradas de la isla Gorgona de cada vertiente. Las quebradas muestreadas corresponden a La Camaronera y Cocal Norte localizadas en áreas no intervenidas e Iguapoga e Ilú consideradas intervenidas, debido a cambios en el uso del suelo y ubicadas en la zona definida como de alta densidad de uso. Se determinaron factores físicos y químicos del agua. Los valores de abundancia microbiana mostraron diferencias de acuerdo a la vertiente, siendo mayores en las quebradas que sufrieron intervención. El análisis de los recuentos de los grupos microbianos y los factores físico químicos del agua de las quebradas, realizado mediante un ordenamiento no métrico multidimensional indicó que las quebradas se separaron de acuerdo a su ubicación dentro de áreas intervenidas y no intervenidas. El análisis mostró que la abundancia de hongos en hojarasca y en agua, y la de coliformes en la biopelícula y en agua son las variables principales de la estructuración. Los parámetros ambientales que mejor se correlacionaron con la ordenación fueron: conductividad, pH y temperatura del agua. Procedimientos de permutación de respuestas múltiples mostraron que las quebradas en áreas no intervenidas difieren significativamente en su composición microbiana de las quebradas localizadas en áreas intervenidas. Los hábitats caracterizados presentaron mayor recuento de bacterias heterótrofas y de hongos. La hojarasca presentó el mayor valor de abundancia, seguido por la biopelícula en las piedras y en el agua. La hojarasca aporta bacterias heterótrofas y hongos en todos los hábitats, tanto rápidos como pozos. Este trabajo sugiere que los grupos microbianos pueden ser utilizados como bioindicadores de intervención en la isla Gorgona.
Palabras clave: bacterias heterótrofas, biopelícula, coliformes, hongos, hojarasca, microbiota, quebradas.
Abstract
In the tropics and particularly in Colombia, studies about microbial composition in islands and their possible use as bioindicators are scarce. This work contributes to fill in the current information gaps by establishing the composition of the microorganisms in three stream microhabitats in Gorgona Island. This study determined the abundance of fungi, heterotrophic bacteria and coliforms in leaf litter, biofilms on submerged stones, and in water samples. This samples were collected in both pools and riffles, located at 10 and 50 msnm, in four streams in Gorgona Island: La Camaronera y Cocal Norte located at undisturbed areas, and Iguapoga and Ilú located at disturbed areas. Disturbance was related to past deforestation and proximity to the current zone of high building and use density. Physico–chemical factors of the water were measured. Microbial abundance showed differences relative to the two island's drainages being higher in streams that suffered past disturbances. The analysis of microbial counts and the physico–chemical variables of the water of the streams using Non Metric Multidimensional Scaling separated the streams according to disturbance. The analysis showed that the number of fungi in leaf litter and water, coliforms in the biofilm and in water are the main variables explaining the ordination. The environmental parameters better explaining the ordination were: water conductivity, pH, and temperature. Multiple Response Permutation Procedure showed that streams in undisturbed areas differed significantly in their composition of the streams in disturbed areas. All habitats presented high accounts of heterotrophic bacteria and fungi. The leaf litter presented a higher abundance of heterotrophic bacteria and fungi, followed by the biofilm on stones and water samples. The leaf litter contributed heterotrophic bacteria and fungi to both riffles and pools. This work suggests that the microbial groups studied in this work can be used as bioindicators of disturbance in the Gorgona Island.
Key words: biofilm, coliforms, fungi, heterotrophic bacteria, leaf litter, microorganisms, stream
INTRODUCCIÓN
La calidad de los ecosistemas acuáticos lóticos con frecuencia se ha estimado en relación con características fisicoquímicas (Stutter et al. 2007), e históricamente ésta valoración se ha implementado de acuerdo a razones de tipo económico y sanitarias (Bonada et al. 2006). Recientemente, este enfoque ha cambiado enfatizándose ahora la importancia de reconocer de manera integrada, algunos de sus aspectos químicos, físicos, biológicos e hidrogeológicos, ya que esto puede conducir a valorar de manera más precisa el estado ecológico de éstos sistemas (Stutter et al. 2007). Las actividades humanas tienen un efecto importante sobre el estado ecológico de ríos y quebradas, siendo éstos sometidos a diferentes estados de perturbación y alterando algunas de sus características químicas, físicas y biológicas. A pesar de que el efecto de éstas alteraciones puede ser difícil de identificar y de predecir (Lear y Lewis 2009), se sugiere que las poblaciones microbianas pueden ser más sensibles a pequeñas variaciones en las condiciones locales. El uso de indicadores microbianos se constituye en una alternativa para identificar algunas alteraciones en los sistemas acuáticos naturales, debido a su ubicuidad y rápida respuesta a los cambios en el medio ambiente (Solé et al. 2008).
En lo referente a los aspectos biológicos, los programas de biomonitoreo tradicionalmente han usado como principales indicadores las comunidades de insectos y otros macroinvertebrados acuáticos, al igual que indicadores microbianos de calidad sanitaria, como el grupo de bacterias coliformes (Bonada et al. 2006). Sin embargo, considerando que los ecosistemas lóticos tropicales son ecosistemas de gran complejidad y relevancia ecológica, es importante resaltar el papel que cumplen las poblaciones microbianas y la dinámica de sus interacciones en el mantenimiento de su estructura y su funcionamiento. Los microorganismos son los que en mayor proporción contribuyen con la degradación de la materia orgánica que ingresa al sistema y que en un gran porcentaje es aportada por material vegetal, siendo así la hojarasca una fuente importante de energía y carbono (Das et al. 2007). Dentro de los organismos más activos en la descomposición de materia orgánica se encuentran tanto hongos como bacterias, los cuales se consideran importantes dinamizadores del reciclaje de nutrientes en ambientes acuáticos (Schoenlein–Crusius 2003). Estos organismos contribuyen con la transferencia de energía hacia niveles tróficos superiores al incrementar la disponibilidad de algunos nutrientes y la palatabilidad, así como por su capacidad para metabolizar algunos compuestos recalcitrantes (Wright y Covich 2005).
Las bacterias quimiorganotrofas y quimiolitotrofas pueden estar asociadas a materia orgánica en descomposición, encontrándose también en la biopelícula de la superficie de rocas y en la hojarasca, en los intersticios del substrato y suspendidas en el agua. A pesar de su importancia este grupo microbiano no ha sido ampliamente estudiado (Giller y Malmqvist, 1998). Entre los grupos bacterianos el más predominante en ambientes acuáticos son los bacilos Gram negativos que presentan actividad enzimática pectinasa y celulasa. Dentro de éstos, bacterias coliformes han sido consideradas indicadoras de contaminación de origen fecal y descomponedores de materia orgánica (Romaní 2006). Los hongos en ambientes acuáticos asociados a procesos de descomposición de materia orgánica corresponden al grupo hifomicete (Duarte et al. 2006). Los hifomicetos maceran el tejido vegetal básicamente por la acción de pectinasas (Giller y Malmqvisti,1998).
Para Colombia no existen estudios acerca del efecto antrópico o los cambios en los usos del suelo sobre los ecosistemas lóticos desde una perspectiva que incluya las poblaciones microbianas como herramienta de valoración. El Parque Nacional Natural Gorgona (PNN Gorgona), por su carácter insular y por poseer zonas intervenidas en diferentes estados de recuperación, así como zonas no intervenidas, constituye la localidad ideal para adelantar estudios encaminados a evaluar la variación de diferentes grupos microbianos y su potencial como bioindicadores.
Este trabajo es la primera caracterización de la variación espacial de las poblaciones de algunos grupos microbianos de importancia en los ecosistemas acuáticos del PNN Gorgona y su posible relación con el grado de intervención. A partir de este trabajo futuros estudios permitirán determinar los diversos factores involucrados en la estructura de éstos sistemas y su dinámica en el proceso de descomposición de hojarasca en ambientes acuáticos, y particularmente en regiones insulares.
MATERIALES Y MÉTODOS
Área de estudio. La isla Gorgona se encuentra localizada en el Pacífico oriental (2° 47' – 3° 06' N, 78° 06' – 78° 18' O), formando parte del Chocó biogeográfico (Díaz et al. 2001). Aunque el marco tectónico no está del todo claro, se plantean principalmente tres hipótesis en relación con su origen. Una de ellas plantea que Gorgona es una isla oceánica, mientras que las otras dos sugieren un origen continental (Aguirre y Rangel 1993). En cuanto a sus condiciones climáticas presenta una temperatura promedio anual de 26 °C, con una humedad relativa promedio superior al 90% y un régimen de precipitación unimodal y un promedio anual de 6.778 mm.
La isla es un mosaico que comprende vegetación intervenida y/o ruderal principalmente hacia el costado oriental y suroriental. Esto como resultado de diferentes perturbaciones generadas durante el funcionamiento de la prisión. Igualmente, posee bosques en diferentes etapas de regeneración y vegetación natural que le da carácter prístino a algunos de sus bosques en el costado occidental. La vegetación intervenida comprende zonas de cultivo con árboles frutales y plantas ornamentales y de jardinería, vegetación secundaria por clareos con diferentes etapas en los procesos de sucesión, al igual que comunidades pioneras sobre la playa. Por su parte, la vegetación natural corresponde a tres asociaciones que comprende vegetación de tipo selvático (Rangel 1990).
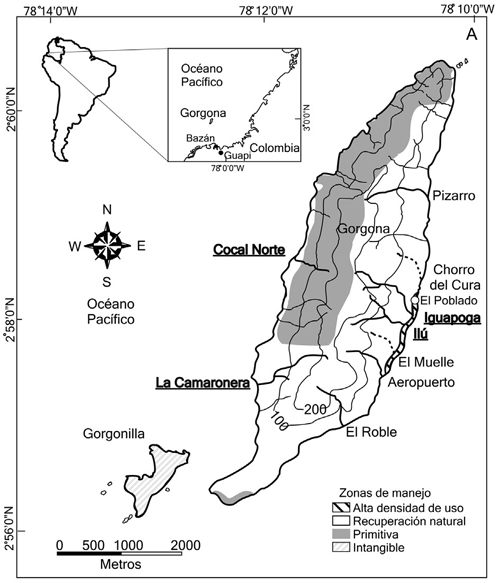
Colecta y procesamiento de muestras. Para evaluar la composición y variación de la microbiota presente en las quebradas de la isla se eligieron cuatro quebradas, dos en cada vertiente. El muestreo fue realizado en el mes de febrero de 2009, época de bajas lluvias. Dos quebradas drenando áreas intervenidas se muestrearon en la vertiente oriental, Ilú e Iguapoga. Dos quebradas no intervenidas se muestrearon en la vertiente occidental, La Camaronera y Cocal Norte. Cada quebrada se dividió en dos tramos: alto y bajo, a 50 y 10 msnm, respectivamente. En cada tramo se muestrearon dos hábitats, pozos y rápidos, y dentro de éstos se estudiaron tres microhábitat. Los microhábitat fueron paquetes de hojarasca, biopelícula sobre piedras sumergidas y muestras de la columna de agua. Se colectaron doce muestras por quebrada, correspondiendo a seis por altura, tres por hábitat y una de cada microhabitat, siguiendo un diseño anidado, para un total de 48 unidades de muestreo (figura1).
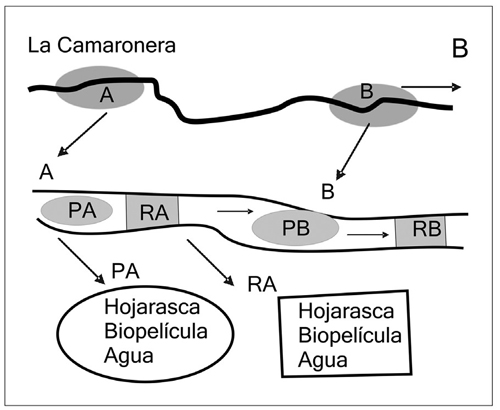
Figura 1. A. Ubicación de la isla Gorgona en el Pacífico Central colombiano y de las quebradas muestreadas. Se indica la zonificación de la isla según Plan de Manejo 1998– 2003 (UAESPNN 2005). B. Distribución de las unidades de muestreo dentro de cada quebrada. Tramos. A = alto; B = bajo. Hábitats. P = pozos; R = rápidos. Microhábitats: hojarasca, biopelícula de piedras sumergidas y agua [tomado y modificado de Gómez–Aguirre (2009)]
Las muestras de hojarasca sumergida se colectaron manualmente formando paquetes mixtos y se guardaron en bolsas estériles tipo whirl pak. Para las muestras de biopelícula se tomaron aleatoriamente dos piedras de tamaños similares por sitio de muestreo. En cada piedra se delimitó un área de aproximadamente diez centímetros cuadrados para hacer un raspado que posteriormente fue resuspendido en agua estéril. Adicionalmente, se tomó en cada unidad de muestreo una muestra de la columna de agua de un volumen de 100 mililitros. Todas las muestras fueron mantenidas en condiciones de esterilidad y refrigeración hasta su procesamiento.
Se establecieron como grupos microbianos a evaluar el grupo de coliformes, bacterias heterótrofas totales y hongos. El procesamiento de las muestras incluyó la determinación de las poblaciones de todos los grupos como unidades formadoras de colonias (UFC) por mililitro o gramo. Se realizaron siembras en medios diferenciales referenciados para cada grupo microbiano, utilizando la técnica de vertido en placa y siembra en superficie siguiendo la metodología propuesta en el Standard Methods (versión 20.0) (APHA 1998).
Para cada punto de muestreo se evaluaron algunos parámetros fisicoquímicos in situ, como la temperatura del aire y del agua, la concentración y saturación de oxígeno disuelto, la concentración de dióxido de carbono (por medio de titulación con NaOH), el pH y la alcalinidad (por medio de titulación con H2SO4) y la conductividad eléctrica. A partir de muestras de agua se analizó la concentración de carbono orgánico disuelto (método de oxidación, Norma Técnica Colombiana 5167), fósforo total (P2O5, por medio de fotometría, NTC 234) y concentración de cloruros (por medio de electroforesis capilar). Se cuantificó el nitrógeno total (por medio de la técnica de Kjeldahl, NTC 370) y la concentración de sulfatos (SO4 mediante titulación con BaCl2).
Procesamiento de la información. Para establecer comparaciones entre los valores de abundancia de cada grupo microbiano éstos se calcularon como porcentaje de acuerdo con la escala evaluada. Con el objetivo de determinar las similitudes entre las unidades de muestreo se realizó un análisis de Escalamiento Multidimensional no–Métrico (NMS), utilizando como distancia de medida Sorensen (Bray–Curtis). La validez de la ordenación obtenida se determinó a partir del valor del stress y el valor de p, utilizando una prueba de Monte–Carlo. Las coordenadas de la ordenación fueron correlacionadas con la matriz de datos para determinar las variables que guardan mayor relación con los ejes. Para evaluar la correlación de las variables fisicoquímicas con la distribución de las poblaciones de los grupos microbianos evaluados, se empleó un diagrama conjunto que relaciona la configuración de los puntos en la ordenación con el comportamiento de éstas variables. Adicionalmente, la significancia estadística de los grupos en cada nivel fue evaluada a través de procedimientos de permutación de respuestas múltiples (MRPP) empleando como medida de distancia Sorensen (Bray–Curtis). Estos análisis fueron realizados utilizando el programa PC–ORD (McCune y Mefford 1999).
RESULTADOS
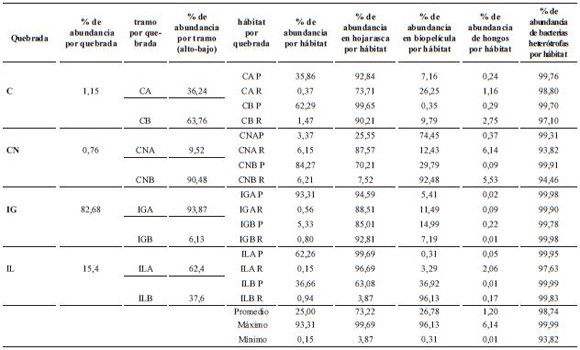
Los grupos microbianos mostraron diferencias marcadas en su composición de acuerdo con el grado de intervención que presenta cada vertiente. Los mayores valores de abundancia (UFC/mL) se presentaron en las quebradas Ilú e Iguapoga, ambas intervenidas. Evaluando las cuatro quebradas como un grupo, se encontró que en estas dos quebradas se concentra cerca del 97% del total de microorganismos, con un 82,7% y 15,4% en Iguapoga e Ilú, respectivamente. En comparación, los valores encontrados en La Camaronera (1,15%) y Cocal Norte (0,76%), no intervenidas, fueron menores.
El grupo dominante fue bacterias heterótrofas totales, seguido por hongos y coliformes, lo que se observa independiente de la escala evaluada (vertiente/intervención, quebrada, tramo, hábitat y microhábitat). La abundancia de coliformes en la columna de agua fue mayor en la quebrada Iguapoga, con 67% del total de coliformes de las cuatro quebradas. En Ilú se encontró el 30,64%, mientras que en La Camaronera y Cocal Norte, quebradas no intervenidas, los valores de abundancia fueron inferiores al 1% (tabla 1).
Tabla 1. Porcentajes de abundancia microbiana presente en cada quebrada en los diferentes tramos y hábitats en la isla Gorgona, Pacífico Central colombiano (C = La Camaronera; CN = Cocal Norte; IG = Iguapoga; IL = llú)
A nivel de tramo, la composición microbiana mostró patrones distintos en cada vertiente. En las quebradas de la vertiente occidental, no intervenida (La Camaronera y Cocal Norte), el mayor porcentaje de abundancia se presentó en el tramo de la parte baja. En las quebradas de la vertiente oriental, intervenida (Ilú e Iguapoga), los mayores valores se registraron en el tramo de la parte alta (tabla 1). A nivel de hábitat, los mayores valores de abundancia de grupos microbianos se registraron en pozos, con valores entre 93 y 35%. El mayor porcentaje se registró en Iguapoga y el más bajo en La Camaronera, en el pozo de la parte alta (figura 2a). En los rápidos la abundancia de los grupos microbianos fue menor del 7% en todas las quebradas. En general, el hábitat que presentó mayor abundancia fue pozo, excepto para Cocal Norte.
En lo referente al microhábitat, la hojarasca presentó la mayor abundancia microbiana en comparación con la biopelícula y el agua (tabla 1). La abundancia de la hojarasca representó el 92,5%, del total calculado para todas las quebradas. La biopelícula contribuyó con el 7,5%, y el agua presentó un porcentaje de aporte menor al 1%.
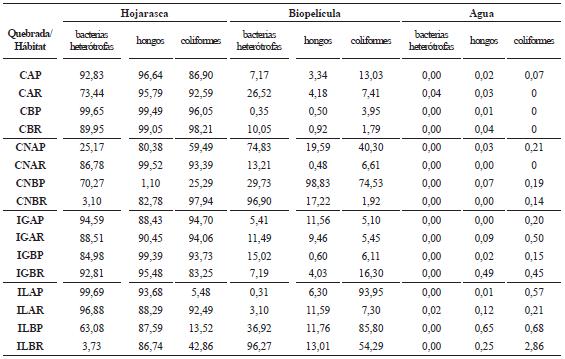
Composición de microorganismos por quebrada. La abundancia microbiana en relación al hábitat, en todas las quebradas fue mayor para bacterias heterótrofas, seguido por hongos y coliformes. Para el grupo de hongos, en las quebradas La Camaronera, Cocal Norte e Ilú los mayores valores de abundancia se presentaron en los rápidos, mientras que en Iguapoga, los valores de abundancia de hongos no presentan diferencias (tabla 2).
En la quebrada La Camaronera, la mayor abundancia de microorganismos se presentó en la hojarasca con valores superiores al 90%, excepto para el rápido de la parte alta con aportes del 73%. La biopelícula presentó el segundo valor de abundancia seguido por el agua, que representó valores inferiores al 1%. Los valores de abundancia para todos los grupos indicaron que la hojarasca aportó más del 90% del total de estos grupos en cada hábitat. La segunda fuente de aporte es la biopelícula, con un porcentaje de 26,5% para el rápido de la parte alta y valores inferiores al 10% en los otros hábitats (tabla 2).
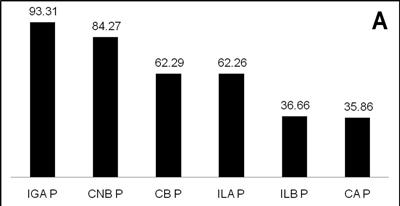
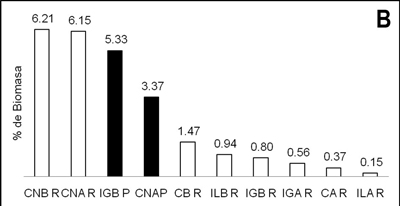
Figura 2. Porcentaje de abundancia microbiana por hábitat (pozos y rápidos) en isla Gorgona, Pacífico Central colombiano. A. Hábitats con porcentajes superiores al 30%. b. Hábitats con porcentajes inferiores al 7%. CAP = La Camaronera alta pozo; CAR = La Camaronera alta rápido; CbP = La Camaronera baja pozo; CbR = La Camaronera baja rápido; CNAP = Cocal Norte alta pozo; CNAR = Cocal Norte alta rápido; CNbP = Cocal Norte baja pozo; CNbR = Cocal Norte baja rápido; IGAP = Iguapoga alta pozo; IGAR = Iguapoga alta rápido; IGbP = Iguapoga baja pozo; IGbR = Iguapoga baja rápido; ILAP = Ilú alta pozo; ILAR = Ilú alta rápido; ILbP = Ilú baja pozo; IbR = Ilú baja rápido
En Cocal Norte, la hojarasca y la biopelícula presentaron los mayores valores de abundancia microbiana, mientras que el agua no representó un aporte significativo. En la mayoría de los hábitats, el mayor aporte lo realizó la hojarasca, excepto para el pozo de la parte baja donde la biopelícula presentó el 92,48% del total en ese hábitat (tabla 2). En general, en Cocal Norte la hojarasca presentó mayores recuentos de hongos, el 99% de los hongos en el pozo de la parte alta se encuentran en hojarasca (tabla 2). En la biopelícula el porcentaje de abundancia de hongos es de 19 y 17% para el pozo de la parte alta y el rápido de la parte baja, respectivamente. En el pozo de la parte baja, donde la hojarasca presentó el 1,0 % de los hongos, la biopelícula aportó el 98,8%. En esta quebrada el porcentaje de hongos, coliformes y bacterias heterótrofas en agua son inferiores al 0,21% por hábitat (tabla 2).
Tabla 2. Valores de porcentaje de los diferentes grupos microbianos en hojarasca, biopelícula de piedras sumergidas y agua para los diferentes hábitats en los tramos y quebradas muestreadas en la isla Gorgona, Pacífico Central colombiano (CAP = La Ca– maronera alta pozo; CAR = La Camaronera alta rápido; CBP = La Camaronera baja pozo; CBR = La Camaronera baja rápido; CNAP = Cocal Norte alta pozo; CNAR = Cocal Norte alta rápido; CNBP = Cocal Norte baja pozo; CNBR = Cocal Norte baja rápido; IGAP = Iguapoga alta pozo; IGAR = Iguapoga alta rápido; IGBP = Iguapoga baja pozo; IGBR = Iguapoga baja rápido; ILAP = Ilú alta pozo; ILAR = Ilú alta rápido; ILBP = Ilú baja pozo; IBR = Ilú baja rápido)
El porcentaje de microorganismos presentes en la hojarasca de los hábitats de la quebrada Iguapoga fue superior al 85%. La hojarasca aportó valores del 83% al 99% de bacterias heterótrofas, hongos y coliformes (tabla 1). En la biopelícula se encontró entre el 1 y el 16% de los microorganismos por hábitat, presentándose las mayores abundancias para el grupo de bacterias heterótrofas, seguido por hongos y coliformes. En el agua los valores de abundancia fueron bajos (tabla 2).
En la quebrada Ilú, la abundancia de microorganismos fue inferior en agua. Los mayores valores se presentaron en hojarasca y en biopelícula, lo cual varió de acuerdo al hábitat. En los rápidos correspondientes al tramo alto, la hojarasca presentó el 96% de la abundancia total. Para los rápidos de la parte baja la abundancia de microorganismos en la biopelícula correspondió al 96,1% del total en este hábitat (tabla 2). En esta quebrada, la biopelícula aportó mayores porcentajes de coliformes, seguido de bacterias heterótrofas y hongos.
El análisis de NMS, basado en los valores de recuento de todos los grupos microbianos por microhábitat, mostró una separación por quebrada y tramo. Un grupo fue conformado por la quebrada La Camaronera y el tramo alto de Cocal Norte, un segundo grupo por el tramo bajo de la quebrada Cocal Norte exclusivamente y un tercer grupo conformado por las quebradas Ilú e Iguapoga, en los dos tramos estudiados. Este agrupamiento estuvo determinado por las variables en el eje 2. Este eje se correlacionó con los recuentos de bacterias heterótrofas en hojarasca, hongos en hojarasca, bacterias heterótrofas en biopelícula, coliformes en biopelícula, hongos en agua, bacterias heterótrofas en agua y coliformes en agua. Con el eje 1 se encontró correlación con la abundancia de coliformes en agua.
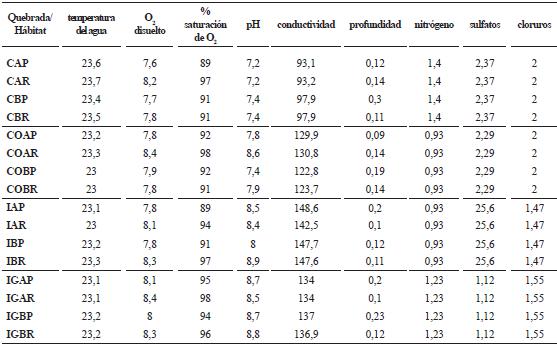
El diagrama conjunto de NMS de los valores de abundancia de los grupos microbianos y su relación con las variables fisicoquímicas (tabla 3), indicó que únicamente cinco explican significativamente la ordenación (figura 3). La abundancia de los grupos microbianos en las quebradas Ilú e Iguapoga se encontró correlacionada principalmente con las variables pH, conductividad y concentración de sulfatos. Estas variables presentaron valores superiores en éstas quebradas en comparación con las quebradas no intervenidas, La Camaronera y Cocal Norte. Por otro lado, para las quebradas La Camaronera y Cocal Norte, la abundancia de microorganismos se correlacionó con una mayor temperatura del agua y mayores concentraciones de cloruros.
Tabla 3. Variables fisicoquímicas para los diferentes hábitats en los tramos y quebradas muestreadas en isla Gorgona, Pacífico Central colombiano
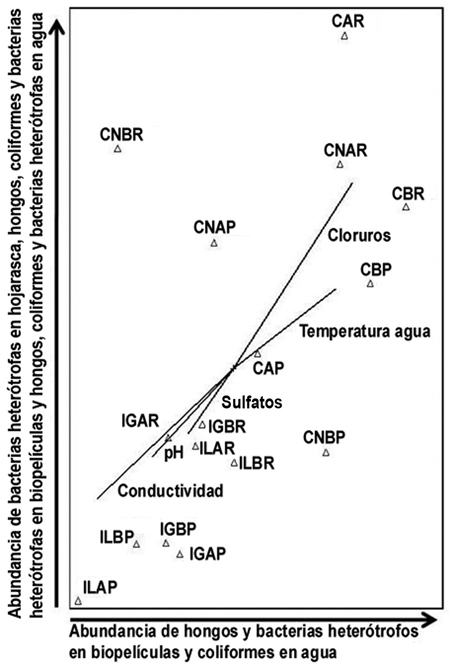
Figura 3. Diagrama conjunto de la ordenación obtenida por el análisis MNS y las variables fisicoquímicas muestreas en isla Gorgona, Pacífico Central colombiano. Para cada eje se indican las variables con mayor correlación. Para el eje 2: Abundancia de bacterias heterótrofas en hojarasca (R =–0,808); abundancia de hongos en biopelícula (R = –0,507); abundancia de bacterias heterótrofas en biopelícula (R = –0, 697); abundancia de coliformes en biopelícula (R= –0,909); abundancia de hongos en agua (R = –0,916); abundancia de bacterias heterótrofas en agua (R= –0,797); abundancia de coliformes en agua (R= –0,899). Para el eje 1: abundancia de hongos en biopelícula (R = –0,636); abundancia de bacterias heterótrofas en biopelícula (R = –0, 639); abundancia de coliformes en agua (R = –0,839). Stress final: 10,23; p <0,01
Las variables fisicoquímicas que presentaron mayor relación con los ejes en la ordenación fueron la temperatura del agua (R = –0,625 para el eje 1 y R = –0,529 en el eje 2, el pH (R = –0,558 y R = –0,556 para el eje 1 y 2 respectivamente), la conductividad (con valores de R de –0,724 en el eje 1 y –0,677 en el eje 2) y la concentración de sulfatos (R = –0,416 y –0,478). La concentración de cloruros presentó una relación positiva con ambos ejes (R = 0,675 y R = 0,811, respectivamente).
De acuerdo con los análisis de procedimientos de permutación de respuestas múltiples (MRPP), se observaron diferencias significativas respecto a la abundancia de microorganismos a nivel de vertiente, separando la vertiente intervenida de la no intervenida (A = 0,283; p < 0,001). Igualmente, se presentaron diferencias significativas a nivel de quebradas con un valor del estadístico A = 0,283; p < 0,05, así como a nivel de microhábitat (A = 0,217; p < 0,05). Por otra parte, para las escalas de tramo y hábitat no se presentaron diferencias estadísticamente significativas.
DISCUSIÓN
Actualmente, muy pocos estudios se han enfocado en el uso de grupos microbianos como indicadores de la influencia de los diversos usos del suelo y los cambios en la composición de los bosques ribereños sobre la calidad de los ecosistemas acuáticos asociados a éstos. Sin embargo, este trabajo sugiere que las poblaciones microbianas pueden ser suficientemente sensibles a los cambios generados como consecuencia de las diferencias en el uso actual o pasado del suelo, por lo que podrían usarse como bioindicadores. La vertiente oriental de la isla es una zona que ha estado sujeta a diferentes grados de intervención. Durante la época en que funcionó la prisión, que se ubicaba en la zona conocida como ''El poblado'', los suelos fueron fuertemente impactados por la intensa deforestación y por su uso con fines agrícolas (Rangel 1990). Actualmente, esta vertiente oriental se considera como una zona intervenida con coberturas vegetales en diferentes etapas de sucesión (Aguirre y Rangel 1993) y donde se concentra la mayor parte de las actividades humanas. Esta área está drenada por las quebradas Ilú e Iguapoga. La vertiente occidental cuenta con bosques maduros y ha sido poco intervenida por lo que puede considerarse una zona prístina, en donde se ubican las quebradas La Camaronera y Cocal Norte. Los resultados muestran que la abundancia de microorganismos es mayor en las quebradas intervenidas, este hecho puede estar influenciado por la calidad de los suelos y las coberturas vegetales. En estudios previos en zonas tropicales, se ha reportado una menor biomasa y actividad microbiana en suelos de bosques ribereños no intervenidos. Esto se ha explicado como un efecto del estado de sucesión de dichos bosques. Los bosques perturbados poseen vegetación joven y en diferentes etapas de crecimiento generando un aporte mayor de materia orgánica y nutrientes disponibles para el desarrollo de las poblaciones microbianas (Groffman 2001).
Las quebradas de la isla se han considerado sanitariamente limpias, debido a las altas concentraciones y saturaciones de oxígeno y bajas concentraciones de CO2 disuelto (Blanco 2009, en este volumen). A pesar de esto y debido a las diferencias encontradas en relación con la abundancia de bacterias coliformes entre las quebradas intervenidas y no intervenidas, este grupo se podría considerar como un indicador microbiano de calidad para las quebradas de la isla Gorgona. Recientemente, DiDonato et al. (2009) registraron un aumento significativo de las poblaciones de bacterias coliformes en ecosistemas acuáticos de áreas costeras, como consecuencia de cambios en el uso del suelo debido a procesos de urbanización. Sin embrago, para determinar el grupo coliformes como indicador en la isla se hace necesario realizar análisis posteriores estableciendo programas de monitoreo en todas las quebradas
Este estudio indicó que la hojarasca es una fuente de materia orgánica que favorece el desarrollo de microorganismos heterótrofos como hongos y bacterias quimiorganotrofas. La colonización de las hojas por hongos y bacterias, puede comenzar antes de que las hojas lleguen a las quebradas (Abelho 2001). El hecho de que los mayores valores de abundancia de los diferentes grupos microbianos se presentaran en éste microhábitat, podría estar indicando que la hojarasca sería la fuente principal de ingreso de los microorganismos a las quebradas. Por otra parte, los bosques ribereños que tienen influencia sobre las quebradas intervenidas fueron fuertemente impactados antes de que la isla fuera declarada Parque Nacional. En los bosques de las quebradas Ilú e Iguapoga es evidente la influencia de la deforestación pasada (Rangel et al. 1990a). En esta zona se encuentran especies introducidas, junto con árboles emergentes de especies pioneras y vegetación de crecimiento secundario (Valencia–G. et al. 2009, en este volumen). Los bosques ribereños en el área de influencia de las quebradas La Camaronera y Cocal Norte, son maduros y bien conservados (UAESPNN 2005). Estudios realizados acerca de la composición de la hojarasca presente en las quebradas de la isla Gorgona (Valencia–G. et al. 2009, en este número) han indicado que en las áreas de influencia de Ilú e Iguapoga, predominan especies introducidas como la Cespedesia macrophila (Ochnaceae), conocida como Pácora. Esta especie se caracteriza por presentar hojas grandes, (alcanzando de 20 a 100 cm de largo y de 20 a 100 cm de ancho) con bordes dentados. Esta morfología en general favorece el depósito y colonización por parte de la microbiota, al igual que la formación de grandes paquetes de hojarasca a lo largo del cauce de las quebradas. La calidad de las hojas de esta especie se considera baja, debido a que es muy dura y permanece como recalcitrante (datos sin publicar). Estas diferencias en la composición de especies de los bosques ribereños, determinadas por el grado de intervención, podrían tener una incidencia sobre la cantidad y la calidad de la hojarasca que ingresa a las quebradas. Como consecuencia de esto, pueden verse alterados los patrones de colonización y distribución de algunas poblaciones microbianas. Considerando los resultados obtenidos aquí, las diferencias en la abundancia de los grupos microbianos en las quebradas de la isla pueden estar reflejando diferencias en relación al grado de intervención. De esta forma, las poblaciones microbianas podrían ser utilizadas como indicadores de intervención y calidad de los ecosistemas acuáticos en la isla Gorgona.
De acuerdo con los resultados de la ordenación existe una separación entre vertiente intervenida, respecto la no intervenida. Este resultado propone que las diferencias en la estructura vegetal de la isla se reflejan en la composición y abundancia de los grupos microbianos en las quebradas.
Varios estudios han demostrado que la abundancia de microorganismos y algunos aspectos funcionales de las quebradas son regulados por aspectos como la calidad de la hojarasca y factores ambientales como la temperatura, el pH y la concentración de nutrientes disueltos (Bergfur et al. 2007). Los resultados indican que el contenido de cloruros es mayor en las quebradas no intervenidas, mientras que la conductividad y el pH presentaron mayores valores en las quebradas intervenidas. Lo anterior sugiere que pueden existir múltiples factores que tienen incidencia sobre la abundancia y distribución de la microbiota en las quebradas de la isla. Sin embargo, las consecuencias del legado de usos del terreno, considerando los procesos de sucesión vegetal es tan evidente, que se espera que este sea el principal factor que está condicionando la abundancia y patrones de distribución de los grupos microbianos y probablemente los parámetros físicoquímicos.
Las quebradas de la isla Gorgona están sujetas a variaciones espaciales y temporales que pueden afectar la distribución y actividad de los microorganismos. Considerando que este es el primer estudio, se propone implementar programas de monitoreo en las quebradas que incluyan indicadores microbianos y físicoquímicos. Esto permitirá establecer patrones de variación de acuerdo con los estados sucesionales que se presentan en cada vertiente.
En conclusión, este trabajo propone que el grado de intervención, debido a la historia de uso del suelo en la isla Gorgona tiene un efecto sobre la abundancia y distribución de algunos grupos microbianos en las quebradas. De esta forma, los grupos microbianos pueden ser utilizados como bioindicadores del grado de intervención de los bosques ribereños, debido a su rápida respuesta a los cambios ambientales.
AGRADECIMIENTOS
Agradecemos al Comité Central de Apoyo a la Investigación (CODI) de la Universidad de Antioquia por la financiación de este estudio. A la Unidad Administrativa Especial del Sistema de Parques Nacionales Naturales por permitirnos realizar esta investigación en la isla Gorgona. A los integrantes del grupo de trabajo del Proyecto Gorgona Island Stream Bio–Assessment (GISbIO). Agradecemos a Juan Felipe Blanco, Magnolia Longo, Ana María Gómez, Edison Parra y Héctor Javier Montaño quienes participaron en el trabajo de campo. Agradecemos también al Laboratorio de Micología por el préstamo de sus instalaciones y equipos para la realización de los experimentos de laboratorio. Finalmente, agradecemos los comentarios de dos evaluadores anónimos que contribuyeron a mejorar el manuscrito.
REFERENCIAS
1. Abelho M. 2001. From litter fall to breakdown stream: a review. The scientific world 1:656–680. [ Links ]
2. Aguirre J, Rangel O. 1993. La isla Gorgona y sus ecosistemas. En: Leyva P, editor. Colombia Pacífico. Tomo I. Bogotá (Colombia): Fondo para la protección del medio ambiente –FEN– Colombia. p. 106–170. [ Links ]
3. APHA (American Public Health Association). 1998. Standard methods for the examination of water and wastewater. New York (United States): Water Pollution Control Federation; American Water Works Association. [ Links ]
4. Bergfur J, Johnson RF, Sandin L, Goedkoop W, Nygren K. 2007. Effects of nutrient enrichment on boreal streams: invertebrates, fungi and leaf–litter breakdown. Freshwater Biology, 52: 1618–1633. [ Links ]
5. Blanco JF. 2009. Características físico–químicas de las quebradas del Parque Nacional Natural Gorgona. Actualidades Biológicas, 31 (91): 123–140. [ Links ]
6. Bonada N, Prat N, Resh VH, Statzner B. 2006. Developments in aquatic insect biomonitoring: A comparative analysis of recent approaches. Annual Review of Entomology, 51: 495–523. [ Links ]
7. Das M, Royer T V, Leff LG. 2007. Diversity of fungi, bacteria and actinomycetes on leaves decomposing in a stream. Applied and Environmental Microbiology, 73: 756–767. [ Links ]
8. Díaz JM, López M, Barrios LM. 2001. Introducción. En: Barrios LM, López M, editores. Gorgona marina: contribución al conocimiento de una isla única. Serie Publicaciones Especiales No. 7. Santa Marta (Colombia): INVEMAR. p. 13–16. [ Links ]
9. DiDonato GT, Stewart JR, Sanger DM, Robinson BJ, Robinson BC, Holland AF, van Dolah RF. 2009. Effects of changing land use on the microbial water quality of tidal creeks. Marine Pollution Bulletin, 58: 97–106. [ Links ]
10. Duarte S, Pascoal C, Cássio F, Barlocher F. 2006. Aquatic hyphomycete diversity and identity affect leaf litter decomposition in microcosm. Oecologia, 147: 658–666. [ Links ]
11. Giller PS, Malmqvist B. 1998. The biology of stream and rivers. New York: Oxford University Press. p. 31–70. [ Links ]
12. Gómez–Aguirre AM. 2009. Variación de la estructura y composición del ensamblaje de macroinvertebrados acuáticos en una jerarquía espacias en los sistemas lóticos del Parque Natural Nacional Gorgona. [Tesis de Pregrado]. [Medellín, (Colombia)]. Instituto de Biología, Universidad de Antioquia. p. 75. [ Links ]
13. Groffman PM, McDowell WH, Myersc JC, Merriam JL. 2001. Soil microbial biomass and activity in tropical riparian forests. Soil Biology and Biochemistry, 33: 1339–1348. [ Links ]
14. Lear G, Lewis GD. 2009. Impact of catchment land use on bacterial communities within stream biofilms. Ecological Indicator, 9: 848–855. [ Links ]
15. McCune B, Mefford MJ. 1999. PC–ORD Multivariate analysis of ecological data. Version 4. MjM Software Design. Gleneden Beach (Oregon). p. xx. [ Links ]
16. Rangel O. 1990. Tipos de Vegetación. En: Aguirre J, Rangel O, editores. Biota y ecosistemas de Gorgona. Bogotá (Colombia): Fondo para la protección del medio ambiente –FEN– Colombia. p. 109–126 [ Links ]
17. Rangel O, Aguirre J, Sánchez R. 1990a. Aspectos estructurales, dinámicos y fisionómicos de la vegetación (una aproximación preliminar). En: Aguirre J, Rangel O, editores. Biota y Ecosistemas de Gorgona. Bogotá (Colombia): Fondo para la protección del medio ambiente –FEN– Colombia. p. 127–141. [ Links ]
18. Romaní AM; Fischer H, Mille–Lindblom C, Tranvik LJ. 2006. Interactions of bacteria and fungi on decomposing litter: differential extracellular enzyme activities. Ecology, 87: 2559–2569. [ Links ]
19. Schoenlein–Crusius IH, Piccolo RA. 2003. The diversity of aquatic hyphomycetes in South America. Brazilian Journal of Microbiology 34:183–193. [ Links ]
20. Solé M, Fetzer I, Wennrich R, Sridhar KR, Harms H, Krauss G. 2008. Aquatic hyphomycete communities as potential bioindicators for assessing anthropogenic stress. Science of The Total Environment, 389: 557–565. [ Links ]
21. Stutter MI, Langan SJ, Demars BO. 2007. River sediments provide a link between catchment pressures and ecological status in a mixed land use Scottish River system. Water Research 41: 2803–2815. [ Links ]
22. UAESPNN–DTSO. 2005. Plan de Manejo Parque Nacional Natural Gorgona. Resumen Ejecutivo. Cali (Colombia): Unidad Administrativa Especial del Sistema de Parques Nacionales Naturales de Colombia Dirección Territorial Suroccidental. SUT 021105. [ Links ]
23. Valencia–G SM, Pérez–Z GA, Lizarazo–M PX, Blanco JF. 2009. Patrones espacio–temporales de la estructura y composición de la hojarasca en las quebradas del Parque Nacional Natural Gorgona. Actualidades Biológicas, 31 (91): 197–211. [ Links ]
24. Wright MS, Covich AP. 2005. Relative importance of bacteria and fungi in a tropical headwater stream: leaf decomposition and invertebrate feeding preference. Microbial Ecology, 49: 536–546. [ Links ]
Recibido: mayo 2009;
Aceptado: noviembre 2009.
Anexo
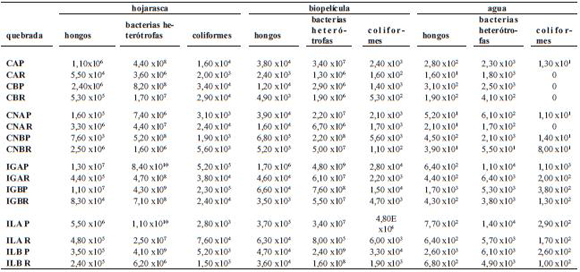
Anexo 1. Recuento en UFC/ml–g de los diferentes grupos microbianos en hojarasca, biopelícula de piedras sumergidas y agua para los diferentes hábitats en los tramos y quebradas muestreadas de la isla Gorgona, Pacífico Central colombiano (CAP: La Camaronera alta pozo; CAR : La Camaronera alta rápido; CBP: La Camaronera baja pozo; CBR: La Camaronera baja rápido; CNAP: Cocal Norte alta pozo; CNAR: Cocal Norte alta rápido; CNBP: Cocal Norte baja pozo; CNBR: Cocal Norte baja rápido; IGAP: Iguapoga alta pozo; IGAR: Iguapoga alta rápido; IGBP: Iguapoga baja pozo; IGBR: Iguapoga baja rápido; ILAP: Ilú alta pozo; ILAR: Ilú alta rápido; ILBP: Ilú baja pozo; IBR: Ilú baja rápido)