Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actualidades Biológicas
versión impresa ISSN 0304-3584
Actu Biol v.32 n.92 Medellín ene./jun. 2010
ARTÍCULOS DE INVESTIGACIÓN
DISTRIBUCIÓN DE ESPECIES Y SU RELACIÓN CON LA VARIACIÓN AMBIENTAL Y ESPACIAL A ESCALA LOCAL EN UN BOSQUE DE TIERRA FIRME EN LA AMAZONIA COLOMBIANA
SPECIES DISTRIBUTIONS AND THEIR RELATIONSHIP TO ENVIRONMENTAL AND SPATIAL VARIATION AT A LOCAL SCALE IN A TERRA FIRME FOREST IN THE COLOMBIAN AMAZONIA
Miguel A. Peña1; Dairon Cárdenas2; Álvaro Duque3
1 Departamento de Ciencias Forestales, Universidad Nacional de Colombia, Sede Medellín. A. A. 1027. Medellín, Colombia. mapenah@unalmed.edu.co.
2 Instituto Amazónico de Investigaciones Científicas (SINCHI). Amazonia, Colombia. dcardenas@sinchi.org.co.
3 Profesor asociado. Departamento de Ciencias Forestales, Universidad Nacional de Colombia, Sede Medellín. A. A. 1027. Medellín, Colombia. ajduque@unalmed.edu.co.
Resumen
El presente estudio analizó la magnitud a la cual la variación ambiental y las variables espaciales influencian la distribución de las especies arbóreas de dosel (DAP ≥ 10 cm), a escala local en un bosque de tierra firme de la Amazonia colombiana. El muestreo se llevó a cabo en una parcela de cinco ha, dividida en 125 cuadrantes de 20 x 20 m, ubicada en el PNN Amacayacu. Se seleccionaron las especies con una frecuencia igual o mayor a diez (10) en los 125 cuadrantes. Para cuantificar el efecto del ambiente y el espacio geográfico, se empleó la regresión logística con base en los datos de presencia ausencia de las especies en cada uno de los cuadrantes.
La distribución de las especies presentó mayor relación con las variables espaciales que con las ambientales, permaneciendo generalmente en promedio el 50,7 ± 23,8% de desviación sin explicar. Las variables ambientales fueron significativas en 33 modelos, presentando capacidad explicativa entre 0,21 y 23,71%. Las variables espaciales fueron incluidas en todos los modelos explicativos de la distribución de las especies, con una importancia relativa de hasta el 97,3%. El presente estudio, resalta la importancia del análisis de las respuestas de especies arbóreas individuales a los cambios ambientales y espaciales, encontrando diferencias en los factores que determinan la distribución de especies dentro de familias e incluso dentro de un mismo género, lo cual tiene gran influencia en la estructuración de la diversidad alpha. Lo que esto demuestra es que la especialización de hábitat y los procesos espacialmente estructurados como la limitación en dispersión, más que ser mecanismos excluyentes, actúan de forma complementaria a diferentes niveles promoviendo la coexistencia de especies. Los resultados obtenidos difieren de estudios anteriores en cuanto que este estudio muestra menor importancia relativa de los factores edáficos sobre la distribución de especies a escala local. En este caso particular, se sugiere que a escala local existe un alto componente aleatorio asociado con la variación no explicada. Sin embargo, no se descarta que esta condición emerja como producto del submuestreo en estos bosques de diversidad muy alta.
Palabras clave: Colombia, conservación, especialización de hábitat, limitación en dispersión, Parque Natural Nacional Amacayacu, regresión logística.
Abstract
In this study, we analyzed the extent to which environmental variation and the spatial template influenced the distribution of individual canopy species (DBH ≥ 10 cm) at a local scale in terra firme forest in the Colombian Amazonia. The survey was carried out in a 5-ha plot, divided into 125 quadrants of 20 m x 20 m, located in the Amacayacu National Park. To run the analyses we selected all species with presence in ten or more quadrants.
In order to quantify the effect of the environment and geographical space, we used a logistic regression model, which was based on species presence-absence data for the selected species. Species distributions showed a higher correlation with the spatial variables than with the environmental ones, with an average of 50.7 ± 23.8% of unexplained variation remaining. Environmental variables were significant in 33 out of 45 models, ranging in relative importance between 0.21 and 23.71%. All explanatory models of species distributions included spatial variables, which reached a relative importance of up to 97.3%. We found differences in the factors determining the distribution of individual species within the same family and even within the same genera, which helped to understand the key factors structuring alpha diversity. In this way, our results support the idea that environmental filtering and spatially structured processes, such us dispersal limitation, are complementary rather than exclusive mechanisms promoting species coexistence. The results obtained in this study showed a relatively lower importance of soils and topography on species distribution, at a local spatial scale, than reported before. In this case study, we found a high random component related to the unexplained variation; however, it was also necessary to emphasize the effect of species undersampling on the unexplained variation, due to the high local diversity recorded in this forest.
Key words: Amacayacu Natural National Park, Colombia, conservation, dispersal limitation, environmental filtering, logistic regression.
INTRODUCCIÓN
Los bosques de tierra firme de la Amazonia noroccidental son conocidos por estar entre los de mayor diversidad arbórea del mundo (Ter Steege et al. 2003, Valencia et al. 1994). Identificar los factores y mecanismos que promueven y mantienen esta muy alta diversidad ha sido motivo de continuo debate en las últimas décadas (véase Wright 2002). Por un lado, quienes apoyan la teoría de nicho, asumen que la heterogeneidad ambiental determina el establecimiento y desarrollo de las especies (Chase y Leibold 2003, Tilman y Pacala 1993). De esta manera, a escala de paisaje o entre hábitats (e. g., plano inundable, tierra firme, etc.), en la cuenca amazónica y en los bosques tropicales en general, parece existir consenso con respecto al efecto de la variación ambiental sobre los patrones de composición florística regional (Clark et al. 1998, Duivenvoorden y Lips 1995, Duque et al. 2001, Tuomisto et al. 2002). Sin embargo, cuando se considera el efecto de la variación de las características del hábitat a escala local sobre los patrones florísticos, dentro de cada unidad de paisaje, los resultados son contrastantes (Condit et al. 2002, Duivenvoorden 1995, Duque et al. 2002, Gentry 1988, Hubbell y Foster 1986, Phillips et al. 2003, Pitman et al. 2008, Tuomisto et al. 1995, 2003, Valencia et al. 2004, Vormisto et al. 2004).
En paisajes continuos como tierra firme en la Amazonia noroccidental, los cuales poseen suelos relativamente bien drenados y donde no ocurren eventos periódicos de disturbio asociados con procesos de inundación, es donde se ha reportado la mayor riqueza de especies (Duivenvoorden 1996, Valencia et al. 1994); sin embargo, los patrones de variación florística han sido sustentados en mecanismos excluyentes promovidos por procesos opuestos. De un lado, hay quienes apoyan la idea de que incluso dentro del paisaje existe alta diversidad beta debido al efecto de la especialización de las especies con respecto a variaciones relacionadas con la topografía y el cambio de textura y fertilidad local en los suelos (Gentry 1988, Tuomisto et al. 1995, 2003). En contraste, otros estudios apoyan la idea de que la diversidad beta en tierra firme es relativamente baja y que las especies son en su mayoría generalistas, siendo definido su patrón de distribución principalmente por la limitación en dispersión (Condit et al. 2002, Duivenvoorden 1995, Duque et al. 2002, Hubbell 2001, Pitman et al. 2001, 2002). A escala local (< 1 km2), dentro de tierra firme, el debate acerca de los factores y mecanismos que determinan la distribución de especies es similar al anterior. Mientras algunos estudios reportan la importancia de la especialización edáfica en diferentes grupos de plantas (Jones et al. 2007, Poulsen et al. 2006), otros en cambio la cuestionan (e. g., Duque et al. 2003, Valencia et al. 2004).
Las tendencias hasta aquí descritas, no obstante, han sido definidas mayormente con base en investigaciones enfocadas en la comunidad vegetal en su totalidad. En los bosques húmedos tropicales, en mucha menor proporción, los estudios se han enfocado en analizar la respuesta a los cambios microambientales de especies arbóreas individuales, lo cual tiene gran importancia dado que los factores que son responsables de los patrones espaciales de una especie podrían no influenciar otras (He et al. 1997). Los resultados encontrados en los análisis de especies arbóreas individuales reportan mayor especialización de hábitat en los estadios juveniles (Comita et al. 2007), coincidiendo además, en que otros factores como la limitación en dispersión y la luz intervienen también de manera importante en la coexistencia y distribución de las especies (Jones et al. 2007, Svenning 1999).
El presente estudio tiene como objetivo central evaluar la relación entre algunos factores ambientales y espaciales con la distribución de especies arbóreas de dosel en cinco (5) hectáreas en un bosque de tierra firme, ubicado en el Parque Nacional Natural Amacayacu en la Amazonia colombiana. Específicamente, se busca cuantificar a escala local el efecto de la variación en hábitat referida a la topografía, fertilidad y estructura de los suelos, así como el de procesos biológicos espacialmente estructurados, como por ejemplo la limitación en dispersión, en la definición de la distribución local de especies individuales en este bosque de tierra firme. De esta manera, se espera contribuir al conocimiento de los mecanismos que promueven la coexistencia de especies, con el fin de optimizar las estrategias de conservación en el Parque Amacayacu y la Amazonia colombiana en general.
MATERIALES Y MÉTODOS
Área de estudio. El área de estudio está localizada en un bosque de tierra firme, ubicado al sur del Parque Nacional Natural Amacayacu (PNNA) en la Amazonia colombiana (03° 49' S y 70° 19' O). Las familias más dominantes en este bosque son en orden respectivo: Lecythidaceae, Myristicaceae, Arecaceae, Moraceae y Mimosaceae (Barreto et al. 2010). Según el sistema de zonas de vida de Holdridge (1979), el sitio de estudio se clasifica como Bosque Húmedo Tropical (Bh-T), presentando temperatura media de 25,8 °C (Rudas y Prieto 2005). La precipitación anual alcanza los 3.200 mm, con promedio mensual de 270 mm, no existiendo ningún mes con menos de 100 mm en promedio; por este motivo, en este bosque con régimen de precipitación no estacional teóricamente no existen meses con déficit hídrico para las plantas. Los suelos pertenecen a la formación Pebas, en la cual predominan texturas que van desde arcillosas, franco-arcillosas hasta franco-limo-arcillosas y en ocasiones francas, presentando elevaciones entre 80 y 200 msnm (Rudas y Prieto 1998).
Metodología. El sitio de estudio cubre un área demarcada de 500 x 100 m (5 ha). La parcela permanente está dividida en unidades básicas de muestreo de 20 x 20 m (400 m2) para un total de 125 cuadrantes. Todos los árboles con diámetro DAP (a 1,30 m de altura) mayor o igual a diez (10) cm fueron marcados, mapeados, medidos y colectados. Posteriormente, los ejemplares botánicos fueron llevados al Herbario Amazónico Colombiano (COAH) para su determinación taxonómica (véase Barreto et al. 2010) y asimismo, los ejemplares botánicos fueron depositados en este mismo herbario (COAH).
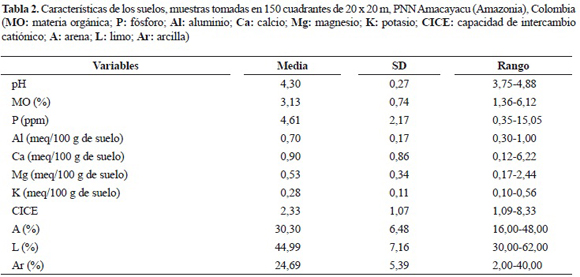
En cada cuadrante se tomó una muestra del horizonte mineral A del suelo, las cuales fueron empacadas en bolsas herméticas, para ser posteriormente analizadas en el Laboratorio de Ecología César Pérez Figueroa de la Universidad Nacional de Colombia, Sede Medellín. A todas las muestras de suelo se les evaluó el contenido extraíble o disponible de pH, porcentaje de materia orgánica (MO), iones intercambiables (Ca, Mg, K, P y Al), capacidad de intercambio catiónico efectiva (CICE = Al + Ca + Mg + K) y en lo referente a la textura del suelo se determinó el porcentaje de arena (A), arcilla (Ar) y limo (L), según los métodos descritos en la tabla 1. Las variables topográficas consideradas fueron: altitud, pendiente y curvatura, definidas de acuerdo con la metodología utilizada por Harms et al. (2001) y por Valencia et al. (2004).
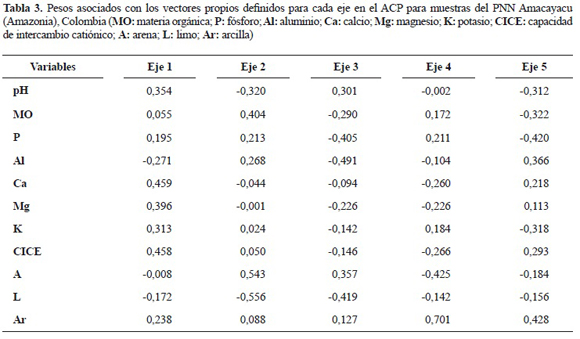
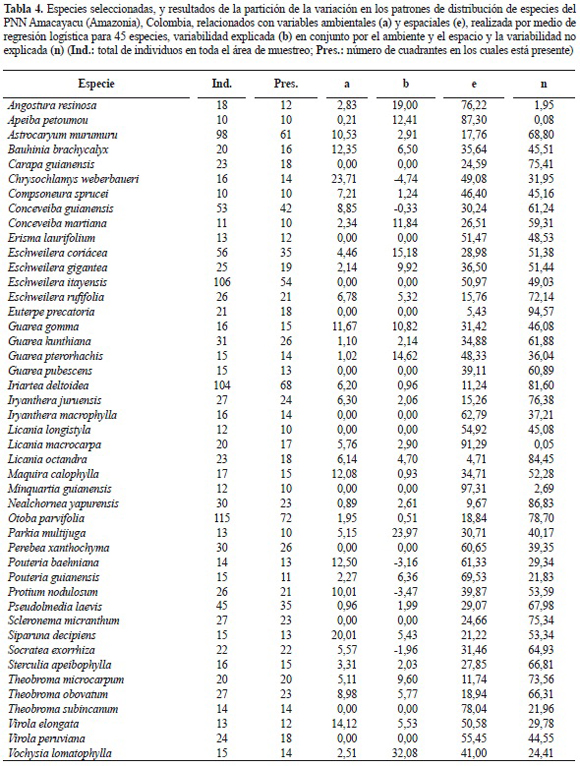
Análisis estadísticos de datos. Para efecto de los análisis, se seleccionaron 45 especies pertenecientes a dieciocho familias botánicas las cuales se presentaron en diez (10) o más cuadrantes de 20 x 20 m, registrando su presencia (1) o ausencia (0) en cada cuadrante. Con el objetivo de reducir la dimensionalidad de los datos cuantitativos de los suelos, se realizó un análisis de componentes principales (ACP) a las variables ambientales sin incluir las variables topográficas (altitud, curvatura y pendiente), seleccionando los ejes que presentaron valores propios mayores a uno (1). Para cuantificar el efecto proveniente por procesos espacialmente estructurados, como por ejemplo la limitación en dispersión, al centro de cada cuadrante se le asignaron dos coordenadas geográficas (x, y), las cuales fueron analizadas usando el método de coordenadas principales de matrices vecinas (PCNM, en inglés); se usó como umbral para generar la matriz truncada una distancia de 20 m, reemplazando todas las distancias mayores por cuatro veces esta distancia, es decir 80 m (Borcard y Legendre 2002).
Para analizar la relación entre la distribución de las especies seleccionadas con la variación ambiental y espacial, se utilizó un modelo tipo logístico, el cual es un caso específico de los modelos lineales generalizados (MLG). Este tipo de MLG son considerados modelos paramétricos debido a que una función de probabilidad binomial es especificada para la variable respuesta (enlace logit) y para los términos del error del modelo. La transformación logit de la probabilidad de presencia [π (x)] produce una función lineal, representada por la siguiente ecuación:
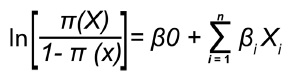
Donde β0 y βi son los parámetros estimados de la regresión y el lado izquierdo de la ecuación es la transformación logística o función de enlace. El ajuste de los modelos se estimó mediante una prueba de razón de verosimilitud. Esta prueba compara el ajuste del modelo completo con el ajuste de un modelo reducido, es decir, únicamente con la constante o β 0 (nivel de significancia del 95%, P = 0,05).
La variable dependiente (variable respuesta) de la regresión es la probabilidad de ocurrencia de cada especie, la cual se estima a partir de la presencia (1) o ausencia (0) de individuos de la especie analizada en cada cuadrante. Las variables explicativas (independientes) del modelo están representadas por el ambiente y el espacio. Las variables no significativas fueron retiradas del modelo mediante el proceso de eliminación por pasos hacia atrás (backward elimination), asumiendo un α < 0,05 para ser introducida en el modelo. Este proceso se llevó a cabo primero, usando solo las variables ambientales (1), y luego, considerando únicamente las variables correspondientes al espacio geográfico (2). Con todas las variables que fueron significativas en los análisis independientes (ambientales y espaciales), se evaluó el modelo final (3).
Posteriormente se realizó una partición de la variación al modelo final, para obtener así el porcentaje de desviación explicado, definido por el estimador de máxima verosimilitud L, por las variables ambientales y espaciales en los análisis individuales y en conjunto (siguiendo a Borcard et al. 1992). La variabilidad explicada por el ambiente y el espacio en conjunto (b) se calculó restando del porcentaje de desviación explicado por el modelo final (3) la suma de la desviación explicada por las variables ambientales (1) y espaciales (2) por separado, b = [L(1) + L(2)] - L(3); la desviación explicada (%) por las variables ambientales es: a = L(1) - b; la desviación explicada (%) por la distancia geográfica sola es: e = L(2) - b; y el porcentaje de desviación no explicado es: n = 100 - L(3). Todos los análisis estadísticos se realizaron con el paquete estadístico Statgraphics Centurion XV.I.
RESULTADOS
Suelos. Los análisis de las propiedades físicas y químicas de los suelos de los 125 cuadrantes mostraron, de acuerdo con los valores de pH y las concentraciones de aluminio, que los suelos en el área de estudio son ácidos. La CICE en la parcela es conformada principalmente por aluminio y calcio. En lo relacionado con la textura, los suelos presentaron una fracción alta de grano fino, con porcentaje del 70% representado por limos y arcillas (tabla 2).
Los primeros cinco ejes del ACP presentaron valores propios mayores a 1, explicando el 81,63% de la variación total de los datos. El eje 1 (el cual explicó el 31,44% de la variación) y el eje 3 (12,7%), de acuerdo con los pesos o coeficientes asociados con los vectores propios (tabla 3), se asociaron con gradientes de fertilidad. El segundo eje (17,39%) se asoció con un gradiente de drenaje. Los ejes 4 (10,58%) y 5 (9,52%) parecen ser una combinación de factores físicos y químicos en los suelos, con alta influencia de la cantidad de arcilla en la determinación del gradiente.
Modelos de distribución de especies individuales. Las 45 especies seleccionadas representan el 58% de todos los individuos de la parcela. Las especies más abundantes fueron: Otoba parvifolia (Myristicaceae) y Eschweilera itayensis (Lecythidaceae) con promedio de 23 y 21 individuos ha-1, respectivamente. Las especies presentes en un mayor número de cuadrantes fueron O. parvifolia (Myristicaceae) e Iriartea deltoidea (Arecaceae) en el 58 y 54% de los cuadrantes, respectivamente (tabla 4).
Las variables ambientales, representadas por los ejes del ACP y las variables topográficas (pendiente, altitud y curvatura), fueron significativas en 33 de los 45 modelos explicativos de distribución de especies, con una importancia relativa promedio de 6,82 ± 5,55%. Las variables espaciales, por su parte, fueron significativas e incluidas en todos los modelos analizados, presentando una capacidad explicativa promedio de 39,77 ± 23,15%. Doce (12) especies incluyeron en su modelo final únicamente variables relacionadas con el espacio geográfico (tabla 4). Cinco especies: Conceveiba weberbaueri, C. guianensis (Euphorbaiceae), Pouteria baehniana (Sapotaceae), Protium nodulosum (Burseraceae) y Socratea exorrhiza (Arecaceae) presentaron valor b negativo, lo cual indica que los grupos de variables explican mejor la distribución de las especies por separado que en conjunto (Legendre y Legendre 1998). La variabilidad en la distribución de las especies quedó en promedio con el 50,7 ± 23,8% de porcentaje sin explicar. Todos los modelos ajustaron con un nivel de significancia mayor al 95% (p < 0,05).
DISCUSIÓN
La distribución de las especies analizadas estuvo en su mayor parte determinada por la configuración espacial de la localización de las especies dentro de la parcela, lo cual nos permite concluir que procesos biológicos, como por ejemplo la limitación en dispersión, son el principal mecanismo controlando la distribución de especies arbóreas de dosel a escala local en estos bosques de tierra firme (Duivenvoorden y Duque 2010, Duque et al. 2003, Ruokolainen et al. 2007, Svenning 2001, Valencia et al. 2004). Según los resultados obtenidos, la variación edáfica y topográfica fue responsable en menor proporción de la distribución de las especies arbóreas en el área de estudio. De esta manera, nuestros resultados difieren con respecto a la importancia que tuvo la especialización de hábitat de las especies vegetales a escala local en otros estudios en bosques neotropicales (John et al. 2007, Kraft et al. 2008, Poulsen et al. 2006).
Dos posibles escenarios cuestionan o justifican los resultados obtenidos con respecto a la poca importancia de la variabilidad ambiental como determinante de la distribución de las especies arbóreas a escala local en estos bosques de tierras bajas. En el primer caso, dado que aquí solo se consideró la variación con respecto a la geomorfología y los suelos, es posible que esto no sea suficiente para detectar la respuesta sistemática de las especies a lo largo de ejes de variación ortogonal tales como la estrategia de adquisición de recursos, la regeneración del nicho y las historias de vida de las especies (Kraft et al. 2008). Esto en parte explicaría además el alto porcentaje de variación no explicada en un buen número de los modelos de distribución de especies. En segundo lugar, podría también ocurrir que debido a la no inclusión de los elementos del sotobosque, los cuales han mostrado mayor respuesta a la variación geomorfológica y edáfica (Comita et al. 2007, Duque et al. 2002, Ruokolainen y Vormisto 2000), se esté sesgando el patrón de respuesta general por especie. De esta manera, hasta tanto se compruebe el posible efecto determinístico de la variación del nicho asumido como un hiperespacio más complejo en este tipo de bosque, los resultados obtenidos muestran mayor efecto de procesos aleatorios y espacialmente estructurados, como los responsables de los arreglos de especies en este tipo de bosques (Valencia et al. 2004).
El presente estudio, resalta la importancia del análisis de las respuestas de especies arbóreas individuales a los cambios ambientales y/o espaciales, encontrando diferencias en los factores que determinan los patrones de distribución de especies dentro de familias e inclusive dentro de un mismo género, lo cual tiene gran influencia en la estructuración de la diversidad alpha (Wright 2002). Aunque hubo casos como el de los Eschweilera (Lecythidaceae) que en todas las especies predominó el factor espacial como determinante de su distribución, en otros géneros como Licania (Chrysobalanaceae) los resultados fueron contrastantes; por ejemplo, la especie Licania octandra tuvo predomino de los factores ambientales como determinantes de su distribución, mientras que Licania longistyla mostró un patrón totalmente estructurado por el componente espacial (tabla 4). Lo que esto propone es que la especialización de hábitat y los procesos espacialmente estructurados como la limitación en dispersión, más que ser mecanismos excluyentes, actúan de forma complementaria a diferentes niveles promoviendo la coexistencia de especies (Chust et al. 2006, Duque et al. 2002, Vormisto et al. 2004). Esta condición o relevancia de uno u otro mecanismo, sin embargo, depende fuertemente de la escala espacial de análisis (Duque 2004).
En síntesis, el presente estudio sugiere que existe un alto componente aleatorio asociado con la variabilidad no explicada del patrón de distribución de las especies, el cual debido a la alta diversidad de estos bosques podría en gran porcentaje atribuirse al submuestreo; por esta razón, se requieren validaciones con base en tamaños de muestra más grandes. De igual forma, la inclusión del componente del sotobosque, podría conducir a resultados más integrales en estos bosques con tan alta diversidad (Agudelo et al. en preparación). No obstante, los resultados actuales apoyan la idea de que el tamaño de las áreas de reserva (Duque et al. 2009) es un elemento fundamental para evitar la extinción local de las especies por procesos aleatorios asociados puramente con la deriva ecológica (Hubbell 2001), y poder así preservar al máximo posible la diversidad y los procesos que la mantienen en estos bosques de tierra firme en la Amazonia colombiana.
AGRADECIMIENTOS
Los autores del presente estudio extendemos nuestro especial agradecimiento a la Dirección de Parques Nacionales Naturales de Colombia, y muy especialmente a todos los miembros del PNN Amacayacu. A los colaboradores de campo y en general a la comunidad de Palmeras. A todos los miembros del Herbario Amazónico Colombiano (COAH) y a aquellos especialistas que colaboraron con la determinación del material botánico. Al profesor Álvaro Lema por su valiosa colaboración y a todas las personas que de una u otra forma colaboraron con el desarrollo de esta investigación. Los autores de este estudio agradecen y valoran enormemente la revisión hecha por los dos evaluadores, quienes con sus valiosos comentarios y aportes, hicieron que la calidad del texto mejorara ostensiblemente. El presente trabajo fue posible gracias a la financiación recibida de COLCIENCIAS (CT 1118-333-18676) y el Center for Tropical Forest Science (CTFS; subcontrato # 08-440-0000137735).
REFERENCIAS
1. Barreto J, Duque A, Cárdenas D, Moreno F. 2010. Variación florística de especies arbóreas a escala local en un bosque de tierra firme en la Amazonia colombiana. Acta Amazónica, 40 (1): 179-188. [ Links ]
2. Borcard D, Legendre P, Drapeau P. 1992. Partialling out the spatial component of ecological variation. Ecology, 73 (3): 1045-1055. [ Links ]
3. Borcard D, Legendre P. 2002. All-scale spatial analysis of ecological data by means of principal coodinates of neighbour matrices. Ecological Modelling, 153 (1): 51-68. [ Links ]
4. Chase J, Leibold M. 2003. Ecological niches: Linking classical and contemporary approaches. Chicago: University of Chicago Press. p. 216. [ Links ]
5. Chust G, Chave J, Condit R, Aguilar S, Lao S, Perez R. 2006. Determinants and spatial modeling of tree β-diversity in a tropical forest landscape in Panama. Journal of Vegetation Science, 17 (1): 83-92. [ Links ]
6. Clark D, Clark D, Read J. 1998. Edaphic variation and the mesoscale distribution of tree species in a neotropical rain forest. Journal of Ecology, 82 (1): 101-112. [ Links ]
7. Comita L, Condit R, Hubbell SP. 2007. Developmental changes in habitat associations of tropical trees. Journal of Ecology, 95 (3): 482-492. [ Links ]
8. Condit R, Pitman N, Leigh E, Chave J, Terborgh J, Foster RB, Nuñez P, Aguilar S, Valencia R, Villa G, Muller-Laundau H, Losos E, Hubbell SP. 2002. Beta-diversity in tropical forest trees. Science, 295 (5556): 666-668. [ Links ]
9. Duivenvoorden JF. 1995. Tree species composition and rain forest-environment relationships in the middle Caquetá area, Colombia, NW Amazonia. Vegetation, 120 (1): 91-113. [ Links ]
10. Duivenvoorden JF, Lips JM. 1995. A land-ecological study of soils, vegetation, and plant diversity in Colombian Amazonia. Tropenbos series 12. Holanda: Fundación Tropenbos, Wageningen. p. 438. [ Links ]
11. Duivenvoorden JF. 1996. Patterns of tree species richness in rain forest of middle Caqueta area, Colombia, NW Amazonia. Biotropica, 28 (2): 142-158. [ Links ]
12. Duivenvoorden JF, Duque A. 2010. Composition and diversity of northwestern Amazonian rainforest in a geological context. En: Hoorn C, Wesselingh F (editores). Amazonia: Landscape and species evolution a look into the past. Oxford: Blackwell Publishing. p. 360-372. [ Links ]
12. Duque A, Sánchez M, Cavelier J, Duivenvoorden JF, Miraña P, Miraña J, Matapi A. 2001. Relación bosque-ambiente en el medio Caquetá, Amazonia colombiana. En: Duivenvoorden JF, Baslev H, Cavelier J, Grandez C, Tuomisto H, Valencia R (editores). Evaluación de recursos vegetales no maderables en la Amazonia noroccidental. Amsterdam: IBED, Universiteit van Amsterdam. p. 99-130. [ Links ]
14. Duque A, Sanchez M, Cavelier J, Duivenvoorden JF. 2002. Different floristic patterns of woody understory and canopy plants in Colombian Amazonia. Journal of Tropical Ecology, 18 (4): 499-525. [ Links ]
15. Duque A, Cavelier J, Posada A. 2003. Strategies of tree occupation at a local scale in terra firme Forests in the Colombian Amazon. Biotropica, 35 (1): 20-27. [ Links ]
16. Duque A. 2004. Plant diversity scales by growth forms along spatial and environmental gradients a study in the rain forest of NW Amazonia [Tesis de doctorado]. [Amsterdam (The Netherlands)]: University of Amsterdam. [ Links ]
17. Duque A, Phillips J, Hildebrand P, Posada C, Prieto A, Rudas A, Suescún M, Stevenson P. 2009. Distance decay of tree species similarity in protected areas on terra firme forest in Colombian Amazonia. Biotropica, 41 (5): 599-607. [ Links ]
18. Gentry AH. 1988. Changes in plant community diversity and floristic composition on environmental and geographic gradients. Annals of the Missouri Botanical Garden, 75 (1): 1-34. [ Links ]
19. Harms KE, Condit R, Hubbell SP, Foster RH. 2001. Habitat associations of trees and shrubs in a 50-ha neotropical forest plot. Journal of Ecology, 89 (6): 947-959. [ Links ]
20. He F, Legendre P, James VL. 1997. Distribution patterns of tree species in a Malaysian tropical rain forest. Journal of Vegetation Science, 8 (1): 105-114. [ Links ]
21. Holdridge LR. 1979. Ecología basada en zonas de vida. San José (Costa Rica): Editorial IICA. p. 206. [ Links ]
22. Hubbell SP. 2001. The unified neutral theory of biodiversity and biogeography. Monographs in population biology 32. Princeton (USA): Princeton University Press. p. 375. [ Links ]
23. Hubbell SP, Foster R. 1986. Biology, chance, and history and the structure of tropical rain forest tree communities. En: Diamond J, Case T (editors). Community ecology. Nueva York: Harper & Row. p. 314-329. [ Links ]
24. John R, Dalling JW, Harms KE, Yavitt JB, Stallard RF, Mirabello M, Hubbell SP, Valencia R, Navarrete H, Vallejo M, Foster RB. 2007. Soil nutrients influence spatial distributions of tropical tree species. Proceedings of the National Academy of Sciences (USA), 104 (3): 864-869. [ Links ]
25. Jones MM, Olivas P, Tuomisto H. 2007. Environmental and neighbourhood effects on tree fern distributions in a neotropical lowland rain forest. Journal of Vegetation Science, 18 (1): 13-24. [ Links ]
26. Kraft NJB, Valencia R, Ackerly DD. 2008. Functional traits and niche-based tree community assembly in an Amazonian forest. Science, 322 (5901): 580-582. [ Links ]
27. Legendre P, Legendre L. 1998. Numerical ecology. Amsterdam: Elsevier Science. p. 870. [ Links ]
28. Phillips O, Nuñez P, Monteagudo A, Peña A, Chuspe M, Galiano W, Yli-Halla M, Rose S. 2003. Habitat association among Amazonian tree species: a landscape-scale approach. Journal of Ecology, 91 (5): 757-775. [ Links ]
29. Pitman N, Terborgh JW, Silman MS, Núñez P, Neill DA, Cerón CE, Palacios WA, Aulestia M. 2001. Dominance and distribution of tree species in upper Amazonian terra firme forests. Ecology, 82 (8): 2101-2117. [ Links ]
30. Pitman N, Terborgh JW, Silman MS, Núñez P, Neill DA, Cerón CE, Palacios WA, Aulestia M. 2002. A comparison of tree species diversity in two upper Amazonain forests. Ecology, 83 (11): 3210-3224. [ Links ]
31. Pitman N, Mogollón H, Dávila N, Ríos M, García R, Guevara J, Baker T, Monteagudo A, Phillips O, Vásquez R, Ahuite M, Aulestia M, Cárdenas D, Cerón C, Loizeau P, Neill D, Núñez P, Palacios W, Spichiger R, Valderrama E. 2008. Tree community changes across 700 km of lowland Amazonian forest from the andean foothills to Brazil. Biotropica, 40 (5): 525-535. [ Links ]
32. Poulsen A, Tuomisto H, Balslev H. 2006. Edaphic and floristic variation within a 1-ha plot of lowland Amazonian rain forest. Biotropica, 38 (4): 468-478. [ Links ]
33. Rudas A, Prieto A. 1998. Análisis florístico del Parque Nacional Natural Amacayacu e isla de Mocagua, Amazonas (Colombia). Caldasia, 20 (2): 142-172. [ Links ]
34. Rudas A, Prieto A. 2005. Florula del Parque Nacional Natural Amacayacu, Amazonas, Colombia. Saint Louis, Missouri: Missouri Botanical Garden Press. p. 680. [ Links ]
35. Ruokolainen K, Vormisto J. 2000. The most widespread Amazonian palms tend to be tall and generalists. Basic and Applied Ecology, 1 (2): 97-108. [ Links ]
36. Ruokolainen K, Tuomisto H, Macía M, Higgins M, Yli-Halla M. 2007. Are floristic and edaphic patterns in Amazonian rain forests congruent for trees, pteridophytes and Melastomataceae. Journal of Tropical Ecology, 23 (1): 13-25. [ Links ]
37. Svenning JC. 1999. Microhabitat specialization in a species-rich palm community in Amazonian Ecuador. Journal of Ecology, 87 (1): 55-56. [ Links ]
38. Svenning JC. 2001. Environmental heterogeneity, recruitment limitation and the mesoscale distribution of palms in a tropical montane rain forest (Maquipucuna, Ecuador). Journal of Tropical Ecology, 17 (1): 97-113. [ Links ]
39. Ter Steege H, Pitman N, Sabatier D, Castellanos D, van der Hout P, Daly D, Silveira M, Phillips O, Vasquez R, Van Andel T, Duivenvoorden JF, Adalardo A, Ek R, Lilwah R, Thomas R, Van Essen J, Baider C, Maas P, Mori S, Terborgh J, Núñez P, Mogollón H, Morawetz W. 2003. A spatial model of tree α diversity and tree density for the Amazon. Biodiversity and Conservation, 12 (11): 2255-2277. [ Links ]
40. Tilman D, Pacala S. 1993. The maintenance of species diversity in plant communities. En: Ricklefs R, Schluter D (editores). Species diversity in ecological communities. Chicago: University of Chicago Press. p. 13-25. [ Links ]
41. Tuomisto H, Ruokolainen K, Kalliola R, Linna A, Danjoy W, Rodriguez Z. 1995. Dissecting Amazonian biodiversity. Science, 269 (5220): 63-66. [ Links ]
42. Tuomisto H, Ruokolainen K, Poulsen A, Moran R, Quintana C, Cañas G, Celi J. 2002. Distribution and diversity of pteridophytes and melastomatacesae along edaphic gradients in Yasuni national park, Ecuadorian Amazonia. Biotropica, 34 (4): 516-533. [ Links ]
43. Tuomisto H, Ruokolainen K, Yli-Halla M. 2003. Dispersal, environment, and flristic variation of western amazonian forests. Science, 299 (5604): 241-244. [ Links ]
44. Valencia R, Balslev H, Paz y Mino G. 1994. High tree alpha-diversity in Amazonian Ecuador. Biodiversity and Conservation, 3 (1): 21-28. [ Links ]
45. Valencia R, Foster RB, Villa G, Condit R, Svenning JE, Hernández C, Romoleroux K, Losos E, Magard E, Balslev H. 2004. Tree species distributions and local habitat variation in the Amazon: large forest plot in eastern Ecuador. Journal of Ecology, 92 (2): 214-229. [ Links ]
46. Vormisto J, Svenning J, Hall P, Balslev H. 2004. Diversity and dominance in palm (Arecaceae) communities in terra firme forest in the western Amazon basin. Journal of Ecology, 92 (4): 577-588. [ Links ]
47. Wright J. 2002. Plant diversity in tropical forest: a review of mechanisms of species coexistence. Oecologia, 130 (1): 1-14. [ Links ]
Recibido: marzo 2010;
aceptado: junio 2010.