Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.32 no.92 Medellín Jan./June 2010
ARTÍCULOS DE INVESTIGACIÓN
BIOLOGÍA REPRODUCTIVA DEL COCOBOLO (ANDINOACARA PULCHER MUSILOVÁ ET AL. 2009) (PISCES: CICHLIDAE) EN LA CIÉNAGA GRANDE DE LORICA (CÓRDOBA), COLOMBIA
REPRODUCTIVE BIOLOGY OF COCOBOLO (ANDINOACARA PULCHER MUSILOVÁ ET AL. 2009) (PISCES: CICHLIDAE) IN THE CIÉNAGA GRANDE DE LORICA (CÓRDOBA), COLOMBIA
Charles W. Olaya-Nieto1;Ana L. Bautista-Blanco2; Marcela Pérez-Pisciotti2
1 Laboratorio de Investigación Biológico Pesquera (LIBP). Departamento de Ciencias Acuícolas, Universidad de Córdoba. Cra. 23, # 2A-20, 2.º piso. Lorica (Córdoba), Colombia. charles_olaya@hotmail.com.
2 Laboratorio de Investigación Biológico Pesquera (LIBP). Departamento de Ciencias Acuícolas, Universidad de Córdoba. Cra. 23, # 2A-20, 2.º piso. Lorica (Córdoba), Colombia.
Resumen
Se estudió la biología reproductiva del Cocobolo (Andinoacara pulcher Musilová et al. 2009) en la Ciénaga Grande de Lorica, cuenca del río Sinú (Córdoba), Colombia. Se analizaron individuos colectados entre enero y diciembre 2005, con tallas entre 7,2-14,5 cm de longitud total (LT) y peso total (WT) entre 9,1-89,1 g. Las gónadas se conservaron en solución Gilson, se utilizó la escala de Vazzoler y se estimó proporción sexual, índices de madurez sexual, época de desove, talla media de madurez sexual, diámetro de ovocitos y fecundidad. Se estudiaron 169 hembras, 125 machos y 4 indiferenciados, con proporción sexual hembra: macho de 1,4:1, diferente a lo esperado. La talla media de madurez fue estimada en 9,5 cm LT para sexos combinados, el diámetro de los ovocitos osciló entre 1.352 y 1.605 m y la fecundidad fue estimada en 954 ovocitos, con ecuación de mejor ajuste F = 0,185 LT3,67, n = 14, r = 0,70. El Cocobolo es un pez con desoves parciales, con época o periodo de reproducción prolongada que se extiende durante el año, con ovocitos pequeños y fecundidad media.
Palabras clave: Andinoacara pulcher, Cocobolo, Colombia, cuenca del río Sinú, reproducción.
Abstract
The reproductive biology of Cocobolo (Andinoacara pulcher Musilová et al. 2009) in the Ciénaga Grande de Lorica, Sinú river basin (Córdoba) Colombia, was evaluated. Individuals collected between January and December 2005 were analized, with total length (TL) ranging between 7.2-14.5 cm and total weight (WT) between 9.1-89.1 g. The gonads were placed in Gilson solution, the Vazzoler scale was applied and sexual proportions, a sexual maturity index, spawning season, the length at first maturity, ovocite diameter, and fecundity were estimated. 169 females, 125 males, and 4 undifferentiated individuals were studied, with sexual proportions of 1.4:1 female: male documented, differing from expected. The length at first maturity was estimated at 9.5 cm TL for both sexes; ovocite diameter ranged between 1.352 and 1.605 m and fecundity was estimated in 954 ovocites, with a best-fit equation F = 0.185 LT3,67, n = 14, r = 0.70. The Cocobolo is a fish with partial spawning, with a prolonged spawning season that extends throughout the year, with small oocytes and medium fecundity.
Key words: Andinoacara pulcher, Cocobolo, Colombia, Sinú river basin, reproduction
INTRODUCCIÓN
El Cocobolo (Andinoacara pulcher Musilová et al. 2009) es un pez que se encuentra ampliamente distribuido en Centro y Suramérica (Colombia y Venezuela) y Trinidad y Tobago (Kullander 2003).
Es común en todas las partes bajas de los sistemas del Magdalena y del Sinú, en donde se considera comestible (Dahl 1971), y es una de las especies de la familia Cichlidae que ocurre en la Ciénaga Grande de Lorica (Colombia). Presenta cuerpo ovalado, boca protráctil; coloración verde oliva, con ocho bandas transversales oscuras en el cuerpo; numerosas líneas verde-azulosas brillantes sobre la mejilla; parte media del cuerpo, dorsal y anal con manchas oscuras (Galvis et al. 1997). Presenta fertilización externa (Stawikowski y Werner 1998) y cuidado parental (Galvis et al. 1997, Ramírez-Gil y Ajiaco-Martínez 2001) y los machos son más coloridos y más grandes que las hembras, acentuando su coloración azul en la época de reproducción (Olaya-Nieto et al. 2008). Habita en aguas turbias, así como en los arroyos de aguas libres y limpias (Kenny 1995, Maldonado-Ocampo et al. 2005) y en ambientes lénticos (Ramírez-Gil y Ajiaco-Martínez 2001). Se alimenta de gusanos, crustáceos e insectos (Mills y Vevers 1989), insectos y presas vivas (Galvis et al. 1997), material vegetal, restos de peces, detritos, insectos y otros (Díaz y Camargo 2008). Tiene gran importancia en la cadena trófica de la Ciénaga Grande de Lorica, al ser uno de los peces más consumidos por los grandes predadores como Doncella Ageneiosus pardalis (Tobías-Arias et al. 2006), Moncholo Hoplias malabaricus (Banquett-Cano et al. 2005) y Mayupa Sternopygus macrurus (Soto y Barrera 2007); además de su importancia en la acuarística, debido a lo sencillo de su manejo en cautiverio, a su coloración llamativa y sus hábitos alimenticios.
El objetivo de este trabajo fue estudiar su biología reproductiva en la Ciénaga Grande de Lorica, cuenca del río Sinú, Colombia, como contribución al ordenamiento de su pesquería y al establecimiento de una base de datos para su proyección y producción en cultivos controlados.
MATERIALES Y MÉTODOS
Área de estudio. El estudio se realizó en la Ciénaga Grande de Lorica (Córdoba), Colombia, cuerpo de agua ubicado en la margen derecha de la cuenca del río Sinú, aguas abajo de la represa de Urrá, a los 9° N y 75° 40' O, en la zona de vida de bosque húmedo tropical, con un área estimada en 44.000 ha y profundidad máxima de 5 m en épocas de lluvia y que se conecta con el río Sinú por los caños Bugre y Aguas Prietas (González et al. 1991). Presenta temperatura promediO anual de 28 °C, que disminuye a 27 °C en épocas de lluvias, cuando las aguas inundan los planos cenagosos (Bustamante 2000). La pluviosidad alcanza valores medios anuales de 1.200 mm/año, con un régimen bimodal de precipitaciones, con periodos lluviosos en abril-junio y agosto-octubre, y el principal periodo seco se prolonga de noviembre a marzo, con otro de menor proporción en julio-agosto (IDEAM 1998).
Metodología. Para la identificación taxonómica de la especie se siguieron las claves de Kullander (2003), colectándose 298 individuos entre enero y diciembre 2005, a quienes se les tomó longitud total (LT) y longitud estándar (LS) al milímetro más cercano con un ictiómetro graduado en mm, y el peso total (WT) al gramo más cercano con una balanza eléctrica Ohaus con capacidad de 1.500 g (± 0,01 g). Todos los peces fueron eviscerados y las gónadas se separaron del resto de órganos, registrándose fecha, sitio de captura, arte de pesca utilizado, peso eviscerado, sexo, peso de las gónadas, número de la muestra y estado de madurez sexual de acuerdo con la escala de Vazzoler (1971).
La proporción sexual total se calculó con la ecuación de Wenner (1972): % machos = 100 * (Nm/Nt), en donde Nm es el número de machos y Nt el número total de individuos, y la proporción sexual a la talla con la técnica de Holden y Raitt (1975), utilizando intervalos de clase de 0,5 cm. El índice gonadosomático (IGS1) y el índice gonadosomático corregido (IGS2) se estimaron con las ecuaciones de Vazzoler et al. (1989) y Tresierra y Culquichicón (1995): IGS1 = 100 * (WG/WT), en donde WG es el peso de las gónadas y WT es el peso total del pez; IGS2 = 100 * (WG/WE), en donde WE es el peso eviscerado del pez. También se obtuvo el índice gonadal (IG) Vazzoler (1996): IG = 104 *WG/LTb, en donde LT es la talla total del pez y b es el coeficiente de crecimiento de la regresión longitud-peso. El factor 104 se utilizó para efectos de cálculos y comparación con IGS1 e IGS2.
La talla de madurez sexual se estimó utilizando la metodología propuesta por Sparre y Venema (1995). Con un ocular micrométrico se midió el diámetro de 1.221 ovocitos procedentes de diferentes muestras de todos los meses del año, seleccionadas al azar, a quienes se les estableció su distribución de frecuencia de diámetro para observar y seleccionar la correspondiente a los de mayor diámetro, es decir, a los ovocitos maduros lo cual está asociado con los estados de madurez sexual.
Se tomaron tres submuestras de cada una de las gónadas (0,15-0,25 g) para estimar la fecundidad promedio por desove o número de ovocitos por desove (F), aplicando el método gravimétrico (Laevastu 1980, Tresierra y Culquichicón 1993) con la siguiente ecuación: F = nG/g, en donde n es el número de ovocitos maduros en la muestra, G es el peso de todos los ovocitos y g es el peso de la muestra. También se estimaron las ecuaciones de fecundidad, longitud total-fecundidad, peso total-fecundidad y peso de gónadas-fecundidad, y la fecundidad relativa con respecto a la talla, peso del pez y peso de las gónadas.
Análisis estadístico. Se utilizó estadística descriptiva y las variables fueron expresadas como promedio ± desviación estándar. Para comprobar si la proporción sexual estimada se ajustaba a la esperada, se aplicó el test estadístico Chi-cuadrado (Zar 1996). Se aplicó el análisis de varianza de una vía para evaluar los cambios de los promedios de los índices estimados para las hembras y machos en cada estado de madurez durante el ciclo reproductivo. Cuando se encontraron diferencias estadísticas significativas (p < 0,05) se aplicó el test de comparaciones múltiples de Tukey-Kramer.
RESULTADOS
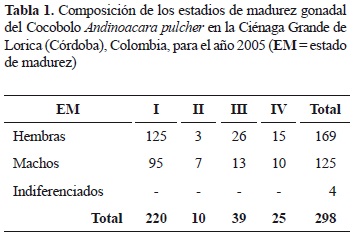
Se analizaron 298 individuos, con tallas y pesos entre 7,2-14,5 cm LT y 9,1-89,1 g de peso total, de los cuales 169 fueron hembras, 125 machos y 4 indiferenciados. La proporción sexual total hembra: macho observada fue 1,4:1. La proporción sexual hembra: macho a la talla fue similar a lo esperado en casi todos los intervalos, excepto uno (10,5-11,5 cm LT).
La talla mínima fue registrada en marzo y la máxima en octubre y diciembre; el menor peso fue registrado en marzo y el mayor en diciembre. La distribución de frecuencias de tallas presenta una curva con intervalos de clase entre 7,0 y 15,0 cm LT y talla media de captura de 10,7 cm LT. En la tabla 1 se observa la composición anual de los estadios de madurez gonadal.
La proporción sexual total hembra: macho fue diferente a lo esperado, 1:1 (X2: 6,585; p: 0,05; 1 gl). Al analizarla mensualmente solo se encontraron diferencias significativas en abril (5,5: 1), mayo (13,5: 1), junio (4,3: 1) y septiembre (3,3: 1); mientras que la proporción sexual hembra: macho a la talla fue similar a lo esperado en casi todos los intervalos, excepto uno (10,5-11,5 cm LT).
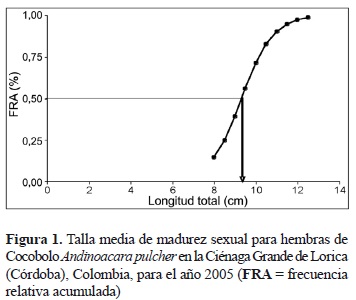
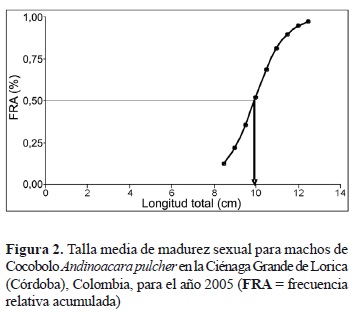
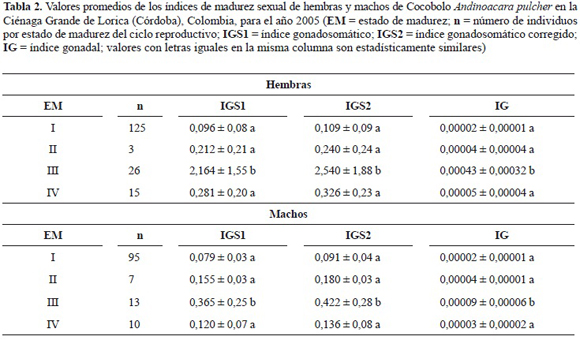
Se analizaron 29 hembras y 20 machos en estado de madurez II y III. La talla de inicio de madurez sexual (TIM) encontrada, o el individuo de menor tamaño, fue de 7,9 y 8,5 cm LT para hembras y machos, respectivamente. La talla media de madurez sexual (TMM) fue estimada en 9,2, 9,7 y 9,5 cm LT para hembras (figura 1), machos (figura 2) y sexos combinados, respectivamente.
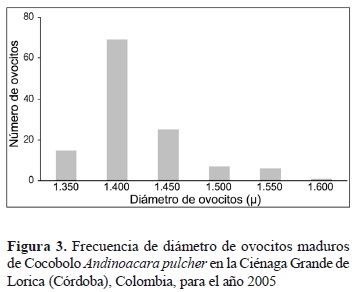
Los ovocitos son grandes y ovalados, similares a los de la Mojarra amarilla (Caquetaia kraussii) y a los de otras especies o géneros de la familia Cichlidae (Olaya-Nieto et al. 2004). Su diámetro osciló entre 213 y 1.605 μ, incluyendo maduros e inmaduros, mientras que el diámetro de los maduros osciló entre 1.352 y 1.605 μ, con promedio de 1.419 (± 50) μ y moda de 1.400 μ (figura 3).
La colecta de ejemplares hembras maduras (en estado de madurez III) se dio en casi todos los meses del año, excepto marzo, septiembre y diciembre, con mayor número en mayo y julio con 8 y 5 individuos, respectivamente; resaltando que en mayo también se encontraron los valores más altos en cuanto a estos índices de madurez sexual se refiere. Para machos solo se observaron individuos maduros en seis meses del año (enero, junio, julio, agosto, septiembre y octubre), con mayor número en enero con seis individuos y cuando se encontraron los valores más altos.
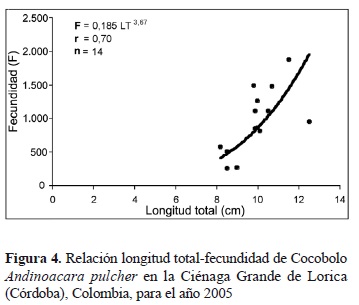
Se analizaron catorce muestras de hembras en estado III, cuyas tallas, pesos totales y pesos de gónadas oscilaron entre 8,2-12,5 cm LT, 12,6-39,7 g y 0,11-1,53 g, respectivamente, con promedios de 9,9 (± 1,2) cm LT, 23,8 (± 7,2) g y 0,604 (± 0,417) g, respectivamente. La fecundidad promedio por desove fue estimada en 954 ± 473 ovocitos, considerada como fecundidad media (100-1.000 ovocitos/año) de acuerdo con Musick (1999). Las ecuaciones de fecundidad fueron: F = 0,185 LT3,67, r = 0,70, n = 14 (figura 4); F = 16,072 WT1,26, r = 0,60, n = 14; F = 1.119,361 WG0,49, r = 0,63, n = 14; con coeficientes de correlación altos y estadísticamente significativos al 95% de confianza. Las fecundidades relativas promedio fueron 94 ± 41 ovocitos/cm LT, 40 ± 16 ovocitos/g de peso total y 2.093 ± 1.277 ovocitos/g de gónada.
DISCUSIÓN
Aunque la mayor parte de la muestra estuvo conformada por individuos inmaduros, tanto para hembras (n = 125, 74,0%) como para machos (n = 95, 76,0%), como era de esperarse, los índices de madurez sexual alcanzaron sus valores más altos en el estado III, encontrándose diferencias estadísticas significativas (p < 0,05) entre este estado con los otros tres en el índice gonadosomático 1 (IGS1), el índice gonadosomático 2 (IGS2) y el índice gonadal (IG), tanto para hembras como machos (tabla 2).
La talla mínima de captura para el Cocobolo no ha sido establecida aún en el país por la entidad estatal responsable, ni se conocen reportes confiables sobre talla media de captura en la cuenca del río Sinú, ni en las demás cuencas en donde habita la especie, excepto los trabajos de Olaya-Nieto et al. (2008), quienes la estimaron en 10,7 y 10,6 cm LT para hembras (n = 259) y machos (n = 192), respectivamente, y Olaya-Nieto et al. (2008) y Padilla y Gorgona (2008) en 10,6 cm LT para sexos combinados (n = 455) en la Ciénaga Grande de Lorica, cuenca del río Sinú.
De acuerdo con lo anterior, la talla media de madurez sexual estimada en este trabajo para hembras, machos y sexos combinados (9,2, 9,7 y 9,5 cm LT, respectivamente) es menor que la talla media de captura estimada para hembras, machos y sexos combinados (10,7, 10,6 y 10,6 cm LT) por los citados autores. Además, solo el 14,8, 26,4 y 18,5% de los individuos colectados se capturó por debajo de las citadas tallas medias de madurez sexual, lo que permite inferir que la población de Cocobolo en la Ciénaga Grande de Lorica es una población no explotada o que no está sometida plenamente a explotación pesquera y que su dinámica poblacional es adecuada, a pesar de las nuevas condiciones que presenta la cuenca del río Sinú después de la construcción y puesta en marcha de la Hidroeléctrica Urrá.
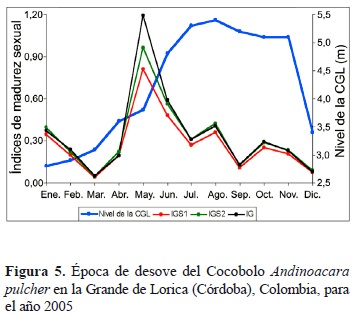
La colecta de hembras en estado de madurez sexual III en casi todos los meses del año, la colecta de machos en estado de madurez sexual III en seis meses del año, las diferencias estadísticas significativas encontradas entre los cuatro estados de madurez sexual asignados para hembras y machos y el diámetro de los ovocitos maduros permite inferir que el Cocobolo es un pez con desove parcial con época o periodo de desove prolongado durante el año, observándose los mayores picos reproductivos entre mayo y agosto (figura 5).
La fecundidad promedio por desove estimada en este trabajo (954 ovocitos) es similar a la reportada para Aequidens latifrons (800) por Stawikowski y Werner (1998) y A. tetramerus (1.000) por Planquette et al. (2000). La dispersión en las estimaciones de fecundidad de las diferentes muestras analizadas en el estudio (CV = 49,6%) puede estar asociada con el peso total y el peso de las gónadas, los cuales son heterogéneos (CV: 30,3 y 69,1%, respectivamente).
Debido a los sucesivos represamientos de los ríos como es el caso del río Sinú, los peces tienden a adecuarse a las nuevas condiciones ecológicas para poder realizar satisfactoriamente su ciclo reproductivo anual (Suzuki y Agostinho 1997). A lo largo de dicho ciclo reproductivo se pueden observar marcadas modificaciones en sus gónadas (Nikolsky 1963), especialmente en torno a su desarrollo, tamaño y peso de los ovocitos, los cuales van creciendo a medida que aumenta su estado de madurez sexual (Vazzoler 1996, Wootton 1990), lo que se refleja en las variaciones observadas en el índice gonadosomático mensual; debido a que la fecundidad, el periodo y el tipo de desove son características específicas esenciales para el manteniendo de cualquier especie de peces (Vazzoler 1996).
La reproducción en la mayoría de los peces está fuertemente ligada a la precipitación y la hidrología, e incluso las especies que desovan durante todo el año tienen ráfagas de actividad reproductiva en el inicio del periodo húmedo (Winemiller 1996). Este patrón de reproducción estacional ha sido descrito para los planos inundables de las regiones tropicales en todo el mundo (Lowe-McConnell 1964, Welcomme 1969, Winemiller 1989, 1991) y aplica también para el Cocobolo, especie en la que se encontraron hembras maduras en abril y mayo, cuando comienzan las lluvias en el área de estudio correspondiendo al periodo de aguas ascendentes en la Ciénaga Grande de Lorica (figura 5).
Según Winemiller (1996), algunas especies con cuidado parental también desovan en la estación seca como los cíclidos Aequidens pulcher (= Andinoacara pulcher) y Caquetaia krausii, y que los peces oportunistas maduran a tallas pequeñas y producen desoves pequeños a intervalos frecuentes durante una prolongada época de desove. Este autor plantea que A. pulcher es un pez con un ciclo de vida caracterizado por desoves relativamente pequeños, ovocitos grandes, cuidado parental y reproducción no estacional (Winemiller 1989), lo cual es confirmado por los resultados obtenidos en este trabajo con desoves en enero y febrero, meses que corresponden a la época seca, periodo de aguas bajas (figura 5).
Probablemente, la selección del desove es facilitada por las altas densidades durante el periodo de aguas bajas, y los ovocitos en desarrollo y las larvas pueden ser transportados hasta los planos inundables por los padres. Los huevos grandes de estas especies permiten que las larvas se desarrollen a partir de las reservas endógenas durante muchos días, mientras están protegidos en la boca del padre, por lo que la alimentación exógena se puede retrasar si las inundaciones se demoran más de lo acostumbrado (Winemiller 1996).
Por todo lo anterior, se concluye que el Cocobolo es un pez que presenta proporción sexual H:M de 1,4:1, desove parcial, época o periodo de reproducción prolongado que se extiende durante el año, talla media de madurez sexual de 9,5 cm LT, ovocitos grandes y fecundidad media.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a los pescadores y comercializadores de pescado de la Ciénaga Grande de Lorica y de la cuenca baja del río Sinú, a los tesistas involucrados en el proyecto de investigación “Estimación de los parámetros biológicos básicos de peces comerciales del río Sinú-Fase III”, Código FMV-01-06, Numeral 1120206, del cual hace parte este trabajo, y a la Oficina de Investigación y Extensión de la Universidad de Córdoba, por la financiación recibida. Finalmente, a los tres revisores anónimos, por sus comentarios y aportes.
REFERENCIAS
1. Banquett-Cano C, Juris-Torregrosa GA, Olaya-Nieto CW, Segura-Guevara FF, Brú-Cordero SB, Tordecilla-Petro. 2005. Hábitos alimenticios del Moncholo (Hoplias malabaricus) (Pisces: Erythrinidae), en la Ciénaga Grande de Lorica, Sistema río Sinú, Colombia. Dahlia, Revista Asociación Colombiana de Ictiólogos, 8: 79-88. [ Links ]
2. Bustamante ID. 2000. Los suelos de la cuenca del río Sinú y el Proyecto Urrá I. Temas Agrarios, 9: 15-28. [ Links ]
3. Dahl G. 1971. Los peces del norte de Colombia. Bogotá (Colombia): Inderena. p. 391. [ Links ]
4. Díaz V, Camargo L. 2008. Hábitos alimenticios del Cocobolo (Aequidens pulcher Gill, 1858) en la Ciénaga Grande de Lorica, Colombia [Trabajo de pregrado]. [Lorica (Córdoba), Colombia]: Programa de Acuicultura, Departamento de Ciencias Acuícolas, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba. [ Links ]
5. Galvis G, Mojica JI, Camargo M. 1997. Peces del Catatumbo. Bogotá (Colombia): Asociación Cravo Norte. p. 118. [ Links ]
6. Gill TN. 1858. Synopsis of the fresh water fishes of the western portion of the island of Trinidad, W. I. Annals of the Lyceum of Natural History of New York, 6 (10-13): 363-430. [ Links ]
7. González A, Solano JM, Yepes J, Solano M. 1991. Determinación del volumen de ictioplancton que entra a las ciénagas de Betancí y Grande de Lorica. Montería (Colombia): Centro de Investigaciones (CIUC). Universidad de Córdoba. [ Links ]
8. Holden MJ, Raitt DFS. 1975. Manual de ciencias pesqueras. Parte 2. Métodos para investigar los recursos y su aplicación. FAO Documentos Técnicos de Pesca, 115: 1-211. [ Links ]
9. IDEAM. 1998. Base de datos. Barranquilla, Colombia: Instituto de Hidrología, Meteorología y Estudios Ambientales. [ Links ]
10. Kenny JS. 1995. Views from the bridge: a memoir on the freshwater fishes of Trinidad. Port of Spain, Trinidad and Tobago: Julian Kenny. p. 98. [ Links ]
11. Kullander SO. 2003. Family Cichlidae. En: Reis RE, Kullander SO, Ferraris Jr CJ (editors). Checklist of the freshwater fishes of South and Central America. Porto Alegre (Brazil): Editora da Pontifícia Universidade Católica do Rio Grande do Sul-EDIPUCRS. p. 605-654. [ Links ]
12. Laevastu T. 1980. Manual de métodos de biología pesquera. Zaragoza (España): Editorial Acribia. p. 243. [ Links ]
13. Lowe-McConnell RH. 1964. The fishes of the Rupununi savanna district of British Guiana, South America. Part 1. Ecological grouping of fish species and effects of the seasonal cycle on the fish. Journal of the Linnean Society (Zoology), 45: 103-144. [ Links ]
14. Maldonado-Ocampo JA, Ortega-Lara A, Usma-Oviedo JS, Galvis G, Villa-Navarro FA, Vásquez L, Prada-Pedreros S, Ardila C. 2005. Peces de los Andes de Colombia. Guía de campo. Bogotá (Colombia): Instituto de Investigación de Recursos Biológicos Alexander Von Humboldt. p. 346. [ Links ]
15. Mills D, Vevers G. 1989. The Tetra encyclopedia of freshwater tropical aquarium fishes. New Jersey. USA: Tetra Press. p. 208. [ Links ]
16. Musick JA. 1999. Criteria to define extinction risk in marine fishes. Fisheries, 24: 6-14. [ Links ]
17. Musilová Z, Rícan O, Novák J. 2009. Phylogeny of the Neotropical cichlid fish tribe Cichlasomatini (Teleostei: Cichlidae) based on morphological and molecular data, with the description of a new genus. Journal of Zoological Systematics and Evolutionary Research, 47 (3): 234-247. [ Links ]
18. Nikolsky GV. 1963. The ecology of fishes. London, England: Academic Press. p. 341. [ Links ]
19. Olaya-Nieto CW, Brú-Cordero SB, Segura-Guevara F, Tordecilla-Petro G. 2004. Estimación de los parámetros biológicos básicos de peces comerciales del río Sinú-Fase I. Informe final. Lorica (Colombia): Laboratorio de Investigación Biológico Pesquera (LIBP). Departamento de Acuicultura, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba. [ Links ]
20. Olaya-Nieto CW, Segura-Guevara F, Tordecilla-Petro G. 2008. Biología básica del Cocobolo (Aequidens pulcher Gill, 1858) en la Ciénaga Grande de Lorica, Colombia. Trabajo de ascenso. Lorica (Colombia): Laboratorio de Investigación Biológico Pesquera (LIBP), Programa de Acuicultura, Departamento de Ciencias Acuícolas, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba. [ Links ]
21. Padilla M, Gorgona Y. 2008. Relaciones talla-peso y factor de condición del Cocobolo Aequidens pulcher (Gill, 1858) en la Ciénaga Grande de Lorica, Colombia [Trabajo de pregrado]. [Lorica (Córdoba), Colombia]: Programa de Acuicultura. Departamento de Ciencias Acuícolas, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba. Lorica. [ Links ]
22. Planquette P, Keith P, Le Bail PY. 2000. Atlas des poissons d'eau douce de Guyane (Tome 2). Paris (France): Publications Scientifiques du Muséum National d'Histoire Naturelle, Collection du Patrimoine Naturel. p. 593. [ Links ]
23. Ramírez-Gil H, Ajiaco-Martínez RE. 2001. Familia Cichlidae. En: Ramírez-Gil H, Ajiaco-Martínez RE (editores). La pesca en la baja Orinoquia colombiana: una visión integral. Bogotá (Colombia): Instituto Nacional de Pesca y Acuicultura (INPA). p. 187-195. [ Links ]
24. Soto P, Barrera J. 2007. Hábitos alimenticios de la Mayupa (Sternopygus macrurus Bloch & Schneider, 1801) en el río Sinú, Colombia [Trabajo de grado]. [Lorica (Colombia)]: Programa de Acuicultura, Departamento de Ciencias Acuícolas, Facultad de Medicina Veterinaria, Universidad de Córdoba. [ Links ]
25. Sparre P, Venema SC. 1995. Introducción a la evaluación de recursos pesqueros tropicales. Parte 1. Manual. FAO Documentos Técnicos de Pesca, 306/1 (rev.1): 1-420. [ Links ]
26. Stawikowski R, Werner O. 1998. Die Buntbarsche Amerikas, Band 1. Stuttgart (Deutschland): Verlag Eugen Ulmer. p. 540. [ Links ]
27. Suzuki HI, Agostinho AA. 1997. Reprodução de peixes do reservatório de Segredo. En: Agostinho AA, Gomes LC. Reservatório de Segredo, bases ecológicas para o manejo. Maringá (Brasil): EDUEM. p. 163-182. [ Links ]
28. Tobías-Arias A, Olaya-Nieto CW, Segura-Guevara FF, Tordecilla-Petro G, Brú-Cordero SB. 2006. Ecología trófica de la Doncella (Ageneiosus pardalis Lütken, 1874) en la cuenca del río Sinú, Colombia. Rev MVZ Córdoba (Medicina Veterinaria y Zootecnia de la Universidad de Córdoba, Colombia), 11 Supl (1): 37-46. [ Links ]
29. Tresierra AE, Culquichicón ZG. 1993. Biología pesquera. Trujillo (Perú): Concytec. p. 432. [ Links ]
30. Tresierra AE, Culquichicón ZG. 1995. Manual de biología pesquera. Trujillo (Perú): Concytec. p. 227. [ Links ]
31. Vazzoler AEA de M. 1971. Diversificação fisiológica e morfológica de Micropogonias furnieri (Desmarest, 1822) ao sul do Cabo Frio, Brasil. Boletim do Instituto Oceanografico, 20 (2): 1-20. [ Links ]
32. Vazzoler AEA de M. 1996. Biología da reprodução de peixes teleósteos: teoría e práctica. São Paulo, Brasil: EDUEM. p. 169. [ Links ]
33. Vazzoler AEA de M, Caraciolo-Malta MC, Amadio SA. 1989. Aspectos biológicos de Peixes amazônicos. XII. Indicadores quantitativos do período de desova das espécies da gênero Semaprochilodus (Characiformes, Prochilodontidae) do baixo rio Negro, Amazonas, Brasil. Revista Brasileira de Biologia, 49 (1): 175-181. [ Links ]
34. Welcomme RL. 1969. The biology and ecology of the fishes of a small tropical stream. Journal of Zoology, 158: 485-529. [ Links ]
35. Wenner AM. 1972. Sex ratio as a function of size in marine crustacea. The American Naturalist, 106: 321-350. [ Links ]
36. Winemiller KO. 1989. Patterns of variation in life history among South American fishes in seasonal environments. Oecologia, 81: 225-241. [ Links ]
37. Winemiller KO. 1991. Ecomorphological diversification in lowland freshwater fish assemblages from five biotic regions. Ecological Monographs, 61 (4): 343-365. [ Links ]
38. Winemiller KO. 1996. Dynamic diversity in fish assemblages of tropical rivers. En: Cody ML, Smallwood JA (editores). Long-term studies of vertebrate communities. Orlando (USA): Academic Press. p. 99-134. [ Links ]
39. Wootton RJ. 1990. Ecology of teleost fishes. London (England): Chapman & Hall. p. 404. [ Links ]
40. Zar JH. 1996. Biostatistical analysis. New Jersey (USA): Prentice Hall Inc. p. 662. [ Links ]
Recibido: noviembre 2009;
aceptado: mayo 2010.