Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.33 no.94 Medellín Jan./June 2011
ARTÍCULOS DE INVESTIGACIÓN
COMPOSICIÓN Y ESTRUCTURA DE UN ENSAMBLE DE PLANTAS ACUÁTICAS VASCULARES DE UNA REPRESA ALTO ANDINA (SANTANDER), COLOMBIA
COMPOSITION AND STRUCTURE OF AN AQUATIC VASCULAR PLANT ASSEMBLAGE OF A HIGHLAND ANDEAN DAM (SANTANDER), COLOMBIA
Licet R. Durán-Suárez1; Héctor E. Terneus-Jácome2; Rosa A. Gavilán-Díaz3; José A. Posada-García4
1 Grupo de Estudios en Biodiversidad. Universidad Industrial de Santander. Bucaramanga (Santander), Colombia. lirodus@gmail.com.
2 Universidad Internacional del Ecuador. terneusesteban@yahoo.es.
3 Grupo de Estudios en Biodiversidad. Universidad Industrial de Santander. Bucaramanga (Santander), Colombia. ragadiz@yahoo.com.
4 Grupo de Investigación de Limnología Básica y Experimental (LimnoBasE). Instituto de Biología, Universidad de Antioquia. Medellín (Antioquia), Colombia. japosga@yahoo.es.
Recibido: agosto 2010; aceptado: mayo 2011.
Resumen
La flora acuática de la represa de Berlín, localizada en un área de páramo seco en el departamento de Santander (Colombia), altitud de 3.214 m, fue estudiada para observar los efectos que la construcción de esta represa podía tener. Se realizaron tres muestreos en transectos desde la orilla hacia el centro de la represa en tres diferentes temporadas climáticas. Se recolectaron en total 28 especies de plantas acuáticas, distribuidas en 17 familias; la mayoría de ellas de hábito emergente. La familia con mayor número de especies fue Poaceae con cinco; sin embargo, la familia Haloragaceae presentó la especie con mayor abundancia relativa (cobertura), Myriophyllum aquaticum. No se encontraron diferencias significativas en la riqueza de especies entre las tres temporadas de muestreo. Al analizar la composición espacial de los transectos se observó la dinámica del ensamble de plantas acuáticas vasculares evidenciando un recambio de siete especies en las tres temporadas de muestreo. Los cambios espaciales fueron más evidentes, encontrándose que los transectos de las zonas litorales mostraron, no solo cambios en la composición sino también en la riqueza, mientras que la zona limnética mantuvo su composición original. La conductividad fue el factor que mostró mayor influencia en la riqueza.
Palabras clave: alto andino, distribución, macrófitas, represa, riqueza
Abstract
The aquatic flora of the Berlin dam reservoir (Santander) Colombia, located in an area of dry páramo at an altitude of 3214 m, was studied to observe the effects that dam construction would have on it. Three samples were collected in transects that ran from the shore to the center of the reservoir during three different climate periods. A total of 28 species of aquatic plants were recorded, distributed in 17 families, most of them exhibiting an emergent life form. The family with the greatest number of species was Poaceae with five species; however, the species with the highest relative abundance (coverage) was Myriophyllum aquaticum (Halogaraceae). There were no significant differences in species richness during the three sampling seasons. In analyzing the spatial composition along the transects, the dynamics of this assemblage of vascular acuatic plants was observed, with a turnover of seven species in the three sampling periods. Spatial changes were most evident, with the transects in the coastal zones showing not only more changes in composition but also in species richness, while the limnetic zone retained its original composition. Conductivity was the factor that showed the greatest influence on richness.
Key words: dam, distribution, highland, macrophytes, richness
INTRODUCCIÓN
En los últimos 20 años se ha analizado el rol de las macrófitas desde el punto de vista del reciclaje de nutrientes (Matos et al. 2004) y recientemente se centró la atención en estudios sobre el impacto en el funcionamiento de los ecosistemas acuáticos, en la diversidad (Thomaz et al. 2008) y el impacto como indicadores delnivel de eutrofización en los cuerpos de agua (García et al. 2006, Rojas y Novelo 1995). Indirectamente las plantas acuáticas también pueden indicar el nivel de eutrofización de los cuerposde agua y su composición varía rápidamente frente al cambio climático (García et al. 2006, Rojas y Novelo 1995). Por estas características se puede decir que el ensamble de plantas acuáticas es considerablemente dinámico (Otáhélová y Valachovic 2002). García et al. (2006) sugieren que la flora permite obtener información del estado de salud ambiental y ecología en algunas zonas, ya que las macrófitasconstituyen sitios adecuados para el desove de algunas especies de insectos y peces, además de contribuir a la mayor diversidad de zooplancton al proveer refugio para disminuir la presión de los depredadores por parte de peces planctívoros (Jeppesen et al. 1997).
La temperatura, las propiedades químicas del agua, la disponibilidad de luz, el grado de herbivoría y el efecto antrópico en cuencas hidrográficas y orillas de los lagos influencian la abundancia de las macrófitas acuáticas en los cuerpos de agua facilitando a su vez cambios en la estructura y composición florística de la vegetación acuática (Barko et al. 1982). La riqueza de macrófitas puede verse influenciada por variables como nutrientes, la radiación subacuática y el pH (Hutchinson 1975), especialmente las plantas enraizadas sumergidas (Vestergaard y Sand-Jensen 2000), mientras que las plantas emergentes muchas veces tienen estrecha relación con el área colonizada en los cuerpos de agua (Møller y Rørdam 1985).
Las macrófitas acuáticas constituyen aproximadamente el 1% de la flora vascular del mundo, siendo hoy en día el centro de muchas investigaciones (Chambers et al. 2008, Ramírez et al. 1982). En la actualidad ha aumentado el interés por los beneficios que estas plantas pueden ofrecer como fertilizantes, en manufactura de cartón, en la producción de biogás (Celis et al. 2005, Robinson et al. 2006), en el tratamiento de aguas, tanto residuales como de sistemas acuáticos naturales (Celis et al. 2005, Goulet et al. 2005, Miglioranza et al. 2004, Terneus 2002) y como absorbentes de metales pesados, colorantes (Celis et al. 2005, Robinson et al. 2006) y pesticidas, y muchos de sus componentes se utilizan en la fabricación de alimentos balanceados para animales (Henry-Silva y Camargo 2006).
Algunas especies se consideran malezas (Nagasaki et al. 2002). Esto se evidencia en condiciones de eutrofia e hipereutrofia (Meerhoff et al. 2006), procesos que facilitan la colonización de macrófitas trayendo como consecuencia el bloqueo de canales y bombas de irrigación así como la obstaculización de la navegación en los lugares en donde se encuentran (Diniz et al. 2005) y, además, pueden aumentar el grado de incidencia de algunas enfermedades asociadas a condiciones de aguas quietas (Schmidt-Mumm 1987).
El estudio de la composición de plantas acuáticas se ha extendido en diferentes países a través de los cinco continentes, siendo Europa (Aguinaco et al. 1989, Khedr y El-Demerdash 1997, entre otros) y América (Bini et al. 2005, Chimney et al. 2006, entre otros) los que cuentan con el mayor número de estudios. En Latinoamérica se han realizado estudios de diversidad, distribución, estado de conservación, evaluación y mejoramiento de la calidad de agua y beneficios que se obtienen de las macrófitas acuáticas (Castaño-Uribe 2002, Rodríguez 2004, Vanegas 2004). Para Colombia en particular, los pocos trabajos realizados sobre el ensamble de macrófitas han sido ejecutados por Schmidt-Mumm (1988a, b). Los sistemas paramunos presentan por sus características alto grado de endemismo (Miranda et al. 2002). Los estudios de flora acuática son poco frecuentes y los trabajos más conocidos son los realizados por Rangel y Aguirre (1983), en la Laguna de Tota (Boyacá, Colombia). Existen también algunos estudios de flora de páramos, los cuales documentan algunas especies hidrófitas como los realizados por Cleef (1981), quien caracterizó azonal y altitudinalmente la vegetación de los páramos de la cordillera Oriental colombiana, y Sánchez et al. (1990) en depósitos turbosos ubicados en los alrededores de Bogotá, entre otros.
Este estudio se realizó en un páramo seco, del corregimiento de Berlín, Tona (Santander), Colombia, el cual no cuenta con un sistema que permita el tratamiento de aguas residuales domésticas y estas descargas desembocan en el cauce del río Jordán, principal afluente de la represa del INPA. Dicha represa provoca la retención de todos los nutrientes, lo que junto con los restos de fertilizantes utilizados en la agricultura de la zona, han favorecido la colmatación vegetal de este cuerpo de agua, lo cual, según los habitantes del sector, produce una reducción en la biomasa de peces, la recreación y el turismo en la zona. El objetivo de este trabajo fue caracterizar la flora vascular acuática de la represa ubicada en el páramo de Berlín sobre el curso del río Jordán, así como determinar si se presentan cambios espaciales y temporales en el ensamble.
MATERIALES Y MÉTODOS
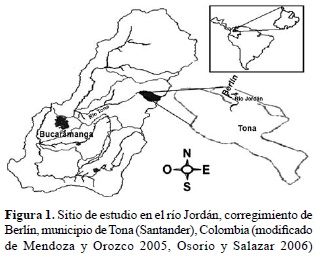
Área de estudio. La represa de Berlín donde se realizó el trabajo se sitúa en el corregimiento de Berlín, municipio de Tona, al nororiente del departamento colombiano de Santander (7° 11' N y 72° 52' O; figura 1). El páramo de Berlín se caracteriza por presentar una precipitación bimodal con dos temporadas de lluvia en los meses de abril-mayo y septiembre-octubre y un periodo de sequía entre diciembre y marzo (Rangel 2002), precipitación media de 685,8 mm y altitud de 3.214 m (IDEAM 2008).
La represa que inicialmente fue construida para alimentar la truchifactoría del Instituto Nacional de Pesca y Acuicultura (INPA), una represa de reborde que tiene aproximadamente 100 m de ancho y una profundidad promedio de 3,30 m, su principal afluente es el río Jordán, que nace en estribaciones de la vereda Parra-Juan Rodríguez a 3.700 msnm, durante su recorrido tiene extensión de 20 km, aproximadamente y desemboca en el río Chitagá en el departamento de Norte de Santander. La cuenca hidrográfica del río Jordán está constituida por nacimientos y cauces de varias quebradas, algunos humedales y pequeñas lagunas, que nacen en colinas altas y medias, las cuales se infiltran en el suelo y posteriormente brotan en las zonas bajas. El paisaje comprende un ecosistema de páramo seco, clima frío (7-23 ºC) con vegetación de pajonales y valles estrechos rodeados de colinas. Su orografía consta de pendientes suaves a moderadas y geológicamente con meteorización arenosa debido a la presencia de rocas ígneas y metamórficas duras y quebradizas. Presenta un sistema estructural que permite la existencia de acuíferos superficiales asociados a eventos glaciares (López-Arenas y Ramírez-Cadena 2010).
Metodología. Para la recolecta del material florístico se realizaron tres muestreos: en periodo de transición (18 de abril de 2007), en temporada lluviosa (12 de octubre de 2007), y en temporada seca (18 de diciembre de 2007). Se trazaron cinco transectos de 4 x 9 m, ubicados desde la orilla hacia el centro de la represa; la ubicación de cada uno de los transectos se realizó teniendo en cuenta las zonas propuestas por Kiersh et al. (2004): zona lacustre (cerca de la represa), zona riberina (la cola de la represa), zona de transición (parte media de la represa), zona litoral poco profunda y zona litoral profunda (figura 2).
Los porcentajes de cobertura de cada especie se estimaron teniendo en cuenta imágenes fotográficas y observaciones directas tomando como referencia una cuerda de 9 m con marcaciones a cada metro.
Las mediciones de parámetros físicos durante la temporada de lluvias y sequía se realizaron superficialmente excepto para el transecto ubicado en el centro, el cual no se pudo muestrear por el avance de la vegetación y dificultad para maniobrar el bote, en la zona litoral, se midieron en cada transecto.
La toma de muestras se realizó siguiendo la metodología de Petean et al. (2003), se recolectaron cuatro muestras de cada especie, las cuales fueron depositadas en diferentes herbarios. Cerca de los transectos se observó la aparición de nuevas especies fuera de los puntos de muestreo, lo cual se documentó para evidenciar cambios en la composición general de la represa.
Los datos de forma de vida se obtuvieron según lo propuesto por Pedralli (1990), presencia y coloración tanto de partes vegetativas como reproductivas se tuvieron en cuenta para cada recolecta. Para la realización de este trabajo setuvo en cuenta las especies anfibias encontradas en la zona del litoral poco profundo.
Los parámetros limnológicos, en el primer muestreo se tomaron in situ datos de turbidez, profundidad, conductividad, pH y temperatura, con una sonda multiparámetros (Horiba U10), en dos puntos, 1) ubicado cerca de la represa, y 2) en el punto medio y no en los transectos; mientras que en salidas posteriores, se midió in situ la temperatura del agua, el pH, la conductividad, la transparencia (Disco Secchi) y la profundidad de la lámina de agua en dos puntos de la represa.
Para los análisis de parámetros químicos (DBO, nitrógeno total, nitrógeno amoniacal, nitritos, nitratos, fosfatos totales, sólidos totales, sólidos suspendidos, sólidos suspendidos volátiles) se emplearon muestras de agua el 6 de marzo de 2008. Las muestras se preservaron en 1 ml de ácido sulfúrico por litro de agua, y posteriormente, se llevaron en una caja con hielo al laboratorio de aguas y suelos de la Corporación Autónoma Regional para la defensa de la meseta de Bucaramanga (CDMB), donde fueron analizados. El lugar de muestreo se detreminó con geoposicionador (GPS) y los datos climatológicos se obtuvieron de la estación meteorológica de Berlín (IDEAM).
Fase de laboratorio. Las muestras botánicas recolectadas se herborizaron siguiendo la misma metodología para plantas terrestres (Mori et al. 1989), este proceso se llevó a cabo en el herbario de la CDMB. El material botánico fue determinado taxonómicamente por especialistas en el área y por medio de comparaciones con excicados revisados en el Herbario de la Universidad deAntioquia (HUA; Medellín), Colombia, y fue corroborado con bibliografía especializada (Judd et al. 2002, Velásquez 1994,). Copias del material florístico de este estudio se depositaron en el Herbario de la Universidad Industrial de Santander (UIS), en el Herbario de la CDMB y en el HUA.
Análisis de datos. Teniendo en cuenta la abundancia relativa se estimaron algunos índices de diversidad, riqueza (Margalef), dominancia (Simpson) y equidad (Shannon) (Moreno 2001); la similitud entre transectos se determinó por medio de la prueba estadística de Chi cuadrado (Chi2) y con el programa Past (Hemmer et al. 2001); se analizó una matriz presencia/ausencia para determinar el índice de Jaccard. Con los datos obtenidos para flora y parámetros, se realizó la tabla de cobertura de cada especie en cada una de las temporadas de muestreo. Los parámetros físicos se analizaron y relacionaron entre sí por medio del coeficiente de correlación de Pearson.
RESULTADOS
La represa mostró un proceso continuo de colmatación acelerada por invasión de plantas acuáticas. Durante el periodo de estudio, se encontraron 28 especies de plantas acuáticas correspondientes a 17 familias (anexo 1). Todas las muestras recolectadas presentan un hábito de crecimiento herbáceo, de las cuales 12 (42,86%) son Liliopsida y 16 (57,14%) Magnoliopsida. La forma de vida predominante es la emergente con 16 especies (57,1%), seguida de las anfibias con 8 (28,6%), enraizada sumergida con 3 (10,7%) y libre flotante con 1 (3,57%).
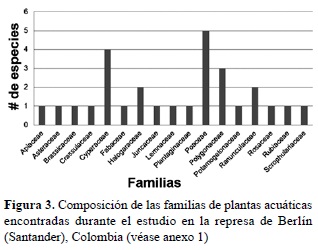
La familia que presentó número mayor de taxones fue Poaceae con 5 especies, seguida por Cyperaceae y Polygonaceae con 4 y 3, respectivamente, las cuales conformaron el 42,87% del total de la flora encontrada (figura 3).
La especie que presentó mayor cobertura dentro de los transectos, fue Miryophyllum aquaticum (Haloragaceae) con 60%, formando un denso colchón, el cual llegó alrededor de 1 m de profundidad. La especie Hydrocotyle cf. bonplandii, tuvo una cobertura del 40%, el segundo mayor porcentaje de cobertura dentro de los transectos. Sin embargo, ninguna de las dos especies se encontró en el litoral poco profundo (tabla 1).
En los diferentes transectos se encontraron 4 especies compartidas, M. aquaticum, H. cf. bonplandii, Holcus lanatus y Rumex crispus, esta última se encontró en todos los transectos junto con H. lanatus (utilizadas por los habitantes del sector como alimento para el ganado). En el litoral poco profundo se registraron 16 especies diferentes a las encontradas en los otros puntos de muestreo, cada una con cobertura baja. En la zona riberina se evidenció la presencia de Potamogeton paramoanus con una área de cobertura del 20%, siendo la única planta sumergida encontrada en la represa, la cual presentó asociación con H. cf. bonplandii.
En el muestreo realizado durante la época de lluvia se evidenció leve aumento en la cobertura de algunas especies, un 85% de las especies se encontró en periodo de floración. A partir de este muestreo, no se pudo acceder al transecto ubicado en la zona riberina, por avance sobre el espejo de agua de M. aquaticum.
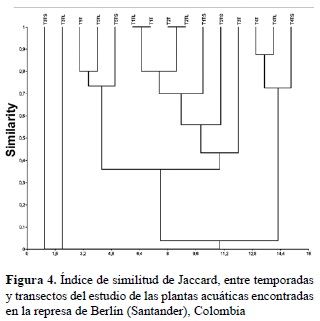
La riqueza no mostró cambios significativos a través de los periodos hidrológicos (Chi2 = 0,13); lo anterior se reflejó en el índice de Jaccard con valores altos (0,875%; figura 4). Sin embargo, Lemna sp. aumentó su cobertura en 100% y se encontró en el litoral de la zona lacustre; M. aquaticum también mostró aumento del 35% en cobertura en temporada de lluvia, dejando un espejo de agua reducido y reemplazando a H. cf. bonplandii y H. lanatus; esta última fue reemplazada totalmente por M. aquaticum para el último muestreo, con lo cual presentó comportamiento de invasora.
Durante el periodo de transición, la mayor riqueza de macrófitas se encontró en la zona lacustre, mientras que para los otros dos periodos del ciclo, se localizó cerca al dique, puesto que M. aquaticum cubre la mayor parte del espejo de agua y aísla otras especies, las cuales se ubican en dicha zona.
En la zona de litoral poco profunda, también se reportó un cambio de especies durante el estudio; ya que Plantago sp. y Poa sp. solo se encontraron en el primer muestreo, mientras Trifollium repens desapareció para el último muestreo, y Taraxacum oficinale y Eleocharis cf. stenocarpa fueron reportadas sólo en temporada seca. En el sustrato de este transecto se evidenció la presencia de musgos y hepáticas. Esta zona presentó mayor riqueza durante la realización de este estudio, con índices de: Margalef entre 2,83 y 3,25, de Shannon entre 2,28 y 2,41; así como menor equidad con 0,89 en el índice de Simpson (tabla 2).
En muestras tomadas fuera de los transectos establecidos, se encontró aguas arriba y aguas abajo de la represa dos poblaciones de plantas sumergidas, Myriophyllum quitense y P. paramoanus a través de todo el estudio; y dentro de la represa en el último muestreo se encontró Nasturtium aquaticum, en periodo de floración, con una cobertura aproximada del 5% de la represa, flotando en litoral de la zona de transición, y cerca de la zona de litoral profundo. La especie Lemna sp., se encontró cerca del dique y bordeando el litoral de la zona lacustre y compartiendo con M. aquaticum, de esta manera generándose una yuxtaposición de distintos tipos de hábitats con una cobertura mayor al 100%.
En el transecto del litoral profundo, dominó Rumex acetosella y M. aquaticum, en menor proporción se encontró Muhlenbergia nigra, M. cf. tenella y H. cf. bonplandii.
En la temporada seca aumenta la cobertura de M. aquaticum en 30%, cubriendo casi por completo el espejo de agua, lo cual impidió la entrada a los dos primeros transectos, el espejo de agua se redujo y las plantas se encontraron en periodo de floración. Se nota la disminución de H. lanatus, y la riqueza de plantas presentes en la represa entre temporadas osciló entre 21 y 24 especies. No se tuvo acceso al transecto ubicado en la zona riberina de la represa. En el litoral poco profundo aumenta la conductividad a 82,8 µs/cm, siendo este el máximo valor para este parámetro durante todo el estudio. Por otra parte, en esta temporada se encontraron algunas especies diferentes a las encontradas en otras temporadas como una E. cf. stenocarpa y T. oficinale.
En periodo de sequía, se mantiene una composición similar al periodo de lluvias, aunque disminuye la cantidad de plantas en floración; se registró la presencia de N. aquaticum cerca de los transectos del centro y litoral profundo, a pesar de no estar dentro de los transectos se aprecia cobertura de aproximadamente 10% de la represa. Para esta época; el avance de M. aquaticum deja un espejo de agua de aproximadamente 1 m2.
Los valores de pH y temperatura del agua, no variaron considerablemente durante el estudio (S = 0,41 y S = 1,05, respectivamente), en contraste con la conductividad, la cual mostró cambio gradual durante el estudio y en los puntos de muestreo; mostró variación en el litoral poco profundo (S = 25,92); y en el litoral profundo (S = 15,88).
La temperatura, el pH y la conductividad, se tomaron in situ y de manera superficial, excepto para el primer muestreo, en el cual se tomaron datos con Horiba U-10 (figura 5). En la zona lacustre se evidenció una clara estratificación aproximadamente a 1 m de profundidad para todos los parámetros, mientras que en la zona riberina se encuentra una profundidad de 0,65 m, el pH, la conductividad, la temperatura y la turbidez se mantienen estables, mostrándose algunos cambios cerca el sustrato (figura 6).
En temporada de lluvia la conductividad disminuye notablemente hacia los litorales; el pH osciló entre 6,08 y 6,5, y la temperatura se mantuvo estable con un promedio de 17,1 ºC, excepto en el litoral poco profundo donde aumentó. Los cambios en la temperatura se presentaron entre transectos con una fluctuación de 0,5-1 ºC aproximadamente entre transectos, excepto en los litorales profundo y poco profundo donde hubo una desviación estándar de 4,83 y 3,56 y un promedio de 18,2 y 12,9, respectivamente.
En la temporada seca la conductividad se mantuvo baja en el litoral profundo; sin embargo, aumentó notablemente en el litoral poco profundo. Mientras que el pH, osciló entre 6,35 y 6,07 y mostró disminución en el litoral poco profundo, donde exhibió valores de 5,84. La temperatura se mantuvo estable excepto en el litoral poco profundo guardando similitud con lo encontrado en transición (tabla 3).
En las zonas lacustre y de transición que presentaron mayores valores de conductividad se encontró menor riqueza de especies, mientras que en la zona de los litorales se presenta mayor riqueza y valores menores de conductividad así como valores mayores para temperatura; especialmente en el litoral poco profundo donde se presenta mayor riqueza.
En el transecto ubicado en la zona de transición, el pH presentó correlación negativa con la conductividad (-0,92) y correlación positiva con la temperatura (0,85). En la zona lacustre se mantuvo correlación negativa entre el pH y la conductividad (-0,78); y esta última mostró correlación positiva con la temperatura (0,77), y a su vez la temperatura se correlaciona negativamente con la precipitación (-0,93).
En la zona litoral poco profunda la correlación negativa entre pH y conductividad continúa (-0,70); y entre esta última y la precipitación (-0,93), mientras que se dio correlación positiva entre la precipitación y la temperatura (0,86). En la zona de litoral profundo la correlación fue positiva entre el pH y la conductividad (0,99), y esta última con la temperatura (0,77).
Los parámetros químicos se tomaron en un punto ubicado en la zona de transición, se llevó a cabo como referencia de las variables que se pueden manejar en la represa, para determinar formas de nitrógeno y fósforo presentes; sus datos se relacionan en la tabla 4.
DISCUSIÓN
El cambió de lótico a léntico del curso del río Jordán, promueve la colmatación vegetal, semejante a lo que ocurre en otras represas del mundo (Otáhélová y Valachovic 2002), probablemente debido a que la mayoría de las especiesde macrófitas acuáticas muestran preferencia por establecerse en lugares ricos en nutrientes (Terneus 2002).
Según Fontúrbel (2003), la presencia de plantas acuáticas flotantes libres se puede tomar como indicador del estado trófico en algunos cuerpos de agua. En este sentido, si se tiene en cuenta que la flora de la zona limnética encontrada en la represa es predominantemente flotante (27,6%), puede inferirse que este cuerpo de agua presenta un proceso de eutrofización avanzado. La presencia de especies como Lemna sp. y N. aquaticum pueden facilitar de alguna manera la depuración del agua de la represa (Celis et al. 2005).
Petean et al. (2003) sugiere la importancia dedocumentar las especies anfibias pues al tener mayor absorción de nutrientes del sustrato, se adaptan al medio a través de las diferentes temporadas, lo que permite ampliar los registros de diversidad al realizar los inventarios (Esteves 1998). Sin embargo, hay que tener en cuenta que especies como T. oficinale y Eleocharis cf. stenocarpa, son plantas anfibias por lo cual desaparecen en temporadas invernales donde el espejo de agua aumenta.
Algunas de las especies de plantas enraizadas emergentes que se encontraron en la represa de Berlín; han sido referidas en lagos oligotróficos de páramos (Veloza et al. 2000) mostrando una distribución independiente al estado trófico de los cuerpos de agua en los que se encuentran.
La ampliación en la cobertura de M. aquaticum pudo deberse al aumento en la contaminación del agua por prácticas agrícolas y actividad antrópica en las zonas aledañas a la represa, lo cual es consistente con lo encontrado en otros sitios como Egipto (El-Gharably et al. 1982) donde se atribuye el aumento de la cobertura de algunas especies de macrófitas acuáticas a factores externos al cuerpo de agua. Durante todo el estudio se observó contaminación al cuerpo de agua por vertimientos de agua servida, basura y agroquímicos que llegan por escorrentía debido a los sembradíos de cebolla y papa que se mantienen a su alrededor.
La especie M. aquaticum es tolerante a cambios en la salinidad (Ramírez et al. 1989), en algunos ambientes presenta reproducción sexual y asexual, lo que le permite saturar espacios favorables y disminuir la competencia interespecífica (Terneus 2002), esto podría explicar el aumento en la cobertura que presentó esta especie durante la temporada seca.
Según Mazer et al. (2001), es posible que la desaparición de algunas poaceas como H. lanatus y Poa sp. durante el último muestreo se deba a la disminución en la velocidad de flujo; ya que M. aquaticum forma una barrera que llega aproximadamente a un metro de profundidad disminuyendo la disponibilidad de recursos.
La presencia de P. paramoanus en la zona de la cabecera puede deberse a que algunas especies de este género son estrategas tipo K (Celis et al. 2005), las cuales pueden mantenerse cerca de la densidad máxima dadas las condiciones del medio que habitan, lo que les permite colonizar algunos espacios. Las plantas sumergidas tienden a tener una distribución cerradamente relacionada con el nivel de penetración de luz para realizar fotosíntesis (Hutchinson 1975, Terneus 2002), lo que podría explicar la presencia de esta planta en el punto de menor profundidad de la represa (65 cm).
Aunque los índices de calidad de agua se tornan específicos para cada región, podemos inferir el estado trófico del agua de la represa tomando como referencia los estudios realizados en España por Moreno et al. (2006), donde se estima la calidad de agua teniendo en cuenta la presencia y el valor individual de cada especie (Kiersh et al. 2004), por lo tanto, basados en lo anterior, la calidad del agua de la represa se podría clasificar entre buena y moderada para consumo humano debido a la presencia de especies de los géneros: Myriophyllum, Lemna, Potamogeton y Ranunculus, a pesar de la contaminación.
El aumento en la cobertura de L. minor podría tomarse también como especie indicadora del estado trófico del agua de la represa pues esta especie solo accede a los nutrientes disponibles en la columna de agua (Nasu y Kugimoto 1981, Terneus 2002). En estudios realizados por Robinson et al. (2006) se menciona la capacidad de L. minor y N. aquaticum para absorber metales pesados. Teniendo en cuenta lo anterior podemos sugerir que estas plantas flotantes ayudan a mantener la calidad de agua de la represa, pues el río Jordán, luego de su paso por la represa posee una transparencia total y una profundidad de aproximadamente 0,5 m, características que facilitan el establecimiento de plantas sumergidas (Hutchinson 1975, Terneus 2002).
Similar a lo ocurrido en Baia Candeia (Brasil) (Das Neves et al. 2006) y en seis lagos Faroese (Schierup et al. 2002), en la represa de Berlín, el pH se mantuvo entre neutro y alcalino, sin mostrar grandes variaciones. La temperatura del agua tampoco muestra variaciones drásticas a través del tiempo de estudio, por tanto no parecería explicar los cambios en la composición florística de la represa; a pesar de ser un factor relevante en procesos metabólicos y reproductivos en las plantas (Kirk 1983). Sin embargo, entre transectos se muestra un cambio en este parámetro, debido a los cambios ambientales propios de ambientes paramunos tropicales en cortos periodos de tiempo (Terneus 2002).
La variación que presenta la conductividad puede estar explicando el cambio en la estructura del ensamble de plantas acuáticas como lo encontrado en las Lagunas Verdes (Ecuador) por Terneus (2002), ya que en los puntos donde aumenta la conductividad (zona lacustre y de transición) se encuentra riqueza menor, y por el contrario en las zonas litorales hay mayor número de especies.
El establecimiento y desarrollo humano en el corregimiento, así como el aumento del uso de fertilizantes, han permitido el proceso de eutrofización en la represa, lo que se evidencia en el valor de fósforo total (0,27 mg/l), se supone que tal hecho sucede por el aumento de nutrientes que recibe la represa y por ende, alta precipitación de fósforo y materia orgánica puesto que estos nutrientes no circulan por debajo del nivel de la represa y el material alóctono se acumula en esta zona (Roldán y Ramírez 2008). Derivado de este problema en el futuro, puede darse la pérdida de profundidad en la zona riberina y de la extensión del área inundable (Rojas y Novelo 1995).
CONCLUSIÓN
La riqueza del ensamble de plantas acuáticas vasculares no mostró cambios significativos a través del tiempo de estudio, sin embargo, se encontró el reemplazo de 6 especies con muy baja densidad. Los cambios espaciales fueron más evidentes, pues se verificó que los transectos de las zonas litorales mostraron, no solo cambios o diferencias en la composición sino también en la riqueza, mientras que la zona limnética mantuvo su composición, estas observaciones se mantuvieron en todas las temporadas de muestreo.
Entre las variables analizadas, la conductividad mostró significancia en el ensamble estudiado, puesto que se encontró que la mayor conductividad de algunos transectos está relacionada con menor riqueza, y viceversa.
Las cargas de nutrientes que recibe la represa por parte de la población del corregimiento pueden estar favoreciendo la colmatación vegetal y la disminución del área de inundación, principalmente por el incremento de M. aquaticum, lo que favorecería la pérdida de hábitat y comunidades acuáticas. En la actualidad, este cuerpo de agua presenta un proceso de eutrofización avanzado. El futuro de este cuerpo de agua depende del cuidado de los habitantes del sector; así como de la disminución de nutrientes por aguas servidas y fertilizantes.
AGRADECIMIENTOS
Los autores expresan su agradecimiento al Laboratorio de Limnología de la Universidad Industrial por la colaboración logística y financiera para la realización del estudio. Agradecimientos sinceros a Alicia Rojas por el préstamo de material florístico del Herbario y la determinación de algunos ejemplares; a Mariana Meerhoff (Universidad de la República, Uruguay/Universidad Aarhus, Dinamarca), Sidenei Thomaz (Universidad Estadual de Maringá) y Thomas C. Andres (Honorary Research Associate del New York Botanical Garden), por sus valiosos comentarios y sugerencias al manuscrito de este estudio. Finalmente, a Kaj Sand-Jensen (Universidad de Copenhagen) y Martin Søndergaard (Danmarks Miljøundersøgelser), por el suministro de la literatura científica.
REFERENCIAS
1. Aguinaco M, Bellot J, Serrano M. 1989. Pautas de distribución espacial de macrófitos en los canales de drenaje del Polígono de riego de la Violada (Huesca). Option Mediterranéennes, 3: 77-81. [ Links ]
2. Barko J, Hardin G, Matthews M. 1982. Growth and morphology of submersed freshwater macrophytes in relation to light and temperature. Canadian Journal of Botany, 60: 877-886. [ Links ]
3. Bini L, Oliveira L, Souza D, Carvalho P, Pinto M. 2005. Patterns of the aquatic macrophyte cover in Cachoeira dourada Reservoir (GO-MG). Brazilian Journal of Biology, 64 (4): 767-770. [ Links ]
4. Castaño-Uribe C, editor. 2002. Páramos y ecosistemas alto andinos de Colombia en condición Hotspot y global climatic tensor. Bogotá (Colombia): Ministerio del Medio Ambiente, Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM). p. 387. [ Links ]
5. Celis H, Junod M, Sandoval E. 2005. Recientes aplicaciones de la depuración de aguas residuales con plantas acuáticas. Theoria, 14 (1): 17-25. [ Links ]
6. Chambers P, Lacoul P, Murphy K, Thomaz S. 2008. Global diversity of aquatic macrophytes in freshwater. Hydrobiologia, 595: 9-26. [ Links ]
7. Chimney M, Wenkert L, Pietro K. 2006. Patterns of vertical stratification in a subtropical constructed wetland in south Florida (U. S. A.). Ecological Engineering, 27: 322-330. [ Links ]
8. Cleef A. 1981. The vegetation of the paramos of the Colombian Cordillera Oriental (Dissertationes Botanicae Series: Vol. 61). Vaduz (Liechtenstein): Lubrecht y Cramer Ltd. p. 316. [ Links ]
9. Das Neves EL, Leite KRB, França F, De Melo E. 2006. Plantas aquáticas em uma lagoa de planície costeira no município de Candeias, Bahia, Brasil. Sitientibus (Série Ciências Biológicas), 6 (1): 24-29. [ Links ]
10. Diniz CR, Ceballos BSO de, Barbosa JEL, Konig A. 2005. Uso de macrófitas aquáticas como solução ecológicapara melhoria da qualidade de água. Revista Brasileira de Engenharia Agrícola e Ambiental, 9 (Suplemento): 226-230. [ Links ]
11. El-Gharably Z, Khattab AF, Dubbers FAA. 1982. Experience with grass carps for the control of aquatic weeds in irrigation canals in Egypt. Proceedings of the 2nd Internationatl Symposium on Herbivorous Fish. Wageningen (The Netherlands): EWRS. p. 17-26. [ Links ]
12. Esteves F. 1998. Fundamentos de limnología. 2.ª edición. Río de Janeiro (Brasil): Interciencia. p. 578. [ Links ]
13. Fontúrbel F. 2003. Algunos critérios biológicos sobre el proceso de eutrofización a orillas de seis localidades del lago Titikaka. Ecología Aplicada, 2 (1): 75-79. [ Links ]
14. García P, Fernández R, Cirujano S, Sousa A. 2006. Aquatic macrophytes in Doñana protected area (sw Spain): An overview. Limnética, 25 (1-2): 71-80. [ Links ]
15. Goulet R, Lalonde J, Munger C, Dupuis S, Dumont-Frenette G, Premont S, Campbell P. 2005. Phytoremediation of effluents from aluminum smelters: A study of Al retention in mesocosms containing aquatic plants. Water Research, 39: 2291-2300. [ Links ]
16. Hammer Ø, Harper D, Ryan P. 2001. PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica, 4 (1): 9. [ Links ]
17. Henry-Silva GG, Camargo A. 2006. Composição química de macrófitas aquáticas flutuantes utilizadas no tratamento de efluentes de aqüicultura. Planta Dañina (Viçosa, Brasil), 24 (1): 21-28. [ Links ]
18. Hutchinson G. 1975. A treatise on limnology. Vol. 3: Limnological Botany. New York (U. S. A.): John Wiley y Sons. p. 660. [ Links ]
19. IDEAM. 2008. Datos diarios de precipitación. Estación: 3701502, Berlín (Santander), Colombia. Bogotá (Colombia): IDEAM. [ Links ]
20. Jeppesen E, Søndergaard M, Jensen JP, Kanstrup E, Petersen B. 1997. Macrophytes and turbidity in brackish lakes, with special emphasis on the role of top-down control. En: Jeppesen E, Søndergaard M, Søndergaard M, Kristoffersen K, editores. The structuring role of submerged macrophytes in lake. New York (U. S. A.): Springer Verlag. p. 421. [ Links ]
21. Judd WS, Campbell CS, Kellogg EA, Stevens PF, Donoghue MJ. 2002. Plant systematics: a phylogenetic approach. Sunderland (U. S. A.): Sinauer Associates, Inc. p. 576. [ Links ]
22. Khedr A, El-Demerdash M. 1997. Distribution of aquatic plants in relation to environmental factors in the Nile Delta. Aquatic Botany, 56: 75-86. [ Links ]
23. Kiersh B, Mühleck R, Gunkel G. 2004. Las macrófitas de algunos lagos alto-andinos del Ecuador y su bajo potencial como bioindicadores de eutrofización. Revista de Biología Tropical, 52 (4): 829-837. [ Links ]
24. Kirk J. 1983. Light and photosyntesis in aquatic ecosystems. Nueva York (U. S. A.): Cambridge University Press. p. 662. [ Links ]
25. López-Arenas CD, Ramírez-Cadena J (compiladores). 2010. Glaciares, nieves y hielos de América Latina. Cambio climático y amenazas. Bogotá (Colombia): Instituto Colombiano de Geología y Minería (Ingeominas), Ministerio de Minas y Energía. p. 343. [ Links ]
26. Matos de CA, da Silva PL, Cezar MC, Hiroshi AF, Caetano A, Pains da SH. 2004. Presença de macrófitas aquáticas medicinais nas Baías Negra e Salobra, rio Paraguai, Cáceres, Pantanal Norte, Mato Grosso, Brasil. En: Anônimo. Informe derivado del IV Simposio sobre recursos naturais e sócio-económicos do Pantanal 2004. Sustentabilidade regional. Pantanal (Brasil): Empresa Brasileira de Pesquisa Agropecuária. p. 6. [ Links ]
27. Mazer G, Booth D, Ewing K. 2001. Limitation to vegetation establishment and growth in biofiltration swales. Ecology Engineering, 17 (4): 429-443. [ Links ]
28. Meerhoff M, Fosalba C, Bruzzone C, Mazzeo N, Noordoven W, Jeppesen E. 2006. An experimental study of habitat choice by Daphnia: plants signal danger more than refuge in subtropical lakes. Freshwater Biology, 51: 1320-1330. [ Links ]
29. Mendoza L, Orozco F. 2005. Inventario del recurso hídrico superficial y muestreo hidroquímico en la cuenca experimental del río Sucio, Tona, Santander [Trabajo de grado] [Santander (Colombia)]: Escuela de Ingeniería Civil, Universidad Industrial de Santander. p. xx. [ Links ]
30. Miglioranza K, de Moreno J, Moreno V. 2004. Organochlorine pesticides sequestered in the aquatic macrophyte Schoenoplectus californicus (C. A. Meyer) Soják from a shallow lake in Argentina. Water Research, 38: 1765-1772. [ Links ]
31. Miranda D, Rangel J, Roa L. 2002. Endemismo en páramos colombianos con base en la distribución de espermatófitos y el análisis de parsimonia de endemismo (PAE). En: Ange-Jaramillo C, Castaño-Uribe C, Durán CL. Memorias del Congreso Mundial de Páramos. Bogotá (Colombia): Ministerio del Ambiente. Tomo I: p. 253-266. [ Links ]
32. Møller T, Rørdam C. 1985. Species numbers of vascular plants in relation to area, isolation and age of ponds in Denmark. Oikos, 45: 8-16. [ Links ]
33. Moreno C. 2001. Métodos para medir la biodiversidad. M & T (Manuales y Tesis SEA), vol. 1. Zaragoza (España): Sociedad Entomológica Aragonesa (S. E. A.). p. 84. [ Links ]
34. Moreno J, Navarro C, De Las Heras J. 2006. Propuesta de un índice de vegetación acuática (IVAM) para la evaluación del estado trófico de los ríos de Castilla-La Mancha: comparación con otros índices biótico. Limnética, 25 (3-4): 211-228. [ Links ]
35. Mori SA, Silva LAM, Lisboa G, Corandin L. 1989. Manual de manejo do herbário fanerogâmico. Ilhéus (Bahía, Brasil): Centro de Pesquisas do Cacau. p. 103. [ Links ]
36. Nagasaki A, Yoshizawa K, Ariizumi K, Hirabayashi A. 2002. Temporal changes and vertical distribution of macrophytes in Lake Kawaguchi. Limnology, 3: 107-114. [ Links ]
37. Nasu Y, Kugimoto M. 1981. Lemna (duckweed) as an indicator of water pollution. I. The sensitivity of Lemna paucicostata to heavy metals. Archives Environmental Cotamination and Toxicology, 10: 159-169. [ Links ]
38. Osorio L, Salazar O. 2006. Cartografía geológica y caracterización estructural de la subcuenca del río Tona, macizo de Santander, con fines hidrológicos [Trabajo de grado]. [Santander (Colombia)]: Escuela de Geología, Universidad Industrial de Santander. p. xx. [ Links ]
39. Otáhélová H, Valachovic M. 2002. Effects of the gabcíkovo hydroelectric-station on the aquatic vegetation of the Danube river (Slovakia). Preslia (Praha), 74: 323-331. [ Links ]
40. Pedralli G. 1990. Macrófitos aquáticos: técnicas e métodos de estudos. Estudos de Biologia, 26: 5-24. [ Links ]
41. Petean C, Bragança A, Barbosa C, Barros R. 2003. Hidrófitas fanerogâmicas de ecossistemas aquáticos temporários da planície costeira do estado do Rio de Janeiro, Brasil. Acta Botánica Brasilera, 17 (1): 119-135. [ Links ]
42. Ramírez C, Figueroa H, Hauenstein E, Contreras D. 1989. Distribution of benthic flora in the lower course of the Valdivia River, Chile. Estuaries, 12 (2): 111-118. [ Links ]
43. Ramírez C, Godoy R, Contreras D, Stegmaier E. 1982. Guía de plantas acuáticas y palustres valdivianas. Valdivia (Chile): Facultad de Ciencias, Universidad Austral de Chile. p. 64. [ Links ]
44. Rangel-Ch JO. 2000. Colombia diversidad biótica III, la región de vida paramuna. Bogotá (Colombia): Universidad Nacional de Colombia, Unilibros, 2000. p. 902. [ Links ]
45. Rangel O, Aguirre J. 1983. Comunidades acuáticas altoandinas I. Vetegación sumergida y de ribera en el lago de Tota, Boyacá, Colombia. Caldasia, 13: 725-742. [ Links ]
46. Robinson B, Kim N, Marchetti M, Moni C, Schroeter L, Van Den Dijsse C, Milne G, Clothier B. 2006. Arsenic hyperaccumulation by aquatic macrophytes in the Taupo Volcanic Zone, New Zealand. Environmental and Experimental Botany, 58: 206-215. [ Links ]
47. Rodríguez D. 2004. Utilización de macrófitas acuáticas para la remoción de nutrientes y metales en aguas destinadas al consumo humano. Caso planta de tratamiento de Tibitoc [Tesis de maestría]. [Bogotá (Colombia)]: Universidad de los Andes. p. 134. [ Links ]
48. Rojas J, Novelo A. 1995. Flora y vegetación del lago Cuitzeo, Michoacán, México. Acta Botánica Mexicana, 31: 1-17. [ Links ]
49. Roldán G, Ramírez J. 2008. Fundamentos de limnología neotropical. 2.ª ed. Medellín: Editorial Universidad de Antioquia. p. 440. [ Links ]
50. Sánchez R, Rangel O, Aguirre J. 1990. Estudios ecológicos en la Cordillera Oriental. V. Análisis fitosociológico de los depósitos turbosos paramunos de los alrededores de Bogotá. Caldasia, 16 (6): 41-57. [ Links ]
51. Schierup H, Mjelde M, Bagger J. 2002. Aquatic macrophytes in Six Faroese Lakes. Annals Society Scientist Færoensis (Supplement), 36: 47-58. [ Links ]
52. Schmidt-Mumm U. 1987. Lista comentada de macrófitos acuáticos y palustres de la región de Barrancabermeja (Santander). Perez-Arbelaezia, 1 (4-5): 43-53. [ Links ]
53. Schmidt-Mumm, U. 1988a. Notas sobre la vegetación acuática de Colombia I: estructura. Revista de la Facultad de Ciencias Universidad Javeriana, 1 (2): 107-122. [ Links ]
54. Schmidt-Mumm, U. 1988b. Vegetación acuática y palustre de la parte alta de la hoya del río Namay (Albán, Cundinamarca). Pérez-Arbelaezia, 2 (6-7): 9-41. [ Links ]
55. Terneus E. 2002. Comunidades de plantas acuáticas de los páramos de norte y sur del Ecuador. Caldasia, 24 (2): 379-391. [ Links ]
56. Thomaz S, Dibble E, Evangelista L, Higuti J, Bini L. 2008. Influence of aquatic macrophyte habitat complexity on invertebrate abundance and richness in tropical lagoons. Freshwater Biology, 53: 358-367. [ Links ]
57. Vanegas D. 2004. Modelación matemática y evaluación del efecto del uso de macrófitas sobre la calidad de agua en la dársena del Tibitoc [Tesis de maestría]. [Bogotá (Colombia)]: Universidad de los Andes. p. 91. [ Links ]
58. Velásquez J. 1994. Plantas acuáticas vasculares de Venezuela. Caracas (Venezuela): Universidad Central de Venezuela. p. 990. [ Links ]
59. Veloza C, García I, Ortega C, Dávila R. 2000. Contribución al estudio taxonómico de los hidrófitos de la laguna Negra de la región de Taquecitos, Páramo de Sumapaz (Colombia). Actualidades Biológicas, 22 (73): 177-194. [ Links ]
60. Vestergaard O, Sand-Jensen K. 2000. Aquatic macrophyte richness in Danish lakes in relation to alkalinity, transparency, and lake area. Canadian Journal Fisheries and Aquatic Science, 57: 2022-2031. [ Links ]
ANEXOS