Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.33 no.94 Medellín Jan./June 2011
ARTÍCULOS DE INVESTIGACIÓN
CARACTERIZACIÓN GENOTÍPICA DE AISLAMIENTOS COLOMBIANOS DEL POTATO MOP-TOP VIRUS (PMTV, POMOVIRUS)
GENOTYPIC CHARACTERIZATION OF COLOMBIAN ISOLATES
OF POTATO MOP-TOP VIRUS (PMTV, POMOVIRUS)
José F. Gil1; Pablo A. Gutiérrez2; José M. Cotes3; Elena P. González4; Mauricio Marín5
1 Laboratorios de Biología Celular y Molecular y Microbiología Industrial. Escuela de Biociencias, Facultad de Ciencias. Universidad Nacional de Colombia (Sede Medellín). Medellín (Antioquia), Colombia. josefergil@gmail.com.
2 Laboratorios de Biología Celular y Molecular y Microbiología Industrial. Escuela de Biociencias, Facultad de Ciencias. Universidad Nacional de Colombia (Sede Medellín). Medellín (Antioquia), Colombia. paguties@unal.edu.co.
3 Departamento de Ciencias Agronómicas, Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia (Sede Medellín). Medellín (Antioquia), Colombia. jmcotes@unal.edu.co.
4 Laboratorio de Sanidad Vegetal, Facultad de Ciencias Agrarias. Politécnico Colombiano Jaime Isaza Cadavid. Medellín (Antioquia), Colombia. epgonzalez@elpoli.edu.co.
5 Laboratorios de Biología Celular y Molecular y Microbiología Industrial. Escuela de Biociencias, Facultad de Ciencias. Universidad Nacional de Colombia (Sede Medellín). Medellín (Antioquia), Colombia. mamarinm@unal.edu.co.
Recibido: octubre 2010; aceptado: abril 2011.
Resumen
Recientemente se detectó en Colombia la presencia del virus mop-top de la papa (PMTV, Pomovirus), transmitido por zoosporas del protozoo Spongospora subterranea f. sp. subterranea, agente causal de la sarna polvosa de la papa. Esta investigación se planteó con el fin de evaluar las características genotípicas de las cepas virales del PMTV obtenidas a partir de 20 muestras de suelos de cultivos de papa de los departamentos de Antioquia, Boyacá, Cundinamarca y Nariño. Para esto, se amplificaron mediante RT-PCR las regiones parciales que codifican para los genes de la cápside (CP) y del segundo gen del triple bloque de genes (TGB2), secuenciándose y comparándose con las secuencias de este virus depositadas en las bases de datos moleculares. Adicionalmente, se seleccionaron dos cepas del virus para aumentar el cubrimiento de las secuencias de los segmentos dos y tres (ARN 2 y ARN 3) del genoma viral. Los resultados reconfirmaron la presencia del virus PMTV en Colombia, detectándose dos variantes principales (I y II), una de ellas correspondiente al genotipo distribuido mundialmente (I); mientras que la otra variante (II) representa aislamientos virales de PMTV no registrados hasta ahora en otros países del mundo. Se espera que la información generada en esta investigación sea considerada en los programas de certificación de tubérculo semilla y del manejo cuarentenario de patógenos del cultivo de papa en el país.
Palabras clave: PMTV, RT-PCR, secuenciación, Spongospora subterranea f. sp. subterranea, variantes, virus
Abstract
Potato mop-top virus (PMTV, Pomovirus) was detected recently in Colombia. PMTV is transmitted by zoopores of the protozoan Spongospora subterranean f. sp. subterranea, the causal agent of powdery scab in potato. The goal of this study was to assess the genotypic characteristics of viral strains of PMTV obtained from 20 soil samples of potato crops in the departments of Antioquia, Boyacá, Cundinamarca, and Nariño. To do so, partial regions of the capsid gene (CP) and the second gen of the Triple Gene Block (TGB2) were amplified using RT-PCR. Amplicons were sequenced and compared with PMTV sequences deposited in molecular databases. In addition, we selected two strains of the virus to increase the coverage of sequencing in segments two and three (RNA 2 and RNA 3) of the viral genome. Our results reconfirmed the presence of PMTV in Colombia, with detection of two variants (I and II). One of them corresponds to the major genotype of PMTV reported worldwide (I); the second variant (II) corresponds to a PMTV strain not detected previously in other countries. We hope that this information will be useful to certification programs of eed tubers and plant quarantine management of potato pathogens in Colombia.
Key words: PMTV, RNA virus, potato virus, RT-PCR, sequencing, Spongospora subterranea f. sp. subterranea, variants
INTRODUCCIÓN
El virus mop-top de la papa [Potato mop-top virus, Pomovirus (PMTV)] ha sido registrado para diferentes lugares del mundo incluyendo el norte de Europa, China, Japón, Australia y el continente americano (Latvala-Kilby et al. 2009). En esta última región, su detección se ha realizado en Estados Unidos y Canadá (Johnson 2009, Lambert et al. 2003, Xu et al. 2004), Costa Rica (Vásquez et al. 2006), Perú y Bolivia (Tenorio et al. 2006) y en Venezuela (Ortega y Rodríguez 2004).
En Colombia, la presencia del PMTV solo ha sido comunicada recientemente en cultivos de papa (Solanum tuberosum) de Cundinamarca y Boyacá (Vélez 2007), a pesar de que su vector, el protozoo plasmodiofórido Spongospora subterranea f. sp. subterranea (Sss), agente causal de la sarna polvosa de la papa, ha tenido presencia generalizada en el país (Carreño, 2009).
El PMTV puede causar pérdidas estimadas de hasta 25% en rendimiento de cultivos de papa, lo que sumándose al efecto del daño ocasionado por su vector Sss, puede ascender a valores de 50-80% (Guerrero 1997, 2000, Jones y Harrison 1972). Según Salazar (2006), el PMTV es uno de los virus que ha sido prevalente en el cultivo de la papa en los Andes sudamericanos, pero cuyo efecto sobre el rendimiento del cultivo no se ha establecido claramente en esta zona. La enfermedad inducida por PMTV presenta amplia gama de síntomas dependiendo de la variedad de papa cultivada, que incluyen amarillamiento foliar, anillos necróticos y cuarteamiento o agrietamiento de tubérculos y moteados foliares tipo ''Aucuba'' (Salazar 1995, Sokmen et al. 1998, Xu et al. 2004). En las variedades cultivadas en los Andes estos síntomas no son evidentes, y en su su lugar se presentan amarillamientos foliares, enanismo y acortamiento de entrenudos (Sa-lazar 1995). En Colombia, no ha sido posible identificar con exactitud la sintomatología que induce PMTV en los cultivos de papa, pudiéndose confundir con desórdenes fisiológicos o afecciones de otros patógenos, incluyendo las razas N y NTN del virus mosaico severo de la papa (Potato Virus Y, PVY), perteneciente a la familia Potyviridae (Vélez, 2007).
El PMTV pertenece al género Pomovirus y a la familia Virgaviridae, que comparte con las especies Beet soil-borne virus (BSBV), Beet virus Q (BVQ) y Broad bean necrosis virus (BBNV). BSBV y BVQ son transmitidos por Polymyxa betae (Meunier et al. 2003), mientras que BBNV es transmitido por Polymyxa graminis (Deacon 2010); todos estos patógenos habitantes del suelo. Los virus de este género poseen viriones con simetría helicoidal cuyas longitudes varían de 60 a 310 nm (Büchen-Osmond 2010), además que difieren en su rango de hospederos, vectores, morfología de los cuerpos de inclusión en tejidos, relaciones serológicas y componentes del genoma, particularmente la presencia o ausencia del gen CRP (gen que codifica para una proteína rica en cisteína) (Büchen-Osmond 2010).
El virus PMTV posee un genoma tripartita con tamaños de 6.043 nt (ARN 1), 3.134 nt (ARN 2) y 2.964 nt (ARN 3) (accesiones de GenBank: NC003723, NC003724 y NC003725, respectivamente). Su virión consiste en tres partículas elongadas con simetría helicoidal en forma de bastón, con longitudes de 100 a 150 nm y 250 a 300 nm, y diámetro de 18 a 20 nm (Büchen-Osmond 2010). El ARN1 tiene dos ORF, el primero codifica para una proteína de 149 kDa y el segundo de 206 kDa, ambas asociadas con la replicación del virus (incluyendo la polimerasa RdRp); en este ARN se presenta una estrategia de traducción de supresión del codón de parada. En las proteínas de dicho ARN se han detectado además dominios de metiltransferasa y helicasa (Savenkov et al. 1999). El ARN 2 tiene una estrategia genética similar al anterior, con dos ORF que codifican para la CP y para una proteína generada por supresión del codón de parada denominada CP2 o CPRT. El ARN 3 codifica para TGB (Triple Gene Block) y para CRP, generalmente también nombrada como 8K y que aparentemente está relacionada con la inducción de síntomas del virus en las plantas infectadas (Latvala-Kilby et al. 2009, Savenkov et al. 2003).
El PMTV es una especie que para su movimiento sistémico en la planta hospedante no requiere la expresión de CP, ni de la formación del virión (McGeachy y Barker 2000), debido a que el TGB le ofrece la posibilidad de mover el ARN infeccioso a través de la planta (Melander et al. 2001). Dicho ARN desnudo se puede encontrar en tubérculos asintomáticos y causar una infección secundaria para la siguiente temporada de siembra (McGeachy y Barker 2000). La manifestación de los síntomas característicos de la enfermedad depende de la presencia de los tres ARN en el tejido (Savenkov et al. 2003).
El PMTV es transmitido de forma persistente y muy específica por Sss, que posee unas estructuras de resistencia denominadas quistosoros, que pueden sobrevivir en el suelo en forma latente durante largos periodos de tiempo. El patógeno inicia su infección cuando los quistosoros liberan las zoosporas primarias, las cuales se adhieren a los pelos radicales de la planta y comienzan la fase de penetración. Una vez dentro de las raíces de la planta, el patógeno forma un plasmodio primario multinucleado con una delgada membrana que posteriormente se convierte en un zooesporangio, que produce zoosporas secundarias. Ambos tipos de zoosporas pueden transmitir el PMTV (Merz y Fallon 2009). Bajo condiciones experimentales el virus puede infectar plantas de las familias Chenopodiaceae, Solanaceae y Tetragoniaceae. Entre estas se encuentran Nicotiana debneyi y Chenopodium amaranticolor, en las que el virus induce necrosis sistémica y lesiones locales concéntricas cafés, respectivamente (Büchen-Osmond 2010).
También se ha observado que el PMTV es transmitido eficientemente a plantas indicadoras como. Nicotiana tabacum y N. benthamiana, a partir de muestras de suelo infestadas con quistes de Sss (Campbell 1996, Vélez 2007). Incluso se ha diseñado un ensayo de detección de Sss y de su virus asociado PMTV utilizando dichas especies vegetales, gracias a su abundante sistema radicular, permisividad para el movimiento del PMTV por los haces vasculares y mayores niveles de título viral (Sjöberg 2006).
Ya que el problema de la sarna polvosa de la papa causado por Sss se ha expandido dramáticamente en los últimos años en las principales regiones donde se cultiva papa en Colombia (Carreño 2009, Gilchrist et al. 2009, Jaramillo y Botero 2007), es posible que paralelamente la infección por PMTV también se encuentre en aumento.
Esta investigación se planteó con el objetivo de evaluar las características genotípicas del PMTV en las principales regiones cultivadoras de papa de los departamentos de Antioquia, Cundinamarca, Boyacá y Nariño, mediante análisis de secuencias de la región que codifica para CP y TGB2. Adicionalmente, se realizó una estrategia de minado de cebadores de los segmentos ARN 2 y 3 del genoma de este virus, con el fin de aumentar la información disponible de las secuencias de este virus en el mundo.
MATERIALES Y MÉTODOS
Localización. Esta investigación se desarrolló en el Laboratorio de ''Biología celular y Molecular'', Universidad Nacional de Colombia (Sede Medellín) y el Laboratorio de ''Sanidad vegetal'', Politécnico Colombiano Jaime Isaza Cadavid. Las muestras de plantas de papa, de tubérculos con síntomas de sarna polvosa y de suelos, fueron obtenidas en los principales municipios cultivadores de los departamentos colombianos de Antioquia (zona 1: La Unión, Sonsón; zona 2: Santuario, Marinilla, Carmen de Víboral; zona 3: Santa Rosa de Osos), Cundinamarca (zona 4: Zipaquirá; zona 5: Villa Pinzón; zona 6: Madrid, Cota), Boyacá (zona 7: Turmequé, Ventaquemada; zona 8: Siachoque) y Nariño (zona 9: Pasto; zona 10: Ipiales). Las plantas utilizadas para la detección de PMTV a partir de muestras de suelo infestadas con quistosoros de Sss, fueron mantenidas en casas malla en el Centro Experimental Paysandú, ubicado en el corregimiento Santa Elena, municipio de Medellín (Antioquia).
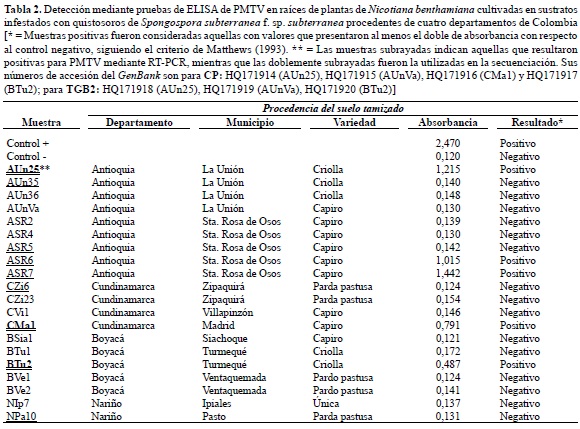
Detección del PMTV en cultivos de papa afectados por Sss. En cada una de las diez zonas, se ubicó al menos un cultivo afectado por sarna polvosa, tomándose una muestra de raíces y tubérculos sintomáticos, además de una muestra de suelo de 1 kg, para un total de 20 muestras bajo estudio. Las muestras de tejidos sintomáticos (raíces y tubérculos) fueron utilizadas para la detección de PMTV directamente mediante una prueba de DAS-ELISA (Double Antibody Sandwich) de la compañía Bioreba (Reinach, Suiza), utilizando anticuerpos monoclonales y su detección con anticuerpos conjugados a la enzima fosfatasa alcalina, siguiendo las instrucciones del fabricante. Por otra parte, las muestras de suelos fueron tamizadas para la extracción de quistosoros siguiendo la metodología de Jaramillo y Botero (2007), en la cual se utiliza un juego de tamices de 25 y 90 μm. Una vez realizado este procedimiento, se tomaron 5 g del material retenido en el tamiz de 25 μm (suelo y quistosoros) para realizar su inoculación en macetas de 250 g de capacidad con turba como sustrato; trasplantándose plantas de N. benthamiana con 2-3 pares de hojas verdaderas, utilizadas como señuelo, siguiendo la metodología de Vélez (2007). Tres meses después de la siembra se tomaron muestras de raíces para el diagnóstico de PMTV mediante pruebas de DAS-ELISA y RT-PCR (Reverse Transcriptase PCR).
Análisis filogenético de regiones del genoma de PMTV codificantes para la cápside y TGB.El ARN molde necesario para desarrollar la técnica de RT-PCR se obtuvo a partir de extracciones de ARN total de tejido foliar de papa, agallas de raíces y tubérculos con sarna polvosa, colectados en cada una de las zonas bajo estudio, mediante el RNeasy plant mini kit (Qiagen, California, EE. UU.). También se evaluaron las raíces de plantas de N. benthamiana mantenidas en suelos infestados con quistosoros de Sss. Para este procedimiento se maceraron 100 mg de tejido vegetal, utilizando 450 μl de buffer RLT (para tejido foliar) o RLC (para raíces y tubérculos) y 4,5 μl de β-mercaptoetanol, siguiendo las instrucciones del fabricante, pero con dos centrifugaciones consecutivas en la etapa de lavado del ARN. Al finalizar el procedimiento, el ARN obtenido fue resuspendido en 40 μl de agua destilada estéril tratada con DEPC.
Para aquellas muestras en las que no fue posible la obtención de amplicones utilizando la extracción del ARN total, se realizó la transcripción reversa a partir de liberación post-ELISA, siguiendo el procedimiento de inmunocaptura propuesto por Harju et al. (2005). Brevemente, una vez concluida la prueba de ELISA, se remueve el sustrato mediante tres lavados por 1 min con PBS-T (PBS suplementado con 0,05% Tween 20) y las partículas virales fueron liberadas con buffer-R (10 mM Tris-HCl, pH 8,0 con 1% de Triton X-100) bajo incubación a 70 °C por 10 min. La solución resultante se almacenó a -20 °C hasta su uso directo en la retrotranscripción.
Las reacciones de RT-PCR se realizaron en dos pasos. Para esto se utilizaron cebadores específicos para el gen de la cápside de PMTV (C819: 5' CTATGC ACC AGC CCA GCG TAA CC 3' y H360: 5' CAT GAA GGC TGC CGT GAG GAA GT 3') (Mackenzie 1996) y del TGB (PMTVF4: 5' CAG CAA CCA CAAACA GAC AGG 3' y PMTVR4: 5' AGC CAC TAA CAA AAC ATACTGC-3') (Xu et al. 2004). La retrotranscripción se realizó en un volumen de 20 µl, incluyendo 1,9 µl de agua, 1X de buffer RT, 5 mM de MgCl2, 1 mM de dNTPs, 0,5 µM de cebador reverso, 4 U de inhibidor de RNasa, 40 U de enzima M-MuLV Transcriptasa Reversa (Fermentas, Lituania) y 5 µl de ARN o alternativamente una dilución 1:5. El programa consistió en 37 °C por 60 min, 75 °C por 15 min, y finalmente las muestras fueron mantenidas a 4 °C hasta su uso en el PCR posterior. Las reacciones de PCR se realizaron en un volumen de 25 µl con 16,2 µl de agua, 1X de buffer de enzima, 1,8 mM de MgCl2, 0,2 mM de dNTPs, 0,2 µM de cada cebador, 1 U de Taq ADN polimerasa (Fermentas) y 2,5 µl de ADNc, aunque en algunas ocasiones fue necesario preparar diluciones de 1:5 y 1:10 de ADNc. El programa de PCR consistió en 95 °C por 30 s, seguido de 40 ciclos de 95 °C por 30 s, 56 °C por 45 s, 72 °C por 1 min y una extensión final a 72 °C por 5 min.
Los productos amplificados fueron separados por electroforesis en gel de agarosa al 1,5% suplementado con 4 μl de bromuro de etidio (10 mg/ml), visualizados utilizando un transiluminador UV (Biometra, Göttingen, Alemania) y su tamaño verificado por comparación con el marcador de peso molecular Generuler 100 pb DNA ladder (Fermentas). Los amplicones del tamaño esperado para las dos regiones, fueron purificados directamente del gel mediante el kit QIAquick Gel Extraction (Qiagen), para proceder a su secuenciación en ambos sentidos utilizando los mismos cebadores del RT-PCR en un secuenciador ABI Prism 3730xl (PE Applied Biosystems) de la compañía Macrogen (Corea del Sur).
Las secuencias obtenidas con cada cebador fueron editadas mediante los software BioEdit 6.0.6 y Chromas 1.45, construyéndose secuencias consenso y confirmándose su identidad con genes virales por comparación con las bases de datos moleculares, con el programa BLASTn (http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi). Esta información sirvió de base para realizar el análisis de las relaciones filogenéticas de las cepas de PMTV encontradas y aquellas de otras regiones del mundo, cuyas secuencias están registradas en las bases de datos moleculares. Para esto se alinearon las secuencias mediante Clustal W en el programa Bioedit 6.0.6 y la matriz generada fue utilizada para obtener un árbol filogenético basado en máxima parsimonia utilizando la opción Heuristic search del programa PAUP 4.0b, asumiendo los espacios (gaps) como nucleótidos eliminados (missing value) y la orden treebisection reconnection (TBR) (Swofford 1998). El soporte de la topología interna de los dendrogramas fue determinado por análisis de bootstrap con 1.000 remuestreos (Felsenstein 1985).
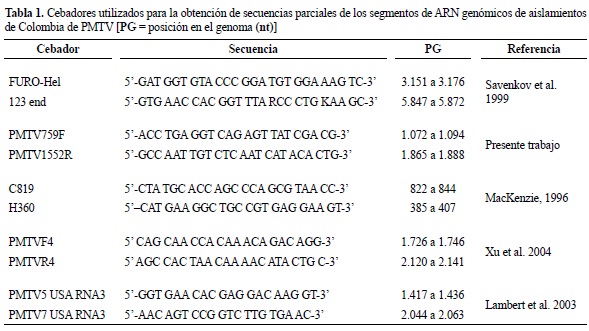
Secuencias parciales del genoma viral de PMTV. Con el fin de obtener mayor nivel de información sobre las características de los genomas del virus PMTV en Colombia, se evaluaron múltiples cebadores dirigidos a otras regiones del genoma, diferentes a las utilizadas en el análisis filogenético, empleándose para ello los cebadores dirigidos al ARN1 (RdRP) FURO-Hel – 123end; ARN 2 (CP): C810-H360, H360PMTV2017R, PMTV759F-PMTV1552R, PMTV1948F-123end y para el ARN 3 (TGB): PMTVF4-PMTVR4, PMTV5USARNA3PMTV7USARNA3 y PMTVF4- 123end (tabla 1). Para esto se siguieron los procedimientos de extracción de ARN, RT-PCR y secuenciación descritos anteriormente, pero utilizando los aislamientos AUn25 y AUnVa, obtenidos del municipio de La Unión (Antioquia), seleccionados por la alta disponibilidad de inóculo de Sss para las pruebas de transmisión en plantas de N. benthamiama.
Para realizar el ensamblaje de los genomas parciales, las secuencias se editaron mediante el software Chromas 1.45, generándose los consensos con ambos cebadores usando Bioedit. Posteriormente, se verificó el marco de lectura correcto utilizando el servidor de Expasy (http://www.expasy.ch/tools/dna.html) y se procedió a su alineamiento con respecto a los genomas completos disponibles en el GenBank para cada uno de los segmentos analizados. Las regiones alineadas fueron seleccionadas para evaluar sus niveles de identidad en nucleótidos y aminoácidos con la herramienta de matriz de identidad del programa Bioedit. Con las secuencias disponibles para cada aislamiento viral, se generó un ensamble en contigs mediante la herramienta ContigExpress del software vector NTI (versión 11.0 Invitrogen). Finalmente, aquellas secuencias genómicas que presentaron mayores niveles de identidad con respecto a las secuencias ensambladas de las cepas nativas, fueron utilizados como base de referencia para realizar diagramas de su ubicación en el contexto genómico, mediante el software Vector NTI.
RESULTADOS
Detección del PMTV en cultivos de papa afectados por Sss. De cada una de las zonas estudiadas se obtuvo al menos una muestra de raíces con agallas, tubérculos con pústulas de sarna polvosa o suelo de lotes con historia previa de infección de Sss. La detección mediante DAS-ELISA del virus PMTV a partir de muestras foliares de papa no arrojó resultados positivos para ninguna de las muestras evaluadas para raíces y tubérculos con sarna polvosa; aunque sí en los controles positivos del kit de Bioreba. Sin embargo, esta situación cambió al evaluar las raíces de plantas de N. benthamiana cultivadas en macetas con turba e inoculadas con quistosoros de Sss. En total se evaluaron las raíces de plantas procedentes de sustratos infestados con 20 muestras diferentes de Sss (figura 1), encontrándose que tres muestras de Antioquia, una de Cundinamarca y una de Boyacá fueron positivas en las pruebas de ELISA (tabla 2).
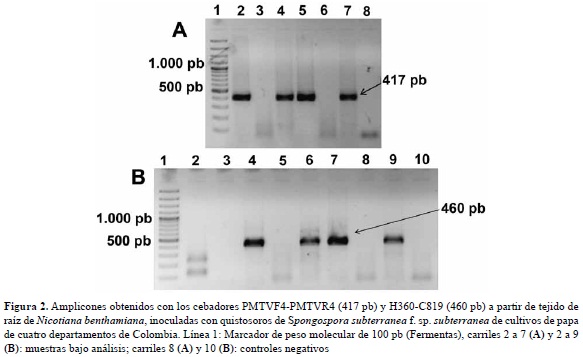
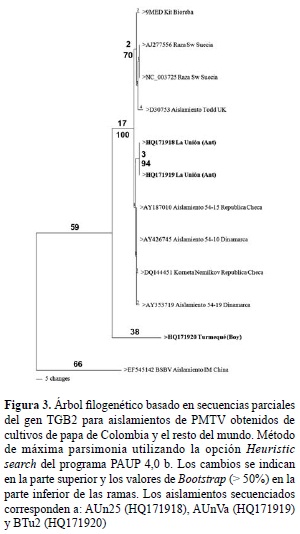
Análisis filogenético de regiones del genoma de PMTV codificantes para la cápside y TGB. Las pruebas de RT-PCR produjeron amplicones del tamaño esperado de ~417 pb (para TGB con cebadores PMTVF4 y PMTVR4) y de ~460 pb (para CP con cebadores H360 y C819) para 10 aislamientos en total (figura 2, tabla 2). El análisis filogenético para el primer par de cebadores se realizó empleando tres secuencias de este virus procedentes de cultivos de papa de Colombia, una secuencia obtenida por inmunocaptura post-ELISA del control positivo del kit de Bioreba y siete secuencias de referencia obtenidas del GenBank de cepas de PMTV de diferentes orígenes geográficos. Los resultados indicaron niveles de identidad para la región TGB2 superiores al 97% entre los aislamientos colombianos; siendo la excepción la cepa BTu2 (Turmequé, Boyacá), que presentó niveles de identidad inferiores al 86% con respecto a las cepas colombianas y a las de referencia mundial. El nivel de identidad de la secuencia utilizada como grupo externo Beet soil-borne virus (BSBV) con relación a las demás fue inferior al 67%. El análisis filogenético para TGB2, utilizó 424 posiciones, 256 de las cuales resultaron constantes, 148 variables pero no informativas y 20 informativas para el método de máxima parsimonia. El dendrograma presentó un índice de consistencia (CI) de 0,97, índice de retención (RI) de 0,82 y un índice de homoplasia (HI) de 0,03 y agrupó las cepas de PMTV en estudio con las de referencia en un clado soportado por un valor bootstrap de 100%. Dentro de este clado se ubicaron dos grupos soportados por valores de boostrap superiores al 70%, el primer grupo incluyó el aislamiento correspondiente al post-ELISA del kit Bioreba con cepas de Suecia y Reino Unido, mientras que el segundo agrupó dos de las cepas colombianas (AUn25 y AUnVa) con cepas de Dinamarca y República Checa. Por otro lado, la cepa BTu2 se localizó por fuera del clado, no soportado por el análisis bootstrap (figura 3).
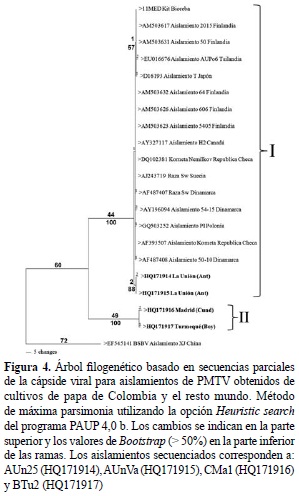
Para la región CP, el análisis se realizó empleando cuatro secuencias de este virus procedentes de cultivos de papa de Colombia, una secuencia obtenida por inmunocaptura post-ELISA del control positivo del kit de Bioreba y 15 secuencias de referencia obtenidas del GenBank de cepas de PMTV representando diferentes orígenes geográficos. Dicho análisis indicó niveles de identidad para la región CP superiores al 98%; con excepción de los aislamientos CMa1 (Madrid, Cundinamarca) y BTu2 (Turmequé, Boyacá), los cuales presentaron niveles inferiores al 76% respecto a las otras cepas colombianas y a las de referencia. El nivel de identidad de la secuencia utilizada como grupo externo Beet soil-borne virus (BSBV) con relación a las demás cepas, fue inferior al 59%. El análisis filogenético utilizó 406 posiciones, 200 de las cuales resultaron constantes, 109 variables pero no informativas y 97 informativas para el método de máxima parsimonia. El dendrograma presentó un CI de 0,99, RI de 0,98 y HI de 0,01 y agrupó las cepas de PMTV en estudio en dos clados (I y II) soportados por valores de bootstrap del 100%. En el primer clado (I) se agruparon las cepas AUn25 y AUnVa (La Unión, Antioquia) junto con todas las cepas de referencia, mientras que en el segundo clado (II) se agruparon las cepas colombianas CMa1 y BTu2 procedentes del altiplano cundiboyacense (figura 4).
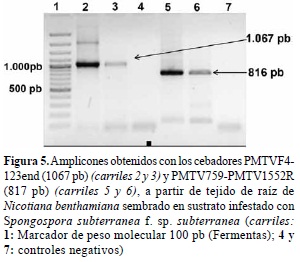
Secuencias parciales del genoma viral de PMTV. Para la amplificación de otras regiones del genoma del virus PMTV, se seleccionaron dos aislamientos (AUn25 y AUnVa) del municipio de La Unión (Antioquia), debido a la alta disponibilidad de quistosoros en las muestras de suelo originales. Se realizaron las reacciones de RT-PCR como se indicó anteriormente. Los cebadores dirigidos al ARN1 (RdRP) FUROHel-123end, no arrojaron los resultados esperados para las cepas evaluadas en este estudio, ya que las secuencias obtenidas de ~2.800 pb no estuvieron relacionadas con el genoma de PMTV y correspondieron al genoma del hospedante; sin embargo para los ARN1 y 2 sí fue posible la obtención de los amplicones del tamaño esperado (figura 5).
El ensamblaje de las secuencias para cada ARN obtenido, se realizó con relación a los genomas completos de PMTV de diferentes orígenes geográficos. Así, para el aislamiento AUn25 se encontraron identidades superiores al 98% en la secuencia de nucleótidos para el fragmento de CP (ARN2) hacia el extremo 5', e identidades del 99% cuando se empleó la secuencia de aminoácidos. Para el fragmento de CP hacia el extremo 3' y con respecto al genoma de referencia (NC_003724), se encontraron identidades superiores al 97% para nucleótidos y de 95% cuando se usaron aminoácidos en las comparaciones (figura 6).
Para la misma cepa, las secuencias obtenidas para la región TGB (ARN 3) se compararon con cinco secuencias completas del GenBank, presentándose identidades superiores al 97% con respecto a los genomas de referencia en nucleótidos y del 94% para aminoácidos. La secuencia comparada corresponde a un fragmento parcial de TGB1, TGB2, TGB3 y CRP.
Para el caso de la región CP de la cepa AUnVa de PMTV, se obtuvieron dos fragmentos de tamaños menores a los alcanzados para la cepa AUn25, que abarcaron además la región CPRT hacia el centro del genoma (ensamblaje no presentado). El análisis se realizó utilizando las mismas secuencias genómicas de referencia que se emplearon para AUn25, e indicó para el primer fragmento (CP), identidades del 99% en las secuencias de nucleótidos y 100% para aminoácidos. Para el segundo fragmento (CPRT y 3' UTR) las identidades para las secuencias de nucleótidos fueron del 98%, mientras que para aminoácidos fueron superiores al 97%.
Para el análisis de la región TGB de la cepa AUnVa, se evaluaron además cinco cepas de referencia que contenían la porción del genoma comprendida entre TGB1 parcial a CRP (ensamblaje no presentado). El análisis de dichas secuencias demostró identidades superiores al 97% para nucleótidos y del 94% para aminoácidos. Las secuencias de ambos aislamientos fueron depositadas en el GenBank bajo los números de accesión: HQ285251, HQ285252, HQ335255, HQ335256 y HQ335257.
DISCUSIÓN
La papa es el cuarto cultivo de producción mundial luego del arroz, maíz y trigo, que provee la subsistencia básica a personas de diferentes continentes y es considerado por algunas sociedades como el segundo pan (Secor y Rivera-Varas 2004). Este cultivo es afectado por un sinnúmero de patógenos, entre los cuales se destacan los virus. Dichos patógenos se han venido reportando regularmente en los cultivos de papa del país, incluyendo PVY, PLRV, PVX, PVS, PYVV (Gil et al. 2009, Guzmán et al. 2004, Zapata 2004) y PMTV. Este último fue registrado recientemente por Vélez (2007) en los municipios de Subachoque, Zipaquirá (Cundinamarca) y Ventaquemada (Boyacá), en cultivos con alta severidad de sarna polvosa.
La literatura describe que la sintomatología inducida por PMTV en papa incluye moteados amarillos y mosaicos en las hojas nuevas, al igual que zonas cloróticas en forma de V y con tipo ''aucuba'' y acortamiento de entrenudos hacia los brotes (síntoma del que proviene el nombre de mop-top). Los síntomas en las hojas parecen estar presentes solo en climas muy fríos y cuando el tubérculo semilla ha sido infectado con anterioridad. En algunas variedades, los tubérculos desarrollan anillos necróticos concéntricos en la superficie o en su interior, síntoma conocido como ''Spraing'' (Harrison y Reavy 2002). Partiendo de este precedente, las colecciones en campo realizadas en nuestro trabajo, estuvieron dirigidas a la consecución de plantas con dichos síntomas, especialmente en los sitios más altos de las zonas evaluadas. Aunque se encontraron plantas con síntomas que podrían asemejarse a los registrados para mop-top, como moteados tipo ''aucuba'', manchas cloróticas en V y anillos necróticos en tubérculos, no fue posible detectar este virus mediante ELISA o RT-PCR a partir de tejido de papa, ni en raíces o tubérculos afectados por Sss. Esta situación, aunque no deseada, no resultó inesperada, por cuanto diversos estudios en el mundo (Sokmen et al. 1998, Xu et al. 2004) y en Colombia (Vélez 2007) han demostrado que PMTV se presenta en forma esporádica y con una distribución altamente irregular en las plantas de papa. Adicionalmente, los cebadores y anticuerpos utilizados en el trabajo, al ser diseñados fundamentalmente con base en la información de aislamientos de PMTV de la zona templada, pueden conducir a falsos negativos, pues no contemplan el rango de variación de dicho virus en la región Andina, lo cual claramente ocurrió en este trabajo, al encontrarse una variante del virus presentando niveles de identidad en el gen CP inferiores al 76% con respecto al genotipo mundialmente señalado para este virus. Lo anterior, sumado a los bajos niveles de título viral que generalmente se presentan en materiales tolerantes a su infección, representa obstáculos para el diagnóstico efectivo de PMTV, que deben ser superados con estudios como el presente, que profundizan en las características genotípicas de las cepas locales de este virus.
Debido a lo anterior, se decidió evaluar la presencia del PMTV a partir de plantas señuelo de N. benthamiana, siguiendo los registros exitosos planteados por Sjöberg (2006) y Vélez (2007). De esta forma, se diagnosticó la ocurrencia del virus en al menos una muestra de los cuatro departamentos evaluados; aunque dicho procedimiento resulta muy ineficiente al requerirse un periodo de al menos dos meses. Por esta razón, persiste la necesidad de desarrollar metodologías de detección de PMTV altamente sensibles y específicas basadas en los genoma de las variantes presentes en el país y que sirvan para su utilización directa en plantas de papa, de manera que sea posible evaluar los niveles de incidencia de PMTV en las diferentes regiones cultivadoras de papa del país y su efecto en la degeneración del tubérculo semilla y en la producción; lo cual de resultar significativo, sería muy grave al adicionar este problema al causado por Sss, su agente vector, que en nuestro medio puede ocasionar reducciones en rendimiento hasta del 40% (Gilchrist et al. 2009).
El análisis filogenético realizado a partir de las secuencias parciales de los genes CP y TGB2, con cebadores utilizados por Vélez (2007), indicó la presencia de al menos dos variantes principales de PMTV en el país. Para el caso del análisis del gen CP, dos de las cuatro secuencias de cepas colombianas (AUn25 y AUnVa), se agruparon en el mismo clado con las secuencias de referencia de PMTV de otros países y compartiendo identidades superiores al 98%, mientras que las otras dos cepas (CMa1 y BTu2) se ubicaron en un clado independiente y con bajos niveles de identidad con respecto al clado I (~76%). Esta situación ya había sido registrada por Vélez (2007), al encontrar que algunos aislamientos colombianos de PMTV presentaban identidades cercanas al 80% en la secuencia de nucleótidos que codifica para la región de CP con relación a las cepas cuyas secuencias se encontraban disponibles en las bases de datos moleculares. Desafortunadamente, las secuencias obtenidas por Vélez (2007) no fueron depositadas en el GenBank, imposibilitándose la comparación directa con los resultados de nuestra investigación.
Con respecto a las secuencias obtenidas de la región TGB2, se obtuvieron niveles de identidad para nucleótidos superiores al 97% para dos de las tres cepas colombianas, mientras que la restante (BTu2) presentó identidades cercanas al 86%. Como es de notar, las dos cepas que mostraron marcada diferencia respecto a las demás para la región CP y esta última descrita para la región TGB2, fueron procedentes de la sabana cundiboyacense, lo que permite suponer que en dicha zona concurren ambos tipos de variantes. Sin embargo, el bajo número de cepas de PMTV detectadas en otras regiones como Nariño y Antioquia, no permite excluir la posibilidad de que en estos departamentos estén igualmente presentes dichas variantes o incluso que se presenten otros genotipos no detectados en esta investigación. Lo anterior indica que el grado de variación que presenta el virus PMTV en Colombia, para las regiones del genoma evaluadas es alto y permite plantear la posibilidad de que las cepas disimilares con las secuencias de referencia mundial del PMTV, correspondan a una especie viral diferente del género Pomovirus, por cuanto Adams et al. (2009) al proponer recientemente la constitución de la nueva familia viral Virgaviridae, indican que el criterio principal para discriminar las especies dentro del género Pomovirus (uno de sus géneros miembro), es la ocurrencia de identidades inferiores al 80 y 90% para la secuencia completa del genoma y para el gen CP, respectivamente. De esta manera en trabajos futuros es fundamental considerar el análisis completo del genoma y realizar estudios epidemiológicos que evalúen el efecto de dicha variante sobre la transmisión por Sss del virus, sus niveles de virulencia en diferentes variedades de papa y su distribución al interior de la planta.
Diversos trabajos de variabilidad genética del PMTV se han realizado en el mundo, especialmente en la Península Escandinava, Escocia, Norteamérica y Perú. Nielsen y Nicolaisen (2003) informaron la presencia en Dinamarca de dos variantes de PMTV basados en análisis de las secuencias de CP, encontrando que estos compartían 98% de identidad, pero con diferencias notables en la reproducción de síntomas en plantas indicadoras. Una situación similar fue encontrada por Mayo et al. (1996) al comparar las secuencias de CP de ocho aislamientos de PMTV obtenidos en los Andes peruanos y tres procedentes de Escocia. Por otra parte, Xu et al. (2004) comunicaron la presencia del virus en EE. UU. y Canadá, con altos niveles de identidad respecto a los aislamientos registrados hasta ese momento en Perú y Europa. En dicho trabajo se confirmó la distribución errática del virus en la planta y se planteó la necesidad de tomar muestras de distintas partes de un mismo tubérculo para aumentar la probabilidad de detectar el virus. Más recientemente, Latvala-Kilby et al. (2009) realizaron un estudio de la variabilidad genética de 37 aislamientos de PMTV de Finlandia y Latvia a partir de la secuenciación de CP y CPRT (CP con lectura continua) del ARN 2 y del gen 8K del ARN 3, con la presencia de dos clases de genotipos tanto para el ARN 2 como 3, los cuales fueron diferenciados mediante análisis de RFLP, siendo los restrictotipos ARN 2-II y ARN 3-B los predominantes en la población evaluada. Sin embargo, al comparar los niveles de identidad entre las secuencias de las tres regiones estudiadas con secuencias depositadas en el GenBank, se encontraron niveles de identidad superiores al 96% en todos los casos. Estos resultados contrastan con lo encontrado en la presente investigación, reafirmándose la necesidad de profundizar en la secuenciación del genoma completo de las variantes de PMTV detectadas en Colombia.
Un aspecto adicional que debe ser considerado en futuros trabajos, corresponde a la relación entre los genotipos de PMTV y la variabilidad encontrada en Colombia entre aislamientos de Sss por Carreño (2009). En dicho estudio, mediante análisis de secuencias y de SSCP de la región ITS del ADNr de Sss, se determinó la presencia de hasta cinco haplotipos del patógeno y fue posible la separación de los aislamientos en dos grupos de acuerdo con el tejido de donde este fue obtenido (tubérculo o raíz). La relación entre las diferencias encontradas entre las poblaciones de ambos patógenos son de interés debido a que es CP y más específicamente CPRT, la proteína relacionada con la transmisión del virus por dicho plasmodiofórido, según lo observado por Reavy et al. (1998), quienes encontraron que el aislamiento PMTV-T, que carece de un fragmento representativo de secuencia en el ARN 2, no puede ser transmitido por Sss, pero sí mediante inoculación mecánica. Esta situación aparentemente se debe a la deleción de una porción de la región CPRT del ARN 2 del virus (Sandgren et al. 2001).
La contextualización en el genoma viral de las secuencias adicionales obtenidas en cepas de PMTV del departamento de Antioquia, reafirmó que se tratan de aislamientos representativos del genoma ordinario de PMTV y no de los genotipos diferentes encontrados en el análisis filogenético. Sus identidades para las porciones secuenciadas del ARN 2 y ARN 3 fueron altas (> 97%) con respecto a los genomas informados en trabajos anteriores (Cerovska et al. 2007, Sandgren et al. 2001). Este resultado contribuye al aumento del número de secuencias disponibles de PMTV en las bases de datos moleculares, aspecto fundamental para el desarrollo de herramientas de diagnóstico viral de amplia cobertura, pues aumenta la efectividad del diseño de los cebadores, sondas e incluso de los anticuerpos obtenidos a partir de la utilización de proteínas recombinantes y péptidos virales como determinantes antigénicos.
Los resultados encontrados hasta el momento en Colombia sobre Sss y PMTV permiten plantear que la situación de estos patógenos en los cultivos de papa de Colombia es singular, dada la presencia de al menos dos variantes genéticas de PMTV, de los altos niveles de afección que causa Sss en los cultivos y de las diferencias notables en la manifestación de síntomas de la sarna polvosa entre las variedades comercializadas (Carreño 2009, Gilchrist et al. 2009, Jaramillo y Botero 2007). Estas condiciones ameritan continuar con los estudios de dichos patosistemas y especialmente evaluar su efecto sobre la producción y calidad del tubérculo semilla en forma independiente y conjunta, así como desarrollar metodologías de diagnóstico que ofrezcan altos niveles de sensibilidad y que estén fundamentados en las características genotípicas que presentan ambos patógenos en el país.
AGRADECIMIENTOS
Esta investigación se realizó gracias al apoyo económico y técnico del Ministerio de Agricultura y Desarrollo Rural (proyecto 0902007S4527-87-08), de la Universidad Nacional de Colombia (Sede Medellín), el Politécnico Colombiano Jaime Isaza Cadavid, Fedepapa y Fritolay. Se reconoce el apoyo técnico de los miembros de los laboratorios de Biología Celular y Molecular y Microbiología Industrial de la Universidad Nacional de Colombia (sede Medellín) y de Sanidad Vegetal del Politécnico Colombiano Jaime Isaza Cadavid. También se agradece la asesoría científica de Jorge Tenorio y Giovanna Müller del Centro Internacional de la Papa (CIP, Perú).
REFERENCIAS
1. Adams MJ, Antoniw JF, Kreuze J. 2009. Virgaviridae: a new family of rod-shaped plant viruses. Archives of Virology, 154: 1967-1972. [ Links ]
2. Büchen-Osmond C. [Internet]. 2010. The Universal Virus Database of the International Committee on Taxonomy of Viruses. Fecha de acceso: 12 de junio de 2010. Disponible en: http://www.ictvdb.org. [ Links ]
3. Campbell RN. 1996. Fungal transmission of plant viruses. Annual Review of Phytopathology, 34: 87-108. [ Links ]
4. Carreño AJ. 2009. Evaluación de la variabilidad genética de Spongospora subterranea f. sp. subterranea mediante la comparación de regiones ITS del ADN ribosomal de cepas procedentes de las regiones productoras de papa en Colombia [Tesis de Maestría]. [Bogotá (Colombia)]: Ciencias Agrarias, Facultad de Agronomía. Universidad Nacional de Colombia. p. 104. [ Links ]
5. Cerovska N, Pecenkova T, Filigarová M, Dedic P. 2007. Sequences analysis of the Czech Potato mop-top virus (PMTV) isolate Korneta-Nemilkov. Folia Microbiologica, 52: 61-64. [ Links ]
6. Deacon J. [Internet]. 2010. The Microbial World: Fungal zoospores II. Chytrids and plasmodiophorids. Institute of Cell and Molecular Biology, The University of Edinburgh. Fecha de acceso: 10 de julio de 2010. Disponible en: http://www.biology.ed.ac.uk/research/ groups/jdeacon/microbes/chytrid.htm. [ Links ]
7. Felsenstein J. 1985. Confidence limits on phylogenies: an approach using the bootstrap. Evolution, 39: 783-791. [ Links ]
8. Gil JF, Quintero M, González EP, Cotes JM, Marín M. 2009. Detección serológica y molecular de virus en cultivos de papa de tres regiones de Antioquia. En: ASCOLFI, editores. Memorias 29 Congreso Nacional de Fitopatología y Ciencias Afines. Medellín (Colombia): ASCOLFI. p. 121. [ Links ]
9. Gilchrist E, Jaramillo S, Reynaldi S. 2009. Efecto sobre la sarna polvosa de cuatro aislamientos del hongo Trichoderma asperellum en tres tipos de suelo. Revista Facultad Nacional de Agronomía Medellín, 62: 4783-4792. [ Links ]
10. Guerrero O. 1997. Reconocimiento del hongo Spongospora subterranea causante de la roña de la papa en el departamento de Nariño. En: Fedepapa, editores. Curso de manejo sanitario del cultivo de la papa. Pasto (Colombia): Fedepapa. p. 25. [ Links ]
11. Guerrero O. 2000. La roña o sarna polvosa en el departamento de Nariño. En: Fedepapa. Papas colombianas 2000, con el mejor entorno ambiental. 2.a ed. Bogotá (Colombia): Fedepapa. p. 127-129. [ Links ]
12. Guzmán M, Caro M, García Y. 2004. Validación de la técnica serológica de inmunoimpresión para detección de diferentes virus que afectan el cultivo de papa. En: CEVIPAPA (Centro Virtual de Investigación de la Cadena Agroalimentaria de la Papa), editores. Memorias, I Taller Nacional sobre Patógenos del Suelo, Virus e Insectos Plagas diferentes a Tecia solanivora. Bogotá (Colombia): Cevipapa. p. 41. [ Links ]
13. Harrison BD, Reavy B. [Internet]. 2002. DPVweb, 2010. Description of plant viruses. Fecha de acceso: 10 de junio de 2011. Disponible en: http://www.dpvweb.net/dpv/showdpv.php?dpvno=389. [ Links ]
14. Harju VA, Skelton A, Clover GRG, Ratti C, Boonham N, Henry CM, Mumford RA. 2005. The use of real-time RT-PCR (TaqMan®) and post-ELISA virus release for the detection of Beet necrotic yellow vein virus types containing RNA 5 and its comparison with conventional RT-PCR. Journal of Virology Methods, 123: 73-80. [ Links ]
15. Jaramillo S, Botero JM. 2007. Respuesta de diferentes poblaciones de Spongospora subterranea f. sp. subterranea a la rotación entre dos variedades de papa (Solanum tuberosum ssp. andigena). Revista Facultad Nacional de Agronomía Medellín, 60: 3859-3876. [ Links ]
16. Jones RAC, Harrison BD. 1972. Ecological studies on Potato mop-top virus in Scotland. Annals of Applied Biology, 71: 47-57. [ Links ]
17. Johnson SB. [Internet]. 2009. Potato mop-top virus (PMTV). University of Maine, Cooperative Extension Bulletin N° 2437. Fecha de acceso: 11 de junio de 2011. Disponible en: http://www.umext.maine.edu/onlinepubs/htmpubs/2437.htm. [ Links ]
18. Lambert DH, Levy L, Mavrodieva VA, Johnson SB, Babcock MJ, Vayda ME. 2003. First Report of Potato mop-top virus on Potato from the United States. Plant Disease, 87: 872. [ Links ]
19. Latvala-Kilby S, Aura JM, Pupola N, Hannukkala A, Valkonen JPT. 2009. Detection of Potato mop-top virus in potato tubers and sprouts: combinations of RNA2 and RNA3 variants and incidence of symptomless infections. Phytopathology, 99: 519-531. [ Links ]
20. MacKenzie DJ. 1996. Detection of Potato mop-top virus in leaf or tuber tissue by reverse transcription-polymerase chain reaction. Sidney (BC), Canada: Centre for Plant Health, Agriculture and Agri-Food Canada. Document CPHBT96K03. [ Links ]
21. Matthews REF. 1993. Diagnosis of plant virus diseases. Boca Ratón (U. S. A): CRC Press. p. 374. [ Links ]
22. Mayo MA, Torrance L, Cowan G, Jolly CA, Macintosh SM, Orrego R, Barrera C, Salazar LF. 1996. Conservation of coat protein sequence among isolates of Potato mop-top virus from Scotland and Peru. Archives of Virology, 141: 1115-1121. [ Links ]
23. McGeachy KD, Barker H. 2000. Potato mop-top virus RNA can move long distance in the absence of coat protein: Evidence from resistant, transgenic plants. Molecular Plant-Microbe Interactions, 13: 125-128. [ Links ]
24. Melander M., Lee M, Sandgren M. 2001. Reduction in Potato mop-top virus accumulation and incidence in tubers of potato transformed with a modified triple gene block gene of PMTV. Molecular Breeding, 8: 197-206. [ Links ]
25. Merz U, Fallon RE. 2009. Review: Powdery Scab of Potatoincreased knowledge of pathogen biology and disease epidemiology for effective disease management. Potato Research, 52: 17-37. [ Links ]
26. Meunier A, Schmit JFO, Stas A, Kutluk N, Bragard C. 2003. Multiplex reverse transcription-PCR for simultaneous detection of Beet Necrotic yellow vein virus, Beet soilborne virus and Beet virus Q and their vector Polymyxa betae on Sugar beet. Applied and Environmental Microbiology, 69: 2356-2360. [ Links ]
27. Nielsen SL, Nicolaisen M. 2003. Identification of two nucleotide sequence sub-groups within Potato mop-top virus. Archives of Virology, 148: 381-388. [ Links ]
28. Ortega E, Rodríguez Y. 2004. Virus del mop top: una amenaza para la producción de papas en Venezuela. INIA Divulga, 1: 36-40. [ Links ]
29. Reavy B, Arif M, Cowan GH, Torrance L. 1998. Association of sequences in the coat protein/readthrough domain of Potato mop-top virus with transmission of Spongospora subterranea. Journal of General Virology, 79: 2343-2347. [ Links ]
30. Salazar LF. 1995. Los virus de la papa y su control. Lima (Perú): Centro Internacional de la Papa (CIP). p. 210. [ Links ]
31. Salazar LF. 2006. Emerging and re-emerging Potato diseases in the Andes. Potato Research, 49: 43-47. [ Links ]
32. Sandgren M, Savenkov E, Valkonen JP. 2001. The readthrough region of Potato mop-top virus (PMTV) coat protein enconding RNA, the second largest RNA of PMTV genome, undergoes structural changes in naturally infected and experimentally inoculated plants. Archives of Virology, 146: 467-477. [ Links ]
33. Savenkov EI, Sandgren MY, Valkonen JPT. 1999. Complete sequence of RNA 1 and the presence of tRNAlike structures in all RNAs of Potato mop-top virus, genus Pomovirus. Journal of General Virology, 80: 2779-2784. [ Links ]
34. Savenkov EI, Germundsson A, Zamyathin AA, Sandgren M, Valkonen JPT. 2003. Potato mop-top virus: The coat protein-encoding RNA and the gene for cysteine-rich protein are dispensable for systemic virus movement in Nicotiana benthamiana. Journal of General Virology, 84: 1001-1005. [ Links ]
35. Secor GA, Rivera-Varas V. 2004. Emerging diseases of cultivated potato and their impact on Latin America. Revista Latinoamericana de la Papa, Suplemento 1: 1-8. [ Links ]
36. Sjöberg, P. 2006. Detection of Tobacco ratle tobravirus and Potato mop-top pomovirus in Swedish soil samples by the use of different bait plants and analysis by ELISA and Biotest. [Tesis de Grado]. [Alnarp, (Suecia)]: Danish-Swedish Horticulture Programme, Swedish University of Agricultural Sciences. p. 29. [ Links ]
37. Sokmen MA, Barker H, Torrance L. 1998. Factors affecting the detection of Potato mop-top virus in potato tubers and improvement of test procedures for more reliable assays. Annals of Applied Biology, 133: 55-63. [ Links ]
38. Swofford DL. 1998. PAUP*: Phylogenetic analysis using parsimony (and other methods). Version 4.0 beta. Sunderland (U. S. A.): Sinauer Associates. p. 128. Disponible en: http://hymenoptera.tamu.edu/courses/ento606/paup4b1.pdf. [ Links ]
39. Tenorio J, Franco Y, Chuquillanqui C, Owens RA, Salazar LF. 2006. Reaction of potato varieties to Potato moptop virus infection in the Andes. American Journal of Potato Research, 83: 423-431. [ Links ]
40. Vásquez V, Montero-Astúa M, Rivera C. 2006. Incidencia y distribución altitudinal de 13 virus en cultivos de Solanum tuberosum (Solanaceae) en Costa Rica. Revista de Biología Tropical, 54: 1135-1141. [ Links ]
41. Vélez PB. 2007. Detección e identificación del Potato mop-top virus (PMTV) en áreas de producción de papa donde se encuentra Spongospora subterranea en dos departamentos de Colombia. [Tesis de Maestría]. [Bogotá (Colombia)]: Maestría en Ciencias Agrarias, Facultad de Agronomía, Universidad Nacional de Colombia Sede Bogotá. p. 115. [ Links ]
42. Xu H, Dehaan TL, De Boer SH. 2004. Detection and confirmation of Potato mop-top virus in potatoes Gil et al. produced in the United States and Canada. Plant Disease, 88: 363-367. [ Links ]
43. Zapata JL. 2004. Algunos aspectos sobre los virus de la papa en Colombia. En: CEVIPAPA (Centro Virtual de Investigación de la Cadena Agroalimentaria de la Papa), editores. Memorias, I Taller Nacional sobre Patógenos del Suelo, Virus e Insectos Plagas diferentes a Tecia solanivora. Bogotá (Colombia): Cevipapa. p. 23-40. [ Links ]