Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actualidades Biológicas
versión impresa ISSN 0304-3584
Actu Biol v.33 n.94 Medellín ene./jun. 2011
ARTÍCULOS DE INVESTIGACIÓN
ALIMENTACIÓN DE PELTOCEPHALUS DUMERILIANUS (TESTUDINES: PODOCNEMIDIDAE) EN CONDICIONES NATURALES
FEEDING OF PELTOCEPHALUS DUMERILIANUS (TESTUDINES: PODOCNEMIDIDAE) IN A NATURAL ENVIRONMENT
Jaime De La Ossa-V.1; Richard C. Vogt2; Ladislau B. Santos-Júnior2
1 Grupo de Investigación en Biodiversidad Tropical. Facultad de Ciencias Agropecuarias, Universidad de Sucre. Sincelejo (Sucre), Colombia. Correo electrónico: jaimedelaossa@yahoo.com.
2 Instituto Nacional de Pesquisas da Amazônia (INPA-BADPI), Manaus, Brasil.
Recibido: octubre 2010; aceptado: abril 2011.
Resumen
El presente trabajo analiza aspectos de alimentación en medio natural de la tortuga, Peltocephalus dumerilianus (Testudines: Podocnemididae; cabezón), a partir de muestras de contenidos alimenticios tomados de estómago e intestino grueso de ejemplares utilizados para consumo por los habitantes ribereños de la comunidad de São Louis, en el medio río Negro, municipio de Barcelos (Amazonas), Brasil. Se documenta que la especie es omnívora, oportunista y generalista, consume preferiblemente vegetales, con predominancia de semillas y frutos de palmeras, además, se registraron otros productos que incluyen materia animal de diversos taxones.
Palabras clave: alimentación, Amazonas, Brasil, medio natural, Peltocephalus dumerilianus
Abstract
This study analyzed aspects of the natural feeding of Peltocephalus dumerilianus (Testudines: Podocnemididae; big headed Amazon river turtle) by inspection of samples taken from stomachs and large intestines of individuals consumed as a protein source by people living along the middle Río Negro river, in the Municipality of Barcelos (Amazon), Brazil. The results showed that this species is an opportunist, omnivore, and generalist, preferring plant material, particularly palm fruits and seeds; in addition, the consumption of diverse animal matter of different taxa was documented.
Key words: Amazon, Brazil, feeding, natural environment, Peltocephalus dumerilianus
INTRODUCCIÓN
Respecto a los hábitos alimenticios se puede afirmar como regla general que las tortugas acuáticas son omnívoras (Moll y Moll 2004), con algunas excepciones: Chelonia mydas (tortuga blanca de mar) que se alimenta de pastos marinos (Seminoff et al. 2002). La especie Dermatemys mawii (tortuga centroamericana de río), que es eminentemente herbívora (Álvarez del Toro 1974, Moll y Moll 2004, Vogt y Villarreal 1996); Chelus fimbriatus (matamata) que se alimenta de invertebrados y peces (Álvarez del Toro 1974, Lemell et al. 2002); sin embargo las tortugas de la familia Trionychidae: Amyda cartilaginea, Apalone mutica, A. spinifera, Aspideretes leithii, Palea steindachneri, Pelodiscus sinensis, Rafetus euphratecus, son predominantemente carnívoras, alimentándose de moluscos, crustáceos, anfibios, pequeños invertebrados acuáticos y peces (Ernst y Barbour 1989, Hailey et al. 2001).
Durante los últimos veinte años se han incrementado los trabajos que demuestran que los hábitos alimenticios de una misma especie de quelonio cambian entre poblaciones con relación a la presencia de otras especies de tortugas y disponibilidad de recursos alimenticios locales (Fachín-Terán et al. 1994, 1995, Moll 1976). Además existe evidencia de que hay cambios en la composición de la dieta en relación con la edad, el sexo y el tipo de hábitat que ocupan e interacciones interespecíficas (Aguirre-León y Aquino-Cruz 2004, Armstrong y Booth 2004, El-Moudena et al. 2006, Lagarde et al. 2003).
De manera específica para las Podocnemididae amazónicas se sabe que: Podocnemis expansa además de consumir abundante material vegetal, puede presentar en sus contenidos estomacales pequeñas cantidades de alimentos de origen animal (Alameida y Abe 2009, Malvasio et al. 2003). La especie Podocnemis unifilis es considerada una especie herbívora que registra consumo de semillas de Ficus spp. y frutos de Pseudobombax munguba (munguba), Sorocea duckei (caiembé), Gymnoluma glabrescens (cramurí) que caen al agua durante las lluvias (Médem 1964, Smith 1979), también ingiere material vegetal proveniente de familias tales como: Convolvulaceae, Leguminosae, Euphorbiaceae y Poacea (Fachín-Terán et al. 1995), 79,6% de materia vegetal, 0,8% de materia animal y 15,1% de sedimentos (Balensiefer y Vogt 2006). En cautiverio, P. expansa y P. sextuberculata se adaptan fácilmente al consumo de alimentos de origen animal y vegetal (Malvasio et al. 2003). En Podocnemis vogli los machos se alimentan más de vegetales mientras que las hembras ingieren más peces y moluscos, diferencia atribuida a las distintas necesidades fisiológicas ligadas al sexo (Moll y Moll 2004, Ramo 1982). Finalmente, P. dumerilianus es omnívora, consume semillas, peces y plantas acuáticas, se observó en sus cometidos estomacales la presencia de invertebrados y algas, lo que sugiere que la composición de la dieta es afectada por el sexo y el tamaño del animal (Pérez-Eman y Paolillo 1997).
En el presente estudio se determinó la dieta de P. dumerilianus mediante el análisis de contenidos estomacales e intestinales de individuos adultos de ambos sexos. Las muestras fueron obtenidas de las capturas de caza de subsistencia que llevan a cabo los habitantes de una comunidad ribereña del medio río Negro (Amazonas), Brasil, durante un periodo de doce meses documentando la variación estacional de la dieta de la especie.
MATERIALES Y MÉTODOS
Área de estudio. Según Vogt (2001) la zona de estudio se caracteriza por ser un igapó típicamente formado por el río Negro, con playas y fondos de abundante sílice, no presenta una buena calidad de nutrientes y posee alta presencia de algas filamentosas. Los niveles del agua pueden variar entre seis y ocho metros durante el año, siendo la época seca de octubre a marzo y la época de lluvias entre abril y septiembre.
Metodología. Durante un año, entre abril de 2005 y marzo de 2006, en la comunidad de São Louis, Barcelos (Amazonas), Brasil (00° 36' S y 63° 21' O), según licencia IBAMA/RAN 059/2006, se colectaron contenidos totales de tractos digestivos (estómago e intestino grueso) de especímenes de la tortuga conocida como ''cabezón'', especie Peltocephalus dumerilianus (Testudines: Podocnemididae). Se obtuvieron a razón de tres individuos por mes, debidamente identificados, cada etiqueta poseía fecha de colecta, lugar de captura, sexo y estado de madurez de acuerdo con el tamaño (Vogt 1980). Se trabajó durante las dos fases del año de manera discriminada: terrestre y acuática (Schõngart et al. 2005). Para la fase terrestre se analizaron los contenidos de 7 machos y 15 hembras, y para la fase acuática: 10 machos y 4 hembras; la muestra total fue de 17 machos y 19 hembras.
Una vez era capturado el individuo se sacrificaba y se le extraían de inmediato las vísceras, a las cuales se les inyectó inicialmente formaldehído al 4% para paralizar los procesos digestivos (Muto et al. 2001; Vásquez y Castello 1998). Seguidamente la conservación del material de colección (estómago e intestinos) fue hecha en una solución de formaldehído al 10% tamponado con glicerina. Posteriormente en el laboratorio, el material se separó, se lavó con agua destilada y se almacenó individuamente en una solución de etanol al 70% para su adecuada conservación y posterior análisis.
Análisis estadístico. Para el análisis de las dietas la información se agrupó según: 1) sexo; 2) frecuencia de ocurrencia (% del número total de estómagos e intestinos gruesos en que ocurre cada categoría de alimento); 3) frecuencia numérica (% de cada producto alimenticio con relación al número total de categorías presentes); y 4) volumen porcentual (volumen de cada producto de alimento en relación con el volumen total de la diferentes categorías presentes) (Aguirre-León y Aquino-Cruz 2004).
La semejanza entre las dietas de hembras y machos, así como la estacionalidad fueron medidas con el índice simplificado de Morisita (IM), calculándose, en cada caso, los valores para contenidos estomacales y contenidos de intestino grueso. Con base en los valores de frecuencia de ocurrencia numérica y frecuencia de ocurrencia, este índice adquiere valores de 0 (ausencia de semejanza) hasta 1 (semejanza total) (Correia 2002).
Para determinar si el hábito alimenticio era generalista o especialista se utilizó el índice de diversidad trófica de Herrera (D); este índice adquiere amplia gama de valores, independientemente del tamaño de la muestra, se reduce cuando la apropiación de los recursos es idéntica entre los individuos, aumenta cuando las preferencias tróficas individuales son muy diferentes, indicando que los organismos son generalistas (Aguirre-León y Aquino-Cruz 2004).
Las diferencias entre dietas, de acuerdo con el volumen, por fase y por órgano fueron analizadas mediante la ANOVA de Friedman (Sentís et al. 2003).
Análisis taxonómico. La totalidad de las muestras fueron identificadas al mínimo nivel taxonómico posible. En la categoría de materia animal no identificada, se agruparon los restos de tejido animal (fragmentos de tejidos, cartílagos y huesos) y en la categoría materia vegetal no identificada, se agruparon como fragmentos de semillas, hojas y raíces que debido al estado de digestión no fue posible identificar.
RESULTADOS
Excluyendo el material animal y vegetal no identificado, se obtuvieron identificadas un total de 49 especies de material vegetal pertenecientes a 23 familias; y 30 categorías identificadas de material animal pertenecientes a siete taxones.
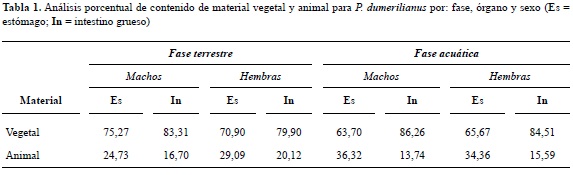
Los contenidos analizados porcentualmente indican que P. dumerilianus es una especie predominantemente omnívora con alto grado de consumo de vegetales que en promedio alcanza el 76,2% (tabla 1).
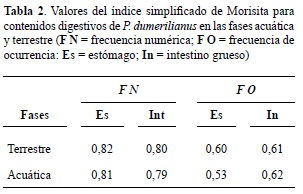
El valor de semejanza estacional [índice simplificado de Morisita (IM)] con cálculo de frecuencia numérica (FN) y de frecuencia de ocurrencia (FO) para los contenidos estomacales e intestinales se presenta en la tabla 2. Existe semejanza entre las dos fases analizadas, tanto para el estómago como para el intestino grueso en ambos sexos.
Según la ANOVA de Friedman existe diferencia al comparar los volúmenes de materia animal y vegetal, con valor significativo para el material vegetal (X2(N = 8, df = 2) = 12,00, p < 0,01) (Coeficiente de concordancia de Kendall = 0,75). Usando la misma prueba estadística se evidencia que existen diferencias significativas entre el volumen de material vegetal y el volumen de hojas totales consumidas dentro de esta gran categoría (X2(N = 8, df = 1) = 8,00, p < 0,01) (Coeficiente de concordancia = 0,95).
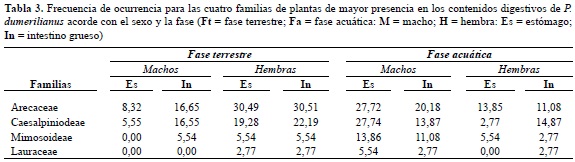
Las cuatro familias de plantas más importantes, analizando la frecuencia de ocurrencia, fueron: Arecaceae (11 especies), Mimosoideae (siete), Lauraceae (cuatro), Caesalpiniodeae (tres) (tabla 3).
Las especies con mayor representatividad por frecuencia de ocurrencia en la totalidad de las muestras analizadas, fueron: Macrolobium acaciifolium (Caesalpiniodeae, 13,30%), Bactris sp. (Arecaceae, 5,45%), Astrocaryum jauari (Arecaceae, 4,85%), Parkia sp. (Mimosoideae, 3,12%), Bactris riparia (Arecaceae, 3,12%), Simaba multifloras (Simaroubaceae, 2,42%) y Euterpe precatoria (Arecaceae, 2,42%).
Las especies con mayor representatividad por volumen porcentual medio en la totalidad de las muestras analizadas, fueron: Macrolobium acaciifolium (Caesalpiniodeae, 9,29%), Bactris sp. (Arecaceae, 2,85%), Astrocaryum jauari (Arecaceae, 2,85%), Parkia sp. (Mimosoideae, 2,61%), Simaba multifloras (Simaroubaceae, 2,59%), Bactris riparia (Arecaceae, 2,27%) y Euterpe precatoria (Arecaceae, 1,93%).
Las semillas no digeridas halladas en el intestino grueso, por familia y especie, según la frecuencia de ocurrencia, muestran los siguientes valores: Arecaceae (9,80%) con: Euterpe precatoria (2,19%), Mauritia flexuosa (2,12%), Astrocarium jauri (2,02%), Dracontium sp. (1,89%) y Socratea exorrhizal (1,58%); Caesalpiniodea (4,30%) con: Macrolobium acaciifolium (4,30); y Moraceae (2,30%) con Ficus sp. (2,30%).
Para material animal según la frecuencia de ocurrencia, se tiene representativamente la presencia de: peces (72,08%), insectos (38,81%), moluscos (27,74%) y crustáceos (24,96%). Analizando el volumen porcentual se halló: peces (2,38%), insectos (1,43%), moluscos (0,97%) y crustáceos (0,46%).
El índice de Herrera (D; tabla 4), indica que en la fase terrestre los machos poseen comparativamente menor diversidad trófica en su dieta, mientras que en la fase acuática la apropiación de recursos es similar para los dos sexos. Al analizar las diferencias de los valores entre sexos para la fase terrestre, se puede evidenciar el carácter generalista de la especie.
DISCUSIÓN
En un estudio de contenido estomacal con duración de tres meses para P. dumerilianus Pérez-Eman y Paolillo (1977) hallaron un total de 28 especies de vegetales pertenecientes a 20 familias, valores que a nivel de familia concuerda con este trabajo, pero con menor número de especies, factor atribuible a la posible duración de la investigación. Indican asimismo que estructuras vegetales, como raíces, ramas y hojas son importantes en el contenido vegetal de la dieta de esta especie, sin destacar la participación discriminada de cada una de ella. Hay que resaltar que en este trabajo se registra en el contenido vegetal, el valor significativo que las hojas poseen como material mayoritario de origen vegetal, lo que permitiría identificar a P. dumerilianus como un omnívoro que acude a la folivoría como estrategia importante dentro de su dieta.
Para la familia Arecaceae se registra una participación del 28,1% en la dieta de P. dumerilianus (Pérez-Eman y Paolillo 1977), los hallazgos encontrados en esta investigación representan para Arecaceae un valor porcentual menor (19,81%). Es relevante la presencia constante durante todo el año de M. acaciifolium (Caesalpiniodeae), constituyéndose en la especie de mayor uso tanto en volumen como en frecuencia de ocurrencia dentro del contenido total analizado. La especie M. acaciifolium, es un taxón dominante que ocurre en aguas negras y pobres en nutrientes (Igapó) de la Amazonia (Schõngart et al. 2005). Por tanto, se relaciona positivamente la presencia que esta especie vegetal en su medio natural con la dominancia hallada en los contenidos digestivos de la tortuga cabezón aquí estudiados.
Se considera, según Pérez-Eman y Paolillo (1977), que P. dumerilianus es una especie omnívora que consume 36% en volumen de frutos y semillas, y 51,6% de peces, catalogándola como uno de los Podocnemididae que registra mayor ingestión de peces. Los resultados del presente trabajo contrastan con Pérez-Eman y Paolillo (1977) dado que muestran que es significativamente una especie con mayor consumo de material vegetal diverso con tendencia a la folivoría, y que los peces dentro de la gran categoría de materia animal poseen significativa frecuencia de ocurrencia, pero el volumen que representan en la dieta total es relativamente bajo (2,38%).
Comparando con otras especies de Podocnemididae: como P. unifilis, la cual es predominante herbívora, ya que sus contenidos estomacales albergan hasta el 89,46% de materia vegetal, tales como semillas, frutos, tallos y hojas de diversas especies. La materia animal registrada está principalmente compuesta de peces, cangrejos y caracoles con el 1,15% (Fachín-Terán et al. 1995), lo cual concuerda parcialmente con lo hallado en este estudio. De forma similar, P. expansa en Rondonia (Brasil), se alimenta de frutos y semillas, con una representación de materia vegetal del 97,6% del volumen total (Fachín-Terán et al. 1995). En Venezuela, se registró para esta misma especie alto consumo de materia vegetal: 86% de frutos y 4% de hojas y tallos, además de alta variabilidad de material animal (10%), representado por invertebrados, huesos, peces y quelonios (Ojasti 1971). Esa similitud en la omnivoría denota tendencias similares entre P. unifilis y P. expansa.
La especie P. dumerilianus, como la mayoría de las especies de quelonios es omnívora y oportunista, presenta un comportamiento típico de omnívoro acuático, pues su forrajeo se caracteriza por la búsqueda de alimentos, explorando los diferentes microhábitats y consumiendo potencialmente lo que sea alimento, en una amplia variedad de productos alimenticios, desde material alóctono hasta presas muertas (Legler 1993). Como comportamiento de alimentación en los Podocnemididae, se establece que existen diferentes grados de ingestión de materia vegetal y materia animal (Balensiefer y Vogt 2006, Fachin-Terán et al. 1995, Mittermeier y Wilson 1974, Ojasti 1971), y que se trata de un grupo típicamente omnívoro, oportunista y generalista, que en el caso de P. dumerilianus muestra marcada folivoría respecto de otras especies de tortugas amazónicas.
Por otro lado, el índice simplificado de Morisita permite evidenciar la semejanza en la dieta independientemente de la época del año, tanto para la frecuencia numérica como para la frecuencia de ocurrencia. Además, no se registraron diferencias de alimentación entre sexos independientemente del órgano en el cual se haga el análisis (estómago o intestino grueso), lo que sugiere que los dos sexos poseen una dieta anual similar y que el uso de los recursos disponibles es igualmente utilizado por la población analizada.
Pérez-Eman y Paolillo (1997) registraron para P. dumerilianus la presencia en el intestino de semillas no digeridas de Mauritia flexuosa y Mauritellia aculeata, lo que podría indicar que esta es una importante diseminadora de semillas al menos para esas dos especies de palmas. En esta investigación se registró también la presencia de semillas no digeridas de M. flexuosa, además de otras cinco especies de Arecaceae, de M. acaciifolium y Ficus sp., ampliando así el posible papel ecológico de esta especie como diseminadora de semillas a un ámbito mayor al reportado anteriormente. Entre las especies de quelonios sugeridos como dispersores de semillas, están: Chelonoides carbonaria y C. denticulata (Moskovits y Bjorndal 1990), Gopherus polyphemus (McDonald y Mushinsky 1988), P. expansa (Ojasti 1971) y Staurotypus triporcatus (Vogt y Guzmán 1988).
Teniendo en cuenta los resultados del índice de Herrera, se evidencia que hay diferencia de nicho trófico al analizar tanto estómago como intestino grueso de machos y hembras durante la fase terrestre, en este periodo focalizado del año las hembras poseen mayor apropiación de recursos que los machos, mientras que en la fase acuática las diferencias entre sexos se hacen menores llegando a ser similar la utilización del nicho trófico. Tales resultados sugieren un comportamiento de ocupación de hábitat mayor en las hembras que en los machos durante la fase terrestre, lo que implicaría una movilización más amplia de las hembras y una ocupación territorial de mayor fidelidad en los machos, que podría relacionarse con territorialidad y comportamiento reproductivo (Vogt 2001).
REFERENCIAS
1. Aguirre-León G, Aquino-Cruz O. 2004. Hábitos alimentarios de Kinosternon herrerai Stejneger 1925 (Testudines: Kinosternidae) en el centro de Veracruz, México. Acta Zoológica Mexicana, 20 (3): 83-98. [ Links ]
2. Almeida CG, Abe AS. 2009. The use of animal feed in the diet of captive Arrau sideneck: Podocnemis expansa. Acta Amazonica, 39 (1): 215-220. [ Links ]
3. Álvarez del Toro M. 1974. Los crocodylia de México. México, D. F. (México): Instituto Mexicano de Recursos Naturales Renovables. p. 70. [ Links ]
4. Armstrong AG, Booth DT. 2004. Dietary ecology of the Australian freshwater turtle (Elseya sp.: Chelonia: Chelidae) in the Burnett River, Queensland. Wildlife Research, 32 (4): 349-353. [ Links ]
5. Balensiefer DC, Vogt RC. 2006. Diet of Podocnemis unifilis (Testudines: Podocnemididae) during the dry season in Mamirauá sustainable development reserve, Amazonas, Brazil. Chelonian Conservation and Biology, 5 (2): 312-317. [ Links ]
6. Correia MA. 2002. Niche breadth and trophic diversity: feeding behaviour of the redswamp crayfish (Procambarus clarkii) towards environmental availability of aquatic macroinvertebrates in a rice field (Portugal). Acta Oecologica, 23: 421-429. [ Links ]
7. El-Moudena EH, Slimania T, Ben-Kaddoura K, Lagarde F. 2006. Testudo graeca graeca feeding ecology in an arid and overgrazed zone in Morocco. Journal of Arid Environments, 64 (3): 422-435. [ Links ]
8. Ernst CH, Barbour RW. 1989. Turtles of the World. Washington, D. C. (U. S. A.): Smithsonian Institution Press. p. 313. [ Links ]
9. Fachín-Terán A, Vogt RC, Gómez MF. 1994. Alimentación de tres especies de tortugas Chelidae en Costa Marques, Rondonia-Brasil. Boletín de Lima, 91-96: 409-416. [ Links ]
10. Fachín-Terán A, Vogt RC, Gómez MF. 1995. Food habits of an assemblage of five species of turtles in the Rio Guapore, Rondônia, Brazil. Journal of Herpetolology, 29 (4): 536-547. [ Links ]
11. Hailey A, Coulson IM, Mwabvu T. 2001. Invertebrate prey and predatory behaviour of the omnivorous African tortoise Kinixys spekii. African Journal of Ecology, 39: 10-17. [ Links ]
12. Lagarde F, Bonnet X, Corbin J, Henen B, Nagy N, Mardonov B, Naulleau G. 2003. Foraging behaviour and diet of an ectothermic herbivore: Testudo horsfieldi. Ecography, 23 (2): 236-242. [ Links ]
13. Legler JM. 1993. Morphology and physiology of the Chelonia. En: Glasby CJ, Ross GJB, Beesley PL, editores. Fauna of Australia. Vol. 2A: Amphibia and Reptilia. Canberra (Australia): Australian Government Publishing Service. p. 108-119. [ Links ]
14. Lemell P, Lemell C, Snelderwaard P, Gumpenberger M, Wochesländer R, Weisgram J. 2002. Feeding patterns of Chelus fimbriatus (Pleurodira: Chelidae). Journal of Experimental Biology, 205: 1495-1506. [ Links ]
15. Malvasio A, De Souza AM, De Barros-Molina F, De Arruga-Sampaio F. 2003. Comportamento e preferênçã alimentar em Podocnemis expansa (Schweigger), P. unifilis (Troschel) e P. sextuberculata (Cornalia) em cativerio, (Testudines: Pelomedusidae). Revista Brasileira de Zoologia, 20 (1): 161-168. [ Links ]
16. McDonald LA, Mushinsky HR. 1988. Foraging ecology of the gopher tortoise, Gopherus polyphemus, in sandhill habitat. Herpetologica, 44: 345-353. [ Links ]
17. Médem F. 1964. Morphologie, oekologie und verbreitung der Schildkrote Podocnemis unifilis in Kolumbien. Senckenberg Biology, 45: 353-368. [ Links ]
18. Mittermeier RA, Wilson RA. 1974. Redescription of Podocnemis erythrocephala (Spix, 1824), and Amazonian pelomedusid turtle. Papéis Avulsos de Zoologia (São Paulo), 28: 147-162. [ Links ]
19. Moll D. 1976. Food and feeding strategies of the Ouachita map turtle (Graptemys pseudogeographica ouachitensis). American Midland Naturalist, 96: 478-482. [ Links ]
20. Moll D, Moll EO. 2004. The ecology, explotation and conservation of river turtles. Nueva York (U. S. A.): Oxford University Press. p. 393. [ Links ]
21. Moskovits DK, Bjorndal KA. 1990. Diet and food preferences of the tortoises Geochelone carbonaria and G. denticulata in northwestern Brazil. Herpetologica, 46: 207-218. [ Links ]
22. Muto EY, Soares LS, Goiten R. 2001. Food resources utilization of Satesriorja agassizzii (Muller & Henle, 1841) and Psammobatis extenta (Garman, 1913) on the continental shelf off Ubatuba, south-eastern Brazil. Revista Brasileira de Zoologia, 61 (2): 217-238. [ Links ]
23. Ojasti J. 1971. La tortuga arrau del Orinoco. Defensa de la Naturaleza, 1 (2): 3-9. [ Links ]
24. Pérez-Emán JL, Paolillo AO. 1997. Diet of the pelomedusid turtle Peltocephalus dumerilianus in the Venezuelan Amazon. Journal of Herpetology, 31 (2): 173-179. [ Links ]
25. Ramo C. 1982. Biología del galápago Podocnemis vogli (Muller, 1935) en Hato el Frío, llanos de Apure (Venezuela). Doñana Acta Vertebrata, 9 (3): 1-61. [ Links ]
26. Schõngart J, Piedade MT, Wittmann F, Junk WJ, Worbes M. 2005. Wood growth patterns of Macrolobium acaciifolium (Benth.) (Fabaceae) in Amazonian blackwater and white-water floodplain forests. Oecologia, 145: 454-461. [ Links ]
27. Seminoff JA, Resendizc A, Nichols WJ. 2002. Diet of East Pacific green turtles (Chelonia mydas) in the central Gulf of California, México. Journal of Herpetology, 36 (3): 447-453. [ Links ]
28. Sentís J, Canela J, Pardell H, Cobo E. 2003. Manual de bioestadística. 3.a ed. Barcelona (España): Elsevier- Masson. p. 337. [ Links ]
29. Smith NJH. 1979. Quelônios aquáticos da Amazônia: um recurso ameaçado. Acta Amazonica, 9 (1): 87-97. [ Links ]
30. Vásquez T, Castello J. 1998. Conteúdo estomacal da albacora-laje Thunnus albacores, durante o inverno e primavera no sul do Brasil. Revista Brasileira de Zoologia, 58 (4): 639-647. [ Links ]
31. Vogt RC. 1980. New methods for trapping aquatic turtles. Copeia, 1980: 368-371. [ Links ]
32. Vogt RC. 2001. Turtles of río Negro. En: Chao NL, Petry P, Prang G, Sonneschien L, Tlusty M, editores. Conservation and management of ornamental fish resources of the río Negro Basin, Amazonia, Brazil - Project Piaba. Manaus (AM, Brasil): Editorial, Universidade do Amazonas. p. 245-262. [ Links ]
33. Vogt RC, Guzmán S. 1988. Food partitioning in a Neotropical freshwater turtle community. Copeia, 1988: 37-47. [ Links ]
34. Vogt RC, Villarreal BJ. 1996. Species abundance and biomass distributions in freshwater turtles. En: Van Abbema J, editor. Proceedings: Conservation, Restoration and Management of Tortoises and Turtles. An International Conference. Nueva York (U. S. A.): New York Turtle and Tortoise and WCS Turtle Recovery Program. p. 210-218. [ Links ]