Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.33 no.95 Medellín July/Dec. 2011
ARTÍCULOS DE INVESTIGACIÓN
EVALUACIÓN DE CITOTOXICIDAD DE NUEVOS ANÁLOGOS DE ESTIRILQUINOLINAS EN CÉLULAS LEUCEMOIDES JURKAT
CYTOTOXICITY EVALUATION OF NEW STYRYLQUINOLINE ANALOGUES IN LEUKEMOID JURKAT CELLS
Andrés F. Soto-López1,4; Juan P. Meneses2,5; Jairo Sáez-Vega2,6; Mauricio Camargo1,3,7
1 Grupo Genética de Poblaciones y Mutacarcinogénesis. Instituto de Biología, Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia.
2 Grupo Química de Plantas Colombianas. Instituto de Química. Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia.
3 Docente. Instituto de Biología, Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia.
Correos electrónicos: 4 <anfeso20@gmail.com>; 5 <jpmb70000@gmail.com>; 6 <jaisav@matematicas.udea.edu.com>; 7 <mauricio.camargo@siu.udea.edu.com>.
Recibido: agosto 2011; aceptado: octubre 2011.
Resumen
Algunas de las drogas más usadas y efectivas en los tratamientos antileucémicos poseen como estructura química principal anillos de quinolina y grupos estireno, lo que podría sugerir que compuestos análogos a estos servirían como posibles nuevos agentes antiproliferativos. Recientemente, uno de nuestros laboratorios sintetizó 6 nuevos análogos de estirilquinolina, candidatas para efectos antiproliferativos y/o anticancerígenos. Así, mediante el ensayo colorimétrico (MTT) se evaluó la citotoxicidad de los seis compuestos en la línea celular Jurkat de origen leucemoide. Los resultados muestran ausencia de efecto citotóxico en las concentraciones y tiempos evaluados. Además, cuando los tratamientos fueron aplicados en presencia de la fracción microsomal S9, no se alteró la viabilidad en este modelo celular leucemoide in vitro. Queda abierta la posibilidad de evaluar estas estirilquinolinas en otras líneas celulares y/o que representen otro modelo de enfermedades, con miras a tamizar efectos biomédicos promisorios.
Palabras clave: estirilquinolina, Jurkat, leucemia, MTT, S9, viabilidad.
Abstract
Some of the most commonly used and effective drugs used in antileukemic treatments posses principal chemical structures with quinoline rings and/or styrene groups, which might suggest that analogous compounds may serve as potential new antiproliferative agents. Recently, one of our laboratories synthesised six new styrylquinoline analogues as candidates for having antiproliferative and/or anti-cancer effects. Thus, using the MTT assay we evaluated the cytotoxicity of these six compounds in the leukemoid cell line Jurkat. The results showed an absence of cytotoxic effects at the concentrations and times assayed. In addition, when the treatments were applied in the presence of S9 microsomal fraction, cell viability was not altered in this leukemoid in vitro model. These results open the possibility of evaluating these styrylquinolines in other cell lines or diseases models with the goal of examining promising biomedical effects.
Key words: Jurkat, leukemia, MTT, S9, styrylquinoline, viability.
INTRODUCCIÓN
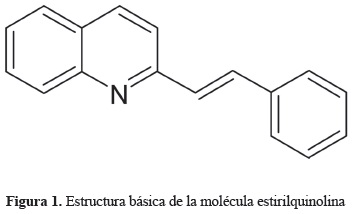
En los últimos años las quinolinas han despertado gran interés debido a que pueden actuar como agentes analgésicos, hipertensores, amebicidas, antibacteriales, antivirales y antitumorales (Musiol et al. 2007). Un derivado de esta molécula son las estirilquinolinas, las cuales en su estructura poseen dos grupos funcionales principales: el grupo quinolina y el grupo estireno (figura 1). La estabilidad de esta molécula permite que sea modificada con algunos grupos sustituyentes (Vieira et al. 2008) que le confieren distintas características fisico químicas, y así cada quinolina puede actuar de una manera diferente de acuerdo a la disposición espacial y las propiedades de los grupos funcionales que sean modificados (Hranjec et al. 2007, kim et al. 2005).
Algunos de los efectos a nivel celular causados por los derivados de quinolinas son la detención del ciclo celular, diferenciación celular y la muerte celular por apoptosis (Lee et al. 2004, Soto-Cerrato et al. 2005, Zhang et al. 2004).
Volkova et al. (2007) registraron dos compuestos que tienen como estructura principal el anillo de quinolina (2-NSqO y 4-NSqO) y que in vitro activan las caspasas 3 y 9 para luego inducir muerte celular por apoptosis en líneas celulares derivadas de eritroleucemia. Igualmente, moléculas que contienen el grupo estireno como parte de su estructura han generado la detención del ciclo celular en diferentes líneas celulares en las que se ha evaluado (Hranjec et al. 2007), sugiriendo que ambas moléculas y sus derivados pueden ejercer una promisoria acción antitumoral.
En vista del potencial antiproliferativo que ejercen muchas quinolinas, evaluamos in vitro seis análogos sintéticos de estirilquinolina que aún no tienen reporte de sus efectos como agentes antiproliferativos y anticancerígenos, con el objetivo de observar los efectos citotóxicos de estas moléculas en el modelo celular leucemoide Jurkat.
MATERIALES Y MÉTODOS
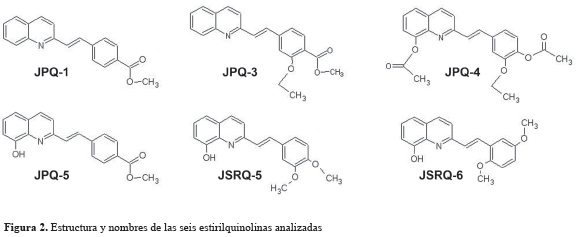
Síntesis de estirilquinolinas. A una solución de quinaldina (30 mmol) en 50 ml de anhídrido acético se le adicionaron 40 mmol del aldehído apropiado y la mezcla se sometió a reflujo durante 12 h. Después de dejar enfriar a temperatura ambiente, la solución se neutralizó con NaHCO3 y se extrajo (2 x 50 ml) con la mezcla hexano: acetato de etilo (1:2); la solución orgánica se secó sobre sulfato de sodio anhidro, se filtró y se evaporó a presión reducida. El extracto crudo se purificó por cromatografía flash utilizando como eluente hexano: acetato de etilo (9:1), obteniéndose de esta manera las estirilquinolinas (Metil 4-[(E)-2-(quinolin-2il)etenil]benzoato) (JPQ 1), (2-etoxi-4-[(E)2-(quinolin-2-il)etenil]fenil acetato) (JPQ3), (2-{(E)-2-[4-(acetiloxi)-3-etoxifenil]etenil} quinolin-8-il acetato) (JPQ 4), (metil 4-[(E)-2(8-hidroxiquinolin-2-il)etenil]benzoato) (JPq5), (2-[(E)-2-(3,4-dimetoxifenil) etenil] quinolin8-ol) (JSRQ-5), (2-[(E)-2-(2,5-dimetoxifenil) etenil]quinolin-8-ol) (JSRQ-6) (figura 2).
Cultivos celulares. Se trabajó con la línea celular linfoblastoide Jurkat, cultivada en medio RPMI 1640 (SIGMA) suplementado con L-glutamina (1 mM), antibióticos penicilina (100 μg/ml), estreptomicina (100 μg/ml), y SBF al 7%, bajo condiciones de humedad saturada y 5% de CO2.
Tratamientos. Los compuestos se emplearon a concentraciones de 0,01, 0,1, 1, 10 y 100 µM. Fueron disueltos en DMSO (1%) y RPMI 1640 (99%). La solución stock y las diluciones fueron almacenadas a 4 °C, como control se usó DMSO (1%).
Ensayo de citotoxicidad. Para determinar el efecto de los compuestos químicos sobre la viabilidad celular, se realizó el ensayo Mtt (3-(4,5-Dimethylthiazol-2-yl)-2,5 diphenyltetrazolium bromide) (Danizot y Lang 1986). En breve, se tomaron células a partir de cultivos en fase exponencial, sembradas en platos de 96 pozos con un total de 1x104 células/pozo en un volumen final de 90 µl de medio RPMI 1640 suplementado con SBF al 10%. Luego de 24 h post-siembra, se agregó el tratamiento a las concentraciones indicadas y evaluados a los tiempos de 24, 48 y 72 h. Después del tratamiento con los compuestos, se agregó el Mtt, y las células fueron incubadas en una atmósfera de 5% de CO2 y a 37 °C por 4 h. Finalmente, se diluyeron los cristales de formazán con isopropanol ácido y frío, y se procedió a las cuantificaciones en un lector de ELISA (Microplate reader Benchmark de Bio-Rad) a una longitud de onda de 570 nm (Danizot y Lang 1986).
Ensayo de citotoxicidad con fracción S9. Porciones de 1 ml de la fracción microsomal S9 de hígado de rata, que contenían aproximadamente 16 mg/ml de proteína, fueron almacenados a -70 °C. Previo a la adición de cada tratamiento se preparó la siguiente solución de trabajo: 50% PBS, 21% H2O destilada, 3,2% MgCl2 (0,25 M), 3,3% kCl (1 M), 2,5% glucosa-6-fosfato, 10% NADP y 10% S9. Se mezclaron 10 µl de solución de trabajo S9 con 10 µl de cada uno de los tratamientos y luego se agregó al respectivo pozo. La evaluación con Mtt se realizó como fue descrito previamente.
Los datos obtenidos de los experimentos fueron analizados estadísticamente mediante el test de t-student(significancia entre medias, p > 0,05).
RESULTADOS
Compuestos aislados. Los seis compuestos evaluados (JPQ-1, JPQ-3, JPQ-4, JPQ-5, JSRQ-5, JSRQ) fueron sintetizados por Juan P. Meneses y obsequiados por el profesor Jairo Sáez quien lidera el laboratorio ''química de Plantas Colombianas'' de la Universidad de Antioquia (Colombia). Son moléculas sintéticas que poseen como estructura fundamental un anillo de quinolina unido a un grupo estireno. Luego de liofilizados, son estables a temperatura ambiente y aislados de la luz. Sus estructuras químicas se detallan a continuación.
Compuesto JPQ-1. (Metil 4-[(E)-2-(quinolin2-il)etenil]benzoato): C19H15NO2 . M+ 289.1 1H NMR (CDCl3, 400MHz): 3.88 (S, 3H, -OCH3), 7.41 (d, 1H, J=16.3Hz, H-2'), 7.46 (t, 1H, J=8 Hz, H-6), 7.56 (d, 1H, J= 8.6 Hz, H-5), 7.62 (d, J=7.4 Hz, H-7), 7.64 (d, J=16Hz, H-1'), 7.67 (d, J=1.2Hz, H-2'', H-6''), 7.72 (d, J=8.6Hz, H-3), 8.01 (d, J=8.4Hz, H-3'', H-5''). 13C NMR (CDCl3, 75MHz): 51.9 (CH3), 119.3 (C-3), 126.3 (C-6), 126.9 (C-8), 127.3 (C-4a), 127.4 (C-2'', C-6''), 129.1 (C-1'), 129.6 (C-4''), 129.7 (C-5), 129.9 (C-3'', 5''), 131.1 (C-7), 132.8 (C-4), 136.3 (C-2'), 140.7 (C-1''), 148.1 (C-8a), 155.1 (C-2), 166.5 (C=O).
Compuesto JPQ-3. (2-etoxi-4-[(E)-2-(quinolin2-il)etenil]fenil acetato). C21H19NO3 . M+ 333.38. 1H NMR (CDCl3, 400MHz):1.43 (t, 3H, -CH3), 2.32 (S, 3H, -OCH3), 4.13 (q, 2H, -CH2), 7.06 (d, 1H, -H-5''), 7.18 (dd, 1H, -H-6''), 7.27 (d, 1H, -H-2''), 7.39 (d, J=16 Hz, 1H, -H-2'), 7.51 (t, 1H, -H-6), 7.64 (d, J=16 Hz, 1H, -H-1'), 7.70 (d, J=8 Hz, 1H, -H-3), 7.73 (d, J=8 Hz, 1H, -H7), 7.80 (d, J=8 Hz, 1H, -H-5), 8.12 (d, J=8 Hz, 1H, -H-4), 8.16 (d, J=8 Hz, 1H, -H-8). 13C NMR (CDCl3, 75MHz): 14.7 (CH3), 20.6 (CH3), 64.4 (CH2), 111,5 (C-2''), 118,9 (C-3), 120.4 (C-6''), 122.9 (C-5''), 126.4 (C-6), 127.3 (C-4a), 127.5 (C-5), 128.8 (C-4), 128.8 (C-2'), 130.0 (C-7), 135.3 (C-1'), 136.8 (C-8), 140.6 (C-4''), 150.7 (C-3''), 155.6 (C-2), 168.9 (C=O).
Compuesto JPQ-4. (2-{(E)-2-[4-(acetiloxi)3-etoxifenil]etenil}quinolin-8-il acetato). C23H21NO5. M+ 391.41. 1H NMR (CDCl3, 400MHz):1.43 (t, 3H, -CH3), 2.33 (S, 3H, -OCH3), 4.14 (q, 2H, -CH2), 7.05 (d, 1H, -H5''), 7.16 (dd, 1H, -H-6''), 7.20 (d, 1H, -H-2''), 7.23 (d, J=16 Hz, 1H, -H-2'), 7.26 (d, J=8 Hz, 1H, -H-7), 7.48 (d, J=8 Hz, 1H, -H-3), 7.49 (d, J=8 Hz, 1H, -H-5), 7.61 (t, 1H, -H-6), 7.66 (d, J=16 Hz, 1H, -H-1'), 8.13 (d, J=8 Hz, 1H, -H-4). 13C NMR (CDCl3, 75MHz): 14.7 (CH3), 20.6 (CH3), 21.0 (CH3), 64.4 (CH2), 111,5 (C-2''), 120.0 (C-7), 120.3 (C-3), 121.6 (C-6''), 122.9 (C-5), 125.5 (C-5''), 125.7 (C-6), 128.5 (C-4a), 129.2 (C-1'), 132.0 (C-4), 135.4 (C-1''), 136.3 (C-2'), 141.0 (C-8), 141.0 (C-4''), 147.3 (C-8a), 150.6 (C-3''), 155.7 (C-2), 169.5 (C=O), 169.8 (C=O).
Compuesto JPQ-5. (metil 4-[(E)-2-(8hidroxiquinolin-2-il)etenil]benzoato). C19H15NO3. M+ 305.32. 1H NMR (CDCl3, 400MHz): 3.89 (CH3), 7.1 (d, J=8 Hz, 1H, -H7), 7.27 (d, J=8 Hz, 1H, -H-5), 7.37 (d, J=8 Hz, 1H, -H-6), 7.43 (d, J=16 Hz, 1H, -H-2'), 7.65 (d, J=8 Hz, 1H, -H-3), 7.66 (d, J=8 Hz, 1H, -H-2'', H-6''), 7.72 (d, J= 16Hz, 1H, -H-1'), 8.01 (d, J=8 Hz, 1H, -H-3'', H-5''), 8.11 (d, J=8 Hz, 1H, -H4). 13C NMR (CDCl3, 75MHz): 52.5 (OCH3), 111.1 (C-7), 118.3 (C-5), 120.7 (C-2'', 6''), 127.5 (C-3), 127.9 (C-6), 128.4 (C-4a), 130.0 (C-4''), 134.4 (C-3'', 5''), 131.2 (C-2'), 133.4 (C-1'), 137.1 (C-4), 138.6 (C-8a), 141.6 (C-1''), 153.7 (C-2), 153.8 (C-8), 167.7 (C=O).
Compuesto JSRQ-5. (2-[(E)-2-(3,4dimetoxifenil)etenil]quinolin-8-ol). C19H17NO3. M+ 307.34. 1H NMR (CDCl3, 400MHz): 3.92 (S, 3H, -OCH3), 3.93 (S, 3H, -OCH3), 6.9 (d, 1H, -H5''), 7.15 (d, 1H, -H-7), 7.17 (d, 1H, -H-6''), 7.18 (d, 1H, -H-2''), 7.21 (d, J=16Hz, 1H, -H-2'), 7.27 (d, 1H, -H-5), 7.37 (d, 1H, -H-6), 7.62 (d, 1H, -H-3), 7.66 (d, J=16Hz, 1H, -H-1'), 8.19 (d, 1H, -H-4). 13C NMR (CDCl3, 75MHz): 55.8 (OCH3), 56.0 (OCH3), 109.0 (C-2''), 110.0 (C-7), 111.1 (C-5''), 117.6 (C-5), 120.2 (C-3), 121.1 (C-6''), 126.1 (C2'), 127.0 (C-6), 127.2 (C-4a), 129.3 (C-1''), 134.1 (C-1'), 136.2 (C-4), 137.9 (C-8a), 149.1 (C-4''), 149.8 (C-3''), 151.9 (C-2), 153.8 (C-8).
Compuesto JSRQ-6. (2-[(E )-2-(2,5dimetoxifenil)etenil]quinolin-8-ol). C19H17NO3 1H NMR (CDCl3, 400MHz): 3.84 (S, 3H, -OCH3), 3.89 (S, 3H, -OCH3), 6.87 (d, 1H, H-4'', H-6''), 7.15 (d, 1H, -H-7), 7.24 (d, 1H, -H-3''), 7.28 (d, 1H, -H-5), 7.35 (d, 1H, -H-2'), 7.37 (d, 1H, -H-6), 7.60 (d, 1H, -H-3), 7.95 (d, 1H, -H-1'), 8.0 (d, 1H, -H-4). 13C NMR (CDCl3, 75MHz): 55.3 (OCH3), 55.7 (OCH3), 109.9 (C-7), 111.9 (C-6''), 112.3 (C-4''), 115.3 (C-3''), 117.6 (C-5), 120.2 (C-3), 125.9 (C-1''), 128.7 (C-2'), 127.1 (C-6), 127.3 (C-4a), 136.1 (C-1'), 137.9 (C-4), 137.9 (C-8a), 151.9 (C-2), 152.0 (C-5''), 153.6 (C-8), 154.1 (C-2'').
Citotoxicidad. Los resultados obtenidos muestran que ningún compuesto generó efecto citotóxico significativo en las concentraciones y tiempos evaluados (figura 3). El ligero efecto positivo observado con los compuestos JPq1 y JPq3 a la concentración de 0,1 µM y a los tiempos de 24 y 48 h no es considerado citotóxico ya que la significancia estadística es marginal y no evidencia efecto de dosis (p > 0,05). Similares resultados se obtuvieron en presencia de la fracción S9 (figura4).
DISCUSIÓN
Entre los medicamentos antileucémicos efectivos, hay drogas como Mk571, quinina y primaquina cuyo compuesto activo contiene anillos de quinolina (Vezmar y Georges 2000). No obstante, y como en la mayoría de antineoplásicos, algunos generan efectos adversos en la recuperación del paciente (Cortes y kantarjian 1995) y resistencia (kaspers et al 1997). De ahí la necesidad constante de investigar nuevos compuestos. Y una estrategia para empezar dicha búsqueda es realizar tamizaje con compuestos químicos estructuralmente modificados y derivados de moléculas que se usan actualmente en la preparación de agentes antileucémicos y en modelos celulares leucemoides.
Los resultados obtenidos en esta investigación con las nuevas estirilquinolinas sintéticas mencionadas, indican que a las concentraciones ensayadas no se alcanzó un efecto citotóxico considerable (IC50) (p > 0,05) sobre la línea celular Jurkat, salvo en algunas concentraciones que mostraron diferencias estadísticamente significativas pero con relación al control, pero sin alcanzar el IC50 (p > 0,05).
En relación a los compuestos individuales cabe mencionar los siguientes aspectos. Los tratamientos con los compuestos JPq-1 y JPq-3, aunque no alcanzaron los umbrales IC50, mostraron diferencias significativas marginales con respecto al control. Estos dos compuestos, estéricamente tienen libre el grupo amino ya que no hay grupos funcionales sustituyentes en los carbonos adyacentes, lo que podría estar permitiendo interacción de este nitrógeno reactivo con componentes celulares, generando inhibición transitoria de la proliferación celular, aunque no suficiente para ser citotóxica. Por otro lado, los compuestos JPq4, JPq5, JSRq6 y JSRq5 que poseen un sustituyente en los carbonos adyacentes al grupo amino fueron menos activos posiblemente porque este grupo está impedido estéricamente por dicha sustitución. Se sabe que los grupos amino poseen dos electrones que son muy reactivos, pero que al haber impedimento estérico, posiblemente no podrían estar activos (kim et al. 2005).
En cuanto a la molécula de estireno se observan grupos sustituyentes los cuales aparentemente no estarían induciendo efecto citotóxico. Evidencia de lo anterior se puede observar cuando se comparan los compuestos JPq-1 y JPq-3 que poseen grupos sustituyentes similares a aquellos que poseen los compuestos JPq5 y JPq4, y a diferencia de los primeros estos dos últimos no causaron efecto alguno sobre la proliferación celular.
Estudios previos indican que compuestos análogos a quinolinas generan un efecto citotóxico directo cuando son evaluados en diferentes tipos de líneas celulares tales como: k562, Jurkat, H460, SW620 (Hranjec 2007, kim et al. 2005, Volkova et al. 2007). Otras quinolinas son inocuas o requieren activación metabólica adicional por el complejo enzimático citocromo P450 (CyP) para poder generar algún efecto cito/genotóxico (knasmüller et al. 2004, yoshie et al 2002).
Con el fin de establecer si la activación metabólica exógena de nuestras quinolinas es un paso determinante a la hora de generar un efecto citotóxico, se procedió a evaluar los compuestos en presencia de la fracción S9 de hígado de rata. Bajo esta condición experimental, tampoco se generó efecto citotóxico (figura 4). Aunque existen trabajos en los cuales se reporta la inhibición de la proliferación en cultivos celulares en presencia de la fracción S9, al parecer el efecto inhibitorio varía considerablemente dependiendo de la línea celular en la cual se evalúe y el tipo de inductor de la activación microsomal (Lebsanft et al. 1989). Nuestra fracción S9 fue obtenida a través de inducción con fenobarbital, el cual preferentemente induce la expresión de los citocromos CyP2B1, CyP1A2, CyP2CS, CyP2C9 y otros CyPs en menores cantidades. Así, podría ser una explicación alterna si partimos de reportes que indican activación preferencial de las quinolinas por los citocromos CyP2E1 (Reigh et al. 1996), CyP2A6 y CyP3A4 (Hirano et al. 2002). Sin embargo, la fracción S9 no carece de ellos, y se trata de nuevas quinolinas sintetizadas cuya acción biológica recién se empieza a investigar en esta investigación.
En conclusión, los seis análogos y/o los grupos sustituyentes que caracterizan a cada una de las moléculas, no están causando efectos en la bioactividad citotóxica de estas quinolinas en células Jurkat leucemoides. y aunque estas evidencias apuntan a clasificarlas como no promisorias en el contexto de la antiproliferación de células B, deja abierta la posibilidad de realizar ensayos en otras líneas celulares con diferentes perfiles de expresión génica-bioquímica y/o que representen otro modelo de enfermedad (Martirosyan et al. 2004).
AGRADECIMIENTOS
A los Programa Sostenibilidad-CODI y ''Joven Investigador'' CODI de la Universidad de Antioquia por el apoyo económico.
REFERENCIAS
1. Cortes JE, kantarjian HM. 1995. Acute lymphoblastic leukemia. Cancer, 76 (12): 2393-2417. [ Links ]
2. Danizot F, Lang R. 1986. Rapid colorimetric assay for cell growth and survival. Modifications to the tetrazolium dye procedure giving improved sensitivity and reliability. Journal of Immunological Methods, 89 (2): 271-277. [ Links ]
3. Hirano y, Uehara M, Saeki k, kato t, takahashi k, Miztutani T. 2002. The influence of quinolines on coumarine 7-hydroxylation in bovine liver microsomes and human CyP2A6. Journal of Health Sciences 48 (2): 118-125. [ Links ]
4. Hranjec M, kralj M, Piantanida I, Sedic M, Suman L, Pavelic k, karminski-Zamola G. 2007. Novel cyanoand amidino-substituted derivatives of styryl-2benzimidazoles and benzimidazo [1, 2-a] quinolines. Synthesis, photochemical synthesis, DNA binding, and antitumor evaluation, part 3. Journal of Medicinal Chemistry, 50 (23): 5696-5711. [ Links ]
5. kaspers GJ, Veerman AJ, Pieters R, Van Zantwijk CH, Smets LA, Van Wering ER, Van Der Does-Van Den Berg A. 1997. In vitro cellular drug resistance and prognosisin newly diagnosed childhood acute lymphoblastic leukemia. Blood, 90 (7): 2723-2729. [ Links ]
6. Kim y, Shin k, Lee t, kim E, Lee M, Ryu S, Suh P. 2005. G2 arrest and apoptosis by 2-amino-N-quinoline-8-ylbenzenesulfonamide (qBS), a novel cytotoxic compound. Biochemical Pharmacology, 69 (9): 1333-1341. [ Links ]
7. Knasmüller S, Majer BJ, kassie F, Sasaki y, Pfauc W, Glatt H, Meinl W, Darroudi F. 2004. Investigation of the genotoxic effects of 2-amino-9H-pyrido[2,3-b]indole in different organs of rodents and in human derived cells. Journal of Chromatography B, 802 (1): 167-173. [ Links ]
8. Lebsanft J, McMahon JB, Steinmann GG, Shoemaker RH. 1989. A rapid in vitro method for the evaluation of potential antitumor drugs requiring metabolic activation by hepatic s9 enzymes. Biochemical Pharmacology, 38 (24): 4477-4483. [ Links ]
9. Lee E, Min H, Park H, Chung H, kim S, Han y, Lee S. 2004. G2/M cell cycle arrest and induction of apoptosis by a stilbenoid, 3, 4, 5-trimethoxy-4'-bromo-cis-stilbene, in human lung cancer cells. Life Sciences, 75 (23): 2829-2839. [ Links ]
10. Martirosyan AR, Rahim-Bata R, Freeman AB, Clarke CD, Howard RL, Strobl JS. 2004. Differentiation-inducing quinolines as experimental breast cancer agents in the MCF-7 human breast cancer model. Biochemical Pharmacology, 68 (9): 1729-1738. [ Links ]
11. Musiol R, Jampilek J, Kralova K, Richardson DR, Kali•nowski D, Podeszwa B, Finster J, Niedbala H, Palka A, Polanski J. 2007. Investigating biological activity spectrum for novel quinoline analogues. Bioorganic and Medicinal Chemistry, 15 (3): 1280-1288. [ Links ]
12. Reigh G, McMahon H, Ishizaki M, Ohara t, Shimane k, Esumi y, Green C, tyson C, Ninomiya S. 1996. Cytochrome P450 species involved in the metabolism of quinoline. Carcinogenesis 17 (9): 1989-1996. [ Links ]
13. Soto-Cerrato V, Montaner B, Martinell M, Vilaseca M, Giralt E, Pérez R. 2005. Cell cycle arrest and proapoptotic effects of the anticancer cyclodepsipeptide serratamolide (At514) are independent of p53 status in breast cancer cells. Biochemical Pharmacology, 71 (1-2): 32-41. [ Links ]
14. Vezmar M, Georges E. 2000. Reversal of MRP-mediated doxorubicin resistance with quinoline-based drugs. Biochemical Pharmacology, 59 (10): 1245-1252. [ Links ]
15. Vieira NC, Herrenknecht C, Vacus J, Fournet A, Bories C, Figadere B, Espindola LS, Loiseau PM. 2008. Selection of the most promising 2-substituted quinoline as antileishmanial candidate for clinical trials. Biomedicine and Pharmacotherapy, 62 (10): 684-689. [ Links ]
16. Volkova t, Zykina N, Malycheva I, Nemova N. 2007. Cell mechanisms for apoptosis induction in k562 human erythroleukemia cell line treated with quinoline-N-oxide derivatives. Biochemistry (Moscow) Supplemental Series B: Biomedical Chemistry, 1 (1): 82-86. [ Links ]
17. Yoshie H, Mayumi U, ken-ichi S, taka-aki k, kazuhiko T, Takaharu M. 2002. The influenze of quinolines on coumarin 7-hydroxylation in bovine liver microsomes and human CyP2A6. Journal of Health Sciences, 48 (2): 118-125. [ Links ]
18. Zhang H, kasibhatla S, Wang y, Herich J, Guastella, J, tseng B, Drewe J, Cai S. 2004. Discovery, characterization and SAR of gambogic acid as a potent apoptosis inducer by a HtS assay. Bioorganic and Medicinal Chemistry, 12 (2): 309-317. [ Links ]