Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actualidades Biológicas
versión impresa ISSN 0304-3584
Actu Biol v.33 n.95 Medellín jul./dic. 2011
ARTÍCULOS DE INVESTIGACIÓN
EVALUACIÓN DE LA ACTIVIDAD ANTIOXIDANTE DE ESPONJAS MARINAS DEL CARIBE COLOMBIANO
EVALUATION OF ANTIOXIDANT ACTIVITY OF MARINE SPONGES FROM THE COLOMBIAN CARIBBEAN
Mary C. Montaño-Castañeda1; Gilmar G. Santafé-Patiño2
1 Grupo de Investigación Química de los Productos Naturales. Universidad de Córdoba. Montería (Córdoba), Colombia. Correo electrónico: maryc1281@yahoo.com; mmontano@correo.unicordoba.edu.co.
2 Grupo de Investigación Química de los Productos Naturales. Universidad de Córdoba. Montería (Córdoba), Colombia. Correo electrónico: gsantafep@gmail.com, gsantafe@correo.unicordoba.edu.co.
Recibido: febrero 2010; aceptado: octubre 2011.
Resumen
Los invertebrados marinos representan un componente importante de la biota oceánica y una fuente rica de compuestos nuevos y biológicamente activos, tales como antibacterianos, anticancerígenos, antiinflamatorios y antioxidantes, entre otros. En este trabajo se evaluó la actividad antioxidante de los extractos metanólicos de las esponjas marinas del Caribe colombiano: Amorphinopsis atlantica, Callyspongia vaginalis, Ircinia felix, Lissodendoryx carolinensis, Mycale microsigmatosa, Niphates erecta y Tedania ignis, frente al catión radical ABTS•+, usando como referencia Trolox. Los ensayos preliminares realizados (100 μg/ml) mostraron buena inhibición del radical (> 53%) con los extractos de A. atlantica (IC50 = 88,26 μg/ml), M. microsigmatosa (IC50 = 59,80 μg/ml) y I. felix (IC50 = 88,81 μg/ml) y baja inhibición del radical (< 33%) para los extractos de las otras esponjas. Al evaluar la actividad antioxidante de las fracciones acuosa y de diclorometano obtenidas a partir de cada extracto metanólico seleccionado, se encontró que la mayor inhibición del radical fue presentada por la fracción acuosa de A. atlantica (IC50 = 58,75 μg/ml), superando a la mostrada por el extracto metanólico de esta esponja, además, la menor inhibición fue la mostrada por la fracción orgánica de I. felix (IC50 = 120,49 μg/ml), valor mucho mayor comparado con el del respectivo extracto. Los resultados encontrados sugieren la producción por parte de esponjas marinas del Caribe colombiano de sustancias capaces de inhibir la reactividad química de radicales orgánicos como el ABTS•+.
Palabras clave: ABTS•+, actividad antioxidante, Caribe colombiano, esponjas marinas, radicales orgánicos.
Abstract
Marine invertebrates are an important component of oceanic biota and a rich source of novel and biologically active compounds, such as anti-bacterial, anticancer, anti-inflammatory, and antioxidants agents, among others. In this study we evaluated the antioxidant activity of methanol extracts from marine sponges from the Colombian Caribbean: Amorphinopsis atlantica, Callyspongia vaginalis, Ircinia felix, Lissodendoryx carolinensis, Mycale microsigmatosa, Niphates erecta, and Tedania ignis against the radical ABTS•+ cation, using Trolox as a reference. The preliminary tests performed (100 μg/ml) showed good inhibition of the radical (> 53%) with extracts from A. atlantica (IC50 = 88.26 μg/ml), M. microsigmatosa (IC50 = 59.80 μg/ml), and I. felix (IC50 = 88.81 μg/ml) and low inhibition of the radical (< 33%) to extracts from the other sponge species. Upon evaluating the antioxidant activity of aqueous fractions of dichloromethane obtained from each of the selected methanol extracts, we found that the greatest inhibition of the radical was obtained from the aqueous fraction of A. atlantica, (IC50 = 58.75 μg/ml), exceeding that exhibited by the methanol extract of this sponge; in addition, the least inhibition was exhibited by the organic fraction of I. felix (IC50 = 120.49 μg/ml), a value considerable greater when compared with the respective extract. The results suggest that marine sponges of the Colombian Caribbean are capable of producing substances that inhibit the chemical reactivity of organic radicals such as ABTS•+.
Keywords: ABTS•+, antioxidant activity, Colombian Caribbean, marine sponges, organic radicals.
INTRODUCCIÓN
Durante el metabolismo de los organismos se generan especies reactivas de oxígeno (ROS, por sus siglas en inglés) y otras especies, como aniones superóxido, radicales peroxilos, hidroperóxidos, aniones peroxinitrilos, radicales hidroxilos, los cuales al igual que el peróxido de hidrógeno son compuestos muy reactivos que pueden dañar las células (Echavarría et al. 2009, Sakac y Sakac 2000). En condiciones naturales, se presenta un equilibrio entre oxidantes, antioxidantes y algunas biomoléculas (Fusco et al. 2007), pero debido a factores de nutrición, ambientales y patológicos se puede acumular exceso de radicales libres produciéndose estrés oxidativo, el cual promueve desbalance de óxidoreducción celular (redox) afectando la membrana plasmática y órganos como la mitocondria y el núcleo celular, transformando muchas veces células normales en células cancerígenas (Choksi et al. 2004, Valko et al. 2006). Estas condiciones están asociadas a enfermedades degenerativas o crónicas como el cáncer, enfermedades cardiovasculares, arterioesclerosis, artritis reumatoidea, mal de Parkinson, diabetes mellitus, envejecimiento e infertilidad masculina (Calabrese et al. 2005, Hogg 1998, Nuñez et al. 2006, Willcox et al. 2004).
Los radicales libres y las ROS actúan sobre ácidos grasos poliinsaturados, carbohidratos, proteínas, colesterol, ADN y lípidos, siendo estos últimos los más reactivos a la sustracción de un electrón por parte del radical que lo requiere para alcanzar su estabilidad electroquímica produciendo así la peroxidación lipídica (Boneffoy et al. 2002, Echavarría et al. 2009, Sakac y Sakac 2000), este comportamiento permite a los antioxidantes actuar como fuentes de hidrógeno y oxidarse en lugar de cualquiera de las moléculas antes mencionadas, protegiendo de esta manera las células contra el daño que causan los radicales libres (Echavarría et al. 2009). La defensa al interior de la célula frente a estos procesos oxidativos, está conformada principalmente por sustancias tipo enzimas como las catalasa, superóxido dismutasa (SOD), glutatión peroxidasa y glutatión transferasa, las cuales contrarrestan la acción específica de compuestos como el peróxido de hidrógeno y los peróxidos lipídicos (Avello y Suwalsky 2006, Willcox et al. 2004).
De igual manera la protección antioxidante celular está dada por mecanismos no enzimáticos con moléculas como el glutatión (GSH), proteínas transportadoras de metales como la cupreína y la ferritina, el ácido ascórbico (vitamina C), β-caroteno y vitamina E (α-tocoferol), estas tres últimas moléculas antioxidantes han demostrado efecto protector contra una variedad de enfermedades como cáncer de esófago, úlceras estomacal y duodenal, infertilidad masculina y daño oxidativo inducido por endotoxinas (Avello y Suwalsky 2006, Rojano et al. 2008, Willcox et al. 2004).
Factores ambientales como el estrés termal, la radiación ultravioleta y la contaminación son generadores de ROS (Librowski et al. 2010, Rojano et al. 2008). Estos factores también se presentan en el ambiente marino, por lo tanto, los organismos que allí habitan están frecuentemente expuestos, traduciéndose esta condición en la presencia de estrés oxidativo en muchos de estos organismos y como posible defensa, ellos pueden también producir sustancias antioxidantes naturales (Nuñez et al. 2006).
Los organismos marinos han sido de gran interés para investigaciones en los campos de la química, la farmacología, la ecología, entre otros y parecen ser una fuente muy probable de sustancias con propiedades antioxidantes. Estudios anteriores de productos naturales marinos con actividad antioxidante, registran que los compuestos (1S)-(+)curcufenol, aaptamina, isoaaptamina y curcudiol aislados de esponjas marinas presentaron potente actividad frente al radical DPPH (Takamatsu et al. 2003), de igual forma extractos hidroalcólicos del coelenterado Anthipates sp. y de la esponja Ircinia sp. mostraron potente actividad antioxidante frente al anión superóxido (80% de inhibición a 670 μg/ml) y el radical ABTS•+ (Nuñez et al. 2006).
De la ascidia Didemnum chartaceum (Sluiter, 1909), se aislaron los lamellarinos, que son un grupo de compuestos aromáticos condensados policíclicos, a los que se les atribuyen un amplio rango de actividades biológicas que incluye actividad antioxidante (Fan et al. 2008, Lindquist et al. 1988). La purpona es un compuesto aislado de una esponja marina del género Iotrochota, con actividad antioxidante frente al radical DPPH (Liu et al. 2008). Del hidroide marino Tridentata marginata (Kirchenpauer, 1864), se aisló tridentatol A, compuesto que exhibió actividad antioxidante contra la oxidación de lipoproteínas causadas por iones de cobre, más potente que la mostrada por la vitamina E en los ensayos (Johnson et al. 1999). Los compuestos 2-octaprenil-1,4-hidroquinona y 2-(24-hidroxi)- octaprenil-1,4-hidroquinona aislados de la esponja Ircinia spinosula (Schmidt, 1862), así como algunos derivados sintéticos de estos, mostraron una fuerte interacción con el radical DPPH y efectos sobre la peroxidación lipídica (Tziveleka et al. 2002). Para algunas esponjas de los géneros Dysidea, Ircinia, Mycale y Tedania recolectadas en costas de Cuba, se registra la actividad antiinflamatoria, analgésica y antioxidante de varios de sus extractos (Aneiros et al. 2000, 2002)
En este mismo sentido, el extracto metanólico de macroalgas como Sargassum cymosum (Agardh, 1820), Dictyota sp., Laurencia sp. y Sargassum sp. del Caribe colombiano también mostraron actividad antioxidante frente al radical DPPH (Echavarría et al. 2009). La posibilidad de encontrar compuestos de origen marino con actividad antioxidante es muy amplia y por esta razón, en la presente investigación se evaluó la capacidad estabilizadora del radical ABTS•+ de los extractos metanólicos de las esponjas A. atlantica (Carvalho, Hajdu, Mothes y van Soest, 2004), I. felix (Duchassaing y Michelotti, 1864) y C. vaginalis (Lamarck, 1814), L. carolinensis (Wilson, 1911), M. microsigmatosa (Arndt, 1927), N. erecta (Duchassaing y Michelotti, 1864) y T. ignis (Duchassaing y Michelotti, 1864), encontrándose resultados promisorios, a través de la cuantificación de la decoloración de este radical debido a la interacción con especies donantes de hidrógeno o de electrones (Re et al. 1999).
MATERIALES Y MÉTODOS
Recolección de los organismos marinos. Las especies de esponjas estudiadas fueron recolectadas en el Caribe colombiano de la siguiente manera: Amorphinopsis atlántica (PNM M-1), Lissodendoryx carolinensis (PNM M-2) y Mycale microsigmatosa (PNM M-3) en Caño Salado al norte de la bahía de Cispatá; Tedania ignis (PNM M-5) y Niphates erecta (PNM M-6) en Punta Calao; Ircinia felix (PNM M-7) en isla Múcura; y Callyspongia vaginallis (PNM M-8) en islas de San Bernardo.
Curación e identificación del material biológico. Después de recolectados los organismos, fueron etiquetados (PNM M-1 a PNM M-8), congelados y transportados al laboratorio de Productos Naturales de la Universidad de Córdoba (Montería), Córdoba. Un ejemplar de cada uno de los organismos fue depositado en el laboratorio de Zoología de Invertebrados Marinos de esta universidad. La identificación taxonómica fue realizada por el Profesor Sven Zea de la Universidad Nacional, sede Santa Marta (Magdalena), Colombia.
Equipos. Para la obtención de los extractos por destilación a presión reducida se empleó un rotavaporador Büchi R-114. Para liofilizar la fase acuosa se utilizó un liofilizador Labconco Freezone 2.5L y bomba de vacío Labconco modelo 117. Los ensayos de actividad antioxidante se realizaron midiendo la absorbancia respectiva (732 nm), empleando un espectrofotómetro GENESYS 20 thermo spectronic modelo 4001/4.
Obtención del extracto y las fracciones. Los organismos fueron cortados en trozos pequeños para ser sometidos a 3 extracciones sucesivas con metanol para obtener el respectivo extracto metanólico. De los extractos seleccionados se tomó una cantidad y se sometió a fraccionamiento por partición empleando dos solventes de polaridades diferentes [diclorometano (DCM) y agua] y obtener la fracción de DCM y la fracción acuosa (tabla 1).
Evaluación de la actividad antioxidante. Para evaluar la capacidad captadora de radicales libres contra el radical catiónico ABST+ fue empleado el método desarrollado por Re et al. (1999) con menores modificaciones. El radical catiónico ABTS•+ es un cromóforo que absorbe a una longitud de onda de 415 o 734 nm y se genera por una reacción de oxidación del ABTS (2,2'-azino-bis-(3-etil benzotiazolin-6- sulfonato de amonio) con persulfato de potasio, la decoloración sufrida por este radical se debe al pasar a su forma reducida en presencia de donantes de hidrógeno o de electrones (Re et al. 1999). El radical catiónico producido es disuelto en una solución buffer fosfatos (pH 7,4 y absorbancia de 0,7) para ser empleado en los ensayos de actividad y de esta manera la decoloración sufrida por la solución de este radical es relacionada directamente con la actividad que tienen los extractos y fracciones para atrapar radicales libres.
Inicialmente se realizó un ensayo preliminar para evaluar la actividad de los extractos y las fracciones a 100 μg/ml para seleccionar los que mejor inhibición del radical presentaron (> 50%) y definir el rango de concentraciones para trabajar (entre 5 y 140 μg/ml, dependiendo del caso). Las soluciones de los extractos y las fracciones se prepararon disolviéndolas en dimetilsulfoxido (DMSO).
Para medir la capacidad antioxidante, 10 μl de las muestras (a diferentes concentraciones) fueron mezcladas con 990 μl de la solución del radical. La cantidad de ABTS•+ estabilizado por las muestras fue medido espectrofotométricamente después de 30 min de incubación, a temperatura ambiente y en oscuridad, según el grado de decoloración o cambio en la absorbancia del radical con respecto a un tratamiento de referencia (10 μl de DMSO y 990 μl de solución del radical ABTS•+) y transformando estos valores en porcentaje de inhibición del radical (% Inh) mediante la ecuación 1. El blanco de los ensayos, se preparó con 10 μl de cada una de las muestras y 990 μl de la solución buffer fosfatos. Para las muestras se determinó la concentración inhibitoria del 50% (IC50). Los resultados también fueron presentados como capacitad antioxidante equivalente a Trolox (TEAC por sus siglas en inglés, expresado como μmol Trolox/g de muestra).
donde Abs = absorbancia
Curva de calibración con Trolox. Para la curva de calibración se usó un estándar de Trolox, el análogo hidrosoluble de la vitamina E. La curva de calibración fue obtenida con los porcentajes de inhibición del radical calculados con la ecuación 1, a través de la medición en la reducción de la absorbancia de la solución del radical ABTS•+ a 6 concentraciones de Trolox (de 1 a 6 μg/ml en DMSO) después de 30 min de incubación (a temperatura ambiente y en oscuridad).
Análisis estadístico. Todos los ensayos se realizaron por triplicado. Para evaluar la actividad antioxidante a las muestras, se consideraron los valores promedios de las absorbancias medidas en los ensayos a cada concentración y se transformaron en valores de % de inhibición para realizar un análisis de regresión simple (% Inh en función de la concentración). Para determinar la concentración inhibitoria del 50% (IC50), se utilizó la ecuación obtenida de la regresión lineal.
RESULTADOS
Para las especies cuyos extractos metanólicos tuvieron una inhibición mayor al 50% en el ensayo preliminar (tabla 2), se procedió a evaluar la actividad antioxidante del extracto y de las fracciones de diclorometano y acuosa a diferentes concentraciones (entre 5 y 140 μg/ ml, dependiendo el caso) calculando el IC50, el cual corresponde a la concentración necesaria para inhibir el 50% de la absorbancia del radical, por lo tanto, un valor bajo de este parámetro significa una mayor actividad antioxidante (Echavarría et al. 2009). Al evaluar la actividad de las fracciones obtenidas se encontraron mejores resultados con las provenientes de la esponja A. atlántica, las cuales inhiben mayor cantidad del radical en comparación con la actividad del extracto metanólico bajo las mismas condiciones.
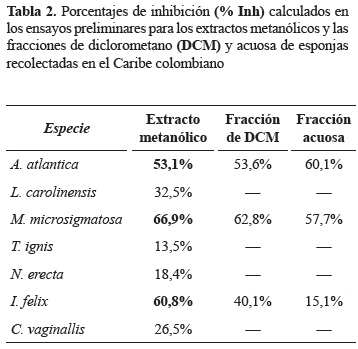
Para la especie M. microsigmatosa se puede observar que las fracciones obtenidas presentan una actividad antioxidante frente al radical ABTS•+, un poco menor que la presentada por el extracto metanólico de esta especie a la misma concentración. Las fracciones de DCM y acuosa de las esponja I. felix fueron las que presentaron los valores más bajos de inhibición del radical (< 40%), comparada con el extracto metanólico y con los extractos y fracciones de las otras esponjas. La poca inhibición del radical (15,1%) presentada por la fracción acuosa de la esponja I. felix en el ensayo preliminar, permite descartar a esta fracción para la evaluación de la actividad antioxidante en los ensayos siguientes.
En la tabla 3, se presentan los porcentajes de inhibición del radical ABTS•+ a las diferentes concentraciones, calculados para cada extracto metanólico seleccionado y las respectivas fracciones de DCM y acuosa.
A partir de estos datos se realizó el análisis de regresión y se calcularon los valores de IC50 para cada una de las muestras, expresándolos como TAEC, los cuales son presentados en la tabla 4, de igual manera se calculó el IC50 del estándar Trolox, valor que corresponde a 3,59 μg/ml.
De este análisis de la regresión se observa que todos los modelos de la regresión son significativos porque presentan valores muy altos de R2, lo que indica una relación fuerte positiva entre la concentración y la actividad inhibitoria del radical. Además, estos resultados indican que de los tres extractos metanólicos de M. microsigmatosa muestran aumento en la inhibición del radical mucho más evidente al aumentar la concentración, comparada con la de los otros dos extractos, además presenta el menor valor de IC50 (59,80 μg/ml), y por lo tanto, un valor de TEAC mayor, equivalente a 234,11 μmoles de Trolox por cada gramo de extracto, sugiriendo que este extracto exhibe mayor actividad antioxidante frente al radical ABTS•+. Para A. atlantica y I. felix se presentan valores de IC50 (88,26 y 88,81 μg/ml, respectivamente) y de TEAC muy similares entre sí, lo que indica que estos dos extractos poseen una capacidad captadora del radical ABTS•+ muy semejante entre ellos. Con respecto a las fracciones obtenidas a partir de los extractos metanólicos, se observa que la mejor actividad antioxidante la presenta la fracción acuosa de A. atlantica (tablas 3 y 4), ya que a los mismos valores de concentración generalmente presenta porcentajes mayores de inhibición en comparación con las otras fracciones, la fracción acuosa de A. atlantica es la que menor cantidad requiere para estabilizar el 50% del radical ABTS•+ y presenta mayor equivalencia con el Trolox, convirtiéndose en la muestra más activa frente a esta especie radicalaria. Las otras fracciones evaluadas presentan una actividad antioxidante muy parecida entre sí (tablas 3 y 4), excepto la fracción orgánica de I. felix que presenta el valor de IC50 más alto (120,49 μg/ml) de todos los registrados y la menor equivalencia con Trolox (95,36 μmol Trolox/g de fracción) con respecto a las demás fracciones y extractos, lo que la convierte en la fracción menos activa para capturar o estabilizar al radical ABTS•+, además su capacidad antioxidante es la mitad de la actividad presentada por la fracción acuosa de A. atlantica, que es la fracción más activa.
DISCUSIÓN
De las siete especies de esponjas recolectadas en el Caribe colombiano, se destacó en el ensayo preliminar, la actividad antioxidante de los extractos metanólicos de M. microsigmatosa, A. atlantica y I. felix, especialmente la del primer organismo, cuyo valor de IC50 está 30 μg por debajo con respecto al de las otras dos esponjas, haciendo al extracto metanólico de M. microsigmatosa hasta 30% más activo frente al radical ABTS•+ comparado con los otros dos extractos. Para A. atlantica y I. felix, los resultados registrados son muy similares entre ellos sin presentarse variaciones significativas entre su capacidad antioxidante. Estos resultados sugieren la presencia en los extractos de uno o varios compuestos con actividad antioxidante frente al radical empleado, especialmente en el de M. microsigmatosa, ya que con esta esponja se requiere menor cantidad de extracto para estabilizar el 50% de la cantidad del radical y por lo tanto presenta mayor capacidad de inhibición del radical ABTS•+, relativa a Trolox.
La evaluación de la actividad antioxidante de las fracciones de DCM y acuosa obtenidas del extracto metanólico de cada esponja, presenta a las fracciones de A. atlantica, especialmente la acuosa, como las de mayor capacidad estabilizadora del radical ABTS•+, lo que sugiere que al hacer el fraccionamiento por partición del extracto metanólico de esta esponja los compuestos con actividad frente a este radical se distribuyeron a las dos fases y consecuentemente le proporcionaron mejor actividad antioxidante a estas fracciones, siendo mucho mayor en la fracción acuosa. Además, el aumento en la actividad antioxidante presentado en las fracciones resulta lógico debido a que la sustancia o sustancias que tienen esta propiedad antioxidante, se encuentran en mayor proporción en estas fracciones con respecto a la proporción que tenían en el extracto metanólico. Este comportamiento, justifica la existencia de compuestos con polaridades diferentes, ya que la actividad presentada por la fracción de DCM sería originada a partir de compuestos medianamente polares y la mayor actividad presentada en la fracción acuosa se debe a la presencia de compuestos mucho más polares, los cuales son más que los presentes en la fracción orgánica o son compuestos que se encuentran en una alta proporción.
Las fracciones de I. felix fueron las que más baja actividad antioxidante presentaron, especialmente la fracción acuosa ya que a 100 μg/ml solo inhibe el 15% del radical ABTS•+, y la fracción orgánica DCM presenta un IC50 muy alto (31,7 μg más comparado con el del extracto metanólico), a esta misma concentración el porcentaje de inhibición del radical disminuye en 23% para la fracción orgánica y en 73% para la fracción acuosa, con respecto al porcentaje de inhibición presentado por el extracto. Esta disminución tan marcada en la actividad antioxidante de las fracciones, sugieren que es mejor utilizar el extracto primario ya que este presenta mejor actividad que las fracciones, tal vez porque está más enriquecido, conteniendo compuestos de diversas polaridades en comparación con las fracciones de DCM y la acuosa, siendo la actividad antioxidante de un extracto equivalente al efecto total (sinérgico o no) de la mezcla de compuestos, como lo propone Echavarría et al. (2009).
Aunque los valores de IC50, registrados para los extractos y fracciones de A. atlantica, I. felix y M. microsigmatosa, son en promedio 20 veces menores en relación con el IC50 del Trolox, se debe destacar que son mezclas complejas de metabolitos secundarios que podrían convertirse en objeto de futuras investigaciones para el aislamiento de los compuestos activos frente al radical ABTS•+, ya que los resultados obtenidos sugieren la presencia de uno o varios compuestos donadores de hidrógenos los cuales neutralizan al radical catiónico empleado, además esta actividad antioxidante registrada, sumada a los resultados de otras investigaciones (Aneiros et al. 2000, 2002, Echavarría et al. 2009, Nuñez et al. 2006, entre otros), proponen a los organismos marinos del Caribe y especialmente a las esponjas, algunas de los géneros Ircinia y Mycale, como fuente promisoria de compuestos con potente actividad antioxidante.
AGRADECIMIENTOS
A la Universidad de Córdoba, en Montería, por la financiación del trabajo. M. Montaño agradece a COLCIENCIAS por una beca de Joven Investigador 2007. A Sven Zea de la Universidad Nacional de Colombia por la identificación de las esponjas marinas y a Jairo Mercado de la Universidad de Cartagena por la liofilización de las fases acuosas.
REFERENCIAS
1. Aneiros A, Garateix A, García T, Palmero A, Valdés A, Arteaga F, Cuquerella E. 2000. Evaluación de nuevas sustancias de origen marino con potencialidades como biofármacos. Informe final. La Habana (Cuba): CEBIMAR, Programas Nacionales de Ciencia e Innovación Tecnológica. Reporte del proyecto # 00403216. [ Links ]
2. Aneiros A, Garateix A, García T, Palmero A, Valdés A, Arteaga F, Cuquerella E. 2002. Obtención de nuevos compuestos de origen marino de aplicación en biomedicina. Informe final. La Habana (Cuba): CEBIMAR, Programas Nacionales de Ciencia e Innovación Tecnológica. Reporte del proyecto # 067. [ Links ]
3. Avello M, Suwalsky M. 2006. Radicales libres. Revista Ciencia Ahora [Internet]: 17 (10-15). Fecha de acceso: 19 de mayo de 2011. Disponible en: http://www.ciencia-ahora.cl/Revista17/03RadicalesLibres.pdf. [ Links ]
4. Bonnefoy M, Drai J, Kostka T. 2002. Antioxidants to slow aging, facts and perspectives. La Presse Medicale, 31 (25): 1174-1184. [ Links ]
5. Calabrese V, Lodi R, Tonon C, D'Agata V, Sapienza M, Scapagnini G, Mangiameli A, Pennisi G, Stella A, Butterfield D. 2005. Oxidative stress, mitochondrial dysfunction and cellular stress response in Friedreich's ataxia. Journal of the Neurogical Sciences, 233 (1): 145-162. [ Links ]
6. Choksi R, Boylston W, Rabek J , Widger W, Papaconstantinou J. 2004. Oxidatively damaged proteins of heart mitochondrial electron transport complexes. Biochimica et Biophysica Acta, 1688 (2): 95-101. [ Links ]
7. Echavarría B, Franco A, Martínez A. 2009. Evaluación de la actividad antioxidante y determinación del contenido de compuestos fenólicos en extractos de macroalgas del Caribe Colombiano. Vitae, 16 (1): 126-131. [ Links ]
8. Fan H, Peng J, Hamann M, Hu J. 2008. Lamellarins and related pyrrole derived alkaloids from marine organism. Chemical Reviews, 108: 264-287. [ Links ]
9. Fusco D, Colloca G, Lo Monaco M, Cesari M. 2007. Effects of antioxidant supplementation on the aging process. Journal of Clinical Interventions in Aging, 2 (3): 377-387. [ Links ]
10. Hogg N. 1998. Free radicals in disease. Seminars in Reproductive Endocrinology, 16 (4): 241-248. [ Links ]
11. Johnson M, Alexander K, Lindquist N, Loo G. 1999. Potent antioxidant activity of a dithiocarbamate related compound from a marine hydroid. Biochemical Pharmacology, 58: 1313-1319. [ Links ]
12. Librowski T, Moniczewski A. 2010. Strong activity of carane derivates. Pharmacological Reports, 62: 178-184. [ Links ]
13. Lindquist N, Fenical W, Van Duyne G. 1988. Clardy, new alkaloids of the lamellarin class from the marine ascidian, Didemmum chartaceum (Sluiter, 1909). Journal of Organic Chemestry, 53: 4570-4574. [ Links ]
14. Liu Y, Ji H, Dong J, Zhang S, Lee K, Mathew S. 2008. Antioxidant alkaloid from the South China sea marine sponge, Iotrochota sp. Zeitschrift für Naturforschung C, 63: 636-638. [ Links ]
15. Nuñez R, Garateix A, Laguna A, Fernández M, Ortiz E, Llanio M, Valdés O, Rodríguez A, Menéndez R. 2006. Caribbean marine biodiversity as a source of new compounds of biomedical interest and others industrial applications. Pharmacologyonline, 3: 111-119. [ Links ]
16. Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. 1999. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine, 26: 1231-1237. [ Links ]
17. Rojano B, Gaviria C, Gil M, Saez J, Schinella G, Tournier H. 2008. Actividad antioxidante del isoespintanol en diferentes medios. Vitae, 15 (1): 173-181. [ Links ]
18. Sakac V, Sakac M. 2000. Free oxygen radiacals and kidney diseases-part I. Medicinski Pregled, 53 (9): 463-474. [ Links ]
19. Takamatsu S, Hodges T, Rajbhandari I, Gerwick W, Hamann M, Nagle D. 2003. Marine natural products as novel antioxidant prototypes. Journal of Natural Products, 66 (5): 605-608. [ Links ]
20. Tziveleka L, Kourounakis A, Kourounakis P, Roussis V, Vagias C. 2002. Antioxidant potential of natural and synthesised polyprenylated hydroquinones. Bioorganic and Medicinal Chemistry, 10 (4): 935-939. [ Links ]
21. Valko M, Rhodes C, Moncol J, Izakovic M, Mazur M. 2006. Free radicals, metals and antioxidants in oxidative stress-induced cancer. Chemico-Biological Interactions, 160 (1): 1-40. [ Links ]
22. Willcox J, Ash S, Catignani G. 2004. Antioxidants and prevention of chronic disease. Critical Reviews in Food Science and Nutrition, 44 (4): 275-295. [ Links ]















