Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.34 no.96 Medellín Jan./June 2012
ARTÍCULOS DE INVESTIGACIÓN
DETERMINACIÓN DE LA ACTIVIDAD ANTIMICROBIANA E INSECTICIDA DE EXTRACTOS PRODUCIDOS POR BACTERIAS AISLADAS DE SUELO
DETERMINATION OF THE ANTIMICROBIAL AND INSECTICIDAL ACTIVITIES IN EXTRACTS PRODUCED BY BACTERIA ISOLATED FROM SOIL
Isabel N. Sierra-García1,4; Magally Romero-Tabarez2,5; Sergio Orduz-Peralta3,6
1 Escuela de Biología, Universidad Industrial de Santander, Corporación para Investigaciones Biológicas. Bucaramanga (Santander), Colombia. inasak@hotmail.com.
2 Ciencias Naturales, Grupo de Biotecnología Microbiana, Laboratorio de Microbiología Industrial, Facultad de Ciencias, Universidad Nacional de de Colombia (Sede Medellín). Medellín (Antioquia), Colombia. mromerota@unal.edu.co.
3 Ciencias Básicas Biomédicas, Escuela de Biociencias, Facultad de Ciencias, Universidad Nacional de Colombia (Sede Medellín). Medellín (Antioquia), Colombia. sorduzp@unal.edu.co.
Recibido: noviembre 2011; aceptado: mayo 2012.
Resumen
Colombia es considerado uno de los países con mayor diversidad biológica, sin embargo, muy poca de esa diversidad ha sido explorada para identificar sustancias biológicamente activas. Los metabolitos secundarios bacterianos pueden presentar actividad frente a patógenos de plantas y animales y representan alternativas biotecnológicas para la industria. El objetivo de este estudio fue evaluar el potencial de diferentes cepas bacterianas aisladas de suelo, para producir sustancias biológicamente activas como antibacterianos, antifúngicos e insecticidas. Un total de 92 extractos metanólicos de metabolitos secundarios bacterianos fueron evaluados. La actividad antibacterial y antifúngica se evaluó mediante el ensayo de difusión en agar frente a diversas bacterias como Bacillus subtilis, Enterococcus faecalis, Escherichia coli y Staphylococcus aureus frente a diferentes hongos Alternaria sp., Colletotrichum sp., Fusarium sp., Pestalotia sp. y Verticillium sp. La actividad insecticida se evaluó determinando el efecto de los extractos sobre la mortalidad de larvas de Aedes aegypti (Diptera) y Spodoptera frugiperda (Lepidoptera). Se determinó que el 50% de los aislamientos bacterianos tuvieron algún tipo de actividad, aunque la mayor actividad biológica se detectó en los extractos producidos por bacterias del género Bacillus, identificados por medio de análisis del ADN ribosomal 16S y por caracterización bioquímica con API® 50 CHB, MicroLogTM y Biolog. Las especies del género Bacillus identificadas han sido caracterizadas como productoras de compuestos antimicrobianos de amplio espectro o de varios compuestos con diferentes actividades. La actividad biológica presentada por los extractos evidencian que los microorganismos terrestres y especialmente, las especies de Bacillus son productores prolíficos de diversas sustancias bioactivas.
Palabras clave: actividad insecticida, antimicrobianos, compuestos activos, extractos bacterianos, Bacillus.
Abstract
Colombia is considered one of the countries with the greatest biological diversity, but very little of this diversity has been explored to identify biologically active substances. Secondary bacterial metabolites may exhibit activity to plant and animal pathogens and represent alternative biotechnologies for industry. The objective of this study was to evaluate the potential of different bacterial strains isolated from soils in order to produce biologically active substances like antibacterial, antifungal, and insecticidal substances. A total of 92 methanolic extracts of secondary bacterial metabolites were evaluated. The antibacterial and antifungal activity was evaluated by means of disk diffusion tests against diverse bacteria such as Bacillus subtilis, Enterococcus faecalis, Escherichia coli and Staphylococcus aureus and against different fungi such as Alternaria sp., Colletotrichum sp., Fusarium sp., Pestalotia sp. and Verticillium sp. Insecticide activity was evaluated by determining the effect of the extracts on larval mortality of Aedes aegypti (Diptera) and Spodoptera frugiperda (Lepidoptera). 50% of the bacterial isolates exhibited some form of activity, with the greatest biological activity detected in the extracts produced by bacteria from the genus Bacillus, identified by means of analysis of ribosomal 16S DNA and by biochemical characterization with API® 50 CHB, MicroLogTM and Biolog. The Bacillus species identified have been characterized as producers of broad spectrum antimicrobial compounds or various compounds with differing activities. The biological activity exhibited by the extracts show that terrestrial microorganisms and especially Bacillus species are prolific producers of diverse bioactive substances.
Key words: active compounds, antimicrobials, bacterial extracts, insecticide activity, Bacillus.
INTRODUCCIÓN
La exploración de la diversidad microbiana y la cantidad de metabolitos secundarios producidos por bacterias ha llevado a considerarlos como una fuente importante de productos naturales con propiedades biológicas como antibacterianos, antifúngicos, antitumorales, hipocolesterolémicos, inmunosupresores, antiparasitarios, herbicidas e insecticidas, entre otros. Los metabolitos secundarios son definidos como sustancias de bajo peso molecular, que no se producen en la vía metabólica primaria y que no juegan un papel fundamental en las funciones primarias o de crecimiento (Vining 1990). A diferencia de los metabolitos primarios, los cuales son comunes en todos los sistemas biológicos, los metabolitos secundarios, son química y taxonómicamente diversos, presentando funciones desconocidas (Bérdy 2005).
Durante más de 50 años los metabolitos secundarios han sido la principal herramienta para el desarrollo de productos para el control de enfermedades causadas por bacterias y hongos (Demain 1999), ya que una buena parte de los antibióticos clínicamente relevantes que incluyen drogas antibacterianas y antifúngicas, han sido productos naturales o derivados de ellos (Strohl 2004). En la actualidad, existe una urgente necesidad de desarrollar nuevos antibióticos debido a que las enfermedades infecciosas representan la segunda causa de mortalidad a nivel mundial, al desarrollo y expansión de patógenos multirresistentes, a la evolución de los agentes infecciosos y a la toxicidad de algunos de los compuestos terapéuticos actuales, entre otras razones (Demain 1999, Luzhetskyy et al. 2007).
De otro lado, en el campo de la agricultura los daños causados por hongos, bacterias e insectos producen reducciones en el rendimiento de los cultivos y pérdidas económicas millonarias a nivel mundial (Hadacek y Greger 2000). El uso excesivo e indiscriminado de químicos sintéticos para el tratamiento de estas plagas y enfermedades ha llevado a la degradación y contaminación del ambiente; al mismo tiempo, se ha observado disminución de la eficiencia para controlarlos debido al desarrollo de patógenos o insectos resistentes (Kim y Chung 2004, Liu et al. 2001, Narayanan 2004). Como método alternativo de tratamiento de estas plagas y enfermedades se ha considerado el desarrollo de nuevos productos basados en metabolitos secundarios producidos por algunas especies de bacterias, los cuales pueden ser más efectivos, biodegradables y con menor toxicidad para los organismos que no son blanco (Liu et al. 2001, Nathan 2006, Pushpalatha y Muthukrishnan 1999, Tasao et al. 2002). La búsqueda de microorganismos productores de compuestos biológicamente activos a partir de diversas fuentes naturales ha sido el fundamento de programas de investigación en antibióticos durante más de 30 años (Demain 2006). Colombia a pesar de ser considerado uno de los países con mayor diversidad biológica, no ha enfocado sus esfuerzos para el conocimiento de la biodiversidad microbiana y su consecuente potencial biotecnológico como productores de metabolitos secundarios activos. El objetivo del presente estudio fue evaluar la capacidad de diversas bacterias nativas de Colombia para producir compuestos con actividad antibacteriana, antifúngica e insecticida. La identificación de bacterias productoras de metabolitos secundarios promisorios por ser altamente activos y de amplio espectro de acción contribuye al conocimiento del potencial de la biodiversidad microbiana de Colombia y cuyos compuestos activos podrían ser utilizados para el desarrollo de productos para el control de patógenos comunes en salud pública y en agricultura.
MATERIALES Y MÉTODOS
Aislamiento y cultivo de microorganismos. Los microorganismos utilizados en la producción de metabolitos secundarios fueron aislados a partir de muestras de suelo de diversas regiones de Colombia. Se sembraron diluciones seriadas de cada muestra recolectada en medio sólido GEN [glucosa 0,88% (p/v), extracto de levadura cervecera 0,5% (p/v), NaCl 1% (p/v), y agar 2% (p/v)] y se incubaron a 30 °C durante 24 horas. Posteriormente, todas las colonias que crecieron en el medio y que presentaron diferencias macroscópicas fueron seleccionadas, esperando tomar el mayor número posible de colonias. Cada colonia fue replicada y se evaluaron sus características macroscópicas y microscópicas. Los aislamientos fueron conservados en su totalidad a -20 °C en Luria-Bertani (LB), suplementado con 40% (v/v) de glicerol.
Producción y extracción de metabolitos secundarios. Los extractos de metabolitos secundarios bacterianos se prepararon siguiendo la metodología descrita por Baur et al. (2006) y Frykman et al. (2006), con algunas modificaciones. Una única colonia de cada bacteria aislada se inoculó en 5 ml de caldo LB durante toda la noche. Al día siguiente, 500 μl de éste cultivo se colocaron en un matraz o erlenmeyer de 125 ml con 50 ml de caldo LB. Al mismo tiempo, se agregaron 2 ml (4% p/v) de resina adsorbente Amberlite® XAD16 (Sigma), en solución acuosa, la cual permite la adsorción de sustancias orgánicas de pequeño y mediano peso molecular en soluciones acuosas. Esta es una resina macroreticular no iónica que absorbe y libera las sustancias a través de interacciones hidrofóbicas y polares. Las resinas adsorbentes han ganado una importancia significativa en el área de recuperación de compuestos y particularmente, antibióticos debido a las ventajas durante procesos de producción y recuperación de bioproductos (Casey et al. 2007). Estas resinas han sido utilizadas con éxito en la identificación y caracterización de antibióticos (Romero-Tabarez et al. 2006, Sasse et al. 1994) y otros metabolitos secundarios (Krug et al. 2008). La incubación fue realizada a 30 °C durante 7 días a 200 rpm, al cabo de este tiempo, la resina se recuperó por decantación, los metabolitos adheridos a ella fueron eluídos con 20 ml de metanol al 99,9% (v/v) y concentrados por evaporación hasta obtener 1 ml de extracto. Los extractos fueron mantenidos y conservados en frascos de vidrio ámbar a -20 °C.
Organismos blanco de actividades biológicas. Las bacterias y hongos utilizados en este estudio como blanco para evaluar la actividad antimicrobiana pertenecen a la colección de miroorganismos patógenos de la Unidad de Biotecnología y Control Biológico de Corporación para Investigaciones Biológicas (CIB/UNALMED). Las bacterias empleadas fueron: Bacillus subtilis, Enterococcus faecalis, Escherichia coli y Staphylococcus aureus, causantes de diversas infecciones en humanos, adicionalmente se evaluaron dos especies patógenas de plantas Erwinia sp. y Ralstonia sp. La totalidad de cepas bacterianas se mantuvieron cultivadas en agar LB a 30 y 37 °C y conservadas a 4 °C. Los hongos fitopatógenos utilizados para evaluar la actividad antifúngica fueron: Alternaria sp., Colletotrichum sp., Fusarium sp., Pestalotia sp., y Verticillium sp., proporcionados por el laboratorio de Fitopatología de la Corporación Colombiana de Investigación Agropecuaria (CORPOICA, Sede La Selva, Rionegro, Antioquia) donde fueron aislados de diversos cultivos, identificados y donados a la colección de la CIB/UNALMED. Todas las cepas de hongos fitopatógenos crecieron a 30 °C en medio agar papa dextrosa (PDA, Merck) realizando pases para el mantenimiento de la cepa cada 7 o 10 días de acuerdo al crecimiento del hongo. La actividad insecticida fue evaluada con larvas de primer estadio de Aedes aegypti (Diptera: Culicidae) y de Spodoptera frugiperda (Lepidoptera: Noctuidae). Las larvas para los ensayos fueron producidas en el insectario de la CIB/UNALMED y fueron mantenidas en fotoperiodo de 12 horas luz y 12 horas de oscuridad a 30 °C y 70% de humedad relativa.
Actividad biológica. Actividad antibacteriana. La determinación de la actividad antibacteriana se realizó siguiendo el procedimiento del ensayo de difusión en agar descrito por Bauer et al. (1966) y modificado por el Clinical and Laboratory Standards Institute (CLSI) –anteriormente, National Committee for Clinical Laboratory Standards (NCCLS)–, (CLSI 2009, Cona 2002). Un volumen de 0,1 ml de cada especie bacteriana ajustada a una concentración equivalente a 5 x 105 UFC/ml de la escala McFarland se inoculó sobre cajas de Petri con agar Mueller-Hinton (Becton Dickinson). Sobre el agar inoculado se dispusieron discos de papel filtro estériles (Mini Trans-Blot, BIO-RAD) de 6 mm de diámetro, los cuales se impregnaron con 15 μl de cada uno de los extractos bacterianos a evaluar. Como controles negativos se emplearon 15 μl de la solución de metanol al 99,9% y 15 μl de agua estéril. Como controles positivos se usaron estreptomicina (10 mg/ml) y vancomicina (10 μg/ml) para microorganismos Gram negativos y Gram positivos, respectivamente. Las cajas de Petri inoculadas fueron incubadas a 30 °C durante 24 horas con excepción de Enterococcus faecalis, Escherichia coli y Staphylococcus aureus que se incubaron a 37 °C. Al cabo de este tiempo, se observó la presencia de halos de inhibición de crecimiento alrededor de los discos y se registró el diámetro de la zona de inhibición en mm. Todos los ensayos se llevaron a cabo por triplicado.
Actividad antifúngica. La actividad antifúngica se determinó con el método de difusión en disco, siguiendo una metodología similar a la empleada en los ensayos de actividad antibacteriana y descrita en detalle por Engelmeier y Hadacek (2006). El inóculo fúngico requerido para los ensayos estuvo conformado por una suspensión de esporas de cada especie a concentración entre 1 x 105 y 1 x 107 esporas/ml por conteo directo de esporas en cámara de Neubauer. Se sembró 0,1 ml de la suspensión de esporas de cada cepa fitopatógena en cajas de Petri previamente servidas con PDA. Se dispusieron los discos de papel filtro (Mini Trans-Blot, BIO-RAD) estériles y se aplicaron los extractos siguiendo el mismo procedimiento empleado en la evaluación antibacteriana. En este caso se incluyeron controles negativos impregnando discos de 6 mm de papel de filtro estériles con 15 μl de metanol al 99,9% y 15 μl de agua estéril. Como control positivo se utilizó anfotericina B (100 μg/ml). Las cajas de Petri inoculadas fueron incubadas a 30 °C y luego de un tiempo máximo de 120 horas se midieron los halos de inhibición del crecimiento alrededor de los discos. En caso de presentarse, se registró el diámetro de la zona de inhibición en mm. Los ensayos fueron realizados por triplicado.
Análisis estadístico. Los resultados de los ensayos de actividad antibacteriana y antifúngica de los extractos fueron analizados con el fin de conocer la eficiencia de los mismos sobre cada microorganismo blanco mediante la comparación de los diámetros de los halos de inhibición presentes en cada organismo blanco en un análisis de varianza de dos vías con el programa GraphPad Prisma versión 4.0. La prueba de Bonferroni se aplicó a los resultados que presentaron diferencias significativas (valor p < 0,05).
Actividad insecticida. La actividad insecticida de los extractos fue evaluada considerando la susceptibilidad de larvas de primer estadio de A. aegypti al ponerse en contacto con los extractos. Se emplearon microplatos de 24 pozos (MULTIWELLTM 24, Becton Dickinson), en los cuales se dispusieron 980 μl de agua estéril y 5 larvas de A. aegypti de primer estadio, posteriormente se adicionaron a cada pozo 20 μl de extracto puro y diluciones a la mitad de cada extracto. Como control positivo se utilizaron 20 μl de cultivo completo final de Bacillus thuringiensis israelensis, equivalente a 3 x 108 esporas/ml y como controles negativos 20 μl de agua estéril y 20 μl de metanol. Al cabo de 24 horas de incubación a 30 °C se calculó el porcentaje de mortalidad. Los ensayos fueron realzados por triplicado y en dos días diferentes.
Los extractos que registraron mayor mortalidad contra larvas de A. aegypti se ensayaron con larvas de S. frugiperda siguiendo la metodología descrita por Arango et al. (2002). En copas desechables de 4 cm de diámetro se sirvió previamente dieta artificial basada en frijol y se añadieron 400 μl de extracto bacteriano puro sobre su superficie. Una vez transcurridas 4 horas, cinco larvas de primer estadio de S. frugiperda fueron dispuestas en la superficie. La incubación se realizó a 30 °C durante 72 horas y al cabo de este tiempo se determinó el número de larvas muertas y se calculó el porcentaje de mortalidad. Igualmente, se realizaron otros tratamientos con diluciones a la mitad y en base 10 (1:100 y 1:1000) del extracto con agua estéril, el control positivo constituido por formulado comercial de B. thuringiensis kurstaki, Dipel, a 10.000 ng/cm2 y como controles negativos se emplearon agua estéril y una mezcla de metanol y agua (1:1). Todos los ensayos se realizaron por triplicado en dos días diferentes.
Identificación de cepas bacterianas productoras de metabolitos secundarios con actividad biológica. La identificación de las cepas bacterias productoras de metabolitos secundarios más activos (selección basada en los mayores tamaños de halos de inhibición y espectro de acción) se basó en el análisis de la secuencia parcial del ADN ribosomal 16S y caracterización bioquímica con API® 50 CHB (Biomerieux, Francia) y con MicroLogTM Minutes, GP2 MicroplateTM BIOLOG y Biolog Microbial Identification System software (MicroLogTM). La extracción del material genético bacteriano se realizó a partir de cultivos de 16 horas de crecimiento en LB siguiendo el procedimiento estándar de Sambrook et al. (1989). La amplificación de los genes que codifican para el ARNr 16S se realizó a partir del ADN genómico por PCR empleando los cebadores universales 27F (5'-AGAGTTTGATCCTGGCTCAG-3') y 1492R (5'-GGTTACATTGTTACGACTT -3'). El volumen final para cada reacción de PCR fue de 50 μl con los reactivos apropiados: tampón (1X), MgCl2 (1 mM), dNTPs (0,2 mM de cada uno), Taq polimerasa 1,2 U (Go Taq® Flexi DNA polymerase, Promega). La amplificación se llevó a cabo en un iCycler Thermal cycler de BIORAD, bajo las siguientes condiciones: un ciclo inicial de desnaturalización a 95 °C por 2 min 30 s; 30 ciclos de 95 °C por 1 min; 55,8 °C por 40 s; 72 °C por 1 min 30 s y un paso final de extensión a 72 °C por 7 min. Los productos de PCR fueron purificados y secuenciados comercialmente por Macrogen (Korea). La identificación de las cepas bacterianas fue realizada a través de comparaciones por homología de secuencias del ADNr 16S depositadas en diferentes bases de datos como GenBank NCBI (National Center for Biotechonology Information), EMBL (European Molecular Biology Laboratory) y RDP (Ribosomal Database Project).
Análisis por microscopía electrónica de barrido. Se prepararon suspensiones de S. aureus y E. faecalis de 5 x 105 UFC/ml a las cuales se les añadieron 200 μl de extracto 43B en tubos de ensayo con 200 μl de caldo Mueller-Hinton (Becton Dickinson). La misma concentración de bacterias con 200 μl de agua en tubos con 200 μl de MH fueron empleados como controles. Transcurridas 4 horas, las células fueron precipitadas y fijadas durante 1 hora con 2% (v/v) glutaraldehído en tampón fosfato 0,1 M. Posterior a la fijación, las células fueron centrifugadas y lavadas 3 veces con agua estéril. Las células bacterianas fueron deshidratadas gradualmente con etanol al 25, 50, 75 y 100% (p/v) cada uno durante 10 minutos y con centrifugaciones entre cada paso de deshidratación. Posterior al secado, las células se dispusieron sobre una lamina portaobjeto, donde fueron recubiertas en oro y examinadas en microscopio electrónico de barrido JEOL JSM 5910LV.
RESULTADOS
En este estudio, se utilizaron un total de 92 aislamientos bacterianos para la producción y extracción de metabolitos secundarios y fueron evaluados para detectar la presencia de actividad antibacteriana, antifúngica e insecticida. Se determinó que 46 aislamientos bacterianos produjeron compuestos con actividad inhibitoria frente a uno o más blancos. De los 46 extractos activos, 7 (15%) mostraron actividad antibacteriana, 14 (31%) actividad antifúngica, 7 (15%) actividad insecticida, 14 (31%) actividad antibacteriana y antifúngica, 2 (4%) actividad antibacteriana e insecticida y otros 2 (4%) actividad antifúngica e insecticida.
Se seleccionaron 12 extractos para ser analizados con mayor detalle, 5 con actividad antibacteriana contra todas las bacterias blanco, 6 con actividad antifúngica frente a la mayoría de hongos fitopatógenos y 1 extracto con actividad insecticida.
Actividad antibacteriana. La actividad antibacteriana de los extractos fue evaluada mediante el ensayo de difusión en agar utilizando como blanco bacterias patógenas de humanos y de plantas. La actividad antibacteriana fue analizada mediante una ANOVA de dos vías con los extractos y las bacterias patógenas blanco como factores. Se presentaron diferencias altamente significativas entre todos los extractos evaluados (F = 2.417,79, df = 7, P < 0,0001) que representaron aproximadamente el 81% del total de la varianza. Los extractos de los aislamientos BCBS 34A, 34B y 43B exhibieron la actividad inhibitoria más alta frente a la totalidad de las bacterias evaluadas, tanto Gram positivas como Gram negativas (tabla 1). La mayor actividad antibacteriana fue detectada en el extracto del aislamiento BCBS 43B, seguido en orden descendente por los extractos de los aislamientos 34A y 34B. La figura 1A muestra la actividad antibacteriana del extracto más activo, BCBS 43B, frente a la bacteria patógena S. aureus.
Adicionalmente, se presentaron diferencias ligeramente significativas entre las bacterias patógenas evaluadas (F = 27,72, df = 5, P < 0,0001) que explican tan sólo el 2,6% aproximadamente del total de la varianza, se concluyó que la especie más sensible a los extractos fue S. aureus y la menos sensible B. subtilis. La interacción entre los dos factores fue considerada significante (F = 24,83, df = 35, P < 0,0001) y se refleja en las variaciones de la actividad antibacteriana de los extractos frente a la bacteria blanco, algunos extractos presentaron actividad frente a algunas bacterias y otros presentaron actividad frente a todas las bacterias evaluadas (datos no presentados).
Actividad antifúngica. Los extractos fueron evaluados en su actividad antifúngica por medio del método de difusión en agar contra diferentes cepas de hongos fitopatógenos. Los análisis de varianza revelaron diferencias significativas entre los hongos fitopatógenos evaluados (F = 591,76, df = 4, P < 0,0001), la especie más sensible a los extractos fue Alternaria sp., mientras que la menos sensible fue Fusarium sp. La interacción entre los dos factores fue considerada significativa (F = 302,54, df = 32, P < 0,0001) y se refleja en las diferentes variaciones de la actividad antifúngica de los extractos de acuerdo al hongo evaluado; algunos extractos presentaron actividad frente a algunos hongos blanco, mientras otros presentaron actividad sobre todos los hongos evaluados (datos no mostrados). Al igual que en los resultados de actividad antibacteriana, los extractos de los aislamientos BCBS 34A, 34B y 43B presentaron la mayor actividad y espectro de acción frente a los diversos hongos evaluados (tabla 1). La mayor actividad antifúngica se evidenció en el extracto del aislamiento BCBS 43B, seguido en orden descendente por los extractos de los aislamientos 34A y 34B (figura 1B). En consecuencia, estos extractos fueron considerados como altamente activos y de actividad dual (antibacteriana y antifúngica) y se incluyeron en análisis posteriores.
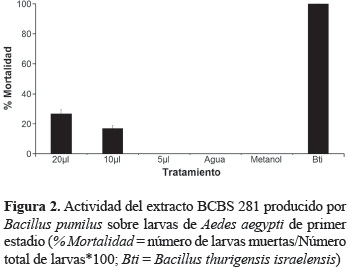
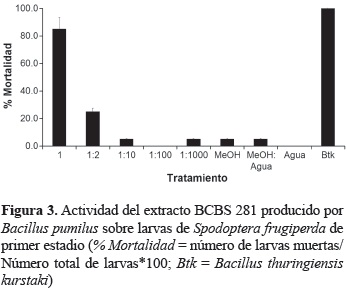
Actividad insecticida. El extracto del aislamiento BCBS 281 fue el único en mostrar un efecto insecticida sobre A. aegypti y contra S. frugiperda. Las larvas de A. aegypti fueron ligeramente sensibles al ponerse en contacto directo con 10 y 20 μl del extracto y no mostraron ningún efecto con la aplicación de 5 μl del mismo (figura 2). El efecto sobre sobre larvas de S. frugiperda fue considerado altamente tóxico mostrando más del 80% de la mortalidad larval en contacto con el extracto crudo (figura 3). Sin embargo, la mortalidad se vio considerablemente disminuida al diluir el extracto a la mitad (1:2) y fue prácticamente inactivo en las diluciones 1:100 y 1:1000.
Identificación bacteriana. De los 92 aislamientos evaluados, las cepas BCBS 34A, BCBS 34B y BCBS 43B produjeron extractos con las actividades antimicrobianas más altas y de mayor espectro (antibacteriana y antifúngica) y la cepa BCBS 281, mostró la mayor actividad insecticida. Estas cepas fueron caracterizadas morfológicamente y a través de métodos moleculares y bioquímicos para su identificación (tabla 2). Las secuencias del ADNr 16S amplificadas de las cepas BCBS 34A y BCBS 43B mostraron alta similaridad con las secuencias de las especies B. subtilis y B. amyloliquefaciens, presentando 99% de identidad. No obstante, a nivel molecular no se encontraron variaciones nucleotídicas en los fragmentos amplificados y secuenciados que permitieran una identificación definitiva entre estas dos especies. Los análisis bioquímicos con Biolog en estas cepas no pudieron ser interpretados con confiabilidad en las cepas seleccionadas y los resultados con API 50 CHB parecen indicar que las cepas BCBS 34A y BCBS 43B pertenecen a la especie B. subtilis con una probabilidad del 65 y 94,5%, respectivamente (tabla 3). El perfil bioquímico obtenido para la cepa BCBS 34B usando Biolog Microbial Identification System (MicrologTM) permitió determinar que corresponde a la especie B. amyloliquefaciens con un 99% de probabilidad aunque no pudo ser corroborado con los otros métodos empleados. El aislamiento BCBS 281 fue identificado con alta confiabilidad como B. pumilus, debido a que presentó 99% de probabilidad de pertenecer a esta especie en cada uno de los métodos de identificación utilizados (tabla 2).
Microscopía electrónica de barrido. La microscopía electrónica de barrido posibilitó la evaluación de la morfología de las células de S. aureus y E. faecalis tratadas con el extracto BCBS 43B. Las células estuvieron en contacto con el extracto durante 4 horas y al cabo de este período, no se observó crecimiento bacteriano en comparación con el tratamiento control (sin extracto), el cual presentó turbidez.
En las figuras 4A y 4B se observan las micrografías de células de S. aureus en caldo MH en ausencia y presencia del extracto bacteriano. Se observó que en el tratamiento control (figura 4A) las células de S. aureus se presentan individuales o en pares con un tamaño aproximado de 0,7 a 0,8 μm de diámetro, mientras que las células tratadas con el extracto (figura 4B) se mantuvieron en agrupamientos irregulares donde se observa un menor tamaño celular 0,4 a 0,5 μm comparadas con aquellas sin adición del extracto antimicrobiano. En las figuras 4C y 4D se observan las células de E. faecalis con y sin contacto con el extracto, respectivamente. La muestras de E. faecalis presentaron una forma esférica de aproximadamente 0,6 μm de diámetro en el control (figura 4C), pero al ponerse en contacto con el extracto se observaron anomalías en la morfología celular perdiendo la forma esférica y mostrando indicios de lisis celular (figura 4D). Por tanto, hubo alteración morfológica en los cultivos de las bacterias, causados por el extracto antimicrobiano producido por la cepa BCBS 43B perteneciente al género Bacillus.
DISCUSIÓN
Los extractos obtenidos de diversas bacterias de suelo fueron ensayados con el fin de conocer la presencia de sustancias antimicrobianas e insecticidas. Los extractos de metabolitos secundarios producidos por las cepas identificadas a nivel de género como Bacillus (BCBS 34A, BCBS 34B y BCBS 43B), presentaron la mayor actividad antimicrobiana determinadas por el tamaño del halo de inhibición y por el amplio espectro de actividad frente a las bacterias patógenas de humanos, de plantas y a la mayoría de los hongos fitopatógenos evaluados.
Asimismo, el extracto BCBS 281 producido por la bacteria identificada como B. pumilus fue seleccionado por ser el único de los 92 aislamientos en presentar actividad insecticida contra larvas de dos especies de insectos de los órdenes Diptera y Lepidoptera. La bacteria B. pumilus ha sido comúnmente aislado del suelo y se ha caracterizado por producir sustancias con propiedades interesantes desde el punto de vista biotecnológico. Algunas cepas de B. pumilus han mostrado actividad antifúngica (Munimbazi y Bullerman 1998) y han sido usadas como control biológico de hongos fitopatógenos (Lehman et al. 2001). Otras cepas de B. pumilus promueven el crecimiento de plantas (Forchetti et al. 2007), otras han sido utilizados como probióticos y otras han mostrado potencial de acción antibacteriana (Wulff et al. 2002). Sin embargo, B. pumilus no se considera un patógeno de insectos como otros miembros del género Bacillus (B. thuringiensis y B. sphaericus). Hasta donde sabemos, existen pocos reportes anteriores sobre la actividad insecticida de esta especie, siendo uno, una patente de esta especie activa contra el gusano de la raíz del maíz (Diabrotica undecimpunctata) y el gusano cogollero (S. exigua) (Heins et al. 1999) y un estudio sobre la selección de B. pumilus con actividad contra la mosca del Mediterráneo (Molina et al. 2010). Estos resultados evidencian que microorganismos del género Bacillus continúan siendo una fuente importante de metabolitos secundarios biológicamente activos (Sansinenea y Ortiz 2011), y que presentan un gran potencial para producir una gran variedad de metabolitos activos, lo cual ha comenzado a ser valorado e intensamente estudiado en la medicina e industria (Lisboa et al. 2006).
Las cepas productoras de metabolitos secundarios con actividad antimicrobiana fueron identificadas con alta confiabilidad a nivel de género y presentaron alta similitud con las especies B. subtilis y B. amyloliquefaciens. Los estudios basados en filogenias demuestran que las especies B. subtilis y B. amyloliquefaciens se encuentran cercanamente relacionadas (Xu y Côté 2003). Adicionalmente, las características fenotípicas de estas cepas son consideradas tan similares que pueden ser fácilmente confundidas (Arguelles-Arias et al. 2009).
La asignación taxonómica definitiva a nivel de especie de las cepas bacterianas productoras de metabolitos secundarios antimicrobianos requiere el análisis a través de otras técnicas moleculares como el uso de más marcadores filogenéticos o el estudio por hibridización de DNA-DNA. Las ligeras diferencias encontradas entre el origen de las muestras, características morfológicas, genéticas y bioquímicas así como en el espectro de actividad de los extractos producidos podrían indicar alguna relación entre la composición, cantidad y potencial de cada extracto con la producción de los mismos en determinada especie y cepa. La futura identificación de las cepas de Bacillus a nivel de especie y la caracterización de los metabolitos producidos por las mismas, permitirá confirmar si la producción y composición de metabolitos secundarios se relaciona más a nivel de cepas o de especies, como fue sugerido por Alippi y Reynaldi (2006) y Wulff et al. (2002), quienes comunicaron que los mecanismos involucrados en la producción de metabolitos para el control biológico son complejos y dependen de las características de un aislamiento en particular (muchas veces presión natural) más que de la especie misma.
Las especies B. subtilis y B. amyloliquefaciens son reconocidas por producir lipopéptidos con propiedades antifúngicas (Zuber et al. 1993), como iturinas (Caldeira et al. 2007, Moyne et al. 2001), los cuales han sido usados para combatir una gran variedad de patógenos de plantas como Aspergillus flavus, Gloeosporium gloeosporioides, Monilinia fructicola, Ophiostoma ulmi y Rhizoctonia solani, actualmente Colletotrichum gloeosporioides (Cho et al. 2003). Asimismo, estas dos especies de Bacillus también han sido reconocidas por la producción péptidos antibacterianos como bacteriocinas y otras sustancias como, surfactinas, bacilomicinas, anfomicinas, acivicina, valinomicina y estenotricina, entre otras (Wulff et al. 2002).
La actividad inhibitoria de los antimicrobianos producidos por las especies de Bacillus se ha observado con mayor frecuencia contra hongos que contra bacterias (Földes et al. 2000, Wulff et al. 2002). Adicionalmente, es común encontrar que en los extractos de actinomicetos, Lactobacillus spp., hongos y plantas, se detecta mayor actividad antibacterial contra especies Gram positivas y menor actividad contra bacterias Gram negativas (Gaspari et al. 2005, Wulff et al. 2002). Se ha estimado que dentro del grupo de los antibióticos conocidos, la actividad inhibitoria contra microorganismos Gram positivos y negativos existe en un 66 y 30% de los compuestos, respectivamente (Bérdy 2005). Adicionalmente, entre todos los antibióticos en total, 34% muestran actividad antifúngica (Bérdy 2005). En contraste con estos antecedentes, en el presente estudio se encontró que el espectro de los extractos con alta actividad antimicrobiana abarcó la inhibición de especies bacterianas tanto Gram positivas como Gram negativas, así como diversas especies de hongos. Estos resultados podrían sugerir que la actividad antimicrobiana de los mejores extractos se debió a la producción de un compuesto antimicrobiano de amplio espectro y varios compuestos con diferentes actividades y diferentes mecanismos de acción, los cuales por un efecto de sinergismo por combinación de sustancias, pudieran presentar actividad frente a los diferentes blancos evaluados.
Las especies de Bacillus presentan diversas características especiales que las hacen buenas candidatas como agentes para control biológico. Son habitantes comunes del suelo, o existen como epífitos o endofítos en la espermósfera (Walker et al. 1998) y rizósfera (Handelsman et al. 1990). Esta característica hace posible el uso de las cepas biológicamente activas o de sus metabolitos como una alternativa o método suplementario prometedor para el control de patógenos de plantas (Földes et al. 2000). Adicionalmente, son conocidas por su potencial como productoras de antibióticos con actividad contra hongos y algunos patógenos bacterianos (Siloh-Suh et al. 1994, Wulff et al. 2002). Forman esporas resistentes que tienen alta viabilidad comparada con las células vegetativas por ser resistentes a la desecación, al calor, a la radiación UV y a los solventes orgánicos, lo cual es importante para procesos posteriores de producción, formulación y comercialización (Han et al. 2005, Walker et al. 1998). La habilidad de colonizar plantas endofíticamente ha sido considerada como una característica importante para el control biológico de patógenos vasculares (Wulff et al. 2002); además de producir sustancias antimicrobianas, tienen actividad promoviendo el crecimiento de plantas. En particular, algunas cepas de B. subtilis y B. amyloliquefaciens han mostrado la capacidad de producir sustancias promotoras del crecimiento vegetal, como giberelinas y ácido indol acético, y el empleo de B. subtilis y sus especies relacionadas ha mostrado un incremento en la productividad de varios cultivos en campo (Reva et al. 2004).
CONCLUSIONES
La habilidad de producir compuestos biológicamente activos fue detectada en 46 (50%) del total de 92 bacterias nativas de suelo, lo cual reconoce a la microbiota natural de suelos como una fuente promisoria de sustancias bioactivas. Tres aislamientos produjeron los extractos que presentaron mayor actividad antimicrobiana, estas cepas fueron identificadas como del género Bacillus, género que ha sido previamente estudiado en cuanto a su producción de compuestos biológicamente activos contra hongos principalmente y bacterias. Tan sólo un extracto presentó la mayor actividad insecticida y fue producido por B. pumilus, el cual no se ha registrado con producción de compuestos activos contra insectos. Los cambios morfológicos, tamaños celulares y agrupamientos anormales observados en las células de E. faecalis y S. aureus en contacto con el extracto BCBS 43B a través de microscopio electrónico corroboran la actividad antibacteriana detectada en los ensayos de difusión en agar. En el presente trabajo, se confirma la utilidad de ciertos productos naturales provenientes de bacterias nativas del país como una fuente de compuestos con potencial utilidad en el control de patógenos y plagas comunes en la salud y la agricultura.
REFERENCIAS
1. Alippi AM, Reynaldi FJ. 2006. Inhibition of the growth of Paenibacillus larvae, the causal agent of American foulbrood of honeybees, by selected strains of aerobic spore-forming bacteria isolated from apiarian sources. Journal of Invertebrate Pathology, 91: 141-146. [ Links ]
2. Arango JA, Romero M, Orduz S. 2002. Diversity of Bacillus thurigensis strains from Colombia with insecticidal activity against Spodoptera frugiperda (Lepidoptera: Noctuidae). Journal of Applied Microbiology, 92 (3): 466-474. [ Links ]
3. Arguelles-Arias A, Ongena M, Halimi B, Lara Y, Brans A, Joris B, Fickers P. 2009. Bacillus amyloliquefaciens GAI as a source of potent antibiotics and other secondary metabolites for biocontrol of plant pathogens. Microbial Cell Factories, 8 (63): 1-12. [ Links ]
4. Bauer AW, Kirby W, Sherrus J, Truck M. 1966. Antibiotic susceptibility testing by a standardized single disc method. American Journal of Clinical Pathology, 45: 493-496. [ Links ]
5. Baur S, Niehaus J, Karagouni AD, Katsifas EA, Chalkou K, Meintanis C, Jones AL, Goodfellow M, Ward AC, Beil W, Schneider K, Süssmuth RD, Fiedler HP. 2006. Fluostatins C E novel members of the fluostatin family produced by Streptomyces strain. Journal of Antibiotics, 59: 293-297. [ Links ]
6. Bérdy J. 2005. Bioactive microbial metabolites. Journal of Antibiotics, 58: 1-26. [ Links ]
7. Caldeira AT, Feio SS, Arteiro JMS, Coelho AV, Roseiro JC. 2007. Environmental dynamics of Bacillus amyloliquefaciens CCMI 1051 antifungal activity under different nitrogen patterns. Journal of Applied Microbiology, 104: 808-816. [ Links ]
8. Casey JT, Walsh PK, O'Shea DG. 2007. Characterization of adsorbent resins for the recovery of geldanamycin from the fermentation broth. Separation and Purification Technology, 53: 281-288. [ Links ]
9. Cho S, Lee S-K, Cha BJ, Kim YH, Shin K-S. 2003. Detection and characterization of the Gloeosporium gloeosporioides growth inhibitory compound iturin A from Bacillus subtilis strain KS03. FEMS Microbiology Letters, 223: 47-51. [ Links ]
10. Cona E. 2002. Condiciones para un buen estudio de susceptibilidad mediante test de difusión en agar. Revista Chilena de Infectología, 19: 77- 81. [ Links ]
11. Demain AL. 1999. Pharmaceutically active secondary metabolites of microorganisms. Applied Microbiology and Biotechnology, 52: 455-463. [ Links ]
12. Demain AL. 2006. From natural products discovery to commercialization: a success story. Journal of Industrial Microbiology and Biotechnology, 33: 486-495. [ Links ]
13. Engelmeier D, Hadacek F. 2006. Antifungal natural products: assays and applications. En: Rai M, Carpinella MC, editors. Naturally occurring bioactive compounds. Amsterdam: Elsevier. p. 423-467. [ Links ]
14. Földes T, Bànhegyi I, Herpai Z, Varga L, Szigeti J. 2000. Isolation of Bacillus strains from the rhizosphere of cereals and in vitro screening for antagonism against phytopathogenic, food-borne pathogenic and spoilage micro-organisms. Journal of Applied Microbiology, 89: 840-846. [ Links ]
15. Forchetti G, Masciarelli O, Alemano S, Alvarez D, Abdala G. 2007. Endophytic bacteria in sunflower (Helianthus annuus L.): isolation, characterization, and production of jasmonates and abscisic acid in culture medium. Applied Microbiology and Biotechnology, 76: 1145-1152. [ Links ]
16. Frykman S, Tsuruta H, Galazzo J, Licari P. 2006. Characterization of product capture resin during microbial cultivations. Journal of Industrial Microbiology and Biotechnology, 33: 445-453. [ Links ]
17. Gaspari F, Paitan Y, Mainini M, Losi D, Ron EZ, Marinelli F. 2005. Myxobacteria isolated in Israel as potential source of new anti-infectives. Journal of Applied Microbiology, 98: 429-439. [ Links ]
18. Hadacek F, Greger H. 2000. Testing of antifungal natural products: methodologies, comparability of results and assay choice. Phytochemical Analysis Journal, 11: 137-147. [ Links ]
19. Han JS, Cheng JH, Yoon TM, Song J, Rajkarnikar A, Kim WG, Yoo ID, Yang YY, Suh JW. 2005. Biological control agent of common scab disease by antagonistic strain Bacillus sp. sunhua. Journal of Applied Microbiology, 99: 213-221. [ Links ]
20. Handelsman J, Raffel S, Mester EH, Wunderlich L, Grau CR. 1990. Biological control of damping-off of alfalfa seedlings with Bacillus cereus UW85. Applied and Environmental Microbiology, 56: 713-718. [ Links ]
21. Heins SD, Manker DK, Jimenez DR, Marrone PG. 1999. Bacillus pumilus strain for controlling corn rootworm, nematode and armyworm infestations. U. S. Patent 6,001,637. [ Links ]
22. Kim PI, Chung K. 2004. Production of an antifungal protein for control of Colletotrichum lagenarium by Bacillus amyloliquefaciens MET0908. FEMS Microbiology Letters, 234: 177-183. [ Links ]
23. Krug D, Zurek G, Revermann O, Vos M, Velicer GJ, Müller R. 2008. Discovering the hidden secondary metabolome of Myxococcus xanthus: a study of intraspecific diversity. Applied and Environmental Microbiology, 74: 3058-3068. [ Links ]
24. Lehman LJ, Mccoy RJ, Messenger BJ, Manker DC, Orjala JE, Lindhard D, Marrone PG. 2001. Strain of Bacillus pumilus for controlling plant diseases caused by fungi. U.S. Patent 6,245,551 B1. [ Links ]
25. Lisboa M, Boniato D, Bizani D, Henriques JAP. Brandelli A. 2006. Characterization of a bacteriocin-like substance produced by Bacillus amyloliquefaciens isolated from the Brazilian Atlantic forest. International Microbiology, 9: 111-118. [ Links ]
26. Liu CH, Zou WX, Lu H, Tan RX. 2001. Antifungal activity of Artemisia annua endophyte cultures against phytopathogenic fungi. Journal of Biotechnology, 88: 277-282. [ Links ]
27. Luzhetskyy A, Pelzer S, Bechthold A. 2007. The future of natural products as a source of new antibiotics. Current Opinion in Investigational Drugs, 8: 608-613. [ Links ]
28. Molina CA, Caña-Roca JF, Osuna Vilchez S. 2010. Selection of a Bacillus pumilus strain highly active against Ceratitis capitata (Wiedemann) larvae. Applied and Environmental Microbiology, 76: 1320-1327. [ Links ]
29. Moyne A-L, Shelby R, Cleveland Te, Tuzun S. 2001. Bacillomycin D: an iturin with antifungal activity against Aspergillus avus. Journal of Applied Microbiology, 90: 622-629. [ Links ]
30. Munimbazi C, Bullerman LB. 1998. Isolation and partial characterization of antifungal metabolites of Bacillus pumilus. Journal of Applied Microbiology, 84: 959-968. [ Links ]
31. Narayanan K. 2004. Insect defense: its impact on microbial control of insect pest. Current Sciences, 86: 800-814. [ Links ]
32. Nathan SS. 2006. The use of Eucalyptus tereticornis Sm. (Myrtaceae) oil (leaf extract) as a natural larvicidal agent against the malaria vector Anopheles stephensi Liston (Diptera: Culicidae). Bioresource Technology, 98: 1856-1860. [ Links ]
33. CLSI (Clinical and Laboratory Standards Institute). 2009. Methods for dilution antimicrobial susceptibility test for bacteria that grow aerobically: Approved Standard. Eighth edition. M07-A8. Vol. 29 (2): 1-65. [ Links ]
34. Pushpalatha E, Muthukrishnan J. 1999. Efficacy of two tropical plant extracts for the control of mosquitoes. Journal of Applied Entomology, 123: 369-373. [ Links ]
35. Reva O, Dixelius C, Meijer J, Priest FG. 2004. Taxonomic characterization and plant colonizing abilities of some bacteria related to Bacillus amyloliquefaciens and Bacillus subtilis. FEMS Microbiology Ecology, 48: 249-259. [ Links ]
36. Romero-Tabarez M, Jansen R, Sylla M, Lünsford H, Häuβler S, Santosa DA, Timmis KN, Molinari G. 2006. 7-O-malonyl macrolactin A, a new macrolactin antibiotic from Bacillus subtilis active against methicillin-resistant Staphylococcus aureus, Vancomycin-resistant enterococci, and a small-colony variant of Burkholderia cepacia. Antimicrobial Agents and Chemotherapy, 50: 1701-1709. [ Links ]
37. Sambrook J, Fritsch E, Maniatis T. 1989. Molecular cloning a laboratory manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press. p. 159. [ Links ]
38. Sansinenea E, Ortiz A. 2011. Secondary metabolites of soil Bacillus spp. Biotechnology Letters, 33: 1523-1538. [ Links ]
39. Sasse F, Steinmetz H, Höfle G, Reichenbach H. 1994. Gephyronic acid, a novel inhibitor of eukaryotic protein synthesis from Archangium gephyra (Myxobacteria) production, isolation, physico-chemical and biological propierties, and mechanism of action. The Journal of Antibiotics, 48: 21-25. [ Links ]
40. Siloh-Suh LA, Lethbridge BJ, Raffel SJ, He H, Clardy J, Handelsman J. 1994. Biological activities of two fungistatic antibiotics produced by Bacillus cereus UW85. Applied and Environmental Microbiology, 60: 2023-2030. [ Links ]
41. Strohl WR. 2004. Antimicrobials. En: Bull AT, editor. Microbial diversity and bioprospecting. Washington D. C. (U. S. A.): ASM Press. p. 336-356. [ Links ]
42. Tasao R, Romanchuk FE, Peterson CJ, Coats JR. 2002. Plant growth regulatory effect and insecticidal activity of the extracts of the tree of heaven (Ailanthus altissima L.). BioMed Central Ecology, 2: 1-8. [ Links ]
43. Vining LC. 1990. Functions of secondary metabolites. Annual Review of Microbiology, 44: 395-427. [ Links ]
44. Walker R, Powell AA, Seddon B. 1998. Bacillus isolates from the spermosphere of peas and dwarf French beans with antifungal activity against Botrytis cinerea and Pythium species. Journal of Applied Microbiology, 84: 791-801. [ Links ]
45. Wulff EG, Mguni CM, Mansfeld-Giese K, Fels J, Lübeck M, Hockenhull J. 2002. Biochemical and molecular characterization of Bacillus amyloliquefaciens, B. subtilis and B. pumilus isolates with distinct antagonistic potential against Xanthomonas campestris pv. campestris. Plant Pathology, 51: 574-584. [ Links ]
46. Xu D, Côté JC. 2003. Phylogenetic relationships between Bacillus species and related genera inferred from comparision of 3' end 16S rDNA and 5' end 16S-23S ITS nucleotide sequences. International Journal of Systematic and Evolutionary Microbiology, 53: 695- 704. [ Links ]
47. Zuber P, Nakano M, Marahiel MA. 1993. Peptide antibiotics. En: Sonenshein AL, Hoch JA, Losick R, editors. Bacillus subtilis and other Gram-positive bacteria. Washington D. C. (U. S. A.): ASM Press. p. 897-916. [ Links ]