Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.34 no.96 Medellín Jan./June 2012
ARTÍCULOS DE INVESTIGACIÓN
ESTRUCTURA DE UN ENSAMBLAJE DE ESCARABAJOS COPRÓFAGOS (COLEOPTERA: SCARABAEINAE) EN TRES SITIOS CON DIFERENTE USO DEL SUELO EN ANTIOQUIA, COLOMBIA
DUNG BEETLE ASSEMBLAGE STRUCTURE (COLEOPTERA: SCARABAEINAE) IN THREE SITES WITH DIFFERING LAND USE IN ANTIOQUIA, COLOMBIA
Jorge Ari Noriega1,2; Javier M. Palacio3; José D. Monroy-G.1,5; Edison Valencia4
1 Laboratorio de Zoología y Ecología Acuática (LAZOEA), Universidad de Los Andes. Bogotá, Colombia.
2 Scarabaeinae Research Network - ScarabNet. jnorieg@hotmail.com.
3 Pontificia Universidad Javeriana. Bogotá, Colombia. javier-palacio82@hotmail.com.
4 University of Lethbridge. Calgary, Canadá. edivalen@gmail.com.
Correo electrónico: 5 dannielmonroy@gmail.com.
Recibido: octubre 2011. Aceptado: marzo 2012.
Resumen
Los bosques andinos se encuentran sometidos a fuertes procesos de perturbación y fragmentación debido a la creación de pastizales y explotación de monocultivos, especialmente, cafetales. Adicionalmente, es poca la información acerca de la capacidad que tienen estos relictos de bosque para mantener su biodiversidad. Se realizó un estudio en una finca cafetalera-ganadera en el municipio de Tarso (Antioquia), Colombia, utilizando a los escarabajos coprófagos como grupo bioindicador. Se realizaron tres muestreos en tres hábitats: bosque, cafetal y pastizal, cada uno de ellos con un transecto de nueve trampas de caída, cebadas con excremento de cerdo por 48 h. Se recolectaron un total de 779 individuos, distribuidos en 13 especies y 7 géneros. Las especies: Onthophagus curvicornis (n = 196, 25,2%) y Oxysternon conspicillatum (n = 159, 20,4%) fueron las especies dominantes. No hubo diferencias significativas en la riqueza, abundancia, ni en la diversidad entre hábitats, pero si en la biomasa. El ensamblaje estuvo dominado por cavadores, algunos endocópridos y ninguna especie rodadora, evidenciando el alto grado de perturbación del bosque. El cafetal fue el hábitat que presentó la mayor diversidad, posiblemente debido a una mayor oferta alimenticia. Las diferencias entre las biomasas encontradas responden a los procesos de perturbación y fragmentación, ocasionando que el ensamblaje estuviera dominado por O. conspicillatum, lo cual sugiere que la presencia de esta especie en esta localidad sería indispensable para el mantenimiento de la funcionalidad ecosistémica.
Palabras clave: biomasa, cafetales, ensamblaje, escarabajos coprófagos, relictos de bosque húmedo premontano, Scarabaeidae.
Abstract
Andean forests are subjected to strong hábitat disturbance and fragmentation due to the creating of pasture and crop monocultures, especially coffee. In addition, there is little information available concerning the ability of these forest relicts to maintain their biodiveristy. This study was conducted in a coffee-ranching farm in the municipality of Tarso (Antioquia), Colombia, using dung beetles are a bioindicator group. Three inventories in three habitats were conducted, each via a transect with nine pitfall traps baited with pig feces during 48 hours. A total of 779 individuals belonging to 13 species and 7 genera were collected. Onthophagus curvicornis (n = 196, 25,2%) and Oxysternon conspicillatum (n = 159, 20,4%) were the dominant species. There were no significant differences among the habitats in terms of richness, abundance, or diversity, but they did differ in biomass. The assemblage was dominated by diggers, with some endocoprids, and no roller species, indicating the high degree of disturbance to the forests. The coffee plantation was the habitat with the highest diversity, perhaps due to a greater food supply. The biomass differences documented were probably a result of hábitat disturbance and fragmentation, leading to the dominance of O. conspicillatum, suggesting that the presence of this species in this área will be indispensable for maintaining ecosystem functionality.
Key words: biomass, coffee plantations, assemblage, dung beetles, premountain humid forest relicts, Scarabaeidae.
INTRODUCCIÓN
Los bosques andinos en Colombia están sometidos a grandes presiones de perturbación, originando una disminución de la riqueza y diversidad faunística (Carrizosa 1990, Henderson et al. 1991, Kattan y Álvarez-López 1996). La extensión original de este hábitat ha sido modificada y transformada a lo largo de los años por eventos de disturbio como tala, sistemas agrícolas extensivos, ganadería y una fuerte expansión de las poblaciones humanas (Andrade 1992, Kappelle y Brown 2001, Wassenaar et al. 2007). El cultivo del café es uno de los usos del suelo que mayor deforestación ha causado en este ecosistema, calculada en 400.000 hectáreas de bosque nativo andino (Allen y Barnes 1985, Etter y Villa 2000). De igual manera los pastizales para ganadería en esta región, representan el grado máximo de disturbio y transformación, presentándose una tala indiscriminada del bosque, sin tener en cuenta que en ocasiones el suelo no es apto para este uso (Tilman et al. 2001).
En este tipo de ecosistemas, con regímenes frecuentes de perturbación, los insectos bioindicadores son un excelente grupo para analizar los efectos y procesos ambientales (Brown 1991, Kremen et al. 1993). Uno de los grupos más utilizados en estudios de evaluación y monitoreo de la biodiversidad mediante grupos indicadores son los escarabajos coprófagos (Coleoptera: Scarabaeinae), ya que responden de manera cualitativa y cuantitativa a la perdida del hábitat y a los efectos de la fragmentación en diferentes ecosistemas (Arellano et al. 2005, Boonrotpong et al. 2004, Concha-Lozada et al. 2010, Davis et al. 2001, Escobar 2004, Estrada y Coates-Estrada 2002, Halffter y Arellano 2002, Horgan 2005, McGeoch et al. 2002, Medina et al. 2002, Nichols et al. 2007, Noriega et al. 2007a, Shahabuddin et al. 2005). Esta familia contiene unas 5.900 especies a nivel mundial con 250 géneros (ScarabNet 2009), para el territorio colombiano se han registrado 39 géneros con aproximadamente 290 especies (Medina y Pulido 2009, Medina et al. 2001, Noriega et al. 2006, 2007b, 2008, Pulido et al. 2007, Vaz-De-Mello 2003).
Para este grupo de insectos, los eventos de disturbio, fragmentación y a largo plazo, de pérdida de hábitat, generan una reducción en la heterogeneidad espacial que se ve expresada en una disminución en la riqueza, abundancia, composición de especies y de grupos funcionales (Horgan 2005, 2008). Además, en fragmentos pequeños o muy perturbados las poblaciones de vertebrados se reducen al punto de desaparecer, lo cual tiene un efecto negativo directo en la producción de excremento, afectando la estructura del ensamblaje (sensu Fauth et al. 1996) y su biomasa (Arellano et al. 2005).
De acuerdo con las consideraciones anteriores, este trabajo busca analizar el efecto de diferentes usos del suelo sobre la estructura del ensamblaje de escarabajos coprófagos en una finca en la región andina en Antioquia, Colombia y su posible impacto en la funcionalidad ecosistémica.
Materiales y Métodos
Área de estudio. Este estudio se llevó a cabo en la Finca Las Camelias, en el municipio de Tarso (Antioquia), Colombia (05° 52' 11'' N; 75° 49' 33'' O; figura 1), a 1.325 msnm, una temperatura promedio de 22 °C. La finca presenta una matriz transformada que alberga fragmentos de bosque húmedo premontano, cafetales y pastizales. La precipitación de la región presenta un régimen bimodal, presentando dos épocas de lluvias: de marzo a junio y de octubre a diciembre, con un promedio anual de 2.200 mm (municipio de Tarso 2010).
Fase de campo y laboratorio. En cada uno de los tres hábitats (bosque, cafetal y pastizal) se estableció un transecto de 270 m, paralelo al borde, a una distancia de 50 m. Siguiendo la metodología propuesta por Noriega y Fagua (2009) en cada transecto se colocaron nueve trampas de caída, separadas 30 m entre si, cebadas con 30 g de excremento de cerdo fresco, durante 48 h. Se realizaron tres muestreos consecutivos en época de lluvias: 30 de marzo, 3 de abril y 7 de abril de 2008, con una diferencia de cuatro días (96 h) entre cada uno, para un esfuerzo total de 1.296 horas/trampa en cada hábitat.
El material recolectado se identificó a especie en el Laboratorio de Ecología y Conservación de la Pontificia Universidad Javeriana, utilizando diversas claves taxonómicas (Camero 2010, Edmonds y Zidek 2004, Genier 1996, 2009, Medina y Lopera-Toro 2000, Vaz-De-Mello et al. 2011), la comparación con material de colecciones: Colección Entomológica Museo de Historia Natural Universidad de Los Andes (ANDES-E.), Colección de Referencia Jorge Ari Noriega (CJAN) y Museo Javeriano de Historia Natural Lorenzo Uribe S.J. (MPUJ); y la ayuda de especialistas internacionales: F. Genier, F. Vaz-de-Mello y P. Gandini. El material etiquetado se depositó en la colección de referencia CJAN del primer autor.
Adicionalmente, se realizó la medición de la biomasa por especie y para la totalidad del ensamblaje en cada uno de los hábitats, siguiendo el protocolo de Davis (1996) y Lobo (1993). Se seleccionaron 10 individuos al azar de cada especie, los cuales fueron deshidratados en un horno a 150 °C durante 12 h. Después se pesaron en una balanza electrónica de precisión (Sartorius BP 210S), calculando el peso promedio por individuo de cada especie. Aquellas especies con un número de individuos menor a 10 no fueron incluidas en el análisis.
Análisis de datos. Se elaboraron curvas de acumulación de especies para cada uno de los hábitats utilizando el programa EstimateS v. 8.2.0 (ACE, Chao 1, Jack 1 y Jack 2; Colwell 1997). Se calcularon los índices de Shannon-Wiener y Simpson para diversidad alfa (a) y dominancia, utilizando el programa Biodiversity Pro. Para calcular la diversidad beta (b) se utilizó el índice de similitud de Jaccard. Se realizó una prueba de normalidad usando el test de Shapiro-Wilk y una prueba de Bartlett para evaluar la homogeneidad de las varianzas. Para comparar las abundancias, riquezas, diversidades y biomasas entre hábitats y muestreos se utilizaron pruebas de Kruskal- Wallis. Todas las pruebas estadísticas se realizaron en el programa Statistix v. 8.1 con un nivel de confianza de α = 0,05.
Resultados
Riqueza, abundancia y diversidad. Se recolectaron un total de 779 individuos pertenecientes a seis tribus, siete géneros y 13 especies de la subfamilia Scarabaeinae (Coleoptera) (tabla 1). Las especies más abundantes fueron Onthophagus curvicornis (n = 196, 25,2%), Oxysternon conspicillatum (n = 159, 20,4%), U. cf. pauliani (n = 115, 14,8%) y Ontherus lunicollis (n = 92, 11,8%). Todos los géneros encontrados, exceptuando Onthophagus, que es un género paleoamericano, son de afinidad biogeográfica Neotropical.
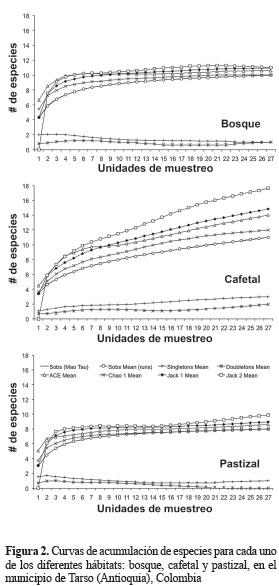
Las curvas de acumulación de especies demostraron que la eficiencia promedio del muestreo fue del 78%, obteniéndose en el bosque la captura más alta (90-95%), en el pastizal entre 80-95% y en cafetal entre 60-90% (figura 2). Las curvas de acumulación demostraron que el pastizal y el bosque estuvieron eficientemente muestreados, pero el cafetal según algunos de los estimadores necesita mayor esfuerzo de muestreo.
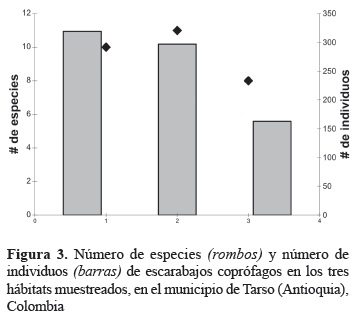
El cafetal fue el hábitat que presentó mayor riqueza con 11 spp., seguido por el bosque (10 spp.) y el pastizal (8 spp.). En cuanto a la abundancia, el bosque presentó el mayor número de individuos (n = 319), seguido por el cafetal (n = 297) y el pastizal (n = 163) (figura 3). Sin embargo, el análisis de Kruskal- Wallis demostró que no existen diferencias estadísticamente significativas en el número de especies por hábitat (H = 1,856; p = 0,395; α = 0,05), ni en el número de individuos por hábitat (H = 0,648; p = 0,723; α = 0,05).
El bosque presentó la mayor diversidad alfa (H' = 0,442) seguido por el cafetal (H' = 0,434) y el pastizal (H' = 0,332), sin encontrarse diferencias estadísticamente significativas (H = 3,693; p = 0,157; α = 0,05). Con respecto a la dominancia, el bosque presentó el mayor valor (D = 0,616), seguido por el cafetal (D = 0,583) y el pastizal (D = 0,609), sin encontrarse diferencias estadísticamente significativas (H = 1,470; p = 0,479; α = 0,05). La diversidad beta, según el índice de similitud de Jaccard, tampoco presentó diferencias entre ninguno de los hábitats (bosque y cafetal = 0,750; cafetal y pastizal = 0,727; bosque y pastizal = 0,636) y la gamma de 13. El índice de recambio en la composición de especies osciló entre 27-38% entre los tres hábitats muestreados.
Grupos funcionales y especies exclusivas. Con respecto a los tipos de relocalización del recurso alimenticio, no se registró la presencia de ninguna especie con hábitos telecópridos (rodadores, tribu Deltochilini), mientras que los paracópridos (cavadores, 11 spp., n = 776, 99,6%) fueron el grupo dominante, seguido por los endocópridos (residentes, 2 spp., n = 3, 0,38%), con dos especies Eurysternus foedus que se registró en el cafetal (n = 1) y E. velutinus que se recolectó en el bosque (n = 2) (tabla 1).
En el bosque se registraron de manera exclusiva E. velutinus y Onthophagus sp. 1 y en el cafetal se registraron E. foedus y Onthophagus clypeatus, mientras que en el pastizal no se registró ninguna especie exclusiva (tabla 1). El número de especies compartidas entre bosquecafetal y cafetal-pastizal fue el mismo, ocho especies. De las 13 especies registradas, siete se presentaron en los tres hábitats, aunque sus abundancias no fueron homogéneas.
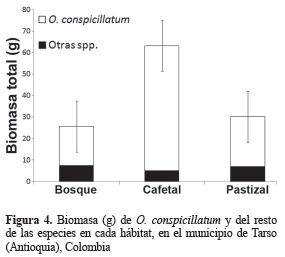
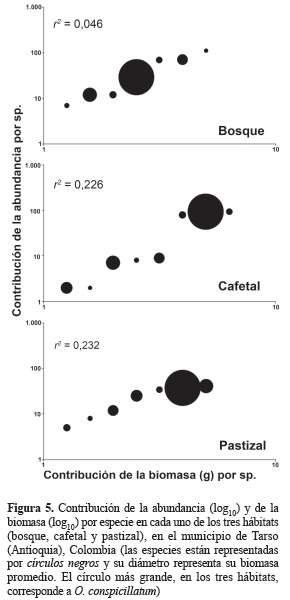
Biomasa. De las 13 especies recolectadas, se cuantificó la biomasa para ocho de ellas, ya que las restantes presentaron menos de diez individuos (tabla 1). El 83% de la biomasa del ensamblaje corresponde a O. conspicillatum (99,39 g). Ninguna de las especies restantes sobrepasó el 5%. El cafetal presentó la mayor biomasa (63,14 g, 53,1%) seguido por el pastizal (30,07 g, 25,3%) y el bosque (25,56 g, 21,5%) (figura 4), registrándose diferencias estadísticamente significativas entre la biomasa total entre los tres hábitats (H = 8,350; p = 0,015; α = 0,05). La contribución de O. conspicillatum a la estructura del ensamblaje es más importante (en términos de biomasa) en el cafetal, presentándose el valor máximo de correlación entre abundancia y biomasa (r2 = 0,226; n = 8; p = 0,23), mientras que en el bosque ocupa la posición más basal en la estructura con un valor de correlación cercano a 0 (r2 = 0,046; n = 7; p = 0,64) (figura 5).
Discusión
Riqueza, abundancia y diversidad. La baja riqueza y abundancia en la zona de estudio responde a los frecuentes eventos de perturbación y fragmentación de los últimos 40 años, lo cual ha originado que estos valores estén por debajo de los existentes en algunas áreas cercanas, menos perturbadas en el departamento de Antioquia (Noriega datos sin pub.). La reducción de las áreas boscosas en mosaicos de paisaje, genera pérdidas de especies a nivel local e impone barreras para el flujo de individuos entre zonas más conservadas, afectando la riqueza y abundancia de las especies de escarabajos coprófagos (Arellano et al. 2005, Davis et al. 2000, Halffter y Arellano 2002, Nichols et al. 2007). Adicionalmente, la ausencia de mamíferos en estos pequeños parches de bosque afecta fuertemente la estructura del ensamblaje (Gardner et al. 2008, Nichols et al. 2009).
Trabajos en diferentes regiones con agroecosistemas (Arellano y Halffter 2003, Giraldo et al. 2010, Pineda et al. 2005, Shahabuddin 2010), proponen que este tipo de matrices alteradas presentan condiciones similares a los relictos de bosque secundario, sin presentar en ocasiones diferencias significativas en algunos indicadores ecológicos. Pineda et al. (2005) registraron que se presentaron el doble de la riqueza en cafetales que en bosques y que el 87% de las especies recolectadas en el bosque estuvieron presentes en el cafetal, por lo que los cafetales, especialmente aquellos que tienen árboles que producen sombra, pueden estar jugando un papel clave en la amortiguación del efecto de la deforestación y fragmentación, al convertirse en hábitats intermedios. Sin embargo, algunos autores como Gardner et al. (2008) han criticado y evidenciado que estos hábitats secundarios no son tan buenos en términos de conservación, por lo que es necesario enfocarse en estrategias de preservación de los bosques primarios.
La mayor riqueza en el cafetal puede atribuirse a que este es un hábitat con ciertas condiciones favorables como una mínima cobertura vegetal que alcanza a proteger a los individuos y disminuye la desecación del excremento, un suelo de fácil remoción y adicionalmente, un recurso adicional como es el excremento humano de los recolectores y campesinos (Pineda et al. 2005). En algunos casos estas zonas de cultivo puedan llegar a albergar mayor biodiversidad, contribuyendo a la conservación regional (Escobar 2004, Escobar et al. 2007, Pineda et al. 2005, Scheffler 2005, Shahabuddin 2010).
Arellano y Halffter (2003) encontraron que la diversidad beta compartida entre bosques, plantaciones de café y pastizales es del 55%, comprobando que existe un importante flujo de especies entre los diferentes hábitats. En este estudio la diversidad beta compartida fue menor (β = 31,8%), evidenciando un menor flujo de especies entre los hábitats, por lo que los pastizales, aparentemente, podrían estar siendo utilizados como matrices de circulación para especies generalistas, aunque también existen especies estrechamente asociadas al excremento de ganado, sugiriendo que en aquellos mosaicos de paisajes fuertemente intervenidos, la heterogeneidad espacial no estaría condicionando una alta diversidad (Horgan 2008).
Grupos funcionales y grado de asociación al hábitat. Con respecto a los tipos de relocalización es interesante mencionar la ausencia del grupo de los telecópridos, lo cual puede explicarse debido al grado de susceptibilidad que este grupo presenta frente a los efectos de la perturbación (Horgan 2008, Noriega et al. 2007a). Este tipo de eventos de disturbio generan una simplificación de la estructura del ensamblaje, presentándose únicamente endocópridos y paracópridos. La dominancia de los cavadores puede estar relacionada a sus hábitos más generalistas, permitiéndoles usar una mayor diversidad de recursos, siendo menos sensibles al estrés por disturbios y al efecto de la cobertura (Davis et al. 2000). En este sentido, la abundancia y la distribución del recurso alimenticio es un limitante importante que puede condicionar la existencia de los diferentes grupos funcionales (Hill 1996), como se evidencia en ciertas regiones donde la producción agrícola y la explotación de madera han ocasionado una fuerte disminución del recurso, afectando la estructura del ensamblaje (Nichols et al. 2007, Shahabuddin 2010, Shahabuddin et al. 2005). De igual manera, las bajas poblaciones o la desaparición de las poblaciones de mamíferos en estos relictos (apreciación según los campesinos de la región) es un factor que podría estar afectando la abundancia de ciertas especies (Andresen y Laurance 2007, Quintero y Roslin 2005).
El ensamblaje de escarabajos coprófagos mostró una tendencia a asociarse con el hábitat de cafetal, lo cual está relacionado con los procesos de reducción del bosque y la pobreza de cobertura del pastizal, haciendo que las especies que lograron permanecer fueron de zonas perturbadas y de hábitos generalistas (Shahabuddin et al. 2005, Wassmer 1995). Este grado de asociación a un determinado hábitat depende adicionalmente de las condiciones microclimáticas, la calidad y la disponibilidad del recurso, el tipo de suelo, la historia evolutiva y las condiciones ecológicas existentes, generando diferentes niveles de adaptación a matrices transformadas (Estrada y Coates-Estrada 2002, Fuentes y Camero 2006, García y Pardo 2004, Horgan 2007, 2009).
Aunque el pastizal es un hábitat poco amigable para los escarabajos asociados a zonas arboladas, por sus extremas condiciones climáticas, la ausencia de una adecuada cobertura vegetal y una alta competencia con dípteros (Barlow et al. 2007), presentó una oferta constante y abundante como es el excremento de ganado, que para el caso de esta localidad no contuvo ningún tipo de ivermectinas, aunque hay que considerarlo un recurso nutricionalmente pobre (Halffter 1991, Martínez y Lumaret 2006). Sin embargo, las especies registradas en este hábitat son principalmente generalistas, mientras que en el bosque se presentó mayor especialización por recursos más específicos como el excremento de primates (Estrada y Coates-Estrada 2002, Wassmer 1995), lo cual también pudo estar asociado a que el pastizal es un tipo de vegetación relativamente nuevo a nivel evolutivo (Escobar et al. 2007).
Adicionalmente, la continúa reducción de los bosques y la inexistencia de cercas vivas o corredores de vegetación interrumpe los procesos de conectividad (Errouissi et al. 2004, Escobar 2004, Escobar et al. 2007, Scheffler 2005), favorecen limitaciones de movilidad (Horgan 2005), que afectan la estructura espacial y repercuten en la funcionalidad (Halffter y Arellano 2002, Horgan 2007, 2009, Slade et al. 2007) afectando la dinámica de los ecosistemas.
Biomasa. Se evidencia que los eventos de perturbación y fragmentación de los bosques andinos están siendo responsables de bajos niveles de biomasa, afectando la aireación del suelo y la relocalización de nutrientes (Cambefort 1986, Nealis 1977). Por el contrario, en el cafetal, las condiciones microclimáticas y la presencia de una mayor cantidad de recursos parece ser más favorable, encontrándose en este hábitat mayor biomasa de escarabajos coprófagos, lo que sin duda puede tener una incidencia en la relocalización de nutrientes y aireación del suelo (Bertone et al. 2006, Mittal 1993,). En general, la baja riqueza, abundancia y biomasa del bosque, evidencian el fuerte efecto antrópico sobre este ecosistema causando una drástica pérdida de biodiversidad, la cual no logra mantenerse en los pequeños relictos boscosos aislados, aún presentándose ''zonas de amortiguamiento'' cercanas como los cafetales.
La especie Oxysternon conspicillatum, se encontró ampliamente distribuida en toda la matriz, siendo al parecer una especie generalista que no se estaría viendo afectada por la fragmentación, sin embargo, su mayor biomasa se encuentra en el cafetal, hábitat que estaría aportando al ensamblaje mayor oferta alimenticia en calidad y cantidad de excremento debido a la presencia de los recolectores de café. La relevancia de esta especie se evidencia en su aporte a la biomasa del ensamblaje, siendo la especie dominante y sin la cual las biomasas entre los hábitats serían muy similares. Su rol funcional estaría asociado con mejor aireación y flujo de los nutrientes, generando un impacto en la calidad del suelo (Medina et al. 1990), lo cual puede llegar a favorecer el crecimiento de los cafetales (J. Molina com. pers.).
Finalmente, sería interesante para estudios futuros en la región investigar el posible efecto que la estacionalidad tiene en la biomasa, y como esta variación puede repercutir en cambios en la funcionalidad ecosistémica.
Agradecimientos
A Jorge Enrique Palacio y María Eugenia Vieira por facilitar el trabajo de campo en la finca Las Camelias. A Juan Manuel Palacio, Juan Alejandro Palacio, Federico Velásquez, Gustavo Álvarez Saa, Ricardo Orjuela y Diana Álvarez por toda su colaboración a lo largo del desarrollo de este trabajo. A Giovanny Fagua por sus anotaciones al anteproyecto. Al Laboratorio de Ecología y Conservación de la Universidad Javeriana por facilitar las instalaciones para la realización del trabajo de laboratorio. A Willson Terán y Pilar Márquez del Laboratorio de Biología Molecular por el uso de la balanza analítica. A François Génier, Fernando Vazde- Mello y Paolo Gandini por su ayuda en la determinación taxonómica. A Carolina Vizcaíno, Ricardo Botero-Trujillo, Oscar Javier Mahecha y a tres evaluadores anónimos por sus valiosos aportes y anotaciones al manuscrito.
REFERENCIAS
1. Allen JC, Barnes DF. 1985. The causes of deforestation in developing countries. Annals of the Association of American Geographers, 75 (2): 163-184. [ Links ]
2. Andrade MG. 1992. Biodiversidad y conservación. En: Andrade G, Ruiz J, Gómez R, editores. Biodiversidad, conservación y uso de recursos naturales: Colombia en el contexto internacional. Bogotá (Colombia): Ed. Presencia Ltda. p. 23-44. [ Links ]
3. Andresen E, Laurance SGW. 2007. Possible indirect effects of mammal hunting on dung beetle assemblages in Panama. Biotropica, 39 (1): 141-146. [ Links ]
4. Arellano L, Favila ME, Huerta C. 2005. Diversity of dung and carrion beetles in a disturbed Mexican tropical montane cloud forest and on shade coffee plantations. Biodiversity and Conservation, 14: 601-615. [ Links ]
5. Arellano L, Halffter G. 2003. Gamma diversity: Derived from and a determinant of alpha diversity and beta diversity. An analysis of three tropical landscapes. Acta Zoologica Mexicana, (90): 27-76. [ Links ]
6. Barlow J, Gardner TA, Araujo IS. 2007. Quantifying the biodiversity value of tropical primary, secondary and plantation forests. Proceedings of the National Academy of Sciences of the United States of America, 104: 18555-18560. [ Links ]
7. Bertone MA, Green JT, Poore MH, Watson DW [Internet]. 2006. The contribution of tunneling dung beetles to pasture soil nutrition. Plant Management Network: Forage and Grazinglands. Domingo de Heredia (Costa Rica). Fecha de acceso: 04 de julio de 2011. Disponible en: http://www.plantmanagementnetwork.org/pub/fg, 6 de Diciembre de 2009. [ Links ]
8. Boonrotpong S, Sotthibandhu S, Pholpunthin C. 2004. Species composition of dung beetles in the primary and secondary forests at Ton Nga Chang Wildlife Sanctuary. Science Asia, 30: 59-65. [ Links ]
9. Brown KS. 1991. Conservation of Neotropical environments: insects as indicators. En: Collins NM, Thomas JA, editors. The conservation of insects and their habitats. Royal Entomological Society Symposium XV, London (England): Academic Press. p. 350-410. [ Links ]
10. Cambefort Y. 1986. Rôle des coléoptères Scarabaeidae dans l'enfouisement des excréments en savane guinéenne de Côte d'Ivoire. Acta Oecologica, Ecologia Generalis, 7 (1): 17-25. [ Links ]
11. Camero E. 2010. Los escarabajos del género Eurysternus Dalman, 1824 (Coleoptera: Scarabaeidae) de Colombia. Boletín de la Sociedad Entomológica Aragonesa (S.E.A.), 46: 147-179. [ Links ]
12.Carrizosa UJ. 1990. La selva andina. En: Carrizosa UJ, Hernández J, editores. Selva y futuro. Bogotá (Colombia): El Sello Editorial. p. 151-184. [ Links ]
13. Colwell RK [Internet]. 1997. ''EstimateS''. Statistical stimation of species richness and shared species samples. Fecha de acceso: 04 de julio de 2011. Disponible en: http://viceroy.eeb.uconn.edu/estimates. [ Links ]
14. Concha-Lozada CM, Gallego MC, Pardo-Locarno LC. 2010. Fragmentación de ecosistemas montanos e impactos estructurales y poblacionales sobre la comunidad de escarabajos coprófagos (Col.: Scarabaeinae) en el Alto Río Cauca, Popayán, Colombia. Boletín Científico Centro de Museos Museo de Historia Natural, 14 (1): 43-55. [ Links ]
15. Davis AJ, Huijbregts H, Krikken J. 2000. The role of local and regional processes in shaping dung beetle communities in tropical forest plantations in Borneo. Global Ecology and Biogeography, 9: 281-292. [ Links ]
16. Davis AJ, Holloway JD, Huijbregts H, Krikken J, Kirk- Spriggs A, Sutton SL. 2001. Dung beetles as indicators of change in the forests of northern Borneo. Journal of Applied Ecology, 38: 593-616. [ Links ]
17. Davis ALV. 1996. Seasonal dung beetle activity and dung dispersal in selected south African habitats: implications for pasture improvement in Australia. Agriculture, Ecosystems and Environment, 58: 157-169. [ Links ]
18. Edmonds WD, Zídek J. 2004. Revision of the Neotropical dung beetle genus Oxysternon (Scarabaeidae: Scarabaeinae: Phanaeini). Folia Heyrovskyana, Supp. 11: 1-60. [ Links ]
19. Errouissi F, Robert JJ, Lumaret JP, Piau O. 2004. Composition and structure of dung beetle (Coleoptera: Aphodiidae, Geotrupidae, Scarabaeidae) assemblages in mountain grasslands of the Southern Alps. Annals of the Entomological Society of America, 97 (4): 701-709. [ Links ]
20. Escobar F. 2004. Diversity and Composition of dung beetle (Scarabaeinae) assemblages in a heterogeneous Andean landscape. Tropical Zoology, 17: 123-136. [ Links ]
21. Escobar F, Halffter G, Arellano L. 2007. From forest to pasture: an evaluation of the influence of environment and biogeography on the structure of dung beetle (Scarabaeinae) assemblages along three altitudinal gradients in the Neotropical region. Ecography, 30: 193-208. [ Links ]
22. Estrada A, Coates-Estrada R. 2002. Dung beetles in continuous forest, forest fragments and in an agricultural mosaic habitat island at Los Tuxtlas, Mexico. Biodiversity and Conservation, 11: 1903-1918. [ Links ]
23. Etter A, Villa LA. 2000. Andean forests and farming systems in part of the Eastern Cordillera (Colombia). Mountain Research and Development, 20 (3): 236-245. [ Links ]
24. Fauth, JE, Bernardo J, Camara M, Resetarits WJ, Van Buskirk V, Mccollum SA. 1996. Symplifying the Jargon of Community Ecology: A conceptual Approach. The American Naturalist, 147 (2): 282-286. [ Links ]
25. Fuentes PV, Camero E. 2006. Estudio de la fauna de escarabajos coprófagos (Coleoptera: Scarabaeidae) en el bosque húmedo tropical de Colombia. Entomotropica, 21 (3): 133-143. [ Links ]
26. García JC, Pardo L. 2004. Escarabajos Scarabaeinae saprófagos (Coleoptera: Scarabaeidae) en un bosque muy húmedo premontano de los Andes occidentales colombianos. Ecología Aplicada, 3 (1-2): 59-63. [ Links ]
27. Gardner TA, Hernández MI, Barlow J, Peres CA. 2008. Understanding the biodiversity consequences of habitat change: the value of secondary and plantation forests for neotropical dung beetles. Journal of Applied Ecology, 45: 883-893. [ Links ]
28. Genier F. 1996. A revision of the neotropical genus Ontherus Erichson (Coleoptera: Scarabaeidae, Scarabaeinae). Memoirs of the Entomological Society of Canada, 170: 1-168. [ Links ]
29. Genier F. 2009. Le genre Eurysternus Dalman, 1824 (Scarabaeidae: Sacrabaeinae: Oniticellini), revisión taxonomique et clés de détermination illustrées. # 85, Series Faunistica. Sofia-Moscow: Pensoft. p. 430. [ Links ]
30. Giraldo C, Escobar F, Chara JD, Calle Z. 2010. The adoption of silvopastoral systems promotes the recovery of ecological processes regulated by dung beetles in the Colombian Andes. Insect Conservation and Diversity, 4 (2): 115-122. [ Links ]
31. Halffter G. 1991. Historical and ecological factors determining the geographical distribution of beetles (Coleoptera: Scarabaeidae: Scarabaeinae). Folia Entomológica Mexicana, (82): 195-238. [ Links ]
32. Halffter G, Arellano L. 2002. Response of dung beetle diversity to human-induced changes in a Tropical landscape. Biotropica, 34 (1): 144-154. [ Links ]
33. Henderson A, Churchill SP, Luteyn JL. 1991. Neotropical plant diversity. Nature, 351: 21-22. [ Links ]
34. Hill CJ. 1996. Habitat specificity and food preferences of an assemblage of tropical australian dung beetle. Journal of Tropical Ecology, 12 (4): 449-460. [ Links ]
35. Horgan FG. 2005. Effects of deforestation on diversity, biomass and function of dung beetles on the eastern slopes of the Peruvian Andes. Forest Ecology and Management, 216: 117-133. [ Links ]
36. Horgan FG. 2007. Dung beetles in pasture landscapes of Central America: proliferation of synanthropogenic species and decline of forest specialists. Biodiversity & Conservation, 16: 2149-2165. [ Links ]
37. Horgan FG. 2008. Dung beetle assemblages in forests and pastures of El Salvador: a functional comparison. Biodiversity Conservation, 17: 2961-2978. [ Links ]
38. Horgan FG. 2009. Invasion and retreat: shifting assemblages of dung beetles amidst changing agricultural landscapes in central Peru. Biodiversity & Conservation, 18: 519-541. [ Links ]
39. Kappelle M, Brown AD (editores). 2001. Bosques nublados del neotrópico. Santo Domingo de Heredia (Costa Rica): Instituto Nacional de Biodiversidad (INBio). 704 pp. [ Links ]
40. Kattan GH, Álvarez-López H. 1996. Preservation and management of biodiversity in fragmented landscapes in the Colombian Andes. En: Schelhas J, Greenberg R, editors. Forest patches in Tropical landscapes. Washington D. C. (U. S. A:): Island Press. p. 3-18. [ Links ]
41. Kremen C, Colwell R, Erwin TL, Murphy DD, Noss RF, Sanjayan MA. 1993. Terrestrial arthropod assemblages: their use in conservation planning. Conservation Biology, 7: 796-808. [ Links ]
42. Lobo JM. 1993. Estimation of dung beetle biomass (Coleoptera, Scarabaeoidea). European Journal of Entomology, 90: 235-238. [ Links ]
43. Martínez I, Lumaret JP. 2006. Las practicas agropecuarias y sus consecuencias en la entomofauna y el entorno ambiental. Folia Entomológica Mexicana, 45 (1): 57-68. [ Links ]
44. McGeoch MA, Van Rensburg BT, Botes A. 2002. The verification and application of bioindicators: A case study of dung beetles in a savanna ecosystem. The Journal of Applied Ecology, 39: 661-672. [ Links ]
45. Medina CA, Lopera-Toro A. 2000. Clave ilustrada para la identificación de los géneros de escarabajos coprófagos (Coleoptera: Scarabaeinae) de Colombia. Caldasia, 22 (2): 299-315. [ Links ]
46. Medina CA, Pulido LA. 2009. Escarabajos coprófagos (Coleoptera: Scarabaeinae) de la Orinoquía colombiana. Biota Colombiana, 10 (1-2): 55-62. [ Links ]
47. Medina CA, Escobar F, Rojas AM. 1990. Aspectos ecológicos y biomecánicos de Oxysternon conspicillatum (Col: Scarabaeidae) en el Valle del Cauca. Revista Colombiana de Entomología, 16 (2): 54-61. [ Links ]
48. Medina C, Lopera A, Vitolo A, Gill B. 2001. Escarabajos coprófagos de Colombia (Coleoptera: Scarabaeidae- Scarabaeinae). Biota Colombiana, 2 (2): 131-144. [ Links ]
49. Medina C, Escobar F, Kattan G. 2002. Diversity and habitat use of dung beetles in a restored Andean landscape. Biotropica, 34 (1): 181-187. [ Links ]
50. Mittal IC. 1993. Natural manuring and soil conditioning by dung beetles. Tropical Ecology, 34: 150-159. [ Links ]
51. Municipio de Tarso. 2010. Plan estratégico de desarrollo municipal 2011-2028. Departamento de Antioquia (Colombia): Municipalidad de Tarso. p. 251. [ Links ]
52. Nealis VG. 1977. Habitat associations and community analysis of South Texas dung beetles (Coleoptera: Scarabaeinae). Canadian Journal of Zoology, 55: 138-147. [ Links ]
53. Nichols E, Larsen T, Spector S, Davis AL, Escobar F, Favila M, Vulinec K, The Scarabaeinae Research Network. 2007. Global dung beetle response to tropical forest modification and fragmentation: a quantitative literature review and meta-analysis. Biological Conservation, 137: 1-19. [ Links ]
54. Nichols E, Gardner TA, Peres CA, Spector S, The Scarabaeinae Research Network. 2009. Co-declining mammals and dung beetles: an impeding ecological cascade. Oikos, 118 (4): 481-487. [ Links ]
55. Noriega JA, Fagua G. 2009. Monitoreo de escarabajos coprófagos (Coleoptera: Scarabaeidae) en la región neotropical. En: Acosta A, Fagua G, Zapata AM, editores. Técnicas de campo en ambientes tropicales: Manual para el monitoreo en ecosistemas acuáticos y artropodos terrestres. Bogotá (Colombia): Unidad de Ecología y Sistemática (UNESIS), Pontificia Universidad Javeriana. p. 165-188. [ Links ]
56. Noriega JA, Solís C, Quintero I, Pérez LG, García HG, Ospino DA. 2006. Registro continental de Digitonthophagus gazella (Coleoptera: Scarabaeidae) en Colombia. Caldasia, 28 (2): 379-381. [ Links ]
57. Noriega JA, Realpe E, Fagua G. 2007a. Diversidad de escarabajos coprófagos (Coleoptera: Scarabaeidae) en un bosque de galería con tres estadios de alteración. Universitas Scientiarum, Número especial, 12: 51-63. [ Links ]
58. Noriega JA, Solis C, Escobar F, Realpe E. 2007b. Escarabajos coprófagos (Coleoptera: Scarabaeidae) de la provincia de la Sierra Nevada de Santa Marta. Biota Colombiana, 8 (1): 77-86. [ Links ]
59. Noriega JA, Rengifo JM, Vaz-de-Mello FZ. 2008. First report of the genus Tetramereia Klages, 1907 (Coleoptera: Scarabaeidae: Phanaeini) in Colombia – notes to its distribution. Biota Colombiana, 9 (1): 131-133. [ Links ]
60. Pineda E, Moreno C, Escobar F, Halffter G. 2005. Frog, bat and dung beetle diversity in the cloud forest and coffee agroecosystems of Veracruz, Mexico. Conservation Biology, 19 (2): 400-410. [ Links ]
61. Pulido LA, Medina CA, Riveros RA. 2007. Nuevos registros de escarabajos coprófagos (Scarabaeidae: Scarabaeinae) para la región andina de Colombia. Parte I. Revista Academia Colombiana de Ciencias, 31 (119): 305-310. [ Links ]
62. Quintero I, Roslin T. 2005. Rapid recovery of dung beetle communities following habitat fragmentation in Central Amazonia. Ecology, 86 (12): 3303-3311. [ Links ]
63. ScarabNet [Internet]. 2009. ScarabNet Global Taxon Database, Version 1.3. Fechas de acceso: 01 de julio de 2009. Disponible en: www.scarabnet.org. [ Links ]
64. Scheffler PY. 2005. Dung beetle (Coleoptera: Scarabaeidae) diversity and community structure across three disturbance regimes in a eastern Amazonia. Journal of Tropical Ecology, 21: 9-19. [ Links ]
65. Shahabuddin C. 2010. Diversity and community structure of dung beetles (Coleoptera: Scarabaeidae) across a habitat disturbance gradient in Lore Lindu National Park, Central Sulawesi. Biodiversitas, 11 (1): 29-33. [ Links ]
66. Shahabuddin C, Shulze H, Tscharntke T. 2005. Changes of dung beetle communities from rainforests towards agroforestry systems and annual cultures. Biodiversity and Conservation, 14: 863-877. [ Links ]
67. Slade EM, Darren JM, Villanueva JF, Lewis OT. 2007. Experimental evidence for the effects of dung beetle functional group richness and composition on ecosystem function in a tropical forest. Journal of Animal Ecology, 76: 1094-1104. [ Links ]
68. Tilman D, Fargione J, Wolff B, D'Antonio C, Dobson A, Howarth R, Schindler D, Schlesinger WH, Simberloff D, Swackhamer D. 2001. Forecasting agriculturally driven global environmental change. Science, 292: 281-284. [ Links ]
69. Vaz-De-Mello FZ. 2003. Species formerly in the genera Trichillum Harold, 1868 and Pedaridium Harold, 1868 (Coleoptera: Scarabaeidae) [Tesis de Maestria]. [Minas Gerais (Brasil)]: Universidade Federal de Lavras. p. 285. [ Links ]
70. Vaz-De-Mello FZ, Edmonds WD, Ocampo FC, Schoolmeesters P. 2011. A multilingual key to the genera and subgenera of the subfamily Scarabaeinae of the New World (Coleoptera: Scarabaeidae). Zootaxa, 2854: 1-73. [ Links ]
71. Wassenaar T, Gerber P, Verburg PH, Rosales M, Ibrahim M, Steinfeld H. 2007. Projecting land use changes in the Neotropics: the geography of pasture expansion into forest. Global Environmental Change, 17: 86-104. [ Links ]
72. Wassmer T. 1995. Selection of the spatial habitat of coprophagous beetles in the Kaiserstuhl area near Freiburg (SWGermany). Acta Ecológica, 16 (4): 461-478. [ Links ]




![GENETIC DIVERSITY IN THE GERMPLASM BANK OF MULBERRY [MORUS SPP. (ROSALES: MORACEAE)] BELONGING TO THE ''EL PILAMO'' EXPERIMENTAL FARM, UNIVERSIDAD TECNOLÓGICA DE PEREIRA, PEREIRA (RISARALDA), COLOMBIA](/img/en/prev.gif)