Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actualidades Biológicas
versión impresa ISSN 0304-3584
Actu Biol vol.34 no.97 Medellín jul./dic. 2012
ARTÍCULOS DE INVESTIGACIÓN
CONCENTRACIÓN Y COMPOSICIÓN MICROBIANA EN EL AMBIENTE DE LA BIBLIOTECA CENTRAL JORGE PALACIOS PRECIADO DE LA UNIVERSIDAD PEDAGÓGICA Y TECNOLÓGICA DE COLOMBIA, TUNJA, COLOMBIA
MICROBIAL CONCENTRATION AND COMPOSITION IN THE ENVIRONMENT OF THE JORGE PALACIOS PRECIADO CENTRAL LIBRARY OF THE UNIVERSIDAD PEDAGÓGICA Y TECNOLÓGICA DE COLOMBIA, TUNJA, COLOMBIA
Deisy L. Toloza-Moreno1,2, Luz M. Lizarazo-Forero1,3, Jorge O. Blanco-Valbuena1,4
1 Grupo de Investigación Biología Ambiental. Escuela de Ciencias Biológicas. Universidad Pedagógica y Tecnológica de Colombia. Avenida Central del Norte. Tunja (Boyacá), Colombia.
Correos electrónicos: 2 lisseth77@gmail.com; 3 luz.lizarazo@uptc.edu.co; 4 jorgeblancojob@hotmail.com.
Recibido: febrero 2012; aceptado: octubre 2012.
Resumen
Los microorganismos, esporas, ácaros y polen son componentes naturales del aire en ambientes internos y pueden ser transportados desde el exterior por partículas aerobiológicas que pueden establecerse en el polvo y causar el biodeterioro de diversos materiales, además de representar un riesgo para la salud de las personas. Con este trabajo, se evaluó la concentración microbiana en el ambiente de la Biblioteca Central Jorge Palacios Preciado, Universidad Pedagógica y Tecnológica de Colombia. Se empleó el método de sedimentación en placa para realizar el muestreo microbiológico del ambiente, utilizando agar Sabouraud para el aislamiento de hongos y agar nutritivo para bacterias. La densidad microbiana del ambiente se encontró dentro de los límites de sanidad aceptados para ambientes de lugares públicos, y la mayor diversidad identificada estuvo representada por 34 géneros de hongos filamentosos y un grupo de hongos de la clase Phycomycetes, siendo las esporas de los géneros Cladosporium, Paecilomyces y Penicillium, las más frecuentes en la biblioteca. Las levaduras fueron las menos representativas en el ambiente con dos géneros aislados Candida y Rhodotorula. En cuanto a las bacterias, se aislaron en total 16 géneros, de los cuales Bacillus y Neisseria, fueron los más comunes. Teniendo en cuenta los géneros microbianos aislados y las investigaciones más recientes, el ambiente de la Biblioteca Central podría representar un riesgo para la salud de las personas, principalmente a nivel respiratorio, sino se adoptan algunas medidas de limpieza y de adecuación de los sistemas de ventilación.
Palabras clave: aerobiología, biblioteca, concentración y composición microbiana, enfermedades respiratorias, microorganismos de bibliotecas.
Abstract
Microorganisms, spores, acari, and pollen are natural components of indoor air and they may be transported from the outdoor air by aerobiological particles that settle on dust and cause the biodeterioration of various materials, in addition to representing a risk for human health. In this study, we evaluated the microbial concentration in the environment of the ''Jorge Palacios Preciado'' Central Library of the Universidad Pedagógica y Tecnológica of Colombia. The open petri dish sedimentation method was used for the microbiological sampling of the environment, using Sabouraud agar for isolating fungi and nutrient agar for bacteria. Microbial density of this environment was found to be within sanitary levels accepted for environments of public buildings, and the greatest diversity was comprised of filamentous fungi, with 34 genera identified, along with a fungal group from the Class Phycomycetes, with Cladosporium, Penicillium, and Paecilomyces spores the most frequent in the library. Yeasts were the less representative in the environment, with two genera isolated, Candida and Rhodotorula. Regarding bacterial forms, a total 16 genera were isolated, of which Bacillus and Neisseria were the most prevalent. Taking into account the microbial genera isolated and recent research results, the environment of the Central Library may pose a health risk o people, mainly at the respiratory level, if measures are not taken to clean and to modify the ventilation system.
Key words: aerobiology, library, library microorganisms, microbial concentration and composition, respiratory diseases.
INTRODUCCIÓN
Los microorganismos así como esporas, ácaros y polen son componentes naturales del aire en ambientes internos y pueden ser transportados desde el exterior por partículas aerobiológicas que pueden establecerse en el polvo (Labarrere et al. 2003). La composición de los microorganismos en ambientes cerrados puede variar tanto en calidad como en cantidad de acuerdo a factores como microbiota predominante en el aire exterior, tipo de edificación y localización geográfica, número de personas presentes y actividades que se realizan, condiciones microclimáticas como humedad relativa y temperatura, puntos locales de vegetación, sistemas de ventilación y limpieza del sitio (Jones y Harrison 2003, Maggi et al. 2000, Nevalainen y Morawska 2009, O'Gorman y Fuller 2008, Pyrri y Kapsanaki-Gotsi 2007, Shelton et al. 2002), y en el caso de bibliotecas y archivos, por ejemplo, por el estado de preservación de libros y documentos (Maggi et al. 2000).
Varios autores han evaluado el ''Síndrome del edificio enfermo'' [Sick building syndrome (SBS)]'' estimando la calidad microbiológica de diferentes ambientes internos como archivos, bibliotecas, catedrales, edificios, laboratorios, museos y hospitales (Aira et al. 2006, Bogomolova y Kirtsideli 2009, Borrego et al. 2008, 2010a, b, Bueno et al. 2003, Chao et al. 2001, Gómez et al. 2005, Haleem Khan et al. 2009, Pitzurra et al. 1999, Rojas et al. 2008, Toloza-Moreno y Lizarazo-Forero 2011), y han encontrado que los microorganismos pueden crecer sobre diversos materiales tanto orgánicos como inorgánicos causando su biodeterioro, además de que pueden representar un riesgo para la salud, originando alergias, infecciones e intoxicaciones (Labarrere et al. 2003).
Aunque las bacterias se encuentran con mayor frecuencia en espacios internos en comparación con los hongos, estas representan un menor riesgo en el biodeterioro de documentos ya que requieren condiciones de humedad más elevadas (Valentín et al. 1997). Sin embargo, se ha documentado que varios géneros de hongos (ej., Alternaria, Aspergillus, Cladosporium) y bacterias (ej., Bacillus, Pseudomonas, Staphylococcus) tienen la capacidad de provocar diversas enfermedades en el hombre, principalmente aquellas de tipo respiratorio (Angelosante-Bruno et al. 2007, Carrabs 1995), siendo la inhalación la principal ruta de infección, además, de la ingestión y el contacto con la piel (Chandra-Mouli et al. 2005, Poulsen et al. 1995).
Distintos autores consideran que se hace imprescindible conocer la composición y la calidad microbiana de ambientes internos como el mecanismo más elemental de prevención de enfermedades (Labarrere et al. 2003) y para conocer el riesgo al que están expuestos los materiales y documentos (Borrego et al. 2008, MiniCultura Colombia 2009).
Por lo anterior, el propósito de esta investigación fue evaluar la composición y la concentración microbiana del ambiente de la Biblioteca Central Jorge Palacios Preciado de la Universidad Pedagógica y Tecnológica de Colombia, y determinar cuáles de los microorganismos aislados, teniendo en cuenta lo registrado en la literatura, podrían incidir en la salud de los trabajadores que laboran en esta dependencia.
MATERIALES Y MÉTODOS
Área de estudio. El estudio se llevó a cabo en la Biblioteca Central Jorge Palacios Preciado ubicada en la Universidad Pedagógica y Tecnológica de Colombia, sede Tunja (Boyacá), Colombia. Se realizaron muestreos mensuales entre marzo y julio de 2010 (época lluviosa), para un total de cinco muestreos. La biblioteca fue fundada en 1934 con una colección de 26.000 volúmenes. Actualmente, la colección bibliográfica asciende a 250.000 ejemplares entre libros, tesis, revistas y publicaciones periódicas, que contienen información en diversas áreas del conocimiento entre las que se encuentran filosofía, religión, ciencias sociales, lingüística y lenguas, ciencias puras, ciencias aplicadas, artes, literatura, geografía e historia.
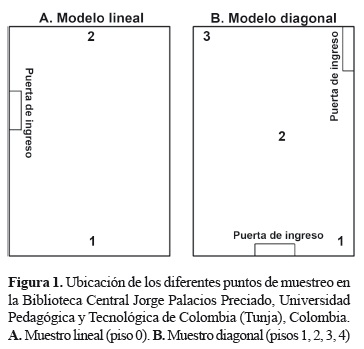
Las diferentes colecciones dentro de la biblioteca están distribuidas así: en el piso 0 se encuentra la galería de exposiciones (con un área aproximada de 187,86 m2); en el piso 1 la Hemeroteca (área aproximada de 619,78 m2); en el piso 2 la Sala de Ciencia y Tecnología (área aproximada de 927,60 m2); en el piso 3 la Sala de Ciencias Sociales (área aproximada de 974,11 m2), Humanidades y Fondo Pedagógico; y en el piso 4 la Sala Biblioteca Virtual (área aproximada de 867,93 m2).
Muestreo microbiológico. Se utilizó el método gravimétrico de sedimentación en placa propuesto por Omeliansky (Bogomolova y Kirtsideli 2009) para los muestreos ambientales. Los puntos de muestreo dentro de la biblioteca se ubicaron siguiendo un modelo lineal en el piso 0 (dos puntos de muestreo), y un modelo diagonal en los pisos 1, 2, 3 y 4 (tres puntos de muestreo en cada uno; figura 1). Los pisos 2 y 4 son los que presentan mayor flujo de personas, principalmente en las horas de la mañana.
Cada punto fue muestreado por triplicado (por cada medio de cultivo, y en cada punto por piso en cada muestreo), empleando agar Sabouraud para el aislamiento de hongos, y agar nutritivo para bacterias, para un total de 42 cajas de Petri expuestas al ambiente de la biblioteca por cada medio de cultivo al mes. Los muestreos fueron realizados hacia las 10:00 h.
Las cajas de Petri (90 mm de diámetro) se ubicaron entre 1,5 y 2,0 m aproximadamente del suelo y fueron expuestas durante 30 minutos en cada punto de muestreo. Paralelamente, en cada muestreo se tomaron datos de humedad relativa y temperatura del ambiente por piso utilizando un medidor atmosférico Davis®. Las cajas con agar Sabouraud fueron incubadas a 28 ºC entre cinco y siete días, y las de agar nutritivo a 35 ºC entre 24 a 72 horas.
Luego del tiempo de incubación, se cuantificaron las unidades formadoras de colonia por metro cúbico de aire (UFC m-3) tanto para hongos filamentosos, levaduras y bacterias (con previa realización de tinción de Gram para distinguir entre bacterias y levaduras en las cajas de agar nutritivo) de acuerdo a la fórmula propuesta por Omeliansky (Bogomolova y Kirtsideli 2009):
N = 5a x 104 (bt)-1
donde N = UFC m-3 de aire en el ambiente interno; a = número de colonias por caja de Petri; b = superficie de la caja de Petri (en cm2); y t = tiempo de exposición, en minutos.
Asimismo, se halló la densidad relativa (DR) de los géneros microbianos aislados de acuerdo con la fórmula de Smith (Borrego et al. 2010a):
DR = (número de colonias del género o especie/ número total de colonias de todos los géneros o especies) x 100
Identificación de los microorganismos aislados. Una vez realizado el conteo de las colonias, se describieron las características macroscópicas de los morfotipos formados a las 24 y 48 horas para el caso de las bacterias y levaduras, y a los 5 días de incubación para hongos filamentosos.
Hongos. Las características microscópicas de las colonias fúngicas se determinaron mediante el montaje con azul de lactofenol y la técnica de impronta (Schaechter et al. 2006), y en los casos en que no se observaron estructuras reproductivas de los hongos se realizaron microcultivos. La identificación de los géneros se realizó utilizando las claves de identificación taxonómica de hongos de Barnett (1960), Carrillo (2003) y Domsh et al. (1980a, b).
Levaduras. Las levaduras fueron observadas microscópicamente con tinción de Gram y haciendo montajes en fresco entre lámina y laminilla con azul de lactofenol e identificadas de acuerdo con Carrillo (2003) y Kirk et al. (2008).
Bacterias. Las características microscópicas de las bacterias aisladas y su identificación hasta género fueron determinadas mediante tinción de Gram, pruebas de catalasa, oxidasa, fermentación de glucosa, siembra en medios selectivos y pruebas bioquímicas (estas últimas para el caso de las formas bacilares Gram negativas utilizando API 20E (para Enterobacterias-Biomérieux®) y API 20NE (para no Enterobacterias-Biomérieux®), y teniendo en cuenta las características bioquímicas señaladas por Finegold y Martin (1983) y Madigan et al. (2006).
Análisis estadístico. Los datos fueron analizados utilizando el programa estadístico R versión 2.12.0. Debido a que los datos obtenidos no cumplieron el supuesto de normalidad, se empleó la prueba no paramétrica de Kruskal-Wallis con un nivel de significancia de 0,05 con el fin de establecer diferencias estadísticas significativas entre la concentración microbiológica del aire en el interior de la biblioteca a lo largo del muestreo.
RESULTADOS
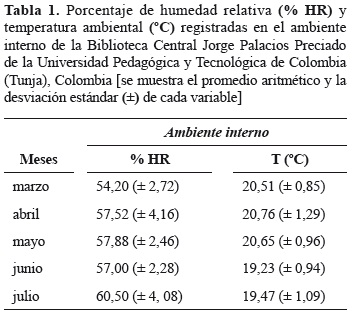
Humedad relativa y temperatura del ambiente. En general, se registró en promedio una humedad relativa de 57,3% (± 3,83) y una temperatura de 20,3 ºC (± 1,24) en el interior de la biblioteca. Los meses con mayor temperatura correspondieron a marzo, abril y mayo, mientras que la mayor humedad relativa se presentó en mayo, junio y julio (tabla 1).
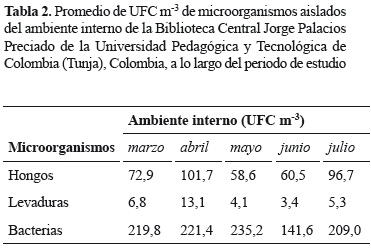
Concentración fúngica en el ambiente. La mayor diversidad microbiana en el ambiente de la biblioteca estuvo representada por los hongos filamentosos con 34 géneros y un grupo de hongos de la clase Phycomycetes no identificados (figura 2), en una concentración fúngica que osciló entre 58,6 y 101,7 UFC m-3 (tabla 2).
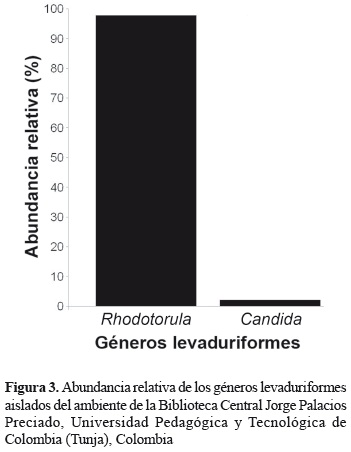
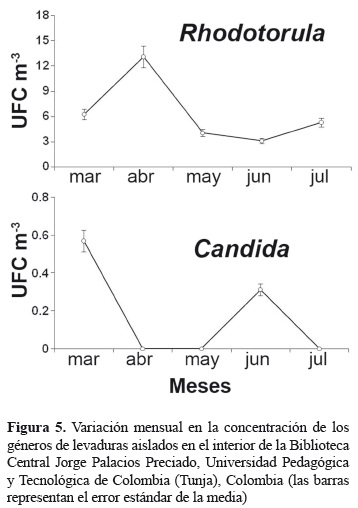
Las colonias fúngicas aisladas fueron estadísticamente iguales entre los muestreos mensuales (Kruskal-Wallis prueba Chi-cuadrado = 6,6734, df = 3, p = 0,0831). El género Penicillium fue el que predominó durante todo el estudio (35,1%). Otros géneros de hongos como Paecilomyces, Cladosporium, Alternaria y Aspergillus, también fueron frecuentes en la biblioteca (figura 2). En cuanto a las levaduras aisladas, se presentaron los géneros Candida y Rhodotorula (figura 3).
Las variaciones mensuales en las concentraciones de esporas de los géneros Penicillium, Alternaria, Cladosporium y Paecilomyces fueron relativamente constantes (figura 4). Sin embargo, las mayores concentraciones se presentaron entre marzo y abril, cuando en general fue mayor la temperatura ambiental y menor la humedad relativa. El género Penicillium, fue el más abundante entre marzo y abril cuando la temperatura fue mayor (figura 4A), antes de que se registrara una disminución en el número de colonias. El género Paecilomyces varió durante el muestreo, con un pico leve en abril en el que se registraron 25,6 UFC m-3 en el ambiente (figura 4B). La concentración de esporas del género Cladosporium osciló muy poco presentando un aumento en el número de colonias en junio con 20,6 UFC m-3, mientras que las esporas del género Alternaria fueron más abundantes en marzo con 19,4 UFC m-3 (figuras 4C, D).
Concentración de levaduras en el ambiente. Las levaduras aisladas fueron estadísticamente significativas entre los muestreos (Kruskal-Wallis prueba Chi-cuadrado = 9,9114, df = 3, p = 0,0193) a pesar de su menor abundancia con respecto al total de las colonias cuantificadas. Su concentración en el ambiente se presentó entre 3,4 y 13,1 UFC m-3 (tabla 2), siendo Rhodotorula el género predominante (figura 5A). Rhodotorula spp., se presentó con mayor abundancia en abril, con 13,1 UFC m-3 (figura 5A) cuando se registró una alta humedad relativa (57,5%). Los aislamientos del género Candida fueron escasos, solo se registró en marzo y junio (figura 5B).
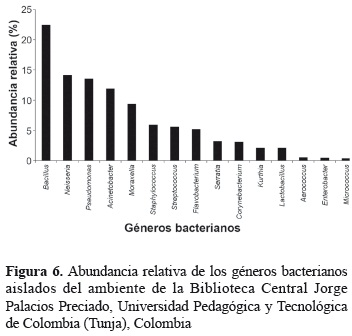
Concentración bacteriana en el ambiente. La abundancia bacteriana en el ambiente interno de la biblioteca estuvo representada por 15 géneros en una concentración entre 141,6 y 235,2 UFC m-3 (tabla 2, figura 6). El número de colonias bacterianas varió estadísticamente a lo largo del muestreo (Kruskal-Wallis prueba Chi-cuadrado = 28,0662, df = 3, p = 3,518e-06), siendo las bacterias Gram negativas las predominantes en el ambiente (57,8%).
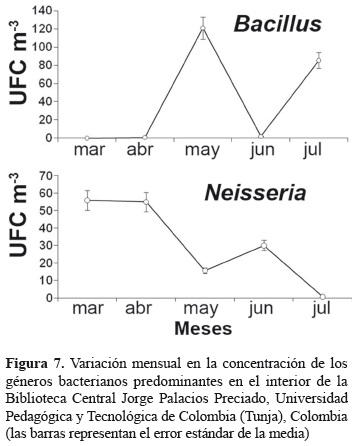
El género Bacillus, fue el de mayor abundancia (22,5%); seguido por el género Neisseria con 14,2% (figura 6). Otros géneros predominantes fueron Acinetobacter y Pseudomonas que representaron 11,9 y 13,6%, respectivamente. El género Bacillus, se aisló entre abril y julio, presentando el mayor pico de abundancia en mayo con 121,0 UFC m-3 (figura 7A), mientras que el género Neisseria, se registró durante todo el período mostrando en su mayoría un descenso desde el primer muestreo hasta el último en el número de colonias aisladas (figura 7B).
DISCUSIÓN
La mayor abundancia de microorganismos presentes en el ambiente interno de la Biblioteca Central correspondió a las bacterias con 69,0% del total de colonias aisladas, mientras que las levaduras y los hongos filamentosos se presentaron en un 4,4 y 26,6%, respectivamente. El ambiente interno de la biblioteca se puede considerar como un ambiente no contaminado tanto en densidad de esporas fúngicas como de bacterias en el ambiente, teniendo en cuenta los límites determinados por diversos autores para considerar contaminado o no un lugar público, entre los cuales, la Organización Mundial de la Salud (Nevalainen y Morawska 2009) y el Ministerio de Labor de Canadá (Radler de Aquino y de Göes 2000) sugieren que la concentración microbiana en ambientes internos no debe exceder las 1000 UFC m-3.
Aunque la humedad relativa del ambiente de la biblioteca se encuentra por debajo del rango óptimo señalado por Gallo (1993) quien considera que valores de humedad relativa entre 60-90% permiten el desarrollo de los microorganismos y causar alteraciones en documentos y libros, y fue menor al 85% requerido por las bacterias para su crecimiento, la concentración microbiana fue alta pero similar a la encontrada en otros estudios que han empleado la técnica de sedimentación en placa para evaluar la calidad del aire en ambientes cerrados (Bogomolova y Kirtsideli 2009, Borrego et al. 2008, 2010a, b, Toloza-Moreno y Lizarazo-Forero 2011). A pesar de que una humedad elevada, ventilación reducida y la temperatura son las condiciones que favorecen la presencia de microorganismos en el aire en ambientes internos, además de un sustrato (como documentos y libros) que proporcione, principalmente a los hongos, los nutrientes necesarios como la celulosa (Aira et al. 2006), esta contaminación también puede estar favorecida en buena parte por una gran presencia de polvo (Shelton et al. 2002) como es el caso encontrado dentro de la Biblioteca Central.
Los géneros Cladosporium, Paecilomyces y Penicillium, fueron predominantes en el ambiente externo de la biblioteca (datos no mostrados), lo cual podría explicar su prevalencia también en el ambiente interno. Estos géneros fúngicos, así como Alternaria y Aspergillus son comunes de ambientes internos de archivos, bibliotecas y museos (Aira et al. 2006, Bogomolova y Kirtsideli 2009, Borrego et al. 2008, 2010a, b, Díez-Herrero et al. 2006, Labarrere et al. 2003, Pitzurra et al. 1999, Rojas et al. 2008, Shelton et al. 2002, Toloza- Moreno y Lizarazo-Forero 2011), e incluyen especies patógenas oportunistas por lo que son considerados de gran importancia en salud pública ya que están asociados con enfermedades respiratorias alérgicas, especialmente asma y rinitis (Haleem Khan et al. 2009, Kurup et al. 2000, Nevalainen y Morawska 2009). Otros géneros que fueron menos frecuentes en este estudio, como Fusarium, Stachybotrys y Trichoderma, son conocidos como indicadores de problemas de humedad en lugares cerrados (HyvÄrinen et al. 2001), y como Acremonium, Chaetomium, Mucor y Rhizopus, los cuales han sido aislados de ambientes cerrados y se han comunicado como responsables del biodeterioro de distintos materiales orgánicos (Gallo 1993, Nugari y Roccardi 2001).
Las esporas del género Penicillium son un componente habitual de la aeromicobiota de ambientes internos y externos, y se presentan tanto en el aire como en el suelo. Algunas especies de este género pueden ser patógenos y causar enfermedades como alergias, asma y alveolitis alérgica (Sáenz y Gutiérrez 2003), y pueden estar implicadas en casos de hipersensibilidad (De la Rosa et al. 2002). Por otra parte, Rautiala et al. (2002) señalan que Paecilomyces es un contaminante común del aire de espacios cerrados, de materiales de construcción y del polvo.
Se ha indicado que géneros como Cladosporium, es causante de alergias respiratorias como asma extrínseca, y Alternaria está asociado con enfermedades pulmonares alérgicas (Labarrere et al. 2003), mientras que algunas especies de Aspergillus pueden ser patógenos produciendo lesiones en los bronquios o en los pulmones (Finegold y Martin 1983).
En cuanto al aislamiento de levaduras del ambiente, la concentración del género Rhodotorula aumentó cuando se registró la mayor humedad relativa y la menor temperatura, características ambientales adecuadas que permiten el crecimiento y desarrollo de esta levadura (Sáez et al. 2004).
Las formas bacterianas identificadas que presentaron mayor abundancia corresponden a bacterias Gram negativas (58,7%); sin embargo, es también relevante el porcentaje de bacterias Gram positivas aisladas (41,3%). Esto es contrario a lo registrado por Borrego et al. (2008, 2010a, b), quienes aislaron de ambientes internos de archivos el mayor número de bacterias Gram positivas, las cuales son más resistentes que las Gram negativas y pueden ingresar al interior de los locales, como consecuencia de la presencia de polvo sobre el piso y de la actividad del hombre, ya que muchas de ellas pueden formar parte de la piel y las mucosas de los organismos (Goh et al. 2000, Zhu et al. 2003). Entre tanto, las bacterias Gram negativas producen endotoxinas que están compuestas por lipopolisacáridos relacionados con la pared celular, que al inhalarse causan irritación de las mucosas del sistema respiratorio originando fiebre, escalofríos, dolores de cabeza, además de problemas cardiovasculares (Awad 2007), y pueden producir bronquitis y asma debido a una exposición continua a este tipo de bacterias (Nevalainen y Morawska 2009). Además, la gran presencia de estas endotoxinas en el ambiente puede estar favorecida por acumulación de polvo y con la limpieza de las superficies (Hines et al. 2000) tal como se observa en el interior de la biblioteca.
Los géneros bacterianos Gram positivos aislados en este estudio como Bacillus, Corynebacterium, Kurthia, Micrococcus, Staphylococcus, Streptococcus, y Gram negativos como Acinetobacter, Enterobacter, Flavobacterium, Moraxella, Serratia, entre otros, han sido aislados en otros ambientes cerrados (Aydogdu et al. 2010, Borrego et al. 2008, 2010a, b, Labarrere et al. 2003), y algunas de sus especies están asociadas con problemas principalmente respiratorios, aunque otras forman parte de la microbiota normal de la piel (Aydogdu et al. 2010, Borrego et al. 2010a).
El género Bacillus, fue el de mayor concentración en el interior de la biblioteca, cuya presencia es común en muestras de agua, suelo y polvo (Aydogdu et al. 2010), y se ha relacionado con el deterioro en la construcción de edificios, además de que puede dar lugar al biodeterioro de materiales orgánicos debido a su alta actividad celulolítica (Villalba et al. 2004). Asimismo, la producción de endosporas por este género, hace que sus especies sean altamente resistentes a diferentes condiciones ambientales y a una amplia variedad de sustancias químicas (incluyendo antibióticos y desinfectantes), lo que les permite tener elevada tasa de supervivencia en el ambiente y gran facilidad de diseminación (Borrego et al. 2011). Entre tanto, algunas especies de Neisseria están asociadas con enfermedades respiratorias e infecciones del sistema nervioso central; el género Acinetobacter no reviste mayor importancia clínica y se encuentra con frecuencia en muchos ambientes siendo parte de la microbiota normal de la piel y de los tractos respiratorio, gastrointestinal y genitourinario del hombre, y Pseudomonas es común encontrarlo en el ambiente aunque algunas cepas son patógenos potenciales para los humanos causando problemas principalmente en las vías urinarias y en el tracto respiratorio inferior (Finegold y Martin 1983).
La diversidad microbiana registrada en el ambiente de la biblioteca es similar a la registrada para otros estudios que han evaluado la concentración microbiana en diferentes ambientes cerrados, y a pesar de que éste no se considere como un ambiente contaminado, es importante mantener un control de poblaciones microbianas específicas, principalmente de los géneros fúngicos y bacterianos que en mayor concentración podrían llegar a causar graves problemas de salud pública. Asimismo, es de tener en cuenta que aspectos como el tiempo de exposición al ambiente y las características inmunológicas de las personas podrían incidir en la sintomatología característica de cierto tipo de enfermedad (Nevalainen y Morawska 2009), por lo que se recomienda que en los lugares internos como bibliotecas o archivos y otros, se deben utilizar los implementos de protección personal apropiados, tales como guantes y tapabocas, y adoptar medidas adecuadas de limpieza del lugar, así como de los estantes de libros y de los mismos documentos, y mantener en buen funcionamiento los sistemas de ventilación, de tal forma que la incidencia en los problemas de salud disminuya.
AGRADECIMIENTOS
Los autores agradecen a la Dirección de Investigaciones de la Universidad Pedagógica y Tecnológica de Colombia por la beca pasantía para la realización de este proyecto, al coordinador de la Biblioteca Central Jorge Palacios Preciado por permitir la realización del muestreo, a la Dra. Sofía Borrego por sus orientaciones en la metodología y facilitarnos documentos y artículos científicos, a la Biól. Martha E. Parada por su colaboración en la fase de muestreo y en el manejo estadístico de los datos, y al Dr. Albert Ortiz por sus valiosas sugerencias.
REFERENCIAS
1. Aira MJ, Rodríguez-Rajo FJ, Jato V, Piontelli E. 2006. Análisis cuantitativo y cualitativo de la aeromicota aislada de la catedral de Santiago de Compostela (Galicia, España). Boletín Micológico, 21: 27-34. [ Links ]
2. Angelosante-Bruno A, Pace L, Tomassetti B, Coppola E, Verdecchia M, Pacioni G, Visconti G. 2007. Estimation of fungal spore concentrations associated to meteorological variables. Aerobiología, 23: 221-228. [ Links ]
3. Awad AHA. 2007. Airborne dust, bacteria, actinomycetes and fungi at a flourmill. Aerobiologia, 23: 59-69. [ Links ]
4. Aydogdu H, Asan A, Tatman-Otkun M. 2010. Indoor and outdoor airborne bacteria in child day-care centers in Edirne City (Turkey), seasonal distribution and influence of meteorological factors. Environmental Monitoring and Assessment, 164: 53-66. [ Links ]
5. Barnett H. 1960. Illustrated genera of imperfect fungi. 2nd ed. Estados Unidos: Burgess Publishing Company. p. 225. [ Links ]
6. Bogomolova E, Kirtsideli I. 2009. Airborne fungi in four stations of the St. Petersburg Underground railway system. International Biodeterioration and Biodegradation, 63: 156-160. [ Links ]
7. Borrego S, Pons V, Perdomo I. 2008. La contaminación microbiana del aire en dos depósitos del Archivo Nacional de la República de Cuba. Revista CENIC. Ciencias Biológicas, 39 (1): 63-69. [ Links ]
8. Borrego S, Guiamet P, Gómez de Saravia S, Batistini P, García M, Lavin P, Perdomo I. 2010a. The quality of air at archives and the biodeterioration of photographs. International Biodeterioration and Biodegradation, 64: 139-145. [ Links ]
9. Borrego S, Perdomo I, Guiamet P, Gómez de Saravia S. 2010b. Estudio de la concentración microbiana en el aire de depósitos del Archivo Nacional de Cuba. Augmdomus, 1: 118-137. [ Links ]
10. Borrego S, Perdomo I, De la Paz J, Gómez de Saravia S, Guiamet P. 2011. Relevamiento microbiológico del aire y de materiales almacenados en el Archivo Histórico del Museo de La Plata, Argentina y en el Archivo Nacional de la República de Cuba. Revista del Museo de La Plata, Sección Botánica, 18 (119): 1-18. [ Links ]
11. Bueno D, Silva J, Oliver G. 2003. Hongos ambientales en una biblioteca: un año de estudio. Anales de Documentación, 6: 27-34. [ Links ]
12. Carrabs M. 1995. Actualización en sinusitis. Antibióticos e Infección, 3 (4): 5-18. [ Links ]
13. Carrillo L. 2003. Los hongos de los alimentos y forrajes. Universidad Nacional de Salta, Argentina. p. 118. [ Links ]
14. Chandra-Mouli P, Venkata-Mohan S, Jayarama-Reddy S. 2005. Assessment of microbial (bacteria) concentrations of ambient air at semi-arid urban region: influence of meteorological factors. Applied Ecology and Environmental Research, 3 (2): 139-149. [ Links ]
15. Chao HJ, Milton DK, Schwartz J, Burge HA. 2001. Dustborne fungi in large office buildings. Mycopathologia, 154: 93-106. [ Links ]
16. De La Rosa MC, Mosso MA, Ullán C. 2002. El aire: Hábitat y medio de transmisión de microorganismos. Observatorio Medioambiental, 5: 375-402. [ Links ]
17. Díez-Herrero A, Sabariego-Ruiz S, Gutiérrez-Bustillo M, y Cervigón-Morales P. 2006. Study of airborne fungal spores in Madrid, Spain. Aerobiología, 22: 135-142. [ Links ]
18. Domsh K, Gams W, Anderson TH. 1980a. Compendium of soil fungi. Volumen 1. Nueva York (Estados Unidos): Academic Press. p. 859. [ Links ]
19. Domsh K, Gams W, Anderson TH. 1980b. Compendium of soil fungi. Volumen 2. Nueva York (Estados Unidos): Academic Press. p. 406. [ Links ]
20. Finegold SM, Martin WJ. 1983. Diagnóstico microbiológico. 6a. ed. Buenos Aires: Editorial Médica Panamericana S. A. p. 670. [ Links ]
21. Gallo F. 1993. Aerobiological research and problems in libraries. Aerobiologia, 9: 117-130. [ Links ]
22. Goh I, Obbard JP, Viswanathan S, Huang Y. 2000. Airborne bacteria and fungal spores in the indoor environment. A case study in Singapore. Acta Biotechnologica, 20: 67-73. [ Links ]
23. Gómez A, Garante I, Martínez JC, Valdivieso MA, Rubio LL, Tarazona GP, Sánchez-Medina M. 2005. Evaluación de alergenos presentes en polvo y ambiente de algunas bibliotecas de Bogotá, D. C. Universitas Médica, 46 (1): 13-20. [ Links ]
24. Haleem Khan AA, Karuppayil SM, Manoharachary C, Kunwar LK, Waghray S. 2009. Isolation, identification and testing for allergenicity of fungi from air-conditioned indoor environments. Aerobiologia, 25: 119-123. [ Links ]
25. Hines C, Milton D, Larsson L, Petersen M, Fisk W, Mendell M. Characterization and variability of endotoxin and 3-hydroxy fatty acids in an office building during a particle intervention study. Indoor Air, 10 (1): 2-12. [ Links ]
26. HyvÄrinen A, Vahteristo M, Meklin T, Jantunen M, Nevalainen A, Moschandreas D. 2001. Temporal and spatial variation of fungal concentrations in indoor air. Aerosol Science and Technology, 35: 688-695. [ Links ]
27. Jones AM, Harrison RM. 2003. The effects of meteorological factors on atmospheric bioaerosol concentrations-a review. Science of the Total Environment, 326 (1-3): 151-180. [ Links ]
28. Kirk PM, Cannon PF, Minter DW, Stalpers JA. 2008. Dictionary of the Fungi. 10th ed. Wallingford: CABI. p. 609. [ Links ]
29. Kurup V, Shen H, Banerjee B. 2000. Respiratory fungal allergy. Microbes and Infection, 2: 1101-1110. [ Links ]
30. Labarrere S, Gómez-Fernández A, Avila-Roque I, Guevara- Andreu ME, Fernández-Lafargue B. 2003. Riesgos biológicos en ambientes confinados. Revista Cubana de Salud y Trabajo, 4 (1-2): 4-7. [ Links ]
31. Madigan M, Martinko J, Parker J. 2006. Brock Biology of Microorganisms. 11a ed. Madrid: Prentice Hall Iberia. p. 1088. [ Links ]
32. Maggi O, Persiani A, Gallo F, Valenti P, Pasquariello G, Sclocchi M, Scorrano M. 2000. Airborne fungal spores in dust present in archives: proposal for a detection method, new for archival materials. Aerobiologia, 16: 429-434. [ Links ]
33. MiniCultura Colombia. 2009. Decreto 763 de 2009. Correspondiente al Patrimonio Cultural de la Nación de Naturaleza Material. Ministerio de Cultura de la República de Colombia. Fecha de acceso: 07 mayo 2011. Disponible en: http://www.museoscolombianos.gov.co/inbox/files/docs/decreto763-09.pdf. [ Links ]
34. Nevalainen A, Morawska L (eds.). 2009. Biological agents in indoor environments. Assessment of health risks. Organización Mundial de la Salud. Fecha de acceso: 16 de abril de 2010. Disponible en: http://www.ilaqh.qut.edu.au/Misc/BIOLOGICALAGENTS2009.pdf. [ Links ]
35. Nugari M, Roccardi A. 2001. Aerobiological investigations applied to the conservation of cultural heritage. Aerobiologia, 17: 215-223. [ Links ]
36. O'Gorman C, Fuller H. 2008. Prevalence of culturable airborne spores of selected allergenic and pathogenic fungi in outdoor air. Atmospheric Environment, 42: 4355-4368. [ Links ]
37. Pitzurra L, Bellezza T, Giammarioli M, Giraldi M, Sbaraglia G, Spera G, Bistoni F. 1999. Microbial environmental monitoring of the refectory in the monastery of St. Anna in Foligno, Italy. Aerobiologia, 15: 203-209. [ Links ]
38. Poulsen OM, Breum NO, Ebbehoj N. 1995. Collection of domestic waste. Review of occupational health problems and their possible causes. Science of the Total Environment, 170: 1-19. [ Links ]
39. Pyrri I, y Kapsanaki-Gotsi E. 2007. A comparative study on the airborne fungi in Athens, Greece, by viable and non-viable sampling methods. Aerobiologia, 23: 3-15. [ Links ]
40. Radler de Aquino N, De Göes L. 2000. Guidelines for indoors air quality in offices in Brazil. Proceedings of Healthy Buildings, 4: 549-554. [ Links ]
41. Rautiala S, Nevalainen A, Kalliokoski P. 2002. Firefighting efforts may lead to massive fungal growth and exposure within one week. A case report. International Journal of Occupational Medicine and Environmental Health, 15 (3): 303-307. [ Links ]
42. Rojas TI, Martínez E, Aira MJ, Almaguer M. 2008. Aeromicota de ambientes internos: comparación de métodos de muestreo. Boletín Micológico, 23: 67-73. [ Links ]
43. Sáenz C, Gutiérrez M. 2003. Esporas atmosféricas en la comunidad de Madrid. Documentos Técnicos de Salud Pública [Internet]. Madrid: Industrias Gráficas MAE. Disponible en: http://www.madrid.org/polen. [ Links ]
44. Sáez G, Rojas M, Candia E, Cáceres S, Jiménez R. 2004. Hongos en ambientes interiores y exteriores de la Facultad de Ciencias Naturales y Matemáticas de la Universidad Nacional Federico Villareal. The Biologist (Perú), 2 (2): 4-5. [ Links ]
45. Schaechter M, Neidhardt F, Ingraham J. 2006. Microbe. Washington: American Society for Microbiology. p. 610. [ Links ]
46. Shelton BG, Kirkland KH, Flanders WD, Morris GK. 2002. Profiles of airborne fungi in buildings and outdoor environments in the United States. Applied and Environmental Microbiology, 68: 1743-1753. [ Links ]
47. Toloza-Moreno D, Lizarazo-Forero L. 2011. Aeromicrobiología del Archivo Central de la Universidad Pedagógica y Tecnológica de Colombia (Tunja-Boyacá). Acta Biológica Colombiana, 16 (1): 185-194. [ Links ]
48. Valentín N, Vaillant M, Guerrero H. 1997. Programa de control integrado de plagas en bienes culturales de países de clima mediterráneo y tropical. Apoyo, 7: 13-14. [ Links ]
49. Villalba LS, Mikán JF, Sánchez S. 2004. Actividades hidrolíticas y caracterización izoenzimática de poblaciones microbianas aisladas del patrimonio documental del Archivo General de Colombia. NOVA, 2: 50-58. [ Links ]
50. Zhu H, Phelan P, Duan T, Raupp G, Fernando H, Che F. 2003. Experimental study of indoor and outdoor airborne bacterial concentrations in Tempe, Arizona, USA. Aerobiologia, 19: 201-211. [ Links ]