Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Actualidades Biológicas
versão impressa ISSN 0304-3584
Actu Biol vol.35 no.98 Medellín jan./jun. 2013
ARTÍCULOS DE INVESTIGACIÓN
ESTUDIO MORFOMÉTRICO Y TOPOLÓGICO DEL CEREBRO DEL PEZ NEÓN CARDENAL, Paracheirodon axelrodi (CHARACIFORMES: CHARACIDAE)
MORPHOMETRICAL AND TOPOLOGICAL STUDY OF CARDINAL NEON BRAIN, Paracheirodon axelrodi (CHARACIFORMS: CHARACIDAE)
Martha J. Obando-Bulla1, 2; Edwin Gómez-Ramírez1,3; Mario O. Tovar-Bohorquez1; Laura Rincón1; María L. Caldas-Martínez1; Hernán Hurtado-Giraldo1,4
1 Laboratorio de Embriología, Programa de Biología Aplicada, Facultad de Ciencias Básicas, Universidad Militar Nueva Granada. Campus Rio Grande. Cajicá, Colombia.
Correos electrónicos: 2 martha.obando@unimilitar.edu.co; 3 edwin.gomez@unimilitar.edu.co; 4 hernan.hurtado@unimilitar.edu.co.
Recibido: marzo de 2012; aceptado: enero de 2013.
Resumen
Este trabajo consistió en identificar y describir la anatomía externa e interna del cerebro de Paracheirodon axelrodi (Schultz, 1956, Characiformes: Characidae). Se emplearon 28 individuos los cuales fueron sacrificados de acuerdo a protocolos de ética para investigación con animales. Las cabezas fueron conservadas en formaldehído al 4%. Posteriormente se realizó la disección de estas para la descripción morfológica del cerebro y obtención de imágenes. Asimismo, se cuantificaron medidas de longitud y área de algunos lóbulos cerebrales (bulbos olfativos, hemisferios telencefálicos, lóbulos ópticos y cerebelo) y se realizó una ANOVA para comprobar si existían diferencias de tamaño en estas regiones. Para la topología del cerebro se siguió el protocolo para la obtención de cortes en parafina y se realizó tinción de Nissl. El cerebro de P. axelrodi está conformado por varios lóbulos conservando el patrón general descrito para otros teleósteos, sin embargo como características particulares se encontró que los bulbos olfativos son sésiles; el cerebelo presentó un tamaño moderado y no se evidenció la presencia de lóbulos faciales. En el análisis morfométrico tanto en longitud como en área se encontraron diferencias altamente significativas entre las estructuras evaluadas (p < 0,001), siendo los lóbulos ópticos la región de mayor tamaño, sugiriendo una dependencia mayor del sentido de la vista. En cuanto a la topología, el cerebro de P. axelrodi presenta características similares en la disposición de núcleos a las descritas en otros grupos de teleósteos.
Palabras claves: cerebro, morfometría, neuroanatomía, núcleos neuronales, Paracheirodon axelrodi.
Abstract
This work identified and described external and internal brain anatomy of Paracheirodon axelrodi (Schultz, 1956, Characiformes: Characidae). 28 individuals were sacrificed using bioethical protocols for research animal use. Heads were stored in 4% formaldehyde. The brains were later removed and dissected for anatomical description and digital image capture. In addition, length and area of some brain lobes (olfactory bulbs, telencephalic hemispheres, optic lobes and cerebellum) were obtained and an ANOVA was carried out to determine if statistical differences in size existed between these structures. For brain internal topology a protocol was followed for the preparations of paraffin sections and Nissl staining was performed. The brain of P. axelrodi exhibited several lobes in agreement with the general teleost brain pattern. However, as special characteristics, olfactory bulbs were sesil, the cerebellum was intermediate in size, and no facial lobes were observed. In the morphometrical analysis, for both length and area, highly significant differences were observed between the evaluated structures (p < 0.001), with optic lobes being the larger structures, suggesting a mayor role of vision. Internal topology of P. axelrodi brains was similar to other teleosts in terms of main nuclei location.
Key words: brain, morphometry, neuroanatomy, neuronal nuclei, Paracheirodon axelrodi.
INTRODUCCIÓN
Los teleósteos son el grupo más numeroso de vertebrados, comprendiendo alrededor de 25.000 especies y se ha encontrado que existe una gran diversidad inter e intra-específica en la morfología y tamaño de los cerebros de estos organismos (Ishikawa et al. 1999a, b, Kotrschal et al. 1998). Asimismo, han sido empleados en muchos estudios para demostrar que la estructura de los cerebros refleja algunas especializaciones en los sistemas sensoriales y han sido empleados para investigaciones neurobiológicas (Wagner 2001a, b).
El cerebro se divide en tres partes principales: el cerebro anterior, el cerebro medio y el cerebro posterior (Roberts 2001, Takashima y Hibiya 1995, Wullimann 1998). El cerebro anterior comprende los bulbos olfativos, los hemisferios telencéfalicos, el tracto olfativo, y el diencéfalo (Butler 2000, Chiason y Radke 1991, Grizzle y Rogers 1976, Wingerd 1988). Los bulbos olfativos son los encargados de recibir las señales olfativas. Los hemisferios telencefálicos son importantes en la recepción y transmisión de impulsos olfativos (Schilling 2002); sin embargo, también están involucrados en aspectos reproductivos, alimentación, visión a color y aprendizaje (Grizzle y Rogers 1976).
El diencéfalo comprende seis regiones: el epitálamo, tálamo dorsal, tálamo ventral, hipotálamo, área preóptica, pretectum y tubérculo posterior. Dentro de las funciones de estas regiones se encuentran la recepción de estímulos relacionadas con el gusto, el olfato y la visión; adicionalmente, algunas regiones están involucradas con el sistema nervioso autonómico y el sistema endocrino (Butler 2000, Butler y Hodos 1996, Chiason y Radke 1991, Evans 1992, Roberts 2001, Schilling 2002, Wingerd 1988).
El cerebro medio incluye el tectum óptico y el tegmentum. El tectum óptico de los teleósteos es el principal centro visual en el cerebro y también ha sido considerado un centro de integración multimodal. El tegmentum tiene un papel dominante en las funciones motoras (Butler 2000, Butler y Hodos 1996, Grizzle y Rogers 1976, Schilling 2002, Springer et al. 1977, Takashima y Hibiya 1995, Wingerd 1988, Wullimann 1998).
El cerebro posterior está constituido por el cerebelo y por la médula oblongata. En peces teleósteos, el cerebelo varía considerablemente en tamaño y morfología entre especies (Evans 1992, Roberts 2001) y la función principal del cerebelo radica en coordinar el balance, los movimientos y la orientación (Butler 2000, Butler y Hodos 1996, Grizzle y Rogers 1976).
Paracheirodon axelrodi (Schultz, 1956, Characiformes: Characidae) es una de las especies más comercializadas en Colombia, Brasil y Venezuela, como pez ornamental de exportación (CCI 2010, COPESCAL 2009). Considerando lo anterior, y con el fin de lograr un mayor entendimiento de su biología, como paso importante hacia un aprovechamiento sostenible, se han adelantado algunos estudios en esta especie (Anjos y Anjos, 2006, Brito y Bazzoli, 2009, Gómez et al. 2011, Oliveira et al. 2008, Tovar et al. 2009). Sin embargo, a pesar de lo informado hasta ahora poco o nada se conoce sobre la organización neuroanatómica de su cerebro, lo cual podría servir como base para estudios posteriores en neuroendocrinología y reproducción en esta especie.
De acuerdo a lo anterior se realizó un estudio sobre la morfología y topología del cerebro de P. axelrodi lo cual es esencial para establecer estudios relacionados con el desarrollo, neuroanatomía, neurofisiología y comportamiento (Ishikawa et al. 1999b, Mukada y Ando 2003). Asimismo, se llevó a cabo un análisis morfométrico de algunas regiones del cerebro relacionadas con la recepción de estímulos de los órganos de los sentidos, con el fin de comprobar si hay o no diferencias significativas en cuanto al tamaño de estas regiones entre sí.
MATERIALES Y MÉTODOS
Especímenes del estudio. Se emplearon 28 individuos adultos de la especie Paracheirodon axelrodi (Schultz, 1956, Characiformes: Characidae) con una longitud total promedio de 2,7 ± 0,19 cm y un peso promedio de 0,19 ± 0,07 g. Los individuos fueron adquiridos en tiendas acuaristas de Bogotá y para este trabajo no se realizó distinción de sexos entre individuos. Una vez adquiridos los individuos, estos fueron anestesiados con benzocaína (0,1 g/l) y posteriormente se realizó un corte en la médula espinal en la parte posterior de la cabeza para su sacrificio teniendo en cuenta las guías para el manejo ético de peces para la investigación (ASIH et al. 1988; AVMA 2000; CCAC 2003).
Procesamiento del material biológico. Una vez sacrificados los individuos, se separaron las cabezas del cuerpo y éstas se introdujeron en el fijador formaldehído al 4%, pH de 7,2-7,3 a 4 ºC durante 4 días. Luego se realizó la disección de todas las cabezas con el fin de extraer el cerebro para la descripción morfológica, topológica y para realizar las medidas respectivas de área y longitud. La identificación de las estructuras externas del cerebro se realizó por medio de imágenes de las partes dorsal, ventral y lateral de 18 cerebros. La captura de imágenes se realizó con un estereoscopio (Carl Zeiss, Stemi DV4), y su sistema de cámara digital.
Análisis morfométrico. Una vez se obtuvieron las imágenes para la identificación de las estructuras externas, estas fueron procesadas y con el uso del Software ImageJ (http://rsbweb.nih.gov/ij/) se midió la longitud de tres estructuras del cerebro: bulbos olfativos, hemisferios telencefálicos y lóbulos ópticos; y el área de cuatro estructuras: bulbos olfativos, hemisferios telencefálicos, lóbulos ópticos y cerebelo. Para realizar las medidas de longitud se tomaron imágenes laterales del cerebro y se siguió la metodología propuesta por Marchetti y Nevitt (2003); mientras que para la obtención de los datos de área se usaron imágenes dorsales del cerebro. Las mediciones del cerebro fueron realizadas por una misma persona, esto con el fin de disminuir el error en las medidas, y de cada región del cerebro se tomaron tres medidas y se promediaron. Los datos promedio se utilizaron para realizar el análisis estadístico.
Análisis estadístico. Se realizó un análisis de varianza (ANOVA) y pruebas de Tukey para comprobar si existen diferencias significativas en área y longitud de las estructuras cerebrales evaluadas (lóbulos ópticos, hemisferios telencefálicos, bulbos olfatorios y cerebelo). Se consideró el nivel de significancia del 5% (p > 0,05 error tipo I) (Zar 1999).
Procesamiento histológico. Para la caracterización topológica se siguió el protocolo de deshidratación para la obtención de cortes en parafina a 5 μm (Hinton 1990) y se realizó la tinción de Nissl (Gridley 1960).
Una vez obtenidos los montajes permanentes se llevó a cabo la respectiva observación y captura de imágenes de las diferentes secciones del cerebro para la caracterización topológica. La captura de imágenes se realizó con un microscopio óptico (Carl Zeiss, Axioskop 2 mot plus) equipado con una cámara digital. Posteriormente, se realizaron los esquemas con la ayuda del Software ImageJ (http://rsbweb.nih.gov/ij/).
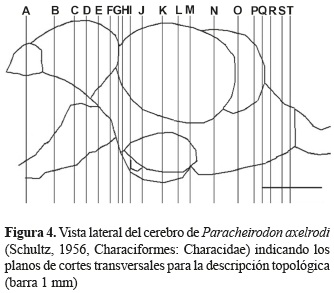
La identificación de los núcleos se llevó a cabo teniendo en cuenta los planos transversales. Para esto se realizó un mapa (figuras 1 y 4) indicando los niveles de los cortes. La designación de los núcleos de cada una de las regiones del cerebro se llevó a cabo teniendo en cuenta los trabajos realizados por Wulliman et al. (1996) en el pez zebra (Danio rerio) y por Anken y Bourrat (1998) en el pez medaka (Oryzias latipes).
Abreviaturas de las estructuras morfológicas. Abreviaturas de estructuras morfológicas presentadas en las figuras 2 a 7, en orden alfabético: A = núcleo talámico anterior; AON = núcleo octaval anterior; AP = núcleo pretectal anterior; ATN = núcleo tuberal anterior; BO = bulbos olfativos; Cans = commissura ansulata; CC = crista cerebelar; CCe = corpus cerebelar; Ccer = commissura cerebelar; CE = Cerebelo; CIL = núcleo central del lóbulo inferior; CM = corpus mamillare; CO = quiasma óptico; COM = núcleo octavolateral caudal; CPN = núcleo pretectal central; Cpop = commissura postóptica; Ctec = commissura tecti; Cven = commissura ventralis rhombencephali; DAO = núcleo óptico accesorio dorsal; Dc = zona central del área dorsal telencefálica D; Dd = zona dorsal de D; Die = Diencéfalo; DIL = núcleo difuso del lóbulo inferior; DiV = ventrículo diencefálico; Dl = zona lateral de D; Dm = zona media de D; DON = núcleo octaval descendente; DOT = tracto óptico dorsomedial; Dp = zona posterior de D; DTN = núcleo tegmental dorsal; DV = descending trigeminal root; ECL = capa celular externa del bulbo olfativo; EG = eminencia granular; ENd = núcleo entopeduncular, parte dorsal; ENv = núcleo entopeduncular, parte ventral; ep = epéndimo; GC = griseum central; GL = capa glomerular del bulbo olfativo; Gm = núcleo preglomerular medial; H = hipófisis; Had = núcleo habenular dorsal; Hav = núcleo habenular ventral; Hc = zona caudal del hipotálamo periventricular; Hd = zona dorsal del hipotálamo periventricular; HTel = Hemisferios telencefálicos; Hv = zona ventral del hipotálamo periventricular; I = núcleo talámico intermédio; ICL = Capa celular interna del bulbo olfativo; III = nervio oculomotor; IO = oliva inferior; IRF = formación reticular inferior; LCa = lóbulo caudal cerebelar; LH = núcleo hipotalámico lateral; LI = Lóbulos inferiores; LO = Lóbulos ópticos; LR = receso lateral del ventrículo diencefálico; LLF = fascículo longitudinal lateral; MA = axon de Mauthner; MAC = célula de Mauthner; ME = médula espinal; MLF = fascículo longitudinal medial; MO = Médulaoblongata; MON = núcleo octavolateral medial; nI = nerviocraneal olfativo; nII = nervio craneal óptico; NIII = núcleo oculomotor; NIV = núcleo delnervio troclear; Nln = núcleo interpeduncular; NLV = núcleo lateralisvalvulae; NT = núcleo taeniae; OT = tracto óptico; PC = comisura posterior; PG = núcleo preglomerular; PGZ = zona gris periventricular del tectum óptico; PL = núcleo perilemniscal, PM = núcleo preóptico magnocelular; PPa = núcleo preóptico parvocellular, parte anterior; PPp = núcleo preóptico parvocellular, parte posterior; PPv = núcleo pretectal periventricular, parte ventral; PR = receso posterior del ventrículo diencefálico; PSm = núcleo pretectal superficial magnocelular; PTN = núcleo tuberal posterior; RF = fasciculus retroflexus; RT = núcleo tegmental rostral; RV = ventrículo rombo encefálico; SC = núcleo supraquiasmático; SD = saccus dorsalis; SRF =formación reticular superior; Tel = hemisferios telencefálicos; TeO = tectum opticum; TeV = ventrículo tectal; TL = torus longitudinalis; TLa = toruslateralis; TPM = tracto pretectu mamillaris; TPp = núcleo periventricular del tuberculum posterior; TS = torus semicircularis; TTB = tracto tecto bulbaris; TTBr = tracto tecto bulbaris rectus; Val = división lateral de la válvula cerebelar; Vam = división medial de la válvula cerebelar; Vd = núcleo dorsal del área ventral telencefálica V; VIII = nervio octaval; Vl = núcleo lateral de V; VL = núcleo talámico ventrolateral; VM = núcleo talámico ventromedial; VOT = tracto óptico ventrolateral; Vp =núcleo post-commissural de V; Vs = núcleo supra-commissural de V; Vv = núcleo ventral de V; X = nervio vagal; ZL = zona limitans).
RESULTADOS
Morfología del cerebro de P. axelrodi. Realizadas observaciones macroscópicas del cerebro de P. axelrodi en tres orientaciones (dorsal, ventral y lateral) fue posible identificar algunas estructuras. Cabe anotar que en el presente estudio no se identificaron los nervios craneales, sino solo aquellos cuya vista fue aparente como el nervio olfativo y el óptico.
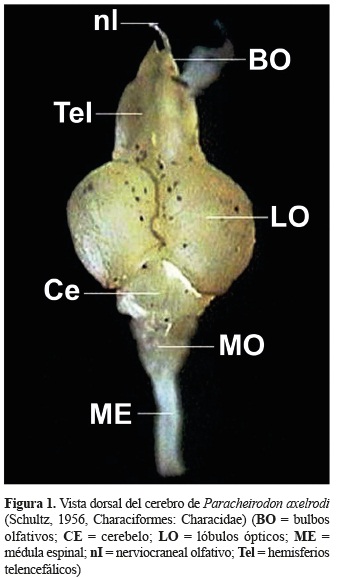
En una vista dorsal (figura 1) se identificaron los bulbos olfativos (BO), hemisferios telencefálicos (HTel), lóbulos ópticos (LO) y el cerebelo (Ce). Los bulbos olfativos se localizan en la parte más rostral del cerebro, son pareados y pequeños en relación a los demás lóbulos; son sésiles ya que se encuentran unidos a los hemisferios telencefálicos. Unidos a los bulbos olfativos en una posición más anterior se encuentran los nervios olfativos. Los hemisferios telencefálicos se ubican caudales a los bulbos olfativos, son pareados y alargados. Los lóbulos ópticos se encuentran adyacentes al telencéfalo, son pareados y circulares. El cerebelo es una estructura de forma circular que se encuentra alojada en medio de la parte caudal de los lóbulos ópticos.
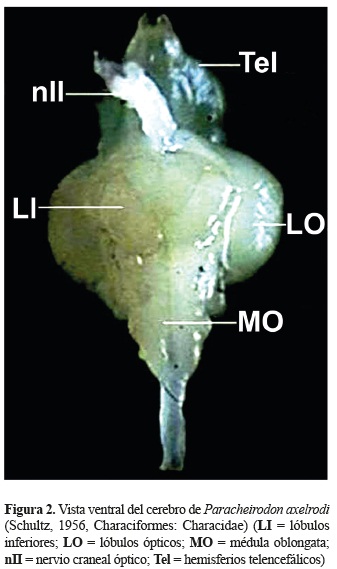
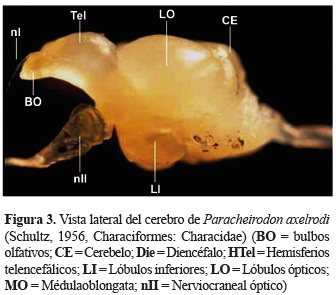
En una vista ventral y lateral; adicionalmente fue posible identificar los lóbulos inferiores (LI) que se encuentran debajo de los lóbulos ópticos, los LI son pareados, alargados, dispuestos en forma de ''v'' y alojada en medio de éstos se encuentra la hipófisis. La médula oblongata (MO) es la estructura más caudal del cerebro, presenta una forma alargada y es continúa con la médula espinal (figuras 3 y 4).
Morfometría del cerebro de P. axelrodi. Para los datos morfométricos de longitud y área obtenidos se utilizó el test de Shapiro- Wilk (Zar 1999), sin embargo los valores de área no fueron normales por lo que tuvieron que ser transformados; para ello se utilizó la transformación ''box.cox''. Caso contrario ocurrió con los valores de longitud, los cuales arrojaron normalidad.
De acuerdo a los resultados morfométricos obtenidos, los lóbulos ópticos fueron la región del cerebro que presentó un mayor valor promedio de longitud seguido por los hemisferios telencefálicos y por último los bulbos olfativos. Al cerebelo no se le cuantificó medida de longitud debido a que la anatomía lateral del cerebelo del P. axelrodi no permite tener un valor significativo de esta estructura lo que llevaría a subestimar el tamaño relativo de la misma. Con respecto al área el mayor valor promedio lo obtuvieron los lóbulos ópticos seguidos por el cerebelo, los hemisferios telencefálicos y por último los bulbos olfatorios (tabla 1).
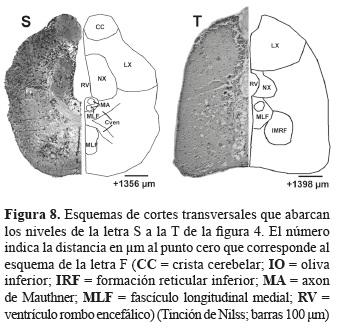
Topología del cerebro de P. axelrodi. La figura 4 representa el mapa de los planos correspondientes a las secciones transversales del cerebro que corresponden a las figuras 5 a 8.
Cerebro anterior. Los bulbos olfativos están conformados por tres capas: capa celular interna (ICL), capa celular externa conformada por las células mitrales (ECL) y la capa glomerular (GL) (figura 5A).
En los hemisferios telencefálicos se identificaron las dos zonas principales en que se dividen: el área dorsalis telencephali (D) y el área ventralis telencephali (V) las cuales a su vez se subdividieron en varios núcleos (figuras 5B a 5F). En D se encontraron cinco zonas: zona central del área dorsal telencefálica (Dc), zona dorsal de D (Dd), zona lateral de D (Dl), zona media de D (Dm) y la zona posterior de D (Dp). Adicionalmente, se encuentra en esta región el núcleo taeniae (NT) ubicándose ventral a la zona Dp. En la región V se identificaron cuatro núcleos ubicados periventricularmente: núcleo dorsal del área ventral telencefálica (Vd), núcleo post-commissural de V (Vp), núcleo supracommissural de V (Vs) y el núcleo ventral de V (Vv). Vd y Vv se encuentran hacia la parte rostral de la comissura anterior (Cant). Por otro lado, el núcleo lateral del área ventral telencefálica (Vl) junto con el núcleo entopeduncular, parte dorsal (ENd) y el núcleo entopeduncular, parte ventral (ENv) se ubican hacia la periferia del cerebro en la región más caudal del telencéfalo.
El diencéfalo se ubica caudal al telencéfalo y en este fue posible identificar algunos núcleos de las seis divisiones que se describen en vertebrados: el área preóptica, epitálamo, hipotálamo, el tálamo, el pretectum y el tuberculum posterior (figuras 5E a 6L). El área preóptica abarca la parte más rostral del ventrículo dincefálico (DiV) y alrededor de éste se ubica hacia la parte ventral el núcleo preóptico parvocelular (PP) en el cual la parte anterior (PPa) está hacia la zona ventral del telencéfalo y en el diencéfalo es reemplazado por núcleo preóptico parvocelular, parte posterior (PPp). Hacia la parte dorsal de PPp se ubica el núcleo preóptico magnocelular (PM). Hacia la parte ventral de PPp se encuentra el núcleo supraquiasmático (SC) (figuras 5D a 6G). En el epitálamo se identificó la epífisis (EP) la cual se localiza hacia la parte rostral en medio de los hemisferios telencefálicos, mientras que hacia la zona caudal se identificó el saccus dorsalis (SD); los núcleos habenulares dorsal (Hd) y ventral (Hv) se ubican hacia la parte lateral de la epífisis (figuras 5D a 6G).
El pretectum superficial incluye el núcleo pretectal superficial magnocelular (PSm), mientras que en el pretectum central está el núcleo pretectal central (CPN). Adicionalmente el núcleo óptico accesorio dorsal (DAO) es considerado parte del pretectum y se ubica adyacente hacia la zona ventral de PSm (figura 6G).
El hipotálamo incluye zonas ventrales, dorsales y caudales. La zona dorsal incluye los núcleo difuso del lóbulo inferior (DIL), adicionalmente se encuentra el receso lateral del ventrículo diencefálico (LR) el cual está rodeado por la zona dorsal del hipotálamo periventricular (Hd). La zona ventral incluye hacia la parte rostral el núcleo periventricular (Hv) y hacia la parte lateral de este se ubican el núcleo tuberal anterior (ATN) y el núcleo hipotalámico lateral (LH). Hacia la zona caudal del hipotálamo se encuentra el núcleo del hipotálamo periventricular (Hc) el cual rodea al receso posterior del ventriculo (PR). La pituitaria (Pit) se encuentra unida ventralmente a las zonas del hipotálamo caudal y ventral (figuras 6H a 7M).
El tálamo se ubica en la parte caudal al epitálamo y se diferencia en tálamo dorsal y tálamo ventral. El tálamo dorsal consiste del núcleo talámico (A) y en el tálamo ventral se ubica el núcleo talámico ventromedial (VM) y el núcleo talámico ventrolateral (VL) (figuras 6H y 6I).
En el tuberculum posterior se incluye una región periventricular la cual consiste de dos núcleos: el núcleo periventricular del tuberculum posterior (TPp) y el núcleo tuberal posterior (PTN). Por otro lado está el núcleo preglomerular (PG) y el núcleo preglomerular medial (PGm). Adicionalmente se encuentra el corpus mamillare (CM) y el toruslateralis (TLa) (figuras 6J a 6L).
Dentro de los tractos y fribras que se ubican en el diencéfalo se encontraron: el quiasma óptico (CO), el tracto óptico (OT), el tracto óptico dorsomedial (DOT), el tracto óptico ventrolateral (VOT), el tracto pretectu mamillaris (TPM), el fasciculus retroflexus (RF) y la commissura postóptica (Cpop),
Cerebro medio. El tectum óptico (TeO) se ubica en la parte dorsal distinguiéndose a su vez la capa gris de la zona periventricular (PGZ). También se encuentra la commissura tecti (Ctec) en medio del tectum óptico; y unido al tectum se encuentra el torus longitudinalis (TL) el cual es una estructura pareada compuesta por células granulares. El torus semicircularis (TS) se ubica en la parte lateral del tegmento (figuras 6G a 7N).
La región del tegmento se encuentra separada de la región dorsal por el ventrículo tectal; en el tegmento se encuentran algunos núcleos motores como el núcleo oculomotor (NIII), el núcleo del nervio troclear (NIV), la región rostral de la formación reticular superior ( SRF), el núcleo tegmental dorsal (DTN), el núcleo tegmental rostral (RT), el núcleo perilemniscal (PL) y el núcleo interpeduncular (NI n) (figuras 6J a 7N).
Cerebro posterior. El cerebelo (Ce) se dividió en tres estructuras: el corpus cerebelar, el lóbulo vestíbulo lateral, y la válvula cerebelar. El lóbulo vestíbulo lateral se subdivide en el lóbulo caudal cerebelar (LCa) y la eminencia granular (EG); la válvula cerebelar contiene subdivisiones mediales y laterales (Vam) y (Val). Adicionalmente se identificó la comisura cerebelar (Ccer) (figuras 6K a 7P).
En la médula oblongata se encuentran los núcleos de los nervios sensores y motores dentro de los que se identificaron el nervio octaval (VIII), y el nervio vagal (X). Por otro lado también se encuentran los nervios de la línea lateral y el núcleo octaval descendente (DON), el núcleo octaval anterior (AON), el núcleo octavolateral medial (MON), la crista cerebelar (CC) y el núcleo octavolateral caudal (CON) (figuras 7N a 8S).
En cuanto a los núcleos que hacen parte de la formación reticular en P. axelrodise identificó el núcleo de la formación reticular inferior (IRF); y dentro de los núcleos medulares adicionales se encuentran el griseum central (GC), el nucleus lateralis valvulae (NLV), las células de Mauthner (MAC), el axón de Mauthner (MA) y el fascículo longitudinal medial (MLF) (figuras 6K a 8T).
DISCUSIÓN
La morfología y disposición de los bulbos olfativos de P. axelrodi es similar a la descrita en peces como Danio rerio (Wulliman et al. 1996) y la Anguilla japonica (Mukada y Ando, 2003), a diferencia de aquellos peces como Ariopsis seemanni perteneciente a los silúridos en los cuales los bulbos olfativos se encuentran unidos a los hemisferios telencefálicos por un tracto olfativo largo (Londoño y Hurtado 2010), ó como Oryzias latipes (Anken y Bourrat 1998, Ishikawa et al. 1999b) en el cual los bulbos olfativos se ubican por debajo de los hemisferios telencefálicos. La topología de esta región, es similar a lo comunicado para las especies anteriormente mencionadas, siendo la función única de los bulbos olfativos la recepción de estímulos relacionados con el sentido del olfato y a su vez la proyección de entradas olfativas a otras regiones del cerebro como la región ventral del telencéfalo y algunos núcleos del diencéfalo (Wullimann et al. 1996).
La región dorsal de los hemisferios telencefálicos de P. axelrodi presenta la forma e vertida descrita para los peces de aleta radiada (Butler y Hodos 1996). En cuanto a los núcleos identificados en esta región, se ha descrito que la zona posterior de D y la zona central de D son los principales blancos del bulbo olfativo. La zona media de D, junto con la zona dorsal de D, la zona lateral de D y la zona central de D reciben entradas sensoriales retrasmitidas de varios núcleos del diencéfalo como por ejemplo del núcleo preglomerular lateral (Striedter 1991). Por otro lado, estudios en Carassius auratus (Durán et al. 2002, Portavella y Vargas 2005, Saito y Watanabe 2004) proponen que Dm o Dl podrían tener una función específica en el aprendizaje espacial. Sin embargo, Gómez et al. (2006) propone que Dm es el homólogo al hipocampo en vertebrados terrestres, mientras que Saito y Watanabe (2006) propone que el homólogo al hipocampo de vertebrados terrestres es Dl.
Por otro lado, los núcleos de la región ventral del telencéfalo reciben entradas olfativas del bulbo olfativo (Butler 2000).
Los lóbulos ópticos de P. axelrodi hacia la región dorsal presentaron el tectum óptico como un par de lóbulos expandidos lateralmente al igual que lo descrito para otros teleósteos. El tectum óptico es una corteza laminada que recibe entradas multimodales de varias fuentes, incluyendo la retina y centros visuales adicionales como el tálamo, el pretectum y el núcleo isthmi. Adicionalmente, el tectum óptico en teleósteos recibe entradas no visuales del torus semicircularis y del telencéfalo. La organización cito-arquitectónica del tectum óptico, sus entradas multimodales segregadas, y la representación topográfica de sus entradas provee una maquinaria neural diseñada para las tareas de orientación integrativa, tales como la identificación y ubicación de objetos, y el control de la coordinación motora (Wullimann et al. 1996).
Adicionalmente, en teleósteos se ha descrito otras áreas del sistema nervioso central que reciben entradas retinales diferentes al tectum óptico y los cuales se identificaron en P. axelrodi. Estos núcleos corresponden a regiones del diencéfalo como son: los núcleos talámico anterior, talámico intermedio y talámico ventrolateral; el núcleo pretectal central, los núcleos dorsal y ventral involucrados en los reflejos oculomotores optocinéticos y el núcleo supraquiasmático. Adicionalmente, este último núcleo puede estar involucrado en peces en la generación y control del ritmo circadiano teniendo en cuenta su rol en otros vertebrados (Butler y Saidel 1991, Northcutt y Butler 1993, Wullimann et al. 1996).
Dentro de los otros núcleos identificados en los lóbulos ópticos se plantea que el torus longitudinalis juega un papel en las funciones orientadas visualmente tales como el movimiento en respuesta a un estímulo específico de varios puntos en el espacio visual (Butler y Hodos 1996, Kotrschal et al. 1998). El torus lateralis es una región única de peces de aleta radiada, y debido a que no se ha encontrado en otros taxones no hay estudios que revelen una homología de esta estructura con alguna otra en los demás vertebrados, por lo que sus funciones no son muy claras (Butler y Hodos 1996).
El torus semicircularis está involucrado en el sistema mecano sensorial recibiendo proyecciones secundarias de los núcleos de la línea lateral y proyectándolos hacia el núcleo preglomerular lateral (Striedter 1991). En P. axelrodi el torus semicircularis presenta un tamaño moderado, característica de teleósteos no electro-receptivos como Carassius auratus; a diferencia de los mormíridos y los gymnotiformes que presentan un torus semicircularis enorme debido a que han desarrollado un sistema electro-sensorial (Butler y Hodos 1996, Wulliman 1998).
El cerebelo de P. axelrodi presenta la forma tripartita típica de los teleósteos, a diferencia de los peces mormíridos cuya forma del cerebelo es más elaborada presentando un aspecto hiperplegado e hipertrofiado cubriendo la superficie dorsal de los hemisferios telencefálicos y los lóbulos ópticos debido a su función eléctrica en este grupo de peces. En la topología cerebelar, el lóbulo vestibulateral comprende la eminencia granularis y el lóbulo caudal, el cual, podría ser homólogo al vestíbulo cerebellum presente en todos los vertebrados, ya que éste recibe entradas octavales primarias, así como proyecciones de la línea lateral (Butler y Hodos 1996).
La válvula cerebelar en P. axelrodi se encuentra alojada dentro del espacio del ventrículo del tectum óptico no siendo visible en la morfología externa del cerebro, caso contrario en los mormíridos los cuales presentan una válvula cerebelar enorme que sobresale caudalmente entre los hemisferios telencefálicos (Butler y Hodos 1996). La válvula cerebelar, al igual que la eminencia granular está involucrada con el sistema de la línea lateral (Butler 2000)
En la médula oblongata, se ubican los núcleos involucrados en la audición y en el gusto. En peces con un sistema del gusto bien desarrollado como es el caso de Cyprinus carpio y Carassius auratus, en el grupo de ciprínidos, e Ictalirus puntactus en el grupo de los silúridos, presentan centros gustativos primarios separados por cada nervio: lóbulo facial (LVII), lóbulo gloso faringeal (LIX) y lóbulo vagal (LX). Sin embargo, el lóbulo facial es más grande y complejo en silúridos y el lóbulo vagal es más grande y complejo en ciprínidos (Kanwal y Caprio 1987, Wullimann et al. 1996). El nervio vagal de los teleósteos también codifica estímulos viscero-sensores generales desde las vísceras hacia el sistema nervioso central, notablemente hacia el núcleo comisural de Cajal (NC). Sin embargo, la extensión de éste lóbulo en P. axeroldi es mucho más pequeña en comparación a lo registrado en ciprínidos (Kotrschal et al. 1998), lo que podría indicar que en P. axeroldi solo se llevaría a cabo la función del estímulo viscero-sensorial. Adicionalmente el lóbulo facial no se identificó en P. axeroldi.
Por otro lado, la médula oblongata junto con el tegmentum (región ventral del mesencéfalo) constituye una red neuronal muy compleja denominada la formación reticular. La formación reticular tiene conexiones recíprocas con el tectum óptico y también con el cerebelo (Wullimann et al. 1996). Hay neuronas da la formación reticular que se proyectan a la médula espinal y otras que se proyectan hacia el telencéfalo (Lee et al. 1993, Murakami et al. 1983, Prasada- Rao et al. 1987, Wullimann y Meyer 1993). Por otro lado, algunas estructuras medulares podrían ser consideradas parte de la formación reticular como las células de Mauthneró el locus coeruleus (LC). El fascículus de Mauthner en P. axelrodi como en otras especies se caracterizó por su gran tamaño; este núcleo se ha descrito que influye en las respuestas rápidas de evasión y escape (Butler y Hodos 1996).
Con respecto a estudios morfométricos, varios autores han relacionado la composición y el tamaño de algunas regiones del cerebro (principalmente las encargadas de recibir información de los órganos de los sentidos) en teleósteos con los hábitos de vida de cada uno así como las características de los cuerpos de agua donde habitan.
Por lo anterior y teniendo en cuenta los resultados morfométricos de las regiones cerebrales evaluadas en P. axelrodi se tiene que los lóbulos ópticos son más grandes que los bulbos olfativos lo que corrobora que frecuentemente hay una oposición entre el sentido del olfato y el visual (Ridet y Bauchot 1990) y de acuerdo con lo publicado con Chiason y Radke (1991) los peces que viven en lagunas o lagos con poca corriente presentan un modesto sentido del olfato y son dependientes de la visión y del gusto para ubicar el alimento, seria de suponerse, entonces, que P. axelrodi quien habita en aguas de bajo flujo de corriente (Walker 2004) presente esta característica. Por otro lado, se ha encontrado que especies de ciprinidos (Huber y Rylander 1992) que habitan aguas claras se caracterizan por presentar estructuras grandes relacionadas con la visión como ojos y casi el doble de fibras en el nervio óptico; característica que ha de sugerirse en P. axelrodi, el cual habita en zonas sombreadas de aguas claras de los ríos; contrario a las especies asociadas a hábitos turbios, que se destacan por presentar estructuras olfativas y gustativas más desarrolladas. De igual forma, especies epibénticas de la familia Liparidae que habitan profundidades de 500-650 m en la Antártida (Eastmon y Lannoo 1998), y en algunas especies de la familia Gadidae que se encuentran en profundidades de 80-600 m como Gadus morhua (Delfini y Diagne 1985), se ha encontrado bulbos olfativos y nervios olfativos grandes y una lamela olfativa bien desarrollada, en contraste con un tectum óptico pequeño al igual que los nervios ópticos.
En relación al tipo de dieta, en un estudio de ciprínidos (Kotrschal y Junger 1988, Kotrschal y Palzenberger 1992), especies que se alimentan de plancton en la superficie fueron caracterizadas por presentar la línea lateral y los lóbulos visuales bien desarrollados, pero con tallos cerebrales y lóbulos gustativos pequeños. Teniendo en cuenta lo anterior y de acuerdo a lo que se conoce de la dieta de P. axelrodi, es decir pequeños invertebrados y microcrustáceos (Walker 2004), el cerebro de este organismo se asemejaría a este grupo de Ciprínidos; adicionalmente teniendo en cuenta un estudio realizado de la composición histológica y morfométrica del ojo de P. axelrodi se determinó que este individuo presenta algunas adaptaciones en este órgano tales como el areae centrales y una córnea delgada lo que muestra las necesidades visuales de este organismo que le permitan tener mejor sensibilidad y resolución visual para adaptarse al hábitat (Tovar et al. 2009).
Con relación a los hemisferios telencefálicos algunos estudios de cíclicos sugieren que el tamaño de los hemisferios telencefálicos podría estar relacionado con la habilidad de subsistir en un ambiente espacialmente estructurado, es decir ambientalmente complejo (Huber et al. 1997). Esta interpretación es consistente con los datos de aves (Riddell y Corl 1977) y mamíferos (Cluttonn-Brock y Harvey 1980, Jolicoeur et al. 1984), en el cual el volumen de los altos centros de procesamiento indica la habilidad de una especie para persistir en situaciones complejas. Sin embargo, hay que tener en cuenta que es muy poco el conocimiento que se tiene acerca de la composición social, estrategias de reproducción, territorialidad y otra serie de comportamientos que determinarían el grado de complejidad en cuanto al comportamiento y hábitats de los peces, incluyendo a P. axelrodi.
En conclusión, el cerebro de P. axelrodi está conformado por varios lóbulos conservando el patrón general descrito para otros teleósteos, sin embargo como características propias se encontró que los bulbos olfativos son sésiles, no presenta tracto olfativo, el cerebelo presentó un tamaño moderado en contraste con peces eléctricos y no se evidenció la presencia de lóbulos faciales. En el análisis morfométrico tanto en longitud como en área se encontraron diferencias altamente significativas entre las estructuras evaluadas (p < 0,001), siendo los lóbulos ópticos la región de mayor tamaño, sugiriendo una dependencia mayor del sentido de la vista, teniendo en cuenta la presencia de los núcleos tanto principales como accesorios que reciben entradas visuales; situación similar a la observada en la trucha arcoiris (Rose 2002), así como en algunas especies mesopelágicas (Wagner 2001a, b). En cuanto a la topología del cerebro de P. axelrodi aunque presenta características similares a las descritas en otros grupos de teleósteos, en algunas regiones no fue posible identificar algunos núcleos. Por ejemplo, en el área preóptica, el núcleo PM no se subdividió en los núcleos preóptico magnocelular gigantocelular (PMg) y núcleo preóptico magnocelular parvocelular (PMp). Asimismo, en el pretectum se reconocen solo dos regiones el pretectum superficial y el pretectum central. En el tálamo ventral no se identificó el núcleo rostrolateral (R) como si ocurre en Danio rerio (Wulliman et al. 1996). El núcleo preglomerular (PG) en Danio rerio presenta varias subdivisiones (PGa, PGl, PGm y PGc), sin embargo en P. axelrodi solo se identificó el núcleo preglomerular medial (PGm). De acuerdo a lo anterior, se sugiere el uso de otras metodologías más apropiadas para corroborar la presencia o ausencia de estos núcleos en P. axelrodi.
AGRADECIMIENTOS
A la Universidad Militar Nueva Granada por la financiación de este trabajo. Proyecto CIAS 549.
REFERENCIAS
Anjos HDB, Anjos CR. 2006. Biologia reprodutiva e desenvolvimento embrionário e larval do cardinal tetra, Paracheirodon axelrodi Schultz, 1956 (Characiformes: Characidae), em laboratório. Boletim do Instituto de Pesca, 32 (2): 151-160. [ Links ]
Anken R, Bourrat F. 1998. Brain Atlas of the Medaka fish Oryzias latipes. Paris (Francia): Institut National de la Recherche Agronomique (INRA). p. 29. [ Links ]
ASIH (American Society of Ichthyologists and Herpetologists, American Fisheries Society, American Institute of Fisheries Research Biologists). 1988. Guidelines for use of fishes in field research. Fisheries, 13 (2): 16-23. [ Links ]
AVMA (American Veterinary Medical Association). 2000. Report of the AVMA panel on euthanasia. JAVMA, 218 (5): 669-696. [ Links ]
Brito MFG, Bazzoli N. 2009. Oogénesis of the cardinal tetra Paracheirodon axelrodi Schultz (1956): a histological and histochemical study. Brazilian Journal of Morphological Sciences, 26 (1): 14-18. [ Links ]
Butler A. 2000. Nervous system. En: Ostrander GK, editor. The Laboratory Fish (Handbook of Experimental Animals). Part 4th California (U. S. A.): Academic Press. p. 678. [ Links ]
Butler AB, Hodos W. 1996. Comparative vertebrate neuroanatomy evolution and adaptation. New York (U. S. A.): Wiley-Liss. p. 514. [ Links ]
Butler AB, Saidel WM. 1991. Retinal projections in the freshwater butterfly fish, Pantodon buchholzi (Osteoglossoidei). I. Cytoarchitectonic analysis and primary visual pathways. Brain, Behavior and Evolution, 38 (2-3): 127-140. [ Links ]
CCAC (Canada Council on Animal Care) [Internet]. 2005. Guidelines on the care and use of fish in research, teaching and testing.Fecha de acceso: 1 de agosto de 2011. Disponible en: http://www.ccac.ca/en_/ standards/guidelines. [ Links ]
CCI (Corporación Colombiana Internacional) [Internet]. 2010. Informe de pesca y acuicultura. Sistema de Información de la Corporación Colombiana Internacional (CCI). Fecha de acceso: 25 de agosto de 2011. Disponible en:http://www.cci.org.co/cci/cci_x/datos/BoletinesIncoder/Publicaciones/Informecompleto2010.pdf . [ Links ]
Chiason R, Radke W. 1991. Laboratory anatomy of the perch. 4th ed. Boston (U. S. A.): McGraw-Hill. p. 112. [ Links ]
Clutton-Brock TH, Harvey PH. 1980. Primates, brain and ecology. Journal of Zoology, 190 (3): 309-323. [ Links ]
COPESCAL [Internet]. 2009. Pesca ornamental en América Latina: Estado, tendencias y desafíos futuros. Comisión de Pesca Continental para América Latina (COPESCAL). Fecha de acceso: 3 de mayo de 2012. Disponible en: http://www.ibcperu.org/doc/isis/11159.pdf. [ Links ]
Delfini C, Diagne M. 1985. Brain of the cod (Gadus morhua morhua, Linne 1758) (Pisces, Paracanthopterygii). Qualitative and quantitative analysis of major subdivisions. Journal für Hirnforschung, 26 (4): 439-449. [ Links ]
Durán-García E, Ocaña-Campos FM, Gómez-García AM, Broglio C, Jiménez-Moya F, Rodríguez F, Salas C. 2002. Place learning and hippocampal pallium in teleost fish. Annual Meeting of the JB Johnston Club of Comparative Neurology. Orlando (U. S. A.): JB Johnston Club. Orlando. [ Links ]
Eastmon J, Lanoo M. 1998. Morphology of the brain and sense organs in the snail fish Paraliparis devriesi: neural convergence and sensory compensation on the Antartic shelf. Journal of Morphology, 237 (3): 213-236. [ Links ]
Evans H. 1992. Anatomy, genetics and breeding, anatomy of Tropical fishes. En: Gratzek JB, Matthews JR, editores. Aquarology: The science of fish health management. Nueva York (U. S. A.): Tetra Press. p. 330. [ Links ]
Gómez-Ramírez E, Obando MJ, Tovar MO, Caldas ML, Hurtado H. 2011. Estudio histológico del tracto digestivo del neón cardenal Paracheirodon axelrodi (Characidae). International Journal of Morphology, 29 (3): 782-786. [ Links ]
Gómez Y, Vargas JP, Portavella M, López JC. 2006. Spatial learning and goldfish telencephalon NMDA receptors. Neurobiology of Learning and Memory, 85 (3): 252-262. [ Links ]
Grizzle J, Rogers W. 1976. Anatomy and histology of the channel catfish. Alabama (U. S. A.): Auburn Printing, Inc. p. 100. [ Links ]
Gridley MF. 1960. Manual of histologic and special staining techniques. 2nd ed. New York (U. S. A.): McGraw Hill Book Company, Inc. p. 207. [ Links ]
Hinton DE. 1990. Histological techniques. En: Schreck CB, Moyle PB, editores. Methods for fish biology Bethesda (U. S. A.): American Fisheries Society. p. 684. [ Links ]
Huber R, Rylander M. 1992. Quantitative histological study of the optic nerve in species of minnows (Cyprinidae, Teleostei) inhabiting clear and turbid water. Brain, Behavior and Evolution, 40: 250-255. [ Links ]
Huber R, Van Staaden M, Kaufman L, Liem K. 1997. Microhabitat use, trophic patterns, and the evolution of brain structures in African Cichlids. Brain, Behavior and Evolution, 50: 167-182. [ Links ]
ImageJ [Internet]. 2011. National Institutes of Health. Fecha de acceso: 19 de agosto de 2011. Disponible en: http://rsbweb.nih.gov/ij/download.html. [ Links ]
Ishikawa Y, Yoshimoto M, Yamamoto M, Ito H. 1999a. Different brain morphologies from different genotypes in a single teleost species, the medaka (Oryzias latipes). Brain, Behavior and Evolution, 53 (2): 74. [ Links ]
Ishikawa Y, Yoshimoto M, Ito H. 1999b. A brain atlas of a wild-type inbred strain of the medaka, Oryzias latipes. The Fish Biology Journal MEDAKA, 10: 1-26. [ Links ]
Jolicoeur P, Pirlot P, Baron G, Stephan H. 1984. Brain structure and correlation patterns in Insectivora, Chiroptera and Primates. Systematic Zoology, 33 (1): 14-29. [ Links ]
Kanwal JS, Caprio J. 1987. Central projections of the glosso fharyngeal and vagal nerves in the channel catfish, Ictalurus punctatus: clues to differential processing of visceral inputs. Journal of Comparative Neurology, 264 (2): 216-230. [ Links ]
Kotrschal K, Junger H. 1988. Patterns of brain morphology in mid-European Cyprinidae (Pisces, Teleostei): a quantitative histological study. Journal für Hirnforschung, 29 (3): 341-352. [ Links ]
Kotrschal K, Palzenberger M, 1992. Neuroecology of cyprinids: comparative, quantitative histology reveals diverse brain patterns. Environmental Biology of Fishes, 33: 135-152. [ Links ]
Kotrschal K, Van Staaden M, Huber R. 1998. Fish brain: evolution and environmental relationship. Reviews in Fish Biology and Fisheries, 8: 373-408. [ Links ]
Lee RKK, Eaton RC, Zottoli SJ. 1993. Segmental arrangement of reticule spinal neurons in the goldfish hindbrain. Journal of Comparative Neurology, 329 (4): 539-556. [ Links ]
Londoño L, Hurtado H. 2010. Estudio preliminar morfológico y morfométrico del encéfalo del pez tiburoncito Ariopsis seemanni, (Pisces: Ariidae). Universitas. Scientiarum, 15 (2): 101-109. [ Links ]
Marchetti M, Nevitt G. 2003. Effects of hatchery rearing on brain structures of rainbow trout, Oncorhynchus mykiss. Environmental Biology of Fishes, 66 (1): 9-14. [ Links ]
Mukada T, Ando M. 2003. Brain atlas of the Japanese Eel: comparison to other fishes. Memoirs of the Faculty of Integrated Arts and Sciences, Hiroshima University, 29: 1-25. [ Links ]
Murakami T, Morita Y, Ito H. 1983. Extrinsic and intrinsic fiber connections of the telencephalon in a teleost, Sebastiscus marmoratus. Journal of Comparative Neurology, 216 (2): 115-131. [ Links ]
Nortcutt RG, Butler AB. 1993. The diencephalon of the Pacific herring, Clupea harengus: retinofugal proyections to the diencephalon and optic tectum. Journal of Comparative Neurology, 328 (4): 547-561. [ Links ]
Oliveira S, Souza RTY, Nunes ES, Carvalho CSM, Menezes GC, Marcon JL, Roubach R, Ono EA, Affons EG. 2008. Tolerance to temperature, pH, ammonia and nitrite in cardinal tetra, Paracheirodon axelrodi, an Amazonian ornamental fish. Acta Amazonica, 38 (4): 773-780. [ Links ]
Portavella M, Vargas J. 2005. Emotional and spatial learning in goldfish is dependent on different telencephalic pallial systems. European Journal of Neuroscience, 21 (10): 2800-2806. [ Links ]
Prasada Rao PD, Jadhao AG, Sharma SC. 1987. Descending projection neurons to the spinal cord of the goldfish, Carassius auratus. Journal of Comparative Neurology, 265 (1): 96-108. [ Links ]
Riddell WI, Corl KG. 1977. Comparative investigation and relationship between cerebral indices and learning abilities. Brain, Behavior and Evolution, 14 (6): 385-398. [ Links ]
Ridet JM, Bauchot R. 1990. Quantitative analysis of the teleost brain: evolutionary and adaptive features of encephalization. II. Primary brain subdivisión. Journal für Hirnforschung, 31 (4): 433-458. [ Links ]
Roberts RJ. 2001. Fish pathology. 3rd ed. Toronto (U. S. A.). Elsevier Health Sciences. p. 472. [ Links ]
Saito K, Watanabe S. 2004. Spatial learning deficits after the development of dorsomedial telencephalon lesions in goldfish. Neuro Report, 15 (18): 2695-2699. [ Links ]
Saito K, Watanabe S. 2006. Deficits in acquisition of spatial learning after dorsomedial telencephalon lesions in goldfish. Behavioural Brain Research, 172 (2): 187-194. [ Links ]
Schillling TF. 2002. The morphology of larval and adult zebrafish. En: Nüsslein-Volhard C, Dahm R, editores. Zebrafish: a practical approach. New York (U. S. A.): Oxford University Press. p. 303. [ Links ]
Springer AD, Easter SS, Agranoff BW. 1977. The role of the optic tectum in various visually mediated behaviors of goldfish. Brain Research, 128 (3): 393-404. [ Links ]
Striedter GF 1991. Auditory, electro sensory, and mechano sensory lateral line pathways through the forebrain in cannel catfishes. Journal of Comparative Neurology, 312 (2): 311-331. [ Links ]
Takashima F, Hibiya T. 1995. An atlas of fish histology normal and pathological features. 2nd ed. Tokio (Japan): Kodansha Ltda. p. 213. [ Links ]
Tovar O, Obando M, Gómez E, Caldas ML, Hurtado H. Histología y morfometría del ojo del pez dulceacuícola Paracheirodon axelrodi (Characiformes: Characidae). Revista de Biología Tropical, 57 (4): 1107-1118. [ Links ]
Wagner H. 2001a. Sensory brain areas in mesopelagic fishes. Brain, Behavior and Evolution, 57: 117-133. [ Links ]
Wagner H. 2001b. Brain areas in abyssal demersal fishes. Brain, Behavior and Evolution, 57: 301-316. [ Links ]
Walker I. 2004. The food spectrum of the cardinal tetra (Paracheirodon axelrodi, Characidae) in its natural habitat. Acta Amazónica, 34 (1): 69-73. [ Links ]
Wingerd B. 1988. Dogfish dissection manual. California (U. S. A.). The Johns Hopkins University Press. p. 72. [ Links ]
Wullimann M. 1998. The central nervous system. En: Evans DDH, Claiborne JB, editores. The physiology of fishes. Florida (U. S. A.). CRC Press. p. 516. [ Links ]
Wullimann MF, Meyer DL. 1993. Possible multiple evolution of indirect telencephalo-cerebellar pathways in teleosts: studies in Carassius auratus and Pantodon buchholzi. Cell and Tissue Research, 274 (3): 447-455. [ Links ]
Wullimann M, Rupp B, Relchert H. 1996. Neuroanatomy of the Zebrafish Brain: a topological atlas. Basilea (Suiza). Birkhauser Verlag. p.144. [ Links ]
Zar JH. 1999. Biostatistical analysis. 4th ed. New Jersey, (U. S. A.): Prentice-Hall. p. 929. [ Links ]