Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.35 no.98 Medellín Jan./June 2013
ARTÍCULOS DE INVESTIGACIÓN
TOXICIDAD AGUDA DE CLORURO DE MERCURIO (HGCL2) EN CACHAMA BLANCA, Piaractus brachypomus (CUVIER, 1818)
ACUTE TOXICITY OF MERCURY CHLORIDE (HGCL2) TO CACHAMA BLANCA, Piaractus brachypomus (CUVIER, 1818)
Juan S. Naranjo-Gómez1,2,4; Luisa F. Vargas-Rojas1,3,5; Iang S. Rondón-Barragán1,3,6
1 Grupo de Investigación en Inmunología y Fisiopatología Animal (IFA).
2 Programa de Biología, Facultad de Ciencias, Universidad del Tolima. Ibagué (Tolima), Colombia.
3 Grupo de Investigación en Enfermedades Neurodegenerativas, Departamento de Sanidad Animal, Facultad de Medicina Veterinaria y Zootecnia, Universidad del Tolima. Ibagué (Tolima), Colombia.
Correos electrónicos: 4 sebasnaranjo08@gmail.com; 5 luisafernanda3000@hotmail.com; 6 isrondon@ut.edu.co.
Recibido: octubre de 2012; aceptado: marzo de 2013.
Resumen
La disposición inapropiada de sustancias que contienen mercurio puede causar toxicidad y acumulación en tejidos de peces. En el presente estudio se registra la concentración letal cincuenta (CL50) a 96 horas del mercurio para la cachama blanca [Piaractus brachypomus (Cuvier, 1818)]. Se calculó a través de una prueba semiestática de toxicidad aguda utilizando cloruro de mercurio (HgCl2) como fuente del metal. El experimento fue realizado en el Laboratorio de Toxicología de la Universidad del Tolima (Colombia), en condiciones controladas (28,09 ± 1,86 °C) y un fotoperiodo 12:12 (luz:oscuridad). Los alevinos (6,55 ± 1,3 g) fueron mantenidos en acuarios de vidrio con aireación constante, sin filtro y la alimentación fue suprimida 24 horas antes del inicio del experimento. Se emplearon 4 concentraciones de mercurio (Hg), con su respectiva replica, incluyendo un grupo control. Las concentraciones fueron: 0,45, 0,55, 0,65 y 0,75 mg Hg/l. Se realizó un análisis histopatológico con dos peces de cada tratamiento tomando muestras de branquias, cerebro y hígado. Los especímenes expuestos a las concentraciones más bajas (0,45 y 0,55 mg Hg/l) mostraron hiperactividad, a diferencia de los de las concentraciones más altas (0,65 y 0,75 mg Hg/l) los cuales evidenciaron disminución de su actividad. El análisis histopatológico mostró anomalías en branquias e hígado, como hiperplasia interlamelar y vaculizaciones lipídicas respectivamente, en respuesta a procesos de detoxificación. El valor de la CL50-96 h fue estimado utilizando el programa TSK (Trimmed-Spearman-Karber) y presentó un valor de 0,56 mg Hg/l. Este valor es cercano a lo registrado en otras especies de peces y representa el primer registro de toxicidad aguda para el mercurio en cachama blanca.
Palabras clave: cloruro de mercurio, mercurio, toxicología acuática, Piaractus brachypomus.
Abstract
The improper disposal of mercury-containing substances may cause toxicity and accumulate in fish tissues. In this study, the median lethal concentration (LC50) of mercury exposure at 96 hours in cachama blanca [Piaractus brachypomus (Cuvier, 1818)] was estimated through a semi-static acute toxicity test by using mercury chloride (HgCl2) as a metal source. The experiment was carried out in the toxicology laboratory of the University of Tolima (Colombia), under controlled conditions (28.09 ± 1.86 °C) and a 12:12 (light:darkness) photoperiod. The cachama blanca fingerlings (6.55 ± 1.3 g) were housed in glass aquaria with constant aeration without filter and feeding was suppressed 24 hours before beginning the experiment. Four cencnetrations of mercury (Hg) were used with replicas including controls. The concentrations were: 0.45, 0.55, 0.65, and 0.75 mg Hg/l. Histopathological analyses were conducted on 2 fish per treatment group on samples of liver, brain and gills tissues. Fish exposed to the lowest concentrations (0.45-0.55 mg Hg/l) of HgCl2 showed hyperactivity, whereas fish exposed to high concentrations (0.65-0.75 mg Hg/l) showed decreased activity. Histopathological analysis showed gills and liver lesions, like a lamellar hyperplasia and lipid vacuolization, respectively, in response to detoxification processes. The value of LC50-96 h was estimated by using the TSK software (Trimmed-Spearman-Karber) and produced a value of 0.56 mg Hg/l. This value is close to those reported for other fish species and represents the first report of acute toxicity to the mercury in cachama blanca.
Key words: aquatic toxicology, mercury, mercury chloride, Piaractus brachypomus.
INTRODUCCIÓN
El ambiente acuático está normalmente expuesto a una gran cantidad de tóxicos, consecuencia de intervenciones antropogénicas incluyendo la contaminación por residuos industriales (Acherman 2007), fumigación con herbicidas organofosforados como glifosato (Ramírez-Duarte et al. 2008, 2009) y contaminación con metales pesados como el mercurio (Marrugo-Negrete et al. 2008, Zhu et al. 2012).
Colombia, un país con gran diversidad de especies nativas acuáticas, se ha visto afectada por el uso creciente e indiscriminado de xenobióticos en prácticas de tipo minero (Marrugo-Negrete et al. 2008) e industrial (Ramírez-Duarte et al. 2009). El mercurio (Hg) es un metal utilizado ampliamente en procesos industriales de fabricación de electrodomésticos, fármacos, cremas entre otros (Geier et al. 2008), así como empleado en la minería artesanal para la extracción del oro, para amalgamar el mismo, proceso que ha ido en aumento en Latinoamérica durante las pasadas 3 décadas (Appleton et al. 2001). Además, posee gran estabilidad química disminuyendo su biodegradación, y metabolización de este por los seres vivos, generando así una contaminación por bioacumulación en el medio y en los organismos circundantes (Mancera-Rodríguez y Álvarez-León 2006).
El efecto tóxico de este metal ya ha sido registrado en diversos organismos como bivalvos (Sheir et al. 2010), peces (Hirt y Domitrovic 2002, Ishikawa et al. 2007), anfibios (Muñoz y Palacio 2010), reptiles (Day et al. 2007), mamíferos (Das et al. 2008, Pelissó et al. 2008), así como en seres humanos (Fillion et al. 2006, Kempuraj et al. 2010, Lebel et al. 1996, Schober et al. 2003). Consecuentemente, la acuicultura es vulnerable a la contaminación de este polutante, debido al uso del recurso hídrico y su posible contaminación con este metal.
La cachama blanca [Piaractus brachypomus (Cuvier, 1818)] como modelo experimental, es una especie nativa que habita las cuencas de los ríos Amazonas y Orinoco, y actualmente, expuestas a condiciones de contaminación que pueden repercutir en la capacidad de esta y otras especies de responder frente a los desafíos del medio (Ramírez-Duarte et al. 2009, Alvarez et al. 2012).
El objetivo del presente estudio fue determinar la toxicidad aguda del cloruro de mercurio y sus efectos histopatológicos a nivel branquial, cerebral y hepático en la cachama blanca (Piaractus brachypomus), un carácido nativo de Colombia endémico de las cuencas hidrográficas cis-andinas del país y del cual se conocen aspectos relacionados con su biología y respuesta como modelo experimental (Ramírez- Duarte et al. 2009).
MATERIALES Y METODOS
Peces. Para este estudio se usaron alevinos de cachama blanca [Piaractus brachypomus (Cuvier, 1818)] (n = 56), clínicamente sanos, con un peso aproximado de 6,55 ± 1,3 g, provenientes de un mismo desove, obtenidos de una instalación comercial de acuicultura.
Condiciones experimentales. El ensayo de toxicidad aguda fue realizado en el Laboratorio de Toxicología de la Universidad del Tolima, Ibagué (Tolima), Colombia. Se establecieron condiciones controladas como temperatura (28,09 ± 1,86 °C), un fotoperiodo 12:12 (luz:oscuridad) y aireación constante sin filtro. El periodo de aclimatación fue de 15 días en acuarios con capacidad de 80 litros. Durante este periodo los peces fueron alimentados con concentrado comercial (Solla®, 34% proteína), una ración del 2% de la biomasa total dividida en tres momentos en el día. Siguiendo los lineamientos de la OECD (1992), se suprimió la alimentación 24 h antes del inicio del experimento y durante el mismo; teniendo en cuenta además una densidad no mayor a 1 g/l. Al iniciar la aclimatación, los animales fueron tratados con cloruro de sodio (NaCl) al 0,2% con el fin de eliminar ectoparásitos según lo descrito por Floyd (1995).
Sustancia experimental. El producto químico usado para este experimento fue cloruro de mercurio (II) (HgCl2) con una pureza del 99% donado por el Departamento de Química de la Universidad de los Andes (Bogotá, Colombia). Se preparó la solución stock hasta llegar a una concentración final de 370 mg Hg/l, obtenida al disolver 0,506 g de HgCl2 en 1 litro de agua deionizada (Ishikawa et al. 2007).
Prueba de toxicidad aguda. Fueron utilizadas 4 concentraciones, preparadas al disolver la solución stock en los tanques a diferentes volúmenes hasta obtener unas concentraciones de: 0,45, 0,55, 0,65 y 0,75 mg Hg/l (para la determinación de estas concentraciones se realizaron ensayos preliminares siguiendo los lineamientos de APHA (1998) en los cuales se usaron concentraciones de 0,25, 0,5, 0,75 y 1 mg Hg/l para el primer ensayo preliminar, y 0,15, 0,25, 0,35 y 0,45 mg Hg/l para el segundo ensayo, dando como resultado una aproximación de la concentración letal cincuenta (CL50) entre las concentraciones 0,5 y 0,7 mg Hg/l), además se usó un grupo control sin exposición para este estudio. Las concentraciones se realizaron por duplicado usando 7 individuos por cada réplica de los tratamientos. Además, se empleó una prueba semi-estática, renovando el 25% del volumen de agua total del acuario y la adición de la cantidad necesaria de la solución stock para restituir la concentración inicial para cada tratamiento (APHA 1998). La mortalidad de alevinos fue registrada a las 24, 48, 72 y 96 horas de exposición; los individuos experimentales fueron considerados como muertos al evidenciar ausencia de movimientos operculares por periodo mayor a un minuto, ausencia de respuesta a la presión del pedúnculo caudal y no reacción al reflejo de huida; los organismos muertos fueron removidos de las unidades experimentales.
Análisis histopatológico. Dos peces sobrevivientes de cada acuario (seleccionados al azar) pasadas las 96 horas fueron insensibilizados mediante sección de la médula espinal, dorsal a los opérculos. Además de estos dos ejemplares, a todos los peces muertos durante la fase experimental se les realizó la necropsia siguiendo el protocolo descrito por Yanong (2003). Para histopatología se tomaron muestras de cerebro, hígado y, para branquias se tomó el segundo arco branquial izquierdo. Las muestras se fijaron en formaldehído tamponado al 3,7% para el procesamiento histológico, embebidas en parafina, realizando cortes de 4-5 μm de grosor y tinción con hematoxilina-eosina tradicional. La evaluación histopatológica se realizó en un microscopio óptico Motic, con el fin de verificar daños en tejidos indicativos de toxicidad como lo son el cerebro, hígado y las branquias, teniendo en cuenta las concentraciones de exposición; la captura de las imágenes se realizó mediante cámara y el software Motic Images Plus, versión 2.0.
Análisis estadístico. El análisis estadístico de la CL50-96 h se realizó con el programa Trimmed- Spearman Karber (TSK) versión 4.1 con una confiabilidad del 95%, analizando la mortalidad acumulada a 96 horas, basado en el algoritmo descrito por Hamilton et al. (1977). La gráfica de mortalidad acumulada fue realizada basada en la mortalidad en cada concentración posterior a las 96 horas de exposición mediante el uso del programa SPSS Statistics versión 20 para Windows (IBM, U. S. A.).
RESULTADOS Y DISCUSIÓN
Los signos clínicos presentados por la cachama blanca expuesta a mercurio fueron observados posterior a las 24 horas. En las concentraciones más altas (0,65 y 0,75 mg Hg/l) se presentó hiperactividad inicial, posterior a esto los individuos se situaron en el tercio superior del acuario, con una disminución progresiva de la frecuencia opercular y posterior muerte. Por otro lado, en las concentraciones más bajas (0,45 y 0,55 mg Hg/l) se encontró disminución de su actividad; en ocasiones se presentaba nado rápido explosivo. Una característica común en las 3 concentraciones más altas era la presencia de una mayor secreción de moco. Esta secreción de moco puede deberse al posible efecto irritante del mercurio, siendo el moco una respuesta adaptativa para la protección mecánica de la superficie del pez. Esta respuesta ha sido descrita en la exposición a otros contaminantes, así como parásitos y bacterias, sin embargo, el incremento o disminución también depende de cambios en la calidad del agua: amonio disuelto, alcalinidad (Balasubramanian et al. 2012, Esteban 2012, Ferguson 2006) los cuales no se presentaron en el presente estudio.
Estos hallazgos son similares a los registrados por varios autores en otras especies como se observa en la tabla 1, mostrando así que el mercurio a distintas concentraciones tiene efectos similares siendo más representativos en algunas especies que en otras.
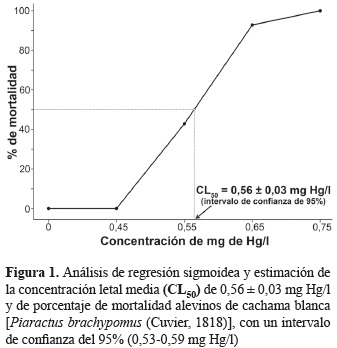
La mortalidad acumulada en porcentaje (figura 1) y el número de individuos a las 96 horas de exposición se registra en la tabla 2. En donde se observa la mortalidad pasadas las 24, 48, 72 y 96 horas con un porcentaje acumulado de 0, 42,85, 92,85 y 100% en las concentraciones 0,45, 0,55, 0,65, 0,75 mg Hg/l, respectivamente.
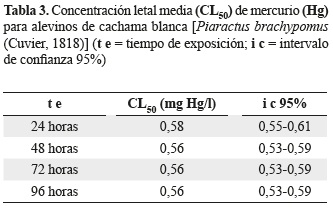
El valor de la CL50 hallado para P. brachypomus en el presente estudio se muestra en la tabla 3, en la cual se registran los valores de: 0,58, 0,56, 0,56 y 0,56 de CL50 para las 24, 48, 72 y 96 horas de exposición, respectivamente con un intervalo de confianza del 95%.
Esta CL50 es cercana a la encontrada por Ramamurthi et al. (1982) en Oreochromis mossambicus en donde se registra una CL50- 96 h de 0,739 mg Hg/l. Además, otros estudios registran concentraciones aún más cercanas como lo son Hirt y Domitrovic (2002) en Cichlasoma dimerus con un valor de CL50- 96 h de 0,488 mg Hg/l. En comparación con otras especies más tolerantes al contaminante como lo registra Charuwan-Somsiri (1982) en Oreochromis niloticus CL50-96 h de 3,710 mg Hg/l y otras menos tolerantes Buhl (1997) en Xyrauchen taxanus CL50-96 h de 0,090 mg Hg/l.
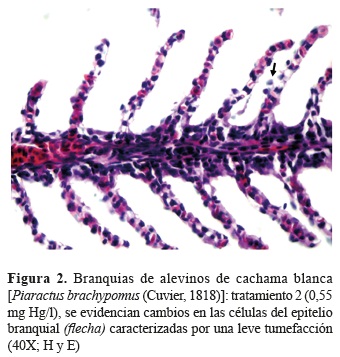
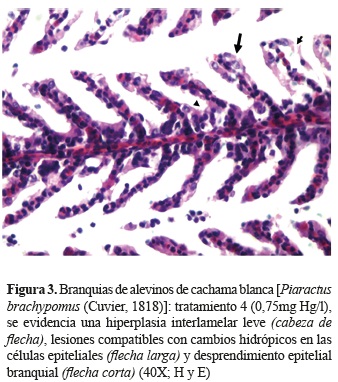
Histopatología. Mediante el análisis histopatológico se evidenciaron lesiones en branquias e hígado, el cerebro no evidenció lesiones en ninguna de las concentraciones evaluadas. En las branquias se observaron lesiones compatibles con cambios hidrópicos en células epiteliales así como hiperplasia interlamelar leve, en las concentraciones más altas (figuras 2 y 3). Se evidenció, además, desprendimiento de las células epiteliales y aneurismas infrecuentes. Las lesiones evidenciadas tales como hiperplasia interlamelar, aneurismas, cambios hidrópicos, desprendimiento de células epiteliales y gotas hialinas citoplasmáticas, tuvieron un comportamiento de severidad dependiente de la concentración, siendo menor en concentraciones bajas y mayor en concentraciones altas.
La ruptura del epitelio branquial puede darse como resultado a la exposición de un compuesto irritante (Ramírez-Duarte et al. 2008). Por otro lado se ha registrado que la hiperplasia de células mucosas en el espacio interlamelar se da como respuesta al reducir la difusión de xenobióticos a través del epitelio branquial, ya que podría provocar un desbalance electrolítico debido a la gran permeabilidad de las branquias (Lin y Randall 1995), esto es similar a lo informado por Sheir et al. (2010) en el bivalvo Mytilus edulis. Por otro lado, se ha registrado que el mercurio puede inducir cambios en el tamaño celular al interactuar con los radicales tiol de las membranas celulares, alterando su permeabilidad sin comprometer la viabilidad celular (Aduayom et al. 2005).
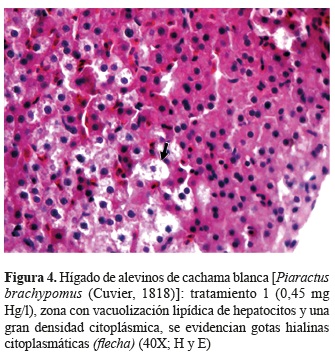
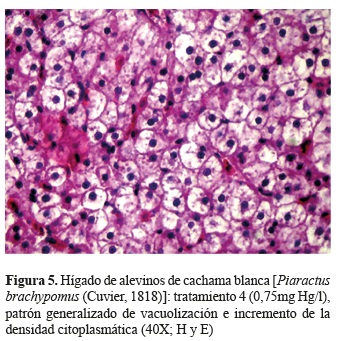
En el hígado, las concentraciones más bajas (tratamientos 1 y 2) evidenciaron distribución multifocal de zonas de vacuolización lipídica (algunos periportales), caracterizadas por gotas hialinas citoplasmáticas (figuras 4 y 5). En los tratamientos de mayor concentración este patrón de vacuolización fue generalizado y de mayor severidad.
En los hepatocitos éstas gotas hialinas pueden representar acumulaciones proteínicas debido a alteraciones en la síntesis y metabolismo de proteínas (Jiraungkoorskul et al. 2003, Papadimitriou et al. 2000) debido a fallas en los procesos de transcripción, los cuales pueden estar relacionados a cambios lipídicos y alteraciones en la síntesis de lipoproteínas necesarias para la liberación y transporte de lípidos de los hepatocitos (Jones et al. 1997). Por otro lado, se ha descrito que los cambios lipídicos puede ser una estrategia para evitar la biodisponibilidad del xenobiótico (Cooley et al. 2000, Sarkar et al. 2005).
El dato obtenido en este estudio demuestra que la especie P. brachypomus muestra sensibilidad frente a este polutante en comparación con otras especies ya registradas y sirve como bioindicador de toxicidad por contaminación por Hg (Zelikoff et al. 2000) Además, asociado a las prácticas industriales así como a la minería, el mercurio puede representar un alto riesgo para el medio ambiente debido a su alta toxicidad, reflejando así una posible causa de injuria o factor nocivo para las poblaciones de peces y otros animales de vida acuática (Aduayom et al. 2005, Das et al. 2008, Day et al. 2007, Monteiro et al. 2010, Pellissó et al. 2008, Sheir et al. 2010), además de perjudicar a comunidades adyacentes que tengan como fuente de alimento y de ingresos la actividad piscícola (Dorea et al. 1998, Fillion et al. 2006, Kempuraj et al. 2010, Schober et al. 2003, Schwenk et al. 2009,).
AGRADECIMIENTOS
Los autores agradecen a la Oficina de Investigación de la Universidad del Tolima, por la financiación del Proyecto: Efecto del cloruro de mercurio (HgCl2) en la respuesta inmune innata (fagocitosis y explosión respiratoria) en cachama blanca (Piaractus brachypomus) Código: 250212. Igualmente, agradecen al Laboratorio de Toxicología de la Universidad del Tolima y a su director Ángel Céspedes así como al Departamento de Química de la Universidad de los Andes (Bogotá, Colombia) y a su director Wolfram Baumann.
REFERENCIAS
Acherman J. 2007. Análisis del estado de alteración y contaminación del humedal Jaboque Bogotá (Colombia) [Tesis de pregrado]. [Bogotá (Colombia)]: Pontificia Universidad Javeriana de Bogotá. p. 110. [ Links ]
Aduayom I, Denizeau F, Jumarie C. 2005. Multiple effects of mercury on cell volume regulation, plasma membrane permeability, and thiol content in the human intestinal cell line Caco-2. Cell Biology and Toxicology, 21 (3- 4): 163-179. [ Links ]
Alvarez S, Jessick AM, Palacio JA, Kolok AS. 2012. Methylmercury concentrations in six fish species from two Colombian rivers. Bulletin of Environmental Contamination and Toxicology, 88 (1): 65-68. [ Links ]
APHA. 1998. Toxicity. En: APHA, AWW A, WPCF, editores. Standard methods for the examination of water and wastewater. 20th edition. Washington D. C. (U. S. A.): American Public Health Association (APHA), American Water Works Association (AWWA) & Water Environment Federation (WEF). p. 140-150. [ Links ]
Appleton J, Williams T, Orbea H, Carrasco M. 2001. Fluvial contamination associated with artisanal gold mining in the Ponce Enríquez, Protovelo-Zaruma and Nambija areas, Ecuador. Water, Air and Soil Pollution, 131 (1-4): 19-39. [ Links ]
Balasubramanian S, Baby RP, Arul PA, Prakash M, Senthilraja P, Gunasekaran G. 2012. Antimicrobial properties of skin mucus from four freshwater cultivable fishes (Catla catla, Hypophthalmichthys molitrix, Labeo rohita and Ctenopharyngodon idella). African Journal of Microbiology Research, 6 (24): 5110-5120. [ Links ]
Buhl KJ. 1997. Relative sensitivity of three endangered fishes, Colorado squawfish, bonytail, and razorback sucker, to selected metal pollutants. Ecotoxicology Environmental and Safety, 37 (2): 186-192. [ Links ]
Charuwan-Somsiri L. 1982. Acute toxicity of mercury, copper and zinc to the Nile tilapia (Tilapia nilotica, Linnaeus, 1757). Thai Fish Gazette, 35 (3): 313-318. [ Links ]
Cooley HM, Evans RE, Klaverkamp JF. 2000. Toxicology of dietary uranium in lake white fish (Coregonus clupeaformis). Aquatic Toxicology, 48 (4): 495-515. [ Links ]
Das K, Siebert U, Gillet A, Dupont A, Di-Poï C, Fonfara S, Mazzucchelli G, De Pauw E, and De Pauw-Gillet M-C. 2008. Mercury immune toxicity in harbour seals: links to in vitro toxicity. Environmental Health, 7 (52): 1-17. [ Links ]
Day RD, Segars AIL, Arendt MD, Lee AM, Peden-Adams MM. 2007. Relationship of blood mercury levels to health parameters in the loggerhead sea turtle (Caretta caretta). Environmental Health Perspectives, 115 (10): 1421-1428. [ Links ]
Dorea JG, Moreira BM, East G, Barbosa AC. 1998. Selenium and mercury concentrations in some fish species of the Madeira River, Amazon Basin, Brazil. Biological Trace Element Research, 65: 211-220. [ Links ]
Esteban MA. 2012. An overview of the immunological defenses in fish skin. ISRN Immunology (International Scholarly Research Network Immunology), 2012: 1-29. [ Links ]
Ferguson HW. 2006. Systemic pathology of fish. 2th ed. London: Scotian Press. p. 366. [ Links ]
Fillion M, Mergler D, Passos CJS, Larribe F, Lemire M, Guimarães JRD. 2006. A preliminary study of mercury exposure and blood pressure in the Brazilian amazon. Environmental Health, 5: 29. [ Links ]
Francis-Floyd R. 1995. The use of salt in aquaculture. Florida: University of Florida. Fact Sheet VM 86. Fecha de acceso: 07 de mayo de 2013. Disponible en: http://edis.ifas.ufl.edu/pdffiles/VM/VM00700.pdf. [ Links ]
Geier DA, King PG, Sykes LK, Geier MR. 2008. A comprehensive review of mercury provoked autism. The Indian Journal of Medical Research, 128 (4): 383-411. [ Links ]
Hamilton MA, Russo RC, Thurston RV. 1977. Trimmed Spearman-Karber method for estimating median lethal concentrations in toxicity bioassays. Environmental Science & Technology, 11 (7): 714-719. [ Links ]
Hirt LM, Domitrovic HA. 2002. Toxicidad y respuesta histopatológica en Cichlasoma dimerus (Pisces, Cichlidae) expuestos a bicloruro de mercurio en ensayos agudos y subletales. Revista Ictiología, 10 (1/2): 37-52. [ Links ]
Ishikawa NM, Tavares MJ, Lombardi JV. 2007. Acute toxicity of mercury (HgCl2) to Nile tilapia, Oreochromis niloticus. Boletim do Instituto de Pesca, 33 (1): 99-104. [ Links ]
Jiraungkoorskul W, Upatham ES, Kruatrachue M, Sahaphong S, Vichasri-Grams S, Pokethitiyook P. 2003. Biochemical and histopathological effects of glyphosate herbicide on Nile tilapia (Oreochromis niloticus). Environmental Toxicology, 18 (4): 260-267. [ Links ]
Jones T, Hunt R, King N. 1997. Veterinary pathology. 6th edition. New York: Lippincott Williams and Wilkins. p. 1392. [ Links ]
Kempuraj D, Asadi S, Zhang B, Manola A, Hogan J, Peterson E, Theoharides TC. 2010. Mercury induces inflammatory mediator release from human mast cells. Journal of Neuroinflammation, 7: 20. [ Links ]
Lebel J, Mergler D, Lucotte M. 1996. Evidence of early nervous systems dysfunction in amazonian populations exposed to low-levels of methylmercury. Neurotoxicology, 17 (1): 157-167. [ Links ]
Lin H, Randall D. 1995. Proton pumps in fish gills. En: Wood C, Shuttleworth T, editores. Cellular and molecular approaches to fish ionic regulation, 14. San Diego (CA, U. S. A.): Academic Press (Elsevier). p. 229-255. [ Links ]
Mancera-Rodríguez NJ, Álvarez-León R. 2006. Estado del conocimiento de las concentraciones de mercurio y otros metales pesados en peces dulceacuícolas de Colombia. Acta Biológica Colombiana, 11 (1): 3-23. [ Links ]
Marrugo-Negrete J, Benítez LN, Olivero-Verbel J. 2008. Distribution of mercury in several environmental compartments in an aquatic ecosystem impacted by gold mining in northern Colombia. Archives of Environmental Contamination and Toxicology, 55 (2): 305-316. [ Links ]
Monteiro DA, Rantin FT, Kalinin AL. 2010. Inorganic mercury exposure: toxicological effects, oxidative stress biomarkers and bioaccumulation in the tropical freshwater fish matrinxã, Brycon amazonicus (Spix and Agassiz, 1829). Ecotoxicology, 19 (1): 105-123. [ Links ]
Muñoz-Escobar EM, Palacio-Baena JA. 2010. Efectos del cloruro de mercurio (HgCl2) sobre la sobrevivencia y crecimiento de renacuajos de Dendrosophus bogerti. Actualidades Biológicas, 32 (93): 189-197. [ Links ]
OECD. 1992. Test N.o 203: Fish, Acute Toxicity Test. Paris: OECD Publishing. p. 1-9. [ Links ]
Papadimitriou JC, Drachenberg CB, Brenner DS, Newkirk C, Trump BF, Silverberg SG. 2000. ''Thanatosomes'': A unifying morphogenetic concept for tumor hyaline globules related to apoptosis. Human Pathology, 31 (12): 1455-1465. [ Links ]
Pellissó SC, Muñoz MJ, Carballo M, Sánchez-Vizcaíno JM. 2008. Determination of the immunotoxic potential of heavy metals on the functional activity of bottlenose dolphin leukocytes in vitro. Veterinary Immunology and Immunopathology, 121 (3-4): 189-198. [ Links ]
Ramamurthi R, Naidu KA, Subbiah MB, Balaji N, Rao MVR. 1982. Toxicity of mercury to some freshwater organisms. Geobios (Jodhpur Journal), 9: 89-90. [ Links ]
Ramírez-Duarte WF, Rondón-Barragán IS, Eslava-Mocha PR. 2008. Acute toxicity and histopathological alterations of Roundup® herbicide on ''Cachama blanca'' (Piaractus brachypomus). Pesquisa Veterinária Brasileira, 28 (11): 547-554. [ Links ]
Ramírez-Duarte W, Rondón-Barragán I, Vidal H, Eslava-Mocha P. 2009. Toxicidad aguda y lesiones histopatológica en cachama blanca (Piaractus brachypomus) expuestas a la muestra de herbicida Roundup® más el surfactante Cosmoflux® 411F. Revista MVZ Córdoba, 14 (1): 1563-1575. [ Links ]
Sarkar B, Chatterjee A, Adhikari S, Ayyappan S. 2005. Carbofuran and cypermethrin-induced histopathological alterations in the liver of Labeo rohita (Hamilton) and its recovery. Journal of Applied Ichthyology, 21 (2): 131-135. [ Links ]
Schober SE, Sinks TH, Jones RL, Bolger PM, McDowell M, Osterloh J, Garrett ES, Canady RA, Dillon CF, Sun Y, Joseph CB, Mahaffey KR. 2003. Blood mercury levels in US children and women of childbearing age, 1999-2000. The Journal of the American Medical Association, 289 (13): 1667-1674. [ Links ]
Schwenk M, Klein R, Templeton DM. 2009. Immunological effects of mercury (IUPAC Technical report). International Union of Pure and Applied Chemistry, 81 (1): 153-167. [ Links ]
Sheir SK, Handy RD, Galloway TS. 2010. Tissue injury and cellular immune responses to mercuric chloride exposure in the common mussel Mytilus edulis: modulation by lipopolysaccharide. Ecotoxicology and Environmental Safety, 73 (6): 1338-1344. [ Links ]
Yanong RPE. 2003. Necropsy techniques for fish. En: Echols S, editor. Practical gross necropsy of exotic animal species. Seminars in avian and exotic pet medicine. Philadelphia (U. S. A.): W. B. Saunders Co. p. 89-105. [ Links ]
Zelikoff JT, Raymond A, Carlson E, Li Y, Beaman JR, Anderson M. 2000. Biomarkers of immunotoxicity in fish: from the lab to the ocean. Toxicology Letters, 112-113: 325-331. [ Links ]
Zhu L, Yan B, Wang L, Pan X. 2012. Mercury concentration in the muscle of seven fish species from Chagan Lake, Northeast China. Environmental Monitoring and Assessment, 184 (3): 1299-1310. [ Links ]