Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.35 no.99 Medellín July/Dec. 2013
ARTÍCULOS DE INVESTIGACIÓN
PRINCIPALES AMENAZAS A LA BIODIVERSIDAD MARINA
MAIN THREATS TO MARINE BIODIVERSITY
José E. Mancera-Pineda1,2; Brigitte Gavio1,2; Jairo Lasso-Zapata2
1 Universidad Nacional de Colombia, Sede Caribe. N.° 52-44, San Andrés isla, San Luis Free Town, Colombia.
2 Universidad Nacional de Colombia, Facultad de Ciencias, Departamento de Biología, sede Bogotá. Colombia.
Correos electrónicos: jemancerap@unal.edu.co; bgavio@unal.edu.co; jlassoz@unal.edu.co.
Recibido: enero 2013; aceptado: octubre 2013.
Resumen
Evaluaciones recientes sobre el conocimiento de la biodiversidad registran que las especies marinas corresponden apenas a un 15% del total de los taxones conocidos en el planeta. La falta de conocimiento de la diversidad marina se suma a una acelerada tasa de pérdida de la misma, debido esencialmente a causas antropogénicas. El objetivo de este trabajo es presentar una revisión de las principales amenazas de origen humano a la biodiversidad marina, tales como sobrepesca, descarga de nutrientes, derrames de petróleo, destrucción de hábitat, bioinvasiones, florecimientos algales nocivos y cambios globales. Cada una de estas amenazas pone en riesgo una o varias especies, y a largo plazo, modifica hábitats y ecosistemas completos, causando una pérdida de biodiversidad, muchas veces difícil de evaluar. Mientras en los ecosistemas terrestres el principal factor de riesgo es la destrucción de hábitat, en ambientes marinos la sobreexplotación de recursos es la causa principal de pérdida de biodiversidad. La percepción que los ecosistemas marinos son más resilientes a los disturbios que los ecosistemas terrestres necesita ser reevaluada, ya que probablemente no corresponde a la realidad.
Palabras clave: algas nocivas, bioinvasiones, derrames de petróleo, destrucción de hábitat, nutrientes, sobreexplotación de recursos.
Abstract
Recent evaluations of the knowledge of biodiversity report that marine species account for only 15% of the total known taxa. The lack of knowledge on marine diversity is coupled by an accelerating rate of diversity loss, due mainly to human factors. The purpose of this review is to present a summary of the main anthropogenic threats to marine biodiversity, such as resource overexploitation, nutrient loads, oil spills, habitat destruction, invasive species, harmful algal blooms, and global climate change. These threats may act together, and their impact on marine ecosystems is still largely overlooked and not completely understood.
Key words: harmful algal blooms, invasive species, oil spills, habitat destruction, nutrient loads, overexploitation.
INTRODUCCIÓN
La biodiversidad juega un papel fundamental en el mantenimiento de la vida en el planeta y el bienestar del ser humano, ya que está ligada a diferentes funciones, procesos y propiedades, tales como producción, biomasa, transferencia, almacenamiento y reciclaje de materia, entre otros (Chapin et al. 1998, Loreau y Hector 2001, Tilman 1999). La biodiversidad marina definida como la variedad de formas de vida en el mar, involucra múltiples dimensiones, medidas y unidades (Sala y Knowlton 2006) e incluye todos los niveles de organización desde genes hasta la biosfera, pasando por especies, poblaciones, comunidades y ecosistemas (Sala y Knowlton 2006, Swingland 2001). Dado que la biodiversidad suministra protección, alimento, materiales y medicinas, es un elemento clave para el desarrollo social, intelectual y espiritual de las sociedades (Patrick 1997).
Hasta hace poco tiempo, la atención sobre biodiversidad se centraba en los bosques lluviosos, debido al constante descubrimiento de nuevas especies, a los usos potenciales de su diversidad genética y su gradual desaparición por acciones antrópicas (Reaka-Kudla 1997). Sin embargo, en los últimos veinte años el interés por la biodiversidad marina ha recibido mayor atención.
Si bien entre los científicos no hay consenso sobre la estimación de la biodiversidad en general, se reconoce no sólo que es esencial para la sobrevivencia de la especie humana, sino que está en serio peligro, debido a múltiples actividades humanas. Algunos autores consideran que existen entre 10 y 100 millones de especies en el planeta (Lovejoy 1997), otros calculan cifras que oscilan entre 5 y 15 millones (Dirzo y Ravan 2003) o 1,2 a 120 millones (Reaka-Kudla 1997). Mora et al. (2011) sugieren que existen alrededor de 8,7 millones de especies eucarióticas en el planeta, de las cuales 2,2 millones son marina. Asimismo, se plantea que las 1,4 a 1,8 millones de especies descritas en todos los ambientes de la tierra corresponderían solamente a 10 o máximo 50% del total de especies existentes (Ehrlich y Wilson 1991, Lovejoy 1997), mientras Mora et al. (2011) consideran que el 86% de las especies terrestres y el 91% de las especies marinas no han sido descritas todavía. Esta situación es debida a que las estimaciones realizadas están sujetas a constantes cambios, resultado del descubriendo de nuevas especies y reorganización sistemática de las existentes, producto del incremento del esfuerzo científico, la exploración de nuevas áreas y la incorporación de nuevas tecnologías de identificación y análisis como las herramientas moleculares.
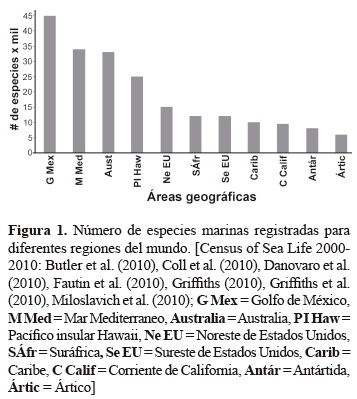
Los resultados de un reciente proyecto sobre Censo de la Vida en el Mar indican que hay unas 212.042 especies distribuidas heterogéneamente en las diferentes regiones del mundo (figura 1); estas especies pertenecen a tres dominios y cuatro reinos, con predomino del grupo de los crustáceos (Butler et al. 2010, Coll et al. 2010, Danovaro et al. 2010, Fautin et al. 2010, Griffiths 2010, Griffiths et al. 2010, Miloslavich et al. 2010). Asimismo, se sabe que los ambientes marinos tienen más altos niveles de organización taxonómica que los terrestres; el 90 % de todas las clases conocidas son marinas; de los 33 filos reconocidos de animales hay representantes marinos en 32 de esos, mientras solamente 12 filos incluyen organismos terrestres; más enfáticamente, solamente el filo Onychophora es exclusivamente terrestre, mientras 21 son únicamente marinos (May 1994). Todo esto contrasta con el hecho de que la biodiversidad marina corresponde a menos del 15% del total de especies conocidas en el planeta (May 1994), lo cual sugiere que ésta es mucho menos conocida que la biodiversidad terrestre. Esta subestimación podría deberse, entre otros aspectos, al desconocimiento que se tiene del mar, a la falta de investigadores en el área, a la carencia de taxónomos para la tarea de identificación de muchos grupos y al difícil acceso a los ecosistemas costeros y oceánicos.
Se reconoce que el medio marino contiene ecosistemas complejos y biodiversos tales como los arrecifes coralinos, praderas de pastos marinos, macroalgas, bosques de manglar, sistemas pelágicos y bentónicos, que proveen usos y servicios esenciales para gran parte de la población humana. Con base en evidencia de registros modernos y fósiles se ha sugerido que las especies marinas tienden a tener consistentemente menor tasa de extinción tanto en tiempo geológico como ecológico (McKinney 1998). Esta afirmación se ha relacionado con la capacidad amortiguadora del medio marino en el que es posible soportar mejor cualquier tipo de alteración, permitiendo que las especies marinas tiendan a ser menos propensas a los procesos de extinción que las especies terrestres (Culotta 1994). Sin embargo, factores antrópicos y naturales sobre los ecosistemas marinos y costeros están causando incremento en la tasa de disminución de especies y degradación de estos ecosistemas, que se ha reflejado en enfermedades, extinciones locales de especies, disminución de algunas poblaciones y homogeneización de comunidades. Consecuentemente se han detectado cambios funcionales a nivel ecosistémico y alteraciones en bienes y servicios provistos por ecosistemas marinos. La sobrepesca, contaminación, introducción de especies y cambios globales como el cambio climático y la acidificación de los océanos, constituyen hoy en día las principales amenazas a la biodiversidad marina.
El objetivo del presente trabajo es presentar una reseña de las principales amenazas de origen humano a los ecosistemas marinos. Estas amenazas muchas veces actúan de forma sinérgica, y aún no se conocen todos los efectos sobre los ecosistemas marinos; asimismo, sus impactos sobre la biodiversidad marina no son entendidos completamente.
SOBRE EXPLOTACIÓN DE RECURSOS
La pesca es el principal y más antiguo factor modificador de los ecosistemas marinos (Jackson et al. 2001), que genera efectos directos e indirectos sobre las cadenas tróficas de los océanos, trayendo consecuencias imprevistas a través de los ecosistemas (Crowder et al. 2008). Se estima que el 75% de los recursos pesqueros del mundo están sobreexplotados (FAO 2000). Solamente en Estados Unidos, el 33% de las pesquerías son explotadas a una tasa insostenible y próximas al agotamiento (Hilborn et al. 2003). Entre 1950 y 2000, se ha registrado el colapso de 366 pesquerías, correspondiente al 24% de las pesquerías mundiales (Mullon et al. 2005).
Gran proporción de la pesquería se ocupa de la captura de depredadores tope, los cuales son extraídos a una tasa no sostenible (Myers y Worm 2003), mientras que en otras se somete a altos niveles de explotación a los pequeños peces pelágicos como las anchovetas (Engraulidae) y sardinas (Clupeididae). En ambos casos, se crean fuertes tensiones en las redes tróficas al remover presas requeridas por peces, mamíferos y aves marinas. Algunas investigaciones estiman que el 90% de los grandes depredadores pelágicos fueron removidos a través de la pesca (Myers y Worm 2003) y aunque estos cálculos han sido criticados (Hampton et al. 2005, Walters 2003), las estimaciones más conservadoras aseguran que la reducción está entre el 50 y 70% (Hampton et al. 2005), cifras aun muy altas que reflejan el descenso a gran escala de depredadores pelágicos.
La sobreexplotación de los recursos pesqueros puede llevar a la extinción local o regional de especies (Gray 1997). De hecho, en ambientes costeros la sobreexplotación de recursos es considerada la primera causa de extinción de biodiversidad marina, pudiendo ser responsable hasta del 55% de las extinciones comunicadas (Dulvy et al. 2003). Los grupos más vulnerables a la extinción son mamíferos y peces cartilaginosos, pero también muchos peces óseos y moluscos han sido explotados local y regionalmente. Si bien, la mayoría de la extinciones se atribuye a la pesca industrial, algunas especies han sido eliminadas a nivel local o regional por actividades de pesca artesanal o de subsistencia, como por ejemplo, el loro arco iris (Scarus guacamaia, Scaridae) en áreas del mar Caribe (Dulvy et al. 2003). De 133 extinciones regionales y globales registradas, el 70% corresponde a especies de los dos niveles tróficos más altos (consumidores secundarios y depredadores) (Byrnes et al. 2007). En el libro rojo de peces marinos de Colombia (Mejia y Acero 2002), 87% de las especies listadas pertenecen a estos niveles tróficos.
El uso de redes de arrastre y dragado para la recolecta de especies bentónicas destruye el hábitat y su estructura física tridimensional, removiendo componentes biológicos (briozoos, esponjas, hidroides, pasto marino, etc.) y topográficos (depresiones o montículos de arena) (Turner et al. 1999). Además, la captura con estas técnicas resulta en grandes volúmenes de pesca de descarte, que puede llegar al 26% del total de pesca desembarcada (Hilborn et al. 2003), correspondiente a 20 millones de toneladas anuales (Flórez-Leiva et al. 2007).
Los efectos desestabilizadores de la sobrepesca afectan el ecosistema por completo, y se han hecho particularmente evidentes en los arrecifes coralinos, los ecosistemas marinos más diversos taxonómicamente y más complejos estructuralmente, hábitat de miles de especies (Jackson et al. 2001). En las últimas décadas, los arrecifes han experimentado cambios de fases en las especies dominantes debido a la intensificación de los impactos antropogénicos. La sobrepesca de grandes herbívoros en el mar Caribe, ya raros a principio del siglo XX (Duerden 1901, citado por Jackson et al. 2001), aparentemente esta no había favorecido la proliferación de las macroalgas sobre los arrecifes, debido al control ejercido por el erizo Diadema antillarum. Sin embargo, a partir de los años 80 se ha evidenciado un drástico cambio de fase a favor de las macroalgas, coincidente con la súbita mortalidad masiva de D. antillarum, el último gran herbívoro presente en el mar Caribe (Jackson et al. 2001). Similarmente, en Australia los corales han experimentado mortandades masivas periódicas desde los años 60, debido a incrementos poblacionales de la estrella de mar Acanthaster planci, que se alimenta de los pólipos. Estas explosiones poblacionales parecen ser debidas a la sobrepesca de las especies que se alimentan de los juveniles de Acanthaster, permitiendo el reclutamiento masivo del equinodermo (Dulvy et al. 2004).
DESTRUCCIÓN DE HÁBITAT
La pérdida de hábitat ha sido el factor principal en la disminución y extinción de especies terrestres, en tanto que la sobreexplotación parece ser la mayor causa de pérdida de biodiversidad en peces marinos (Munday 2004), seguido por la destrucción de hábitat como factor de pérdida de biodiversidad (Dulvy et al. 2003).
Estructuras emergentes, como formaciones rocosas, formaciones arrecifales epibénticas (arrecifes de coral, de ostras, de poliquetos, mantos de rodolitos –maërl–), vegetación (p. ej., pastos marinos, pastizales costeros, manglares, quelpos y otras macroalgas), así como otras características topográficas (conchas, madrigueras, estructuras biogénicas y depresiones) proveen heterogeneidad y complejidad estructural en ambiente marinos bentónicos (Turner et al. 1999). La estructura provista por estas formaciones constituye una característica significativa de muchos sistemas ecológicos y es crítica para el funcionamiento de todo el ecosistema. Estas estructuras representan un hábitat importante para una gran variedad de organismos, proveen refugio de depredadores y competidores, y pueden representar recursos alimenticios, hábitat de crianza y reproducción (p. ej., Perkins- Visser et al. 1996, Posey y Ambrose 1994, Turner et al. 1999). Adicionalmente, esas estructuras modifican el régimen hidrodinámico cerca del sustrato, con efectos potencialmente significativos sobre la disponibilidad de alimento, el crecimiento, el reclutamiento y la sedimentación, influenciando positivamente la sobrevivencia de las especies (Turner et al. 1999). Estas estructuras complejas son cada vez más raras en ambientes marinos templados a escala local, regional y global (Airoldi et al. 2008). Airoldi y Beck (2007) estimaron que en Europa, entre 1960 y 1995, la tasa de intervención de costas fue de un kilómetro por día, causando una pérdida entre 50 y 80% de la extensión original de pastos marinos y humedales costeros.
Los arrecifes biogénicos de aguas templadas (formaciones tridimensionales de origen animal o vegetal) están entre los hábitats marinos en mayor riesgo (Barbera et al. 2003) y gran parte de la plataforma continental y algunas áreas más profundas del fondo oceánico han sido homogeneizadas por las redes de arrastre (Thrush y Dayton 2002). Los fondos blandos, que constituyen el 70% del fondo marino (Snelgrove 1999), están en particular riesgo de degradación. Aunque su estructura tridimensional no es tan obvia como en los sustratos rocosos, estos fondos pueden ser altamente heterogéneos y soportan una gran diversidad de especies (Coleman et al. 1997, Gray et al. 1997). Gran parte de la estructura de esos hábitats es creada por los mismos organismos que viven en los sedimentos (Thrush y Dayton 2002). En los fondos blandos, la pesca con redes de arrastre es la principal causa de pérdida de hábitat; así por ejemplo, se estima que en el golfo de México cada metro cuadrado del fondo es arrastrado con redes hasta siete veces por año (Crowder et al. 2008). En Nueva Zelanda, formaciones biogénicas predominadas por briozoos constituyen una fuente importante de refugio y alimento para los juveniles de varios peces comerciales; el uso de las redes de arrastre desde los años 40 ha destruido casi completamente las formaciones de briozoos de bahía Tasmania y se ha observado, desde entonces, una disminución marcada en el número de juveniles de peces comerciales que han perdido su alimento y refugio (Turner et al. 1999).
La pérdida o destrucción de hábitat impulsa una transición desde un hábitat más complejo a uno menos estructurado, como ocurre por ejemplo cuando se pierden bosques de quelpos para ser remplazadas por praderas de algas filamentosas, en donde los hábitats originales pueden ser sustituidos enteramente por unos nuevos.
En los estudios hechos sobre destrucción de hábitat en ambientes marinos, se han identificado tres consecuencias principales: 1) pérdida de especies residentes, 2) pérdida de recursos alimenticios, y 3) pérdida de funcionalidad ecosistémica y de su capacidad de interactuar con el ambiente (Airoldi et al. 2008). La pérdida de especies residentes puede llevar a extinciones locales y globales, sobre todo, para los taxones con distribución limitada o dependientes exclusivamente de un determinado hábitat (Thrush et al. 2006).
Ecosistemas altamente estructurados, tales como praderas de pastos marinos, bosques de quelpos o arrecifes de coral, tienen generalmente una productividad primaria muy alta (p. ej., Duffy 2006, Hosack et al. 2006) que es, en parte, exportada hacia otros sistemas, por ejemplo, a través de materia orgánica disuelta o particulada (Airoldi et al. 2008). La pérdida de esos hábitats puede tener repercusiones significativas en la cadena trófica, y llevar a su simplificación (Graham 2004).
Los ecosistemas complejos interactúan y modifican el ambiente físico, modificando la sedimentación, la hidrodinámica y las condiciones lumínicas (Jones et al. 1994). La pérdida de esos ecosistemas implica, muchas veces, la pérdida de esas funciones (Hine et al. 1987, Dobson et al. 2006). Se ha demostrado que la disminución de praderas marinas en Florida ha modificado la tasa de sedimentación en el área (Hine et al. 1987), mientras la deforestación de bosques de manglar reduce la resiliencia frente a catástrofes naturales, como tsunamis o huracanes (Das y Vincent 2009, Kathiresan y Rajendran 2005, Vermaat y Thampanya 2006).
Si bien se reconocen las consecuencias de la pérdida de hábitat sobre la abundancia y riqueza de especies, la disminución de la diversidad funcional y ecológica de estos sistemas ha sido altamente subestimada. Los efectos de la simplificación y homogeneización del fondo marino sobre la funcionalidad de los ecosistemas no han sido adecuadamente estudiados.
DESCARGA DE NUTRIENTES
El deterioro de la calidad del agua es un problema global que afecta los ecosistemas costeros (Haynes y Johnson 2000). Entre los principales contaminantes que afectan el océano están: derrames de petróleo, descarga de aguas negras sin tratamiento previo, contaminantes industriales, desechos sólidos y pesticidas (Cheevaporn y Menasveta 2003, Gavio et al. 2010). El enriquecimiento de agua por nutrientes, especialmente nitrógeno y fósforo, puede producir cambios en la concentración de clorofila, turbidez del agua, producción primaria (Gavio et al. 2010) y en la composición de especies (Herbert et al. 1999), los cuales, a su vez, modifican funciones ecosistémicas como la producción primaria y el ciclo de nutrientes (Rejmánková y Komárková 2005). Los ecosistemas costeros oligotróficos tropicales y subtropicales son los más vulnerables a eventos de nutrificación. En particular, se ha hipotetizado que la descarga de nutrientes y sedimentos asociados afectan severamente los arrecifes coralinos (Cortes y Risk 1985), favoreciendo un cambio de fase coral-alga en el ecosistema a favor de las macroalgas, que tendrían una ventaja competitiva sobre los corales (McManus y Polsenberg 2004). Estudios recientes han cuestionado estos supuestos (McCook 2001), demostrando que la causa principal del cambio de fase a favor de las macroalgas, es la extracción de herbívoros; sin embargo, el exceso de nutrientes puede inhibir el éxito del asentamiento de las larvas de corales (Tomascik 1991), mientras que elevadas concentraciones de fósforo reducen la densidad de los corales y debilita el esqueleto de los mismos (Cosser 1997), haciendo la colonia más susceptible a daños por huracanes y tormentas (Rasmussen y Cuff 1990). En varias regiones del mundo la eutrofización de las aguas costeras provoca florecimiento de macroalgas verdes de los géneros Enteromorpha, Monostroma, Ulva y Ulvaria (Nelson et al. 2003), que pueden inhibir el crecimiento de pastos marinos (Nelson y Lee 2001), creando condiciones anóxicas que resultan en pérdida de abundancia y diversidad de la fauna asociada (Hauxwell et al. 2001, Nelson et al. 2003, Tagliapietra et al. 1998, Valiela et al. 1997).
Los nutrientes también estimulan el crecimiento del fitoplancton, y si este crecimiento es excesivo, su descomposición puede crear condiciones de hipoxia en el estrato inferior de agua, y las bacterias reductores de sulfato causan una acumulación de sulfito tóxico para muchos organismos aeróbicos (Gray et al. 2002, Karlson et al. 2002). Si las condiciones hipóxicas y sulfídicas persisten por más de siete días, ocurre una extensa mortandad de invertebrados bentónicos sedentarios (Diaz y Rosenberg 1995, Rabalais et al. 2001), resultando en una pérdida de alimento para peces crustáceos, demersales y aves (Bishop et al. 2006, Eby y Crowder 2002, Eby et al. 2005). Esas condiciones pueden inducir mortandad masiva de peces (Bishop et al. 2006) y reducción masiva de la vida marina en general. Estas ''zonas muertas'' ocurren principalmente en cuencas cerradas (p. ej., el mar Mediterráneo, el golfo de México, el mar Negro, el mar Báltico, etc.), en donde la mezcla vertical de agua es limitada. Desde los años 60, el número de zonas muertas se ha duplicado en cada década, así en 2008 se registraron más de 400 áreas afectadas a lo largo de las costas industrializadas del mundo (Díaz y Rosenberg 2008). Estas áreas pueden ser de dimensiones notables, como la que se encuentra en el golfo de México, de 21.000 km2, o en el Mar Negro, de 40.000 km2 (Mee 2006).
DERRAMES DE PETRÓLEO
La incidencia de derrames de petróleo resultantes de accidente con petroleras, extracción oceánica y actividades asociadas, va en aumento debido al continuo incremento en la demanda de petróleo. Cerca del 90% de la producción de petróleo ocurre en regiones tropicales, por lo tanto el potencial para derrames de petróleo en esas regiones es inmenso (Nansingh y Jurawan 1999). En los trópicos la diversidad biológica es mayor que en otras regiones, así el daño causado por esos accidentes puede ser de mayores dimensiones.
Las causas principales de contaminación por petróleo son: 1) la extracción de crudo, 2) el transporte del crudo con descarga de agua de lastre y accidentes de petroleras, y 3) accidentes relacionados con conflictos y guerras (Haapkylä et al. 2007). Anualmente, alrededor de seis millones de toneladas de crudo son vertidas a los océanos (Capone y Bauer 1992). Los hidrocarburos aromáticos policíclicos, componentes permanentes del crudo, están entre los contaminantes más peligrosos, debido a su toxicidad aguda y de largo plazo (Ramade y Roche 2006).
Los conflictos han provocado los peores derrames de petróleo conocidos. Durante la guerra entre Irán e Iraq en 1983, la destrucción de las plataformas Nowruz por parte de los Iraquies causó el vertimiento de un millón de toneladas de hidrocarburos (Haapkylä et al. 2007) en el mar. La Guerra del Golfo Pérsico ocasionó el vertimiento de casi 160 millones de toneladas de crudo en el golfo Pérsico y aguas adyacentes (Sadiq y McCain 1993).
En el golfo de Arabia, el escenario de la Guerra del Golfo Pérsico, los efectos de los derrames de petróleo han sido extraordinariamente moderados (Downing y Roberts 1993). Haapkylä et al. (2007) sugieren que en el golfo de Arabia, sujeto a contaminación de hidrocarburos por miles de años debido a escapes naturales desde los depósitos submarinos, existe ensamblajes de microorganismos adaptados a este tipo de contaminación. Las altas temperaturas aceleran la evaporación y la foto-oxidación de los compuestos del petróleo, contribuyendo a los procesos de auto purificación del ecosistema.
Entre los accidentes en tiempos de paz, la explosión de la plataforma Deepwater Horizon en el golfo de México en 2010 ha provocado el derrame de 5 millones de barriles de crudo (http://www.restorethegulf.gov/content/one-year-later-alabama), equivalente a más de 710.000 toneladas de petróleo, cuyos impactos económicos han sido estimados en 15,5 billones de dólares a lo largo de siete años, solamente considerando las pesquerías, a los cuales se añade la pérdida de 22.000 puestos de trabajo asociados (Sumaila et al. 2012); el impacto sobre los ecosistemas, en particular de profundidad, parece ser severo (White et al. 2012), aunque todavía es temprano para poder evaluar a cabalidad los daños ambientales del derrame.
La naturaleza y la duración de los efectos negativos de los derrames de petróleo sobre los ecosistemas depende de una variedad de factores, entre ellos: 1) el tipo de petróleo, 2) la cantidad de petróleo, 3) factores físicos ambientales, 4) condiciones climáticas prevalentes, 5) naturaleza del biota, 6) factores estacionales, 7) exposición previa a petróleo, 8) presencia de otros contaminantes, y 9) tipo de acción de contención del desastre (O'Brien y Dixon 1976). Las consecuencias observadas pueden manifestarse como un daño agudo o inmediato, o como efectos sub-letales a largo plazo.
Los efectos negativos de los derrames de petróleo tienden a exacerbarse a altas latitudes. El petróleo persiste más tiempo en condiciones árticas porque se evapora más lentamente, o porque puede ser atrapado debajo del hielo, y por lo tanto, ser menos accesible a la degradación bacteriana. La recuperación de una población después del accidente puede ser mucho más demorada porque muchas especies tienen vida larga y cambio generacional más lento (WWF 2007). Los hidrocarburos aromáticos policíclicos pueden persistir en los sedimentos a concentraciones prácticamente invariadas desde el momento del accidente hasta varias décadas, con efectos subletales para las especies bentónicas, las cuales muestran menor abundancia y fecundidad que las procedentes de sitios sin rastros de crudo (Culbertson et al. 2007).
En ambientes costeros tropicales protegidos, tales como lagunas arrecifales, praderas de fanerógamas y manglar, el petróleo persiste debido al largo tiempo necesario para su evacuación de los sedimentos finos típicos de los bosques de manglar y de la estructura porosa de los arrecifes (Guzmán et al. 1994).
Los efectos directos sobre los corales hermatípicos han sido difíciles de evaluar (Haapkylä et al. 2007), sin embargo, estudios recientes demuestran sus efectos negativos. En Panamá, después de un derrame en 1986, una alta mortalidad de colonias fue observada, la cobertura de coral disminuyó en 76% entre 0,5 y 3 m, y en un 56% entre 3 y 6 m, tres meses después del accidente. En particular la especie de coral, Acropora palmata (Cnidaria: Anthozoa) fue la más afectada, corroborando la hipótesis que los corales ramificados son más sensibles a disturbios antropogénicos (Haapkylä et al. 2007).
Por otro lado, Guzmán et al. (1994) señalaron una reducción de cobertura, abundancia y diversidad, aumento de colonias enfermas y disminución de la tasa de crecimiento en los mismos sitios, después de cinco años del accidente, confirmando un efecto crónico del petróleo sobre esos arrecifes. Otros autores han demostrado efectos subletales a largo plazo por exposición crónica sobre la fecundidad de las colonias (Mercurio et al. 2004), reclutamiento y metamorfosis de las larvas de los corales (Negri y Heyward 2000).
En los manglares, el petróleo entra cuando la marea es alta, y cuando la marea retrocede es depositado sobre las raíces aéreas y el sedimento, este proceso lleva a una distribución heterogénea del crudo y de sus efectos. Los árboles pueden morir por asfixia por la entrada del petróleo en los poros de las raíces que dependen del oxígeno que entra a través de estos poros. Las plantas pueden perecer además por la toxicidad de los compuestos, en particular, los compuestos aromáticos de bajo peso molecular, que dañan la membrana celular en las raíces subsuperficiales, impidiendo el proceso de exclusión de sal (IPIECA 1993). Los árboles afectados empiezan a morir poco después del accidente, y su recuperación es extremamente lenta. En Panamá, las plantas empezaron a morir dos semanas después del accidente, y seis años después el deterioro seguía avanzando, probablemente debido a la persistencia del crudo en los sedimentos (Burns et al. 1993). Otro efecto más sutil, pero no menos impactante, de la exposición al crudo, es el daño genético. La presencia de hidrocarburos aromáticos polinucleares en el suelo ha sido ligada a un aumento de mutaciones en donde la clorofila es deficiente o ausente (Hoff 2010).
América Latina y el Caribe son los segundos productores potenciales de petróleo después de Arabia Saudita (Haapkylä et al. 2007) y, por lo tanto, toda la región estaría en alto riesgo de accidentes. Los recientes planes de exploración petrolera en las aguas del Archipiélago de San Andrés, Providencia y Santa Catalina, Reserva Internacional de Biosfera Seaflower, ponen en riesgo una de las áreas mejor conservada de la región Caribe, y sus valiosos ecosistemas.
BIOINVASIONES
Las especies introducidas son aquellas especies transportadas e introducidas por el ser humano en lugares fuera de su área de distribución natural y que han conseguido establecerse y dispersarse en una nueva región. Las especies se consideran introducidas cuando se establecen en ambiente silvestre y se reproducen exitosamente. Las especies no son consideradas introducidas si son simplemente liberadas en una nueva área; estas liberaciones se definen como inoculaciones y no necesariamente hay evidencia de establecimiento o reproducción. Tampoco se consideran especies introducidas las que son importadas a una nueva región pero permanece solamente en ambientes controlados de acuicultura o maricultura (Carlton 2003).
La introducción de especies a nuevos hábitats o ecosistemas por parte del hombre no es novedosa. Los colonizadores europeos trajeron a América muchas especies, y llevaron a Europa especies del nuevo continente. Hay evidencia que los vikingos, que ya tenían contactos con el continente americano, introdujeron, voluntariamente o involuntariamente, la almeja comestible Mya arenaria a las costas del Norte de Europa durante el siglo XIII (Behrends et al. 2005, Petersen et al. 1992). En el transcurso de los siglos XIII y XIV, los barcos de madera habían permitido la dispersión transglobal de organismos que viven dentro o sobre la madera (poliquetos y crustáceos, entre otros), así que entender su distribución original es extremamente difícil (Carlton 1996).
En las últimas décadas, ese proceso se ha acelerado dramáticamente (Johnson y Chapman 2007); esto es particularmente cierto para las especies marinas, para las cuales se ha estimado que, diariamente, varios miles de taxones son transportados entre regiones biogeográficas solamente por medio del agua de lastre (Carlton 1999, Carlton y Geller 1993). La tasa de establecimiento de especies marinas introducidas está aumentando y en algunas bahías se halla una nueva especie establecida cada 30-40 semanas (Johnson y Chapman 2007). El impacto negativo de las bioinvasiones sobre especies nativas, comunidades y ecosistemas ha sido ampliamente reconocido por décadas (Elton 1958, Lodge 1993, Simberloff 1996), y algunos autores lo visualizan como un componente significativo del cambio global (Vitousek et al. 1996). Entre los impactos causados por las especies invasoras se destacan la pérdida de la biodiversidad, especialmente en especies nativas, y cambios en la estructura de las comunidades (Bax et al. 2001, Sala et al. 2000, Stein et al. 2000, Wilcove et al. 1998, Williamson 1996) y los ecosistemas (Mooney y Hobbs 2000, Vitousek y Walker 1989). De hecho, el impacto de las especies invasoras sobre la biodiversidad es considerado como el segundo más nocivo después de la destrucción de hábitat (Delach 2006, Levine y D'Antonio 2003, Vitousek et al. 1997), representando una amenaza mayor que la contaminación, la recolecta y las enfermedades, juntas. Las consecuencias económicas son enormes, estimadas en 400 billones de dólares anuales a nivel mundial (Gutiérrez 2006), de los cuales 137 billones solamente para los Estados Unidos (Morris y Whitfield 2009, Pimentel et al. 2000, 2005).
Los mecanismos de impacto con las cuales las especies introducidas actúan son (Stokes et al. 2006): a) competencia: la especie introducida compite con las especies nativas por un recurso [p. ej., el alga Sargassum muticum introducida en Escocia compite por el sustrato y la luz con la especie dominante Dictyota dichotoma, desplazándola (Harries et al. 2007)], b) herbivoría: herbívoros introducidos pueden afectar las poblaciones de plantas/macroalgas nativas e indirectamente alterar el hábitat [p. ej., la introducción de la lapa europea Littorina littorea ha modificado el hábitat y la comunidad de las regiones intermareales de Norte América (Bertness 1984)], c) depredación: especies no-nativas pueden alimentarse de especies nativas y sostener mayores poblaciones de depredadores nativos o introducidos [p. ej., la depredación del cangrejo invasor Carcinus maenas sobre la almeja nativa Katelysia scalarina en Tasmania (Walton et al. 2002)], d) parásitos o patógenos: especies introducidas pueden ser parásitos o patógenos [p. ej., el isópodo asiático parásito Orthione griffenis ha reducido drásticamente las poblaciones del camarón Upogebia pugettensis en la costa Pacífica de norte América (Chapman et al. 2012)], e) alteración del hábitat: especies introducidas alteran la estructura de las comunidades, el ciclo de nutrientes y pueden volver el hábitat no apto para las especies nativas [p. ej., en el mar Mediterráneo el alga verde Caulerpa racemosa modifica la comunidad macroalgal favoreciendo las formas a césped en detrimento de las formas erectas (Bulleri et al. 2010)], f) impacto genético: puede ocurrir hibridación entre especies nativas y especies introducidas, lo que puede disminuir la fertilidad de las especies nativas reduciendo la biodiversidad y puede alterar genéticamente las adaptaciones de las especies nativas a su hábitat [p. ej., la hibridación entre el almeja del pacifico Mytilus trossulus y la especie invasora M. galloprovincialis da híbridos con alta tasa de infertilidad en Japón (Brannock y Hilbish 2010)].
Los vectores de introducción de especies en ambientes marinos son (Stokes et al. 2006): 1) agua de lastre, 2) fouling en los cascos de los barcos, 3) acuacultura y maricultura, 4) parásitos y patógenos sobre otras especies introducidas, 5) acuarios e instituciones científicas, 6) puertos, 7) vías de comunicacion como canales, y 8) comercio de especies. Los vectores para las introducciones deliberadas son: 1) control biológico, 2) acuacultura y maricultura, y 3) acuarios e instituciones científicas. La mayoría de las introducciones (> 80%) no son intencionales (Molnar et al. 2008), no obstante, una vez las especies invasoras se establecen en los hábitats marinos, es casi imposible eliminarlas (Thresher y Kuris 2004).
Algunas especies marinas son consideradas entre las bioinvasoras más dañinas a nivel mundial. Un ejemplo es la medusa Mnemiopsis leidyi, nativa de esteros de la costa Atlántica de América, desde EE. UU. hasta Brasil, y que apareció en el mar Negro en el 1982. Probablemente fue introducida por un barco a través de la descarga de su agua de lastre (Carlton, 1996, Kideys 2002). En 1988, apenas seis años después de su introducción, se había convertido en la especie planctónica dominante, llegando a una biomasa estimada de 1,109 toneladas en peso húmedo en todo el mar Negro, un número superior a las capturas mundiales anuales (Ivanov et al. 2000). Esta especie es un insaciable consumidor de zooplancton, lo que incluye a las larvas de los peces de interés económico. Como resultado de esta invasión, las capturas de anchovas disminuyeron de 204.000 toneladas en 1984 a 200 toneladas en 1993; las del arenque anchoado Sprattus sprattus de 24.600 toneladas en 1984 a 12.000 en 1993; y las de escombro de 4.000 toneladas en 1984 a cero en 1993 (GESAMP 1997). Como se puede suponer, los daños económicos de esta invasión han sido gravísimos, con la pérdida de miles de puestos de trabajo y de millones de dólares en ingresos anuales para las comunidades costeras (Knowler 2005). Se ha estimado que las pérdidas totales debidas a la disminución de las pesquerías en el mar Negro son del orden de 1 billón de dólares al año, de los cuales 250 millones de dólares corresponden sólo a Turquía (Caddy 1992, citado en Knowler 2005).
En el mar Caribe, una introducción reciente que está preocupando a los expertos es la del pez león (Pterois volitans y P. miles). Originarias del Indopacífico, estas especies ornamentales de gran valor, muestran un activo comercio para acuarios en Estados Unidos, solamente a través del aeropuerto de Tampa pasaron 7.562 individuos en seis meses de 2003 (Morris y Whitfield 2009). Estos peces han sido introducidos en el Atlántico probablemente desde Biscaine Bay, Florida, cuando varios individuos fueron liberados desde un acuario durante el huracán Andrew en 1992 (Albins y Hixon 2008). Los peces han extendido su rango hacia el este (Bahamas, Bermuda), el norte (Rhode Island) y el sur (la cuenca Caribe), llegando recientemente a aguas colombianas (González et al. 2009).
Whitfield et al. (2007) estimaron una densidad de 21 peces por hectárea en Carolina del Norte en 2004. Cuatro años después, en las mismas localidades se encontraron un promedio de 150 individuos por hectáreas (Morris y Whitfield 2009). Las densidades en el Atlántico son de varios órdenes de magnitud mayores de las observadas en su rango nativo (Green y Côté 2009, Grubich et al. 2009). Estos peces se alimentan de más de 40 especies nativas en las Bahamas (Morris y Akins 2009), y pueden disminuir considerablemente su reclutamiento (hasta 79%), disminuyendo su biomasa (Albins y Hixon 2008), compitiendo con las especies nativas y favoreciendo indirectamente la degradación de los arrecifes de coral y un cambio de fase hacia las macroalgas (Morris y Whitfield 2009).
FLORECIMIENTOS DE ALGAS NOCIVAS
Los florecimientos algales nocivos (FAN) son cambios de color del agua producidos por la concentración de microalgas en determinado espacio y tiempo, en los que una especie domina en más del 50%, en relación a todo el fitoplancton (Mancera et al. 2009). La agregación de estos organismos puede flotar en la superficie formando ''espumas'', cubrir las playas con biomasa o exudados y agotar el oxígeno en el agua a través de excesiva respiración o descomposición. Algunas especies producen toxinas, que alteran los procesos celulares en otros organismos, desde el plancton al hombre. Los efectos más severos y memorables son mortandades masivas de peces, aves y mamíferos (incluyendo el hombre), problemas respiratorios o digestivos, pérdida de memoria, epilepsia, lesiones e irritación cutánea, y pérdida de recursos costeros como fanerógamas marinas y fauna (Corlett y Jones 2007, Cruz-Rivera y Villareal 2006, Foden et al. 2005, Maranda et al. 2007, Sellner et al. 2003).
En el caso de algunas especies, impactos significativos pueden ocurrir con bajas densidades celulares. Por ejemplo, especies dinoflageladas del género Dinophysis necesita una concentración de apenas 100s células/l para inducir síntomas diarreicos, ya que se concentran a lo largo de la cadena trófica. Pfiesteria piscicida y P. shmwayiae pueden causar problemas (irritación y lesiones cutáneas, desordenes neurocognitivos de corto plazo) con una concentración de 250 zoosporas/l (Grattan et al. 2001, Sellner et al. 2003). Los florecimientos algales tóxicos pueden ser causados por dinoflagelados, diatomeas, cianobacterias, rafidofitos y primnesiofitos (Sellner et al. 2003). Los compuestos tóxicos pueden ser neurotoxinas, carcinógenos, y varios otros compuestos que afectan los organismos marinos y/o el ser humano, debido a su concentración a lo largo de la cadena trófica. Los florecimientos impactan negativamente la salud pública, causan pérdidas económicas por reducción de turismo, recreación o cierre temporal de la maricultura. Así mismo, demandan altos costos para la implementación de programas de evaluación de calidad de aguas, composición de plancton, control o vigilancia de toxinas y servicios de alerta pública. Se estima que de 2.000 casos de intoxicación por FAN informados, el 15% genera muerte en los afectados; las pérdidas económicas atribuidas a FAN ascienden a los 862 millones de euros/año para Europa y a 82 millones dólares/año para Estados Unidos (Burkholder 1998, HARRNESS 2005).
Además, tienen un impacto negativo sobre la biodiversidad marina y los ecosistemas costeros. El dinoflagelado tóxico Pfiesteria piscicida causa muertes masivas de peces, llegando a matar a más de 1 billón de peces en un sólo evento (Coyne et al. 2001). Florecimientos de Lyngbya spp., cianobacterias filamentosas tóxicas, son comunes a las costas tropicales y subtropicales del mundo (Paul et al. 2005). En Florida, estos eventos son comunes y han aumentado en frecuencia y persistencia (Capper y Paul 2008). Las toxinas detienen el pastoreo en peces loros juveniles (Thacker et al. 1997), y su presencia tiene un efecto negativo sobre la sobrevivencia de larvas de corales (Kuffner y Paul 2004), sofoca las praderas de pasto marino (Stielow y Ballantine 2003, Watkinson et al. 2005) y provoca disminución de la fauna meiobentónica (García y Johnstone 2006). El contacto físico entre Lyngbya sp. y los corales scleractinios inhibe el crecimiento del animal (Titlyanov et al. 2007). Fong et al. (2006) han demostrado que la presencia de las cianobacterias sobre los arrecifes de coral favorece el cambio de fase en el ecosistema a favor de las macroalgas.
Algunos de los compuestos producidos por estos organismos son agentes promotores de tumores (Arthur et al. 2006, Landsberg et al. 1999, Takahashi et al. 2008), y han sido relacionados con alta incidencia de fibropapilomatosis en varias especies de tortugas marinas (Caretta caretta, Chelonia mydas y Lepidochelys olivacea) (Landsberg et al. 1999), todas en peligro de extinción. El fibropapilomatosis es un tumor benigno, pero su crecimiento puede afectar negativamente el movimiento, la visión y la respiración del reptil. Fibromas viscerales pueden impedir el normal funcionamiento de los órganos, hasta provocar la muerte (Herbst 1994). El fibropapilomatosis fue registrado por primera vez en una tortuga capturada en 1938, cuando el 1,5% de las tortugas en Key West, Florida, estaban afectadas. En los últimos 30 años, se ha observado incremento dramático del tumor en tortugas verdes (Chelonia mydas) en Hawaii, Florida y el Caribe. En Oahu (Hawaii), hay hasta un 92% de incidencia de fibropapilomatosis. En 1995, en Florida la incidencia llegaba a 60% en Chelonia mydas y 11% en Lepidochelys olivácea (Landsberg et al. 1999). En el mar Caribe, aumento en tumores en estas especies se ha detectado, a partir de los años 80, particularmente en Puerto Rico y Colombia (Williams et al. 1994). Más recientemente, se han notificado hasta 25% de incidencia de la enfermedad en juveniles de Chelonia mydas en la costa de Madagascar (Leroux et al. 2010). La ausencia del tumor en adultos de la especie, hace suponer que solamente los individuos sanos sobreviven, o los que superan la enfermedad (Foley et al. 2005, Leroux et al. 2010) ya que se ha observado la regresión del tumor en algunos casos. Supuestamente las tortugas y algunos mamíferos marinos, como el dugongo, se enferman consumiendo pasto marino, sobre cuyas hojas viven epífitas muchas de las algas que producen las toxinas (Takahashi et al. 2008).
CAMBIOS AMBIENTALES GLOBALES
La tierra es un sistema dinámico y los cambios ambientales globales han estado presentes desde su formación y de una u otra manera hacen parte de su funcionamiento. Un ejemplo son los ciclos de glaciación/interglaciación de los pasados dos millones de años (CLIMAP 1976, COHMAP 1988, Davis 1990). El creciente interés en el cambio global surge del hecho que los componentes de origen antrópico, han igualado en magnitud a los componentes de origen natural, siendo además más rápidos por lo general, según lo muestran los últimos millones de años.
Los cambios globales son definidos como esas alteraciones de los fluidos que envuelven y rodean el sistema terrestre, la atmosfera y los océanos, y que pueden ser experimentados globalmente; otros ocurren en sitios discretos pero son tan ampliamente difundidos que se constituyen en un cambio global. Ejemplo de la primera categoría incluye cambios en la composición de atmosférica, cambio climático, decrecimiento en las concentraciones de ozono e incrementos en el flujo ultravioleta. Entre los ejemplos del segundo tipo de cambios se cuentan: cambio en el uso de la tierra, pérdida de la diversidad biológica y cambio en la química atmosférica (Vitousek 1992).
El cambio climático de origen antropogénico es causado por la emisión de gases efecto de invernadero (CO2 principalmente) debido al consumo de combustible fósil y a la deforestación. En la actualidad cerca de 79 millones de toneladas de CO2 son liberadas en el atmosfera diariamente como resultado de las actividades humanas (Bowler et al. 2010). En los últimos 250 años, los niveles de dióxido de carbono (CO2) atmosférico han aumentado en 40% desde niveles preindustriales de 280 ppmv (partes por millón volumen) a casi 384 ppmv en 2007 (Doney et al. 2009). La tasa de incremento es por lo menos del orden de magnitud más rápida de la que ha ocurrido en millones de años (Doney y Schimel 2007), y la concentración actual es la más alta experimentada en los últimos 800.000 años (Lüthi et al. 2008). El aumento de CO2 en la atmósfera causa aumento de la temperatura, estimado en 1,4-5,8 °C para el 2100, una expansión termal del agua, y por lo tanto, aumento en el nivel del mar, estimado en 0,1-0,9 m en 2100 (Peperzak 2003).
El aumento de la CO2 atmosférico es moderado por los océanos, que absorben cerca de una tercera parte del carbono emitido a la atmosfera (Doney et al. 2009, Sabine et al. 2004). Sin embargo, la absorción por parte del océano causa reducción en el pH y reduce la saturación del carbonato de calcio (CaCO3) en aguas superficiales, efectos denominados acidificación del océano (Doney et al. 2009). La disminución del pH tiene tasa actual de 0,015 unidades/década (Miles et al. 2007). Esos cambios pueden afectar varios grupos de organismos marinos, particularmente son vulnerables los organismos que necesitan producir una concha o esqueleto calcáreo para sobrevivir, como los corales (Seibel y Fabry 2003), moluscos (Michaelidis et al. 2005, Orr et al. 2005), crustáceos (DeFur y McMahon 1984), y algas calcáreas (Riebesell et al. 2000). Estudios sobre colonias de corales en la Gran Barrera Coralina de Australia han evidenciado disminución de 21% en la tasa de calcificación entre 1988 y 2003 (Cooper et al. 2008). La respuesta a la acidificación de los estadios tempranos de desarrollo ha sido investigada en bivalvos y equinodermos (Doney et al. 2009). En erizos de mar, la acidificación disminuye el éxito de fertilización, la tasa de desarrollo y tamaño larval, y formación de endoesqueleto (Kurihara y Shirayama 2004). El desarrollo larval de Crassostrea gigas también se ve afectado por altas concentraciones de CO2 en el agua (Kurihara et al. 2007).
Los organismos que depositan aragonita (MgCO3), como los equinodermos (Miles et al. 2007), los moluscos pterópodos (Orr et al. 2005), corales escleratinios y algunos poliquetos pueden encontrarse en mayor riesgo. La aragonitao es 30 veces más soluble que la calcita sin magnesio (Politi et al. 2004), y por lo tanto, su disolución podría ocurrir mucho más rápidamente (Miles et al. 2007). La extinción o migración de pterópodos desde regiones polares debido a la acidificación de las aguas marinas puede provocar cambios en la cadena trófica y en la estructura del ecosistema polar entero (Orr et al. 2005).
Otro efecto del cambio climático en los océanos es el calentamiento y la deoxigenación de las aguas superficiales (Keeling et al. 2010). Se predice la pérdida de O2 disuelto no solamente porque el oxígeno es menos soluble a mayores temperaturas, sino también porque el calentamiento global puede aumentar la estratificación de las aguas superficiales, disminuyendo así el O2 en las aguas más profundas (Keeling y García 2002, Keeling et al. 2010). El oxígeno actúa directamente en los ciclos de carbón, nitrógeno y otros elementos; además, es indispensable para todos organismos aeróbicos. Si las aguas se estratificaran, muchas regiones oceánicas se volverían anóxicas en décadas, debido al continuo consumo de oxígeno por parte de los organismos de aguas profundas (Keeling et al. 2010). Si la concentración de oxígeno es inferior al límite de tolerancia de los organismos, éstos empiezan a sufrir estrés, que los puede llevará a la muerte si la concentración permanece demasiado baja por mucho tiempo.
A bajas concentraciones de O2, ocurren cambios en los ciclos biogeoquímicos. Si el oxígeno es inferior a 5 μmol kg–1, el nitrato resulta importante en la respiración, remplazando el O2 como aceptor de electrones (Keeling et al. 2010). Una vez todo el nitrato es consumido, las poblaciones de microrganismos reductores de sulfato se hacen muy abundantes convirtiendo los sulfatos en sulfuros. En estas condiciones la anoxia puede evolucionar a euxinia, situación en la que las concentraciones de azufre en aguas profundas llegan a niveles tóxicos (Meyer y Kump 2008), causando la muerte de los organismos bentónicos.
El aumento de temperatura es otra consecuencia del cambio climático. La alta sensibilidad de las especies polares a cambios de temperatura las hace particularmente susceptibles ya que tienen ámbitos de tolerancia térmica 2-4 veces más reducidos que los taxones de latitudes inferiores (Peck et al. 2004). Se puede esperar, por lo tanto, alta tasa de extinción entre las especies polares, unido elevadas tasas de invasión por la expansión de hábitat de especies de aguas templadas (Cheung et al. 2009). Paralelamente, la biodiversidad en regiones tropicales se verá afectada por alta tasa de extinciones locales. La mayoría de las especies tropicales son poiquilotermas, con tolerancia térmica cercana a la temperatura máxima de su hábitat (Tewksbury et al. 2008). Por lo tanto, se prevé que estos organismos se desplacen a mayores latitudes cuando las temperaturas en los trópicos aumenten, causando extinciones locales en las regiones tropicales (Cheung et al. 2009).
Eventos de El Niño han ido incrementando en frecuencia y severidad desde que sus registros empezaron en los 1900s, y se espera que este patrón continúe. Un evento de El Niño particularmente fuerte en 1997-1998 causó el blanqueamiento de los corales en todos los océanos (hasta el 95% de corales blanqueados en el Océano Indico), resultando en la extinción del 16% de los corales (Parmesan 2006). Aumentos de temperatura pueden incrementar la susceptibilidad de los corales a enfermedades infecciosas (Harvell et al. 2001). Las enfermedades han tenido gran impacto sobre los arrecifes de coral (Chadwick-Furman 1996), eliminando especies raras y reduciendo severamente la abundancia de los taxones comunes (Porter et al. 2001). Acropora palmata, la especie más común en el mar Caribe, ha experimentado disminución rápida y severa por lo que se ha propuesto incluirla en la lista de especies en peligro de extinción (Lafferty et al. 2004). El deterioro de los corales puede impactar negativamente los ecosistemas de manglar y pastos marinos, que dependen de los arrecifes para la protección de las olas (McLeod y Salm 2006).
CONSIDERACIONES FINALES
El hecho que solo el 15% de la biodiversidad de los mares del mundo ha sido muestreada (Culotta 1994), es indicador del inmenso vacío de conocimiento que se tiene de los océanos y sus áreas costeras. Sin embargo, la presión ejercida sobre esa biodiversidad es cada vez más fuerte, y es el resultado directo del aumento demográfico de la población humana. El 67% de la población mundial vive en áreas costeras o en su proximidad y se espera que este porcentaje aumente en forma exponencial, tal como lo ha hecho la población mundial durante los últimos 50 años (Gray 1997), pues muchas de las mayores metrópolis del mundo como Sao Paulo, Shangai, Hong Kong y Jakarta, están cerca a zonas costeras. Considerando los enormes beneficios que los océanos y su biodiversidad proveen a gran parte de la población global, es importante prevenir el colapso de estos ecosistemas (tabla 1). Los sistemas con alta diversidad proveen más servicios con menor variabilidad, lo cual tiene implicaciones económicas y políticas. Restaurando la biodiversidad marina a través de manejo sostenible de las pesquerías, controlando la contaminación, conservando hábitats clave y manejando mejor reservas marinas, se invierte en la productividad y la confiabilidad de los servicios que el océano provee a la humanidad (Worm et al. 2006).
AGRADECIMIENTOS
Los autores agradecen a la Vicerrectoría de Investigación de la Universidad Nacional de Colombia por el financiamiento del proyecto Código HERMES 12921 que permitió la realización de este artículo y al profesor Orlando Rangel del Instituto de Ciencias Naturales por la invitación a participar en la Cátedra Mutis en el primer semestre de 2010, lo cual contribuyó a la redacción del presente trabajo. Este documento es producto de los grupos de investigación ''Modelación de ecosistemas costeros'' y ''Sistemática molecular y biogeografía de algas marinas''.
REFERENCIAS
Airoldi L, Balata D, Beck MW. 2008. The gray zone: relationships between habitat loss and marine diversity and their applications in conservation. Journal of Experimental Marine Biology and Ecology, 366: 8-15. [ Links ]
Airoldi L, Beck MW. 2007. Loss, status and trends for coastal marine habitats of Europe. Oceanography and Marine Biology: Annual Review, 45: 345-405. [ Links ]
Albins MA, Hixon MA. 2008. Invasive Indo-Pacific lionfish Pterois volitans reduce recruitment of Atlantic coralreef fishes. Marine Ecology Progress Series, 367: 233-238. [ Links ]
Arthur K, Shaw G, Limpus C, Udy J. 2006. A review of the potential role of tumour-promoting compounds produced by Lyngbya majuscula in marine turtle fibropapillomatosis. African Journal of Marine Science, 28 (2): 441-446. [ Links ]
Barbera C, Bordehore C, Borg JA, Glemarec M, Grall J, Hall- Spencer JM, De La Huz CH, Lanfranco E, Lastra M, Moore PG, Mora J, Pita ME, Ramos-Espla AA, Rizzo M, Sanchez-Mata A, Seva A, Schembri PJ, Valle C. 2003. Conservation and management of northeast Atlantic and Mediterranean maerl beds. Aquatic Conservation: Marine and Freshwater Ecosystems, 13: 65-76. [ Links ]
Bax, N, Carlton JT, Mathews-Amos A, Haedrich RL, Howarth FG, Purcell JE, Rieser A, Gray A. 2001. The control of biological invasions in the world's oceans. Conservation Biology, 15: 1234-1246. [ Links ]
Behrends B, Hertweck G, Liebezeit G, Goodfriend G. 2005. Earliest Holocene occurrence of the soft-shell clam, Mya arenaria, in the Greifswalder Bodden, Southern Baltic. Marine Geology, 216: 79-82. [ Links ]
Bertness MD. 1984. Habitat and community modification by an introduced herbivorous snail. Ecology, 65: 370-381. [ Links ]
Bishop MJ, Powers SP, Porter HJ, Peterson CH. 2006. Benthic biological effects of seasonal hypoxia in a eutrophic estuary predate rapid coastal development. Estuarine, Coastal and Shelf Science, 70: 415-422. [ Links ]
Bowler C, Vardi A, Allen AE. 2010 Oceanographic and biogeochemical insights from diatom genomes. Annual Review in Marine Science, 2: 333-365. [ Links ]
Brannock PM, Hilbish TJ. 2010. Hybridization results in high levels of sterility and restricted introgression between invasive and endemic marine blue mussels. Marine Ecology Progress Series, 406: 161-171. [ Links ]
Bulleri F, Balata D, Bertocci I, Tamburello L, Benedetti- Cecchi L. 2010. The seaweed Caulerpa racemosa on Mediterranean rocky reefs: from passenger to driver of ecological change. Ecology, 91 (8): 2205-2212. [ Links ]
Burkholder JM. 1998. Implications of harmful microalgae and heterotrophic dinoflagellates in management of sustainable marine fisheries. Ecological Applications, 8 (1, supplement): S37-S62. [ Links ]
Burns KA, Garrity SD, Levings SC. 1993. How many years until mangrove ecosystems recover from catastrophic spills? Marine Pollution Bulletin, 26 (5): 239-248. [ Links ]
Butler AJ, Rees T, Beesley P, Bax NJ. 2010. Marine biodiversity in the Australian region. PLoS ONE, 5 (8): e11831. [ Links ]
Byrnes JE, Reynolds PL, Stachowicz JJ. 2007. Invasions and extinctions reshape coastal marine food webs. PLoS ONE, 2 (3): e295. [ Links ]
Capone DG, Bauer JE. 1992. Microbial processes in coastal pollution. En: Mitchell R editor. Environmental Microbiology. New York: John Wiley and Sons. p. 191-238. [ Links ]
Capper A, Paul VJ. 2008. Grazer interactions with four species of Lyngbya in southeast Florida. Harmful Algae, 7: 717-728. [ Links ]
Carlton JT, Geller BJ. 1993. Ecological roulette: the global transport of nonindigenous marine organisms. Science, 261: 79-82. [ Links ]
Carlton JT. 1996. Marine bioinvasions: the alteration of marine ecosystems by nonindigenous species. Oceanography, 9: 36-43. [ Links ]
Carlton, JT. 1999. Scale and ecological consequences of biological invasions in the world's oceans. En: Sandlund OT, Schei PJ, Viken A, editores. Invasive species and biodiversity management. Dordrecht: Kluwer Academic Publishers. p. 195-212. [ Links ]
Carlton JT. 2003. Community assembly and historical biogeography in the North Atlantic Ocean: the potential role of human-mediated dispersal vectors. Hydrobiologia, 503: 1-8. [ Links ]
Chadwick-Furman NE. 1996. Reef coral diversity and global change. Global Change Biology, 2: 559-68. [ Links ]
Chapin FS III, Sala OE, Burke IC, Grime JP, Hooper DU. 1998. Ecosystem consequences of changing biodiversity. BioScience, 48: 45-52. [ Links ]
Chapman JV, Dumbauld BR, Itani G, Markham JC. 2012. An introduced Asian parasite threatens northeastern Pacific estuarine ecosystems. Biological Invasions, 14: 1221-1236. [ Links ]
Cheevaporn V, Menasveta P. 2003. Water pollution and habitat degradation in the Gulf of Thailand. Marine Pollution Bulletin, 47: 43-51. [ Links ]
Cheung WWL, Lam VWY, Sarmiento JL, Kearney K, Watson R, Pauly D. 2009. Projecting global marine biodiversity impacts under climate change scenarios. Fish and Fisheries, 10: 235-251. [ Links ]
CLIMAP Project. 1976. The surface of the ice age earth. Science, 191: 1131-1137. [ Links ]
COHMAP Project. 1988. Climatic changes of the last 18,000 years: Observations and model simulations. Science, 241: 1043-1052. [ Links ]
Coleman N, Gason ASH, Poore GCB. 1997. High species richness in the shallow marine waters of southeast Australia. Marine Ecology Progress Series, 154: 17-26. [ Links ]
Coll M, Piroddi C, Steenbeek J, Kaschner K, Lasram FBR, Aguzzi J, Ballesteros E, Bianchi CN, Corbera J, Dailianis T, Danovaro R, Estrada M, Froglia C, Galil BS, Gasol JM, Gertwagen R, Gil J, Guilhaumon F, Kesner- Reyes K, Kitsos MS, Koukouras A, Lampadariou N, Laxamana E, López-Fé de la Cuadra CM, Lotze HK, Martin D, Mouillot D, Oro D, Raicevich S, Rius-Barile J, Saiz-Salinas JI, San Vicente C, Somot S, Templado J, Turon X, Vafidis D, Villanueva R, Voultsiadou E. 2010. The biodiversity of the Mediterranean Sea: estimates, patterns, and threats. PLoS ONE, 5 (8): e11842. [ Links ]
Cooper TF, De 'Ath G, Fabricius KE, Lough JM. 2008. Declining coral calcification in massive Porites in two nearshore regions of the northern Great Barrier Reef. Global Change Biology, 14: 529-38. [ Links ]
Corlett H, Jones B. 2007. Epiphyte communities on Thalassia testudinum from Grand Cayman, British West Indies: Their composition, structure, and contribution to lagoonal sediments. Sedimentary Geology, 194: 245-262. [ Links ]
Cortes J, Risk MJ. 1985. A coral reef under siltation stress: Cahuita, Costa Rica. Bulletin of Marine Science, 36: 339-365. [ Links ]
Cosser PR (editor). 1997. Nutrients in marine and estuarine environments. Canberra (Australia): Environment Australia. p. 53. [ Links ]
Coyne KJ, Hutchins DA, Hare CE, Cary SC. 2001. Assessing temporal and spatial variability in Pfiesteria piscicida distributions using molecular probing techniques. Aquatic Microbial Ecology, 24: 275-285. [ Links ]
Crowder LB, Hazen EL, Avissar N, Bjorkland R, Latanich C, Ogburn MB. 2008. The impacts of fisheries on marine ecosystems and the transition to ecosystem-based management. Annual Review of Ecology, Evolution, and Systematics, 39: 259-78. [ Links ]
Cruz-Rivera E, Villareal T. 2006. Macroalgal palatability and the flux of ciguatera toxins trough marine food webs. Harmful Algae, 5: 497-525. [ Links ]
Culbertson JB, Valiela I, Peacock EE, Reddy CM, Carter A, Vanderkruik R. 2007. Long-term biological effects of petroleum residues on fiddler crabs in salt marshes. Marine Pollution Bulletin, 54: 955-962. [ Links ]
Culotta E. 1994. Is marine biodiversity at risk? Science, 263: 918-920. [ Links ]
Danovaro R, Company JB, Corinaldesi C, D'onghia G, Galil B, Gambi C, Gooday AJ, Lampadariou N, Luna GM, Morigi C, Olu K, Polymenakou P, Ramirez-Llodra E, Sabbatini A, Sardà F, Sibuet M, Tselepides A. 2010. Deep-Sea biodiversity in the Mediterranean Sea: the known, the unknown, and the unknowable. PLoS ONE, 5 (8): e11832. [ Links ]
Das S, Vincent JR. 2009. Mangroves protected villages and reduced death toll during Indian super cyclone. Proceedings of the National Academy of Sciences, 106 (18): 7357-7360. [ Links ]
Davis MB. 1990. Biology and paleobiology of global climate change: introduction. Trends in Ecology & Evolution, 5: 269-270. [ Links ]
Defur, PL, Mcmahon BR. 1984. Physiological compensation to short term air exposure in red rock crabs Cancer productus Randall, from littoral and sublittoral habitats. II. acid-base balance. Physiological Zoology, 57: 151-160. [ Links ]
Delach A. 2006. Invasive species in the northwestern United States: threats to wildlife, and defenders of wildlife's recommendation for prevention policies. Northwestern Naturalist, 87: 43-55. [ Links ]
Diaz RJ, Rosenberg R. 2008. Spreading dead zones and consequences for marine ecosystems. Science, 321: 926-929. [ Links ]
Diaz RJ, Rosenberg R. 1995. Marine benthic hypoxia: a review of its ecological effects and behavioural responses of marine macrofauna. Oceanography and Marine Biology: An Annual Review, 33: 245-303. [ Links ]
Dirzo R, Raven PH. 2003. Global state of biodiversity and loss. Annual Review of Environment and Resources, 28: 137-167. [ Links ]
Dobson A, Lodge D, Alder J, Cumming GS, Keymer J, Mcglade J, Mooney H, Rusak JA, Sala O, Wolters V, Wall D, Winfree R, Xenopoulos MA. 2006. Habitat loss, trophic collapse, and the decline of ecosystem services. Ecology, 87: 1915-1924. [ Links ]
Doney SC, Schimel DS. 2007. Carbon and climate system coupling on timescales from the Precambrian to the Anthropocene. Annual Review of Environment and Resources, 32: 31-66. [ Links ]
Doney SC, Fabry VJ, Feely RA, Kleypas JA. 2009. Ocean Acidification: the other CO2 problem. Annual Review of Marine Science, 1: 169-192. [ Links ]
Downing N, Roberts CM. 1993. Has the Gulf War affected coral reefs of the northwestern Gulf? Marine Pollution Bulletin, 27: 149-156. [ Links ]
Duffy JE. 2006. Biodiversity and the functioning of seagrass ecosystems. Marine Ecology Progress Series, 311: 233-250. [ Links ]
Dulvy NK, Sadovy Y, Reynolds JD. 2003. Extinction vulnerability in marine populations. Fish and Fisheries, 4: 25-65. [ Links ]
Dulvy NK, Freckleton RP, Polunin NVC. 2004. Coral reef cascades and the indirect effects of predator removal by exploitation. Ecology Letters, 7: 410-416. [ Links ]
Eby LA, Crowder LB, McClellan CB, Powers MJ, Peterson CH. 2005. Effects of habitat degradation from intermittent hypoxic disturbances on juvenile fishes. Marine Ecology Progress Series, 291: 249-262. [ Links ]
Eby LA, Crowder LB. 2002. Hypoxia-based habitat compression in the Neuse River Estuary: context-dependent shifts in behavioral avoidance thresholds. Canadian Journal of Fisheries and Aquatic Sciences, 59: 952-965. [ Links ]
Ehrlich PR, Wilson EO. 1991. Biodiversity studies: science and policy. Science, 253: 758-62. [ Links ]
Elton C. 1958. The ecology of invasions by animals and plants. London: Methuen. p.181. [ Links ]
FAO. 2000. The State of World Fisheries and Aquaculture. Rome: UN FAO. p.144. [ Links ]
Fautin D, Dalton P, Incze LS, Leong J-AC, Pautzke C, Rosenberg A, Sandifer P, Sedberry G, Tunnell Jr JW, Abbott I, Brainard RE, Brodeur M, Eldredge LG, Feldman M, Moretzsohn F, Vroom PS, Wainstein M, Wolff N. 2010. An Overview of Marine Biodiversity in United States Waters. PLoS ONE, 5 (8): e11914. [ Links ]
Flórez-Leiva L, Manjarrés-Martínez L, Gómez-Canchong P, Orlando Duarte L, Díaz-Pulido G. 2007. Macroalgas marinas afectadas por la flota de arrastre camaronero en el mar Caribe de Colombia. Revista de la Academia Colombiana de la Ciencia, 31 (118): 41-48. [ Links ]
Foden J, Purdaie D, Morris S, Nascimiento S. 2005. Epipytic abundance and toxicity of Prorocentrum population in Flett Lagoon, UK. Harmful Algae, 4: 1063-1074. [ Links ]
Foley AM, Schroeder BA, Redlow AE, Fick-Child KJ, Teas WG. 2005. Fibropapillomatosis in stranded green turtles (Chelonia mydas) from the eastern United States (1980-98): trends and associations with environmental factors. Journal of Wildlife Diseases, 41 (1): 29-41. [ Links ]
Fong, P, Smith TB, Wartian MJ. 2006. Epiphytic cyanobacteria maintain shifts to macroalgal dominance on coral reefs following ENSO disturbance. Ecology, 87 (5): 1162-1168. [ Links ]
García R, Johnstone RW. 2006. Effects of Lyngbya majuscula (Cyanophycea) blooms on sediment nutrients and meiofaunal assemblages in seagrass beds in Moreton Bay, Australia. Marine & Freshwater Research, 57 (2): 155-165. [ Links ]
Gavio B, Palmer-Cantillo S, Mancera JE. 2010. Historical analysis (2000-2005) of the coastal water quality in San Andrés Island, SeaFlower Biosphere Reserve, Caribbean Colombia. Marine Pollution Bulletin, 60: 1018-1030. [ Links ]
GESAMP. 1997. Opportunistic settlers and the problem of the ctenophore Mnemiopsis leidyi invasion in the Black Sea. London: GESAMP Report and Studies N.° 58. [ Links ]
González J, Grijalba-Bendeck M, Acero A, Betancur-R R. 2009. The invasive red lionfish, Pterois volitans (Linnaeus 1758), in the southwestern Caribbean Sea. Aquatic Invasions, 4 (3): 507-510. [ Links ]
Graham MH. 2004. Effects of local deforestation on the diversity and structure of southern California giant kelp forest food webs. Ecosystems, 7: 341-357. [ Links ]
Grattan LM, Oldach D, Morris JG. 2001. Human health risks of exposure to Pfiesteria piscicida. BioScience, 51: 853-857. [ Links ]
Gray JS, Poore GCB, Ugland KI, Wilson RS, Olsgard F, Johannessen O. 1997. Coastal and deep-sea benthic diversities compared. Marine Ecology Progress Series, 159: 97-103. [ Links ]
Gray JS, Wu RS, Or YY. 2002. Effects of hypoxia and organic enrichment on the coastal marine environment. Marine Ecology Progress Series, 238: 249-279. [ Links ]
Gray JS. 1997. Marine biodiversity: patterns, threats and conservation needs. Biodiversity and Conservation, 6: 153-175. [ Links ]
Green, SJ, Côté IM. 2009. Record densities of Indo-Pacific lionfish on Bahamian coral reefs. Coral Reefs, 28: 107. [ Links ]
Griffiths CL, Robinson TB, Lange L, Mead A. 2010. Marine biodiversity in South Africa: an evaluation of current states of knowledge. PLoS ONE, 5 (8): e12008. [ Links ]
Griffiths HJ. 2010. Antarctic marine biodiversity - what do we know about the distribution of life in the Southern Ocean? PLoS ONE, 5 (8): e11683. [ Links ]
Grubich JR, Westneat MW, McCord CL. 2009. Diversity of lionfishes (Pisces: Scorpaenidae) among remote coral reefs of the Palau Archipelago. Coral Reefs, 28: 807. [ Links ]
Gulf of Mexico Restoration [Internet]. 2011. Gulf coast ecosystem restoration council. Fecha de acceso: 15 de junio de 2011. Disponible en: http://www.restorethegulf.gov. [ Links ]
Gutiérrez F. 2006. Estado de conocimiento de especies invasoras. Propuesta de lineamientos para el control de los impactos. Bogotá: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. p.156. [ Links ]
Guzmán HM, Burns KA, Jackson JBC. 1994. Injury, regeneration and growth of Caribbean reef corals after a major oil spill in Panama. Marine Ecology Progress Series, 105: 231-241. [ Links ]
Haapkylä J, Ramade F, Salvat B. 2007. Oil pollution on coral reefs: a review of the state of knowledge and management needs. Vie et Milieu, 57 (1/2): 91-107. [ Links ]
Hampton J, Sibert JR, Kleiber P, Maunder MN, Harley SJ. 2005. Fisheries: decline of Pacific tuna populations exaggerated? Nature, 434: E1-2. [ Links ]
Harries DB, Harrow S, Wilson J.R, Mair JM, Donnan DW. 2007. The establishment of the invasive alga Sargassum muticum on the west coast of Scotland: a preliminary assessment of community effects. Journal of the Marine Biological Association of the United Kingdom, 87 (5): 1057-1067. [ Links ]
HARRNESS, (Ramsdell JS, Anderson DM, Glibert PM, editores). 2005. Harmful algal research and response: a national environmental science strategy 2005-2015. Washington D.C.: Ecological Society of America. p. 96. [ Links ]
Harvell D, Kim K, Quirolo C, Weir J, Smith G. 2001. Coral bleaching and disease: contributors to 1998 mass mortality in Briareum asbestinum (Octocorallia, Gorgonacea). Hydrobiologia, 460: 97-104. [ Links ]
Hauxwell J, Cebrián J, Furlong C, Valiela I. 2001. Macroalgal canopies contribute to eelgrass (Zostera marina) decline in temperate estuarine ecosystems. Ecology, 82: 1007-1022. [ Links ]
Haynes D, Johnson JE. 2000. Organochlorine, heavy metal and polyaromatic hydrocarbon pollutant concentrations in the Great Barrier Reef (Australia) environment: a review. Marine Pollution Bulletin, 41 (7): 267-278. [ Links ]
Herbert DA, Rastetter EB, Shaver GR, Agren GI. 1999. Effects of plant growth characteristics on biogeochemistry and community composition in a changing climate. Ecosystems, 2: 367-382. [ Links ]
Herbst LH. 1994. Fibropapillomatosis in marine turtles. Annual Review Fish Diseases, 4:389-425. [ Links ]
Hilborn R, Trevor AB, Ernst B, Magnusson A, Minte-Vera CV, Scheuerell MD, Valero JL. 2003. State of the world's fisheries. Annual Review of Environment and Resources, 28: 359-99. [ Links ]
Hine AC, Evans MW, Davis RA Jr, Belknap DF. 1987. Depositional response to seagrass mortality along a low-energy, barrier-island coast: West-Central Florida. Journal of Sedimentary Petrology, 57 (3): 431-439. [ Links ]
Hoff R. 2010. Oil spills in mangroves: planning and response considerations. NOAA National Oceanic and Atmospheric Administration. p. 70. [ Links ]
Hosack GR, Dumbauld BR, Ruesink JL, Armstrong DA. 2006. Habitat associations of estuarine species: Comparisons of intertidal mudflat, seagrass (Zostera marina), and oyster (Crassostrea gigas) habitats. Estuaries and Coasts, 29: 1150-1160. [ Links ]
IPIECA (International Petroleum Industry Environmental Conservation Association). 1993. Biological impacts of oil pollution: mangroves. London: Ipieca Report Series, Vol. IV. [ Links ]
Ivanov VP, Kamakin AM, Ushivtzev VB, Shiganova T, Zhukova O, Aladin N., Wilson SI, Harbison GR, Dumont HJ. 2000. Invasion of the Caspian Sea by the comb jellyfish Mnemiopsis leidyi (Ctenophora). Biological Invasions, 2: 255-258. [ Links ]
Jackson JBC, Kirby MX, Berger WH, Bjorndal KA, Botsford LW, Bourque BJ, Bradbury RH, Cooke R, Erlandson J, Estes JA, Hughes TP, Kidwell S, Lange CB, Lenihan HS, Pandolfi JM, Peterson CH, Steneck RS, Tegner MJ, Warner RR. 2001. Historical overfishing and the recent collapse of coastal ecosystems. Science, 293: 629-638. [ Links ]
Johnson CR, Chapman ARO. 2007. Seaweed invasions: introduction and scope. Botanica Marina, 50: 321-325. [ Links ]
Jones CG, Lawton JH, Shachak M. 1994. Organism as ecosystem engineers. Oikos, 69: 373-386. [ Links ]
Karlson K, Rosenberg R, Bonsdorff E. 2002. Temporal and spatial large-scale effects of eutrophication and oxygen deficiency on benthic fauna in Scandinavian and Baltic waters - a review. Oceanography and Marine Biology: An Annual Review, 40: 427-489. [ Links ]
Kathiresan K, Rajendran N. 2005. Coastal mangrove forests mitigated tsunami. Estuarine, Coastal and Shelf Science, 65: 601-606. [ Links ]
Keeling RF, Garcia H. 2002. The change in oceanic O2 inventory associated with recent global warming. Proceedings of the National Academy of Sciences, 99 (12): 7848-7853. [ Links ]
Keeling RF, Körtzinger A, Gruber N. 2010. Ocean deoxygenation in a warming world. Annual Review of Marine Science, 2: 199-229. [ Links ]
Kideys AE. 2002. Fall and rise of the Black Sea ecosystem. Science, 297: 1482-1484. [ Links ]
Knowler D. 2005. Reassessing the costs of biological invasion: Mnemiopsis leidyi in the Black Sea. Ecological Economics, 52: 187-199. [ Links ]
Kuffner IB, Paul VJ. 2004. Effects of the benthic cyanobacterium Lyngbya majuscula on larval recruitment of the reef corals Acropora surculosa and Pocillopora damicornis. Coral Reefs, 23: 455-458. [ Links ]
Kurihara H, Kato S, Ishimatsu A. 2007. Effects of increased seawater pCO2 on early development of the oyster Crassostrea gigas. Aquatic Biology, 1: 91-98. [ Links ]
Kurihara H, Shirayama Y. 2004. Effects of increased atmospheric CO2 on sea urchin early development. Marine Ecology Progress Series, 274: 161-69. [ Links ]
Lafferty KD, Porter JW, Ford SE. 2004. Are diseases increasing in the ocean? Annual Review of Ecology, Evolution, and Systematics, 35: 31-54. [ Links ]
Landsberg JH, Balazs GH, Steidinger KA, Baden DG, Work TM, Russell DJ. 1999. The potential role of natural tumor promoters in marine turtle fibropapillomatosis. Journal of Aquatic Animal Health, 11: 199-210. [ Links ]
Leroux, G, Rakotonirina B, Ciccione S, Hawawini S, Campillo A. 2010. First report of Chelonia mydas affected by cutaneous fibropapillomatis on the West coast of Madagascar. Indian Ocean Turtle Newsletter, 11: 13-17. [ Links ]
Levine JM, D'Antonio CM. 2003. Forecasting biological invasions with increasing international trade. Conservation Biology, 17 (1): 322-326. [ Links ]
Lodge DM. 1993. Biological invasions: lessons for Ecology. Trends in Ecology and Evolution, 8: 133-137. [ Links ]
Loreau M, Hector A. 2001. Partitioning selection and complementarity in biodiversity experiments. Nature, 412: 72-76. [ Links ]
Lovejoy TE. 1997. Biodiversity: What is it? En: Reaka-Kudla ML, Wilson DE, Wilson EO. Editores. Biodiversity 11: Understanding and Protecting Our Biological Resources. Washington D.C.: Joseph Henry Press. p. 7-14. [ Links ]
Lüthi D, Le Floch M, Bereiter B, Blunier T, Barnola J-M, Siegenthaler U, Raynaud D, Jouzel J, Fischer H, Kawamura K, Stocker TF. 2008. High-resolution carbon dioxide concentration record 650,000-800,000 years before present. Nature, 453: 379-82. [ Links ]
Mancera JE, Gavio B, Arencibia G. 2009. Floraciones algales nocivas, intoxicación por microalgas e impactos en el desarrollo regional: El caso de San Andrés isla, Caribe colombiano. Cuadernos del Caribe, 13: 46-62. [ Links ]
Maranda L, Corwin S, Hargraves P. 2007. Prorocentrum lima (Dinophyceae) in northeastern USA coastal waters II: Toxin load in the epibiota and in shellfish. Harmful Algae, 6: 632-641. [ Links ]
May RM. 1994. Biological diversity: Differences between land and sea. Philosophical Transactions of the Royal Society B, 343: 105-111. [ Links ]
McCook LJ. 2001. Competition between coral and algal turfs along a gradient of terrestrial influence in the nearshore central Great Barrier Reef. Coral Reefs, 19: 419-425. [ Links ]
McKinney LM. 1998. Is marine biodiversity at less risk? Evidence and implications. Diversity and Distributions, 4 (1): 3-8. [ Links ]
McLeod E, Salm R. 2006. Managing mangroves for resilience to climate change. Switzerland: IUCN, Gland. p. 64. [ Links ]
McManus JW, Polsenberg JF. 2004. Coral-algal phase shifts on coral reefs: ecological and environmental aspects. Progress in Oceanography, 60: 263-279. [ Links ]
Mee L. 2006. Reviving dead zones. Scientific American, 295 (5): 79-85. [ Links ]
Mejia LS, Acero A. 2002. Libro rojo de peces marinos de Colombia. La serie Libros Rojo de Especies Amenazadas de Colombia. Bogotá: INVEMAR -Universidad Nacional de Colombia-Ministerio de Medio Ambiente. p.174. [ Links ]
Mercurio P, Negri AP, Burns KA, Heyward AJ. 2004. The ecotoxicology of vegetable versus mineral based lubricating oils: 3. Coral fertilization and adult corals. Environmental Pollution, 129: 183-194. [ Links ]
Meyer KM, Kump LR. 2008. Oceanic euxinia in earth history: causes and consequences. Annual Review of Earth and Planetary Sciences, 36: 251-288. [ Links ]
Michaelidis B, Ouzounis C, Paleras A, Pörtner HO. 2005. Effects of long-term moderate hypercapnia on acid-base balance and growth rate in marine mussels Mytilus galloprovincialis. Marine Ecology Progress Series, 293: 109-118. [ Links ]
Miles H, Widdicombe S, Spicer JI, Hall-Spencer J. 2007. Effects of anthropogenic seawater acidification on acidbase balance in the sea urchin Psammechinus miliaris. Marine Pollution Bulletin, 54 (1): 89-96. [ Links ]
Miloslavich P, Díaz JM, Klein E, Alvarado JJ, Díaz C, Gobin J, Escobar-Briones E, Cruz-Motta JJ, Weil E, Cortés J, Bastidas AC, Robertson R, Zapata F, Martín A, Castillo J, Kazandjian A, Ortiz M. 2010. Marine biodiversity in the Caribbean: regional estimates and distribution patterns. PLoS ONE, 5 (8): e11916. [ Links ]
Molnar JL, Gamboa RL, Revenga C, Spalding MD. 2008. Assessing the global threat of invasive species to marine biodiversity. Frontiers in Ecology and the Environment, 6 (9): 485-492. [ Links ]
Mooney H, Hobbs R, editores. 2000. Invasive species in a changing world. Washington D.C.: Island Press. p. 457. [ Links ]
Mora C, Tittensor DP, Adl S, Simpson AGB, Worm B. 2011. How many species are there on earth and in the ocean? PLoS Biology 9 (8): e1001127. [ Links ]
Morris JA Jr, Akins JL. 2009. Feeding ecology of invasive lionfish (Pterois volitans) in the Bahamian archipelago. Environmental Biology of Fishes, 86: 389-398. [ Links ]
Morris JA Jr, Whitfield PE. 2009. Biology, ecology, control and management of the invasive indo-pacific lionfish: an updated integrated assessment. Beaufort (North Carolina): NOAA Technical Memorandum NOS NCCOS 99. [ Links ]
Mullon C, Fréon P, Cury P. 2005. The dynamics of collapse in world fisheries. Fish and Fisheries, 6: 111-120. [ Links ]
Munday P. 2004. Habitat loss, resource specialization, and extinction on coral reefs. Global Change Biology, 10: 1642-1647. [ Links ]
Myers RA, Worm B. 2003. Rapid worldwide depletion of predatory fish communities. Nature, 423: 280. [ Links ]
Nansingh P, Jurawan S. 1999. Environmental sensitivity of a tropical coastline (Trinidad, West Indies) to oil spills. Spill Science & Technology Bulletin, 5 (2): 161-172. [ Links ]
Negri AP, Heyward AJ. 2000. Inhibition of fertilization and larval metamorphosis of the coral Acropora millepora (Ehrenberg, 1834) by petroleum products. Marine Pollution Bulletin, 41: 420-427. [ Links ]
Nelson TA, Lee A. 2001. A manipulative experiment demonstrates that blooms of the macroalga Ulvaria obscura can reduce eelgrass shoot density. Aquatic Botany, 71: 149-154. [ Links ]
Nelson TA, Nelson AV, Tjoelker M. 2003. Seasonal and spatial patterns of ''green tides'' (ulvoid algal blooms) and related water quality parameters in the coastal waters of Washington State, USA. Botanica Marina, 46: 263-275. [ Links ]
O'Brien PY, Dixon PS. 1976. The effects of oils and oil components on algae: a review. British Phycological Journal, 11: 115-142. [ Links ]
Orr JC, Fabry VJ, Aumont O, Bopp L, Doney SC, Feely RA, Gnanadesikan A, Gruber N, Ishida A, Joos F, Key RM, Lindsay K, Maier-Reimer E, Matear R, Monfray P, Mouchet A, Najjar RG, Plattner GK, Rodgers KB, Sabine CL, Sarmiento JL, Schlitzer R, Slater RD, Totterdell IJ, Weirig MF, Yamanaka Y, Yool A. 2005. Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms. Nature, 437: 681-686. [ Links ]
Parmesan C. 2006. Ecological and evolutionary responses to recent climate change. Annual Review of Ecology, Evolution and Systematics, 37: 637-669. [ Links ]
Patrick R. 1997. Biodiversity: Why is it important? En: Reaka-Kudla M, Wilson DE. Wilson OE, editores. Biodiversity II. Washington D.C.: Joseph Herry Press. p. 15-24. [ Links ]
Paul VJ, Thacker RW, Banks K, Golubic S. 2005. Benthic cyanobacterial bloom impacts the reefs of South Florida (Broward County, USA). Coral Reefs, 24: 693-697. [ Links ]
Peck LS, Webb KE, Bailey DM. 2004. Extreme sensitivity of biological function to temperature in Antarctic marine species. Functional Ecology, 18: 625-630. [ Links ]
Peperzak L. 2003. Climate change and harmful algal blooms in the North Sea. Acta Oecologica, 24: S139-S144. [ Links ]
Perkins-Visser E, Wolcott TG, Wolcott DL. 1996. Nursery role of seagrass beds: enhanced growth of juvenile blue crabs (Callinectes sapidus Rathbun). Journal of Experimental Marine Biology and Ecology, 198: 155-173. [ Links ]
Petersen KS, Rasmussen KL, Heinemeler J, Rud N. 1992. Clams before Columbus? Nature, 359: 679. [ Links ]
Pimentel D, Lach L, Zuniga R, Morrison D. 2000. Environmental and economic costs of non-indigenous species in the United States. BioScience, 50: 53-65. [ Links ]
Pimentel D, Zuniga R, Morrison D. 2005. Update on the environmental and economic costs associated with alien-invasive species in the United States. Ecological Economics, 52: 273-288. [ Links ]
Politi Y, Arad T, Klein E, Weiner S, Addadi L. 2004. Sea urchin spine calcite forms via a transient amorphous calcium carbonate phase. Science, 306: 1161-1164. [ Links ]
Porter JW, Dustan P, Jaap WC, Patterson KL, Kosmynin V, Meier OW, Patterson ME, Parsons M. 2001. Patterns of spread of coral disease in the Florida Keys. Hydrobiologia, 460: 1-24. [ Links ]
Posey MH, Ambrose WG. 1994. Effects of proximity to an offshore hard-bottom reef on infaunal abundances. Marine Biology, 118: 745-753. [ Links ]
Rabalais NN, Harper Jr. DE, Turner RE. 2001. Responses of nekton and demersal and benthic fauna to decreasing oxygen concentrations. Coastal and Estuarine Studies, 58: 115-128. [ Links ]
Ramade F, Roche H. 2006. Ecotoxicological impingement of pollutants on coral reefs: a review. Revue d'Ecologie: La Terre et la Vie, 61 (1): 3-33. [ Links ]
Rasmussen C, Cuff C. 1990. Enhanced nutrient levels in the marine environment and the effects of coral reefs. Proceedings of the Fourth Pacific Congress on Marine Science and Technology, PACON 90. Tokyo. Vol. II, p. 13-20. [ Links ]
Reaka-Kudla ML. 1997. The global biodiversity of coral reefs: a comparison with rain forests. En: Reaka-Kudla ML, Wilson DE, Wilson EO, editores. Biodiversity II: understanding and protecting our biological resources. Washington D.C.: Joseph Henry Press. p. 83-108. [ Links ]
Rejmánková E, Komárková J. 2005. Response of cyanobacterial mats to nutrient and salinity changes. Aquatic Botany, 8: 87-107. [ Links ]
Riebesell U, Zondervan I, Rost B, Tortell PD, Zeebe RE, Morel FMM. 2000. Reduced calcification of marine plankton in response to increased atmospheric CO2. Nature, 407: 364-367. [ Links ]
Sabine CL, Feely RA, Gruber N, Key RM, Lee K, Bullister JL, Wanninkhof R, Wong CS, Wallace DW, Tilbrook B, Millero FJ, Peng TH, Kozyr A, Ono T, Rios AF. 2004. The oceanic sink for anthropogenic CO2. Science, 305: 367-71. [ Links ]
Sadiq M, McCain JC. 1993. The Gulf War aftermath: An environmental tragedy. Dordrecht: Kluwer Academic Publisher. p. 296. [ Links ]
Sala E, Knowlton N. 2006. Global marine biodiversity trend. Annual Review of Environment and Resources, 31: 93-122. [ Links ]
Sala OE, Chapin FS, Armesto JJ, Berlow E, Bloomfield J, Dirzo R, Huber-Sanwald E, Huenneke LF, Jackson RB, Kinzig A, Leemans R, Lodge D, Mooney HA, Oesterheld M, Poff NL, Sykes MT, Walker BH, Walker M, Wall DH. 2000. Global biodiversity scenarios for the year 2100. Science, 287: 1770-1774. [ Links ]
Seibel BA, Fabry VJ. 2003. Marine biotic response to elevated carbon dioxide. Advances in Applied Biodiversity Science, 4: 59-67. [ Links ]
Sellner KG, Doucette GJ, Kirkpatrick GJ. 2003. Harmful algal blooms: causes, impacts and detection. Journal of Industrial Microbiology and Biotechnology, 30: 383-406. [ Links ]
Sepkoski JJ. 1993. Ten years in the library: new data confirm paleontological patterns. Paleobiology, 19: 43-51. [ Links ]
Simberloff D. 1996. Impacts of introduced species in the United States. Consequences, 2 (2): 13-22. [ Links ]
Snelgrove PVR. 1999. Getting to the bottom of marine biodiversity: sedimentary habitats- ocean bottoms are the most widespread habitat on Earth and support high biodiversity and key ecosystem services. Bioscience, 49: 129-138. [ Links ]
Stein BA, Kutner LS, Adams JS. 2000. Precious heritage: the status of biodiversity in the United States. New York: Oxford University Press. p. 416. [ Links ]
Stielow S, Ballantine DL. 2003. Benthic cyanobacterial, Microcoleus lyngbyaceus, blooms in shallow, inshore Puerto Rican seagrass habitats, Caribbean Sea. Harmful Algae, 2: 127-133. [ Links ]
Stokes K, O'Neill K, McDonald RA. 2004. Invasive species in Ireland. Report to Environment & Heritage Service and National Parks & Wildlife Service. Belfast (Republic of Ireland): Environment & Heritage Service of the Department of Environment (Northern Ireland) and the National Parks and Wildlife Service of the Department of Environment, Heritage and Local Government (Republic of Ireland), Quercus (Northern Ireland's Research Centre for Biodiversity and Conservation Biology), and Queen's University, Belfast. p. 151. [ Links ]
Sumaila UR, Cisneros-Montemayor AM, Dyck A, Huang L, Cheung W, Jacquet J, Kleisner K, Lam V, McCrea- Strub A, Swartz W, Watson R, Zeller D, Pauly D. 2012. Impact of the Deepwater Horizon well blowout on the economics of US Gulf fisheries. Canadian Journal of Fisheries and Aquatic Sciences, 69: 499-510. [ Links ]
Swingland IR. 2001. Biodiversity, definition of. En: Levin SA, editor. Encyclopedia of biodiversity. San Diego (California): Academic Press. Vol. 1, p. 377-391. [ Links ]
Tagliapietra D, Pavan M, Wagner C. 1998. Macrobenthic community changes related to eutrophication in Palude della Rosa (Venetian Lagoon, Italy). Estuarine, Coastal and Shelf Science, 47: 217-226. [ Links ]
Takahashi EM, Arthur KE, Shaw GR. 2008. Occurrence of okadaic acid in the feeding grounds of dugongs (Dugong dugon) and green turtles (Chelonia mydas) in Moreton Bay, Australia. Harmful Algae, 7: 430-437. [ Links ]
Tewksbury JJ, Huey RB, Deutsch CA. 2008. Putting the heat on tropical animals. Science, 320: 1296-1297. [ Links ]
Thacker RW, Nagle DG, Paul VJ. 1997. Effects of repeated exposures to marine cyanobacterial secondary metabolites on feeding by juvenile rabbitfish and parrotfish. Marine Ecology Progress Series, 147: 21-29. [ Links ]
Thresher RE, Kuris AM. 2004. Options for managing invasive marine species. Biological Invasions, 6: 295-300. [ Links ]
Thrush SF, Dayton PK. 2002. Disturbance to marine benthic habitats by trawling and dredging - implications for marine biodiversity. Annual Review of Ecology and Systematics, 33: 449-473. [ Links ]
Thrush, SF, Gray JS, Hewitt JE, Ugland KI. 2006. Predicting the effects of habitat homogenization on marine biodiversity. 2006. Ecological Applications, 16 (5): 1636-1642. [ Links ]
Tilman D. 1999. The ecological consequences of changes in biodiversity: a search for general principles. Ecology, 80: 1455-74. [ Links ]
Titlyanov EA, Yakovleva IM, Titlyanova TV. 2007. Interaction between benthic algae (Lyngbya bouillonii, Dictyota dichotoma) and scleractinian coral Porites lutea in direct contact. Journal of Experimental Marine Biology and Ecology, 342: 282-291. [ Links ]
Tomascik T. 1991. Settlement patterns of Caribbean scleractinian corals on artificial substrata along a eutrophication gradient, Barbados, West Indies. Marine Ecology Progress Series, 77: 261-269. [ Links ]
Turner SJ, Thrush SF, Hewitt JE, Cummings VJ, Funnell G. 1999. Fishing impacts and the degradation or loss of habitat structure. Fisheries Management and Ecology, 6: 401-420. [ Links ]
Valiela I, Mcclelland J, Hauxwell J, Behr PJ, Hersh D, Foreman K. 1997. Macroalgal blooms in shallow estuaries: controls and ecophysiological and ecosystem consequences. Limnology and Oceanography, 42: 1105-1118. [ Links ]
Vermaat JE, Thampanya U. 2006 Mangroves mitigate tsunami damage: A further response. Estuarine, Coastal and Shelf Science, 69: 1-3. [ Links ]
Vitousek PM, Walker LR. 1989. Biological invasion by Myrica faya in Hawaii: plant demography, nitrogen fixation, ecosystem effects. Ecological Monographs, 59: 247-265. [ Links ]
Vitousek PM. 1992. Global environmental change: an introduction. Annual Review of Ecology and Systematics, 23: 1-14. [ Links ]
Vitousek PM, D'Antonio CM, Loope LL, Westbrooks R. 1996. Biological invasions as global environmental change. American Scientist, 84: 468-478. [ Links ]
Vitousek PM, D'Antonio CM, Loope L, Rejmanek M, West-Brooks R. 1997. Introduced species: a significant component of human-caused global change. New Zealand Journal of Ecology, 21: 1-16. [ Links ]
Walters CJ. 2003. Folly and fantasy in the analysis of spatial catch rate data. Canadian Journal of Fisheries and Aquatic Sciences, 60: 1433-1436. [ Links ]
Walton WC, MacKinnon C, Rodriguez LF, Proctor C, Ruiz GM. 2002. Effect of an invasive crab upon a marine fishery: green crab, Carcinus maenas, predation upon a venerid clam, Katelysia scalarina, in Tasmania (Australia). Journal of Experimental Marine Biology and Ecology, 272: 171-189. [ Links ]
Watkinson AJ, O'Neil JM, Dennison WC. 2005. Ecophysiology of the marine cyanobacterium, Lyngbya majuscula (Oscillatoriaceae) in Moreton Bay, Australia. Harmful Algae, 4: 697-715. [ Links ]
White HK, Hsing PY, Cho W, Shank TM, Cordes EE, Quattrini AM, Nelson RK, Camilli R, Demopoulos AWJ, German CR, Brooks JM, Roberts HH, Shedd W, M. Reddy CM, Fisher CR. 2012. Impact of the Deepwater Horizon oil spill on a deep-water coral community in the Gulf of Mexico. Proceedings of the National Academy of Sciences, 109: 20303-20308. [ Links ]
Whitfield PE, Hare JA, David AW, Harter SL, Muñoz RC, Addison CM. 2007. Abundance estimates of the Indo-Pacific lionfish Pterois volitans/miles complex in the Western North Atlantic. Biological Invasions, 9: 53-64. [ Links ]
Wilcove DS, Rothstein D, Dubow J, Phillips A, Losos E. 1998. Quantifying threats to imperiled species in the United States. BioScience, 48: 607-615. [ Links ]
Williams EH, Bunkley-Williams L, Peters EC, Pinto- Rodríguez P, Matos-Morales R, Mignucci-Giannoni AA, Hall KV, Rueda-Almonacid JV, Sybesma J, Bonnelly de Calventi I, Boulon RH. 1994. An epizootic of cutaneous fibropapillomas in green turtles Chelonia mydas of the Caribbean: part of a panzootic? Journal of Aquatic Animal Health, 6: 70-78. [ Links ]
Williamson M. 1996. Biological invasions. London: Chapman and Hall. p. 244. [ Links ]
Worm B, Barbier EB, Beaumont N, Duffy JE, Folke C, Halpern BS, Jackson JBC, Lotze HK, Micheli F, Palumbi SR, Sala E, Selkoe KA, Stachowicz JJ, Watson R. 2006. Impacts of biodiversity loss on ocean ecosystem services. Science, 314: 787-790. [ Links ]
WWF. 2007. Oil spill response challenges in Arctic waters. Report. Oslo (Noruega): WWF International Arctic Programme. p. 30. [ Links ]