Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.35 no.99 Medellín July/Dec. 2013
ARTÍCULOS DE INVESTIGACIÓN
MICROPROPAGACIÓN CLONAL DE TRES GENOTIPOS MORTIÑO, VACCINIUM MERIDIONALE SW., POR PROLIFERACIÓN DE YEMAS AXILARES
CLONAL MICROPROPAGATION OF THREE GENOTYPES OF MORTIÑO, VACCINIUM MERIDIONALE SW., BY AXILARY SHOOTS PROLIFERATION
Dagoberto Castro-Restrepo1; Jairo A. Álvarez-Guzmán2
1 Unidad de Biotecnología. Universidad Católica de Oriente. A. A. 008 Rionegro (Antioquia). investigacion.dir@uco.edu.co
Correos electrónicos: 2 investigacion.aux2@uco.edu.co.
Recibido: octubre 2012; aceptado: agosto 2013.
Resumen
El mortiño (Vaccinium meridionale Sw.) es una especie frutal de interés por su contenido de polifenoles. Para el fomento del cultivo se requiere una efectiva propagación masiva. Esta investigación tuvo por objetivo desarrollar un sistema de micropropagación de tres genotipos silvestres de mortiño mediante la proliferación de yemas axilares y su enraizamiento ex vitro. Para los ensayos de micropropagación se utilizaron como fuente de explantes miniestacas inducidas a través de podas. Después de estandarizar el protocolo de desinfección, se evaluó el efecto de diferentes concentraciones de 2-isopenteniladenina (2-iP) sobre la proliferación en el medio de cultivo basal WPM sobre la proliferación. El enraizamiento se realizó bajo condiciones ex vitro con ácido indolbutírico (AIB). En la etapa de proliferación se utilizó la concentración de 5 mg/l de 2-iP, que aunque presentó un menor número de brotes (2,1 a 1,7 por explante) respecto a la concentración de 20 mg/l de 2-iP, estos fueron de origen axilar y de mayor altura. Cada subcultivo se realizó con una periodicidad de 30 días. Estos brotes enraizaron entre el 66,6 y 80% bajo condiciones ex vitro con 2.000 mg/l de AIB y tuvieron una supervivencia del 82,7%. El proceso de enraizamiento ex vitro hasta la obtención de plantas competentes listas para sembrar en campo dura tres meses.
Palabras clave: aclimatización, brotes axilares, enraizamiento ex vitro, Vaccinium.
Abstract
Mortiño (Vaccinium meridionale Sw.) is an important small fruit specie valuable for its polyphenol content. Effective mass production of plants is needed for establishing commercial plantations. The objective of this research was to develop a system of micropropagation of three wild genotypes of mortiño by means of proliferation of axillary shoots and ex vitro rooting. Mini-cuttings induced through pruning were used as a source of explants for micropropagation. After standardizing the disinfection protocol, the effect of different concentrations of 2-isopenteniladenine (2-iP) was evaluated in the WPM culture medium in the proliferation phase. The rooting was carried out under ex vitro conditions with indolbutíric acid (IBA). In the proliferation stage, a concentration of 5 mg/l of 2-iP was used, although it produced a smaller number of buds (2.1 at 1.7 for explant) than a concentration of 20 mg/l of 2-iP, but they were of axillary origin and higher. Each subculture was carried out every 30 days. These buds took root between 66.6 and 80% under ex vitro conditions with 2.000 mg/l of AIB and they had a 82.7% survival rate. The time elapsed between the rooting of the buds and their transfer to the field was three months.
Key words: acclimatization, axillary shoots, ex vitro rooting, Vaccinium.
INTRODUCCIÓN
El género Vaccinium pertenece a la familia Ericaceae y tiene al menos 500 especies distribuidas en el mundo en 30 secciones (Vander Kloet y Dickinson 2009), algunas han sido domesticadas en Norteamérica y se conocen con el nombre de blueberry o arándano. En Colombia, la especie más conocida es Vaccinium meridionale Swartz, se identifica localmente con los nombres de mortiño o agraz. En la agenda del Ministerio de Agricultura y Desarrollo Rural se presenta el mortiño como una especie con potencial antioxidante para la industria de alimentos.
Uno de los principales factores que limita el fomento de muchas especies de Vaccinium es la falta de un sistema de propagación eficiente de materiales libres de plagas y enfermedades de manera masiva y en cortos periodos de tiempo. Tradicionalmente, los arándanos son propagados mediante el enraizamiento de estacas como lo informan Trevisan et al. (2008), no obstante, esta técnica es lenta y muchos genotipos no responden de manera apropiada a la formación de raíces como lo reporta Ostrolucká et al. (2004). Las desventajas de la reproducción sexual en esta especie son la variabilidad genética, bajo porcentaje de germinación, porcentajes de prendimiento fluctuantes y prolongada fase de juvenilidad de acuerdo con Vallejo (2000).
La propagación in vitro es una posibilidad alternativa para la reproducción de germoplasma seleccionado con características superiores, como lo demuestran para el caso del arándano Fukui et al. (1991), Gonzalez et al. (2000) y Tetsumura et al. (2008). La micropropagación en especies leñosas domesticadas se utiliza de manera rutinaria; pero, en especies que crecen de manera silvestre la utilización de explantes de árboles adultos tienen algunos problemas, entre ellos contaminación y baja respuesta morfogénica (McCown 2000, Pereira 2009).
Ostrolucká et al. (2004) lograron la regeneración de brotes a partir del cultivo de meristemos en Vaccinium corymbosum (L.) y V. vitis-idaea (L.) y encontraron que la proliferación de brotes fue dependiente tanto del tipo de citokinina, su concentración y el genotipo, donde la zeatina y la 2 - isopentenil adenina fueron las que mejores repuestas presentaron. Respecto a la inducción de raíces Jaakola et al. (2002), Eccher y Noé (1989) encontraron que el enraizamiento in vitro no ha sido efectivo para especies del género Vaccinium. Por tal razón, se utiliza el enraizamiento ex vitro bajo condiciones de cámara húmeda (Debnath 2005, Debnath y McRae 2002).
El presente trabajo tuvo por objetivo establecer un método de inducción y proliferación de yemas axilares, la formación de raíces adventicias bajo condiciones ex vitro y la aclimatización.
MATERIALES Y MÉTODOS
Selección de plantas madres. En el banco de germoplasma de Corpoica (Centro de Investigación – CI. La Selva) localizado en el municipio de Rionegro (Antioquia) a una altitud de 2.100 m, se seleccionaron tres genotipos caracterizados por sus rasgos morfológicos y calidad de sus frutos, para la realización de los experimentos de propagación bajo condiciones in vitro. Con el propósito de diagnosticar la presencia de patógenos virales se tomaron muestras de hojas y tallos y se efectuó un análisis mediante la prueba de ELISA para los virus: marchitez moteada del tomate (TSWV), virus de las manchas necróticas del género Impatiens (INSV), virus mosaico del pepino (CMV), virus mosaico del tabaco (TMVC) y la detección de partículas virales mediante microscopía electrónica.
Establecimiento bajo condiciones in vitro. Los explantes correspondieron a miniestacas originadas de brotes epicórmicos de 10 a 15 cm de longitud las cuales se dejaron en inmersión durante 24 horas en una solución de dióxido de cloro (2%). En condiciones de total asepsia se eliminaron las hojas y se dividieron en segmentos nodales con 3 a 5 yemas con un tamaño promedio de 4 cm, los cuales se sumergieron en etanol (70%) por un minuto, luego en hipoclorito de sodio (1%) durante 5 minutos, y posteriormente, en nitrato de plata 0,5% (p/v) por 5 minutos, finalmente, se efectuaron tres lavados con agua destilada estéril.
Con el propósito de buscar mayor eficiencia en los procesos de desinfección, se evaluó el uso del fungicida comercial carbendazim en el medio de cultivo a cuatro concentraciones: 0; 0,02; 0,05 y 0,1%. Se empleó un diseño experimental completamente al azar, con tres repeticiones compuesta por 15 unidades experimentales. Se evaluaron variables correspondientes a presencia de hongos y supervivencia in vitro 30 días después de la siembra.
El medio de cultivo consistió en las sales minerales de WPM (Lloyd y McCown 1981). Los constituyentes orgánicos incluyeron sacarosa (30 g/l) y carbón activado (0,05 g/l). El medio de cultivo se solidificó con agar gel-rite (2,4 g/l) se esterilizó en autoclave por 20 minutos a 122 °C y 15 libras de presión, el pH se ajustó previamente a 5,5 con KOH. Los cultivos se incubaron a 21 °C con un fotoperiodo de 12 horas luz/12 horas oscuridad. Como fuente de luz se utilizaron lámparas fluorescentes (75 μmoles. m-2. s-1).
Proliferación de brotes. Se utilizaron segmentos nodales con un tamaño promedio de 0,5 cm de largo. El medio de cultivo correspondió a las sales minerales WPM, sacarosa (30 g/l), vitaminas MS. Se empleó un experimento factorial con tres repeticiones compuestas por 15 unidades experimentales, donde el primer factor correspondió a cinco concentraciones de 2-iP: 0, 5, 10, 15 y 20 mg/l y el segundo a tres genotipos silvestres. Se evaluó el número de brotes por explante mayores a 0,5 cm de altura y la longitud promedia de los brotes.
Enraizamiento y aclimatización. Se emplearon brotes con una altura promedio de 3,5 cm, los cuales se mantuvieron durante 45 días en un medio de cultivo WPM sin reguladores de crecimiento y suplementado con carbón activado (0,1 g/l). Transcurrido este periodo de tiempo, se extrajeron los brotes del medio cultivo y sus bases se sumergieron durante 15 segundos en la auxina ácido indolbutírico (AIB) en: 0, 500, 1.000, 2.000 y 4.000 mg/l y se sembraron en bandejas de 72 alveolos, bajo una cubierta plástica transparente, el sustrato que se utilizó fue turba. Se empleó un experimento factorial con 60 repeticiones, donde el primer factor correspondió a cinco concentraciones de AIB y el segundo a tres genotipos silvestres. Luego los brotes se llevaron a condiciones de cámara húmeda con una temperatura promedio de 30 °C y humedad relativa del 95%; se evaluó el porcentaje de enraizamiento, longitud de raíces, número de raíces por planta y porcentaje de supervivencia para el día 30 después de la siembra. Luego las plántulas se sembraron en bolsas de polietileno para vivero de 17 x 17 cm para que estas continuaran su desarrollo.
Análisis estadístico de los datos. Los experimentos utilizados para determinar el efecto del carbendazim fueron en diseño completo al azar. Para la evaluación de la micropropagación se utilizó un experimento bifactorial (concentración de 2-iP, genotipos de mortiño) y el enraizamiento se empleó un experimento bifactorial (concentración de AIB, genotipos de mortiño). Los datos se analizaron estadísticamente por ANOVA y las medias se compararon mediante el test de Duncan a un nivel de significancia del 5%. El número de brotes y el porcentaje de enraizamiento se transformaron a raíz cuadrada. Todos los datos se evaluaron con la utilización de StatGraphics plus versión 8.0.
RESULTADOS
Material vegetal y establecimiento de cultivos in vitro. Las características de los frutos de las plantas madre de los genotipos seleccionados tuvieron longitud promedia de 1,6 a 2,0 centímetros, ancho de 1,52 cm y peso de 1,8 g, los sólidos solubles totales fueron de 15 a 20 °Brix y el pH de 2,5; lo cual los hace adecuados para los mercados nacionales de la fruta (Avila et al. 2007). Con relación al diagnóstico de virus las pruebas de ELISA indicaron que los materiales estuvieron libres de: TSWV, INSV, CMV y TMVC.
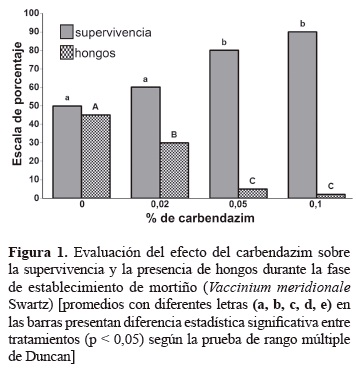
Evaluación de carbendazim para el establecimiento de estacas de mortiño. Contaminaciones por hongos y bacterias son los mayores problemas durante el establecimiento de explantes bajo condiciones in vitro. Para la prevención o control de contaminantes se emplean productos químicos entre ellos fungicidas y antibióticos (Carrazana et al. 1997). De acuerdo con los resultados presentados en la figura 1, el testigo sin carbendazim presentó el 45% de contaminación por los hongos Penicillium sp y Fusarium sp. La utilización del carbendazim en el medio de cultivo disminuyó la presencia de hongos, con concentraciones de 0,05 y 0,1% y la contaminación por hongos disminuyó entre el 5 y el 2%. Este aspecto, es importante cuando se compara con el testigo (sin carbendazim) donde el porcentaje de contaminación fue del 45%. Respecto a la supervivencia de los explantes durante la fase de establecimiento in vitro se logró que fuera mayor del 80% con estas dos concentraciones por efecto de una mayor asepsia de los explantes. Los brotes se formaron directamente en los entrenudos de las miniestacas (brotes axilares).
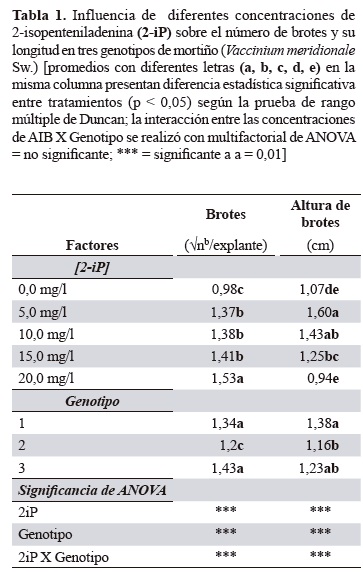
Proliferación de materiales mediante inducción de brotes múltiples. Se evaluó el efecto del 2-iP sobre la proliferación de brotes axilares obtenidos a partir de las microestacas. De acuerdo con los resultados obtenidos en este experimento (tabla 1), el análisis de varianza mostró que las concentraciones de 2-iP y el genotipo afectaron significativamente la respuesta de proliferación respecto al número de brotes y la altura, se presentaron además interacciones entre los dos factores evaluados.
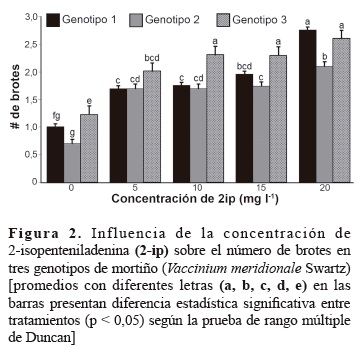
En la figura 2, se presentan las interacciones entre la concentración de 2-iP y los genotipos de mortiño, se observa que el número de brotes se incrementó al aumentar la concentración de 2-iP y que dependió del genotipo.
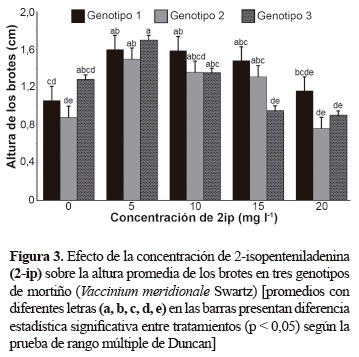
El genotipo 3 presentó el número mayor de brotes cuando el 2-iP se utilizó en concentraciones de 10, 15 y 20 mg/l, los genotipos 1 y 2 mostraron el número mayor de brotes cuando se empleó a 20 mg/l; sin embargo, a esta concentración los brotes presentaron altura promedio menor (figura 3). Además, las hojas fueron más pequeñas y hubo mayor presencia de callos con relación a las otras concentraciones, lo cual coincide con Debnath y McRae (2002), quienes observaron en arándanos que concentraciones de 2-iP mayores a 10 mg/l se produjeron brotes hiperhidratados y de baja altura.
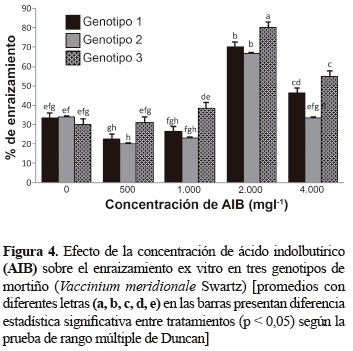
Enraizamiento y aclimatización. El enraizamiento ex vitro de los brotes en los tres genotipos de mortiño tuvo lugar entre los 30 a 40 días después de ser colocados en el sustrato en condiciones de cámara húmeda. Los resultados del análisis de varianza indican que para el porcentaje de plantas enraizadas hubo interacción entre las concentraciones de AIB y los genotipos (tabla 2). La concentración de 2.000 mg/l permitió obtener el 82,7% de supervivencia para los tres genotipos. La altura de los brotes se incrementó cuando se empleó el AIB en comparación con el testigo donde no se utilizó este regulador de crecimiento. El número de raíces no mostró diferencias significativas para los tratamientos evaluados.
De acuerdo con los resultados de la figura 4, en todos los casos se presentó formación de raíces; el porcentaje mayor de plantas enraizadas en los tres genotipos, se obtuvo con 2.000 mg/l de AIB, donde el genotipo 3 tuvo el 80% de enraizamiento. En los genotipos 1 y 2 el porcentaje de enraizamiento fue del 70 y 66%, respectivamente.
DISCUSIÓN
Garantizar que los materiales seleccionados se encuentran libres de virus, es un aspecto importante en la propagación clonal debido a que las infecciones virales pueden ser ampliamente diseminadas y una vez establecidas en un programa de propagación son difíciles de erradicar. En países productores de arándanos (V. corymbosum) la forma más efectiva para la prevención de enfermedades virales es la producción de materiales certificados libres de virus (Medina et al. 2006).
El carbendazim (bencimidazol 2-il carbamato de metilo) es el ingrediente activo de algunos fungicidas sistémicos utilizados para el control de enfermedades fungosas en campo (benomyl, fundazol, agrodazim, bavistin, chemcarb, delsene, entre otras). Cruz et al. (2002) lograron inhibir el crecimiento de hongos filamentosos contaminantes del cultivo in vitro de plantas con carbendazim, lo cual se pudo corroborar en el caso de los materiales de mortiño. Deberg et al. (1993) encontraron que el producto no se degradó durante el proceso de esterilización y que durante la fase de multiplicación no presentó efectos fitotóxicos hasta 160 μg/ml y que además puede presentar actividad similar a las citoquininas; estos resultados coinciden con los que se encontraron en este ensayo donde los brotes que se diferenciaron tuvieron un desarrollo normal y se mejoró la supervivencia por efecto de una mayor asepsia durante el establecimiento.
La respuesta de los genotipos a las diferentes concentraciones del 2-iP posiblemente está relacionada con los niveles endógenos de citoquininas. Un aspecto importante en los procesos de micropropagación es que además del número de brotes, estos tengan calidad referida a la altura y vigor de los brotes. En este sentido, utilizar el tratamiento correspondiente a 5 mg/l de 2-iP, garantiza lograr una proliferación adecuada (entre 1,7 a 2,01 brotes/explante según el genotipo) y altura mayor de sus brotes (1,5 a 1,7 cm). Al respecto, Marcotrigiano y McGlew (1991) en cultivos in vitro de arándano rojo (V. macrocarpon, Aiton) encontraron que concentraciones bajas de 2-iP produjeron mayor formación de brotes axilares y menos adventicios. En mortiño, las concentraciones bajas (1 a 5 mg/l) indujeron brotes axilares; es decir, que se originan a partir de tejidos meristemáticos. Concentraciones mayores desarrollaron brotes de origen axilar y adventicio (figura 5A). Esta situación aunque no se cuantificó en el caso de mortiño, se pudo evidenciar específicamente en la concentración de 20 mg/l donde se presentó mayor número de brotes adventicios, que de acuerdo con Litwinczuk y Wadas (2008) se desarrollan en lugares diferentes al explante original y son de tamaño menor (figura 5B). Algunos investigadores como De Klerk (1990) y Litwinczuk et al. (2005) encontraron que los brotes adventicios que se desarrollan in vitro pueden ser la principal fuente de variación somaclonal, y por lo tanto, se deben descartar en los procesos de micropropagación.
Para los genotipos evaluados, el enraizamiento in vitro presentó porcentajes inferiores al 10% (datos no mostrados), razón por la cual se evaluó el enraizamiento ex vitro; estos datos coinciden con los encontrados por Rache y Pacheco (2010) para mortiño, en los cuales no se formaron estructuras radiculares al utilizar diferentes auxinas y suplementos adicionados al medio de cultivo. En V. corymbosum y V. vitis-idaea el enraizamiento in vitro se logró con la utilización de AIB con porcentajes superiores al 80% (Jaakola et al. 2002, Meiners et al. 2007).
Respecto al enraizamiento de brotes in vitro, Ford et al. (2002) proponen que la auxina endógena ácido indolacético (AIA) desempeña un papel importante en el enraizamiento adventicio. El AIA endógeno se sintetiza en las partes apicales del tallo de la plantas (brotes apicales, hojas jóvenes) y son movilizadas de forma basipétala a través de la vía del transporte polar y se acumula, aunque quizás solo de forma transiente, en la base del esqueje.
En el mortiño, se encontró que el testigo sin la aplicación de la auxina presentó un 30% de enraizamiento para los tres genotipos. Fogaca y Neto (2005) confirman que las concentraciones endógenas y el transporte de las auxinas y sus moduladores afectan la respuesta de inducción radicular, lo cual permite explicar la formación espontánea de raíces en las plantas sin tratamiento con auxinas.
Cuando se utilizó AIB en la concentración de 2.000 mg/l se logró un rendiemiento óptimo de enraizamiento, con porcentajes entre el 66 y 80% de acuerdo al genotipo; la respuesta de inducción de raíces a esta concentración de AIB puede estar influenciada por su capacidad mayor de ser acropétalamente transportado en la raíz, que es la principal ruta de afluencia de las auxinas endógenas en la planta, junto con el transporte vía xilema según Fogaca y Neto (2005); aspecto que es apoyado por Rashotte et al. (2003), quienes demostraron que en la raíz existen dos formas diferentes de transporte polar. El primero, fluye de la base de la raíz hacia el ápice (acropétalo), y el segundo, fluye de la punta de la raíz hacia la parte superior (basipétalo).
Con mayor concentración, en este caso 4.000 mg/l, se presentó disminución del porcentaje de enraizamiento entre el 33 y 55%; se observó la presencia de oxidación en las bases de los esquejes, lo cual puede ser debido al incremento de actividades enzimáticas (peroxidasas y polifenoles) que producen necrosis de los tejidos vegetales de acuerdo con Qaddoury y Amssa (2004). De igual manera, la diferencia en respuesta a las diferentes concentraciones de auxinas pueden reflejar una variación en umbrales específicos que inician las respuestas de inducción o interfieren en el metabolismo de otras fitohormonas, entre ellas el etileno y las giberelinas como demostraron en sus investigaciones sobre interacciones hormonales Ross y O'Neill (2001).
Las raíces de mortiño que se formaron con el tratamiento de 2.000 mg/l de AIB se caracterizaron por tener adecuado desarrollo lateral, abundante formación de raicillas y una corona que permite la emisión de brotes basales (figuras 6A, B). Estas raíces juegan un papel importante en la rizosfera pues incrementa el área radical y disminuye el estrés durante la aclimatización. Después de esta fase, las plántulas desarrollaron una morfología de las hojas y brotes normal (figura 6C). Las plantas no han mostrado variaciones morfológicas detectables cuando se compararon con las plantas madres.
En conclusión, se desarrolló un protocolo para la multiplicación clonal in vitro del mortiño a partir de miniestacas originadas de brotes epicórmicos. Para la fase de establecimiento, se utilizaron segmentos nodales de 4 cm de longitud, los cuales se incubaron a 21 °C con un fotoperiodo de 12 horas luz/12 horas oscuridad durante treinta días. En la fase de proliferación, la utilización de 5 mg/l de 2-iP permitió inducir brotes axilares competentes para la micropropagación. Se logró una tasa de multiplicación entre 1,7 a 2,01 brotes por explante (dependiendo del genotipo) con una periodicidad de subcultivo cada 21 días. El enraizamiento alcanzó valores entre el 66 y 80% bajo condiciones ex vitro con la utilización de 2.000 mg/l de AIB con supervivencia superior al 80% durante la fase de aclimatización. Cada microestaca se subcultiva ocho veces durante un periodo de tiempo aproximado de cinco meses lo cual permite obtener hasta 1.000 brotes; posteriormente, se realiza el proceso de enraizamiento y desarrollo de las plántulas por tres meses, que comprende aproximadamente 30 días para la formación de las raíces y 60 días para tener plantas listas para llevar a campo.
AGRADECIMIENTOS
El presente manuscrito hace parte de los resultados del proyecto: ''Una nueva perspectiva de propagación agámica del mortiño Vaccinium meridionale Swartz a partir de plantas madres micropropagadas libres de patógenos'' gracias al cofinanciamiento del Ministerio de Agricultura y Desarrollo Rural (MADR) y el Fondo Nacional de Fomento Hortifrutícola (FNFH) y la ejecución de la Unidad de Biotecnología de la Universidad Católica de Oriente (UCO).
REFERENCIAS
Avila HG, Cuspoca JA, Fischer G, Ligarreto GA, Quicazán MC. 2007. Caracterización fisicoquímica y organoléptica del fruto de Agraz (Vaccinium meridionale Swartz) almacenado 1 a 2 °C. Revista Facultad Nacional de Agronomía Medellín, 60 (2): 4179-4193. [ Links ]
Carrazana D, León A, Herrera L, Alvarado Y, Quiñones R. 1997. Efecto de diversos fungicidas comerciales sobre hongos contaminantes en biofábricas. Centro Agrícola, 1: 61-66. [ Links ]
Cruz M, Acosta M, Leiva M, Alvarado Y, Lezcano M. 2002. Evaluación del efecto del complejo carbendazim-β- ciclodextrina para el control de hongos filamentosos contaminantes del cultivo in vitro de plantas. Biotecnología Vegetal, 2 (2): 73-76. [ Links ]
Deberg C, Coster G, Steubaut W. 1993. Carbendazim as an alternative growth regulator in tissue culture systems. In Vitro Cell Biology, 29 (2): 89-91. [ Links ]
Debnath SC. 2005. A two-step procedure for adventitious shoot regeneration from in vitro-derived lingonberry leaves: shoot induction with TDZ and shoot elongation using zeatin. HortScience, 40 (1): 189-192. [ Links ]
Debnath SC, McRae KB. 2002. An efficient shoot regeneration system on excised leaves of micropropagated lingonberry (Vaccinium vitis-idaea L.). Journal of Horticultural Science Biotechnology, 77 (6): 744-752. [ Links ]
De Klerk GJ. 1990. How to measure somaclonal variation. Acta Botanica Neerlandica, 39 (2): 129-144. [ Links ]
Eccher T, Noé N. 1989. Comparison between 2-iP and zeatin in the micropropagation of highbush blueberry (Vaccinium corymbosum). Acta Horticulturae, 241: 185-190. [ Links ]
Fogaca CM, Neto AF. 2005. Role of auxin and its modulators in the adventitious rooting of Eucalyptus species differing in recalcitrance. Plant Growth Regulation, 45 (1): 1-10. [ Links ]
Ford YY, Bonham EC, Cameron RWF, Blake PS, Judd HL, Harrison-Murray RS. 2002. Adventitious rooting:examining the role of auxin in an easy- and difficult-to- root plant. Plant Growth Regulation, 36 (2): 149-159. [ Links ]
Fukui H, Murakami Y, Harada T, Tamura T. 1991. Response of highbush blueberry axillary leaf bud apices to growth regulators and its seasonal changes. Memory Faculty Agriculture, Hokkaido University, 15: 1-6. [ Links ]
Gonzalez M, Lopez M, Valdes E, Ordas RJ. 2000. Micropropagation of three berry fruit species using nodal segments from fieldgrown plants. Annals of Applied Biology, 137 (1): 73-78. [ Links ]
Jaakola L, Tolvanen A, Laine K, Hohtola A. 2002. Micropropagation of bilberry and lingonberry. Acta Horticulturae, 574: 401-403. [ Links ]
Litwinczuk W, Szczerba G, Wrona D. 2005. Field performance of highbush blueberries (Vaccinium corymbosum L.) cv. 'Herbert' propagated by cuttings and tissue culture. Scientia Horticulturae, 106 (2): 162-169. [ Links ]
Litwinczuk W, Wadas M. 2008. Auxin-dependent development and habituation of highbush blueberry (Vaccinium covilleanum But. et Pl.) 'Herbert' in vitro shoot cultures. Scientia Horticulturae, 119 (1): 41-48. [ Links ]
Lloyd GB, McCown BH. 1981. Commercially feasible micropropagation of mountain laurel Kalmia latifolia by use of shoot tip culture. Procedure for International Plant Propagation Society, 30: 421-427. [ Links ]
Marcotrigiano M, McGlew SP. 1991. A two-stage micropropagation system for cranberries. Journal of the American Society for Horticultural Science, 116 (5): 911-916. [ Links ]
McCown BH. 2000. Recalcitrance of woody and herbaceous perennial plants: Dealing with genetic predeterminism. In Vitro Cellular and Developmental Biology, 36 (3): 149-154. [ Links ]
Medina C, Matus JT, Zúñiga M, San-Martín C, Arce-Johnson P. 2006. Occurrence and distribution of viruses in commercial plantings of Rubus, Ribes and Vaccinium species in Chile. Ciencia e Investigación Agraria, 33 (1): 23-28. [ Links ]
Meiners J, Schwab M, Szankowski I. 2007. Efficient in vitro regeneration systems for Vaccinium species. Plant Cell Tissue and Organ Culture, 89 (2): 169-176. [ Links ]
Ostrolucká MG, Libiaková G, Ondrusková E, Gajdosová A. 2004. In vitro propagation of Vaccinium species. Acta Universitatis Latviensis Biology, 676: 207-212. [ Links ]
Pereira MJ. 2009. Reversion to juvenility: the use of epicormics in the micropropagation of mature wild shrubs of Vaccinium cylindraceum Smith (Ericacaeae). Arquipélago Life and Marine Sciences, 26: 63-68. [ Links ]
Rashotte AM, Poupart J, Candace SW, Muday GK. 2003. Transport of the acid and indole -3-butiric acid, in Arabidopsis. Plant Physiology, 133: 761-772. [ Links ]
Qaddoury A, Amssa M. 2004. Effect of exogenous indole butyric acid on root formation and peroxidase and indole-3-acetic acid oxidase activities and phenolic contents in date Palm offshoots. Botanical Bulletin of Academia Sinica, 45 (2): 127-131. [ Links ]
Rache LC, Pacheco JM. 2010. Propagación in vitro de plantas adultas de Vaccinium meridionale (Ericaceae). Acta Botanica Brasilica, 24 (4): 1086-1095. [ Links ]
Ross J, O'Neill D. 2001. New interactions between classical plant hormones. Trends Plant Science, 6 (1): 2-4. [ Links ]
Trevisan R, Cezar RF, Fritsche RN, da Silva RG, Dias EG, Corrêa A. 2008. Enraizamento de estacas herbáceas de mirtilo: influência da lesão na base e do ácido indolbutírico. Ciência e agrotecnologia, Lavras, 32 (2): 402-406. [ Links ]
Vallejo DA. 2000. Fomento al mortiño (Vaccinium meridionale) como especie promisoria del Parque Regional Arví. Corantioquia. [ Links ]
Vander Kloet SP, Dickinson TA. 2009. A subgeneric classification of the genus Vaccinium and the metamorphosis of V. section Bracteata Nakai: more terrestrial and less epiphytic in habit; more continental and less insular in distribution. Journal Plant Research, 122 (3): 253-268. [ Links ]
Tetsumura T, Matsumoto Y, Sato M, Honsho Ch, Yamashita K, Komatsu H, Sugimoto Y, Kunitake H. 2008. Evaluation of basal media for micropropagation of four highbush blueberry cultivars. Scientia Horticulturae, 119 (1): 72-74. [ Links ]