Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.35 no.99 Medellín July/Dec. 2013
ARTÍCULOS DE INVESTIGACIÓN
CARACTERIZACIÓN ANATÓMICA CUALITATIVA DE LOS EJES CAULINARES EN LAS ESPECIES DE PIPER (L.), CLADO ENCKEA (PIPERACEAE)
QUALITATIVE CHARACTERIZATION OF THE STEM ANATOMY IN THE SPECIES OF PIPER L., ENCKEA CLADE (PIPERACEAE)
Mario A. Quijano-Abril1; Daniel Silva-Sierra2; Ricardo Callejas-Posada3
1 Docente, Grupo de Estudios Florísticos, Herbario Universidad Católica de Oriente. Rionegro (Antioquia), Colombia. maquijano@uco.edu.co.
2 Instituto de Biología, Universidad de Antioquia. Medellín (Antioquia), Colombia. dsilvasierra@me.com.
3 Docente, Instituto de Biología, Universidad de Antioquia. Medellín (Antioquia), Colombia. callejas542004@yahoo.com.
Recibido: diciembre 2012 ; aceptado: agosto 2013.
Resumen
Enckea es uno de los clados con distribución neotropical del género Piper (L.), compuesto por aproximadamente 80 especies que generalmente exhiben hábitos de crecimiento arbóreo, arbustivo, herbáceo y lianescente. Dicho clado es el único al interior de Piper que se distribuye en su mayoría en zonas de bosque seco tropical (BST), con un reducido número de especies distribuidas en bosque húmedo tropical (BHT) de Centro y Sur América. A pesar de la particular distribución de Enckea y de ser un elemento frecuente en el BST, no existen trabajos donde se describa de manera detallada la anatomía caulinar de sus especies. Esta información puede usarse para determinar la relación entre la presencia de estos caracteres anatómicos y el hábitat de las especies. En el presente estudio analizamos la anatomía de los ejes caulinares de 25 especies de Enckea, buscando variaciones morfológicas a nivel de hábitos de crecimiento y tipos de hábitat. Encontramos diferencias en los haces vasculares y tejidos de sostén entre las especies arbustivas y herbáceas, así como la presencia de una endodermis claramente diferenciada en algunas especies de BST. Se registra la presencia de aerénquima en Piper nudilimbum, una especie distribuida en llanuras aluviales de la Amazonía. Aunque se observó un considerable rango de variación morfológica, no hubo una clara diferenciación anatómica a nivel caulinar que permitiera diferenciar rigurosamente las especies de Enckea de BST de las de BHT.
Palabras clave: anatomía caulinar, Enckea, hábitat, hábito de crecimiento, Piper.
Abstract
Enckea is a clade of Piper (L.) with Neotropical distribution; it has approximately 80 species that generally show arboreal, arbustive, herbaceous, and lianescent growth habits. This clade is the only one in Piper with species living in tropical dry forests (TDF) and tropical wet forests (TWF) of Central and South America. Despite the unique distribution of Enckea and its commonness in the TDF, a detailed description of the stem anatomy of Enckea species is lacking. This information could be useful to determine the relationship between stem anatomy and habitat. Here we analyzed the stem anatomy of 25 Enckea species, looking for morphological variation in growth habits and habitat type. We found differences in vascular bundles and support tissues between arbustive and herbaceous species, as well as a clearly differentiated endodermis in some TDF species. A species distributed in Amazonian alluvian plains, Piper nudilumbum, showed aerenchyma. Despite the considerable morphological variation observed, there was no clear distinction in the stem anatomy between TDF and TWF species of Enckea.
Key words: Enckea, growth habit, habitat, Piper, stem anatomy.
INTRODUCCIÓN
Los actuales análisis filogenéticos moleculares han mostrado que algunos de los tratamientos taxonómicos tradicionales han dejado de tener validez y que muchos han sido modificados (APG I 1998, APG II 2003, APG III 2009, Jaramillo y Manos 2001, Randall et al. 1998, Shaw y Small 2005, Shaw et al. 2007). El reconocimiento del contraste entre la evidencia morfológica y molecular ha llevado a una minuciosa observación de caracteres morfológicos, al estudio de su plasticidad y a interpretar como estos caracteres pueden de alguna manera haberse originado independientemente y estar constantemente influenciados por el ambiente (Schlichting y Pigliucci 1998).
Los análisis anatómicos realizados para el género Piper (L.) han tenido diferentes objetivos y alcances. En estos se ha estudiado aspectos generales de su estructura caulinar; no obstante son pocos los trabajos que han realizado una descripción anatómica de clados específicos con el objetivo de abordar variaciones anatómicas a nivel de los diferentes hábitos de crecimiento y tipos de hábitat (Callejas 1986, Tepe et al 2007a, b).
Enckea es un clado del género Piper (Piperaceae) compuesto por aproximadamente 80 especies, las cuales generalmente son arbustos; no obstante un pequeño grupo puede exhibir hábitos de crecimiento lianecente. Las especies del clado exhiben una amplia distribución en el Neotrópico, las especies distribuidas en Centroamérica se encuentran a lo largo de las provincias biogeográficas del sur de Centroamérica (occidente del Istmo de Panamá, oriente de América Central, península de Yucatán, costa mexicana del Pacífico) y mucho más al norte en las vertientes mexicanas de las sierras Madre Occidental y Madre Oriental. Gran parte de las especies centroamericanas tienen afinidad por los bosques secos deciduos y subdeciduos tropicales, donde generalmente habitan en zonas abiertas o en limites de bosque, en alturas inferiores a los 1.000 m.s.n.m., con excepción de Piper santarosanum C. DC. y P. brevipedicellatum Bornst., los cuales se distribuyen hasta los 1.800 m.s.n.m. Las especies suramericanas se distribuyen a lo largo del piedemonte oriental y occidental de los Andes y un reducido número especies habitan los bosques húmedos de la provincia biogeográfica del Chocó y la Amazonía.
La primera descripción anatómica conocida para especies de Enckea fue realizada por C. de Candolle (1866) en su tratado sobre la familia Piperaceae, y esta a su vez fue la primera descripción anatómica conocida para el género Piper. En este análisis, el autor describe algunos caracteres estructurales a nivel de tallos, hojas y flores, no obstante, gran parte de la descripción fue basada en ejes caulinares. Una de las especies examinadas por Candolle fue P. unguiculatum Ruiz y Pav., con la cual propone algunos aspectos generales sobre la anatomía del género Piper. Algunos de los caracteres descritos hacían referencia a una zona medular rodeada de dos hileras de haces vasculares en diferentes estados de desarrollo, con una abundante cantidad de fibras, denominados por el autor como haces fibrovasculares. En algunos apartes de la diagnosis de Candolle describe la formación de un anillo de xilema hacia la periferia del tallo y la presencia de abundantes radios. Sin embargo, no explica el origen de este crecimiento secundario ni la formación de madera en las especies de Piper. Asimismo, el autor no discute acerca del hábitat de P. unguiculatum, ni como los caracteres anatómicos descritos podrían estar relacionados con el medio donde esta especie crece.
Esta especie, P. unguiculatum fue descrita originalmente en el tratado de la flora del Perú (Ruiz y Pavon 1794-1802) con material ánuco, en el piedemonte oriental de los Andes peruanos, en la provincia biogeográfica de la Puna de Morrone (2002). Las características ecológicas de esta zona son muy variables y en ellas existen pequeños enclaves de bosque seco tropical BST), donde crecen estos especímenes. De esta manera, se realizó la primera descripción anatómica de una especie del género Piper con base en material recolectado de una especie de BST. No obstante, ninguno de los análisis morfológicos posteriores para especies del género discutió las posibles variaciones a nivel anatómico que podrían existir entre especies de Piper distribuidas en BST y bosque húmedo tropical (BHT).Los análisis anatómicos posteriores se limitaron a describir algunos caracteres relevantes de morfología descriptiva y orientación de los haces vasculares. Gran parte de estos trabajos se dirigieron a explicar el origen y presencia de la doble capa de haces vasculares presente en algunos géneros de Piperaceae, tales como Piper y Peperomia, así como en Saururaceae, más específicamente en Saururus (Burguer 1977, Carlquist 1961, Datta y Dasgupta 1977a, b, 1979, Hoffstadt 1916, Johnson 1902, Metcalfe y Chalk 1950, Patel y Bowles 1980, Schmitz 1871, Van Tieghem 1891, Wveiss 1876).
El primer estudio anatómico realizado para un clado neotropical de Piper fue propuesto por Callejas (1986), en este trabajo se realizó una descripción morfológica para las especies del clado Ottonia, sin embargo, el autor no se refiere al papel de estos caracteres en la ecología de las especies del grupo. Además del trabajo de Callejas (1986), existen otros trabajos anatómicos realizados para clados específicos, como los de Tepe et al. (2007a, b), efectuados para especies de Piper pertenecientes al clado Macrostachys. Las especies de Macrostachys se caracterizan por exhibir hábitos de crecimiento arbustivo y en algunas ocasiones arbóreos, así como por tener relaciones mutualistas con hormigas del género Pheidole (Fischer et al. 2003). Las contribuciones sobre la anatomía del clado Macrostachys se enfocaron en la descripción de domacios y algunas otras adaptaciones morfológicas en tallos y pecíolos, que permiten el alojamiento de los insectos. No obstante, en estos trabajos no se explora el desarrollo del crecimiento secundario, ni se realiza una descripción anatómica general para las especies del clado.
En el presente estudio, se propone una descripción anatómica caulinar para las especies del clado Enckea. Además, se realizaron comparaciones en cuanto a la presencia y variación de ciertos caracteres anatómicos, entre especies con distribución en bosque seco versus en bosque húmedo, y entre especies con hábitos de crecimiento arbustivo, herbáceo y lianescente.
MATERIALES Y MÉTODOS
Área de estudio. Las áreas donde se recolectó el material de las especies para el presente análisis son de formaciones de bosque seco tropical (BST) y bosque húmedo tropical (BHT), de países como: México, El Salvador, Costa Rica, Panamá, Colombia y Perú (tabla 1). Estas formaciones fueron delimitadas con base en diferentes sistemas de clasificación de zonas de vida (Bullock et al. 1995, Holdridge 1967, Pennington et al. 2000, 2004).
Taxones. Las especies estudiadas para el presente estudio fueron seleccionadas con base en su distribución en diferentes zonas de vida, con el objetivo de obtener un muestreo representativo del clado Enckea. Asimismo, se incluyeron especies con diferentes hábitos de crecimiento, y de esta manera, obtener información de posibles variaciones anatómicas. El muestreo de los especímenes fue selectivo, con el fin de incluir en el análisis el mayor número de especies representantes de cada uno de los clados propuestos en análisis filogenéticos previos para Enckea (Jaramillo y Manos 2001, Jaramillo et al. 2008, Quijano-Abril 2009). De cada especie se seleccionaron dos muestras de los especímenes para realizar los cortes anatómicos.
En resumen, en el presente trabajo se utilizaron muestras de 21 especies de Piper pertenecientes al clado Enckea, procedentes de diferentes colecciones botánicas: Herbario Universidad de Antioquia (HUA), Missouri Botanical Garden (MO) y Herbario Nacional (UNAM). Asimismo se recolectó material de campo para cuatro especies (Piper ceanothifolium; P. reticulatum; P. tenue; Piper sp. nov 2), para un total de 25 especies (tabla 1).
Análisis. A cada uno de los especímenes se le tomaron datos de las siguientes variables: hábito de crecimiento, altura total, altitud sobre el nivel del mar, zona de vida y una descripción del sitio de recolección. El material recolectado en el presente análisis fue depositado en el Herbario de la Universidad Católica de Oriente (HUCO) y el Herbario de la Universidad de Antioquia (HUA).
Para las muestras de herbario se realizó un proceso de rehidratación, calentando el material en agua o utilizando una serie de alcoholes en concentraciones descendentes, desde alcohol al 100%, hasta agua. Tanto las muestras procedentes de herbario, como las recolectadas en campo fueron preservadas en una solución de formaldehído-alcohol-acido acético (FAA). Los cortes histológicos de cada uno de los tallos fueron realizados manualmente a nivel del quinto entrenudo tomando como referencia el ápice de cada individuo.
Todas las muestras fueron teñidas utilizando una solución de azul de toluidina acida al 1% en solución acuosa y para la visualización de los cortes se empleó un microscopio óptico compuesto de serie CX21 Olympus. Cada uno de los montajes fue fotografiado con una cámara digital Panasonic Lumix DMC-FS12, solamente con el lente óptico de dicha cámara. Para la selección de caracteres a nivel de xilema y floema se utilizó como guía el manual de la Asociación Internacional de Anatomistas de la Madera (IAWA Committee 1989). Finalmente, se elaboraron las descripciones anatómicas para las especies del clado Enckea, basadas en la organización y distribución de los tejidos corticales, epidérmicos, medulares y vasculares.
RESULTADOS
Con base en el análisis anatómico se propone una descripción anatómica caulinar para las especies del clado Enckea:
Hábito hierbas, arbustos y lianas. Epidermis 1-2 series de células, sin espacios intercelulares. Tricomas pluricelulares filiformes de ramificación simple. Presencia de idioblastos. Células epidérmicas en algunas ocasiones con pared celular secundaria y abundantes cantidades de lignina (figura 1A, B, C).
Peridermis cuando presente claramente estratificada y en algunas especies formando lenticelas en ejes maduros (figura 2C). Felema dispuesto en series compactas con un grosor variable. Felógeno de 2-4 series de células. Felodermis de 1-2 series de células, sin espacios intercelulares, similares en forma y contenido celular a las células del parénquima cortical (figura 2A, B).
Córtex de 5-9 series de células de espesor, caracterizado por la abundante acumulación de sustancias ergásticas y cristales de oxalato de calcio a manera de drusas y rafidios. Células de parénquima cortical dispuestas de manera compacta sin espacios intercelulares, en algunas especies formación de canales de mucílago e idioblastos (figura 3A y B). Presencia de parénquima fotosintético no estratificado en especies herbáceas. Fibras esclerenquimáticas claramente estratificadas con respecto al colénquima, ubicadas al interior o en la periferia de dicho tejido (figura 4A). Colénquima tipo de angular (figura 5B), formando paquetes a lo largo de la periferia cortical y ausente en tallos con crecimiento secundario.
Sistema vascular compuesto por haces vasculares de tipo colateral abierto, periféricos de 22-32 y medulares de 6-10 unidades, sin formación de anillos de crecimiento (figura 6A).
Los haces vasculares periféricos, alargados, alternando en tamaño (figuras 7A, 8B); mientras los haces vasculares medulares de menor tamaño y constantes en su longitud (figura 6A, B). Tráqueas y traqueidas organizadas de forma irregular, con disposición diagonal o radial, solitarias y redondeadas. Parénquima radiomedular procumbente con un número variable de series de células entre haces vasculares contiguos y con acumulaciones de plastos a nivel citoplasmático (figura 9A, B, C). Parénquima axial apotraqueal difuso. Fibras xilemáticas con acumulaciones diferenciales de lignina formando estratos (figura 7B, C).
Médula presente en todas las especies evaluadas. Parénquima fundamental con acumulaciones de sustancias ergásticas o inclusiones de oxalato de calcio (figura 10C). Presencia de campos de puntuaciones secundarias y en algunas especies formación de parénquima esclerótico o de braquiesclereidas (figura 10B, D).
Características como el alargamiento de los haces vasculares, presencia de colénquima angular y acumulación de sustancias ergásticas en el parénquima radiomedular fueron constantes en todas las muestras de las especies y consideradas en trabajos previos para el género Piper (Carlquist 1961, Johnson 1902, López-Naranjo 1998, Metcalfe y Chalk 1950). Además, fueron señalados algunos caracteres que solo están presentes en ciertas especies, dichos caracteres podrían estar relacionados con su hábitat. Este fue el caso de P. nudilimbum C. DC., donde se observa abundante aerénquima a nivel cortical. Igualmente la presencia de células epidérmicas con paredes lignificadas, agrupaciones de esclereidas a nivel cortical y la endodermis claramente diferenciada fueron algunos de los caracteres poco comunes en el clado.
Tejido epidérmico. En la mayoría de especies de Enckea, las ramas adultas poseen una epidermis finamente estriada e irregularmente fistulosa, pero sólida a nivel de los nudos caulinares, la cual se encuentra conformada generalmente por 1-2 series de células formando capas relativamente pequeñas, de forma irregular sin espacios intercelulares (figura 1A, B, C). Cuando presentes los tricomas suelen ser pluricelulares, filiformes de 4-5 series de células sin acumulaciones de sustancias o fluidos. La cutícula generalmente es de menor grosor que las células epidérmicas, pero en especies que habitan bosques secos suele ser mucho más gruesa, en comparación con las especies de bosques húmedos. En algunas ocasiones, las paredes celulares de las células epidérmicas se encuentran lignificadas. Esta lignificación fue encontrada tanto en especies de bosque seco, como de bosques mesófilos con una alta humedad relativa. No existen trabajos sobre anatomía de Piper que registren esta lignificación en la epidermis, razón por la cual se desconoce el origen de su desarrollo y su contribución al sostén de la planta (figura 1C). Los estomas caulinares de algunas especies son reemplazados por lenticelas, las cuales pueden ser abundantes en tallos leñosos (figura 2C). La peridermis en las especies del clado Enckea se forma tempranamente a nivel de ejes caulinares, reemplazando la epidermis. Dicho conjunto de tejidos está conformado por una capa de felógeno de 2-4 series de células de espesor. En algunas especies es común la formación de estratos consecutivos de felógeno, por esta razón se puede observar la formación de varias series células claramente diferenciados a nivel del súber (figura 2B).
Córtex. En las especies leñosas con alta densidad de haces vasculares periféricos o de vasos por haz vascular, el córtex tiende a ser más o menos homogéneo y sencillo en su estructura. Al contrario, en las especies herbáceas con baja densidad de haces vasculares periféricos o de vasos por haz vascular, el córtex tiende a ser bastante heterogéneo, encontrándose varios tipos de parénquima, mayor cantidad de fibras y paquetes de colénquima (López-Naranjo 1997, 1998). En las especies de Enckea la región cortical está claramente demarcada y puede ser variable en grosor con relación al habito de crecimiento y desarrollo del tallo. Las células parenquimatosas corticales generalmente acumulan sustancias ergásticas de diferente tipo. En gran parte de las muestras de las especies evaluadas fue común la presencia de idioblastos, los cuales se distribuyen de manera aleatoria a lo largo de la región cortical (figura 3B).
En los tallos evaluados el parénquima cortical está conformado por 5-9 series de células, sin espacios intercelulares. Es común, la presencia de parénquima fotosintético no estratificado en las especies herbáceas, este tejido desaparece en las especies con crecimiento secundario. En algunos casos, las acumulaciones de parénquima cortical están conformadas por células distribuidas espaciadamente dejando grandes espacios intercelulares, esta configuración es similar a la presente en el aerénquima. La presencia de aerénquima en especies de Piper no es informada en previos trabajos anatómicos; no obstante existen algunas especies amazónicas distribuidas en zonas inundables que presentan esta característica a nivel cortical, como es el caso de P. coruscans Kunth, perteneciente al clado Rádula (figura 11A), esta especie crece en llanuras aluviales y en las márgenes de ríos. En las especies de Enckea el tejido aerenquimático no es muy común, salvo en P. nudilimbum, una especie que habita bosques amazónicos inundables (figura 11B).
En la parte más superficial del córtex es usual encontrar tejido colenquimático angular con acumulaciones de sustancias ergásticas o plastos, el cual se organiza en paquetes discontinuos de tamaño similar (figura 5B). No obstante, en algunas especies de Piper pertenecientes a otros clados, este tejido conforma un anillo continuo en la periferia del tallo como es el caso de P. montanum C. DC. especie perteneciente al clado Peltobryon, dicho tejido colenquimático desaparece a medida que avanza el crecimiento secundario en especies arbustivas o lianecentes (Silva y Quijano 2010). El esclerénquima cortical cuando presente se dispone aleatoriamente al interior de los paquetes de colénquima o rodea este tejido conformando bandas de 2-3 series de células, las cuales pueden limitar con el parénquima cortical, sistema vascular periférico o con la endodermis. En algunas especies es común la presencia de braquiesclereidas, las cuales se distribuyen en el límite entre el córtex y el sistema vascular periférico (figura 4B, C). En algunas ocasiones estas células están ubicadas de manera aleatoria en el córtex y en otras limitan con el cambium interfascicular y el parénquima radiomedular.
En las especies de Enckea, como en algunas otras especies de Piper los tejidos corticales de soporte y protección usualmente están situados frente a los haces vasculares periféricos de mayor diámetro, los cuales forman las costillas o estrías del tallo, pero quedan interrumpidos frente a las regiones interfasciculares. Según López-Naranjo y Parra (1993), esta organización común entre las especies leñosas y semileñosas, le proporciona cierta estabilidad a la epidermis y al córtex, evitando su ruptura durante el crecimiento secundario (figura 12A, B). En algunas especies las regiones interfasciculares se esclerotizan secundariamente, por el contrario en especies herbáceas el esclerénquima forma un anillo continuo y cerrado entorno del sistema vascular periférico.
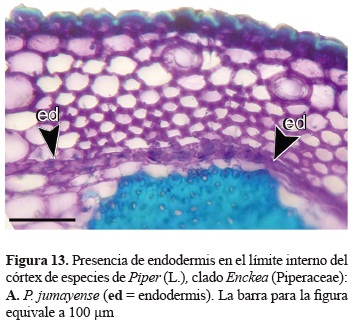
La presencia de endodermis en los tallos de Piper ha sido referenciada con anterioridad por Bond (1931), no obstante en el clado Enckea este tejido se observó generalmente en las especies de bosque seco. La endodermis está conformada por un anillo continuo con una sola serie de células, de forma rectangular que se encuentra en el límite interno del córtex (figura 13). Algunos trabajos anatómicos han documentado la transformación de las células de la endodermis y la posterior acumulación de granos de almidón a nivel citoplasmático, que dan origen a una vaina amilífera claramente diferenciada en especies de este género (López- Naranjo y Parra 1993), en el presente trabajo la aparición de dicha vaina no ha sido evidente.
DISCUSIÓN
De acuerdo con las observaciones realizadas, la organización de los tejidos a nivel del córtex en las especies de Enckea es congruente con lo observado en otras especies de Piper pertenecientes a diferentes clados (Quijano- Abril y Silva-Sierra 2010):
1) Epidermis con solo un estrato de células, colénquima formando un cordón discontinuo, fibras esclerenquimáticas y parénquima fotosintético (común en hierbas, arbustos o lianas).
2) Epidermis con 1-2 estratos de células lignificadas o con acumulaciones gruesas de cutícula, colénquima formando un cordón discontinuo, fibras esclerenquimáticas y parénquima fotosintético (común en hierbas, arbustos y lianas).
3) Peridermis de 3-5 series de células, colénquima formando un cordón discontinuo, fibras esclerenquimáticas y endodermis (común en arbustos y lianas de bosque seco).
4) Peridermis de 3-5 series de células, parénquima de reserva y endodermis (común en arbustos y lianas de bosque seco).
5) Peridermis con más 5 series de células, presencia de lenticelas y parénquima de reserva (común en arbustos y lianas de bosque húmedo).
En las especies de Enckea así como en el resto de especies de Piper es clara la estratificación existente a nivel vascular, conformándose dos grupos de haces vasculares con características similares, los cuales han sido denominados en trabajos previos, como sistema vascular periférico (SVP) y sistema vascular medular (SVM) (de Candolle 1866, Hoffstadt 1916, Ravindran y Remasshree 1998) (figura 6A). Generalmente el SVP ocupa mayor área a nivel de tallos y sufre alargamiento en especies que exhiben crecimiento secundario, mientras el SVM está compuesto por pequeños haces vasculares los cuales pueden variar en número, tamaño y ubicación con respecto a la médula. Asimismo, pueden variar su organización con respecto al segmento del eje caulinar donde se encuentren, observando de esta manera grandes diferencias en la disposición de los haces vasculares medulares a nivel de nudos y entrenudos. Algunos trabajos han descrito que estas diferencias se deben a que los haces vasculares medulares generalmente vascularizan las inflorescencias, mientras los haces vasculares periféricos son los encargados de la vascularización caulinofoliar periférica y la vascularización procambial de las segmentos intrapeciolares (López-Naranjo y Parra 1993).
Eames y MacDaniels (1953), han descrito la anatomía de las especies de Piper como típica de un crecimiento anómalo, debido al alargamiento producido a nivel de los haces vasculares periféricos, los cuales no son continuos, ni forman anillos de crecimiento. Aunque la formación de anillos en el xilema no es claramente diferenciada en todas las especies de Piper, en las especies de Enckea fue común identificar acumulaciones diferenciales de lignina a nivel de las células del parénquima apotraqueal y fibras acompañantes del xilema, dicho fenómeno semeja la formación insipiente de anillos de crecimiento (figura 7B, C).
El crecimiento anómalo es común en especies de algunas familias como Aristolochiaceae, Bignoniaceae, Malpighiaceae y Menispermaceae, las cuales exhiben hábitos de crecimiento que propician este fenómeno estructural (Angyalossy et al. 2011). En familias del orden Piperales, este tipo de crecimiento ha sido encontrado en géneros como Aristolochia y Manekia (Acevedo-R. 2005, Isnard et al. 2012). En las especies de Enckea fue común encontrar este tipo de crecimiento a nivel de tallos, y además, otros trabajos han mostrado que en raíces esta organización se mantiene. Algunos autores consideraron anómala la estructura caulinar primaria y el cuerpo leñoso de Piper debido a la vascularización manifiesta de la médula, y por el crecimiento secundario excéntrico del cambium vascular, como ocurre en algunas especies de lianas (Chalk y Chattaway 1937, López-Naranjo y Parra 1993, Metcalfe y Chalk 1950).
En las especies de Enckea los haces vasculares, tanto del SVP como del SVM, son de tipo colateral abierto (figuras 6B, 7C), sin embargo, en el SVP los haces sufren un alargamiento continuo a medida que aumenta el grosor del tallo, mientras que los haces del SVM permanecen constantes en su tamaño. En algunas especies del orden Piperales como Macropiper excelsum Miq., Piper gorgonillense Trel. y Yunck., y algunas especies del género Aristolochia ha sido registrado el alargamiento de los haces vasculares periféricos, seguido de una bifurcación del xilema en su parte más distal (Isnard et al. 2012, Patel y Bowles 1980). Este patrón ha sido explicado como una segunda fase de crecimiento a partir de la formación, de lo que según Patel y Bowles (1980) se denominan radios primarios, los cuales conforman a medida que avanza el crecimiento lateral, dan lugar a radios secundarios en el SVP. En las especies analizadas solo se encontró este patrón de bifurcación del SVP en la especie P. reticulatum L. (figura 7D), donde se exhibe en algunos de sus haces del SVP dicho patrón de bifurcación. Igualmente fue común la presencia numerosos haces vasculares cuyo número puede variar de 22-32; a diferencia del SVM donde el número varía de 5-9. En todas las especies fue común encontrar alternancia de tamaño entre haces vasculares consecutivos del SVP, notándose una disminución en cuanto al número de vasos en los haces vasculares de menor tamaño (figura 8A, B, C). En todas las especies evaluadas el SVP y SVM presentan casquetes o fibras pericíclicas asociadas tanto al floema como al xilema, compuestas de 2-9 series de células. Estos casquetes pueden variar en su densidad o en las acumulaciones de lignina a nivel de la pared celular. En los haces del SVP esta disposición de las fibras pueden formar una serie continua de células a modo de anillo hacia la periferia de la médula (figura 10A).
A nivel vascular el procambium está formado por 2-3 series de células de forma rectangular o irregular. En el SVP estas células limitan con las del cambium interfascicular formando un cordón aparentemente continuo. El cambium vascular en las especies de Piper se origina en el SVP, mediante la integración del cambium fascicular y el cambium interfascicular. No obstante, el crecimiento en grosor en ejes basales no es debido a la formación de anillos de xilema, como en gran parte de las especies leñosas de otros grupos de angiospermas, si no a la formación de series de parénquima radiomedular, las cuales en algún momento de su desarrollo sufren esclerotización a nivel de las paredes secundarias. Esta esclerotización de dichos radios de parénquima, podría intervenir en el sostén de los ejes de forma similar a la que dan los anillos de crecimiento xilemáticos en cualquier planta con crecimiento secundario (Isnard et al. 2012). En algunas especies de Enckea como P. abalienatum Trel. fue común encontrar además un fenómeno de esclerotización a nivel del parénquima medular, el cual podría en algún momento intervenir en el soporte de la planta (figura 10B), además en Piper sp. nov 2, algunas de las células de la médula son esclereidas del tipo braquiesclereidas y exhiben campos de puntuaciones secundarias en sus paredes (figura 10D).
En el clado Enckea las células del cambium interfascicular generalmente se componen de 1-15 series de células de forma irregular, formando parénquima radiomedular esclerótico; este último de 1-12 series células entre haces vasculares consecutivos y de 3-20 series células entre el punto de origen del cambium interfascicular y el parénquima medular (figura 9A, B, C). En algunas especies fue común la presencia de plastos o sustancias ergásticas a nivel citoplasmático en este tipo de células.
Luego de evaluar la totalidad de las especies, la organización el SVP fue constante en los hábitos de crecimiento arbustivo, arbóreo y lianescente. Sin embargo, en las especies herbáceas no existe un alargamiento a nivel del SVP, asimismo en dichas especies la región cortical presentó una mayor área. En especies lianecentes paleotropicales de Piper diferentes a Enckea, existe una marcada diferencia en la organización del SVP variando notablemente algunos caracteres entre estos el tamaño del haz vascular, así como la densidad y diámetro de los vasos. Análisis comparativos de anatomía caulinar en diferentes especies de lianas y arboles han explicado estas diferencias como adaptaciones morfológicas para optimizar el transporte de agua, rápido crecimiento y sostén (Ewers y Fisher 1989, Ewers et al. 1997, Gasson y Dobbins 1991).
Los caracteres anatómicos de los ejes caulinares evaluados en el presente trabajo, no permiten una clara diferenciación entre las especies que habitan bosques secos, con respecto a las especies de bosques húmedos. No obstante, la presencia de una endodermis claramente diferenciada y la posible formación de una vaina amilífera deberían analizarse en detalle. Trabajos como el propuesto por Quijano-Abril (2009), han mostrado variaciones morfológicas a nivel foliar en especies de Enckea de bosques secos, como caracteres estructurales del pericarpio en frutos y morfología floral. Estos caracteres podrían suministrar mayor información sobre las adaptaciones anatómicas de este grupo de especies al bosque seco tropical.
AGRADECIMIENTOS
Los autores agradecen muy especialmente al herbario de la Universidad de Antioquia (HUA) y a su grupo de trabajo por la colaboración logística y el suministro de material vegetal para la realización del presente trabajo. A la Unidad de Investigación y Desarrollo y el herbario de la Universidad Católica de Oriente por haber financiado el presente proyecto. Asimismo los autores agradecen las valiosas observaciones realizadas al articulo de dos revisores anónimos.
REFERENCIAS
Acevedo-R P. 2005. Vines and climbing plants of Puerto Rico and the Virgin Islands. Vol. 51. Washington (U. S. A): National Museum of Natural History Press. p. 483. [ Links ]
Angyalossy V, Angeles G, Pace MR, Lima AC, Dias LG, Madero C. 2011. An overview on the anatomy, development and evolution of the vascular system of lianas. Plant Ecology and Diversity, 5 (2): 1-16. [ Links ]
APG. 1998. An ordinal classification for the families of flowering plants. Annals Missouri Botanical Garden, 85: 531-553. [ Links ]
APGII. 2003. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG II. Botanical Journal of the Linnean Society, 141: 399-436. [ Links ]
APGIII. 2009. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG III. Botanical Journal of the Linnean Society, 161: 105-121. [ Links ]
Bond G. 1931. The stem endodermis in the genus Piper. Transactions of the Royal Society of Edinburgh, 56: 695-724. [ Links ]
Bullock SH, Mooney HA, Medina E. 1995. Seasonally dry tropical forests. Cambridge University Press, New York. p. 450. [ Links ]
Burger W. 1977. The Piperales and the monocots; alternate hypotheses for the origin of monocotyledoneous flowers. The Botanical Review, 43 (3): 345-387. [ Links ]
Callejas R. 1986. Taxomonic revision of Piper subgenus Ottonia (Piperaceae) (South America) [Ph. D. thesis]. [New York (U. S. A.)]: City University of New York. p. 512. [ Links ]
de Candolle CM. 1866. Mémoire sur la famille des Pipéracées. Tiré des Mémoires de la Société de Physique et d'Histoire Naturelle de Genéve, tome XVIII, 2mo partie. Genéve: Imprimerie Ramboz et Schuchardt. p. 32. [ Links ]
Carlquist S. 1961. Comparative plant anatomy: a guide to taxonomic and evolutionary application of anatomical data in angiosperms. New York (U. S. A.): Holt, Rinehart and Winston Press. p. 280. [ Links ]
Chalk L, Chattaway M. 1937. Identification of woods with included phloem. Tropical Woods, 50: 1-31. [ Links ]
Datta PC, Dasgupta A. 1977a. Comparison of vegetative anatomy of Piperales. I Juvenile xylem of twigs. Acta Biologica Academiae Scientiarum Hungaricae, 28 (1): 81-96. [ Links ]
Datta PC, Dasgupta A. 1977b. Comparison of vegetative anatomy of Piperales. II Leaf. Acta Biologica Academiae Scientiarum Hungaricae, 28 (1): 97-110. [ Links ]
Datta PC, Dasgupta A. 1979. Comparison of vegetative anatomy of Piperales. III. Vascular supplies to leaves. Acta Botanica Indica, 7: 39-46. [ Links ]
Eames AJ, Mac Daniels LH. 1953. An introduction to plant anatomy. New York (U. S. A.): McGraw-Hill Press. p. 427. [ Links ]
Esau K. 1977. Anatomía vegetal. Habana Cuba: Instituto Cubano del Libro. p. 729. [ Links ]
Ewers F, Fisher J. 1989. Variation in wood lenght and diameter in stems of six tropical and subtropical lianas. American Journal of Botany, 76: 1452-1459. [ Links ]
Ewers F, Carlton M, Fisher J, Kolb K, Tyre M. 1997. Vessel diameters in roots versus stems of tropical lianas and other growth forms. IAWA Journal, 28: 261-279. [ Links ]
Fischer RC, Wanke W, Richter A, Mayer V. 2003. Do ants feed plants? A 15N labelling study of nitrogen fluxes from ants to plants in the mutualism of Pheidole and Piper. Journal Ecology, 91 (1): 126-134. [ Links ]
Gasson P, Dobbins D. 1991. Wood anatomy of the Bignoniaceae, with a comparison of trees and lianes. IAWA Bulletin, 12: 389-417. [ Links ]
Hoffstadt RE. 1916. The vascular anatomy of Piper methysticum. Botanical Gazette, 62 (2): 115-132. [ Links ]
Holdridge LR. 1967. Life zone ecology. San José (Costa Rica): Tropical Science Center. p. 206. [ Links ]
IAWA Committee. 1989. IAWA List of microscopic features for hardwood identification by an IAWA Committee. International Association of Wood Anatomists Bulletin (new series), 10: 219-332. [ Links ]
Isnard S, Prosperi J, Wanke S, Wagner ST, Samain MS, Trueba S, Frenzke L, Neinhuis C, Rowe NP. 2012. Growth form evolution in piperales and its relevance for understanding angiosperm diversification: an integrative approach combining plant architecture, anatomy, and biomechanics. International Journal of Plant Sciences, 173 (6): 610- 639. [ Links ]
Jaramillo MA, Manos PS. 2001. Phylogeny and patterns of floral diversity in the genus Piper (Piperaceae). American Journal of Botany, 88 (4): 706-716. [ Links ]
Jaramillo MA, Callejas R, Davidson C, Smith JF, Stevens AC, Tepe EJ. 2008. A phylogeny of the tropical genus Piper (Piperaceae) using ITS and the chloroplast intron psbJ-petA. Systematic Botany, 33 (4): 647-660. [ Links ]
Johnson DS. 1902. On the development of certain Piperaceae. Botanical Gazette, 34 (5): 321-340. [ Links ]
López-Naranjo H, Parra J. 1993. Organografía y hábito de crecimiento de Piper nobile C. DC. (Piperaceae). Pittieria, 20: 79-109. [ Links ]
López-Naranjo H. 1997. Habito epífito de Piper subsessilifolium C. DC. var. morii Steyermark: anatomía y ecología. Pittieria, 26: 21-39. [ Links ]
López-Naranjo H. 1998. Desarrollo de epidermis y el córtex en el tallo de Piper (Piperaceae). Pittieria, 27: 7-24. [ Links ]
Metcalfe CR, Chalk L. 1950. Anatomy of the Dicotyledons; leaves, stem, and wood in relation to taxonomy, with notes on economic uses. Oxford (UK): Clarendon Press. p. 1500. [ Links ]
Morrone JJ. 2002. Biogeographical regions under track and cladistic scrutiny. Journal of Biogeography, 29: 149-152. [ Links ]
Patel RN, Bowles A. 1980. Wood anatomy of the dicotyledons indigenous to New Zealand 14. Piperaceae. New Zealand Journal of Botany, 18 (4): 507-513. [ Links ]
Pennington RT, Prado DE, Pendry CA. 2000. Neotropical seasonally dry forests and Quaternary vegetation changes. Journal of Biogeography, 27 (2): 261-273. [ Links ]
Pennington RT, Lavin M, Prado DE, Pendry CA, Pell SK, Butterworth CA. 2004. Historical climate change and speciation: neotropical seasonally dry forest plants show patterns of both Tertiary and Quaternary diversification. Philosophical Transactions of the Royal Society of London. Series B, 359 (1443): 515-537. [ Links ]
Quijano-Abril MA. 2009. Análisis filogenético basado en caracteres morfológicos para las especies del subgénero Enckea Kunth (Piperaceae) [Tesis de maestría]. [Medellín (Colombia)]: Instituto de Biología, Universidad de Antioquia, Colombia. [ Links ]
Randall JM, Rejmánek M, Hunter JC. 1998. Characteristics of the exotic flora of California. Fremontia, 26 (4): 3-12. [ Links ]
Ravindran PN, Remasshree AB. 1998. Anatomy of Piper colubrinum Link. Journal of Spices and Aromatic Crops, 7 (2): 111-123. [ Links ]
Ruiz H, Pavon J. 1794-1802. Florae peruvianae et chilensis prodromus. Flora peruviana et chilensis (Tomos 1/3.) With bibliographical notes by F. A. Stafleu. New York: Lehre, J. Cramer, Stechert-Hafner. p. 792. [ Links ]
Schlichting CD, Pigliucci M. 1998. Phenotypic evolution: a reaction norm perspective. Sunderland (MA): Sinauer Associates. p. 387. [ Links ]
Schmitz F. 1871. Fibrovasalsystem im Blutenkolben der Piperaceen. Essen (Germany). [ Links ]
Shaw J, Small RL. 2005. Chloroplast DNA phylogeny and phylogeography of the North American plums (Prunus subgenus Prunus section Prunocerasus, Rosaceae). American Journal of Botany, 92: 2011-2030. [ Links ]
Shaw J, Lickey E, Schilling E, Small R. 2007. Comparison of whole chloroplast genome sequences to choose noncoding regions for phylogenetic studies in angiosperms: The tortoise and the hare III. American Journal of Botany, 94 (3): 275-288. [ Links ]
Silva D, Quijano MA. 2010. Variación anatómica de los ejes caulinares en los diferentes clados del género Piper (Piperaceae). N.° 55, Anatomía vegetal. Memorias, X Congreso Latinoamericano de Botánica: ''Conservación y uso sustentable de la flora nativa latinoamericana''. 4 al 10 de octubre de 2010. La Serena, Chile. [ Links ]
Tepe EJ, Vincent MA, Watson LE. 2007a. The importance of petiole structure on inhabitability by ants in Piper section Macrostachys (Piperaceae). Botanical Journal of the Linnean Society, 153: 181-191. [ Links ]
Tepe EJ, Vincent MA, Watson LE. 2007b. Stem diversity, cauline domatia, and the evolution of ant-plant associations in Piper section Macrostachys (Piperaceae). American Journal of Botany, 94: 1-11. [ Links ]
Van Tieghem PÉL. 1891. Traité de botanique. 2.a ed. Paris: Librairie F. Savy. p. 1855. [ Links ]
Weiss JE. 1876. Wachstumsverhältnisseund Gefässbündelverlauf bei den Piperaceen. [ Links ]