Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actualidades Biológicas
Print version ISSN 0304-3584
Actu Biol vol.35 no.99 Medellín July/Dec. 2013
ARTÍCULOS DE INVESTIGACIÓN
ESTUDIO DE LA DIVERSIDAD DE SERPIENTES EN ÁREAS DE BOSQUE PERTURBADO Y PASTIZAL EN SAN VICENTE DEL CAGUÁN (CAQUETÁ), COLOMBIA
STUDY OF DIVERSITY OF SNAKES IN PERTURBED FOREST AND PASTURE AREAS IN SAN VICENTE DEL CAGUÁN (CAQUETÁ), COLOMBIA
Leandro Cortes-Ávila1,2; José J. Toledo1,3
1 Instituto Nacional de Pesquisas da Amazônia (INPA, CPBA). Manaus (AM), Brasil.
Correos electrónicos: 2 leandro_ca09@yahoo.com, leandrocortesavila@hotmail.com; 3 jjuliotoledo@yahoo.com.br.
Recibido: noviembre 2012; aceptado: octubre 2013.
Resumen
Los bosques del municipio de San Vicente del Caguán (Caquetá), Colombia, han sido rápidamente degradados y convertidos en áreas de pastizal en las últimas décadas, causando la pérdida de biodiversidad, aislamiento de poblaciones y en el peor de los casos favoreciendo extinciones locales. El objetivo del estudio fue determinar la diversidad de serpientes en cinco áreas de bosque perturbado y pastizal de la región. Los muestreos fueron realizados durante recorridos diurnos y nocturnos. Los especímenes fueron capturados manualmente con ayuda de ganchos y pinzas herpetológicas. Durante cuatro meses de estudio se hallaron 57 individuos distribuidos en cuatro familias, 13 géneros y 19 especies; predominó Colubridae con 14 especies. Helicops angulatus (Linnaeus, 1758) fue la especie más abundante (27 registros) y solamente se registró en el área de pastizal, seguida por Leptodeira annulata (Linnaeus, 1758) con un individuo en el bosque perturbado y siete en el área de pastizal. Las áreas de pastizal fueron las más ricas (15 especies) en comparación con las áreas de bosque perturbado (6). Como método de ordenación fue usado el escalonamiento multidimensional no-métrico (EMNM) que separó dos áreas de bosque perturbado de las de pastizal, lo cual indica que la estructura y composición de especies del área de pastizal difiere de las especies de bosque. Concluimos que para las dos especies más abundantes, estas podrían ser consideradas como especies persistentes y tolerantes debido a la permanencia y uso de los recursos en ecosistemas con alto grado de perturbación.
Palabras clave: Colombia, composición, estructura, serpientes, San Vicente del Caguán.
Abstract
During the last decades the forests of San Vicente del Caguán (Caquetá), Colombia, have been turned into pasture areas, an activity that is leading to biodiversity loss, isolation of populations and, in the worst of the scenarios, to local extinctions. The aim of this study was to document the effect of deforestation on snake diversity. Therefore, we selected five pasture areas and compared them to sampling areas inside five different secondary forest fragments. Sampling was conducted during day and night. Specimens were hand caught with the aid of hooks and herpetological tongs. During the four months of samplings, 57 individuals were captured, belonging to four families, 13 genera and 19 species. The family Colubridae was predominant, with 14 species represented. Helicops angulatus (Linnaeus, 1758) was the most abundant species (with 27 individuals) and occurred only in the pasture areas. The second most abundant species was Leptodeira annulata (Linnaeus, 1758) with seven individuals registered for the pasture areas and only one individual for the secondary forest fragments. Pasture areas were more species-rich (15 species) when compared to the secondary forest fragments (6). Nonmetric multidimensional scaling analysis (NMDS = EMNM) was used as an ordination method that separated two forest areas from all pasture areas, which indicates different species structure and composition between the forests and pasture areas. We conclude that the two above species mentioned above may be considered persistent and tolerances species, due to their permanence and use of resources in highly disturbed ecosystems.
Key words: composition, snakes, structure, San Vicente del Caguán, Colombia.
INTRODUCCIÓN
La Amazonía colombiana es un ecosistema rico en recursos naturales y se caracteriza por exhibir alta biodiversidad de reptiles (Duellman 1990, Sánchez et al. 1995, Vitt 1987, Vogt et al. 2001). Sin embargo, la intervención humana junto con prácticas extractivas de deforestación, extracción de madera, agricultura y ganadería, han generado cambios en la cobertura vegetal de los sistemas amazónicos, causando disminución del área boscosa, desplazamiento de la fauna, reducción de la diversidad y cambios en la estructura de la vegetación y el microclima (Aichinger 1991, Alves et al. 1999, Arzamendia y Giraudo 2004, Jellinek et al. 2004, MinMinas 1996, Ramírez et al. 2000, Saunders et al. 1991, Silvano et al. 2003, Tapia-Coral et al. 1999, Urbina et al. 2008, Vitt y Caldwell 2001). A pesar de toda la problemática que presenta para la región, la conversión del bosque en áreas de pastizal es la actividad más frecuente e impactante que se realiza a gran escala en los ecosistemas amazónicos durante hace más de 30 años (García et al. 1996). Por lo anterior, es posible afirmar que el estado de la herpetofauna de esta región ha sufrido cambios en su composición y abundancia en las últimas décadas debido principalmente a la destrucción de los ecosistemas forestales (Carvajal-Cogollo y Urbina-Cardona 2008), los cuales han generado cambios rápidos, drásticos y perceptibles en estas comunidades llegando a afectar en algunos casos la variabilidad genética de poblaciones aisladas (Colli et al. 2003). En general, los bosques neotropicales presentan en la actualidad ciertos grados de intervención humana (Carvajal-Cogollo et al. 2007), y sin embargo, estos aún exhiben alta biodiversidad de serpientes, las cuales se han adaptado a pesar de los resultados de los disturbios humanos originados en sus hábitats (Carvajal-Cogollo y Urbina-Cardona 2008, INVIAS 1999, Urbina- Cardona y Londoño-Murcia 2003, Vargas y Bolaños 1999a, b). A pesar de la conversión de los bosques en áreas de pastizal y que hayan generado grandes impactos, no solo sobre la comunidad de serpientes sino también la de otros grupos de organismos (Rueda 1999), estudios han mostrado que algunas especies de serpientes han respondido de forma significativa a las nuevas áreas predominantes de pastizal aumentado sus abundancias (Bastos et al. 2005, Hernández-Ruz et al. 2001, Oliveros et al. 2000) y afectando de diversas maneras a otras especies que habitan en esas localidades (Carvajal- Cogollo y Urbina-Cardona 2008).
El objetivo de este estudio fue determinar la diversidad de serpientes en cinco áreas de bosque perturbado y pastizal del municipio de San Vicente del Caguán (Caquetá), Amazonía colombiana.
MATERIALES Y MÉTODOS
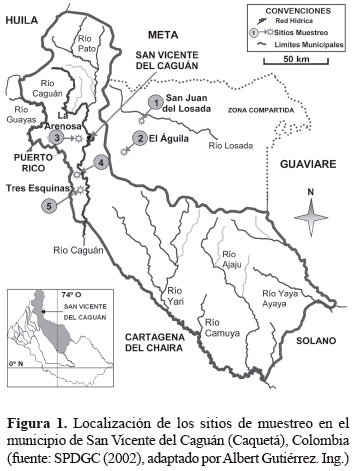
Área de estudio. El estudio fue realizado en el municipio de San Vicente del Caguán (Caquetá), Colombia (1° 48' a 2° 14' S, 74° 27' a 74° 50' O; IGAC 1996) ubicado al nororiente del departamento del Caquetá y limitando con los municipios Puerto Rico, Cartagena del Chaira y Solano, y además, con los departamentos del Huila, Meta y Guaviare. Se seleccionaron tres veredas del municipio de San Vicente del Caguán: San Juan del Losada (1), El Águila (2), La Arenosa (3) y dos inspecciones: Tres Esquinas I (4) y Tres Esquinas II (5) (figura 1). Actualmente, las veredas San Juan del Losada y El Águila pertenecen al municipio de San Vicente del Caguán aunque figuren por fuera del límite municipal (Cortes-Villalba 2008). El periodo de establecimiento de las áreas de pastizal en las localidades de muestreo varía entre 10 a 25 años. La altitud de las localidades de estudio varió desde 400 a 420 m; temperatura media anual oscila entre 24 y 25,8 °C; precipitación anual 2.486,1 mm, correspondiendo a una media mensual interanual de 207,18 mm; y humedad relativa entre 79 a 88% al año, con promedio anual de 82,33% (Aeronáutica Civil 2011). Los suelos son ácidos y de baja fertilidad, pertenecen al terciario y cuaternario, los cuales varían en su composición desde arenosos hasta arcillosos (IGAC 1996, SPDGC 1987). El municipio se divide en tres conjuntos morfológicos, el flanco oriental de la cordillera Oriental, el piedemonte y la altillanura, siendo la región suroriental la más conservada en ecosistemas amazónicos (IGAC 1996). En este estudio se evaluaron dos regiones de vida: el piedemonte y la altillanura.
El periodo de establecimiento de las áreas de pastizal ha tomado entre 10 a 25 años, las cuales presentan pequeños parches de arbustos y pteridofitas. Los bosques perturbados actualmente sufren extracción de madera, quemas temporales y compactación del suelo por el pisoteo de bovinos que ingresan a estas áreas.
Diseño de sitios de muestreo. En cada una de las cinco localidades de muestreo fue seleccionada un área de pastizal (P: P1-P5) y un área de bosque perturbado (B: B1-B5) adyacentes. Las cinco localidades estuvieron dispersas en un área de aproximadamente 2.000 km2, con una variación de distancia entre un sitio y otro de 5 a 61 km. En cada área de bosque y pastizal, fueron establecidos tres sub-transectos de 50 x 100 m (0,5 ha) distantes 50 m uno del otro para percibir posibles modificaciones tenues en la composición. Todos los sub-transectos tuvieron 100 m de distancia del borde bosque pastizal y fueron orientados en sentido paralelo. Los tres sub-transectos fueron considerados como un único transecto de 50 x 300 m totalizando un área de 1,5 ha para cada área de bosque perturbado y pastizal.
Recolectas y curación del material biológico. Las recolectas fueron realizadas en cinco sitios con áreas de bosque perturbado y pastizal durante cuatro meses (= 120 días): agosto y diciembre de 2005, y enero y febrero de 2006, siendo evaluada simultáneamente un área de bosque y una de pastizal. Tres salidas al día fueron realizadas durante los cuatro meses de estudio (total 360 salidas), cada una de ellas con 12 horas de recolecta, totalizando por todo el estudio 1.440 horas de esfuerzo de muestreo/ hombre. Fueron realizados recorridos diurnos y nocturnos, por la mañana entre las 06:00 y 10:00 h, en la tarde entre las 14:00 y 18:00 h, y en la noche desde las 19:00 hasta las 23:00 h. La captura de los individuos se efectuó de forma manual, con ganchos, pinzas herpetológicas y varas con lazada al igual como lo menciona Hernández-Ruz et al. (2001) y Vargas y Bolaños (1999a). Los especímenes fueron sacrificados a través de inmersión en agua templada y posteriormente inyectados con solución de formaldehído al 10%. Para su preservación fueron colocados en recipientes definitivos de vidrio con etanol al 75% como lo sugiere Oliveros et al. (2000).
Los especímenes fueron identificados en el laboratorio de Biología de la Universidad de la Amazonía (Florencia, Caquetá) hasta el nivel de especie, y posteriormente verificados por especialistas en el Instituto de Ciencias Naturales (ICN) de la Universidad Nacional de Colombia, Bogotá. Las claves de identificación utilizadas fueron las de Campbell y Lamar (2004), Dixon (1989), Dixon et al. (1993), Pérez-Santos y Moreno (1988) y Roze (1966, 1996). Los ejemplares recolectados fueron depositados en la colección del serpentario de la Universidad de la Amazonía de Florencia (Caquetá), Colombia.
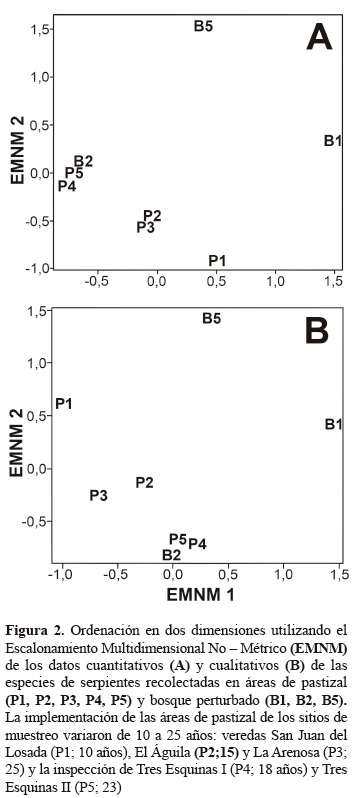
Análisis de datos. Fue realizada una ANOVA para determinar si existe diferencia significativa entre la riqueza de serpientes encontradas en las áreas de bosque perturbado y pastizal, y entre localidades, esto permitirá determinar si la variación en la riqueza se ve explicada por alguno de los factores o la interacción entre ellos. Fue utilizado el escalonamiento multidimensional no-métrico (EMNM) como método de ordenación para resumir la composición de las especies en dos dimensiones (McCune y Grace 2002). Las áreas de bosque perturbado B3 y B4 fueron excluidas del análisis debido a la ausencia de individuos. Las ordenaciones fueron realizadas con datos cuantitativos (abundancias) y cualitativos (presencia y ausencia). Los datos cuantitativos fueron estandarizados dividiendo cada valor por el máximo valor de la abundancia para las especies del conjunto de datos. La ordenación con los datos cuantitativos revelan patrones en función de las especies más comunes, y los de presencia y ausencia dan más peso a las especies raras con pequeña abundancia. Como la mayoría de las especies presentaron solamente un individuo por área, la ordenación cualitativa se muestra adecuada.
El índice de asociación de Bray-Curtis fue usado como medida de disimilitud entre las áreas de recolecta. Para la determinación de la diversidad, fue utilizado el método de rarefacción. Este método es utilizado cuando los tamaños de las muestras son desiguales, o sea, se trabaja con el número de especies que podría ser esperado en muestras de tamaños padronizados (Magurran 1988). La riqueza de especies fue estimada por el método de Jackknife de primer orden (Krebs 1989) y la representatividad fue calculada para conocer el porcentaje real de la riqueza encontrada. Este análisis fue realizado para las cinco localidades y para los dos sistemas evaluados (bosque perturbado y pastizal).
El análisis inferencial y los gráficos fueron realizados en el programa R (R development core team 2007), la ordenación con EMNM en el programa PC-Ord 4,25 (McCune y Mefford 1999) y los cálculos de diversidad y estimación de especies con el programa EstimateS: versión 8.2.0 (Colwell 2009).
RESULTADOS
Fueron recolectados 57 individuos de serpientes pertenecientes a cuatro familias, 13 géneros y 19 especies. La familia más abundante y rica fue Colubridae con 51 individuos (89%) y 14 especies (74%); Boidae presentó tres individuos (5%) y dos especies (11%); Elapidae dos individuos (4%) y dos especies (11%); y Viperidae con solo un individuo. Helicops angulatus (Linnaeus, 1758) fue la especie más abundante con 27 individuos (4%) seguida por Leptodeira annulata (Linnaeus, 1758) con 8 (14%). Cinco especies presentaron dos individuos y 12 especies presentaron únicamente un ejemplar (tabla 1).
Fueron encontrados 50 individuos (88%) pertenecientes a 15 especies en las áreas de pastizal y siete individuos (12%) pertenecientes a seis especies en las áreas de bosque perturbado. Las áreas de pastizal presentaron mayor riqueza de especies (15) que las áreas de bosque perturbado (6). Estadísticamente se observa diferencia significativa entre las riquezas de las dos áreas evaluadas (p = 0,0025). Las riquezas por localidad también mostraron diferencia significativa (p = 0,003).
Trece especies fueron exclusivas de las áreas de pastizal: Boa constrictor (Linnaeus, 1758), Bothrops atrox (García, 1896), Chironius carinatus (Linnaeus, 1758), Chironius exoletus (Linnaeus, 1758), Chironius fuscus (Linnaeus, 1758), Chironius monticola (Roze, 1952), Helicops angulatus (Linnaeus, 1758), Hydrops triangularis (Wagler, 1824), Liophis epinephelus (Cope, 1862), Micrurus lemniscatus (Schmidt y Schmidt, 1925), Micrurus spixii (Jan, 1872), Oxyrhopus petola (Reuss, 1834) y Pseudoboa coronata (Schneider, 1801); cuatro solamente en los boques perturbados: Dipsas catesbyi (Sentzen, 1796), Eunectes murinus (Latrielle, 1802), Helicops leopardinus (Schlegel, 1837) y Helicops pastazae (Shreve, 1934); y solo dos estuvieron presentes en los dos ambientes: L. annulata (Linnaeus, 1758), y Spilotes pullatus (Linnaeus, 1758) (tabla 1).
Las dos dimensiones del EMNM captaron 56 y 72% (stress = 24,5%) de la variación de la composición de las especies para los datos cuantitativos y cualitativos, respectivamente. Fue posible visualizar la separación de dos áreas de bosque perturbado, San Juan del Losada (B1) y Tres Esquinas II (B5) de las de pastizal a través da ordenación con datos cuantitativos y cualitativos (figura 2A, B). Sin embargo, el área de bosque perturbado del Águila (B2) se encontró cerca de las zonas de pastizal (figuras 2A, B).
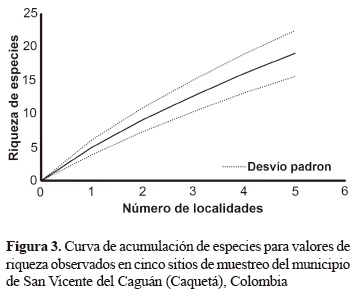
Aunque la curva de acumulación de especies sigue de forma creciente, esta no manifiesta clara tendencia a estabilizarse en lo que se refiere al aumento de especies que componen el ensamblaje de serpientes del municipio de San Vicente del Caguán. Esto indica, que un total de 360 salidas distribuidas en cinco localidades y en cuatro meses, no es un número satisfactorio que pueda representar la riqueza total de las especies de la región (figura 3).
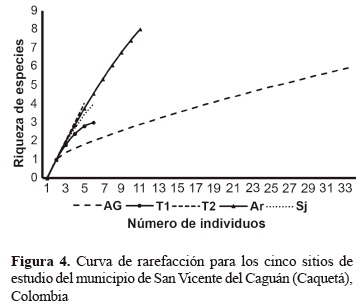
Con base en las informaciones generadas por medio del método de rarefacción calculado con el número de individuos, las riquezas de las cinco localidades variaron de tres especies para inspección de Tres Esquinas I hasta 8 taxones para la vereda La Arenosa. Considerando que La Inspección de Tres Esquinas II presentó el tamaño menor de las muestras (cuatro individuos), según los cálculos de rarefacción, para las otras veredas e inspecciones el número de especies esperadas sería de aproximadamente tres (Tres Esquinas I); dos (El Águila); cuatro (La Arenosa) y tres (San Juan del Losada) especies (figura 4).
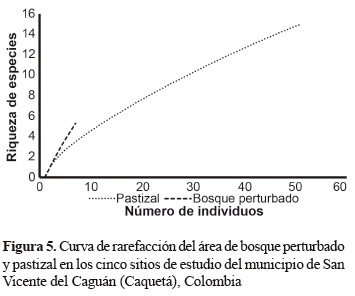
Ya el método de Rarefacción calculado con el número de individuos para el área de bosque perturbado y pastizal, el valor de las especies para el área de pastizal fue de tres y cuatro especies para el otro hábitat (figura 5).
Los valores de riqueza estimados por el método de Jackknife para las cinco localidades de estudio, demostraron que 360 salidas de campo dentro del municipio de San Vicente del Caguán correspondieron a 54,3% de la riqueza total estimada para un total de 19 especies recolectadas. A partir de los resultados del índice, se estima que aún existen 16 nuevas especies a ser adicionadas para que el ensamble de serpientes sea muestreado en su totalidad (35 especies). Según el método de Jackknife para el área de bosque perturbado y pastizal, faltan aún 29 especies para el sistema de bosque perturbado (representatividad 20,7%) y 24 especies a ser adicionadas en el ensamblaje del área de pastizal (representatividad 62,5%).
Para la especie C. monticola se registra un nuevo registro altitudinal de 450 m recolectada en la vereda La Arenosa, segundo Dixon et al. (1993) menciona que esta se encuentra a partir de los 1.000 m.
DISCUSIÓN
La especie H. angulatus fue encontrada principalmente en las áreas de pastizal inundadas. Este sistema se caracterizó por presentar charcas y pequeñas áreas inundadas dispersos dentro de los transectos evaluados. Se puede sugerir que esta especie al presentar comportamiento acuático, podría estar beneficiándose del cambio generado en el ambiente para el forrajeo debido a la presencia de pequeños peces (Characidae y Rivulidae) y anuros en el sistema de pastizal durante el estudio. Según França et al. (2008), el aumento de los recursos alimenticios en sistemas perturbados ocurren de forma rápida y considerable. Siendo así, es posible que el aumento de la abundancia de H. angulatus en áreas abiertas por la modificación del hábitat sea más elevada en comparación con otras especies no tan resistentes a cambios en los ecosistemas al igual como lo menciona Bernarde y Macedo (2008).
Para L. annulata, especie semiarborícola que se alimenta de pequeños lagartos, insectos y anuros (Pérez-Santos y Moreno 1988), su abundancia mayor en el área de pastizal no fue estimulada por la abundancia de recursos alimenticios, pues dentro de los recursos que esta especie explora en áreas de bosque difieren a los de este hábitat. Referente a su abundancia mayor en el área de pastizal, posibles factores como la humedad relativa, luminosidad y microhábitat pudieron haber influenciado este resultado como lo menciona Silvano et al. (2003), donde mostraron que al incorporar algunas variables ambientales en los análisis, algunas especies pueden ser más abundantes en hábitats alterados, reflejando que estas toleran un cierto grado de impacto y tienen capacidad de persistir si la cobertura nativa no es destruida en su totalidad. Cabe mencionar que estos factores ambientales no fueron medidos en este estudio.
A pesar de existir grandes modificaciones en los bosques amazónicos, los bosques perturbados son considerados por algunos autores como ecosistemas con grande importancia faunística por la diversidad y disponibilidad de hábitats (INVIAS 1999, Urbina-Cardona y Londoño- Murcia 2003, Urbina et al. 2008, Vargas y Bolaños 1999a, b). Según nuestros resultados, como los de Hernández-Ruz et al. (2001), demuestran que áreas húmedas deforestadas pueden ser beneficiosas para ciertas especies debido al desequilibrio causado por la tala del bosque. Esto no implica que desequilibrios en ambientes forestados sean benéficos para todas las especies, pues algunas especies son resistentes y se adaptan más rápido que otras consideradas frágiles a degradaciones ambientales. Este hecho puede ser corroborado con los estudios de Bastos et al. (2005), Hernández-Ruz et al. (2001) y Oliveros et al. (2000), donde las especies Crotalus durissus terrificus, Epictia goudotii y L. annulata, debido al corte del bosque y al establecimiento de un ambiente predominantemente de pastura mostraron respuestas benéficas a este nuevo tipo de hábitat, esto posiblemente al aumento de la disponibilidad del alimento en esas áreas.
La mayor abundancia y riqueza encontrada en las áreas de pastizal en este estudio, también se debe a la gran facilidad de detección al igual como lo establece Carvajal-Cogollo y Urbina-Cardona (2008), donde las serpientes al presentar hábitos crípticos, la mayoría de las veces son imperceptibles a la búsqueda por encuentro visual dentro de hábitats forestados, siendo lo contrario en áreas abiertas.
De las 13 especies que fueron exclusivamente encontradas en las áreas de pastizal, algunas también pueden ser encontradas en los bosques perturbados (Campbell y Lamar 2004, Dixon et al. 1993, Pérez-Santos y Moreno 1988, Roze 1966, 1996), esto muestra que a pesar del gran impacto generado en los ecosistemas, algunas especies de herpetos han mostrado sobrevivir en ambientes con diferente grado de intervención así como lo afirmaron Cárdenas-Arévalo et al. (2010) y Duellman (1990).
La separación de dos áreas de bosque perturbado (B1 y B5) de las áreas de pastizal fue posible debido a la presencia restricta de D. catesbyi, H. leopardinus y H. pastazae en esas áreas. Siendo así, estas tres especies pueden ser categorizadas como especies del grupo de las que toleran ambientes medio y altamente intervenidos (García-R. et al. 2007). Aunque la mayoría de las serpientes exploten zonas selváticas (Murillo- Moreno et al. 2006), según Carvajal-Cogollo et al. (2007), especies exclusivas de ciertos hábitats parecen tener relación con el grado de conservación. Esto fue demostrado en el estudio de Carvajal-Cogollo y Urbina-Cardona (2008) donde fragmentos mayores de bosque alterado presentaron mayor número de especies exclusivas.
Un área de bosque (B2) fue semejante en composición a las áreas de pastizal gracias a la presencia común de dos especies, L. annulata y S. pullatus. La primera fue encontrada en cuatro áreas de pastizal (P2-P5) y la segunda en una sola área (P5). Según Saunders et al. (1991), la poca diferencia entre el número de especies de las áreas de bosque y las áreas abiertas puede atribuirse a que esta ultima presenta áreas de cultivos, arbustos y vegetación herbácea, sistemas diversificados que permite la compenetración de un diverso número de especies.
Cabe indicar que las tres especies encontradas en áreas B1 y B5 son predominantemente encontradas en áreas de bosque. Para las especies D. catesbyi especie semiarborícola, H. leopardinus junto con H. pastazae y E. murinus de hábitos acuáticos, es posible que estas no hagan uso de las nuevas condiciones del hábitat de pastizal, posiblemente la falta de abrigo junto a restricciones alimenticias que pueden haber influenciado en la ausencia de la especie en áreas abiertas, pues al igual como lo establece Dickerson (2001), Gibbons et al. (2000), Keller y Heske (2000) y, Prior y Weatherhead (1996), cambios generados por el impacto humano como la pérdida del hábitat, contribuyen a la disminución de presas, disminución poblacional de algunas serpientes y en algunos casos pueden causar extinción local. Aunque E. murinus se haya registrado en el área de bosque perturbado, según Strimple (1993), esta especie también habita sistemas abiertos e intervenidos inundados, hábitats en donde su ecología comportamental no se ve alterada.
Las especies H. leopardinus y H. pastazae se alimentan de una gran variedad de peces y anuros, teniendo preferencia por presa sedentarias como peces eléctricos Gymnotiformes y especies territorialistas como los Cichlidae (Ávila et al. 2006). Este hecho podría reflejar la permanencia de estas especies en el sistema acuáticos de bosque perturbado, pues especies como Cichlidae y Gymnotiformes no habitan sistemas inundados de profundidad baja como se presentaron en las áreas de pastizal.
La conversión del bosque en áreas de pastizal ocasiona modificaciones en la temperatura, humedad relativa y entre otros factores importantes para la sobrevivencia de diversos organismos que sirven de alimento para diversas especies entre estos los anuros (Bernarde y Macedo 2008, Seigel y Collins 1993, Urbina- Cardona et al. 2006), que según García-R. et al. (2007) y Urbina-Cardona et al. (2006), algunas especies presentan diferencias significativas entre los hábitats debido a variables climáticas y de cobertura vegetal. Siendo así, D. catesbyi puede ser la especie más amenazada debido al cambio de hábitat, pues al presentar hábitos arborícolas y por alimentarse de anélidos y gasterópodos, las modificaciones de los bosques para áreas de pastizal comprometen estos recursos indispensables para la sobrevivencia de esta especie y otras serpientes en estos ecosistemas. En general, la pérdida de hábitat ejerce un efecto deletéreo sobre las especies que habitan áreas de bosque (Saunders et al. 1991), en donde más tarde aquellas especies afines a áreas abiertas tienden a reemplazar a aquellas especies de hábitats boscosos (Vargas y Bolaños 1999a). Según Urbina-Cardona y Reynoso (2005), algunas especies de serpientes usan microhábitats puntuales y poseen requerimientos fisiológicos y comportamentales específicos lo que contribuye a la baja capacidad de adaptación de las mismas en sistemas alterados.
La curva de acumulación de especies obtenida para las cinco localidades presentó carácter creciente, indicando que aún faltan especies de serpientes por ser registradas en los dos ecosistemas estudiados (áreas de bosque perturbado y pastizal). Por lo tanto, con mayor número de salidas, esfuerzo del muestreo y la utilización de trampas ampliaría el valor de la riqueza de la localidad. Según Murillo- Moreno et al. (2006), el hecho de la curva no indica un inventario representativo puede estar relacionado con algunos de los patrones de comportamientos de organismos (camuflaje), y entre otros, como abundancia menor y tamaños poblacionales bajos (Carvajal-Cogollo y Urbina-Cardona 2008, Medina-Rangel 2011).
Las curvas de rarefacción, indicaron que la reducción en la riqueza ni siempre es un artefacto da reducción en la abundancia de individuos, esto puede ser observado en La Inspección de Tres Esquinas II y vereda El Águila, donde con cuatro individuos el número de especies varió de cuatro a dos. Ya para el cálculo de rarefacción del sistema de pastizal y bosque perturbado varió de cuatro a tres especies.
El estimador de riqueza (Jackknife) mostró que el número de especies para este trabajo (19) puede ser considerado fue significativo para evaluar una parte de la diversidad de serpientes que componen el ensamble de áreas de bosque perturbado y pastizal. La riqueza de especies de este estudio en comparación con los de Carvajal- Cogollo y Urbina-Cardona (2008) (14), Carvajal- Cogollo et al. (2007) (20), Cárdenas-Arévalo et al. (2010) (16), Medina-Rangel (2011) (20), Moreno-Arias et al. (2009) (34), Murillo- Moreno et al. (2006) (44), Pedroza-Banda y Angarita-Sierra (2011) (2), Urbina-Cardona y Londoño-Murcia (2003) (8) y Urbina-Cardona et al. (2006) (13), demuestran que el número de especies de ofidios registrados para este son representativos aunque la curva de acumulación de especies muestre aún tendencia creciente. Sin embargo, para las especies de serpientes que componen el ensamblaje de los estudios anteriores, pocas especies se compartieron con nuestros resultados, esto es debido a que esas investigaciones fueron llevadas a cabo en ecosistemas que no corresponden al Piedemonte amazónico.
Aunque se registraron 19 especies de serpientes para la región y al ser este el primer estudio del grupo en la localidad, es de gran importancia destacar que a pesar de existir actualmente grandes cambios en las coberturas vegetales, las serpientes han mostrado resistencia, tolerancia y plasticidad frente a estos eventos. Según Murillo-Moreno et al. (2006), serpientes que habitan zonas abiertas como fincas y potreros reflejan un moderado grado de adaptación a estas áreas intervenidas.
CONCLUSIONES
A pesar que la región ha sido poco muestreada y debido a la baja densidad de ofidios en las áreas estudiadas, concluimos que el ensamblaje de serpientes de áreas intervenidas (áreas de pastizal) presenta mayor riqueza que las de áreas de bosque perturbado. Para las dos especies más abundantes sugerimos catalogarlas como especies persistentes y tolerantes debido a la permanencia y uso de los recursos en ecosistemas con alto grado de perturbación.
AGRADECIMIENTOS
Agradecemos a J. Edilberto Cortes y Eberth Andrés Ciro por la ayuda en las labores de recolección de especímenes. También a Fernando Ortiz, Jaime Velásquez y Clemencia Serrato Hurtado por las sugerencias en la fase de implementación del trabajo de campo. Agradecidos con Nelson Quintero y Jaime Rodríguez por su hospitalidad y hospedaje en sus predios. Agradecimientos póstumos a Ramón Quintero (q. d. e. p.). A la Facultad de Herpetología del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia por la verificación de las identificación del material recolectado.
REFERENCIAS
Aeronáutica Civil. 2011. Informe meteorológico anual de San Vicente del Caguán. Estación meteorológica de San Vicente del Caguán - Caquetá HIMAT. Aeropuerto Eduardo Falla Solano, San Vicente del Caguán (Caquetá). Informe meteorológico anual N.o AEVVZYF6TF2M-634-382. [ Links ]
Aichinger M. 1991. Faunal deficit of anurans in tropical farmland of Amazonian Peru. Alytes, 9 (1): 23-32. [ Links ]
Alves FSM, Fisch G, Vendrame IF. 1999. Modificações do microclima e regime hidrológico devido ao desmatamento na Amazônia: estudo de um caso em Rondônia (RO), Brasil. Acta Amazónica, 29 (3): 395-409. [ Links ]
Arzamendia V, Giraudo AR. 2004. Usando patrones de biodiversidad para la evaluación y diseño de áreas protegidas: las serpientes de la provincia de Santa Fé (Argentina) como ejemplo. Revista Chilena de Historia Natural, 77: 335-348. [ Links ]
Ávila RW, Ferreira V, Arruda JAO. 2006. Natural history of the South American water snake Helicops leopardinus (Colubridae: Hydropsini) in the Pantanal, Central Brazil. Journal of Herpetology, 40 (2): 274-279. [ Links ]
Bastos EG, Araújo AF, Silva HR. 2005. Records of the rattlesnakes Crotalus durissus terrificus (Laurenti), (Serpentes, Viperidae) in the State of Rio de Janeiro, Brazil: a possible case of invasion facilitated by deforestation. Revista Brasileira de Zoologia, 22 (3): 812-815. [ Links ]
Bernarde PS, Macedo LC. 2008. Impacto do desmatamento e formação de pastagens sobre a anurofauna de serapilheira em Rondônia. Iheringia Série Zoológica, 98 (4): 454-459. [ Links ]
Campbell JA, Lamar WW. 2004. The venomous reptiles of the western hemisphere. New York: Cornell University Press. p. 1032. [ Links ]
Cárdenas-Arévalo G, Castaño-Mora OV, Carvajal-Cogollo JE. 2010. Comunidad de reptiles en humedales y áreas aledañas del departamento de Córdoba. En: Rangel-Ch JO, editor. Colombia diversidad biótica IX: ciénagas de Córdoba: biodiversidad-ecología y manejo ambiental. Bogotá D.C (Colombia): Instituto de Ciencias Naturales- Universidad Nacional de Colombia. p. 361-380. [ Links ]
Carvajal-Cogollo JE, Castaño-Mora OV, Cárdenas-Arévalo G, Urbina-Cardona JN. 2007. Reptiles de áreas asociadas a humedales de la planicie del departamento de Córdoba, Colombia. Caldasia, 29 (2): 427-438. [ Links ]
Carvajal-Cogollo JE, Urbina-Cardona JN. 2008. Patrones de diversidad y composición de reptiles en fragmentos de bosque seco tropical en Córdoba, Colombia. Tropical Conservation Science, 1 (4): 397-416. [ Links ]
Colli GR, Accacio GM, Antonini Y, Constantino R, Franceschinelli EV, Laps RR, Scariot A, Vieira MV, Wiederhecker HC. 2003. A Fragmentação dos Ecossistemas e a Biodiversidade Brasileira: uma síntese. En: Rambaldi DM, Oliveira DAS, editores. Fragmentação de Ecossistemas: Causas, efeitos sobre a biodiversidade e recomendações de políticas públicas. Brasília (Brasil): Ministério do Meio Ambiente/ Secretaria de Biodiversidade e Florestas. p. 317-324. [ Links ]
Cortes-Villalba H. 2008. Municipio de San Vicente del Caguán, Caquetá, monografía. San Vicente del Caguán (Caquetá): Alcaldía municipal. p. 124. [ Links ]
Dickerson DD. 2001. Riparian habitat management for reptiles and amphibians on Corps of Engineers projects. Vicksburg (MS, U. S. A.): US Army Engineer Research and Development Center, Major Shared Resource Center. Technical Note: ERDC TN-EMRRP-S1-22. p. 13. Fecha de acceso: 23 de mayo de 2006. Disponible en: http://www.el.erdc.usace.army.mil/elpubs/pdf/si22.pdf. [ Links ]
Dixon JR. 1989. A key and checklist of the neotropical snake genus Liophis with country list and maps. Washington D. C. (U. S. A.): Smithsonian Herpetological Information Service Series. p. 79. [ Links ]
Dixon JR, Wiest JA, Cei JM. 1993. Revision of the Neotropical snake genus Chironius Fitzinger (Serpentes: Colubridae) Monografie XIII. Torino (Italy): Museo Reginali di Scienze Naturali. p. 279. [ Links ]
Duellman WE. 1990. Herpetofauna in Neotropical rainforests: comparative composition, history and resource use. En: Gentry H, editor. Neotropical rainforests. 4.a ed. Londres (Inglaterra): Yale University Press. p. 455-505. [ Links ]
França FG, Mesquita DO, Nogueira CC, Araújo AF. 2008. Phylogeny and ecology determine morphological structure in a snake assemblage in the Central Brazilian Cerrado. Copeia, 1: 23-38. [ Links ]
García J, Gómez JE, Ortiz FI, Zuluaga JJ. 1996. Principales especies nativas de fauna y flora del Caquetá, usos actuales y potenciales. Florencia (Caquetá, Colombia): PNR-CORPOICA. p. 81. [ Links ]
García-R JC, Cárdenas-H H, Castro-H F. 2007. Relación entre la diversidad de anuros y los estados sucesionales de un bosque muy húmedo montano bajo del Valle del Cauca, Suroccidente colombiano. Caldasia, 29 (2): 363-374. [ Links ]
Gibbons JW, Scott DE, Ryan TJ, Buhlmann KA, Tuberville TD, Metts BS, Greene JL, Mills T, Leiden Y, Poppy S, Winne CT. 2000. The global decline of reptiles, Déjà Vu amphibians. BioScience, 50 (8): 653-661. [ Links ]
Hernández-Ruz EJ, Castaño-Mora OV, Cárdenas-Arévalo G, Galvis-Peñuela PA. 2001. Caracterización preliminar de la ''comunidad'' de reptiles de un sector de la Serranía del Perijá, Colombia. Caldasia, 23 (2): 475-489. [ Links ]
IGAC (Instituto Geográfico Agustín Codazzi). 1996. Diccionario geográfico de Colombia. Bogotá D.C (Colombia): Rabal-Zuzagua. p. 2504. [ Links ]
INVIAS (Instituto Nacional de Vías). 1999. Mejoramiento y ampliación de la vía Villa Garzón-San José del Fragua (Putumayo, Bota Caucana, Caquetá). Cali (Colombia): Consorcio P. I. S. I.-INVIAS. p. 150. [ Links ]
Jellinek S, Driscoll DA, Kirkpatrick JB. 2004. Environmental and vegetation variables have a greater influence than habitat fragmentation in structuring lizard communities in remnant urban bushland. Austral Ecology, 29 (3): 294-304. [ Links ]
Keller L, Heske E. 2000. Habitat use by three species ok snakes at the middle fork fish and wildlife area Illinois. Journal of Herpetology, 34 (4): 558-564. [ Links ]
Krebs CJ. 1989. Ecological methodology. Nova York (U. S. A): Harpers Collins Publishers. p. 654. [ Links ]
Magurran AE. 1988. Ecological diversity and its measurement. London (England): Croom Helm. p. 179. [ Links ]
McCune B, Grace JB. 2002. Analysis of ecological communities. Oregon (U. S .A): MJM Software Design. p. 304. [ Links ]
McCune B, Mefford MJ. 1999. PC-Ord Multivariate analysis of ecological data. Oregon (U. S .A): MJM software Design. p. 237. [ Links ]
Medina-Rangel GF. 2011. Diversidad alfa y beta de la comunidad de reptiles en el complejo cenagoso de Zapatosa, Colombia. Revista de Biología Tropical, 59 (2): 935-968. [ Links ]
MinMinas (Ministerio de Minas y Energía de Colombia). 1996. Desarrollo hidroeléctrico cuenca del Alto Caquetá. Cali (Colombia): Estudio de impacto ambiental ISAGEN S. A., EPSA, EMCALI, ICEL, INGETEC S. A. p. 159. [ Links ]
Moreno-Arias RA, Medina-Rangel GF, Castaño-Mora OV, Carvajal-Cogollo JE. 2009. Herpetofauna de la Serranía del Perijá, Colombia. En: Rangel-Ch JO, editor. Colombia diversidad biótica VIII: Media y baja montaña de la Serranía del Perijá. Bogotá D. C. (Colombia): Instituto de Ciencias Naturales- Universidad Nacional de Colombia-CORPOCESAR. p. 449-470. [ Links ]
Murillo-Moreno FJ, Rivas-Lara TS, Saldarriaga MM. 2006. Caracterización taxonómica y aspectos ecológicos de la fauna de ofidios de la cuenca hidrográfica del río Cabí, Chocó-Colombia. Revista Institucional Universidad Tecnológica del Chocó Diego Luís Córdova, 24: 43-53. [ Links ]
Oliveros O, Prieto A, Cornejo P. 2000. Reptiles de cerro colorado y sus alrededores, Cumaná, Estado Sucre, Venezuela. Acta Científica Venezolana, 51 (2): 104-108. [ Links ]
Pedroza-Banda R, Angarita-Sierra T. 2011. Herpetofauna de los humedales la Bolsa y Charco de Oro, Andalucía, Valle del Cauca, Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 35 (135): 243-260. [ Links ]
Pérez-Santos C, Moreno AG. 1988. Ofidios de Colombia. Monografie VI. Torino (Italia): Museo Regionale di Scienze Naturali. p. 517. [ Links ]
Prior K, Weatherhead P. 1996. Habitat features of black rat snake hibernacula in Ontario. Journal of Herpetology, 30 (2): 211-218. Fecha de acceso: 30 de septiembre de 2007. Disponible en: http://www.jstor.org/stable/1565512. [ Links ]
R development core team. 2007. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna (Austria). Disponible en: http://www.r-project.org/. [ Links ]
Ramírez JG, Arias JC, Cardenas D. 2000. Biodiversidad y sistemas de producción agrarios en zonas de colonización amazónica. Bogotá (Colombia): Produmedios. p. 24. [ Links ]
Roze JA. 1966. La taxonomía y zoogeografía de los ofidios en Venezuela. Caracas (Venezuela): Universidad Central de Venezuela. p. 362. [ Links ]
Roze JA. 1996. Coral snakes of the Americas: biology, identification, and venoms. Florida (U. S. A).: Krieger Publishing Company. p. 328. [ Links ]
Rueda JV. 1999. Anfibios y reptiles amenazados de extinción en Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 23: 475-498. [ Links ]
Sánchez CH, Castaño O, Cárdenas G. 1995. Diversidad de los reptiles en Colombia. En: Rangel CH. JO, editor. Colombia: diversidad biótica I. Bogotá D. C. (Colombia): Universidad Nacional de Colombia, Inderena, Fundación FES. p. 277-325. [ Links ]
Saunders D, Hobbs R, Margules C. 1991. Biological consequences of ecosystem fragmentation: a review. Conservation Biology, 5 (1): 18-32. [ Links ]
Seigel RA, Collins JT. 1993. Snakes: ecology and behavior. New York (U. S. A.): McGraw-Hill Inc. p. 403. [ Links ]
Silvano DL, Colli GR, Dixo MBO, Pimenta BVS, Wiederhecker HC. 2003. Anfíbios e Répteis. En: Rambaldi DM, Oliveira DAS, editores. Fragmentação de Ecossistemas: Causas, efeitos sobre a biodiversidade e recomendações de políticas públicas. Brasília (Brasil): Ministério do Meio Ambiente-Secretaria de Biodiversidade e Florestas. p. 183-200. [ Links ]
SPDGC (Secretaria de Planeación Departamental Gobernación del Caquetá). 1987. Monografía de San Vicente del Caguán. Florencia (Caquetá, Colombia): Publiprensa publicaciones. p. 61-64. [ Links ]
SPDGC (Secretaria de Planeación Departamental Gobernación del Caquetá). 2002. Atlas general del Caquetá, ordenamiento territorial. Florencia (Caquetá, Colombia): Ministerio del Interior-Colombia. p. 177-179. [ Links ]
Strimple P. 1993. Overview of the natural history of the green anaconda (Eunectes murinus). Herpetological Natural History, 1: 25-35. [ Links ]
Tapia-Coral SC, Luizão FJ, Wandelli EV. 1999. Macrofauna da liteira em sistemas agroflorestais sobre pastagens abandonadas na Amazônia Central. Acta Amazónica, 29 (3): 477-495. [ Links ]
Urbina-Cardona JN, Londoño-Murcia MC. 2003. Distribución de la comunidad de herpetofauna asociada a cuatro áreas con diferente grado de perturbación en la Isla Gorgona, Pacifico Colombiano. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 27 (102): 105-113. [ Links ]
Urbina-Cardona JS, Olivares-Pérez M, Reynoso VH. 2006. Herpetofauna diversity and microenvironment correlates across a pasture-edge-interior ecotone in tropical rainforest fragments in the Los Tuxtlas Biosphere Reserve of Veracruz, Mexico. Biological Conservation, 132: 61-75. [ Links ]
Urbina JN, Londoño MC, García DG. 2008. Dinámica espacio-temporal en la diversidad de serpientes en cuatro hábitats con diferente grado de alteración antropogénica en el Parque Nacional Natural Isla Gorgona, Pacífico colombiano. Caldasia, 30 (2): 479-493. [ Links ]
Urbina-Cardona JN, Reynoso VH. 2005. Recambio de anfibios y reptiles en el gradiente potrero-borde-interior en la Reserva de Los Tuxtlas, Veracruz, México. En: Halffter GJ, Soberón P, Koleff L, Melic A, editores. Sobre diversidad biológica: el significado de las diversidades alfa, beta y gamma. Zaragoza (España): Editorial Monografías Tercer Milenio. p. 191-207. [ Links ]
Vargas F, Bolaños ME. 1999a. Presencia de reptiles en la región de Achicayá, Pacifico Colombiano, a través de un gradiente de deforestación. Caldasia, 21 (2): 235-238. [ Links ]
Vargas F, Bolaños ME. 1999b. Anfibios y reptiles en hábitats perturbados de selva lluviosa tropical en el Bajo Anchicayá, Pacífico colombiano. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales (Suplemento especial), 23: 499-511. [ Links ]
Vitt LJ. 1987. Communities En: Seigel RA, Collins JT, Novak SS, editores. Snakes: ecology and evolutionary biology. New York (U. S. A): MacMillan Publishing Company. p. 335-365. [ Links ]
Vitt LV, Caldwell JP. 2001. The effects of logging on reptiles and amphibians of tropical forests. En: Fimbel RA, Grajal A. Robinson JG, editores. The cutting edge: conserving wildlife in logged tropical forests. New York (U. S. A): Columbia University. p. 239-259. [ Links ]
Vogt RC, Moreira G, Duarte ACOC. 2001. Biodiversidade de répteis do bioma floresta Amazônica e Ações prioritárias para sua conservação. En: Capobianco JPR, editor. Biodiversidade na Amazônia brasileira: avaliação e ações prioritárias para a conservação, uso sustentável e repartição de benefícios. São Paulo (Brasil): Instituto Sócio Ambiental. p. 89-96. [ Links ]